闪锌矿中的Fe元素主要以什么形式存在?氧化物,还是硫化物?
 黄雄健2022-10-04 11:39:541条回答
黄雄健2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 chingstar 共回答了16个问题
chingstar 共回答了16个问题 |采纳率87.5%- 硫化物,闪锌是还原性环境
- 1年前
相关推荐
- MnO2和Zn是制造普通干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:
MnO2和Zn是制造普通干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:
①将软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O;
②除去反应混合物中的不溶物;
③电解混合物:MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4电解 .
下列说法错误的是( )
A.干电池是一种将化学能转变为电能的装置
B.步骤③电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
C.步骤①每析出12.8g S沉淀,共转移0.8mol电子
D.步骤③的反应也可以设计成原电池 chev20061年前1
chev20061年前1 -
 呆瓜已 共回答了14个问题
呆瓜已 共回答了14个问题 |采纳率85.7%解题思路:A、干电池是一种将化学能转变为电能的装置;
B、阳极处生成发生氧化反应,失电子,电极反应式为:Mn2+-2e-+2H2O═MnO2+4H+;
C、生成32g的硫转移2mol的电子,每析出12.8g S沉淀,
×2mol电子,即共转移0.8mol电子;12.8g 32g
D、步骤③的反应不可以设计成原电池,不是自发的氧化还原反应.A、干电池是一种将化学能转变为电能的装置,故A正确;
B、阳极处生成发生氧化反应,失电子,电极反应式为:Mn2+-2e-+2H2O═MnO2+4H+,故B正确;
C、生成32g的硫转移2mol的电子,每析出12.8g S沉淀,
12.8g
32g×2mol电子,即共转移0.8mol电子,故C正确;
D、步骤③的反应不可以设计成原电池,不是自发的氧化还原反应,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题是金属的冶炼和氧化还原反应结合原电池原理综合考查,明确元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.1年前查看全部
- (2013•韶关一模)软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80
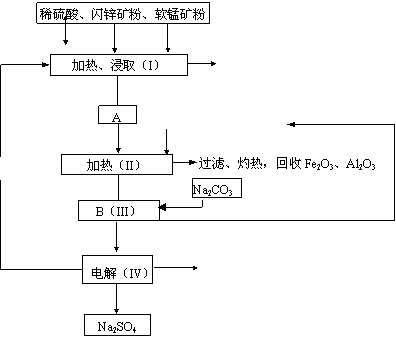
(2013•韶关一模)软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分.科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4.其工艺流程如下:
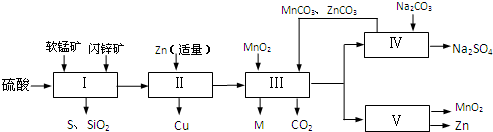
(1)Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等.写出MnO2、CuS与硫酸反应的化学方程式:沉淀物 Fe(OH)3 Al(OH)3 Zn(OH)2 开始沉淀pH 2.3 4.0 5.4 完全沉淀pH 4.1 5.2 8.0
______.
(2)Ⅲ中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为______(写化学式);Ⅲ中加入MnO2的作用是______.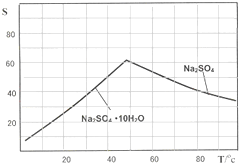
(3)如图是Na2SO4和Na2SO4•10H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、______、用乙醇洗涤后干燥.乙醇洗涤而不用水洗的原因是______.
(4)Ⅴ是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为______.
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的物质有:MnO2、ZnCO3、MnCO3、______和______(写化学式). li40842531年前1
li40842531年前1 -
 1235661 共回答了18个问题
1235661 共回答了18个问题 |采纳率100%解题思路:(1)依据流程图分析生成沉淀硫,MnO2、CuS与硫酸反应生成MnSO4、CuSO4、H2O,分析可知发生氧化还原反应;
(2)依据图表数据分析,pH至5.2~5.4时铁离子和铝离子全部沉淀;Ⅲ中加入MnO2的作用是做氧化剂氧化亚铁离子;
(3)依据图象的溶解度随温度变化分析判断,得到硫酸钠的适宜条件,注意溶解度的影响;
(4)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极失电子生成;
(5)在流程图中做为原料参加反应,过程中最后生成的物质是可以循环利用的物质分析判断.(1)流程图分析生成沉淀硫,MnO2、CuS与硫酸反应生成MnSO4、CuSO4、H2O,配平书写化学方程式为:MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O,
故答案为:MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O;
(2)图表数据分析,pH至5.2~5.4时铁离子和铝离子全部沉淀;Ⅲ中加入MnO2的作用是做氧化剂氧化亚铁离子易于调节溶液PH全部沉淀,
故答案为:Fe(OH)3、Al(OH)3;将Fe2+氧化成Fe3+;
(3)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,
故答案为:趁热过滤,防止形成 Na2SO4•10H2O;
(4)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(5)依据流程图中物质的反应和物质的生成分析可知锌、硫酸是可以循环使用的试剂,故答案为:Zn;H2SO4;点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;电解原理;蒸发和结晶、重结晶.
考点点评: 本题考查了物质制备实验的分析判断,物质溶解性的理解应用,电解原理的应用判断.电极反应的产物判断和电极反应书写,题目难度较大.1年前查看全部
- MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO4+ZnSO4+2H2
MnO2+Zn+2H2SO4.电解 .
A. 步骤(1)中MnO2和H2SO4都是氧化剂
B. 步骤(1)中每析出12.8gS沉淀共转移0.8mol电子
C. 步骤(3)中电解时MnO2在阳极处产生
D. 硫酸在生产中可循环使用 郭纷飞1年前1
郭纷飞1年前1 -
 xyvllbb 共回答了20个问题
xyvllbb 共回答了20个问题 |采纳率85%解题思路:A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变;
B.反应中S元素由-2价升高为0;
C.电解时阳极发生氧化反应;
D.由(1)、(3)可知,硫酸既参加反应,又从反应中生成.A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变,则步骤(1)中MnO2是氧化剂,H2SO4是反应物,故A选;
B.反应中S元素由-2价升高为0,则每析出12.8gS沉淀共转移[12.8g/32g/mol]×(2-0)=0.8mol电子,故B不选;
C.电解时Mn元素的化合价升高,发生氧化反应,阳极发生氧化反应,则步骤(3)中电解时MnO2在阳极处产生,故C不选;
D.由(1)、(3)可知,硫酸既参加反应,又从反应中生成,所以硫酸在生产中可循环使用,故D不选;
故选A.点评:
本题考点: 金属冶炼的一般原理;氧化还原反应的电子转移数目计算;氧化还原反应.
考点点评: 本题考查金属的冶炼和氧化还原反应,明确元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.1年前查看全部
- 某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料)
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):
已知:A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液.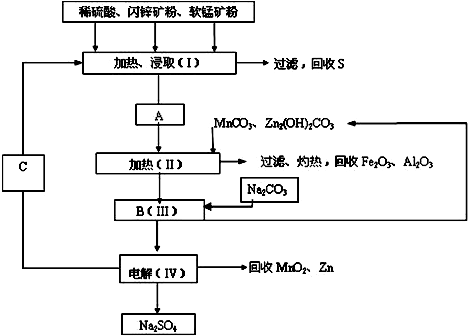
(1)A中属于还原产物的是______.
(2)加入MnCO3、Zn2(OH)2CO3的作用是______.
(3)请写出IV中电解的阳极反应式______.
(4)电解IV分离出的产物C的化学式是______.
(5)该生产中除得到MnO2和Zn以外,还可得到的副产品有Na2SO4、Fe2O3和______.
(6)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.(填名称) 艾静1231年前1
艾静1231年前1 -
 亚明画 共回答了24个问题
亚明画 共回答了24个问题 |采纳率83.3%解题思路:分析流程软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)加入硫酸酸溶,加热酸浸过滤得到A为A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液,加热过滤回收Fe2O3,Al2O3,加入碳酸钠沉淀锰离子和锌离子,得到滤液电解得到 二氧化锰和硫酸钠;
(1)比较信息①A与软锰矿中元素化合价的变化可知,A中还原产物为MnSO4.
(2)由工艺流程可知,A中加入MnCO3、Zn2(OH)2CO3,A中的Fe3+、Al3+,经过一系列操作转化为氧化铁、氧化铝,Fe3+、Al3+沉淀时容易形成胶体,不利于氢氧化铁、氢氧化铝沉降;
(3)依据电解原理分析,IV中电解的阳极反应为锰离子失电子生成二氧化锰,结合电荷守恒书写;
(4)操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用;
(5)根据流程图不难得出副产物有Na2SO4、Fe2O3和硫、氧化铝等;
(6)除矿石外,需加入的物质,就是要购买的化工原料.(1)比较信息①A与软锰矿中元素化合价的变化可知,Mn元素化合价由+4价降低为+2价,所以A中还原产物为MnSO4.
故答案为:MnSO4.
(2)由工艺流程可知,MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全;
故答案为:增大溶液的pH,使Fe3+和 Al3+生成沉淀;
(3)依据电解原理分析,IV中电解的阳极反应为锰离子失电子生成二氧化锰,结合电荷守恒书写得到阳极反应式为:Mn2++2H2O-2e-=MnO2+4H+;
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(4)操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用,电解IV分离出的产物C的化学式是H2SO4;
故答案为:H2SO4;
(5)生产中除得到MnO2和Zn以外,还可得到的副产品有Na2SO4、Fe2O3,根据流程图可知,副产物有硫、氧化铝.
故答案为:Al2O3、S;
(6)根据流程图可知,需要加入碳酸钠、硫酸,所以除矿石外,需购买的化工原料是碳酸钠、硫酸.
故答案为:碳酸钠、硫酸.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本实验的目的是制备二氧化锰与锌,因而需要把氧化铝、铁元素、硫元素除去.据此考查学生对工艺流程的理解、物质性质、氧化还原反应、分离提纯基本操作、化学计算等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.1年前查看全部
- MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO 2 +ZnS+2H 2 SO 4 =MnSO 4 +ZnSO 4 +S+2H 2 O
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO 4 +ZnSO 4 +2H 2
MnO 2 +Zn+2H 2 SO 4 .电解 . A.步骤(1)中MnO 2 和H 2 SO 4 都是氧化剂 B.步骤(1)中每析出12.8gS沉淀共转移0.8mol电子 C.步骤(3)中电解时MnO 2 在阳极处产生 D.硫酸在生产中可循环使用  魔瞳惑情1年前1
魔瞳惑情1年前1 -
 银海 共回答了14个问题
银海 共回答了14个问题 |采纳率100%A.MnO 2 中Mn元素的化合价降低,H 2 SO 4 中各元素的化合价不变,则步骤(1)中MnO 2 是氧化剂,H 2 SO 4 是反应物,故A错误;
B.反应中S元素由-2价升高为0,则每析出12.8gS沉淀共转移
12.8g
32g/mol ×(2-0)=0.8mol电子,故B正确;
C.电解时Mn元素的化合价升高,阴极发生还原反应,则步骤(3)中电解时MnO 2 在阴极处产生,故C正确;
D.由(1)、(3)可知,硫酸既参加反应,又从反应中生成,所以硫酸在生产中可循环使用,故D正确;
故选A.1年前查看全部
- (2013•番禺区模拟)工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4•7H2O
(2013•番禺区模拟)工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4•7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为______.
(2)浸取过程中Fe2(SO4)3的作用是______,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为______.
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为______.该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是______.
(4)置换法除重金属离子是Cd2+,所用物质C为______.
(5)硫酸锌的溶解度与温度之间的关系如下表:
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为______、______、过滤、干燥.温度/℃ 0 20 40 60 80 100 溶解度/g 41.8 54.1 70.4 74.8 67.2 60.5  我想我是海_1年前1
我想我是海_1年前1 -
 17896 共回答了15个问题
17896 共回答了15个问题 |采纳率100%解题思路:(1)硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫;
(2)加入硫酸铁和硫酸是为了溶解氧化铁、硫化锌、硫化镉获得生产硫酸锌晶体和硫酸亚铁晶体的原料;其中硫酸铁氧化硫化锌;
(3)除铁是利用空气中氧气氧化亚铁离子生成FeOOH,在空气入口处设计了一个类似淋浴喷头的装置,依据增大物质接触面积会加快反应速率;
(4)依据置换反应的反应条件是活泼金属进行置换,结合制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间分析;
(5)依据溶解度与温度的 关系分析,低温和高温都不利于晶体的析出,适宜的温度是60℃.(1)依据流程转化关系分析判断,加入的硫酸铁具有氧化性能溶解氧化硫化锌、硫化镉,从滤渣A中可获得一种淡黄色非金属单质的副产品为氧化产物为硫,
故答案为:S;
(2)依据流程反应和生成硫单质可知,硫酸铁具有氧化性能氧化硫化锌和 硫化镉,生成单质硫,反应的化学方程式为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S,
故答案为:做氧化剂; Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S;
(3)除铁过程控制溶液的pH在5.4左右,利用空气中氧气氧化亚铁离子生成FeOOH,反应的两种方程式为:4Fe2++O2+6H2O=4FeOOH+8H+;在空气入口处设计了一个类似淋浴喷头的装置是为了增大与空气的接触面积增大反应速率,
故答案为:4Fe2++O2+6H2O=4FeOOH+8H+;增大空气与溶液的接触面积,加快反应速率;
(4)制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,
故答案为:Zn;
(5)依据图表中硫酸锌的溶解度与温度之间的关系分析,低温和高温溶解度都不是最大,只有在60°C硫酸锌的溶解度最大74.8g,通过加热蒸发浓缩,冷却结晶会最大程度得到晶体,
故答案为:60℃条件下蒸发浓缩、降温结晶.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查了物质制备方案的流程分析和反应判断,实验流程信息应用,物质性质是解题关键,题目难度中等.1年前查看全部
- 软锰矿中含MnO 2 约70%,SiO 2 约20%,Al 2 O 3 约4%,其余为水分;闪锌矿中含ZnS约80%,F
软锰矿中含MnO 2 约70%,SiO 2 约20%,Al 2 O 3 约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO 2 共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO 2 和Na 2 SO 4 。其工艺流程如下:
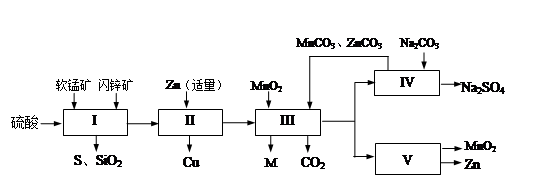
(1)I的滤液中含有MnSO 4 、ZnSO 4 、CuSO 4 、Fe 2 (SO 4 ) 3 、Al 2 (SO 4 ) 3 等。写出MnO 2 、CuS与硫酸反应的化学方程式: ;
(2)已知Fe(OH) 3 、Al(OH) 3 、Zn(OH) 2 三种物质开始沉淀和完全沉淀时溶液的pH如下表:沉淀物 Fe(OH) 3 Al(OH) 3 Zn(OH) 2 开始沉淀pH 2.3 4.0 5.6 完全沉淀pH 4.1 5.2 8.0
则III中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为 (写化学式),III中加入MnO 2 的作用是 ;
(3)Na 2 SO 4 和Na 2 SO 4 ·10H 2 O的溶解度曲线(g/100g水)如图,则IV中得到Na 2 SO 4 固体的操作是:将分离出MnCO 3 和ZnCO 3 后的滤液升温结晶、 、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是 ;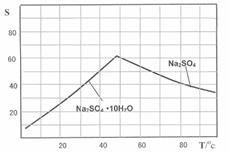
(4)V是用惰性电极电解制得Zn和MnO 2 ,则阳极的电极反应式为 ;
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的主要物质有:MnO 2 、ZnCO 3 、MnCO 3 、 和 (写化学式)。 hh3411年前1
hh3411年前1 -
 zz新奇 共回答了11个问题
zz新奇 共回答了11个问题 |采纳率72.7%(16分)
(1)MnO 2 + CuS+ 2H 2 SO 4 ="S" + MnSO 4 + CuSO 4 +2H 2 O(3分)
(2)Fe(OH) 3 、Al(OH) 3 (各1分) 将Fe 2+ 氧化成Fe 3+ (2分)
(3)趁热过滤(2分) 防止形成 Na 2 SO 4 ·10H 2 O(2分)
(4)Mn 2+ —2e - +2H 2 O = MnO 2 +4H + (3分)
(5)Zn、H 2 SO 4 (各1分)
1年前查看全部
- 某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
共同生产MnO2和Zn(干电池原料):
已知① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
② IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+ Zn+2H2SO4.
从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________.(计算结果保留三位有效数字)
答案是1(或1.03)
 xzmath1年前1
xzmath1年前1 -
 病态婆婆 共回答了23个问题
病态婆婆 共回答了23个问题 |采纳率95.7%根据最后IV中的反应生成的 MnO2+ Zn的物质的量之比为1:1,根据原子守恒,原料中的Mn、Zn元素均全进入最后产生中的MnO2+ Zn中,所以原料中的MnO2和ZnS的物质的量之比也为1:1,1molMnO2为87克,molZnS为97克,软锰矿和闪锌矿的质量比为87/0.7:97/0.8.结果约为1.03.1年前查看全部
- (2014•临沂三模)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)
(2014•临沂三模)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如图1所示:
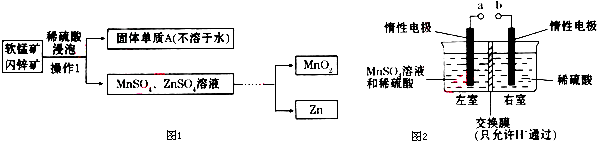
(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和______(填仪器名称).
(2)稀硫酸浸泡时反应的离子方程式为______;该反应中若析出19.2g单质A,共转移______mo1电子.浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是______(填代号).
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2.已知:
2MnO(s)+O2(g)═2MnO2(s)△H1=akJ•mol-1
MnCO3(s)═MnO(s)+CO2(g)△H2=bkJ•mol-1
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式______.
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如图2所示:
①a应与直流电源的______(填“正”或“负”)极相连..
②电解过程中氢离子的作用是______和______;若转移的电子数为6.02×1023个,左室溶液中n(H+)的变化量为______. xierui_19921年前1
xierui_19921年前1 -
 ssks227 共回答了19个问题
ssks227 共回答了19个问题 |采纳率78.9%解题思路:(1)过滤适用于不溶于水的固体和液体,根据过滤操作用到的仪器分析,陶瓷、玻璃、水泥等都是硅酸盐产品;
(2)稀硫酸浸泡时反应为MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,19.2g单质A为S,依据反应中S元素由-2价升高为0计算电子;影响物质的反应速率的一些常见因素:反应物的接触面、反应的温度、反应物的浓度等;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)①a极上是MnSO4电解池工作时,阳极上锰离子失电子生成二氧化锰;
②电解过程中氢离子的作用是参与阴极反应和通过交换膜定向移动形成电流,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,阳极反应式为:MnSO4-2e-+2H2O═MnO2+SO42-+4H+,根据氢离子和转移电子之间的关系式计算;工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程:软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)在酸溶后MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,过滤,滤渣A为硫单质,滤液为:MnSO4和ZnSO4,通电电解在阳极生成二氧化锰,阴极生成锌.
(1)分离不溶于水的固体和液体,用过滤的方法,滤渣A为硫单质,滤液为:MnSO4和ZnSO4,过滤操作用到的玻璃仪器:漏斗、烧杯、玻璃棒,属于硅酸盐材质,
故答案为:漏斗;
(2)稀硫酸浸泡时反应为MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,MnO2、ZnS难溶于水,MnSO4、ZnSO4,易溶于水易电离,所以离子反应为:MnO2+ZnS+4H+═Mn2++Zn2++S↓+2H2O,19.2g单质A为S,反应中S元素由-2价升高为0,则每析出19.2gS沉淀共转移[19.2g/32g/mol]×(2-0)=1.2mol电子,
a.将矿石粉碎,增大反应物的接触面,化学反应速率提高,故不选;
b.提高浸泡温度,温度升高,反应速率增大,故不选;
c.适当增大硫酸浓度,增大了反应物的浓度,化学反应速率提高,故不选;
d.改变软锰矿与闪锌矿的比例,不能改变反应速率,故选;
故答案为:MnO2+ZnS+4H+═Mn2++Zn2++S↓+2H2O;1.2mol;d;
(3)2MnO(s)+O2(g)═2MnO2(s)△H1=akJ•mol-1①
MnCO3(s)═MnO(s)+CO2(g)△H2=bkJ•mol-1②将①+②×2可得:2MnCO3(S)+O2(g)═2MnO2(S)+2CO2(g)△H=(a+2b)KJ•mol-1;
故答案为:2MnCO3(S)+O2(g)═2MnO2(S)+2CO2(g)△H=(a+2b)KJ•mol-1;
(4)①用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2,阳极上锰离子失电子生成二氧化锰,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+;,所以a是正极,
故答案为:正;
②电解过程中氢离子的作用是参与阴极反应和通过交换膜定向移动形成电流,电解酸化的MnSO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,阳极反应式为:MnSO4-2e-+2H2O═MnO2+SO42-+4H+,若转移的电子数为6.02×1023个,根据氢离子和转移电子之间的关系式2H+~2e-,则左室溶液中n(H+)=1mol,
故答案为:1mol;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;电解原理.
考点点评: 本题是一道有关化工生产工艺的综合知识题目,考查了热化学方程式书写方法,电解池原理的分析应用,影响物质的反应速率的一些常见因素等知识,侧重于学生的分析能力和计算能力的考查,注意把握实验的原理以及题给信息为解答该题的关键,题目难度中等.1年前查看全部
- (10分)MnO 2 和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
(10分)MnO 2 和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO 2 含量≥65% Al 2 O 3 含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO 2 传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO 2 在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O 2 2ZnO+2SO 2 2C+O 2
2ZnO+2SO 2 2C+O 2  2CO ZnO+CO
2CO ZnO+CO Zn(g)+CO 2
Zn(g)+CO 2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO 4 溶液可生产纯度为99.95%的锌。
现在生产MnO 2 和锌的新工艺主要是通过电解获得MnO 2 和锌,副产品是硫、金属铜和镉。简化流程杠图如下: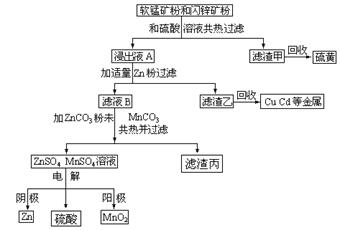
试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO 2 +ZnS+2H 2 SO 4 =MnSO 4 +ZnSO 4 +S↓+2H 2 O,据此写出MnO 2 在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al 2 O 3 溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO 4 和ZnSO 4 的混合溶液可以得到Zn和MnO 2 ,电解时,铁做 极,铁极发生的电极反应为 。 宝宝2蚂蚁1年前1
宝宝2蚂蚁1年前1 -
 最后的恐龙 共回答了15个问题
最后的恐龙 共回答了15个问题 |采纳率100%(1)四周期ⅡB族;MnO 2 +2FeS+6H 2 SO 4 =Fe 2 (SO 4 ) 3 +3MnSO 4 +2S¯+6H 2 O ,
Al 2 O 3 +6H + =2Al 3 + +3H 2 O ,加热(每空1分)
(2)Zn+Cu 2 + =Cu+Zn 2 + Zn+Cd 2 + =Cd+Zn 2 + Zn+2Fe 3 + =2Fe 2 + +Zn 2 + (3分)
(3)Fe(OH) 3 ,Al(OH) 3 ;(2分,漏写1分)
(4)阴极(1分);Zn 2+ +2e - =Zn(1分)
略1年前查看全部
- 某工厂用软锰矿(含MnO 2 约70%及Al 2 O 3 )和闪锌矿(含ZnS约80%及FeS),共同生产MnO 2 和
某工厂用软锰矿(含MnO 2 约70%及Al 2 O 3 )和闪锌矿(含ZnS约80%及FeS),共同生产MnO 2 和Zn(干电池原料)。
已知:①A是MnSO 4 、ZnSO 4 、Fe 2 (SO 4 ) 3 、Al 2 (SO 4 ) 3 的混合液。
②IV中的电解反应式为MnSO 4 +ZnSO 4 +2H 2 O MnO 2 +Zn+2H 2 SO 4 。
MnO 2 +Zn+2H 2 SO 4 。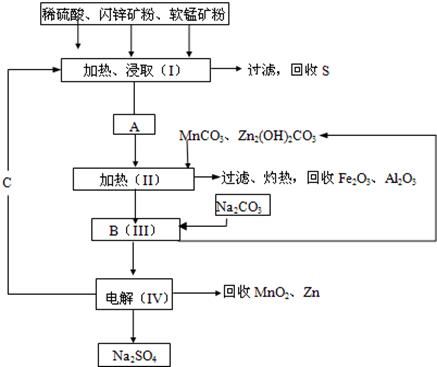
(1)A中属于还原产物的是 。
(2)MnCO 3 、Zn 2 (OH) 2 CO 3 的作用是 ;Ⅱ需要加热的原因是 ;C的化学式是 。
(3)Ⅲ中发生的离子方程式为 , ;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是 。 linsitaoo1年前1
linsitaoo1年前1 -
 布么 共回答了22个问题
布么 共回答了22个问题 |采纳率81.8%(1)MnSO 4
(2)增大溶液的pH,使Fe 3+ 和Al 3+ 均生成沉淀;促进Fe 3+ 、Al 3+ 的水解;H 2 SO 4
(3)Mn 2+ +CO 3 2- =MnCO 3 2Zn 2+ +2CO 3 2- +H 2 O=Zn 2 (OH) 2 CO 3 ↓+CO 2 ↑
(4)纯碱和硫酸
(1)由已知信息条件知,Mn元素化合价由+4价降低为+2价,民以A中还原产物为MnSO 4 ;
(2)由工艺流程图知,MnCO 3 、Zn(OH)2CO3的作用就是调节pH,使Fe 3+ 和Al 3+ 均生成沉淀。Fe 3+ 、Al 3+ 沉淀容易形成胶体,不利于氢氧化铝、氢氧化铁沉淀,所以Ⅱ加热的目的是加速沉淀生成,防止胶体出现,并使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用。
(4)溶液B中含有Mn 2+ 、Zn 2+ ,根据流程图,加入Na 2 CO 3 后,生成MnCO 3 和Zn 2 (OH) 2 CO 3 ,离子方程式是,Mn 2+ +CO 3 2- =MnCO 3 ,2Zn 2+ +2CO 3 2- +H 2 O=Zn 2 (OH) 2 CO 3 ↓+CO 2 ↑。1年前查看全部
- 某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料)
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):
已知①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.②IV中的电解反应式为MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4.电解 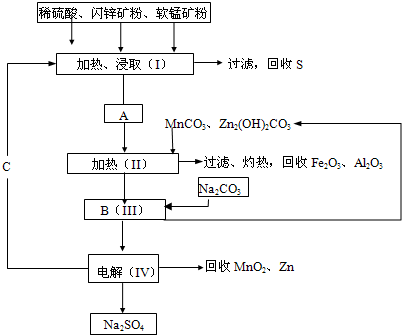
(1)A中属于还原产物的是______.
(2)MnCO3、Zn2(OH)2CO3的作用是______;II需要加热的原因是______;C的化学式是______.
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______.
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.
(5)要从Na2SO4溶液中得到芒硝(Na2SO4•10H2O),需进行的操作有蒸发浓缩、______、过滤、洗涤、干燥等.
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______. 还得割耳1年前1
还得割耳1年前1 -
 gillgigi 共回答了28个问题
gillgigi 共回答了28个问题 |采纳率85.7%解题思路:(1)比较信息①A与软锰矿中元素化合价的变化可知,A中还原产物为MnSO4.
(2)由工艺流程可知,A中加入MnCO3、Zn2(OH)2CO3,A中的Fe3+、Al3+,经过一系列操作转化为氧化铁、氧化铝.
Fe3+、Al3+沉淀时容易形成胶体,不利于氢氧化铁、氢氧化铝沉降.
操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用.
(3)根据流程图不难得出副产物有硫、氧化铁、氧化铝,
(4)除矿石外,需加入的物质,就是要购买的化工原料.
(5)从溶液中获得固体物质,需蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(6)设软锰矿、闪锌矿的质量分别为x、y,根据②可知MnO2、Zn的物质的量之比为1:1,据此列放出计算x:y的值.(1)比较信息①A与软锰矿中元素化合价的变化可知,Mn元素化合价由+4价降低为+2价,所以A中还原产物为MnSO4.
故答案为:MnSO4.
(2)由工艺流程可知,MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全.
Fe3+、Al3+沉淀容易形成胶体,不利于氢氧化铁、氢氧化铝沉降,Ⅱ中加热的目的是加速沉淀生成,防止胶体出现,并使形成胶体的氢氧化铝和氢氧化铁也生成沉淀.
操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用.
故答案为:调节溶液的pH,使Fe3+和 Al3+生成沉淀;加速沉淀生成,防止胶体出现,并使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;H2SO4.
(3)根据流程图可知,副产物有硫、氧化铁、氧化铝.
故答案为:硫、氧化铁、氧化铝.
(4)根据流程图可知,需要加入碳酸钠、硫酸,所以除矿石外,需购买的化工原料是碳酸钠、硫酸.
故答案为:碳酸钠、硫酸.
(5)从溶液中获得固体物质,需蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
故答案为:冷却结晶.
(6)设软锰矿、闪锌矿的质量分别为xg、yg,根据②可知MnO2、Zn的物质的量之比为1:1,则:
[0.7xg/87g/mol]:[0.8yg/97g/mol]=1:1,解得x:y=1.03.
故答案为:1.03.点评:
本题考点: 制备实验方案的设计;常见金属元素的单质及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本实验的目的是制备二氧化锰与锌,因而需要把氧化铝、铁元素、硫元素除去.据此考查学生对工艺流程的理解、物质性质、氧化还原反应、分离提纯基本操作、化学计算等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.1年前查看全部
- 某工厂用软锰矿(含MnO 2 约70% 及A1 2 O 3 )和闪锌矿(含ZnS约80%及FeS)共同生产MnO 2 和
某工厂用软锰矿(含MnO 2 约70% 及A1 2 O 3 )和闪锌矿(含ZnS约80%及FeS)共同生产MnO 2 和Zn(干电池原料):
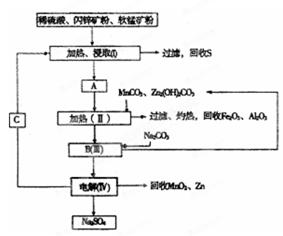
已知:①A是MnSO 4 、ZnSO 4 、Fe 2 (SO 4 ) 3 、Al 2 (SO 4 ) 3 的混合液。
②IV中的电解方程式为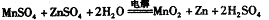
(1)A中属于还原产物的是_____。
(2)加人MnCO 3 、Zn 2 (OH) 2 CO 3 的作用是_________________;II需要加热的原因是:______ ;C的化学式是_________。
(3)该生产中除得到MnO 2 和Zn以外,还可得到的副产品是_____。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是_______。
(5)要从Na 2 SO 4 溶液中得到芒硝(Na 2 SO 4 ·10H 2 O),需进 行的操作有蒸发浓缩、 、过滤、洗涤、干燥等。
(6)从生产MnO 2 和Zn的角度计算,软锰矿和闪锌矿的质量比大约是____。 天之南_ss1年前1
天之南_ss1年前1 -
 lxf2332 共回答了19个问题
lxf2332 共回答了19个问题 |采纳率89.5%(1) MnSO 4 (2分)
(2)增大溶液的pH,使Fe 3+ 和 Al 3+ 生成沉淀 (2分)
(3) Fe 2 O 3 、Al 2 O 3 、S (4) 纯碱、硫酸 (5)降温结晶 、1.03
1年前查看全部
- 一道固体物理题闪锌矿密度p=4.06*10^3kg/m^3,锌的原子量为65.37,硫的原子量为32.06,求闪锌矿结构
一道固体物理题
闪锌矿密度p=4.06*10^3kg/m^3,锌的原子量为65.37,硫的原子量为32.06,求闪锌矿结构的点阵常数.
闪锌矿结构为金刚石结构,中心体对角线1/4处4个原子为锌,顶角与面心处为硫。 栏杆里的毛栗子1年前2
栏杆里的毛栗子1年前2 -
 helenawang 共回答了10个问题
helenawang 共回答了10个问题 |采纳率100%抱歉 非常抱歉. 我把问题想简单了, 发现自己固体物理已经忘记差不多了, 这个题目答不上. (从网上查到结果是 a0 = 0.542 nm)
耽误你了, 非常抱歉.为此, 帮你用高分问了下
http://zhidao.baidu.com/question/89730964.html
请关注有无让你满意的回答
---------------
已经有人给出回答,而且计算结果与我查到的值恰好相等(但我没对计算过程检验,相信他是正确计算的吧)
每个晶胞中的Zn原子数为4,S原子数为4
每个晶胞的质量为
M=(65.37×4+32.06×4)/NA=(65.37×4+32.06×4)/6.02×10^23=6.47×10^-22g
每个晶胞的体积为V=M/p=6.47×10^-22/4.06×10^6=1.59×10-28 m^3
晶格常数为a=V^(1/3)=(1.59×10-28 m^3)^(1/3)=5.42×10^-10m=0.542nm
即其点阵常数为a=b=c=0.542nm
----------
但我在采纳后再仔细看了下, 发现其计算方法其实和我原来的回答一样, 只是可能我的计算过程有误.
按他的说法 每个晶胞中依然是 4个 Zn 和 4 个 S.(我原来也是这么算的)
但那种金刚石结构中, 具体多大算一个晶胞 呢, 我搞不清楚这一点.
你还是自己再研究研究.1年前查看全部
- CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
(1)Cu2+基态的电子排布式可表示为______;
(2)SO42-的空间构型为______(用文字描述);中心原子采用的轨道杂化方式是______;写出一种与SO42-互为等电子体的分子的化学式:______;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是______.
(5)CuS比CuO的熔点______(填高或低),原因是______.
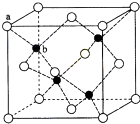
(6)闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为______(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为270 1−cos109°28′ pm(列式表示).270 1−cos109°28′  错过在重来1年前1
错过在重来1年前1 -
 Anpopo 共回答了18个问题
Anpopo 共回答了18个问题 |采纳率94.4%解题思路:(1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(2)计算S原子的价电子对数进行判断;具有相同原子数和价电子数的微粒互称为等电子体;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键;
(4)根据沉淀转化原理分析;
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高;
(6)利用均摊法计算晶胞中含有的硫原子和锌原子,根据ρ=
计算密度;每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270M NA V
pm,根据余弦定理计算白球和黑球之间的距离.2 (1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,Cu2+基态的电子排布式可表示为1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)SO42-的价电子对数=[6+2/2]=4,形成四条杂化轨道,S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与SO42-互为等电子体的微粒有SiCl4等;
故答案为:正四面体;sp3;SiCl4;
(3))[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,
,
故答案为: ;
;
(4)由沉淀转化原理可知溶度积大的沉淀转化为溶度积小的沉淀容易实现,在相同温度下,Ksp(CuS)<Ksp(ZnS),所以ZnS能转化为CuS;
故答案为:在相同温度下,Ksp(CuS)<Ksp(ZnS);
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高,CuS与CuO中O2-比S2-半径小,所以CuO的熔点比CuS高;
故答案为:低;CuO晶格能比CuS大;
(6)黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数=[1/8]×8+[1/2]×6=4,ρ=
M
NA
V=
4×(65+32)g/mol
6.02×1023mol−1
(540×10−10cm)3=4.1g/(cm)3,
每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270
2pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270
2)2,x=
(270点评:
本题考点: 原子核外电子排布;判断简单分子或离子的构型;“等电子原理”的应用;晶体熔沸点的比较;晶胞的计算.
考点点评: 本题考查了核外电子的排布、分子的空间构型、配位键、晶胞的计算等知识点,难度较大,会利用均摊法计算晶胞中含有的离子,注意运用余弦定理计算硫离子和锌离子之间的距离,为难点.1年前查看全部
- MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
①软锰矿、闪锌矿与硫酸共热:MnO 2 +ZnS+2H 2 SO 4 =MnSO 4 +ZnSO 4 +S+2H 2 O
②除去反应混合物中的不溶物
③电解混合液:MnSO 4 +ZnSO 4 +2H 2 O MnO 2 +Zn+2H 2 SO 4
MnO 2 +Zn+2H 2 SO 4
下列说法不正确的是[ ]A.步骤①中MnO 2 和H 2 SO 4 都是氧化剂
B.步骤①中每析出12.8gS沉淀共转移0.8mol电子
C.电解时MnO 2 在阳极处产生
D.硫酸在生产中可循环使 yh0525cn1年前1
yh0525cn1年前1 -
 那些美丽的时光 共回答了17个问题
那些美丽的时光 共回答了17个问题 |采纳率76.5%A1年前查看全部
- MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
①软锰矿、闪锌矿与硫酸共热:
MnO2 + ZnS + 2H2SO4 == MnSO4 + ZnSO4 + S + 2H2O
②除去反应后混合物中的不溶物
③电解混合液:
MnSO4 + ZnSO4 + S + 2H2O ==(电解)MnO2 + Zn + 2H2SO4
下列说法中不正确的是
A.步骤①中MnO2和H2SO4 都是氧化剂
B.步骤①中每析出12.8gS,则共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
 求不他1年前1
求不他1年前1 -
 iqhv 共回答了19个问题
iqhv 共回答了19个问题 |采纳率94.7%答案:A。 只有MnO2是氧化剂 氧化S2- 两个SO42-分别在MnSO4 + ZnSO4 价态不变 也不可能是SO42-氧化S2- 氧化还原化合价不能交叉1年前查看全部
- 工业上常以软锰矿、闪锌矿(除主要成分为MnO 2 、ZnS外还含有少量的FeS、CuS、Al 2 O 3 等物质)为原料
工业上常以软锰矿、闪锌矿(除主要成分为MnO 2 、ZnS外还含有少量的FeS、CuS、Al 2 O 3 等物质)为原料制取Zn和MnO 2 。
(1)已知将MnO 2 、ZnS浸在硫酸溶液中有少量黄色物质析出,写出并配平该化学反应方程式: 。
(2)在酸浸的过程中还会发生以下反应:
a. 3MnO 2 +2FeS +6H 2 SO 4 =3MnSO 4 +Fe 2 (SO 4 ) 3 +2S+ 6H 2 O
b. MnO 2 +CuS+4H 2 SO 4 =MnSO 4 +CuSO 4 +S+2H 2 O
c. Al 2 O 3 +3H 2 SO 4 =Al 2 (SO 4 ) 3 +3H 2 O
将酸浸所得的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO 2 和Zn。
①操作①中加Zn粉后发生反应的离子方程式为:Zn+2H + =Zn 2+ +H 2 ↑、
Zn+Cu 2+ =Zn 2+ +Cu、 。
②操作②中加入适量X的作用是: 。
③操作③中所加碳酸盐的化学式是: 。
(3)为了从上述流程中产生的Fe(OH) 3 、Al(OH) 3 沉淀混合物中回收Al(OH) 3 ,某化学兴趣小组设计了如下两种方案图。
方案Ⅰ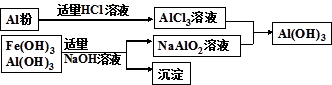
方案Ⅱ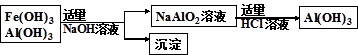
①方案Ⅰ中,AlCl 3 溶液和NaAlO 2 溶液反应生成Al(OH) 3 的离子方程式为:
。若总共得到n molAl(OH) 3 ,则消耗的NaOH和HCl的理论量分别为: mol、 mol。
②从消耗酸碱的用量角度考虑,方案 (填“Ⅰ”或“Ⅱ”)所消耗的酸碱少些。 heaven西界1年前1
heaven西界1年前1 -
 瞎转悠老三 共回答了19个问题
瞎转悠老三 共回答了19个问题 |采纳率84.2%(1)MnO 2 +ZnS +2H 2 SO 4 =MnSO 4 +ZnSO 4 +S↓+2H 2 O(2分)
(2)①Zn+2Fe 3+ =Zn 2+ +2Fe 2+ (2分) ②将Fe 2+ 氧化成Fe 3+ (2分) ③MnCO 3 或ZnCO 3 或MnCO 3 和ZnCO 3 (2分)
(3)① Al 3 + +3AlO 2 - +6H 2 O=4Al(OH) 3 ↓(2分); 3n/4(1分)、3n/4 (1分)②Ⅰ(1分)
1年前查看全部
- 某地有软锰矿和闪锌矿两座矿山,它们的组成如下: 软锰矿:MnO 2 含量≥65%,SiO 2 含量约20%,Al 2 O
某地有软锰矿和闪锌矿两座矿山,它们的组成如下: 软锰矿:MnO 2 含量≥65%,SiO 2 含量约20%,Al 2 O 3 含量约4%,其余为水分; 闪锌矿:ZnS含量≥80%,FeS、CuS、SiO 2 含量约7%,其余为水分。 科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。 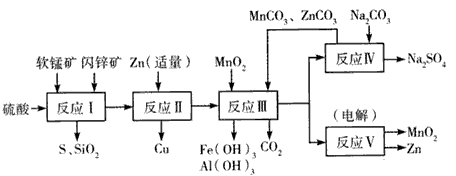
请回答下列问题:
(1)反应I的滤液中含有MnSO 4 、ZnSO 4 、CuSO 4 、Fe 2 (SO 4 ) 3、 Al 2 (SO 4 ) 3 等。试完成反应I中生成CuSO 4 和MnSO 4 的化学方程式:MnO 2 +CuS+___=___↓+MnSO 4 +CuSO 4 +___。
(2)反应Ⅱ加入适量锌的作用是___, 如果锌过量,还会进一步与___等离子反应。
(3)反应Ⅲ要调节pH生成Fe(OH) 3 、Al(OH) 3 ,中和过量的H + 所使用的物质是___,调节的pH 范围是___(pH数据见下表)。
(4)本工艺可以循环利用的物质除MnCO 3 、ZnCO 3 以外,还有____。  sueshishi1年前1
sueshishi1年前1 -
 wy4528 共回答了24个问题
wy4528 共回答了24个问题 |采纳率91.7%(l)2H 2 SO 4 ;S; 2H 2 O
(2)将溶液中的Cu 2+ 转化为铜; H + 、Fe 2+ 、Mn 2+
(3)MnCO 3 、ZnCO 3 ;5.2~5.4
(4) Zn、MnO 21年前查看全部
- 某地有软锰矿和闪锌矿 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO 2 含量≥65 %,SiO 2 含量
某地有软锰矿和闪锌矿
某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO 2 含量≥65 %,SiO 2 含量约为20%,
Al 2 O 3 含量约为4%,其余为水分;闪锌矿:ZnS含量≥ 80%,FeS、CuS、SiO 2 含量约为7%,其余为水分.科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示.
请回答下列问题:
(1)反应I后过滤所得滤液中含有MnSO 4 、ZnSO 4 、CuSO 4 、Fe 2 (SO 4 ) 3 、Al 2 (SO 4 ) 3 等.试写出反应I中生成
CuSO 4 的化学方程式_____________________.
(2)反应Ⅱ加入适量锌的作用是________________________.如果锌过量,还会进一步发生反应的离子方程式为________________________.
(3)反应V的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为____________.
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要________等原料. 04224311年前1
04224311年前1 -
 vana4444 共回答了16个问题
vana4444 共回答了16个问题 |采纳率81.3%(1)MnO 2 +CuS+2H 2 SO 4 =S+MnSO 4 +CuSO 4 +2H 2 O
(2)将溶液中的硫酸铜转化为铜;Zn+Fe 2+ =Fe+Zn 2+
(3)Mn 2+ -2e - +2H 2 O=MnO 2 +4H +
(4) Na 2 CO 3 、Zn、MnO 21年前
91年前查看全部
- MnO 2 和Zn是制造普通干电池的重要原料,工业上用软锰矿(主要成分MnO 2 )和闪锌矿(主要成分ZnS)来制取:
MnO 2 和Zn是制造普通干电池的重要原料,工业上用软锰矿(主要成分MnO 2 )和闪锌矿(主要成分ZnS)来制取:
①将软锰矿、闪锌矿与硫酸共热:MnO 2 +ZnS+2H 2 SO 4 =MnSO 4 +ZnSO 4 +S+2H 2 O;
②除去反应混合物中的不溶物;
③电解混合物:MnSO 4 +ZnSO 4 +2H 2 O
 MnO 2 +Zn+2H 2 SO 4
MnO 2 +Zn+2H 2 SO 4
下列说法错误的是A.干电池是一种将化学能转变为电能的装置 B.步骤③电解时MnO 2 在阳极处生成,电极反应为:Mn 2+ -2e - +2H 2 O=MnO 2 +4H + C.步骤①每析出12.8g S沉淀,共转移0.8mol电子 D.步骤③的反应也可以设计成原电池  alandeng0011年前1
alandeng0011年前1 -
 365707267 共回答了21个问题
365707267 共回答了21个问题 |采纳率95.2%D
1年前查看全部
- MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
(l)软锰矿、闪锌矿与硫酸共热:MnO 2 +ZnS +2H 2 SO 4 = MnSO 4 +ZnSO 4 +S↓+2H 2 O
(2)除去反应混合物中的不溶物
(3)电解混合液:MnSO 4 + ZnSO 4 +2H 2 O MnO 2 +Zn+2H 2 SO 4 下列说法不正确的是[ ]
MnO 2 +Zn+2H 2 SO 4 下列说法不正确的是[ ]A.步骤(l)中MnO 2 和H 2 SO 4 都是氧化剂
B.步骤(1)中每析出12. 8 g S沉淀共转移0.8mol电子
C.步骤(3)中电解时MnO 2 在阳极处产生
D.硫酸在生产中可循环使用 younger0071年前1
younger0071年前1 -
 四点钟 共回答了28个问题
四点钟 共回答了28个问题 |采纳率96.4%A1年前查看全部
- 怎么不用仪器,化学试剂分辨铅锌矿和闪锌矿
 岛主tt潇湘舞子1年前2
岛主tt潇湘舞子1年前2 -
 雪地里的小妖 共回答了12个问题
雪地里的小妖 共回答了12个问题 |采纳率100%铅锌在自然界里特别在原生矿床中极为密切,常常共生.它们具有共同的成矿物质来源和十分相似的地球化学行为,有类似的外层电子结构,都具有强烈的亲硫性,并形成相同的易溶络合物.它们被铁锰质、粘土或有机质吸附的情况也很相近.
闪锌矿,菱形十二面体完全解理、光泽以及与方铅矿密切共生;闪锌矿因为颜色变化很大,所以不易鉴定,不过却仍然可以从它的光泽和解理当中,予以判别;一些暗黑色的,叫黑闪锌矿(BlackJack),条痕多红棕色,常较其本身整体的颜色为浅.
希望对你有所帮助.1年前查看全部
- (2011•湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生
 (2011•湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
(2011•湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4
(1)A中属于还原产物的是______.
(2)Ⅱ中加入MnCO3、Zn2(OH)2CO3的作用是______;
Ⅱ需要加热的原因是______;C的化学式是______.
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______.
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.
(5)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______. cfq19851年前1
cfq19851年前1 -
 tianwudml 共回答了10个问题
tianwudml 共回答了10个问题 |采纳率100%解题思路:(1)在氧化还原反应中,化合价降低元素所在的产物是还原产物;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝;
(3)根据转化过程中发生的反应来确定得到的副产品;
(4)格局框图中要加入的物质可以确定工厂需要购买的化工原料;
(5)根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知MnO2、Zn的物质的量之比为1:1来计算即可.(1)比较信息①,A与软锰矿中元素化合价的变化可知,锰元素化合价从+4价降低为+2价,所以A中还原产物为MnSO4,故答案为:MnSO4;(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2...
点评:
本题考点: 金属的回收与环境、资源保护;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题是一道有关化工生产工艺的综合知识题目,考查角度广,难度大.1年前查看全部
- 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO 2 含量≥65 %,SiO 2 含量约为20%,
某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO 2 含量≥65 %,SiO 2 含量约为20%,
Al 2 O 3 含量约为4%,其余为水分;闪锌矿:ZnS含量≥ 80%,FeS、CuS、SiO 2 含量约为7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。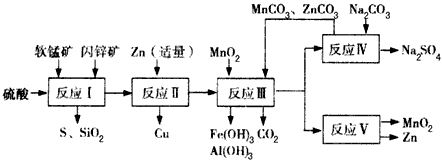
请回答下列问题:
(1)反应I后过滤所得滤液中含有MnSO 4 、ZnSO 4 、CuSO 4 、Fe 2 (SO 4 ) 3 、Al 2 (SO 4 ) 3 等。试写出反应I中生成
CuSO 4 的化学方程式_____________________。
(2)反应Ⅱ加入适量锌的作用是________________________。如果锌过量,还会进一步发生反应的离子方程式为________________________。
(3)反应V的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为____________。
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要________等原料。 sadasdwqesdwqeqw1年前1
sadasdwqesdwqeqw1年前1 -
 木人美 共回答了11个问题
木人美 共回答了11个问题 |采纳率90.9%(1)MnO 2 +CuS+2H 2 SO 4 =S+MnSO 4 +CuSO 4 +2H 2 O
(2)将溶液中的硫酸铜转化为铜;Zn+Fe 2+ =Fe+Zn 2+
(3)Mn 2+ -2e - +2H 2 O=MnO 2 +4H +
(4) Na 2 CO 3 、Zn、MnO 21年前查看全部
- MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO4+ZnSO4+2H2
MnO2+Zn+2H2SO4.电解 .
A. 步骤(1)中MnO2和H2SO4都是氧化剂
B. 步骤(1)中每析出12.8gS沉淀共转移0.8mol电子
C. 步骤(3)中电解时MnO2在阳极处产生
D. 硫酸在生产中可循环使用 fanghaifeng1年前1
fanghaifeng1年前1 -
 ayu001 共回答了25个问题
ayu001 共回答了25个问题 |采纳率96%解题思路:A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变;
B.反应中S元素由-2价升高为0;
C.电解时阳极发生氧化反应;
D.由(1)、(3)可知,硫酸既参加反应,又从反应中生成.A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变,则步骤(1)中MnO2是氧化剂,H2SO4是反应物,故A选;
B.反应中S元素由-2价升高为0,则每析出12.8gS沉淀共转移[12.8g/32g/mol]×(2-0)=0.8mol电子,故B不选;
C.电解时Mn元素的化合价升高,发生氧化反应,阳极发生氧化反应,则步骤(3)中电解时MnO2在阳极处产生,故C不选;
D.由(1)、(3)可知,硫酸既参加反应,又从反应中生成,所以硫酸在生产中可循环使用,故D不选;
故选A.点评:
本题考点: 金属冶炼的一般原理;氧化还原反应的电子转移数目计算;氧化还原反应.
考点点评: 本题考查金属的冶炼和氧化还原反应,明确元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.1年前查看全部
- MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热:MnO 2 +ZnS +2H 2 SO 4 =MnSO 4 +ZnSO 4 +S↓+2H 2 O
(2)除去反应混合物中的不溶物
(3)电解混合液:MnSO 4 +ZnSO 4 +2H 2 O MnO 2 +Zn+2H 2 SO 4
MnO 2 +Zn+2H 2 SO 4
下列说法不正确的是[ ]A.步骤(1)中MnO 2 和H 2 SO 4 都是氧化剂
B.步骤(1)中每析出12.8 g S沉淀共转移0.8 mol电子
C.步骤(3)中电解时MnO 2 在阳极处产生
D.硫酸在生产中可循环使用 Hello5201101年前1
Hello5201101年前1 -
 5100net 共回答了17个问题
5100net 共回答了17个问题 |采纳率82.4%A1年前查看全部
- MnO2和Zn是制造普通干电池的重要原料.工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:(1)将.
MnO2和Zn是制造普通干电池的重要原料.工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:(1)将...
MnO2和Zn是制造普通干电池的重要原料.工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:(1)将软锰矿.闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4==MnSO4+ZnSO4+S+2H2O(2)除去反应混合物中的不溶物(3)电解混合物:MnSO4+ZnSO4+2H2O==(电解)MnO2+Zn+2HSO4下列说法错误的是A:干电池是一种将化学能转变为电能的装置B:步骤三电解时MnO2在阳极处生成.电极反应为Mn2+-2e-+2H2O==MnO2+4H+C:步骤一每析出12.8gS沉淀共转移0.8mol电子D:步骤三的反应也可以设计成原电池 我觉得选B angelflypig1年前1
angelflypig1年前1 -
 牛肉干VS猪耳朵 共回答了22个问题
牛肉干VS猪耳朵 共回答了22个问题 |采纳率90.9%下列说法错误的是
A:干电池是一种将化学能转变为电能的装置
干电池是原电池,是一种将化学能转变为电能的装置.
B:步骤三电解时MnO2在阳极处生成.电极反应为Mn2+-2e-+2H2O==MnO2+4H+
阳极发生失去电子的反应,化合价升高.符合守恒定律.
C:步骤一每析出12.8gS沉淀共转移0.8mol电子
12.8gS的物质的量为0.4mol,化合价从-2价升高到0价,共转移0.8mol电子.
D:步骤三的反应也可以设计成原电池
步骤三的反应不是自发的氧化还原反应,不能设计成原电池 .
答案选D1年前查看全部
大家在问
- 1利用《三峡》这篇课文的资料,写一篇关于三峡美景的作文 ,其间加入自己的语言感受【不能喝译文差不多』
- 2Jim had a good time in Hainan.(改为同义句)Jim—— —— in Hainan.
- 3设P是一个数集,且至少含有两个数,若对任意a、b∈P,都有a+b、a-b、ab、 ∈P(除数b≠0)则称P是一个数域,例
- 4假如有幸在太空中亲眼目睹一场精彩的星际大战,我们能听到飞船引擎发出的声音吗?
- 5一个四位数,其首位上的数字为1,若把守位移作末位,则新的四位数是原数的4倍还多1995,试求原来的四位数
- 6平方分米的字母单位.
- 7在平面直角坐标系中,已知A(根号3,1),O(0,0),C(根号3,0)三点,AE平分角OAC,交OC于E,则直线
- 8谁能告诉我五个定语从句应该怎么写?
- 9大自然的语言第四段为什么说利用物候学与农事活动比较简便,容易掌握?
- 10如图,已知直线l的函数表达式为y=[3/4]x+3,它与x轴、y轴的交点分别为A、B两点.
- 11用纸折动物怎么弄
- 12怎么样可以从英语白痴变成个能听懂而且会说英语的人呢?
- 13一种有盖的汽油桶的底面直径是60厘米,高是100厘米.做一个这样的汽油桶至少需要多少平方厘米铁皮?
- 14求过点p(3,1)引圆x方+y方=9的切线方程
- 15要做英语作文,请大神帮我润色一下这篇英语文章,下面是现在作文的评分
