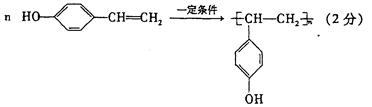
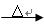B《有机化学基础》(1)科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.①如果将CO
 wansafelyf2022-10-04 11:39:541条回答
wansafelyf2022-10-04 11:39:541条回答(1)科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.
①如果将CO2和H2以1:4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源.请完成以下化学方程式:CO2+4H2______+2H2O
②若将CO2和H2以1:3的比例混合,使之发生反应生成某种重要的化工原料和水,则生成的该重要化工原料可能是______(填字母).
A.烷烃B.烯烃C.炔烃D.芳香烃
③二氧化碳“组合转化”的某烷烃碳架结构如图所示:
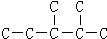 ,此烷烃的一溴代物有______种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为______,
,此烷烃的一溴代物有______种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为______,(2)根据下面的反应路线及所给信息填空.
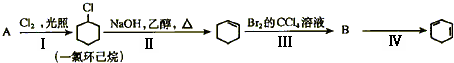
①A的结构简式是______.
Ⅰ的反应类型是______,Ⅱ的反应类型是______.
②反应Ⅳ的化学方程式是______.
(3)某有机物X由C、H、O三种元素组成,15gX完全燃烧可生成22gCO2和9gH2O.
试求:
①该有机物的最简式是______.
②若符合该最简式X物质可能不止一种,则它们之间的关系是______(填字母).
a.一定相互为同分异构体
b.等质量时完全燃烧氧气的量相同
c.等物质的量时完全燃烧耗氧量相同
③若X与碳酸钠溶液反应有气体放出,则反应的化学方程式为:______.
④若X是具有水果香味的液体,能发生水解反应,其结构简式为:______.
⑤若X的相对分子质量为180,能发生银镜反应也能发生酯化反应,则其分子式为______.

已提交,审核后显示!提交回复
共1条回复
 子寤 共回答了13个问题
子寤 共回答了13个问题 |采纳率92.3%- 解题思路:(1)①根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式;
②化学变化中,变化前后原子种类、个数不变;根据CO2和H2混合气体发生反应的分子数比1:3及生成水的组成与分子构成,结合选项所传递的关于化工原料由C、H元素组成的信息,推断生成的化工原料的分子中C、H原子的个数比;
③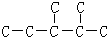 分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,若此烷烃为单烯烃加氢制得则相邻的碳原子上均至少有1氢原子.
分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,若此烷烃为单烯烃加氢制得则相邻的碳原子上均至少有1氢原子.
(2)由合成路线可知,反应Ⅰ为光照条件下的取代反应,所以A为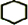 ,反应Ⅱ为卤代烃发生的消去反应,反应Ⅲ为环己烯的加成反应,B为
,反应Ⅱ为卤代烃发生的消去反应,反应Ⅲ为环己烯的加成反应,B为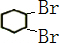 ,反应Ⅳ为卤代烃的消去反应,生成环己二烯,结合对应物质的结构和性质以及题目要求解答该题;
,反应Ⅳ为卤代烃的消去反应,生成环己二烯,结合对应物质的结构和性质以及题目要求解答该题;
(3)①根据质量守恒可知,生成22g 的二氧化碳中C元素质量即为化合物中所含C元素质量、生成9g的水中H元素质量即为化合物中所含H元素质量,化合物与C、H两种元素质量和的差为氧元素的质量,然后求出各自的物质的量,由碳、氢、氧元素的物质的量之比可推测实验式(最简式);
②A、结构相似,分子组成上相差1个或者若干个基团的化合物互称为同系物同系物;
B、有相同分子式而结构不同的化合物互为同分异构体;
C、最简式相同,质量相等,所含C、H、O质量相同,完全燃烧耗氧量相同;
D、最简式相同,分子式不一定相同,等物质的量,完全燃烧耗氧量不一定相同;
③只含一种官能团且与碳酸钠溶液反应有气体放出,则含有羧基;
④酯具有水果香味的液体,可发生水解反应,生成相应的羧酸与醇;
⑤相对分子质量为180,结合实验式求出分子式,能发生银镜反应,含有醛基,也能发生酯化反应含有羧基或羟基(具体根据分子式确定).①根据质量守恒定律的微观解释可以知道:反应前后的原子数目和种类应该相等,分析题给的化学反应方程式可以知道,反应前出现了2个O,1个C,8个H,反应后出现了2个O,4个H,所以在X中含有4个H和1个C,
故答案为:CH4;
②由反应物CO2和H2混合在一定条件下以1:3(分子数比)比例发生反应,可判断混合气体中C、H原子个数比为1:6;又由于反应后生成水,即有H原子与O原子化合成水分子;而在四个选项中的物质中都不含O元素,可判断1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料;
通过以上分析,可得出化工原料中C、H原子个数比应为1:2;而在CH4中C、H原子个数比为1:4,在C2H2中C、H原子个数比为1:1,在C2H4中C、H原子个数比为1:2,在C2H6中C、H原子个数比为1:3;
故答案为:B;
③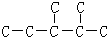 分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,则此炔烃的结构简式为
分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,则此炔烃的结构简式为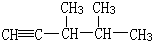 ,故答案为:6;
,故答案为:6; .
.
(2)由合成路线可知,反应Ⅰ为光照条件下的取代反应,所以A为 ,反应Ⅱ为卤代烃发生的消去反应,反应Ⅲ为环己烯的加成反应,B为
,反应Ⅱ为卤代烃发生的消去反应,反应Ⅲ为环己烯的加成反应,B为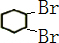 ,反应Ⅳ为卤代烃的消去反应,生成环己二烯,
,反应Ⅳ为卤代烃的消去反应,生成环己二烯,
①由以上分析可知A为 ,名称为环己烷,反应①为取代反应,③为加成反应,故答案为:
,名称为环己烷,反应①为取代反应,③为加成反应,故答案为: ;取代反应;加成反应;
;取代反应;加成反应;
②反应Ⅳ为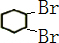 的消去反应,反应的化学方程式为
的消去反应,反应的化学方程式为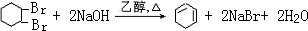 ,
,
故答案为: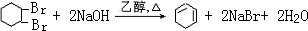 .
.
(3)①根据质量守恒定律得:15g X化合物中所含C元素质量为:22g×[12/44]=6g,
化合物中所含H元素质量为:9g×[2/18]=1g,
化合物中所含O元素质量为:15g-6g-1g=8g,
n(C):n(H):n(O)=[6g/12g/mol]:[1g/1g/mol]:[8g/16g/mol]=1:2:1,所以化合物的实验式(最简式)是CH2O,
故答案为:CH2O;
②A、最简式相同,不一定是同系物,如苯与乙炔,同系物最简式也不一定相同,如甲烷与乙烷,故A错误;
B、最简式相同,不一定是同分异构体,如苯与乙炔,故B错误;
C、最简式相同,质量相等,所含C、H、O质量相同,完全燃烧耗氧量相同,故C正确.
D、最简式相同,分子式不一定相同,等物质的量,完全燃烧耗氧量不一定相同,如1mol的苯与乙炔,故D错误.
故答案为:C;
③只含一种官能团且与碳酸钠溶液反应有气体放出,则含有羧基,最简式为CH2O,若含有一个羧基,分子式为C2H4O2,
为饱和羧酸,所以X为乙酸,结构简式为CH3COOH,与Na2CO3反应的方程式为2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O,
故答案为:2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O;
④酯具有水果香味的液体,可发生水解反应,生成相应的羧酸与醇,若含有一个酯基,分子式为C2H4O2,为饱和一元酯,所以A为甲酸甲酯,结构简式为HCOOCH3,
故答案为:HCOOCH3;
⑤令分子式为(CH2O)n,相对分子质量为180,所以30n=180,解得n=6,分子式为C6H12O6,不饱和度为[2×6+2−12/2]=1,能发生银镜反应,也能发生酯化反应,所以为葡萄糖,结构简式为CH2OH(CHOH)4CHO,故答案为:CH2OH(CHOH)4CHO.点评:
本题考点: 化石燃料与基本化工原料;有机物的合成;有机物的结构和性质;有关有机物分子式确定的计算.
考点点评: 本题考查学生利用化学反应方程式和质量守恒定律来推断物质的化学式、有机物的性质、结构与分子式确定,难度中等,守恒方法是解答本题的常用方法,学生应熟悉元素守恒、原子守恒来解答此类习题,烯烃炔烃转化为烷烃注意结构上氢原子的变化. - 1年前
相关推荐
- 济南外国语高中高二的化学是先学《化学反应原理》还是《有机化学基础》 高二物理学习多少本选修,顺序?
济南外国语高中高二的化学是先学《化学反应原理》还是《有机化学基础》 高二物理学习多少本选修,顺序?
本人,求尽量详细,明白一点. zylxj1年前1
zylxj1年前1 -
 诺基呀 共回答了13个问题
诺基呀 共回答了13个问题 |采纳率84.6%化学先上《化学反应原理》; 物理学两本:选修3-4和3-51年前查看全部
- 现在高二学的人教版选修5《有机化学基础》,第一章的第4节研究有机化合物的一般步骤和方法中(p17)
现在高二学的人教版选修5《有机化学基础》,第一章的第4节研究有机化合物的一般步骤和方法中(p17)
所以学这一册十分吃力,尤其是研究有机化合物的一般步骤和方法中这一节,怎样去分离物质是弄懂了(蒸馏……),可是应该怎样判断有机物与有机物之间的是否溶解,从而判断两者的化合物应该选取什么方法分离提纯呢?是不是有什么规律可循?是否和初中“酸碱盐溶或解性表”有关系?是否跟复分解反应也有某种关系?以及后面和这两者的关系所在,最好告诉本人我所欠缺的重点在哪里?我基础不太好,应该看看哪一部分才会对上面问题有重要帮助? 珍藏情感1年前1
珍藏情感1年前1 -
 本职7 共回答了25个问题
本职7 共回答了25个问题 |采纳率96%记住:物以类聚,相似相溶
像是H2O,到了有机化学就看成H-OH,有一个羟基-OH,那么含有-OH的物质就易溶于水.
含-OH的醇类和羧酸就能溶于水.,甲醇都能与水互溶.
但是-OH与-CH2-、-CH3溶解时是死对头
如果醇或酸类的碳多了,-CH2-就多了,占了主导地位,就不易溶于水了.比如辛醇就不溶于水
再看看甲烷CH4根本没有-OH,那他就根本不溶于水.
就此推出所有烃类和卤代烃也都不溶于水.
含苯环的也都能互相溶解.如甲苯、苯酚、苯都溶解对方.,
苯环也有-C|H-所以也能溶解于一些有机溶剂.如醇类
就大概举这么多,记住含有相似基团有机物能互相溶解.哪种基团占的比例多就越偏向谁
能问出这种问题,基础还可以了.不用着急,看看下面附的的参考资料,会有帮助1年前查看全部
- 江西高考化学选修 化学与技术可以做吗? 选考内容包括选修模块《化学与技术》、《物质结构与性质》、《有机化学基础》,三选一
江西高考化学选修 化学与技术可以做吗? 选考内容包括选修模块《化学与技术》、《物质结构与性质》、《有机化学基础》,三选一,但对江西考生来说选考内容只有《有机化学基础》这一个选择,因为实验题将不会重现选考题中.
这个说的是什么意思,可不可以写《化学与技术》哇? 古道沐雯1年前1
古道沐雯1年前1 -
 yt_lavey 共回答了22个问题
yt_lavey 共回答了22个问题 |采纳率95.5%可以呀1年前查看全部
- 苏教版高中化学必修1,必修2,及选修的《化学反应原理》《有机化学基础》《实验化学》中所有的化学方程式
 taws021年前4
taws021年前4 -
 我爱布丁 共回答了16个问题
我爱布丁 共回答了16个问题 |采纳率100%高中化学方程式大全
2Mg+TiCl4(熔融)===Ti+2MgCl2
Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C
2Mg+SiO2===2MgO+Si
Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3
4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg
4Al+3MnO2===2Al2O3+3Mn
2Al+Cr2O3===Al2O3+2Cr
2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2
Fe+2HCl===FeCl2+H2
Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2
(铁在酸性环境下,不能把四氯化锡完全
还原为单质锡 Fe+SnCl2==FeCl2+Sn)
三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2
2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O
2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O
3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O
4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2
4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
2,酸性:
4HF+SiO2===SiF4+2H2O
(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2===CaF2+2HCl
H2S+Fe===FeS+H2
H2S+CuCl2===CuS+2HCl
H2S+2AgNO3===Ag2S+2HNO3
H2S+HgCl2===HgS+2HCl
H2S+Pb(NO3)2===PbS+2HNO3
H2S+FeCl2===
2NH3+2Na==2NaNH2+H2
(NaNH2+H2O===NaOH+NH3)
3,碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl
(此反应用于工业制备小苏打,苏打)
4,不稳定性:
2HF===H2+F2
2HCl===H2+Cl2
2H2O===2H2+O2
2H2O2===2H2O+O2
H2S===H2+S
2NH3===N2+3H2
四,非金属氧化物
低价态的还原性:
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+Br2+2H2O===H2SO4+2HBr
SO2+I2+2H2O===H2SO4+2HI
SO2+NO2===SO3+NO
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2
CO+CuO===Cu+CO2
3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
3 高中化学方程式大全
氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2===Si+2H2O
SiO2+2Mg===2MgO+Si
3,与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O===2HPO3
P2O5+3H2O===2H3PO4
(P2O5极易吸水,可作气体干燥剂
P2O5+3H2SO4(浓)===2H3PO4+3SO3)
CO2+H2O===H2CO3
4,与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,
再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2
生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH+NaHCO3
SiO2+CaO===CaSiO3
SiO2+2NaOH===Na2SiO3+H2O
(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3===Na2SiO3+CO2
SiO2+CaCO3===CaSiO3+CO2
五,金属氧化物
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
3,与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;
2H2O2===2H2O+O2. H2O2的制备可利用类似的反应:
BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O+SO3===Na2SO4
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(Al2O3是两性氧化物:
Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
六,含氧酸
1,氧化性:
4HClO3+3H2S===3H2SO4+4HCl
HClO3+HI===HIO3+HCl
3HClO+HI===HIO3+3HCl
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2
(氧化性:HClO>HClO2>HClO3>HClO4,
但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C===CO2+2SO2+2H2O
2H2SO4(浓)+S===3SO2+2H2O
H2SO4+Fe(Al) 室温下钝化
6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O
2H2SO4(浓)+Cu===CuSO4+SO2+2H2O
H2SO4(浓)+2HBr===SO2+Br2+2H2O
H2SO4(浓)+2HI===SO2+I2+2H2O
H2SO4(稀)+Fe===FeSO4+H2
2H2SO3+2H2S===3S+2H2O
4HNO3(浓)+C===CO2+4NO2+2H2O
6HNO3(浓)+S===H2SO4+6NO2+2H2O
5HNO3(浓)+P===H3PO4+5NO2+H2O
6HNO3+Fe===Fe(NO3)3+3NO2+3H2O
4HNO3+Fe===Fe(NO3)3+NO+2H2O
30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O
36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O
30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O
2,还原性:
H2SO3+X2+H2O===H2SO4+2HX
(X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3,酸性:
H2SO4(浓) +CaF2===CaSO4+2HF
H2SO4(浓)+NaCl===NaHSO4+HCl
H2SO4(浓) +2NaCl===Na2SO4+2HCl
H2SO4(浓)+NaNO3===NaHSO4+HNO3
3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4
2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)2
3HNO3+Ag3PO4===H3PO4+3AgNO3
2HNO3+CaCO3===Ca(NO3)2+H2O+CO2
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)
等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
H3PO4(浓)+NaBr===NaH2PO4+HBr
H3PO4(浓)+NaI===NaH2PO4+HI
4,不稳定性:
2HClO===2HCl+O2
4HNO3===4NO2+O2+2H2O
H2SO3===H2O+SO2
H2CO3===H2O+CO2
H4SiO4===H2SiO3+H2O
七,碱
低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===NaSiO3+H2O
2NaOH+Al2O3===2NaAlO2+H2O
2NaOH+Cl2===NaCl+NaClO+H2O
NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3+3NaCl
NaOH+Al(OH)3===NaAlO2+2H2O
(AlCl3和Al(OH)3哪个酸性强?)
NaOH+NH4Cl===NaCl+NH3+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2O
Al(OH)3+NH4Cl 不溶解
3,不稳定性:
Mg(OH)2===MgO+H2O
2Al(OH)3===Al2O3+3H2O
2Fe(OH)3===Fe2O3+3H2O
Cu(OH)2===CuO+H2O
八,盐
1,氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2
(用于雕刻铜线路版)
2FeCl3+Zn===2FeCl2+ZnCl2
FeCl3+Ag===FeCl2+AgC
Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)
Fe(NO3)3+Ag 不反应
2FeCl3+H2S===2FeCl2+2HCl+S
2FeCl3+2KI===2FeCl2+2KCl+I2
FeCl2+Mg===Fe+MgCl2
2,还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O
2Na2SO3+O2===2Na2SO4
3,与碱性物质的作用:
MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl
AlCl3+3NH3.H2O===Al(OH)3+3NH4Cl
FeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl
4,与酸性物质的作用:
Na3PO4+HCl===Na2HPO4+NaCl
Na2HPO4+HCl===NaH2PO4+NaCl
NaH2PO4+HCl===H3PO4+NaCl
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2
3Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl
3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl
3NaHCO3+AlCl3===Al(OH)3+3CO2
3NaHCO3+FeCl3===Fe(OH)3+3CO2
3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S
3NaAlO2+AlCl3+6H2O===4Al(OH)3
5,不稳定性:
Na2S2O3+H2SO4===Na2SO4+S+SO2+H2O
NH4Cl===NH3+HCl
NH4HCO3===NH3+H2O+CO2
2KNO3===2KNO2+O2
2Cu(NO3)3===2CuO+4NO2+O2
2KMnO4===K2MnO4+MnO2+O2
2KClO3===2KCl+3O2
2NaHCO3===Na2CO3+H2O+CO2
Ca(HCO3)2===CaCO3+H2O+CO2
CaCO3===CaO+CO2
MgCO3===MgO+CO2
高中化学方程式总结
非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
甲烷燃烧
CH4+2O2→CO2+2H2O(条件为点燃)
甲烷隔绝空气高温分解
甲烷分解很复杂,以下是最终分解.CH4→C+2H2(条件为高温高压,催化剂)
甲烷和氯气发生取代反应
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl (条件都为光照. )
实验室制甲烷
CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)
乙烯燃烧
CH2=CH2+3O2→2CO2+2H2O(条件为点燃)
乙烯和溴水
CH2=CH2+Br2→CH2Br-CH2Br
乙烯和水
CH2=CH2+H20→CH3CH2OH (条件为催化剂)
乙烯和氯化氢
CH2=CH2+HCl→CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2→CH3-CH3 (条件为催化剂)
乙烯聚合
nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)
氯乙烯聚合
nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)
实验室制乙烯
CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)
乙炔燃烧
C2H2+3O2→2CO2+H2O (条件为点燃)
乙炔和溴水
C2H2+2Br2→C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)
实验室制乙炔
CaC2+2H2O→Ca(OH)2+C2H2↑
以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式.
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2
CaC2+2H2O→C2H2+Ca(OH)2
C+H2O===CO+H2-----高温
C2H2+H2→C2H4 ----乙炔加成生成乙烯
C2H4可聚合
苯燃烧
2C6H6+15O2→12CO2+6H2O (条件为点燃)
苯和液溴的取代
C6H6+Br2→C6H5Br+HBr
苯和浓硫酸浓硝酸
C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)
苯和氢气
C6H6+3H2→C6H12 (条件为催化剂)
乙醇完全燃烧的方程式
C2H5OH+3O2→2CO2+3H2O (条件为点燃)
乙醇的催化氧化的方程式
2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)
乙醇发生消去反应的方程式
CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)
两分子乙醇发生分子间脱水
2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)
乙醇和乙酸发生酯化反应的方程式
CH3COOH+C2H5OH→CH3COOC2H5+H2O
乙酸和镁
Mg+2CH3COOH→(CH3COO)2Mg+H2
乙酸和氧化钙
2CH3COOH+CaO→(CH3CH2)2Ca+H2O
乙酸和氢氧化钠
CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH
乙酸和碳酸钠
Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑
甲醛和新制的氢氧化铜
HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O
乙醛和新制的氢氧化铜
CH3CHO+2Cu→Cu2O(沉淀)+CH3COOH+2H2O
乙醛氧化为乙酸
2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)
烯烃是指含有C=C键的碳氢化合物.属于不饱和烃.烯烃分子通式为CnH2n,非极性分子,不溶或微溶于水.容易发生加成、聚合、氧化反应等.
乙烯的物理性质
通常情况下,无色稍有气味的气体,密度略小比空气,难溶于水,易溶于四氯化碳等有机溶剂.
1) 氧化反应:
①常温下极易被氧化剂氧化.如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去,由此可用鉴别乙烯.
②易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟.
2) 加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应.
3) 聚合反应:
2.乙烯的实验室制法
(1)反应原理:CH3CH2OH===CH2=CH2↑+H2O (条件为加热,浓H2SO4)
(2)发生装置:选用“液液加热制气体”的反应装置.
(3)收集方法:排水集气法.
(4)注意事项:
①反应液中乙醇与浓硫酸的体积比为1∶3.
②在圆底烧瓶中加少量碎瓷片,目的是防止反应混合物在受热时暴沸.
③温度计水银球应插在液面下,以准确测定反应液温度.加热时要使温度迅速提高到170℃,以减少乙醚生成的机会.
④在制取乙烯的反应中,浓硫酸不但是催化剂、吸水剂,也是氧化剂,在反应过程中易将乙醇氧化,最后生成CO2、CO、C等(因此试管中液体变黑),而硫酸本身被还原成SO2.SO2能使溴水或KMnO4溶液褪色.因此,在做乙烯的性质实验前,可以将气体通过NaOH溶液以洗涤除去SO2,得到较纯净的乙烯.
乙炔又称电石气.结构简式HC≡CH,是最简单的炔烃.化学式C2H2
分子结构:分子为直线形的非极性分子.
无色、无味、易燃的气体,微溶于水,易溶于乙醇、丙酮等有机溶剂.
化学性质很活泼,能起加成、氧化、聚合及金属取代等反应.
能使高锰酸钾溶液的紫色褪去.
乙炔的实验室制法:CaC2+2H2O→Ca(OH)2+C2H2↑
化学性质:
(1)氧化反应:
a.可燃性:2C2H2+5O2 → 4CO2+2H2O
现象:火焰明亮、带浓烟 .
b.被KMnO4氧化:能使紫色酸性高锰酸钾溶液褪色.
(2)加成反应:可以跟Br2、H2、HX等多种物质发生加成反应.
现象:溴水褪色或Br2的CCl4溶液褪色
与H2的加成
CH≡CH+H2 → CH2=CH2
与H2的加成
两步反应:C2H2+H2→C2H4
C2H2+2H2→C2H6 (条件为催化剂)
氯乙烯用于制聚氯乙烯
C2H2+HCl→C2H3Cl nCH2=CHCl→=-[-CH2-CHCl-]n- (条件为催化剂)
(3)由于乙炔与乙烯都是不饱和烃,所以化学性质基本相似.金属取代反应:将乙炔通入溶有金属钠的液氨里有氢气放出.乙炔与银氨溶液反应,产生白色乙炔银沉淀.
1、 卤化烃:官能团,卤原子
在碱的溶液中发生“水解反应”,生成醇
在碱的醇溶液中发生“消去反应”,得到不饱和烃
2、 醇:官能团,醇羟基
能与钠反应,产生氢气
能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去)
能与羧酸发生酯化反应
能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化)
3、 醛:官能团,醛基
能与银氨溶液发生银镜反应
能与新制的氢氧化铜溶液反应生成红色沉淀
能被氧化成羧酸
能被加氢还原成醇
4、 酚,官能团,酚羟基
具有酸性
能钠反应得到氢气
酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基
能与羧酸发生酯化
5、 羧酸,官能团,羧基
具有酸性(一般酸性强于碳酸)
能与钠反应得到氢气
不能被还原成醛(注意是“不能”)
能与醇发生酯化反应
6、 酯,官能团,酯基
能发生水解得到酸和醇
物质的制取:
实验室制甲烷
CH3COONa+NaOH→Na2CO3+CH4 (条件是CaO 加热)
实验室制乙烯
CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)
实验室制乙炔
CaC2+2H2O→Ca(OH)2+C2H2↑
工业制取乙醇:
C2H4+H20→CH3CH2OH (条件为催化剂)
乙醛的制取
乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)
乙烯氧化法:2 CH2=CH2+O2→2CH3CHO(条件为催化剂,加热)
乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热)
乙酸的制取
乙醛氧化为乙酸 :2CH3CHO+O2→2CH3COOH(条件为催化剂和加温)
加聚反应:
乙烯聚合
nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)
氯乙烯聚合
nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)
氧化反应:
甲烷燃烧
CH4+2O2→CO2+2H2O(条件为点燃)
乙烯燃烧
CH2=CH2+3O2→2CO2+2H2O(条件为点燃)
乙炔燃烧
C2H2+3O2→2CO2+H2O (条件为点燃)
苯燃烧
2C6H6+15O2→12CO2+6H2O (条件为点燃)
乙醇完全燃烧的方程式
C2H5OH+3O2→2CO2+3H2O (条件为点燃)
乙醇的催化氧化的方程式
2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)
乙醛的催化氧化:
CH3CHO+O2→2CH3COOH (条件为催化剂加热)
取代反应:有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应.
甲烷和氯气发生取代反应
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
(条件都为光照.)
苯和浓硫酸浓硝酸
C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)
苯与苯的同系物与卤素单质、浓硝酸等的取代.如:
酚与浓溴水的取代.如:
烷烃与卤素单质在光照下的取代.如:
酯化反应.酸和醇在浓硫酸作用下生成酯和水的反应,其实质是羧基与羟基生成酯基和水的反应.如:
水解反应.水分子中的-OH或-H取代有机化合物中的原子或原子团的反应叫水解反应.
①卤代烃水解生成醇.如:
②酯水解生成羧酸(羧酸盐)和醇.如:
乙酸乙酯的水
CH3COOC2H5+H2O→CH3COOH+C2H5OH(条件为无机酸式碱)
加成反应.
不饱和的碳原子跟其他原子或原子团结合生成别的有机物的反应.
乙烯和溴水
CH2=CH2+Br2→CH2Br-CH2Br
乙烯和水
CH2=CH2+H20→CH3CH2OH (条件为催化剂)
乙烯和氯化氢
CH2=H2+HCl→CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2→CH3-CH3 (条件为催化剂)
乙炔和溴水
C2H2+2Br2→C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2→C2H4---------C2H2+2H2→C2H6 (条件为催化剂)
苯和氢气
C6H6+3H2→C6H12 (条件为催化剂)
消去反应.有机分子中脱去一个小分子(水、卤化氢等),而生成不饱和(含碳碳双键或碳碳三键)化合物的反应.
乙醇发生消去反应的方程式
CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)
两分子乙醇发生分子间脱水
2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)
不是很完全,但是基本可以完成1年前查看全部
- 本题为选做题,包括A、B两题.选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做
本题为选做题,包括a、b两题.选学《化学与生活》模块的考生答a题,选学《有机化学基础》模块的考生答b题,每位考生只可选做1题.若两题都作答,则以a题计分.
a.《化学与生活》
(1)防治环境污染,改善生态环境已成为全球的共识.
①空气质量报告的各项指标可以反映出各地的空气质量.下列气体已纳入***空气质量报告的是______(填字母).
a.co2b.n2c.no2
②垃圾应分类收集.导致“白色污染”的生活垃圾应放置于贴有______(填字母)标志的垃圾桶内.
③工业废水需处理达标后才能排放.下列废水处理方法合理的是______(填字母).
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(2)***材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出了杰出贡献,荣获2010年度国家最高科学技术奖.
①合金是生活中常见的材料.某合金具有密度小、强度高的优良性能,常用于制造门窗框架.该合金中含量最高的金属为______(填元素符号).
②铁锈的主要成分是______(填化学式),它是钢铁在潮湿的空气中发生______腐蚀的结果.
③玻璃是一种常用的硅酸盐材料.制备普通玻璃的原料有caco3、______和______(填化学式).
(3)保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
①人类的生命活动需要糖类、______、______、维生素、水和无机盐(或矿物质)等六大类营养物质.
②维生素c是一种重要的维生素,能防止坏血病,用淀粉溶液、碘水为试剂,验证维生素c具有还原性的实验操作和现象是______.
③阿司匹林具有______作用.长期大量服用阿司匹林,其水解产物水杨酸(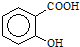 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(nahco3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式______.
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(nahco3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式______.  魔法奇兵1年前1
魔法奇兵1年前1 -
 kindle110 共回答了21个问题
kindle110 共回答了21个问题 |采纳率85.7%解题思路:(1)①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等;
②根据“白色污染”的生活垃圾属于可回收垃圾;
③根据混凝剂适用于除去废水中的悬浮物;沉淀法适用于除去废水中的重金属离子;中和法适用于除去废水中的酸;
(2)①根据该金属常用于制造门窗框架.可知为铝;
②钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀,铁锈的成分为Fe2O3•xH2O(或Fe2O3);
③工业制玻璃主要原料有石英、纯碱和石灰石;
(3)①食物中含有六大类营养物质:蛋白质、糖类、脂肪、维生素、水和无机盐;
②根据碘单质遇淀粉变蓝色,碘单质能被维生素C还原,淀粉溶液褪色;
③阿司匹林具有解热镇痛的作用;水杨酸中的羧基可以和碳酸氢钠发生反应,生成二氧化碳.(1)①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,故选:c;
②“白色污染”的生活垃圾属于可回收垃圾,故选:a;
③a.中和法适用于除去废水中的酸,所以用中和法除去废水中的酸,故a正确;
b.用沉淀法除去废水中的重金属离子,故b错误;
c.用混凝剂如明矾等除去废水中的悬浮物,故c错误;
故选:a;
(2)①铝合金具有密度小、强度高的优良性能,常用于制造门窗框架,该合金中含量最高的金属为Al,故答案为:Al;
②铁锈的主要成分是Fe2O3•xH2O(或Fe2O3),它是钢铁在潮湿的空气中发生电化学腐蚀的结果,故答案为:Fe2O3•xH2O(或Fe2O3);电化学;
③工业制玻璃主要原料有CaCO3、Na2CO3、SiO2,故答案为:Na2CO3;SiO2;
(3)①人类的生命活动需要糖类、蛋白质、油脂、维生素、水、和无机盐(或矿物质)等六大素营养物;
故答案为:蛋白质;油脂;
②碘单质遇淀粉变蓝色,碘单质能被维生素C还原后蓝色褪去,
故答案为:取少许淀粉溶液,加入数滴碘水呈蓝色,再加入维生素C,振荡后溶液蓝色褪去;
③阿司匹林具有解热镇痛的作用;水杨酸中的羧基可以和碳酸氢钠发生反应,生成二氧化碳,
水杨酸中的羧基可以和碳酸氢钠发生反应,生成二氧化碳,即: ,
,
故答案为:解热镇痛; .
.点评:
本题考点: 常见的生活环境的污染及治理;无机非金属材料;合金的概念及其重要应用;有机物的合成;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是一道综合题,考查内容涉及空气质量、废水的处理、合金的组成、钢铁的腐蚀、玻璃的制造,保持营养平衡、合理使用药物等,注意基础知识的积累,难度不大.1年前查看全部
- 《有机化学基础》18-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列关于有机物的说法
《有机化学基础》
18-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
下列关于有机物的说法中,正确的是()
E.A.蔗糖是高分子化合物,其水解产物能发生银镜反应 B.橡胶和纤维不一定都是合成高分子材料 C.常温下淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH) 2 发生反应 D.将某烃类的混合气体跟Cl 2 混合光照,发现有油状液滴生成,说明混合气体肯定含有甲烷 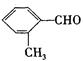 分子中所有原子不可能共平面
分子中所有原子不可能共平面
18-2.(14分)已知:一个碳原子上连有两个羟基时,易发生下列转化:
请根据下图作答: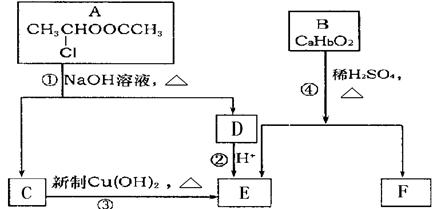
(1)A的核磁共振氢谱中出现 组峰;E中含有的官能团的名称是 ;
(2)反应③的化学方程式为 ;
(3)已知B的相对分子质量为162,其完全燃烧的产物中CO 2 和H 2 O的物质的量之比为 n(CO 2 )︰n (H 2 O)=2︰1,则B的分子式为 ;
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①属于芳香族化合物;②能跟FeCl 3 溶液发生显色反应;③能发生加聚反应;④苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 ;
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种可能的结构,请写出它们的结构简式 。 清风上人1年前1
清风上人1年前1 -
 dannywong0708 共回答了13个问题
dannywong0708 共回答了13个问题 |采纳率100%1年前查看全部
- 谁能帮我理一下《有机化学基础》里的几个问题
谁能帮我理一下《有机化学基础》里的几个问题
液溴 溴水 溴的四氯化碳溶液:做题目的时候很混乱?
还有溴水和酸性高锰酸钾,怎么用怎么区别?
关于实验条件,什么要水浴?
学了感觉知识很混乱诶,怎么办 射手曲曲1年前4
射手曲曲1年前4 -
 记有54 共回答了20个问题
记有54 共回答了20个问题 |采纳率95%老大 你说明白点.
在水浴条件下的有
1、苯的硝化反应:50-60摄氏度水浴
2、所有的银镜反应:温水浴
3、酚醛树脂的制取:沸水浴(100摄氏度)
4、乙酸乙酯的水70-80摄氏度水浴
5、蔗糖的水热水浴
6、纤维素的水热水浴
使溴水褪色的有机物有:
1、不饱和烃(烯、炔、二烯、苯乙烯等);
2、不饱和烃的衍生物(烯醇、烯醛等);
使酸性高锰酸钾溶液褪色的有机物有:
1、不饱和烃;
2、苯的同系物;
3、不饱和烃的衍生物;
4、部分醇类有机物;
5、含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐;
总的来说吧溴水和高锰酸钾溶液在有机化学中常用来作为检验一些有机物的试剂,反应以溶液中颜色变化来鉴定或鉴别某些有机物.
(1)能使溴水褪色或变色的物质及有关化学反应原理分别为:
①烯烃、炔烃、二烯烃等不饱和烃类反应,使溴水褪色
CH2=CH2+Br2——→CH2Br-CH2Br
CH≡CH+Br2——→CHBr=CHBr
(或CH≡CH+2Br2——→CHBr2-CHBr2
CH2=CH-CH=CH2+Br2——→CH2Br-CH=CH-CH2Br
(或CH2=CH-CH=CH2+Br2——→CH2Br-CHBr-CH=CH2)
②与苯酚反应生成白色沉淀
③与醛类等有醛基的物质反应,使溴水褪色
CH3CHO+Br2+H2O=CH3COOH+2HBr
④与苯、甲苯、四氯化碳等有机溶液混合振荡,因萃取作用使溴水褪色,有机溶剂溶解溴呈橙色(或棕红色).
⑤与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应,使溴水褪色.
Br2+2NaOH=NaBr+NaBrO+H2O
(或3Br2+6NaOH=5NaBr+NaBrO3+3H2O)
Br2+Na2CO3=NaBr+NaBrO+CO2
⑥与较强的无机还原剂(如H2S、SO2、KI和FeSO4等)发生反应,使溴水褪色.
Br2+H2S=2HBr+S↓(浅黄色沉淀)
Br2+SO2+2H2O=2HBr+H2SO4
3Br2+6FeSO4=2Fe2(SO4)3+2FeBr3
Br2+2KI=2KBr+I2(溶液变为棕色)
(2)能使高锰酸钾溶液褪色的物质及有关化学反应原理分别为:
①与烯烃、炔烃、二烯烃等不饱和烃类反应,使高锰酸钾溶液褪色;与苯的同系物(甲苯、乙苯、二甲苯等)反应,使酸性高锰酸钾溶液褪色.
②与苯酚发生氧化还原反应,使高锰酸钾溶液褪色
③与醛类等有醛基的有机物发生氧化还原反应,使高锰酸钾溶液褪色
④与具有还原性的无机还原剂(如H2S、SO2、FeSO4、KI、HCl等)反应,使高锰酸钾溶液褪色.
(3)归纳“既使高锰酸钾溶液褪色,又使溴水褪色的物质”包括:
既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的物质包括分子结构中有C=C双键、C≡叁键、醛基(—CHO)的有机物;苯酚和无机还原剂.苯的同系物只能使其中的酸性高锰酸钾溶液褪色;有机萃取剂只能使其中的溴水褪色.
老大,帮你总结了那么多,行了吧``!至于分你就看者给吧.1年前查看全部
- 求高中化学《有机化学基础》知识点
 一一SHOPPING1年前4
一一SHOPPING1年前4 -
 蓝雨蒙蒙 共回答了13个问题
蓝雨蒙蒙 共回答了13个问题 |采纳率92.3%会考导引,会考标准,或者一些课外辅导书,都会有知识点条目的1年前查看全部
- 谁有招安一中化学2009—2010年《有机化学基础》脂肪烃(烷烃、烯烃、炔烃- “福建高中新 .
 穆穆良朝1年前2
穆穆良朝1年前2 -
 cherrypony 共回答了14个问题
cherrypony 共回答了14个问题 |采纳率92.9%建议你去恒谦教育网看一下,哪里的试卷很多,教育资源也很多1年前查看全部
- B.《有机化学基础》(1)有机物中广泛存在着同分异构现象.①烷烃C5Hl2的同分异构体有______
B.《有机化学基础》
(1)有机物中广泛存在着同分异构现象.
①烷烃C5Hl2的同分异构体有______种(填字母).
a.2b.3c.4
②下列同分异构体中,能发生银镜反应的是______(填字母).
a.CH3CH2CHOb.CH3CO CH3c.CH2=CHCH2OH
③下列同分异构体中,不能与氢氧化钠溶液反应的是______ (填字母).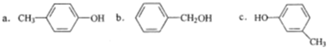
(2)有机物X的结构简式为CH3CHBrCH3.
①X的核磁共振氢谱图上有______个吸收峰.
②X与NaOH的水溶液共热可生成有机物Y,Y的结构简式为______.
③X与NaOH的醇溶液共热可生成有机物Z,该反应的化学方程式为CH3CHBrCH3+NaOH
CH2=CHCH3+NaBr醇 △ CH3CHBrCH3+NaOH.
CH2=CHCH3+NaBr醇 △
(3)有机合成高分子化合物为我们提供了丰富多彩的合成材料.
①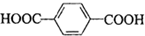 和HOCH2CH2OH两种单体可通过______ 反应(填反应类型)制造合成纤维,该合成纤维的结构简式为______.
和HOCH2CH2OH两种单体可通过______ 反应(填反应类型)制造合成纤维,该合成纤维的结构简式为______.
②聚丙烯酸甲酯是一种优良的高分子涂料,其结构简式如图: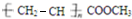
该高分子化合物的单体是______(填结构简式),该单体与氢氧化钠溶液完全反应可生成______(填结构简式). fjwmm88001年前1
fjwmm88001年前1 -
 x421313 共回答了19个问题
x421313 共回答了19个问题 |采纳率78.9%解题思路:(1)①烷烃C5Hl2的同分异构体,存在碳链异构;
②含-CHO的物质可发生银镜反应;
③含酚-OH的有机物具有酸性,与碱反应,而醇不与碱反应;
(2)①CH3CHBrCH3中含2种位置的H;
②X与NaOH的水溶液共热可生成有机物Y,发生水解反应,Y为醇;
③X与NaOH的醇溶液共热可生成有机物Z,发生消去反应,Z为丙烯;
(3)①含-OH、-COOH的有机物发生缩聚反应生成高分子化合物;
②由结构简式可知,高分子为加聚反应产物,将主链中的半键闭合得到双键,单体中含酯基,可发生水解反应.(1)①烷烃C5Hl2的同分异构体,存在碳链异构,有3种同分异构体,分别为正戊烷、新戊烷、异戊烷,故答案为:b;
②含-CHO的物质可发生银镜反应,只有a可发生银镜反应,故答案为:a;
③含酚-OH的有机物具有酸性,与碱反应,而醇不与碱反应,只有b为醇,与碱不反应,故答案为:b;
(2)①CH3CHBrCH3中含2种位置的H,则核磁共振氢谱图上有2个吸收峰,故答案为:2;
②X与NaOH的水溶液共热可生成有机物Y,发生水解反应,Y为醇,Y的结构简式为CH3CHOHCH3,故答案为:CH3CHOHCH3;
③X与NaOH的醇溶液共热可生成有机物Z,发生消去反应,Z为丙烯,该反应的化学方程式为CH3CHBrCH3+NaOH
醇
△CH2=CHCH3+NaBr,
故答案为:CH3CHBrCH3+NaOH
醇
△CH2=CHCH3+NaBr;
(3)①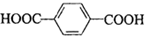 和HOCH2CH2OH两种单体发生缩聚反应生成高分子化合物,该合成纤维的结构简式为
和HOCH2CH2OH两种单体发生缩聚反应生成高分子化合物,该合成纤维的结构简式为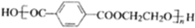 ,
,
故答案为:缩聚;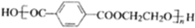 ;
;
②由结构简式可知,高分子为加聚反应产物,将主链中的半键闭合得到双键,则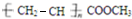 的单体为CH2=CHCOOCH3,含酯基,可发生水解反应,与NaOH反应的水解反应为CH2=CHCOOCH3+NaOH
的单体为CH2=CHCOOCH3,含酯基,可发生水解反应,与NaOH反应的水解反应为CH2=CHCOOCH3+NaOH
水
△CH2=CHCOONa+HOCH3,即完全反应生成CH2=CHCOONa、HOCH3,
故答案为:CH2=CHCOOCH3;CH2=CHCOONa、HOCH3.点评:
本题考点: 有机物的合成;有机物分子中的官能团及其结构;有机物的结构和性质;有机化学反应的综合应用.
考点点评: 本题考查较综合,涉及有机物的合成、有机物的结构与性质、同分异构体等,为高频考点,把握官能团与性质的关系为解答的关键,侧重卤代烃、醇、羧酸、酯性质的考查,题目难度不大.1年前查看全部
- 本题为选做题,包括A、B两题.选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做
本题为选做题,包括a、b两题.选学《化学与生活》模块的考生答a题,选学《有机化学基础》模块的考生答b题,每位考生只可选做1题.若两题都作答,则以a题计分.
a.《化学与生活》
(1)材料是人类赖以生存和发展的重要物质基础.
①生产水泥的主要原料是黏土和______(填名称).
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种______.(选填“橡胶”或“纤维”或“塑料”)
③上海世博会中国馆用到一种涂料-氟碳涂层聚酯(fep),它的单体为cf3-cf=cf2,这种涂料具有______(选填“热塑性”或“热固性”).
④玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于______材料(选填“合金”或“复合”).
(2)人体健康与食品、药物等关系密切.
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取______(选填“脂肪”、“维生素”或“蛋白质”)不足引起的.
②生活中应合理地摄取人体必需的元素,体内______含量过高,会引起甲状腺疾病.
③糖类、油脂、蛋白质都是人体必需的营养物质.其中蛋白质被摄入人体后,在酶的作用下水解为______(写名称).
④小苏打可用来治疗胃酸过多,请写出该反应的离子方程式______.
⑤可以帮助流感病人解热镇痛的药物是______(选填“青霉素”或“阿司匹林”).
(3)洁净安全的生存环境更是健康的保障.
①为确保上海世博会期间城市空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是______.
a.可吸入颗粒物(pm10)b.no2浓度c.so2浓度d.co2浓度
②自来水可利用漂白粉来杀菌消毒,其能杀菌消毒的原因(用化学反应方程式表示)是______.
③垃圾的无害化处理常用的方法包括卫生填埋和______焚烧.
④人们为追求时尚而把头发染成各种各样的颜色,常见的染发剂有植物染发剂、无机染发剂和______染发剂(选填“有机”“合成”或“复合”).
b.(1)具有明显现象的官能团特征反应常被用来鉴定化合物.
①欲区分ch2=ch2和ch3ch3,应选用______(填字母).
a.naoh溶液b.溴水c.银氨溶液
②欲区分hcho和hcooh,应选用______ (填字母).
a.kmno4溶液b.银氨溶液c.na2co3溶液
③欲区分 和
和 ,应选用______ (填字母).
,应选用______ (填字母).
a.fecl3溶液b.naoh溶液c.agno3溶液
(2)在有机化学中,同分异构是普遍存在现象.分子式为c4h9oh的有机物共有______
种.其中,一种有机物通过消去反应可转变为2-丁烯,请写出该消去反应的化学方程式h3cch2ch(oh)ch3
ch3ch=chch3+h2o浓硫酸 .△ h3cch2ch(oh)ch3;另一种有机物的核磁共振氢谱图(1h核磁共振谱图)中显示一个峰,请写出该有机物的结构简式如下:______.
ch3ch=chch3+h2o浓硫酸 .△
(3)a是石油裂解气的成分之一,a的某一同系物e的产量通常用来衡量一个***的石油化工水平.现以a为主要原料合成c6h12o2,其合成路线如图所示: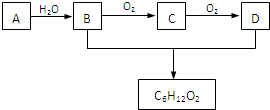
回答下列问题:
①a的结构简式为:______.
②b、d分子中的官能团名称分别为______、______.
③写出b的同类别的同分异构体的结构简式:______.
④写出b→c的化学方程式:2ch3ch2ch2oh+o2
2ch3ch2cho+2h2o催化剂 .△ 2ch3ch2ch2oh+o2.
2ch3ch2cho+2h2o催化剂 .△  wangqian881年前1
wangqian881年前1 -
 shanguang06 共回答了17个问题
shanguang06 共回答了17个问题 |采纳率88.2%解题思路:A(1)①黏土和石灰石是水泥的原料;
②有机玻璃属于塑料;
③线性分子具有热塑性;
④复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料;
(2)①根据水果、蔬菜的营养成分分析;
②根据缺碘会引起甲状腺疾病;
③糖类水解生成葡萄糖;
④小苏打为NaHCO3,胃酸中含盐酸,二者反应生成氯化钠、水、二氧化碳;
⑤阿司匹林是解热镇痛药;
(3)①空气质量日报中检测的是可吸入颗粒物和二氧化硫和氮氧化物;
②次氯酸钙可以和空气中的水及二氧化碳反应生成具有漂白作用的次氯酸;
③焚烧会产生有毒气体;
④常见的染发剂有植物染发剂、无机染发剂和合成洗涤剂.
B(1)根据有机物的官能团判断性质的异同,以选择鉴别方法,注意醛基、酚羟基的性质;
(2)C4H9OH的同分异构体由C4H9-决定,有CH3CH2CH2CH2OH、CH3CH2CHOHCH3、(CH3)2CHCH2OH、(CH3)3COH4种,结合题目要求可解答该题;
(3)E是乙烯,A是乙烯的同系物,A和水发生加成反应生成B,则B是醇,醇和氧气反应生成C,则C是醛,C和氧气反应生成D,D是酸,醇和酸反应生成酯C6H12O2,则醇和酸都含有3个碳原子,即A为丙烯.A(1)①水泥的主要原料是黏土和石灰石,故答案为:石灰石;
②有机玻璃的单体是甲基丙烯酸甲酯(化学式为C5H8O2),所以有机玻璃实际上是一种塑料,故答案为:塑料;
③氟碳涂层聚酯(FEP)为线性分子具有热塑性,故答案为:热塑性;
④玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,故答案为:复合;
(2)①水果、蔬菜富含维生素,故答案为:维生素;
②体内缺碘会引起甲状腺疾病,故答案为:碘或I;
③淀粉水解生成葡萄糖,故答案为:葡萄糖;
④小苏打为NaHCO3,胃酸中含盐酸,用小苏打治疗胃酸过多的离子反应为H++HCO3-=H2O+CO2↑,故答案为:H++HCO3-=H2O+CO2↑;
⑤青霉素是抗生素,阿司匹林是解热镇痛药,故答案为:阿司匹林;
(3)①空气质量日报中检测的是可吸入颗粒物和二氧化硫和氮氧化物,所以二氧化碳不在检测范围之内,故选d;
②漂白粉的漂白原理是:次氯酸钙与空气中的水和CO2作用生成的次氯酸是一种很好的杀菌消毒剂,反应方程式如下:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
③焚烧会产生有毒气体,应在封闭条件下进行,故答案为:封闭式;
④常见的染发剂有植物染发剂、无机染发剂和合成洗涤剂,故答案为:合成.
B(1)①乙烯能使溴水褪色而乙烷不能,故答案为:b;
②甲酸能与Na2CO3溶液反应生成二氧化碳,而甲醛不能,故答案为:c;
③苯酚可与FeCl3溶液发生反应,溶液呈紫色,为特征反应,故答案为:a;
(2)C4H9OH的同分异构体由C4H9-决定,有CH3CH2CH2CH2OH、CH3CH2CHOHCH3、(CH3)2CHCH2OH、(CH3)3COH4种,其中通过消去反应可转变为2-丁烯的为CH3CH2CHBrCH3,
反应的方程式为H3CCH2CH(OH)CH3
浓硫酸
.
△CH3CH=CHCH3+H2O,另一种有机物的核磁共振氢谱图中显示只有一个峰,说明只含有1种H,应为(CH3)3COH,可写为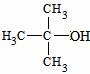 ,故答案为:H3CCH2CH(OH)CH3
,故答案为:H3CCH2CH(OH)CH3
浓硫酸
.
△CH3CH=CHCH3+H2O;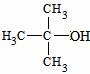 ;
;
(3)①A为丙烯,结构简式为:CH3CH=CH2,故答案为:CH3CH=CH2;
②B是丙醇,含有羟基,D是丙酸,含有羧基,故答案为:羟基,羧基;
③B的同类别的同分异构体的结构简式: ,故答案为:
,故答案为: ;
;
④丙醇被氧化为丙醛,反应方程式为:2CH3CH2CH2OH+O2
催化剂
.
△2CH3CH2CHO+2H2O,故答案为:2CH3CH2CH2OH+O2
催化剂
.
△2CH3CH2CHO+2H2O.点评:
本题考点: 水泥的主要化学成分、生产原料及其用途;常见的生活环境的污染及治理;有机物的鉴别;有机物的推断;营养均衡与人体健康的关系;药物的主要成分和疗效;常用合成高分子材料的化学成分及其性能;有机物(官能团)的检验.
考点点评: 本题考查有机物的推断与合成,涉及烯、醇、醛、羧酸等的性质与转化等、常用化学用语的书写,难度不大.1年前查看全部
- 求高中化学《有机化学基础》知识点!
 qdgt20101年前2
qdgt20101年前2 -
 神兵赴朔方 共回答了19个问题
神兵赴朔方 共回答了19个问题 |采纳率89.5%我的百度空间有复习资料1年前查看全部
- 求高中选修5《有机化学基础》练习题
求高中选修5《有机化学基础》练习题
各个章节的练习题,没啥毛病的.最好有答案的. Heart_Lost1年前1
Heart_Lost1年前1 -
 毕业的选择 共回答了20个问题
毕业的选择 共回答了20个问题 |采纳率95%学科网下载1年前查看全部
- 必修5《有机化学基础》第三章,烃的含氧衍生物,怎么办?上课都有点听不懂了,学案也不会做,更别提大题了!恳求您的指导!
 幽迷撒加1年前4
幽迷撒加1年前4 -
 成成15 共回答了17个问题
成成15 共回答了17个问题 |采纳率94.1%其实有机化学不难,高中化学中难得是化学反应原理.有机化学比较系统,想要学好有机化学先要记清通式,官能团能够发生什么反应,反应的条件是什么,这是最基本的.你现在应该是对之前的知识不够熟悉所以上课才会不懂.想做好题就必须懂题,不能急,要弄清楚题目给你什么信息,问题是什么?这题会需要到那些信息,这些就是解的关键.看每个人对化学的敏感度1年前查看全部
- 谁能帮我理一下高中化学各种有机物鉴别方法(就必修2和选修《有机化学基础》)
 偏偏要把唐僧爱1年前1
偏偏要把唐僧爱1年前1 -
 放肆一把 共回答了6个问题
放肆一把 共回答了6个问题 |采纳率100%有机物检验重点是官能团的检验.例如醇类检验就是对醇羟基的检验,可以加入很少量的金属钠,看是否有气泡.对醛类的检验就是检验醛基,可以用新制银氨溶液,看表面是否有光亮的银,或者是新制的氢氧化铜悬浊液,看是否有砖红色沉淀生成,不过是具体的物质,还要根据具体情况而定.1年前查看全部
- 《有机化学基础》中的一道题目7.萘、蒽、菲()是比较简单的稠环芳香烃.请回答以下问题:(1)在一定条件下,萘与浓硫酸、浓
《有机化学基础》中的一道题目
7.萘、蒽、菲()是比较简单的稠环芳香烃.请回答以下问题:
(1)在一定条件下,萘与浓硫酸、浓硝酸的混合酸作用可以得到两种萘的一硝基取代物,写出这两个反应的化学方程式.
(2)蒽和菲之间存在何种关系?
(3)菲的一氯取代产物可能有多少种?写出它们的结构简式. badorange1年前1
badorange1年前1 -
 frankfunny 共回答了16个问题
frankfunny 共回答了16个问题 |采纳率87.5%(1)α,β的取代
(2)同分异构
(3)这个好像是初中问题.应该是5种.1年前查看全部
- 我是江苏徐州的学生,我想问一下高二选修化学的学哪本书,是人教版的《有机化学基础》还是苏教版的《有机化学基础》
 ceelly1年前1
ceelly1年前1 -
 5fds8a8f 共回答了22个问题
5fds8a8f 共回答了22个问题 |采纳率81.8%我是江苏南京的,学的是人教版的《有机化学基础》
第一章 认识有机化合物
第二章 烃和卤代烃
第三章 烃的含氧衍生物
第四章 生命中的基础有机化合物质
第五章 进入合成有机高分子的时代1年前查看全部
- 《有机化学基础》(1)根据官能团可以对有机物进行分类、鉴别和除杂.①下列有机物属于烃的是______(填字母).a.乙炔
《有机化学基础》
(1)根据官能团可以对有机物进行分类、鉴别和除杂.
①下列有机物属于烃的是______(填字母).
a.乙炔b.乙醇c.乙酸
②区分甲苯和苯酚,不可用的试剂是______(填字母).
a.FeCl3溶液b.酸性KMnO4溶液c.溴水
③除去乙酸乙酯中的乙酸,可用的试剂是______(填字母).
a.NaOH溶液b.NaCl溶液c.饱和Na2CO3溶液
(2)异丙苯是一种重要的有机化工原料.异丙苯的结构简式为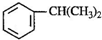
①异丙苯中至多有______个碳原子共平面.
②异丙苯有多种同分异构体,其中一溴代物种类最少的芳香烃的是______.
③由异丙苯制备对溴异丙苯的反应条件为______.
(3)化合物III是一种重要的医药合成中间体,其合成路线如下: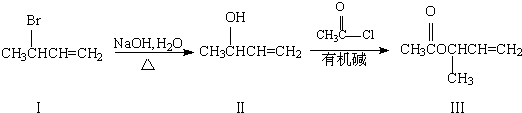
①该合成路线中第二步反应属于______(填反应类型).
②在一定条件下,Ⅰ、Ⅱ、Ⅲ3种化合物中的______(填序号)可发生消去反应生成不含甲基的产物.
③化合物Ⅲ的一种同分异构体X能发生银镜反应且能水解,X的核磁共振氢谱图显示分子中有3种不同化学环境的氢.X的结构简式为______.
④请写出区分化合物Ⅰ和化合物Ⅱ的实验方法和现象______. james12101年前1
james12101年前1 -
 名字独一无二 共回答了20个问题
名字独一无二 共回答了20个问题 |采纳率90%解题思路:(1)①烃中只含C、H元素;
②苯酚可发生显色反应、取代反应;
③除去乙酸乙酯中的乙酸,可选饱和碳酸钠,与乙酸反应,且降低乙酸乙酯的溶解度;
(2)①苯环为平面结构,与苯环直接相连的C在同一平面内;
②异丙苯的多种同分异构体中,一溴代物最少的是1,3,5-三甲苯,只有一取代物;
③异丙苯制备对溴异丙苯,与溴发生取代,Fe作催化剂;
(3)由合成流程可知,Ⅰ→Ⅱ发生卤代烃的水解反应,Ⅱ→Ⅲ发生取代反应,-OH被CH3CO-取代,然后结合有机物的结构与性质来解答.(1)①烃中只含C、H元素,只有a符合,b、c中含O元素,故答案为:a;
②苯酚可与氯化铁发生显色反应、与溴水发生取代反应生成白色沉淀,区分甲苯和苯酚,不可用的试剂是b,二者均使高锰酸钾褪色,故答案为:b;
③除去乙酸乙酯中的乙酸,可选饱和碳酸钠,与乙酸反应,且降低乙酸乙酯的溶解度,故答案为:c;
(2)①苯环为平面结构,与苯环直接相连的C在同一平面内,甲烷中3个原子可共面,则只多8个C原子共面,故答案为:8;
②异丙苯的多种同分异构体中,一溴代物最少的是1,3,5-三甲苯,只有一取代物,故答案为:1,3,5-三甲苯;
③异丙苯制备对溴异丙苯,与溴发生取代,Fe作催化剂,则反应条件为Br2/Fe,故答案为:Br2/Fe;
(3)由合成流程可知,Ⅰ→Ⅱ发生卤代烃的水解反应,Ⅱ→Ⅲ发生取代反应,-OH被CH3CO-取代,
①由上述分析可知,该合成路线中第二步反应属于取代反应,故答案为:取代反应;
②Ⅰ、Ⅱ中均可发生消去反应生成不含甲基的化合物,但消去反应的条件不同,故答案为:Ⅰ、Ⅱ;
③化合物Ⅲ的一种同分异构体X能发生银镜反应且能水解,X的核磁共振氢谱图显示分子中有3种不同化学环境的氢,X为甲酸某酯,且分子中含3种位置的H,则X为HCOOC(CH3)=C(CH3)2,故答案为:HCOOC(CH3)=C(CH3)2;
④Ⅱ中含-OH,与Na反应生成氢气,则区分化合物Ⅰ和化合物Ⅱ的实验方法和现象为分别取二者加少量钠,生成气体的为Ⅱ,故答案为:分别取二者加少量钠,生成气体的为Ⅱ.点评:
本题考点: 有机物的合成;有机物分子中的官能团及其结构;有机物的鉴别;有机化学反应的综合应用.
考点点评: 本题考查有机物的合成,涉及结构与性质、官能团与性质及合成流程分析,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析能力和综合应用能力的考查,题目难度不大.1年前查看全部
大家在问
- 1把一个分数的分子乘上3 分母除以3 分数值是原来的几倍,为什么
- 2I will meet you ___ you like.
- 3设z=ln(x+y),则z/x=
- 4求×ain格式的英文单词,例如pain,vain,main..把知道的告诉我把~
- 5为什么又是顷盆大雨?伤感的季节…
- 6我是高二女生,学理科的,没有参加数理化生信竞赛,但是英语还行,一般年级1-5名左右,擅长英语作文(一般考试25分的英语作
- 7英语翻译(Or ninety-five percent) Here,follow him,around the crat
- 8下面运算顺序一样的一组是( )
- 9北京时间2013年4月20日8时2分在四川省雅安市芦山县(北纬30.3,东经103.0)发生7.0级地震。震源深度13公
- 10新编广州版english小学英语目标实施手册测试卷四年级第二学期的答案
- 11把一个棱长为20立方厘米的正方体切割成一个最大的圆锥,这个圆锥的体积是正方体体积的几分之几?
- 12溶液中溶质的质量分数的符号是什么?
- 13(2011•德州)下列区域叙述正确的是( )
- 14(2012•深圳二模)一不计重力的带电粒子q从A点射人一正点电荷Q的电场中,运动轨迹如图所示,则( )
- 15小玲和小伶去买书,每人都买了一本趣味数学