nacl容液电解方程式粗铜点解
 t82818262022-10-04 11:39:542条回答
t82818262022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 流浪的鱼我 共回答了25个问题
流浪的鱼我 共回答了25个问题 |采纳率88%- 阳极是氢离子和电子生成氢气,阴极反应是氯离子失电子生成氯气
- 1年前
 246789 共回答了20个问题
246789 共回答了20个问题 |采纳率- 阳极:Cu-2e¯=Cu2¯(铜比氯离子优先失电子。因为电极失电子优先于溶液中阴离子失电子)
阴极:2H﹢+2e¯=H2↑
总方程式:Cu+2H﹢=H2↑+Cu2¯ - 1年前
相关推荐
- 某同学把30克质量分数为15%的高猛酸钾容液稀释成质量分数为0.03%的容液,需加水多少千克?
 mv__nj37bpp65211年前1
mv__nj37bpp65211年前1 -
 kid606 共回答了14个问题
kid606 共回答了14个问题 |采纳率92.9%要加水X克.
15%*30=0.03%*X
解X=15000克=15千克.
答.
希望能帮到你.1年前查看全部
- 实验室常用百分之十的H2O2容液在MnO2作催化剂反应下制氧气,有百分之三十的H2O2溶液五十克,使质量分数为百分之十,
实验室常用百分之十的H2O2容液在MnO2作催化剂反应下制氧气,有百分之三十的H2O2溶液五十克,使质量分数为百分之十,要加入多少水 ?如果百分之十的H2O2溶液136克来制取O2完全反应得多少克 ?
 天不亮就上网1年前1
天不亮就上网1年前1 -
 我为入眠迷 共回答了24个问题
我为入眠迷 共回答了24个问题 |采纳率91.7%百分之三十的H2O2溶液五十克,使质量分数为百分之十,要加入水的质量是 50g * 30% / 10% - 50g = 100g 2H2O2 =MnO2催化= 2H2O + O2↑ 2*34 32 13.6g 6.4g 百分之十的H2O2溶液136克含溶质13.6克,来制取O2完全反应得6.4...1年前查看全部
- 某同学通过实验探究铁、铜、银的金属活动性顺序,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜容液.
 bielaizhende1年前3
bielaizhende1年前3 -
 mjp42574439 共回答了20个问题
mjp42574439 共回答了20个问题 |采纳率95%方法一:1、取适量铁丝放入硫酸铜溶液里,反应一段时间会发现有红色的铜被置换出来了,溶液颜色变成浅黄色.证明:铁>铜
2、取适量银丝放入硫酸铜溶液里,会发现不能置换出铜,溶液无变化.证明:银铜>银
方法二:1、取适量三种金属分别加适量硫酸溶液,反应一段时间,观察现象,铁会反应消失,溶液变成浅黄色;铜、银无变化.证明:铁>铜、银
2、取适量银丝放入硫酸铜溶液里,会发现不能置换出铜,溶液无变化.证明:银铜>银1年前查看全部
- 将某物质的容液蒸发60克水后,降温到原来度数析出5克固体再蒸发60克水温度仍降到原来温度又析出6克固体则
将某物质的容液蒸发60克水后,降温到原来度数析出5克固体再蒸发60克水温度仍降到原来温度又析出6克固体则
原溶液变成饱和溶液,需补充1克溶质 B原溶液变成饱和溶液许补充6克溶质 C再该温度下该物质的溶解度为6克 D 再该温度下该物质的溶解度为八点三克 蚊子蜂1年前2
蚊子蜂1年前2 -
 不想骗人的 共回答了16个问题
不想骗人的 共回答了16个问题 |采纳率87.5%A 原溶液变成饱和溶液,需补充1克溶质
第二次蒸发为饱和溶液蒸发,即该温度时60g水最多能溶6克,溶解度为10克.第一次蒸发60克只析出了5克,若要达到饱和应为6克.所以需补充1克溶质1年前查看全部
- 铝与硝酸银容液能否反应
 liyh0111211年前5
liyh0111211年前5 -
 13是我的人0003 共回答了13个问题
13是我的人0003 共回答了13个问题 |采纳率100%能,铝的活泼性大于银,所以可以把银置换出来.1年前查看全部
- 百分之一的尿素容液是什么百分比?
 ee皇sy1年前1
ee皇sy1年前1 -
 6xmm 共回答了28个问题
6xmm 共回答了28个问题 |采纳率78.6%按常规应该是质量百分比,用数学式表示为:
[一克脲素/(一克脲素+99克水)]*100%
=1% .(如果溶剂是水)1年前查看全部
- 稀硫酸除铁锈离子方程式 铝片溶于稀硫酸 锌片放入硫酸铜容液中 SIO2与NAOH反映
稀硫酸除铁锈离子方程式 铝片溶于稀硫酸 锌片放入硫酸铜容液中 SIO2与NAOH反映
除去O2中的CO2
除去硫酸根离子中的碳酸根离子
全些离子方程式 打了个哎呀1年前1
打了个哎呀1年前1 -
 异域甜甜 共回答了17个问题
异域甜甜 共回答了17个问题 |采纳率88.2%Fe2O3+6H+=2Fe3+ + 3H2O
2Al+6H+=2Al3+ + 3H2↑
Zn+Cu2+ = Cu +Zn2+
SiO2+2OH- = SiO32- + H2O
CO2+ 2OH-=CO32- +H2O
CO32- +2H+ =H2O+CO2↑1年前查看全部
- 以石墨作电极,电解下列容液,写出点解反应及点解总反应式.
以石墨作电极,电解下列容液,写出点解反应及点解总反应式.
1氯化氢溶液 2硫酸钠溶液 3氯化钠溶液 4硝酸银溶液 殴伤ii1年前1
殴伤ii1年前1 -
 逸风尘子 共回答了21个问题
逸风尘子 共回答了21个问题 |采纳率90.5%写电解方程式的关键是要清楚各离子的放电顺序,几个比较常见的如下:
(前提是电极为惰性电极)
阴离子:S 2- >I ->Br - >Cl ->OH- >含氧酸根》F-
阳离子:Ag +>Fe 3+>Cu 2+>H +>Fe 2+>Zn 2+>Mg 2+>Na +
所以你可以先找出溶液中有什么离子(注意溶液中一定有由水电离的H+和OH-),再根据上面的放电顺序自己写写看,再不懂才再问,那样你映象会深刻许多.1年前查看全部
- 已知某温度下0.01mol·L乙酸溶液的电离度为4.2%,求此时乙酸的电离常数和容液中[H+]浓度
已知某温度下0.01mol·L乙酸溶液的电离度为4.2%,求此时乙酸的电离常数和容液中[H+]浓度
已知某温度下0.01mol.L乙酸容液的电离度为4.2%,求此时乙酸的电离常数和容液中[H+]浓度 uumm1年前1
uumm1年前1 -
 啃啃跟着 共回答了18个问题
啃啃跟着 共回答了18个问题 |采纳率88.9%C(H)=0.01x4.2%=0.00042mol/L,K=C(ch3coo-)xC(H+)/C(cH3cooh)=(0.01x4.2%)^2/0.01x(1-4.2%)=0.0000181年前查看全部
- 高一化学离子反应题5道1,碳酸钾溶液与硝酸反应2,硝酸钡与硫酸钾容液反应 3,锌与硝酸铜溶液反应4,稀盐酸与铁锈5,大理
高一化学离子反应题5道
1,碳酸钾溶液与硝酸反应
2,硝酸钡与硫酸钾容液反应
3,锌与硝酸铜溶液反应
4,稀盐酸与铁锈
5,大理石与稀盐酸
悬赏额不够了
分别要有 写 拆 删 3个方程 xixiboliya1年前3
xixiboliya1年前3 -
 慢慢么么 共回答了18个问题
慢慢么么 共回答了18个问题 |采纳率100%1.K2CO3+2HNO3=2KNO3+CO2↑+H2O
2K+ +CO32+ +2H+ +2NO3-=2K+ +2NO3- +CO2↑+H2O
CO32- +2H+=CO2↑+H2O
2.Ba(NO3)2+K2SO4=BaSO4↓+2KNO3
Ba2+ +2NO3- +2K+ +SO42-=BaSO4+ 2K+ +2NO3-
Ba2+ +SO42-=BaSO4↓
3.Zn+CuSO4=ZnSO4+Cu
Zn+Cu2+ +SO42-=Zn2+ +SO42- + Cu
Zn+ Cu2+=Zn2+ +Cu
4.6HCl+Fe2O3=2FeCl3+3H2O
6H+ +6Cl- +Fe2O3=2Fe3+ +6Cl- +3H2O
6H+ +Fe2O3=2Fe3+ +3H2O
5.CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+ 2H+ +2Cl-=Ca2+ +2Cl- +CO2↑+H2O
CaCO3+2H+=Ca2+ +CO2↑+H2O1年前查看全部
- 简述0.5molL标准H2SO4容液1L的步骤,并计算需要称取多少g的H2SO4:(计算公式)
 fszylwf1年前1
fszylwf1年前1 -
 呐呐大人 共回答了18个问题
呐呐大人 共回答了18个问题 |采纳率77.8%根据n=cv=0.5mol/Lx1L=0.5mol,m=nM=0.5molx98g/mol=49g1年前查看全部
- 取出某市销售某种:纯碱 样品,经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙容液使其完全反应,
取出某市销售某种:纯碱 样品,经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙容液使其完全反应,
Na2CO3 +CaCl2 =====2NaCl +CaCO3↓ 将反应生成德沉淀物经过滤、洗涤、干燥后得到白色固体10克 .
纯碱 .含杂质≤5%
(1)计算10.9克样品中纯碱的质量
(2)结算样品中含纯碱的质量分数.
快晚上9.00之前 . 湘江梦1年前1
湘江梦1年前1 -
 tinlanlanhailanl 共回答了15个问题
tinlanlanhailanl 共回答了15个问题 |采纳率86.7%要标准格式吗?
设纯碱的质量是X
Na2CO3 +CaCl2 =====2NaCl +CaCO3↓
106 100
X 10g
X=10.6g
m(Na2CO3)=10.6g
Na2CO3%=m(Na2CO3)/m样品 ×100%=10.6/10.9×100%=(这里是约等)97.2%
差不多是这样做的~不知道计算对不对……1年前查看全部
- 在20mL 0.l0mol•L -1 HCl溶液中逐滴加入0.20mol•L -1 氨水,容液pH
在20mL 0.l0mol•L -1 HCl溶液中逐滴加入0.20mol•L -1 氨水,容液pH和加入的氨水的体积关系曲线如右图所示,有关微粒浓度大小关系正确的是( ) A.A、B间的溶液中可能有:c(Cl - )>c(NH 4 + )>c(H + )>c(OH - ) B.B点:c(Cl - )=c(NH 4 + )>c(OH - )=c(H + ),且a=10.0 C.C点:c(NH 4 + )>c(Cl - )>c(H + )>c(OH - ) D.D点:c(Cl - )>c(NH 4 + )>c(OH - )>c(H + ) 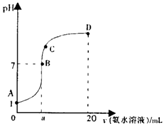
 法891年前1
法891年前1 -
 飘如沉 共回答了25个问题
飘如沉 共回答了25个问题 |采纳率92%A.在HCl和NH 4 Cl的混合溶液中可能存在c(Cl - )>c(NH 4 + )>c(H + )>c(OH - ),故A正确;
B.B点对应的溶质为NH 4 Cl和NH 3 •H 2 O,溶液呈中性,氨水应稍过量,故B错误;
C.C点溶液呈碱性,c(OH - )>c(H + ),溶液中离子关系应为c(NH 4 + )>c(Cl - )>c(OH - )>c(H + ),故C错误;
D.电荷不守恒,应为c(NH 4 + )>c(OH - )>c(Cl - )c(H + ),故D错误.
故选A.1年前查看全部
- 室温下,在0.01mol/L的NaOH某容液中,由水电离的c(OH)为多少mol/L?
室温下,在0.01mol/L的NaOH某容液中,由水电离的c(OH)为多少mol/L?
请告诉我解题思路!
 cyh07691年前1
cyh07691年前1 -
 zlandy 共回答了23个问题
zlandy 共回答了23个问题 |采纳率87%0.01mol/l的NaOH溶液中OH离子的浓度为10的负二次方mol/l,那么H离子浓度应该为10的负12次方mol/l,由于溶液中的H离子都是水电离出来的,那么由水电离出的H离子浓度应该为10的负12次方mol/l,又根据水电离出的H离子和OH离子浓度相等,得出由水电离出的OH离子的浓度是10的负12次方mol/l1年前查看全部
- 如何去看溶解度图像.如何判断是否达到饱和容液?
 薄荷糖的夏天1年前1
薄荷糖的夏天1年前1 -
 老金老师 共回答了22个问题
老金老师 共回答了22个问题 |采纳率86.4%溶解度曲线中,曲线上的点所代表的是溶液在该温度时,恰好达到饱和状态,
而曲线上面的区域,表示溶液是饱和状态,并且溶液中还有没有溶解完的溶质存在.
曲线下面的区域,表示溶液是不饱和状态.
如果还不明白,请Hi我.1年前查看全部
- 请写一片关于学英语的作文急常温下将150毫升百分之28的硝酸钠容液加100克水,溶液中溶质的质量分数为百分之14,求原溶
请写一片关于学英语的作文急
常温下将150毫升百分之28的硝酸钠容液加100克水,溶液中溶质的质量分数为百分之14,求原溶液的物质的量浓度.急急常温下将150毫升百分之28的硝酸钠容液加100克水,溶液中溶质的质量分数为百分之14,求原溶液的物质的量浓度. 朱艳1年前2
朱艳1年前2 -
 mad_mass 共回答了17个问题
mad_mass 共回答了17个问题 |采纳率94.1%dshkhdkslfhdkjsgrouapaiopdgfeswzxdhwshdaapplehfstjdshkjdhfkjsdhjklzxjkskkajkdbananakjdssdiutgiudshfkjsghreuiytieuriosdoslfjdlkgfjkhjdglksk;ldskf;lskfl;sdgkreiuyeiufsdyfhdvfdghoitgpofohgprdytdfgdfhtth1年前查看全部
- 把1.0mol/L Cuso4容液和0.5mol/L H2So4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的
把1.0mol/L Cuso4容液和0.5mol/L H2So4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之
 cmh78801年前1
cmh78801年前1 -
 nancyliu9943 共回答了18个问题
nancyliu9943 共回答了18个问题 |采纳率94.4%问题呢?
反正最后铜离子小于0.5MOL(因为CU2+水解)
硫酸根离子=0.75MOL
氢离子大于0.25MOL(理由同上)1年前查看全部
- 一种容器容量为10O毫升.(1)8个这样的容器的总容量是多少亳升?(2)如果用这种容器来装3升容液,需要多少个?
 wumianyezi1年前4
wumianyezi1年前4 -
 羽毛SU27smk 共回答了16个问题
羽毛SU27smk 共回答了16个问题 |采纳率81.3%1年前查看全部
- 将下列容液与1L0.1mol/LNaCl溶液混合,所得溶液中Cl离子的浓度
将下列容液与1L0.1mol/LNaCl溶液混合,所得溶液中Cl离子的浓度
A 50mL1mol/LNaCl溶液
B 20mL2mol/LAlCl3溶液
C 30mL1mol/LMgCl2溶液
D 100mL3mol/LNaClO3溶
这种题有什么解题技巧吗 代为1年前1
代为1年前1 -
 102131314 共回答了16个问题
102131314 共回答了16个问题 |采纳率87.5%假设二种溶液混合后体积 = 混合前体积之和:
这类题目解题要注意的是
1、分子中各离子之间的关系,比如2mol/l AlCl3中,Cl-浓度为 2*3 mol/L.
2、混合后溶液中Cl- 浓度 = (原溶液中Cl-的物质的量 + 加入的Cl-物质的量)/ 总体积
已知原溶液中的Cl- = 1L*0.1 mol/L = 0.1 mol
A、c(Cl-) = (0.1 + 0.05*1) mol / (1 + 0.05) L
B、c(Cl-) = (0.1 + 0.02*2*3) mol / (1 + 0.02) L
C、c(Cl-) = (0.1 + 0.03*1*2) mol / (1 + 0.03) L
D、c(Cl-) = 0.1 mol / (1 + 0.01) L.NaClO3加入后,没有加入Cl-,只是溶液稀释,总体积发生改变.
以上分别算出结果即得.1年前查看全部
- 将浓度为20%的盐水溶液500克和浓度为10%的盐水溶液300克混合后,倒出100克,再加入300克水,新的盐水容液的浓
将浓度为20%的盐水溶液500克和浓度为10%的盐水溶液300克混合后,倒出100克,再加入300克水,新的盐水容液的浓度是多少?
 643521291年前1
643521291年前1 -
 鲨汁ss 共回答了14个问题
鲨汁ss 共回答了14个问题 |采纳率78.6%500克20%的盐水中含盐:500×20%=100克
300克10%的盐水中含盐:300×10%=30克
两种盐水混合后,
总共含盐:100+30=130克
总质量为;500+300=800克
所以混合后的盐水浓度为:130÷800=16.25%
倒出100克混合液后,剩余盐水总质量:800-100=700克
剩余盐水中含盐:700×16.25%=113.75克
加入300克水后,新盐水总质量:700+300=1000克
所以新盐水浓度为:113.75÷1000=11.375%1年前查看全部
- 高一化学离子反应题5道1,碳酸钾溶液与硝酸反应2,硝酸钡与硫酸钾容液反应 3,锌与硝酸铜溶液反应4,稀盐酸与铁锈5,大理
高一化学离子反应题5道
1,碳酸钾溶液与硝酸反应
2,硝酸钡与硫酸钾容液反应
3,锌与硝酸铜溶液反应
4,稀盐酸与铁锈
5,大理石与稀盐酸
悬赏额不够了 磊落青衫险峰行1年前2
磊落青衫险峰行1年前2 -
 banbaner 共回答了18个问题
banbaner 共回答了18个问题 |采纳率77.8%每道题要有3个方程.是什么意思?1年前查看全部
- 有一瓶酒精容液,酒精含量是40%,经过一段时间后,酒精含量降为30%,现在这瓶酒精的质量是原来的百分之几?
 胖胖的西红柿1年前1
胖胖的西红柿1年前1 -
 断线ggyy 共回答了20个问题
断线ggyy 共回答了20个问题 |采纳率95%酒精挥发,水的质量不变
a*(1-40%)=b*(1-30%)
b/a=6/7=85.7%1年前查看全部
- 高猛酸钾的问题高猛酸钾是氧化剂,具有抗氧化的容剂和高猛酸钾反应是否能中和容液,使容液由紫色变为白色?就是安利里的一些产品
高猛酸钾的问题
高猛酸钾是氧化剂,具有抗氧化的容剂和高猛酸钾反应是否能中和容液,使容液由紫色变为白色?就是安利里的一些产品实验. wsyxb1年前1
wsyxb1年前1 -
 游荡边缘 共回答了20个问题
游荡边缘 共回答了20个问题 |采纳率90%高锰酸钾是强氧化剂,所谓“中和”就是加入还原性的物质.例如,维生素c就可以让高锰酸钾褪色.1年前查看全部
- 现在已知1,2两试管装着不同的两种溶液,分别为可容性淀粉溶液和蔗糖容液,为了证明淀粉酶对谁有水解作用
现在已知1,2两试管装着不同的两种溶液,分别为可容性淀粉溶液和蔗糖容液,为了证明淀粉酶对谁有水解作用
A;先都加淀粉酶,搅拌后,加斐林试剂,再隔水加热,已证上述方法正确
问将斐林试剂换成碘液是否能行,为啥 白色宝马车1年前1
白色宝马车1年前1 -
 友ff 共回答了12个问题
友ff 共回答了12个问题 |采纳率91.7%不行,碘与淀粉的反应非常灵敏的,而我们无法判断淀粉是否已分解完,只要有淀粉没有分解完,实验前后实验现象变化不明显,难以判断是否有淀粉分解.1年前查看全部
- 氯化铁容液加热蒸发后最终得不到氯化铁固体吗 为什么
 lw2005chin1年前1
lw2005chin1年前1 -
 小俊俊俊 共回答了13个问题
小俊俊俊 共回答了13个问题 |采纳率84.6%因为:铁离子要水FeCl3+3H2O=Fe(OH)3↓+3HCl,然后再分2Fe(OH)3=Fe2O3+3H2O
加热都是促进这两个方程式向右进行,所以最后得到Fe2O3而不是氯化铁1年前查看全部
- 《容液中氯离子含量测定.》吸取5mL试液加入50mL水.7滴铬酸钾指示剂.用.标准硝酸银容液滴定至淡红色为终点.,.为什
《容液中氯离子含量测定.》吸取5mL试液加入50mL水.7滴铬酸钾指示剂.用.标准硝酸银容液滴定至淡红色为终点.,.为什么不同PH值试液测定结果不同.PH=6.5和PH=8测的结果差别很大.另一个现象滴到终点的淡红色容液,滴上一滴稀硫酸或稀氨水马上淡红色退去.再用硝酸银滴定还要消耗几毫升.容液又变成淡红色.容液没有加入氯离子为什么会有这种现象?
我提的《容液中氯离子含量测定。》是指(水容液中氯离子含量测定,) 其实到处都是rr1年前2
其实到处都是rr1年前2 -
 windflower2007 共回答了11个问题
windflower2007 共回答了11个问题 |采纳率100%水溶液中氯离子含量测定的滴定条件:
(1)酸度 是在中性或弱碱性介质中进行的,在酸性溶液中,CrO42-会有以下反应,使CrO42-浓度降低,影响Ag2CrO4沉淀的形成,降低指示剂的灵敏度.
H+ + CrO4 = HCrO4-
2HCrO4- = CrO72- + H2O
如果溶液的碱性太强,会析出Ag2O沉淀.
Ag+ + OH- = AgOH↓
2AgOH↓=AgO↓+ H2O
也不能在氨性溶液中进行滴定,因为容易生成Ag(NH3)2+,会使AgCl沉淀溶解.
AgCl+2NH3+= Ag(NH3)2++Cl-
(2)干扰离子 能与Ag+生成沉淀的阴离子和能与CrO42-生成沉淀的阳离子都不应存在(如PO43-、SO32-、S2-、CO32-、Ba2+、Pb2+等).另外有色离子如Cu2+Co2+Ni2+等也不应存在,否则会给滴定终点的观察带来较大的误差.若上述离子存在,可采用分离或掩蔽的方法将它们除去,然后才进行滴定.
(3)温度与振荡 在室温下进行滴定,可避免因Ag2CrO4沉淀溶解度增加而降低指示剂的灵敏度.充分振荡可以减少AgCl沉淀对Cl-的吸附作用,提高分析结果的准确度.
(4) 指示剂浓度为5.3×10-3mol/L为宜.如果试液浓度较低时,还需做指示剂空白值校正,以减少误差.1年前查看全部
- 有两个瓶子装的容液,第一个瓶子的质量是第二个瓶子的6倍,把第一个瓶子的容液倒120kg到第二个瓶子里面,两个瓶子的质量相
有两个瓶子装的容液,第一个瓶子的质量是第二个瓶子的6倍,把第一个瓶子的容液倒120kg到第二个瓶子里面,两个瓶子的质量相同,求两个瓶子原有的容液是多少kg?
 萧逸枫20051年前1
萧逸枫20051年前1 -
 deboowee 共回答了24个问题
deboowee 共回答了24个问题 |采纳率91.7%求个屁啊,什么关系嘛,题目都读不通,一哈六倍关系一哈又相等了!1年前查看全部
- 钠与硫酸铜容液反应的化学方程式?
 踏雪寻梅20031年前1
踏雪寻梅20031年前1 -
 lumaokai 共回答了16个问题
lumaokai 共回答了16个问题 |采纳率87.5%钠与硫酸铜溶液反应分两步:先与水反应生成氢氧化钠和氢气,再与硫酸铜反应生成氢氧化铜和硫酸钠!2Na+2H2O==2NaOH+H2↑ 2NaOH+CuSO4==Cu(OH)2↓+Na2SO41年前查看全部
- 将一种浓度为15%的容液30kg,配置成浓度不低于20%的同种溶液,则至少需要浓度为35%的该溶液多少千克?
 IDFORHELL1年前1
IDFORHELL1年前1 -
 wwwwdd 共回答了14个问题
wwwwdd 共回答了14个问题 |采纳率85.7%设至少需要浓度为35%的该种溶液xkg,则由题意得
(30*15%+x*35%)/(30+x)>=20%
去分母得4.5+0.35x>=6+0.2x
得0.15x>=1.5
得x>=10
所以至少需要浓度为35%的该种溶液10kg1年前查看全部
- kcl.zncl2.znso4三种盐配的混合容液中,钾离子为0.1摩尔,锌离子0.25摩尔,氯离子为0.2摩尔,硫酸根为
kcl.zncl2.znso4三种盐配的混合容液中,钾离子为0.1摩尔,锌离子0.25摩尔,氯离子为0.2摩尔,硫酸根为多少
2mol
我认为是这么求的:0.1+0.25-0.2=0.15mol
n(K+)=0.1mol n(Zn2+)=0.25mol n(Cl-)=0.2mol
n(正电)=0.1+0.25*2=0.6mol
n(负电)=0.6mol=n(Cl-)+2n(SO42-)
所以n(SO42-)=0.2mol 821305551年前2
821305551年前2 -
 mylove20030220 共回答了17个问题
mylove20030220 共回答了17个问题 |采纳率94.1%溶液电荷量总合为0
K+为0.1mol,1molK+带1mol正电,所以0.1molK+带0.1mol正电
Zn2+为0.25mol,而1molZn2+带2mol正电,所以0.25molZn2+带0.5mol正电
所以n(正电)=0.1+0.25*2=0.6mol
Cl-为0.2mol,1molCl-带1mol负电,所以0.1molCl-带0.1mol负电
又1molSO42-带2mol负电,
所以n(负电)=0.6mol=n(Cl-)+2n(SO42-)
所以n(SO42-)=0.2mol1年前查看全部
大家在问
- 1用24个1平方厘米的小正方形拼成长方形,有( )种不同的拼法,拼成的长方形的周长由小到大依次是( )厘米、( )厘米、(
- 22º+……+2二零一三次方,等于多少?
- 3改写句子1).He will never eat so many sweets any more.(保持句意不变)He
- 4Room 3,North Region的意思是?
- 5x=5t-2t(的平方)5s末的速度等于
- 61.一个金属球用弹簧秤测得在空气中的重力为54牛,把它浸没在水中,弹簧秤的示数变为34N,求:(1)金属球受到的浮力是多
- 7如图 在平面直角坐标系中 rt三角形oab的顶点a在x轴的正半轴上,顶点A的坐标为(3,0).角AOB=30°,点c的坐
- 8The weather is ( ) here.(change)
- 91.4分米等于多少米,还有6.4米等于多少分米
- 10用古诗文原句填空。①_________________,燕然未勒归无计。(《渔家傲·秋思》)②足蒸暑土气,_______
- 11杯中装的是水,玻璃管中装的是某种液体,玻璃管下段蒙的橡皮膜平时,管中液面较低,则管中液体可能是
- 12With business booming,keeping up had become a struggle – she
- 13出自论语十二张的的8个成语是那些?
- 14红光农场去年植树的数量比前年成活的树木多百分之50,去年的成活率是百分之80,去年成活的树木数量是前年成活树木的?%
- 15call和called的区别

