无机及分析化学、缓冲溶液的配置欲制备pH = 9.95的缓冲溶液,其中NaHCO3和Na2CO3的物质的量比应为:…(
 timshawnq2022-10-04 11:39:541条回答
timshawnq2022-10-04 11:39:541条回答
无机及分析化学、缓冲溶液的配置
欲制备pH = 9.95的缓冲溶液,其中NaHCO3和Na2CO3的物质的量比应为:…( ) Ka(H2CO3) = 4.4* 10^-7,Ka (HCO3-) = 5.61* 10^-11
(A) 2 : 1 (B) 1 : 1 (C) 1 : 2 (D) 1 : 3.9*10^3
欲制备pH = 9.95的缓冲溶液,其中NaHCO3和Na2CO3的物质的量比应为:…( ) Ka(H2CO3) = 4.4* 10^-7,Ka (HCO3-) = 5.61* 10^-11
(A) 2 : 1 (B) 1 : 1 (C) 1 : 2 (D) 1 : 3.9*10^3

已提交,审核后显示!提交回复
共1条回复
 gfhgjhgj3 共回答了16个问题
gfhgjhgj3 共回答了16个问题 |采纳率93.8%- 缓冲溶液PH=PKa+lgc(共轭碱)/c(共轭酸)
此题中共轭碱是CO32- ,共轭酸是HCO3- 涉及这两个离子的pka,所以pKa用Ka (HCO3-) = 5.61* 10^-11
代入计算9.95=10.25+lgx
碱和酸物质的量比就是浓度比=1:2,答案就是酸比碱为A 2:1 - 1年前
相关推荐
- 无机及分析化学,四、计算题(每题10分,共计30分)1、某反应的活化能为7660 J·mol-1,试计算该反应从100
无机及分析化学,
四、计算题(每题10分,共计30分)
1、某反应的活化能为7660 J·mol-1,试计算该反应从100 K升温到200 K时反应增大的倍数.
2、在1000 mL0.050 mol·L-1HAc和NaAc混合溶液中加入0.010 molHCl(设溶液体积保持不变),求此溶液的PH(已知HAc的pKa=4.75).
3、Mg(OH)2的溶度积为:Ksp= 4.5×10-14,饱和Mg(OH)2的水溶液的pH值是多少?
4、Cl-、Br-、I-都能与Ag+生成难溶性盐,当三种混合离子浓度均为0.01 mol·L-1时,加入Ag+,它们沉淀顺序如何?已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(AgI)=1.5×10-16
5、利用半反应2H+ + 2e- = H2 的标准电极电势和醋酸的电离常数计算半反应
2HAc + 2e- = H2 + 2Ac- 的标准电极势.(已知HAc的Ka=1.75×10-5) 红红蝈蝈1年前1
红红蝈蝈1年前1 -
 7047771 共回答了10个问题
7047771 共回答了10个问题 |采纳率80%1、k=Ae^(-Ea/RT)
Lnk =LnA -Ea/RT
Lnk2- Lnk 1= -Ea/R(1/T2 - 1/T1)=-7660/8.314 *(1/200 -1/100)=4.606
k2/k1=100
即100倍
2、加盐酸前:n(HAc)=0.050mol n(Ac-)=0.050mol
加盐酸后:n(HAc)=0.060mol n(Ac-)=0.040mol
显然还是缓冲溶液
pH=pKa +lg n(Ac-)/n(HAc)=4.75+lg 0.04/0.06=4.57
3、Mg(OH)2 Mg2+ + 2OH-
s 2s +10^-7
由于Ksp较大
因此:s *( 2s +10^-7)^2=4.5×10-14
近似为:s *( 2s)^2=4.5×10-14
S=2.24×10^-5
2S=4.48×10^-5
POH=4.34
pH=9.66
4、由于KspAgCl >KspAgBr >KspAgI
因此沉淀顺序:AgI >AgBr>AgCl
5、要求2HAc + 2e- = H2 + 2Ac- 的标准电极势意味着:
c(HAc)=1mol/L c(Ac-)=1mol/L p0(H2)=100Kpa
KaHAc=c(H+)*c(Ac-)/c(HAc)=c(H+)
c(H+)=1.75×10-5mol/L
根据能斯特方程式可得:
2HAc + 2e- = H2 + 2Ac- 的标准电极势=φ0H+/H2 + 0.0591 ×lg{ [c(H+)/C0]/ (pH2/P0)^1/2}
=0V +0.0591V×lg{1.75×10-5}
=-0.28V1年前查看全部
- 无机及分析化学(第三版) 科学出版社 课后习题精解 和配套练习
无机及分析化学(第三版) 科学出版社 课后习题精解 和配套练习
我是大一的医学检验的学生,在上 无机及分析化学 这本书,可是老师讲得太快了,完全不能接受,想课后多做点题巩固一下,可是课后习题没答案,而且也没有配套练习可以巩固知识点,跟高中太不一样了.有没有哪些配套练习比较好的.或者什么答案精解的.一定要配套哦.是无机及分析化学(第三版) 科学出版社的. 韩rr毒草1年前1
韩rr毒草1年前1 -
 mars0920 共回答了17个问题
mars0920 共回答了17个问题 |采纳率88.2%请你留下邮箱或联系方式!
┏┓ ┏┓┏┓
┃┃┏━┳┳┳━┓ ┃┗┛┣━┳┳┓
┃┗┫┃┃┃┃┻┫ ┗┓┏┫┃┃┃┃
┗━┻━┻━┻━┛ ┗┛┗━┻━┛
没有问题请及时采纳哦!
百度一下——快乐你我!
谢谢----(*^__^*) 嘻嘻……1年前查看全部
- 一道无机及分析化学题CHCl3 在40℃时蒸气压为49.3kPa.于此温度和101.3kPa压力下,有4.00L空气缓慢
一道无机及分析化学题
CHCl3 在40℃时蒸气压为49.3kPa.于此温度和101.3kPa压力下,有4.00L空气缓慢地通过CHCl3(即每个气泡都为CHCl3蒸气所饱和).求
(1)空气和CHCl3混合气体的体积是多少?
(2)被空气带走的CHCl3质量是多少? effesy1年前1
effesy1年前1 -
 zitengmaogua 共回答了15个问题
zitengmaogua 共回答了15个问题 |采纳率100%(1)得到的气体中P(空气+CHCl3)=101.3kPa 而CHCl3 在40℃时蒸气压为49.3kPa,且CHCl3蒸气饱和,所以气体中P(CHCl3)=49.3kPa V(空气)=4L V(CHCl3)=3.79L
(2)根据 PV=nRT (R=8.314*10^3,T是绝对温度) 可以计算出n=0.1475mol
m=17.63g1年前查看全部
- 无机及分析化学 酸碱滴定法的问题
无机及分析化学 酸碱滴定法的问题
已知某试样中可能含有Na3PO4,NaH2PO4,Na2HPO4和惰性物质.称取该试样1.0000g,用水溶解.试样溶液以甲基橙为指示剂,用0.2500mol/L HCl溶液滴定,用去32.00mL.含同样质量的试样溶液以百里酚酞作指示剂,需上述HCL溶液12.00mL.求试样组成和含量. dyc000dyc1年前1
dyc000dyc1年前1 -
 onthesnow 共回答了11个问题
onthesnow 共回答了11个问题 |采纳率90.9%以百里酚酞作指示剂,终点跃迁pH~10.说明样品含Na3PO4.
PO43- + H+ ----> HPO42-
这时需0.2500mol/L HCL溶液12.00mL ==> Na3PO4摩尔 =0.2500 x 0.01200 =0.003000 摩尔
Na3PO4重量=0.003000 x 163.94= 0.4918 克.
Na3PO4%=49.18%
又,甲基橙为指示剂,终点跃迁pH~5.因为32.00 mL > 2x12.00mL,说明样品中含有Na2HPO4
HPO42- + H+ ----> H2PO4-
这时消耗0.2500mol/L HCL溶液32.00mL ==>Na2HPO4摩尔=0.2500 x {0.03200 -(2 x 0.01200)}= 0.002000 摩尔
Na2HPO4重量=0.002000 x 141.96= 0.2839 克.
Na2HPO4重量%=28.39%
100%-28.39%-49.18%= 22.43%
所以,样品中还含有22.43%的NaH2PO4,和/或惰性物质.1年前查看全部
- 大学无机及分析化学缓冲溶液的配制问题求解
 洋蔥頭1年前2
洋蔥頭1年前2 -
 我锐3 共回答了16个问题
我锐3 共回答了16个问题 |采纳率93.8%Ka(HAc)=[H+]*[Ac-]/[HAc]
=约=[H+]*c(Ac-)/c(HAc)
=[H+] *n(Ac-)/n(HAc)
1.75*10^-5=1.0*10^-5*(0.125L*1.0mol/L)/n(HAc)
n(HAc)=0.0714mol
6.0 mol·L―1 的 HAc 溶液的体积=0.0714mol/ 6.0mol/L=0.012L
即12mL
需要水的体积=250-125-12=113mL1年前查看全部
- 无机及分析化学,大一酸碱滴定法取0.1mol/L NaCO3溶液20mL两份,用0.2mol/L HCl溶液滴定,分别用
无机及分析化学,大一酸碱滴定法
取0.1mol/L NaCO3溶液20mL两份,用0.2mol/L HCl溶液滴定,分别用甲基橙和酚酞为指示剂,指示剂变色时所用盐酸的体积各为多少? 盛sunny夏1年前1
盛sunny夏1年前1 -
 香积有能 共回答了15个问题
香积有能 共回答了15个问题 |采纳率100%用甲基橙指示剂:
Na2CO3 + 2HCI = 2NaCI + CO2 + H2O
1 2
0.1*20/1000 0.2*V/1000
V=20ml
用酚酞指示剂:
Na2CO3 + HCI = NaCI + NaHCO3
1 1
0.1*20/1000 0.2*V/1000
V=10ml1年前查看全部
- 大一无机及分析化学题不懂为什么算W时,分母要加1000,而且0.292与180单位不是不同吗
大一无机及分析化学题

不懂为什么算W时,分母要加1000,而且0.292与180单位不是不同吗 ying_kui1年前1
ying_kui1年前1 -
 li_alpha 共回答了19个问题
li_alpha 共回答了19个问题 |采纳率94.7%1、质量摩尔浓度b
由计算可求得:
b(C6H12O6) = 0.292 (mol /kg)
此时b表示质量摩尔浓度.
质量摩尔浓度的定义是:每1000克溶剂中所含溶质的物质的量,这里是指每1000克水中所含葡萄糖0.292 mol
2、质量分数w
质量分数是:w = 溶质质量/ 溶液质量
= 溶质质量/ (溶质质量 + 溶剂质量)
在1000克水中,有葡萄糖 0.292 摩尔,葡萄糖摩尔质量为:180 g / mol
所以:
葡萄糖质量:0.292 mol * 180 g / mol
水的质量:1000 g
溶液质量:0.292 *180 + 1000
w = 葡萄糖质量/ 溶液质量
将数据代入即可求出w.1年前查看全部
- 无机及分析化学中什么时候要保留有效数字
无机及分析化学中什么时候要保留有效数字
我在学无机分析化学这本书,写题的时候不知道哪些题目要保留有效数字,就是什么情况要用有效数字运算规则,题现在写题目我都是随意保留的.总会错 lu27539751年前1
lu27539751年前1 -
 仙与魔 共回答了6个问题
仙与魔 共回答了6个问题 |采纳率83.3%规则其实不复杂:
加减计算按小数位数保留,并以小数位数最少的数值为准保留相应的小数位数.
乘除计算按有效数字的位数保留,并以有效数字位数最少的数值为准保留相应的有效数字位数.1年前查看全部
- 无机及分析化学,急某一元弱酸HA试样1.250g,加水50毫升使其溶解,然后用0.09mol/LNaOH标准溶液滴定至化
无机及分析化学,急
某一元弱酸HA试样1.250g,加水50毫升使其溶解,然后用0.09mol/LNaOH标准溶液滴定至化学计量点,用去氢氧化钠41.2ml,滴定过程中发现,当加入8.42ml氢氧化钠时,PH为4.30.求1,HA的分子量,2,HA的Ka,3,计算化学计量点的PH, zz捧1年前1
zz捧1年前1 -
 水鬼儿 共回答了16个问题
水鬼儿 共回答了16个问题 |采纳率93.8%先根据化学计量点算出相对分子质量(摩尔质量)
M=1.250/(0.09×41.2)×1000=337.1g/mol
(2)加入的氢氧化钠的总量是0.09×41.2=3.708mmol,加入8.42ml氢氧化钠就是0.3368mmol
即溶液中有0.3368mmol是NaA,其余的全部是HA.因为Ka=[H+][A-]/[HA]=0.2568[H+]=1.3×10^-5
(3)化学计量点就是3.708mmolNaA,因为是强碱弱酸盐,所以显碱性,所以[OH-]=√(cKa)=2.20×10^-4mol/L,所以[H+]=4.55×10^-9mol/L,pH=8.34
希望对你有所帮助!1年前查看全部
- 请问这道题怎么理解呢(大学无机及分析化学之氧化还原平衡和氧化还原滴定法)
 梨破1年前1
梨破1年前1 -
 adc1180被uu 共回答了17个问题
adc1180被uu 共回答了17个问题 |采纳率88.2%1 碘化亚铜不溶有个 沉淀溶解平衡 CuI = Cu+ + I-
所以第一个电势要考虑沉淀变离子这个过程
2 那个总反应就是 2Cu2+ +2e- = 2Cu+
2I- - 2e- = I2
2Cu+ + 2I- = 2CuI(s) 三个方程式的组成 ...1年前查看全部
- 大学无机及分析化学题将0.605g苯溶入40.0g CCl4中,测得溶液的沸点较纯溶剂升高0.50℃.若在同量的溶剂CC
大学无机及分析化学题
将0.605g苯溶入40.0g CCl4中,测得溶液的沸点较纯溶剂升高0.50℃.若在同量的溶剂CCl4中溶入0.450g的未知物,测得溶液沸点升高约0.42℃.求该未知物的摩尔质量 alsen19821年前1
alsen19821年前1 -
 其实俺不孬 共回答了19个问题
其实俺不孬 共回答了19个问题 |采纳率73.7%1、先求出沸点升高常数kb,已知质量摩尔浓度:m = [0.605 / M(C6H6)] *1000 /40 = (0.605*1000 / 78 ) / 40 = 0.1939 (mol / kg-1溶剂)
△t = kb *m
0.50 = kb * 0.1939
kb = 2.5786
2、求未知物的摩尔质量M
0.42 = 2.5786 * (0.450*1000 / M ) / 40
M = 691年前查看全部
- 南京大学无机及分析化学第四版课后习题第二章第24题详解
南京大学无机及分析化学第四版课后习题第二章第24题详解
求求各位大哥大姐, jds19841年前1
jds19841年前1 -
 xxw0609 共回答了20个问题
xxw0609 共回答了20个问题 |采纳率95%建议你去 课后答案网 找找,哪里有很多大学课程资源的参考答案的电子版书籍!1年前查看全部
- 一道无机及分析化学的课后题(求详解 谢啦)
一道无机及分析化学的课后题(求详解 谢啦)
某一含有Na2CO3,NaHCO3及杂质的试样0.602g加水溶解,用0.212mol/L的HCL溶液滴定至酚酞终点,用去20.5ml,继续滴定至甲基橙终点又用去24.08ml HCL,求NaCO3和NaHCO3的质量分数
谁先和盐酸反应啊?碳酸钠先反应吗? nancychen19843211年前1
nancychen19843211年前1 -
 fj2387g 共回答了19个问题
fj2387g 共回答了19个问题 |采纳率94.7%酚酞终点就是所有的Na2Co3都反应生成了NaHCo3,甲基橙的终点就是所有的碳酸氢钠都反应了(注意有碳酸钠生成的),然后列方程式计算就可以,具体如下滴定到酚酞终点:
Na2CO3+HCl==NaHCO3+NaCl
n(Na2CO3)=n(HCl)=0.212*0.0205=4.346*10^-3(mol),m(Na2CO3)=4.346*10^-3*106=0.4607(g)
滴定到甲基橙终点:
NaHCO3+HCl==NaCl+H2O+CO2
所以,碳酸氢钠物质的量等于第二步消耗盐酸物质的量减去碳酸钠物质的量
n(NaHCO3)=0.212*(0.02408-0.0205)=7.5896*10^-4(mol)
m(NaHCO3)=7.5896*10^-4*84=0.06375(g)
碳酸钠质量分数=100%*0.4607/0.602=76.52%
碳酸氢钠质量分数=100%*0.06375/0.602=10.59%1年前查看全部
- 分析化学中的计算题每一步计算要不要都修约?还是只要最后修约?(无机及分析化学第四版的一道应用类计算题答案没有先修约再计算
分析化学中的计算题每一步计算要不要都修约?还是只要最后修约?(无机及分析化学第四版的一道应用类计算题答案没有先修约再计算,可老师原来都说先修约再计算) 纠结.
 大刀鬼将1年前1
大刀鬼将1年前1 -
 心灵栖息之地 共回答了16个问题
心灵栖息之地 共回答了16个问题 |采纳率81.3%记得十几年前,我在烟台商检局参加了一个培训班,谈到进出口商品检验问题.在一次出口贸易中,外商要求索赔,原因是商品检验不合格,而我们的出口检验是合格的,面临的将是国际官司.于是双方排检验人员到国际检验中心共同检验一个标准样品,检验结果准确的一方将获胜.巧的是双方的检验结果相同,于是双方都在挑对方的毛病,我方检验员在查对方的计算过程记录时,发现对方计算过程中不按规定进行修约,结果我方获胜,因为对方连起码的化学分析知识都不懂.
可见,应该先修约再计算.1年前查看全部
- 无机及分析化学题已知在25摄氏度及101千帕压力下,含有氮气和氢气的混合气体的密度为0.50克每升,则氮气和氢气的分压及
无机及分析化学题
已知在25摄氏度及101千帕压力下,含有氮气和氢气的混合气体的密度为0.50克每升,则氮气和氢气的分压及体积分数是多少? geminiblacktea1年前1
geminiblacktea1年前1 -
 找个好女孩 共回答了20个问题
找个好女孩 共回答了20个问题 |采纳率85%T=273.15+25=298015K P=101KPa=101000Pa p(密度)=0.50g/L n=m/M PV=NRT p(密度)=m/v得出M=12.97Mol 28X(N2)+2(H2)=12.97 X(H2)+X(N2)=1 得出氢气的摩尔分数为0.395 (体积分数) 氮气的摩尔分数为0.605(体积分数)接下来的分压等于总压乘于各自的摩尔分数就得出答案了!1年前查看全部
- 问2道大一的无机及分析化学题欲配制250ml pH喂5.00的缓冲溶液,问在125ml 1.0ml/L NaAc溶液中应
问2道大一的无机及分析化学题
欲配制250ml pH喂5.00的缓冲溶液,问在125ml 1.0ml/L NaAc溶液中应加多少6.0mol/L HAc和多少水?
欲配制pH为9.50的缓冲溶液,问需取多少固体NH4Cl溶解在500ml 0.2mol/L NH3·H2O中?
 小知更鸟1年前1
小知更鸟1年前1 -
 joytwan 共回答了20个问题
joytwan 共回答了20个问题 |采纳率95%1、此溶液为 HAc ~ Ac- 缓冲溶液:
pH = pka - lg c(HAc) / c(Ac-)
5 = 4.75 - lg 6.0 V / 125*1.0
V = 11.7 mL
需加入HAc11.7 mL
加入水:250 - 125 - 11.7 = 113.3 mL
2、此溶液为NH3 ~NH4+ 缓冲溶液
pOH = pKb - lg c(NH3) / c(NH4+)
14 - 9.5 = 4.76 - lg 0.2 / c(NH4+)
c(NH4+) = 0.11 mol/L
m = 0.11 * 0.5 *M(NH4Cl)
= 0.11 * 0.5 * 53.5
= 2.94 g1年前查看全部
- 化学性质和物理性质完全相同是什麽意思,这能相同吗?这是在看无机及分析化学时遇到的问题,
 hanzeyuheyuyue1年前3
hanzeyuheyuyue1年前3 -
 徐庆 共回答了24个问题
徐庆 共回答了24个问题 |采纳率100%物质发生物理变化时,分子不变,物质不发生变化,它和原来物质的具有完全相同的化学性质.有的两种物质化学性质完全一样,只有物理的旋光性不一样,若说化学性质和物理性质完全相同,说明他们是同一物质.
关于旋光性,是人们在使用一种药物的过程中发现的.1年前查看全部
- 大一无机及分析化学 图中3.
大一无机及分析化学 图中3.

 冷飒1年前1
冷飒1年前1 -
 斐轩 共回答了19个问题
斐轩 共回答了19个问题 |采纳率89.5%1、求P总
由反应式:
----------------NH4HS(s) = NH3(g) + H2S(g)
初:0 0
平衡:x x
[p(NH3)/pθ] [p(H2S)/pθ] = Kθ
xx = 100^2 Kθ
x = 26.45 (kPa)
p总 = 2x = 53 kPa
2、求p(H2S)
---------------NH4HS(s) = NH3(g) + H2S(g)
初:25.3 0
平衡:25.3+x x
[p(NH3)/pθ] [p(H2S)/pθ] = Kθ
(25.3+x) x = 100^2 Kθ
求出x即可.1年前查看全部
- 无机及分析化学使活化能不同的两个反应同样由T1升温至T2,则活化能较大的反应速率增加的倍数(较大).为什么较大?
 hh与离婚1年前1
hh与离婚1年前1 -
 yrc0577 共回答了18个问题
yrc0577 共回答了18个问题 |采纳率83.3%因为活化能大的反应对温度的上升更加敏感.
这是化学平衡理论的基础,正是因为正逆反应的活化能不同才会出现平衡的移动.1年前查看全部
- 晶格能方面的问题说晶格能通常为VB=1时放出的能量,单位为kJ/mol.这个VB是什么?(浙江大学 无机及分析化学第二版
晶格能方面的问题
说晶格能通常为VB=1时放出的能量,单位为kJ/mol.这个VB是什么?
(浙江大学 无机及分析化学第二版 P206) 中间代安琪1年前1
中间代安琪1年前1 -
 飘逸的猫 共回答了18个问题
飘逸的猫 共回答了18个问题 |采纳率94.4%vb应该应该是指气态离子的系数
就像算反应级数的时候的,反应物前面的系数也是v1年前查看全部
- 无机及分析化学 配位滴定法的问题
无机及分析化学 配位滴定法的问题
以0.02mol/LEDTA溶液滴定同浓度的含Pb2+试剂,且含酒石酸分析浓度为0.2mol/L,溶液PH为10.0.问于化学计量点时的lgK'PbY,c(Pb2+)和酒石酸铅配合物的浓度(酒石酸铅配合物的lgK=3...
根据lgk'PbY=lgkPbY-lg;
特别问一下第一步中Pb的副反应系数的对数怎么求? 碌碌无为20061年前0
碌碌无为20061年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 英语翻译把以下科目翻译成英语,环保与安全,无机及分析化学,精细有机合成技术,精细化工生产技术,精细化学品检验技术,涂料工
英语翻译
把以下科目翻译成英语,环保与安全,无机及分析化学,精细有机合成技术,精细化工生产技术,精细化学品检验技术,涂料工艺,化工制图,化工单元操作,化工AutoCAD,化工仪表及自动化,英语,化工设备 乔念祖1年前1
乔念祖1年前1 -
 hetai-lan 共回答了21个问题
hetai-lan 共回答了21个问题 |采纳率85.7%环保与安全,无机及分析化学,物理化学,有机化学,精细有机,合成技术,精细化工生产技术,精细化学品检验技术,涂料工艺,化工制图,化工单元操作,高分子化学,化工AutoCAD,化工仪表及自动化,英语,高等数学,化工设备.
Environmental protection and security, inorganic and analytical chemistry, physics, chemistry, organic chemistry, organic synthesis technology, fine, fine chemical production technology, fine chemicals, coating process inspection technology, chemistry engineering drawing, chemical unit operation, high polymer chemistry, chemical AutoCAD, chemical instrumentation and automation, English, higher mathematics, chemical equipment.1年前查看全部
- 无机及分析化学某温度下反应N2O4(g)=(可逆号)2NO2(g)的K=0.15,在总压为100.0kpa时,下列各种条
无机及分析化学
某温度下反应N2O4(g)=(可逆号)2NO2(g)的K=0.15,在总压为100.0kpa时,下列各种条件,能使反应向生成NO2方向进行的是
A n(N2O2)=n(NO2)=1.0mol
B n(N2O4)=1.0mol,n(NO2)=2.0mol
C n(N2O4)=4.0mol,n(NO2)=0.5mol
D n(N2O4)=2.0mol,n(NO2)=1.0mol
请写明分析过程 ntsxk1年前2
ntsxk1年前2 -
 solomoncjc 共回答了18个问题
solomoncjc 共回答了18个问题 |采纳率83.3%应该选C题目要求反应正向移动,即反应的浓度商Q小于K(K=[NO2]2/[N2O4],要使NO2浓度增大,即K要减小),依照此原理,把题目数据带入即可算出选C,希望对你有帮助.1年前查看全部
- 无机及分析化学第七章物质结构基础中的lp是啥意思
 贪吃的橘子1年前1
贪吃的橘子1年前1 -
 娟子lela 共回答了15个问题
娟子lela 共回答了15个问题 |采纳率93.3%物质结构基础中的lp;:孤电子对1年前查看全部
- 需要哪些课程铺垫?听说还有无机及分析化学,无机的有必要学吗?
 julymo1年前1
julymo1年前1 -
 dxbamboo 共回答了23个问题
dxbamboo 共回答了23个问题 |采纳率87%无机,有机,分析化学都要学的,我一一说明.
无机化学学习一些分子间的相互作用力如氢键、离子键等等;分子内的双键、三键;原子理论等等,虽说这种微观的东西不太好学,但如果你想学生化比较深入的话还是蛮重要的,比如蛋白质分子之间的相互作用,微观了解就会深入到基团与基团间的作用.
有机主要是有些芳香族,杂环类,这些结构要清楚,因为结构决定性质,比如组氨酸是一个很特殊的氨基酸,它含有咪唑基,所以其pH在中性,具有缓冲作用,在蛋白质结构中含量很高,由于20中氨基酸的R基结构不同,所以他们组成的氨基酸序列就会导致蛋白质的二级结构和高级结构不同,比如脯氨酸含有环若出现在结构中,二级结构就会中断等等
至于分析化学,主要是现在生命科学实验都需要先进的仪器,分析化学就是学习一些比较基本的原理,比如高效液相色谱的原理之类的,1年前查看全部
- 江南大学远程教育2012下半年无机及分析化学第1阶段解析题,“在 500K 时,”
江南大学远程教育2012下半年无机及分析化学第1阶段解析题,“在 500K 时,”
在 500K 时,将 1.0molPCl5(g)置于 5.0L 密闭容器中达平衡:PCl5(g) PCl3(g) + Cl2(g) PCl5(g)还余 0.20mol.1)求 500K 时该反应的标准平衡常数和 PCl5 的分解率; 2)达平衡的容器中再加入 0.50mol PCl5(g) ,求重新达平衡后各组分的平衡分压 daxin7308221年前1
daxin7308221年前1 -
 北世界 共回答了18个问题
北世界 共回答了18个问题 |采纳率88.9%1)
分解率为0.8,K=(0.8*0.8/25)/(0.2/5)=0.64
2)设末态平衡时,有PCl5 xmol,则有方程K=0.64=(1.5-x)*(1.5-x)/5x
得x=.mol,再用pv=nRT换算成分压.(中间自己解一下那个方程吧,很简单的)1年前查看全部
- 大一无机及分析化学,求大神解答药典中规定测定CuSO45H2O含量的方法为:取本品0.5g,精确称量,置于碘瓶中加蒸馏水
大一无机及分析化学,求大神解答
药典中规定测定CuSO45H2O含量的方法为:取本品0.5g,精确称量,置于碘瓶中加蒸馏水50 mL,溶解后加醋酸4 mL,KI 2g,用0.1 mol/L NaS2O3标准溶液滴定,近终点时加入淀粉指示剂2 mL,继续滴定至蓝色消失.
(1)写出上述测定反应的主要方程式
(2)为何在近终点时加入淀粉指示剂?
(3)写出CuSO45H2O含量计算公式?
 快乐美人1年前1
快乐美人1年前1 -
 花飞蝶舞剑 共回答了15个问题
花飞蝶舞剑 共回答了15个问题 |采纳率93.3%(1)CUSO4+2KI=CU+K2SO4+I2,还有碘量法的公式.
(2)为了更好指示滴定终点,减少由操作带来的误差.
(3)《分析化学》中去找氧化还原中的碘量法.1年前查看全部
- 无机及分析化学(第4版)第一章第六题分析
无机及分析化学(第4版)第一章第六题分析
CHCl3在40℃时蒸汽压为49.3kPa.于此温度和101.3压力下,有4.00L空气缓缓的通过CHCl3(即每个气泡都为CHCl3蒸汽所饱和).求:(1)空气和CHCl3混合气体的体积是多少?(2)被空气带走的CHCl3质量是多少?(真是的拍照功能哪里去了,害我还要用手打) 菲菲的玉米1年前1
菲菲的玉米1年前1 -
 麻的灯牌是最眩的 共回答了14个问题
麻的灯牌是最眩的 共回答了14个问题 |采纳率85.7%把试题拍过来才能解,这本书不是每个人都有1年前查看全部
- 无机及分析化学题目测定Nacl试样中氯的质量分数.多次测定结果w(Cl)为:0.6012,0.6018,0.6045,0
无机及分析化学题目
测定Nacl试样中氯的质量分数.多次测定结果w(Cl)为:0.6012,0.6018,0.6045,0.6020和0.6037.请计算分析结果:(1)平均值;(2)平均偏差和相对平均偏差;(3)标准偏差和相对标准偏差.假如取纯NaCl为试样,请计算分析结果平均值的绝对误差和相对误差各为多少?请帮忙解答以上题目,谢谢……其中的真实值和测量值怎么算?
 lumaying1年前1
lumaying1年前1 -
 冰冰茬 共回答了22个问题
冰冰茬 共回答了22个问题 |采纳率86.4%1.0.6026 2.平均偏差=(|d1|+|d2|+|d3|+|d4|+|d5|)/5=0.0012 .相对平均偏差=平均偏差/平均值=0.20%4.标准偏差=0.0014(不方便写出表达式) 相对标准偏差=标准偏差/平均值=0.23%理论值=35.5/58.5=0.6068 绝对误差=理论值-真实值=0.042 相对误差=绝对误差/真实值=0.69%此题中测量值即为该题中的平均值.真实值即为理论值(即氯化钠的相对原子质量).1年前查看全部
- 关于一道大学无机及分析化学的题某年级学生用碘量法测定某铜合金中铜的质量分数,得到120个分析结果基本符合正态分布N(59
关于一道大学无机及分析化学的题
某年级学生用碘量法测定某铜合金中铜的质量分数,得到120个分析结果基本符合正态分布N(59.11,0.36)。求分析结果出现在区间(58.39,59.70)内的概率。求大神解答啊,刚开始学有点不明白
 shiyu19971年前1
shiyu19971年前1 -
 丽江女儿 共回答了15个问题
丽江女儿 共回答了15个问题 |采纳率73.3%总体平均值是59.11,总体标准偏差是0.36,然后根据边界值求u,再据u值去查概率积分表即可。1年前查看全部
- 如何通过电负性来判断化学键的类型和极性?大学无机及分析化学的问题..请化学基础比较好的同胞帮帮忙!
 woaicy61年前2
woaicy61年前2 -
 1wangtou3012 共回答了17个问题
1wangtou3012 共回答了17个问题 |采纳率94.1%形成共价键的两个元素的电负性差值越大,共价键的极性越强.
当差值大于1.7时,就是离子键了.1年前查看全部
- 过渡态理论问题在书(无机及分析化学----南京大学)上的反应速率理论简介一节中的“过渡态理论”一小节中,为什么反应物分子
过渡态理论问题
在书(无机及分析化学----南京大学)上的反应速率理论简介一节中的“过渡态理论”一小节中,为什么反应物分子的平均势能(E1)与产物分子的平均势能(E2)的能量差为反应的焓变(严格说为热力学能变△U)? Google测试员3961年前1
Google测试员3961年前1 -
 梦子柯 共回答了16个问题
梦子柯 共回答了16个问题 |采纳率93.8%..△H=△U+P△V
是您所要的答案吗?
不是的话我再修改
不过
您这书不太好
建议用《普通化学原理》,北京大学化学学院大三用的教材
本人看了几遍,觉得还蛮简单的1年前查看全部
- 无机及分析化学的题目,求做.一、选择题(每题2分,共计20分)1、下列关于价键理论对配合物的说法正确的是( )A.任何中
无机及分析化学的题目,求做.
一、选择题(每题2分,共计20分)
1、下列关于价键理论对配合物的说法正确的是( )
A.任何中心离子与任何配体都可形成外轨型化合物;
B. 任何中心离子与任何配体都可形成内轨型化合物;
C.中心离子用于形成配位键的原子轨道是经过杂化的等价轨道;
D.以sp3d2和d2sp3杂化轨道成键的配合物具有不同的空间构型.
2、下列何种因素不影响化学平衡( )
A 温度 B 浓度 C 催化剂 D 压力
3、可以减少分析测试中偶然误差的措施是( )
A 增加平行测定次数 B 进行方法校正
C 进行空白实验 D 进行仪器校正
4、HAc的共轭碱是 ( )
A. Ac¯ B. H+ C.HAc D.OH¯
5、滴定分析中,一般利用指示剂颜色的突变来判断化学计量点的到 达,在指示剂变色时停止了滴定,这一点称为( )
A.化学计量点 B. 滴定分析 C. 滴定 D.滴定终点
6、下列化合物中,哪个不具有孤电子对( )
A H2O B NH3
C NH4+ D H2S
7、CH3OH和水之间存在的分子间作用力是下列哪一种( )
A.取向力 B.氢键 C.色散力和诱导力 D.以上四种力均存在
8、胶体系统的电泳现象表明( )
A、分散介质不带电B、胶体粒子处于等电状态
C、胶团带电D、胶体粒子带有大量的电荷
9、在化学动力学中,质量作用定律只适用于( )
A、反应级数为正整数的反应B、基元反应
C、恒温恒容反应D、理想气体反应
10、下列说法正确的是( )
A. 溶度积小的物质一定比溶度积大的物质溶解度小
B. 对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小
C. 难溶物质的溶度积与温度无关
D 难溶物的溶解度仅与温度有关
11、室温下,0.20 mol.dm-3HCOOH溶液电离常数为3.2%,HCOOH的电离常数=( )
(A)2.0×10-4 (B)1.3×10-3 (C)6.4×10-3 (D)6.4×10-4
12、根据Nernst方程式计算SO32﹣/ S2O32﹣的电极电势E,下列叙述不正确的是( )
A. 温度应为298K; B. 得失电子数为6;
C. SO32﹣离子浓度减小则E变小; D. S2O32﹣离子浓度增大则E变小;
13、某缓冲溶液含有等浓度的X–和HX, X–的Kb=1.0×10-10,此缓冲溶的pH值是( )
A. 4 B. 7 C. 10 D. 14
14、在酸性介质中MnO2与Fe2+反应,其还原产物为 ( )
A. MnO42﹣ B. MnO4﹣ C. Mn2+ D. Fe
15、将铁片浸在FeCl2溶液中,金属镉浸在相同浓度的Cd(NO3)2溶液中,组成原电池,已知: EøFe3+/Fe2+>EøCd2+/Cd>EøFe2+/Fe, 则 ( )
A. 铁电极为正极 B. 铁电极为负极 C. Fe2+被氧化为Fe3+ D. Fe2+被还原为Fe
 mmteng1年前1
mmteng1年前1 -
 turbing 共回答了21个问题
turbing 共回答了21个问题 |采纳率90.5%BCACDCBCDABACDCCCBAD1年前查看全部
- 无机及分析化学,写出下列电极反应的离子电子式
 wwwggg681年前0
wwwggg681年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 大学无机及分析化学为什么三氯化铁的熔点低于二氯化铁的熔点?
 90度的火1年前1
90度的火1年前1 -
 末日之剑 共回答了25个问题
末日之剑 共回答了25个问题 |采纳率92%因为三氯化铁的共价性强,更趋向于分子晶体,所以不如氯化亚铁的离子晶体来的稳定1年前查看全部
- 什么是“零水准物质”啊无机及分析化学中的一个名词
 懵懵懂懂10131年前1
懵懵懂懂10131年前1 -
 圣剑斩情思 共回答了16个问题
圣剑斩情思 共回答了16个问题 |采纳率81.3%首先,从酸碱平衡系统中选取质子参考水准(又称为零水准),它们是溶液中大量存在并参与质子转移的物质.也叫质子基准物质.1年前查看全部
- 武汉大学出版无机及分析化学的一道氧化还原平衡常数的题,求学过的高手
武汉大学出版无机及分析化学的一道氧化还原平衡常数的题,求学过的高手
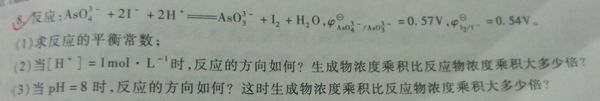
第一问算出来平衡常数为10,关键第二问和第三位没有思路

我不明白为什么改变pH第二问没影响,而第三问就有影响了? 宝贝爱贝贝1年前1
宝贝爱贝贝1年前1 -
 route510 共回答了13个问题
route510 共回答了13个问题 |采纳率92.3%因为反应在酸性环境中进行,给出的标准电极电势即是在[H+]=1 mol/L条件下的,所以不会有影响,但是后面[H+]≠1mol/L 时就有影响了
(2)∵[H+]=1 mol/L,E>0,由K可以算标准吉布斯自由能1年前查看全部
- 一道无机及分析化学题将0℃和98.0kPa下的2.00ml N2和60℃ 53.0kPa下的50.0ml O2,在0℃混
一道无机及分析化学题
将0℃和98.0kPa下的2.00ml N2和60℃ 53.0kPa下的50.0ml O2,在0℃混合于一个50.0ml容器中.问此混合物的总压力是多少? 拭qq1年前0
拭qq1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 11米=______分米,1分米=______厘米,1米=______厘米.
- 2顺便把这个句子给翻译了,我正写英语作文呢请翻译"他们认为这个男人可能是小偷"
- 3the strip holder is dirty ,please clean it!
- 4How many _____ can you see in the picture? [
- 5对反应2NO2(g) =(可逆号) N2O4(g),在一定条件下达到平衡,在温度不变、压强不变时,充入N2,[NO2]
- 6抛掷一枚均匀的硬币5次,已知有3次正面向上,则这三次中恰有2次连续正面向上的概率为多少.
- 7我的桌子有4条腿.桌子上什么也没有.用英语怎么说
- 8下列哪个选项不属于鱼类的特征( )
- 9描写天空的古诗句要边塞诗中的诗句,有描写天空的
- 10计算3+33+333……前10项之和 CLEAR m=3 n=0 s=0 FOR i=10 to 1 _______ n
- 11pigs are sleeping under the tree
- 12从公式P=fv可知,汽车的发动机功率可以随速度的增大而增大吗
- 13高中数学应该怎样学才会对其产生兴趣?怎么样锻炼我们的数学思维能力?
- 14小学数学去括号的原则?
- 15《庐山的云雾》阅读答案庐山的景色十分秀丽.那里有高峰,有幽谷,有瀑布,有溪流,尤其是变幻无常的云雾,更给它增添了几分神秘
