CuSO4中滴加过量氨水后溶液呈深蓝色,再通入SO2生成白色沉淀,这个沉淀是什么?
 一个好人-格格2022-10-04 11:39:541条回答
一个好人-格格2022-10-04 11:39:541条回答然后将沉淀加入稀硫酸中,产生SO2的体积与通入的体积相等吗?
答案是:白色沉淀是Cu2SO3,SO2体积是减少的.
为什么?

已提交,审核后显示!提交回复
共1条回复
 cici2sky 共回答了14个问题
cici2sky 共回答了14个问题 |采纳率92.9%- 白色沉淀是Cu2SO3说明铜的化合价降低,即反应中得到了电子,则部分SO2被氧化成硫酸根,所以生成的SO2体积是减少.
- 1年前
相关推荐
- 下列离子方程式错误的是 A.向Ba(OH) 2 溶液中滴加稀硫酸:Ba 2 + +2OH - +2H + + SO 4
下列离子方程式错误的是
A.向Ba(OH) 2 溶液中滴加稀硫酸:Ba 2 + +2OH - +2H + + SO 4 2 - =BaS0 4 ↓+2H 2 O B.酸性介质中KMnO 4 氧化 H 2 O 2 :2MnO 4 - +5H 2 O 2 +6H + = 2Mn 2 + +5O 2 ↑+ 8H 2 O C.等物质的量的MgCl 2 、Ba(OH) 2 和 HC1 溶液混合:Mg 2 + +2OH - = Mg(OH) 2 ↓ D.铅酸蓄电池充电时的正极反应:PbSO 4 + 2H 2 O-2e- = PbO 2 +4H + +SO 4 2 -  保湿面霜1年前1
保湿面霜1年前1 -
 小雨巫 共回答了22个问题
小雨巫 共回答了22个问题 |采纳率86.4%C
1年前查看全部
- 能与滴加了紫色石蕊的稀盐酸反应,且反应后的溶液依然为红色的是
能与滴加了紫色石蕊的稀盐酸反应,且反应后的溶液依然为红色的是
1.碳酸钙
2.氢氧化钠
3.氧化铜
4.硝酸银 fengche20071年前1
fengche20071年前1 -
 双双464266627 共回答了14个问题
双双464266627 共回答了14个问题 |采纳率92.9%4.硝酸银
反应后生成硝酸,还是酸,所以溶液还是红色
1生成二氧化碳气体、水、氯化钙,二氧化碳未溶于水,因而未中性
2生成氯化钠和水,均为中性
3生成氯化铜和水,均为中性
所以答案是41年前查看全部
- 将一定质量的镁、铝合金,投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5mol/L NaOH溶
将一定质量的镁、铝合金,投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:

①原合金中镁的质量为______g
②铝的质量为______g
③盐酸的物质的量浓度为______mol/L. webgame171731年前1
webgame171731年前1 -
 永茂皮草 共回答了19个问题
永茂皮草 共回答了19个问题 |采纳率89.5%解题思路:由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O.
①由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量;
②根据Al原子守恒有n(Al)=n[Al(OH)3],m=nM计算Al的质量;
③加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=[n/V]计算盐酸的物质的量浓度.①由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,故3×0.1mol+2n[Mg(OH)2]=0.7mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g,
故答案为:4.8g;
②由①计算可知,n(Al)=n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,故m(Al)=0.1mol×27g/mol=2.7g,
故答案为:2.7;
③加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为[0.8mol/0.1L]=8mol/L,
故答案为:8.点评:
本题考点: 镁、铝的重要化合物;有关混合物反应的计算.
考点点评: 考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.1年前查看全部
- 分别向醋酸钠,乙酸,碳酸氢钠溶液中滴加氯化铁溶液,分别会产生什么现象
 xingxing6771年前1
xingxing6771年前1 -
 gggg一支花 共回答了17个问题
gggg一支花 共回答了17个问题 |采纳率100%红色沉淀,黄色变浅,红色沉淀加气泡1年前查看全部
- 用浓硫酸碳化木条,所得的含有碳单质的悬浊液在滴加硫酸钠后,变为澄清!
用浓硫酸碳化木条,所得的含有碳单质的悬浊液在滴加硫酸钠后,变为澄清!
是氧化还原反应吗? 大能猫和小完能1年前4
大能猫和小完能1年前4 -
 黑鼠一只 共回答了14个问题
黑鼠一只 共回答了14个问题 |采纳率92.9%浓硫酸碳化木条后所得到的溶液中含有大量未反应的硫酸,这时在所得的含有碳单质的悬浊液在滴加硫酸钠后,增加了硫酸的含量,浓的硫酸与碳发生反应
2H2SO4+C=CO2+2SO2+2H2O
反应可以使溶液变澄清.1年前查看全部
- 向x盐溶液通入过量氯气,再滴加硝酸银和稀硝酸,溶液中有白色沉淀生成,根据上述实验现象判断x盐溶液可能是()A.亚硫酸钠
向x盐溶液通入过量氯气,
再滴加硝酸银和稀硝酸,溶液中有白色沉淀生成,根据上述实验现象判断x盐溶液可能是()
A.亚硫酸钠 B.硫酸钠 C.硝酸钠 D.磷酸钠 qinger9231年前1
qinger9231年前1 -
 输女把密码输了 共回答了24个问题
输女把密码输了 共回答了24个问题 |采纳率79.2%选择A
Na2SO3 + Cl2 + H2O = Na2SO4 + 2 HCl
产生了Cl-,能与硝酸银反应得到白色的AgCl沉淀.
B、虽然Ag2SO4微溶,但如果浓度较小,不一定有沉淀析出.
C、硝酸钠不参加反应
D、Na3PO4能与AgNO3反应得到黄色的Ag3PO4沉淀.该沉淀能溶于HNO31年前查看全部
- 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/
向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L
向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成红棕色沉淀证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度为什么不对 不是往更难溶转化么 拉拉夏1年前1
拉拉夏1年前1 -
 浪漫屋 共回答了18个问题
浪漫屋 共回答了18个问题 |采纳率77.8%氢氧化钠过量,内含两种沉淀但你只能看到红色,白色被覆盖.1年前查看全部
- 向盛水的试管里滴加浓硫酸如何操作
向盛水的试管里滴加浓硫酸如何操作
滴管要不要靠住试管壁! 洲黄1年前2
洲黄1年前2 -
 大海123abc 共回答了15个问题
大海123abc 共回答了15个问题 |采纳率100%浓硫酸溶于水会放出大量的热 如过往浓硫酸中加水的话 放出的热会使水沸腾 溅出 所以一定要往水中加浓硫酸
往水中加浓硫酸时 把浓硫酸沿烧杯壁慢慢倒入水中 并用玻璃棒不断搅拌1年前查看全部
- 向氯化亚铁中加入硫氰化钾溶液的实验现象,再滴加几滴氯水的实验现象以及离子方程式
 yice3651年前1
yice3651年前1 -
 我真的没钱 共回答了17个问题
我真的没钱 共回答了17个问题 |采纳率94.1%向氯化亚铁中加入硫氰化钾溶液:无明显现象
再滴加几滴氯水:溶液变为血红色
离子方程式:2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
Fe3+ + 3SCN- == Fe(SCN)3(血红色)1年前查看全部
- 向滴有酚酞的硅酸钠溶液中滴加盐酸至浅红色
向滴有酚酞的硅酸钠溶液中滴加盐酸至浅红色
这是什么原理? 灰蓝色1年前2
灰蓝色1年前2 -
 __思思 共回答了18个问题
__思思 共回答了18个问题 |采纳率77.8%向滴有酚酞的硅酸钠溶液中滴加盐酸至浅红色
这是因为硅酸钠是强碱弱酸盐,所以在水溶液中硅酸钠水解呈碱性,会使酚酞变红.滴盐酸会中和硅酸钠的碱性,使酚酞的红色变浅.再往下滴加,溶液会变无色,并有沉淀的生成,因为硅酸根与氢离子结合能生成不溶于水的偏硅酸1年前查看全部
- 已知:①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验
已知:①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( ) A.实验③说明KI被氧化 B.实验②中氧化剂与还原剂的物质的量之比为2:1 C.实验①证明Cl - 具有还原性 D.上述实验证明氧化性:ClO 3 - <Cl 2 <I 2  花殇之魇1年前1
花殇之魇1年前1 -
 silentsoun 共回答了14个问题
silentsoun 共回答了14个问题 |采纳率92.9%①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体,反应的化学方程式为:KClO 3 +6HCl=KCl+3Cl 2 ↑+3H 2 O,说明Cl - 具有还原性,氧化剂KClO 3 的氧化性大于氧化产物Cl 2 ;
②向NaI溶液中通入少量实验①产生的气体,反应的化学方程式为:Cl 2 +2NaI=2NaCl+I 2 ;氧化剂Cl 2 和还原剂NaI物质的量之比为1:2;氧化剂Cl 2 的氧化性大于氧化产物I 2 ;
③取实验②生成的溶液中含有碘单质,滴在淀粉KI试纸上,碘单质遇淀粉试纸变蓝色,说明溶液中含有碘单质;所以:
A、说明实验②生成的溶液中含有碘单质,不是试纸上的碘化钾被氧化,故A错误;
B、实验②中氧化剂与还原剂的物质的量之比为1:2,故B错误;
C、实验①反应可知能证明Cl - 具有还原性,故C正确;
D、上述实验证明氧化性:ClO 3 - >Cl 2 >I 2 ,故D错误;
故选C.1年前查看全部
- 向氢氧化钠和酚酞溶液的混合液中滴加稀盐酸,红色褪去后,为了检验所得溶液的酸碱性,将所得溶液分成四等份,进行如下实验,其中
向氢氧化钠和酚酞溶液的混合液中滴加稀盐酸,红色褪去后,为了检验所得溶液的酸碱性,将所得溶液分成四等份,进行如下实验,其中实验结论正确的是( )
选项 实验操作和现象 实验结论 A 向所得溶液中加入紫色石蕊,又变红色 该溶液显酸性 B 向所得溶液中再加入少量氢氧化钠溶液,不变色 该溶液显中性 C 向所得溶液中加入碳酸钠粉末,有气泡 该溶液显碱性 D 向所得溶液中加入少量锌粒,有气泡 该溶液显中性
A. A
B. B
C. C
D. D 心爱新灵1年前1
心爱新灵1年前1 -
 carol1022 共回答了21个问题
carol1022 共回答了21个问题 |采纳率90.5%解题思路:氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,根据酸性溶液的性质分析解答.A、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,滴加紫色石蕊试液变红色,说明呈酸性,故A正确;
B、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,滴加少量氢氧化钠溶液不变色,说明盐酸过量,溶液呈酸性,将加入的氢氧化钠中和,故B错误;
C、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,滴加碳酸钠溶液有气泡,说明溶液呈酸性,故C错误;
D、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,加入锌粒有气泡,说明溶液呈酸性,故D错误;
故选A.点评:
本题考点: 溶液的酸碱性测定;酸碱指示剂及其性质.
考点点评: 酸性溶液能使紫色石蕊试液变红,能与碳酸盐反应生成二氧化碳,能与氢前金属反应生成氢气.1年前查看全部
- Bacl2溶液通入SO2气体有何现象?再滴加少量H2O2溶液,又有何现象
 yzhp19841年前5
yzhp19841年前5 -
 lqh123456654321 共回答了16个问题
lqh123456654321 共回答了16个问题 |采纳率93.8%Bacl2溶液通入SO2气体有何现象?无明显现象
因为不会生成亚硫酸钡,它溶解于酸中的.
再滴加少量H2O2溶液,又有何现象:产生白色沉淀.
因为H2O2有强氧化性,能使溶液中的亚硫酸根离子转化为硫酸根离子,结合钡离子生成硫酸钡的.1年前查看全部
- 在化学实验室中,要吸取和滴加少量试剂,应选用的仪器是
 琥珀10101年前1
琥珀10101年前1 -
 helen0510 共回答了16个问题
helen0510 共回答了16个问题 |采纳率87.5%刻度吸管,也叫做吸量管!分容积的,有0.5ml的,1ml的,2ml的,直至25ml
当然若只是没有要求定量滴加的话,用胶头滴管就够用了1年前查看全部
- 高一化学难题求解将2.5g碳酸钠、氢氧化钠、碳酸氢钠的固体混合物完全溶解于水中,制成稀溶液,然后向溶液中滴加1mol/L
高一化学难题求解
将2.5g碳酸钠、氢氧化钠、碳酸氢钠的固体混合物完全溶解于水中,制成稀溶液,然后向溶液中滴加1mol/L的盐酸,所加入盐酸体积与产生二氧化碳的体积(标况)关系如图,计算原混合物中NaOH的质量及碳酸钠的质量分数.
我自己都不知道怎么下手了,我当初是在问问上拿下来的,然后没人回答,也不知道是不是缺少条件,然后,我只知道氢氧化钠可以与碳酸氢钠反应!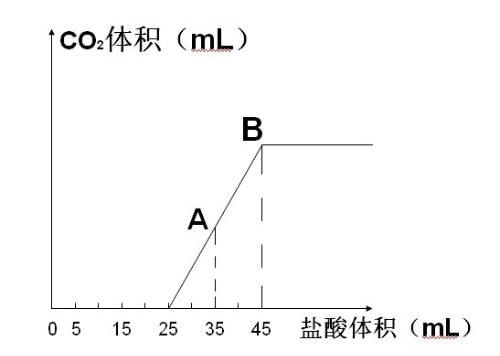
 szzxt1年前1
szzxt1年前1 -
 爱VS奉献 共回答了24个问题
爱VS奉献 共回答了24个问题 |采纳率91.7%首先,在前二十五毫升内,是盐酸与氢氧化钠或碳酸钠反应,总共耗去盐酸,0.025mol.由式子NaoH+HCI==NaCI+H2O,NaOH+NaHCO3==Na2CO3+H2ONa2CO3+HCI==NaCI+NaHCO3所以,碳酸钠与氢氧化钠总物质的量0.025mol,然后HCI+NaHCO3==...1年前查看全部
- 向氯化镁和氯化铝混合物中滴加氢氧化钠,氢氧化钠与氯化镁反应还是先于氯化铝反应,有先后顺序吗?原理...
向氯化镁和氯化铝混合物中滴加氢氧化钠,氢氧化钠与氯化镁反应还是先于氯化铝反应,有先后顺序吗?原理...
向氯化镁和氯化铝混合物中滴加氢氧化钠,氢氧化钠与氯化镁反应还是先于氯化铝反应,有先后顺序吗?原理是什么? 把你问青天1年前1
把你问青天1年前1 -
 相约33 共回答了20个问题
相约33 共回答了20个问题 |采纳率80%理论上,如果非常慢的滴加,氢氧化钠浓度又很低,那氢氧化铝先析出,因为氢氧化镁是微溶,溶解度高于氢氧化铝好几个数量级
一般情况下,滴加的快,局部过浓,没有先后顺序,同时沉淀下来1年前查看全部
- 向足量碳酸氢钡溶液中逐渐滴加硫酸氢钠溶液离子方程式
 林之冬阳1年前2
林之冬阳1年前2 -
 妖女托托 共回答了17个问题
妖女托托 共回答了17个问题 |采纳率94.1%硫酸氢钠溶少量
Ba(HCO3) 2+ NaHSO4 = NaHCO3 +CO2 + BaSO4 + H20
因为
硫酸氢钠溶少量
只能和一份的Ba(HCO3) 2的HCO3反应1年前查看全部
- 酯化反应中药品的滴加顺序在乙酸和乙醇的反应中,为什么要先加乙醇,再加浓硫酸,冷却后再加乙酸?
 jxl_lzy1年前3
jxl_lzy1年前3 -
 苏樱儿 共回答了11个问题
苏樱儿 共回答了11个问题 |采纳率100%将浓硫酸加入乙醇中是为了防止混合产生的热量导致局部过热而是液体迸溅(这和稀释浓硫酸把浓硫酸加入水中的道理上是一样的),待溶液冷却后再与乙酸混合是为了防止乙酸挥发
先加乙醇,再加硫酸,虽说不太会造成液体迸溅的情况,但仍然会释放出大量的热量,使乙酸挥发损耗,使液体迸溅的实际上是因为两种液体的密度不同,以及添加的顺序造成的1年前查看全部
- 在硬水中滴加少量肥皂水,为什么会有白色沉淀产生?
 brigitte501年前1
brigitte501年前1 -
 白旭阳 共回答了17个问题
白旭阳 共回答了17个问题 |采纳率76.5%解题思路:硬水中含较多钙、镁等离子,易与肥皂中的硬脂酸钠结合生成不溶于水的硬脂酸钙、硬脂酸镁.硬水中含较多钙、镁等离子,硬水中的Ca2+或Mg2+跟肥皂的主要成分硬脂酸钠起反应生成硬脂酸钙[Ca(C17H35COO)2]或硬脂酸镁[Mg(C17H35COO)2]沉淀,
答:硬水中含较多钙、镁等离子,与肥皂中的硬脂酸结合生成不溶于水的硬脂酸钙、硬脂酸镁白色沉淀.点评:
本题考点: 羧酸简介;油脂的性质、组成与结构.
考点点评: 本题考查了硬水中滴加少量肥皂水白色沉淀产生的原因,题目难度一般,掌握硬水、肥皂水的成分和性质是解题的关键.1年前查看全部
- A和硝酸银反应,产生白色沉淀B,再滴加稀硝酸沉淀不消失.A是什么,B是什么
 影风芝1年前3
影风芝1年前3 -
 qab20 共回答了25个问题
qab20 共回答了25个问题 |采纳率76%A 是氯盐,后面应该还有判别条件吧?如果后面还有判别条件确定A是具体某个盐的话,经验来看A是盐酸概率最大,其次是氯化钠、氯化钾.
B 是氯化银.1年前查看全部
- 向盛有硫酸铁溶液的试管中滴加0.1mol/L的KSCN溶液后,呈现红色,发生反应的离子方程式为Fe3+ +3SCN-=F
向盛有硫酸铁溶液的试管中滴加0.1mol/L的KSCN溶液后,呈现红色,发生反应的离子方程式为Fe3+ +3SCN-=Fe(SCN)3;若向反应后的溶液中滴加1mol/L的KSCN溶液,化学平衡___,可以看到的现象是___.
请写明原因谢谢 palyball1年前2
palyball1年前2 -
 真他吗犯贱 共回答了19个问题
真他吗犯贱 共回答了19个问题 |采纳率89.5%化学平衡_正向移动__,可以看到的现象是__颜色更深_.1年前查看全部
- 下列实验结论正确的是( )A.向某固体中滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐B.向某无色溶液中滴加石灰水有白色
下列实验结论正确的是( )
A.向某固体中滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐
B.向某无色溶液中滴加石灰水有白色沉淀生成,则该溶液一定含有碳酸根离子
C.某固体化肥与熟石灰混合研磨产生氨气,则该化肥一定是铵态氮肥
D.两种物质间发生反应,若有沉淀生成,则该反应一定属于复分解反应 zhouyancheng1年前1
zhouyancheng1年前1 -
 何以-解忧 共回答了27个问题
何以-解忧 共回答了27个问题 |采纳率85.2%解题思路:A、根据酸能与活泼金属、碳酸盐等反应生成气体进行分析判断.
B、向某无色溶液中滴加石灰水有白色沉淀生成,该白色沉淀也可能是硫酸钙白色沉淀.
C、铵态氮肥与碱性物质混合后能放出氨气,据此进行分析判断.
D、复分解反应是两种化合物相互交换成分生成两种新的化合物的反应.A、向某固体中滴加稀盐酸,有气泡产生,则该固体不一定是碳酸盐,也可能是活泼金属等,故选项说法错误.
B、向某无色溶液中滴加石灰水有白色沉淀生成,该溶液不一定含有碳酸根离子,该白色沉淀也可能是硫酸钙白色沉淀,故选项说法错误.
C、某固体化肥与熟石灰(属于碱,显碱性)混合研磨产生氨气,则该化肥一定是铵态氮肥,故选项说法正确.
D、两种物质间发生反应,若有沉淀生成,则该反应不一定属于复分解反应,如CO2+Ca(OH)2═CaCO3↓+H2O,故选项说法错误.
故选:C.点评:
本题考点: 证明碳酸盐;复分解反应及其发生的条件;铵态氮肥的检验.
考点点评: 本题难度不大,掌握酸的化学性质、常见离子的检验方法、铵态氮肥的性质等是正确解答本题的关键.1年前查看全部
- 为了探究分子性质,小丽和小明设计了如下实验:如下图1所示,A烧杯中加20mL蒸馏水,在向其中滴加5~6滴酚酞溶液,B烧杯
为了探究分子性质,小丽和小明设计了如下实验:如下图1所示,A烧杯中加20mL蒸馏水,在向其中滴加5~6滴酚酞溶液,B烧杯中加入5mL浓氨水,然后用一个大烧杯罩住A、B两个小烧杯。回答下面问题

 ibm闲1年前1
ibm闲1年前1 -
 carson_hu 共回答了14个问题
carson_hu 共回答了14个问题 |采纳率78.6%A 中变红1年前查看全部
- 向鸡蛋壳、草木灰、石灰石、纯碱等物质中滴加稀盐酸,都能产生CO2,其原因是( )
向鸡蛋壳、草木灰、石灰石、纯碱等物质中滴加稀盐酸,都能产生CO2,其原因是( )
A. 这些物质都是固体
B. 这些物质中都含有碳元素
C. 这些物质中都含有碳酸盐
D. 这些物质中都含有二氧化碳 谁是燕七1年前3
谁是燕七1年前3 -
 点击我的xx 共回答了19个问题
点击我的xx 共回答了19个问题 |采纳率89.5%解题思路:碳酸盐遇酸能反应生成二氧化碳.鸡蛋壳、草木灰、石灰石、纯碱等物质中都含有碳酸根,遇酸能反应生成二氧化碳气体,观察选项,故选C.
点评:
本题考点: 证明碳酸盐.
考点点评: 本题考查了碳酸盐的检验,完成此题,可以依据碳酸盐的检验方法进行,及采用加酸化气的方法.1年前查看全部
- 向一定量的氢氧化钠溶液中滴加稀硫酸后再滴加硫酸铜溶液,的反应方程式.能不能说明H2SO4与NaOH反应?
 hhm0051年前1
hhm0051年前1 -
 wl5167999 共回答了24个问题
wl5167999 共回答了24个问题 |采纳率95.8%能是能,但必须要加入过量的硫酸,使反应2NaOH+H2SO4→Na2SO4+H2O中NaOH完全消耗完,这时溶液中只剩H2SO4和Na2SO4,再滴加CuSO4,就不发生反应,没有蓝色沉淀生成,说明溶液中的NaOH已经被H2SO4反应掉了.【注:CuSO4与NaOH会发生反应生成蓝色沉淀Cu(OH)2】1年前查看全部
- 下列实验方案中合理的是 A.鉴别氯化铝和氯化镁溶液:分别滴加过量的氢氧化钠溶液 B.除去氯化铵溶液中的氯化铁:向溶液中滴
下列实验方案中合理的是
A.鉴别氯化铝和氯化镁溶液:分别滴加过量的氢氧化钠溶液 B.除去氯化铵溶液中的氯化铁:向溶液中滴加适量氢氧化钠溶液,过滤 C.除去苯中的苯酚:向溶液中加入浓溴水,过滤 D.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液加热后,用稀硝酸酸化再滴加硝酸银溶液  yimuy1年前1
yimuy1年前1 -
 edcrfvtgb1 共回答了20个问题
edcrfvtgb1 共回答了20个问题 |采纳率80%AD
B中除去氯化铵溶液中的氯化铁:向溶液中滴加适量氨水,过滤;C中除去苯中的苯酚:向溶液中加入氢氧化钠溶液,分液。1年前查看全部
- 明矾中滴加氯化钡溶液至过量离子方程式
 lijinmimi011年前3
lijinmimi011年前3 -
 边走边吃游世界 共回答了20个问题
边走边吃游世界 共回答了20个问题 |采纳率85%Ba2+ +SO4 2-=BaSO41年前查看全部
- 下列离子方程式正确的是( )A.向烧碱溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2OB.硝酸铝溶液
下列离子方程式正确的是( )
A.向烧碱溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O
B.硝酸铝溶液中加入过量氨水Al3++3NH3•H2O=Al(OH)3↓+3NH+4
C.氢氧化钡溶液和稀硫酸反应Ba2++SO42-=BaSO4↓
D.向酸性FeSO4溶液中滴入H2O2Fe2++H2O2+2H+=Fe3++2H2O 相约丹枫赴远冬1年前1
相约丹枫赴远冬1年前1 -
 剑客方无病 共回答了14个问题
剑客方无病 共回答了14个问题 |采纳率92.9%解题思路:A、烧碱过量,反应生成了偏铝酸根离子;
B、氨水碱性较弱,不能够溶解氢氧化铝,反应生成了氢氧化铝沉淀;
C、氢氧化钡与稀硫酸反应生成了硫酸钡沉淀和水,方程式中漏掉了水;
D、亚铁离子被双氧水氧化成了铁离子,离子方程式两边电荷不守恒.A、向烧碱溶液中滴加少量氯化铝溶液,氢氧根离子过量,反应生成了偏铝酸根离子,反应的离子方程式为:Az3++yO多-=AzO2-+2多2O,故A正确;
6、硝酸铝溶液中加入过量氨水,反应生成了氢氧化铝沉淀,反应的离子方程式为:Az3++3w多3•多2O=Az(O多)3↓+3w多y+,故6正确;
2、氢氧化钡溶液和稀硫酸反应,生成了硫酸钡沉淀和水,反应的离子方程式为:2多++SOy2-+6a2++2O多-=6aSOy↓+2多2O,故2错误;
上、向酸性六eSOy溶液中滴入多2O2,亚铁离子被氧化成铁离子,2六e2++多2O2+2多+=2六e3++2多2O,故上错误;
故选A6.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断,题目难度中等,该题是高考中的高频题,侧重对学生能力的培养和训练,该题需要明确判断离子方程式常用方法(1)检查反应能否发生;(2)检查反应物、生成物是否正确;(3)检查各物质拆分是否正确;(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等);(5)检查是否符合原化学方程式.1年前查看全部
- 取两毫升的硫酸铜溶液于试管中,滴加几滴烧碱溶液,观察到的现象是 反映的化学方程式为 再向试管中滴加稀盐酸,观察到的现象时
取两毫升的硫酸铜溶液于试管中,滴加几滴烧碱溶液,观察到的现象是 反映的化学方程式为 再向试管中滴加稀盐酸,观察到的现象时是 反映的化学方程式为
 xlcss1年前3
xlcss1年前3 -
 潇剑℃ 共回答了26个问题
潇剑℃ 共回答了26个问题 |采纳率92.3%取两毫升的硫酸铜溶液于试管中,滴加几滴烧碱溶液,观察到的现象是(产生蓝色沉淀)
反映的化学方程式为(CuSO4 + 2 NaOH = Cu(OH)2↙ + Na2SO4)
再向试管中滴加稀盐酸,观察到的现象时是(蓝色沉淀溶解,得到蓝色溶液)
反映的化学方程式为(Ca(OH)2 + 2 HCl = CuCl2 + 2 H2O)1年前查看全部
- 取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成(
取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( ).
 屋檐无语1年前1
屋檐无语1年前1 -
 诗韵梦月 共回答了25个问题
诗韵梦月 共回答了25个问题 |采纳率88%取三张蓝色石蕊试纸湿润后贴在
玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( ).
(A)白、红、白 (B)红、黑、白
(C)红、红、红 (D)白、黑、白1年前查看全部
- 将镁铝的混合物0.1mol溶于100mL2mol·L-1硫酸溶液中,然后再滴加1mol·L-1氢氧化钠溶液,请回答以下问
将镁铝的混合物0.1mol溶于100mL2mol·L-1硫酸溶液中,然后再滴加1mol·L-1氢氧化钠溶液,请回答以下问题:
若在滴加NaOH溶液过程中,沉淀质量m随加入氢氧化钠的体积v变化关系如图.当V1=160ml时,金属粉末中n(Mg)= V2=
图如下: 紫眸微颤1年前2
紫眸微颤1年前2 -
 尼莫小丑鱼 共回答了12个问题
尼莫小丑鱼 共回答了12个问题 |采纳率100%看不到图呢.1年前查看全部
- 下列关于物质及离子的检验,结论正确的是 A.向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO
下列关于物质及离子的检验,结论正确的是
A.向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO 3 2 - B.向某溶液中滴加氯化钡溶液,产生白色沉淀,再滴加足量稀硝酸,依然有白色固体,说明原溶液含有SO 4 2 - C.向某溶液中逐渐滴加NaOH溶液,先有白色胶状沉淀产生,后来沉淀逐渐溶解,则原溶液中可能含有Al 3 + D.向某溶液中先加入氯水,再滴入KSCN溶液,最后溶液显血红色,则原溶液中一定含有Fe 3 +  whdkb1年前1
whdkb1年前1 -
 dd的烦恼11 共回答了19个问题
dd的烦恼11 共回答了19个问题 |采纳率84.2%C
1年前查看全部
- 向 Al2(SO4)3 溶液中滴加氨水(NH3.H2O)至过量 现象?
向 Al2(SO4)3 溶液中滴加氨水(NH3.H2O)至过量 现象?
可氨水是个弱碱阿? 哈哈haha的ww1年前1
哈哈haha的ww1年前1 -
 33513336 共回答了21个问题
33513336 共回答了21个问题 |采纳率90.5%出现白色沉淀 沉淀不消失 就因为是弱碱 沉淀才不消失
AL(OH)3是两性的,碱性比氨水还 弱 所以才会产生沉淀1年前查看全部
- 向下列分散系中滴加稀硫酸,先生成沉淀继而沉淀又溶解的是:A、Fe(OH)3胶体 B、H2SiO3胶体 C、Na2SiO3
向下列分散系中滴加稀硫酸,先生成沉淀继而沉淀又溶解的是:A、Fe(OH)3胶体 B、H2SiO3胶体 C、Na2SiO3溶液D、Ba(HCO3)2溶液.
 mh1683691年前1
mh1683691年前1 -
 李小军202 共回答了18个问题
李小军202 共回答了18个问题 |采纳率88.9%答案是A
A中先是氢氧化铁聚沉,后硫酸过量,氢氧化铁溶解
B中硅酸聚沉
C中变成硅酸沉淀
D中变成硫酸钡,1年前查看全部
- 下列实验能达到预期目的的是A.检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水B.从含I—的溶液中提
下列实验能达到预期目的的是
A.检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水
B.从含I—的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取
C.检验蔗糖水解产物:向蔗糖溶液中加入适量稀硫酸水浴加热后,再加入新制的Cu(OH)2,加热至沸腾
D.除去Mg(OH)2中的少量Ca(OH) 2:加入足量的MgCl2溶液,充分反应后过滤洗涤 girlzpy1年前1
girlzpy1年前1 -
 leftwaylian 共回答了17个问题
leftwaylian 共回答了17个问题 |采纳率94.1%选D
A二氧化硫
B酒精与水混溶
C应先碱化再加新制的Cu(OH)21年前查看全部
- 吸取和滴加少量液体时用滴管:使用滴管时()在上,滴管()或()
 887020681年前1
887020681年前1 -
 198811060l 共回答了25个问题
198811060l 共回答了25个问题 |采纳率96%胶头在上,滴管垂直或稍斜1年前查看全部
- 取少量的FeO加稀盐酸溶解,再滴加氢氧化钠溶液,观察到的现象是什么
 zahjn1年前1
zahjn1年前1 -
 xialin870129 共回答了17个问题
xialin870129 共回答了17个问题 |采纳率76.5%加稀盐酸后形成浅绿色溶液,加入氢氧化钠后先形成白色沉淀,然后迅速变灰绿,最终变为红褐色沉淀1年前查看全部
- 取样,加水溶解,溶液蓝色的是CuSO4.在溶液中,滴加无色酚酞试液,变红色的是NaOH.
取样,加水溶解,溶液蓝色的是CuSO4.在溶液中,滴加无色酚酞试液,变红色的是NaOH.
在溶液中再滴加AgNO3溶液,产生白色沉淀的是NaCl.
无现象的是KNO3
写出这个过程中所发生反应的化学方程式 comicon1年前1
comicon1年前1 -
 魑魅魍魉1999 共回答了21个问题
魑魅魍魉1999 共回答了21个问题 |采纳率85.7%AgNO3 HCl=AgCl(沉淀,标下箭头) HNO31年前查看全部
- 1.向硫酸铜溶液中滴加氯化钡溶液和几滴稀硝酸的实验现象和化学方程式
1.向硫酸铜溶液中滴加氯化钡溶液和几滴稀硝酸的实验现象和化学方程式
2.向碳酸钾溶液中滴加氯化钡和几滴稀硝酸的实验现象和化学方程式 jzhlfs1年前2
jzhlfs1年前2 -
 fredtiger 共回答了14个问题
fredtiger 共回答了14个问题 |采纳率92.9%1.向硫酸铜溶液中滴加氯化钡溶液和几滴稀硝酸的实验现象和化学方程式:
CuSO4 + BaCl2 == CuCl2 + BaSO4↓
现象:生成难溶于稀硝酸的白色沉淀.
2.向碳酸钾溶液中滴加氯化钡和几滴稀硝酸的实验现象和化学方程式:
K2CO3 + BaCl2 == 2KCl + BaCO3↓
3BaSO3 + 2HNO3 == 3BaSO4 + 2NO↑ + H2O
2NO + O2 == 2NO2
现象:生成白色沉淀,加入硝酸后生成无色气体,遇空气变红棕色,沉淀不溶解.1年前查看全部
- 1.(1)若要用实验方法证明氢氧化钠溶液已变质,可取少量氢氧化钠溶液于一只试管中,滴加少量的( )溶液,观察到的现象是(
1.(1)若要用实验方法证明氢氧化钠溶液已变质,可取少量氢氧化钠溶液于一只试管中,滴加少量的( )溶液,观察到的现象是( ),则证明氢氧化钠溶液已变质.写出该反应的化学方程式( ).
(2)如何除去此氢氧化钠溶液中的杂质(简要写出试验方法和有关反应的化学方程式)? 喜欢喜欢喜欢小qw1年前1
喜欢喜欢喜欢小qw1年前1 -
 ranran522 共回答了20个问题
ranran522 共回答了20个问题 |采纳率95%1.盐酸 气泡生成 Na2CO3+HCl=2NaCl+CO2↑+H2O
2.一般来说,NaOH中的杂质是指Na2CO3(碳酸钠),这是由于NaOH和空气中的CO2作用使NaOH变质(成Na2CO3)的缘故.因此,只要加入适量HCl(盐酸)即可:Na2CO3+HCl=NaCl+H2O+CO2↑,然后再经过过滤,把NaCl过滤出来即可1年前查看全部
- 为什么滴加浓盐酸可鉴别饱和碳酸氢钠,碳酸钾,亚硫酸钠,氯化钠,硝酸钾五种无色溶液
 xiangxcy1年前1
xiangxcy1年前1 -
 2068963 共回答了26个问题
2068963 共回答了26个问题 |采纳率88.5%解析:
浓盐酸滴加饱和碳酸氢钠,反应式:NaHCO3+HCl = NaCl + CO2(气体) + H2O 现象为:有无色无味的气体生成.
浓盐酸滴加饱和碳酸钾溶液中,反应式:K2CO3 + HCl = KCl + KHCO3 ,KHCO3+HCl=KCl + CO2(气体) + H2O 现象为:先没有气体,后产生无色无味的气体.
浓盐酸滴加饱和亚硫酸钠溶液中,反应式:Na2SO3 + HCl = NaCl + NaHSO3 ,NaHSO3+HCl=NaCl + SO2(气体) + H2O 现象为:先没有气体,后产生无色有刺激性气味的气体.
浓盐酸滴加饱和NaCl溶液中,同离子效应,NaCl = Na+ + Cl- HCl=Cl- +H+ 饱和NaCl中C(Cl-)浓度增大,使饱和NaCl溶液有晶体析出.现象为:有晶体析出.
浓盐酸滴加饱和硝酸钾溶液中,只吸收HCl.无明显现象.1年前查看全部
- 1.某盐酸与氢氧化钠溶液混合后,向其中滴加紫色石蕊试液,溶液变红为什么混合溶液的质量是混合前两种溶液的质量之和?为什么混
1.某盐酸与氢氧化钠溶液混合后,向其中滴加紫色石蕊试液,溶液变红为什么混合溶液的质量是混合前两种溶液的质量之和?为什么混合后溶液中水的质量大于混合前两种溶液中水的质量之和?
2.如图,有HCl,Cacl2的混合溶液,想起逐滴加入过量某物质X的量得变化关系为什么只有纯碱溶液?不能澄清石灰水?

 shiyanhaoma1年前3
shiyanhaoma1年前3 -
 65552392j 共回答了26个问题
65552392j 共回答了26个问题 |采纳率88.5%我先回答你的第一个问题:盐酸和氢氧化钠溶液混合后发生中和反应生成水和氯化钠,相信这个知识点你是懂的.根据质量守恒定律,化学反应前后质量不变.由于发生反应后有水产生,所以混合后溶液中的水质量就增加了.
第二个问题:因为在加入X物质的过程中,溶液的PH有一段是呈中性的,这是因为纯喊溶液和Cacl2反应生成碳酸钙的过程.如果是石灰水的话,不会有一段呈中性的过程,而是直接变碱性了.
能明白吗?不明白的话我再详细解释.1年前查看全部
- 向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.滴加HNO3,有什么作用?
 liuhe5211年前1
liuhe5211年前1 -
 床前zz裳 共回答了20个问题
床前zz裳 共回答了20个问题 |采纳率90%Na2SO3和HNO3反应产生BaSO4,加HNO3是为了验证产生了Ba2SO41年前查看全部
- 向NaAlO2滴加NaHCO3的化学方程式 漂白粉失效的原因 的化学方程式
 我是好人嗯1年前2
我是好人嗯1年前2 -
 liudehua2006 共回答了26个问题
liudehua2006 共回答了26个问题 |采纳率100%NaAlO2+NaHCO3+H2O=Na2CO3+Al(OH)3
Ca(ClO)2+CO2+H2O=CaCO3 +2HClO
2HClO=2HCl+O2 ↑1年前查看全部
- 将氢氧化钠溶液滴加到胆矾溶液中时产生的现象是?
 a_ya1261年前3
a_ya1261年前3 -
 优雅的aa 共回答了12个问题
优雅的aa 共回答了12个问题 |采纳率91.7%应该是有蓝色的沉淀物生成,因为胆矾溶液的化学式是CuSO4,和NaOH溶液发生反应生成Cu(OH)2,而Cu(OH)2是难溶于水的,所以有蓝色沉淀生成1年前查看全部
- 取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
生成沉淀质量与加入氢氧化钠溶液体积关系如图,则原合金中镁的质量为?(沉淀最大值19.4克,沉淀最大值对应氢氧化钠的量为160毫升,最后沉淀为11.6克,对应氢氧化钠的量为180毫升.) 爱情三分球1年前1
爱情三分球1年前1 -
 习他们的 共回答了13个问题
习他们的 共回答了13个问题 |采纳率92.3%最后的沉淀为氢氧化镁,可以算出氢氧化镁物质的量为 11.6/58=0.2mol 所以Mg为0.2mol,为4.8g 沉淀最大时,应该是氢氧化铝和氢氧化镁共存,所以氢氧化铝质量为19.4-11.6=7.8g 其物质的量为 7.8/78=0.1mol 所以铝为2.7g1年前查看全部
- 酸碱滴定实验相关rt,酸碱指示剂多数是有机弱酸,那么用向待测液(碱性)中滴加指示剂时会不会将待测液中和一部分从而使标准液
酸碱滴定实验相关
rt,酸碱指示剂多数是有机弱酸,那么用向待测液(碱性)中滴加指示剂时会不会将待测液中和一部分从而使标准液体积减小进而影响待测液的浓度呢?如果会的话请问该如何处理实验误差?当做系统误差忽略? 会叫的蛐蛐1年前1
会叫的蛐蛐1年前1 -
 丹紫口琴 共回答了26个问题
丹紫口琴 共回答了26个问题 |采纳率84.6%指示剂通常是有机弱酸或有机弱碱,指示剂的变色原理就是消耗一定的滴定剂结构发生变化而表现出不同的颜色,所以肯定会中和一部分待测液(或者标准液,视用的指示剂是有机酸还是碱).实验误差肯定存在,所以应尽量减少指示剂用量,由于量少产生的误差可以忽略,而且待测液的突越范围比指示剂范围小的多,所以误差可以忽略1年前查看全部
- 向H3PO4溶液中逐滴加NaOH直至过量 求离子方程式﹙求详细过程及讲解﹚
 小猴子咬咬1年前5
小猴子咬咬1年前5 -
 走路去上课 共回答了21个问题
走路去上课 共回答了21个问题 |采纳率81%H3PO4 + OH- PO4^3- + H2O
磷酸是三元酸,一份磷酸能消耗三份碱,但磷酸不是强酸,写离子方程式时不可拆开.1年前查看全部
- NaOH溶液中滴加AlCl3为什么沉淀不溶解
 q522041年前1
q522041年前1 -
 吴月枝 共回答了19个问题
吴月枝 共回答了19个问题 |采纳率78.9%因为最开始NaOH过量,发生的反应是Al3+=4OH- ==AlO2-+2H2O,然后过一段时间,OH-反应完了,此时溶液的溶质是NaAlO2,溶液呈碱性.然后再滴加AlCl3,发生反应Al3+ +3AlO2-+6H2O==4Al(OH)3↓ 反应完后溶液溶质就是NaCl,再滴加AlCl3,虽然要水解使溶液呈酸性,但是程度太微弱,不足以使Al(OH)3溶解.1年前查看全部
大家在问
- 1一点一横两点再一横 目字少一横 己字加三横
- 2已知a,b,c是△ABC的三边,试说明a²-b²-c²-2bc的值是正数,零还是负数?
- 3已知,a,b,c是三角形ABC的三边,试说明a²-b²-c²-2bl的值是正数,零,还是负数.
- 4六年级数学手抄报起什么题目?
- 5课文《紫藤萝瀑布》的问题我不由得停住了脚步.从未见过开得这样盛的藤萝,只见一片辉煌的淡紫色,像一条瀑布,从空中垂下,不见
- 6我的家庭成员有祖父母、父母和我自己 用英文怎么说
- 70.049乘以0.32怎样简便计算
- 8若向量a,向量b的绝对值=1,向量a与向量b的夹角为120°,则实数x为何值时向量a-x向量b的模最小?
- 9求初中英语介词,连词的基本概念.
- 10什么是介词 副词 感叹词 连词最好再举一些单词做例子.
- 11:若|向量a|=|向量b|=2,向量a与向量b的夹角为θ=120°,那么实数x为何值时,|向量a-x
- 12化学反应速率理论可指导怎样提高原料的转化率
- 13被父母骂用英语怎么说翻译:这就是为什么我被父母骂的原因
- 14下表是一组用新鲜洋葱表皮进行的实验处理和结果,请分析回答:
- 152.4立方厘米等于多少升多少毫升
