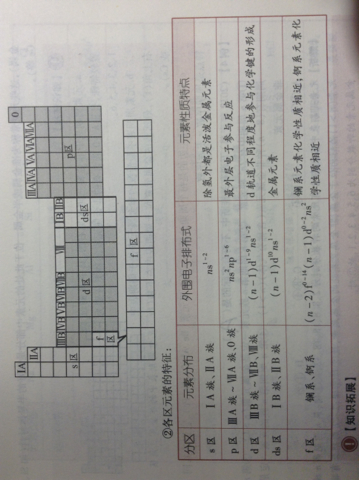
A、B、C、D、E是周期表短周期的五种常见元素,原子序数依次增大.C、D、E最高价氧化物对应的水化物两两均可互相反应生成
 玫瑰俱乐部3222022-10-04 11:39:541条回答
玫瑰俱乐部3222022-10-04 11:39:541条回答(1)C在周期表中的位置是?写出其有色氢化物的一种用途?
(2)B单质的结构式为?写出其氢化物的电子式?
(3)B、E的氢化物混合时的现象为?生成物中含有的化学键是?
(4)C、D最高价氧化物对应的水化物相互反应的离子方程式为?
(5)E的单质与A的一种氧化物反应生成具有漂白性的物质:E的单质与A的另一种氧化物能发生置换反应.有关反映的化学方程式分别为:,

已提交,审核后显示!提交回复
共1条回复
 zz城 共回答了15个问题
zz城 共回答了15个问题 |采纳率73.3%- (1)C在周期表中的位置是 第三周期ⅠA 族
写出其有色氢化物的一种用途 作还原剂
(2)B单质的结构式为 N三N
写出其氢化物的电子式
H
..
H :N:H
..
(3)B、E的氢化物混合时的现象为 有白雾生成
生成物中含有的化学键是 共价键
(4)C、D最高价氧化物对应的水化物相互反应的离子方程式为:
OH- + Al(OH)3 == AlO2- + 2H2O
(5)E的单质与A的一种氧化物反应生成具有漂白性的物质:E的单质与A的另一种氧化物能发生置换反应.有关反映的化学方程式分别为:
Cl2 + H2O HCl + HClO 可逆
Cl2 + H2O2 == 2HCl + O2 - 1年前
相关推荐
- 钠元素位于周期表__周期__族,自然界中钠只能以 的形态存在,主要以
钠元素位于周期表__周期__族,自然界中钠只能以 的形态存在,主要以
钠元素位于周期表__周期__族,自然界中钠只能以 的形态存在,主要以
的形式存在.
二、 钠
1.钠的物理性质
钠是 色有 的 体,硬度较 ,低,密度比水 .
2.钠的化学性质
Na - e- → Na+ 化学反应中表现为 性 007猪1年前2
007猪1年前2 -
 goodhis 共回答了14个问题
goodhis 共回答了14个问题 |采纳率85.7%钠元素位于周期表(第三)周期(ⅠA)族,自然界中钠只能以(化合物)的形态存在,主要以
(盐类)的形式存在.
二、 钠
1.钠的物理性质
钠是(银白)色有(金属光泽)的(固)体,硬度较(小),(熔点)低,密度比水(小).
2.钠的化学性质
Na - e- → Na+ 化学反应中表现为(还原)性.1年前查看全部
- 几个化学问题..求教~~~1.电负性随周期表改变的规律2.为什么有这个规律?(详细点..我笨..)3.几个热力学方程(有
几个化学问题..求教~~~
1.电负性随周期表改变的规律
2.为什么有这个规律?(详细点..我笨..)
3.几个热力学方程(有关G,S的那几个例如什么霍什么等温方程..我一般不记得名字..)怎么来得..?还有ΔG=ΔH+TΔS这个..
4.影响系统对环境做功的大小的量有什么?怎么影响的(就是改变什么引起什么..)?只是通过影响S而使系统对环境做的功改变的么?
以上反应 全部针对 气体 氧化还原(当然能讲讲固体什么的也行啊!)
万分感谢..100分悬赏..猛人追加~~~
话说那个等温自由能修正方程怎么来得?G=G(-)+RTlnJ..貌似是这个吧..我看的是三校合编的无机。。里面也没说。。大哥您吉化的?微积分初等我也学了呃。。问题是一个基本式子都不知道怎么推的? silkage1631年前10
silkage1631年前10 -
 小TAOTAO 共回答了23个问题
小TAOTAO 共回答了23个问题 |采纳率95.7%1,2
电负性(electronegativity)的强弱是指该原子对(价)电子的束缚能力.因此电负性越强,在化学反应中的电子的可能性越大.
电负性的强弱取决于以下几个因素
首先,核电荷数.核对电子的引力主要来源于正电荷与负电荷的吸引力,所以核电荷数越大,引力越大.
同时,电子层数也有影响.内层电子对外曾电子有斥力,抵消核的引力(shielding effect).所以在衡量核对价电子的引力大小时,一般比较有效核电荷数(effective nulear charge,约等于核电荷数-所有内层电子数),在同一周期内,从左至右核电荷增加,电子能数不变,所以有效核电荷数增加,电负性增强.(d电子层和f电子层也会有一定的屏蔽作用(shielding effect),所以一般来说副族金属的电负性变化不大,只是缓慢增加)
其次,考虑到静电力的大小与距离平方成反比,在有效核电荷数相同情况下,价电子离核越远,引力越小,原子的电负性越差.所以在同一族中,电负性自上而下减弱.
因此整体上电负性由右上自左下递减,稀有气体不算.
3 A衡量的是系统所能够做的总功,G衡量系统所能做的总非膨胀功.
定义 G=A+pV
有 dG=dA+p*dV+dp*V
在等温及不做其他功的情况下dA=膨胀功=-p*dV
化简得 dG=Vdp 而根据状态方程V=nRT/p
两边积分得到G=G(-)+RTln(p/p(-))
对于非气态V约等于常数
G=G(-)+V(p-p(-))
为什么G=H+TS
A是系统能够做的总功,U是系统的内能
两者之差就是不能转化为功的能量
U=A+TS 为什么+TS,因为U=W+Q,而A=W=最大功时,Q为所有不能转化成功的内能.而dS=dQ/T,关于从S=-klnΩ到dS=dQ/T的推导,可以去维基百科查一查,比较复杂.
根据H的定义 H=U+pV G=A+pV
带入上式
得G=H-TS
保持温度不变
ΔG=ΔH-TΔS
4 很多因素,比如物质的量,反应完成的程度,反应时的温度等等1年前查看全部
- (2010•崇左)元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
(2010•崇左)元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
请认真分析表中信息,回答下列问题:1 H
氢2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8 O
氧9 F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫17 Cl
氯18 Ar
氩
(1)食盐中含有的非金属元素名称是______,该元素的原子结构示意图为______.
(2)由原子序数为1和8的两种元素组成的化合物是______ (写化学式).
(3)元素周期表同一横行元素的原子序数从左至右逐渐______. philately_lee1年前1
philately_lee1年前1 -
 大灰狼abc 共回答了20个问题
大灰狼abc 共回答了20个问题 |采纳率90%解题思路:(1)食盐中含有两种元素钠元素与氯元素,根据元素周期律:同一周期原子的最外层电子数从左到右逐渐增加.画出Z元素的原子结构示意图.
(2)分别查找1与8号元素的具体名称即可书写.
(3)依据同周期元素的特点解决.(1)食盐中含有两种元素钠元素与氯元素,由汉字的特点以及核外电子的排布情况可知,非金属元素是氯元素.再根据元素周期律:同一周期原子的最外层电子数从左到右逐渐增加.画出Z元素的原子结构示意图.
(2)分别查找1与8号元素可知元素分别是氢元素与氧元素,组成的物质分别是水或双氧水.
(3)依据同周期元素的特点由左向右原子序数依次递增.
故答案为:(1)氯;如图,(2)H2O或H2O2(任选一种即可)(3)增大(合理即可)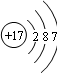
点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;元素的简单分类;化学式的书写及意义.
考点点评: 本题主要考查学生对元素周期律知识的理解与在解题中灵活应用的能力.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请认真分析表中信息,回答下列问题:
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请认真分析表中信息,回答下列问题:
(1)空气中含量最多的元素名称是______,该元素原子的质子数为______.1 H
氢2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8 O
氧9 F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫17 Cl
氯18 Ar
氩
(2)元素周期表同一横行元素的排列规律是从左右______
(3)由原子序数为8和13的两种元素组成的化合物是______ (写化学式). 大眼睛朴1年前1
大眼睛朴1年前1 -
 颜飞路 共回答了15个问题
颜飞路 共回答了15个问题 |采纳率73.3%解题思路:(1)空气中含量最多的元素名称是氮元素;由上表可知,其原子的质子数;
(2)根据元素周期表,从原子序数、核外电子数等方面解答.
(3)根据原子序数为8和13的两种元素从元素周期表中可查出分别是O和Al进行解答;(1)空气中含量最多的元素名称是氮元素;由上表可知,其原子的质子数为7;
(2)根据元素周期表中规律的知识可知元素周期表同一横行元素的排列规律是:从左至右原子序数(核电荷数)依次增大(或由金属逐渐过渡到非金属);
(3)原子序数为8和13的两种元素从元素周期表中可查出分别是O和Al,由这两种元素组成的化合物是A12O3;
答案:(1)氮7
(2)原子序数依次递增
(3)A12O3点评:
本题考点: 元素周期表的特点及其应用;化学式的书写及意义.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
请认真分析表中信息,回答下列问题:1H
1.0082He
4.0033Li
6.9744Be
9.0125B
10.81xC
12.017N
14.018O
16.009F
19.0010Ne
20.1811Na
22.9912Mg
24.31…
…13Al
26.98ySi
28.0915P
30.9716S
32.0617Cl
35.4518Ar
39.95
(1)地壳中含量最多元素的名称是______,该元素原子的质子数为______
(2)从表中查出镁(Mg)元素的相对原子质量为______;
(3)请写出图中x与y的值:x=______,y=______
(4)表中不同种元素最本质的区别是______(填序号):
A.质子数不同B.中子数不同C.相对原子质量不同
(5)序号为11、17的元素的原子结构示意图如图所示,试根据规律,在右边画出序号为12的原子结构示意图______.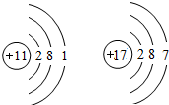
 完美你发1年前1
完美你发1年前1 -
 ymwz 共回答了20个问题
ymwz 共回答了20个问题 |采纳率95%解题思路:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,进行解答;
(2)根据元素周期表提供的信息进行解答;
(3)根据元素周期律:同一周期从左到右原子序数逐渐递增,进行解答;
(4)根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素之间的本质区别是质子数不同,进行解答;
(5)根据题中信息和核外电子层的排布进行解答.(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,可知地壳中含量最多元素的名称是:氧;
从元素周期表中可查出该元素原子的质子数为:8,故答案为:氧;8;
(2)从元素周期表中可查出镁(Mg)元素的相对原子质量为:24.31;故答案为:24.31;
(3)根据元素周期律:同一周期从左到右原子序数依次递增,x介于5与7之间,所以x=6;y介于13 与15 之间,所以y=14;
故答案为:6;14;
(4)根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素之间的本质区别是质子数不同,故选A;
(5)根据题中信息和核外电子层的排布,可知元素序号为12的原子结构示意图为;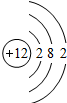 故答案为:
故答案为: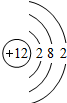 .
.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;元素的概念.
考点点评: 本题主要考查学生对元素周期表知识的理解与应用及原子结构示意图的书写.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具.下表是元素周期表的部分信息.
元素周期律和周期表是学习化学的重要工具.下表是元素周期表的部分信息.
(1)列出的18种元素中,有______种属于金属元素.1 H
氢2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8 O
氧9 F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫17 Cl
氯18 Ar
氩
(2)从原子结构角度看,同一周期元素的原子具有相同的______数.某粒子结构示意图为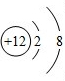 ,该粒子的符号为______、它所属元素位于周期表的第______周期.
,该粒子的符号为______、它所属元素位于周期表的第______周期.
(3)观察硫原子结构示意图,在下图中填空: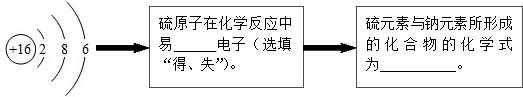
 陈米杰1年前1
陈米杰1年前1 -
 u330id 共回答了14个问题
u330id 共回答了14个问题 |采纳率85.7%解题思路:(1)根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,进行解答;
(2)根据元素周期律:同一周期元素的原子具有相同的电子层数,进行解答;
根据当核电荷数=质子数>核外电子数,为阳离子;由周期表可知其周期数;
(3)根据原子结构示意图的特点:非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;根据化合物化学式的书写步骤:归类→定序→标价→交叉→约简,进行解答.(1)根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,由此可知,列出的18种元素中,有锂,铍、钠,镁,铝 5种金属元素;故答案为:5;(2)根据元素周期律:同一周期元素的原子具有相...
点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律知识与微粒结构示意图的理解,及在解题中应用的能力.1年前查看全部
- 1.旧版化学元素周期表是苏联科学家 门捷列夫的杰作,新版周期表是谁的杰作?
1.旧版化学元素周期表是苏联科学家 门捷列夫的杰作,新版周期表是谁的杰作?
2.新、旧版周期表为何从序号105开始化学元素符号不一样? leew_yu1年前2
leew_yu1年前2 -
 映辉工作室 共回答了16个问题
映辉工作室 共回答了16个问题 |采纳率93.8%1、自从门捷列夫以后,元素周期表在不断发展之中,不是一个人的杰作.
2、原来103号以后元素的发现者有了命名,这体现在旧版周期表上.后来世界上统一对此规定103号以后的元素都根据原子序号命名.
数字 0 1 2 3 4 5 6 7 8 9
字头 Nil Un Bi Tri Quad Pent Hex Sept Oct Enn
104.Unq(Unnilquadium),也称Rf(Rutherfordium),以纪念英国核物理学家卢瑟福
(Ernest Ruther-ford),他获得过1909年诺贝尔化学奖,还发现了原子核和质子(获奖后
的贡献).
105.Unp(Unnilpentium),过去称Ha(Hahnium),以纪念犹太裔德国核物理学家哈恩
(Otto Harn),他发现了铀原子的核裂变反应,是1944年诺贝尔化学奖奖获得者,现在称
Db(Dubnium),是以莫斯科杜布纳(Dubna)核研究中心命名的.
106.Unh(Unnilhexium),也称Sg(Seaborgium),以纪念美国核物理学家西伯格(Gle
nn Theodore Sea-borg,1912-1999),他发现了镎(93),是1951年诺贝尔化学奖获得者
.
107.Uns(Unnilseptium),也称Bh(Bohrium),以纪念丹麦物理学家玻尔(Niels
Henrik David Bohr,1885-1962),他是量子力学的奠基人之一,1922年诺贝尔物理学奖
获得者.
108.Uno(Unniloctium),也称Hs(Hassium),该原子由德国达姆施塔特(Darmstardt
)重离子研究中心获得,用该实验室的所在地黑森州(Hessen)命名.
109.Une(Unnilenntium),也称Mt(Meitnerium),以纪念犹太裔瑞典核物理学家麦
特纳(Lise Meitner,1878-1968),他和哈恩(参见第105号元素)共同发现了铀原子的核
裂变反应.
109号以后的元素不再用科学家的名字命名.1年前查看全部
- 什么元素是活泼的给你一副周期表,如何判断哪些是最活泼的
 kbme1年前0
kbme1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•宁德模拟)X、Y、Z为短周期主族元素,在周期表位置关系如图,X为非金属元素.下列说法正确的是( )
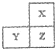 (2012•宁德模拟)X、Y、Z为短周期主族元素,在周期表位置关系如图,X为非金属元素.下列说法正确的是( )
(2012•宁德模拟)X、Y、Z为短周期主族元素,在周期表位置关系如图,X为非金属元素.下列说法正确的是( )
A.Y和Z的最高价氧化物对应的水化物可能均为强酸
B.X的单质一定能与氧气反应
C.原子半径X>Y>Z
D.Y的单质一定不能与稀硫酸反应 叫人怎能不忆江南1年前1
叫人怎能不忆江南1年前1 -
 yysyys3 共回答了13个问题
yysyys3 共回答了13个问题 |采纳率100%解题思路:X、Y、Z为短周期主族元素,由元素在周期表位置可知X处于第二周期,Y、Z处于第三周期.
A、当X为F元素,Z为氯元素、Y为硫元素,符合题意.
B、X为F元素,氟气与氧气不反应.
C、同周期自左而右原子半径减小,同主族自上而下原子半径增大,据此判断.
D、若X为碳元素,Z为硅元素,Y为铝元素,Al与硫酸反应.A、当X为F元素,Z为氯元素、Y为硫元素,二者的最高价氧化物对应的水化物为HClO4、H2SO4,HClO4、H2SO4均为强酸,故A正确;
B、X为F元素,氟气与氧气不反应,故B错误;
C、同周期自左而右原子半径减小,所以原子半径Y>Z,同主族自上而下原子半径增大,所以原子半径Z>X,故原子半径Y>Z>X,故C错误;
D、如X为碳元素,Z为硅元素,Y为铝元素,Al与硫酸反应生成硫酸铝与氢气,故D错误.
故选:A.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 考查元素周期表、元素周期律、元素化合物性质等,难度中等,注意基础知识的掌握.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息. 1 H
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
请认真分析表中信息,回答下列问题:1 H
氢2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8 O
氧9 F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫17 Cl
氯18 Ar
氩
(1)地壳中含量仅次于氧的非金属元素名称是______,该元素原子的质子数为______.
(2)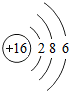 所表示的粒子符号为______,它的最外层电子数为______.
所表示的粒子符号为______,它的最外层电子数为______.
(3)由原子序数为8和13的两种元素组成的化合物是______ (写化学式).
(4)元素周期表同一横行元素的排列规律是:从左至右______.
(5)表中不同种元素最本质的区别是______ (填序号):
A.质子数不同B.中子数不同C.相对原子质量不同. vanx1311年前1
vanx1311年前1 -
 李祥震 共回答了19个问题
李祥震 共回答了19个问题 |采纳率100%解题思路:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,进行解答;该元素原子的质子数从表中查得;
(2)根据当核电荷数=质子数=核外电子数,为原子;进行解答;由结构示意图可知最外层电子数;
(3)从周期表中查出原子序数为8和13的两种元素,写出组成的化合物的化学式即可;
(4)根据元素周期表中每一个周期都从金属元素开始,到非金属元素,到稀有气体元素结束(第一周期从非金属元素氢开始).进行解答;
(5)根据不同种元素之间的本质区别是质子数不同,进行解答.(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,因此地壳中含量仅次于氧的非金属元素名称是硅;该元素原子的质子数为 14;
(2)根据当核电荷数=质子数=核外电子数,为原子;表示的粒子符号为S;由结构示意图可知最外层电子数为 6;
(3)从周期表中查出原子序数为8和13的两种元素分别是O和Al,已知铝元素的化合价为+3价,氧元素的化合价为-2价,利用化合价数值交叉法书写,组成的化合物的化学式为:Al2O3;
(4)根据元素周期表中每一个周期都从金属元素开始,到非金属元素,到稀有气体元素结束(第一周期从非金属元素氢开始)(或原子序数(核电荷数)依次增大);
(5)根据不同种元素之间的本质区别是质子数不同,表中不同种元素最本质的区别是质子数不同;
故答案为:(1)硅; 14;
(2)S;6;
(3)Al2O3 ;
(4)金属元素→非金属元素→稀有气体元素; (或原子序数(核电荷数)依次增大)
(5)A.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;元素的概念.
考点点评: 了解元素周期表的特点及其应用;了解化学式的书写及意义;了解原子结构示意图与离子结构示意图的特点.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
请认真分析表中信息,用化学用语回答下列问题:
(1)地壳中含量最多的金属元素是______,该元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)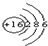 所表示的粒子符号为______,
所表示的粒子符号为______,
(3)标出氯化钠中钠元素的化合价
Cl+1 Na ,
Cl+1 Na
(4)元素的化学性质与原子结构中的______数关系密切;
(5)由原子序数为1、8、12三种元素组成化合物的化学式为______,
(6)元素周期表同一横行元素的排列规律是:从左至右______. yuefree1年前1
yuefree1年前1 -
 tcqls 共回答了12个问题
tcqls 共回答了12个问题 |采纳率91.7%解题思路:(1)地壳中含量最多的金属元素是铝元素,有名称可知该元素属于金属元素,它在化学反应中易失电子;
(2)根据原子结构示意图可知该符号表示的是硫原子的结构示意图;
(3)根据化合价的表示方法解答;
(4)元素的化学性质与原子结构中的最外层电子数关系密切;
(5)根据原子序数为1、8、12三种元素确定组成化合物的化学式;
(6)元素周期表同一横行元素的排列规律是:从左至右原子序数依次递增.(1)地壳中含量最多的金属元素是铝元素,由元素名称可知该元素属于金属元素,它在化学反应中易失电子;
(2)根据原子结构示意图可知该符号表示的是硫原子的结构示意图;
(3)氯化钠中钠元素的化合价为+1价,
(4)元素的化学性质与原子结构中的最外层电子数关系密切;
(5)原子序数为1、8、12三种元素分别是氢、氧、镁,故组成化合物为氢氧化镁;
(6)元素周期表同一横行元素的排列规律是:从左至右子序数依次递增.
答案(1)Al,金属,失;
(2)S;
(3)
+1
NaCl;
(4)最外层电子;
(5)Mg(OH)2;
(6)原子序数依次递增.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;化学符号及其周围数字的意义.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息。
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息。
请认真分析表中信息,回答下列问题:族
周期ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA O 2 3 Li
锂
6.9414 Be
铍
9.0125 B
硼
10.816 C
碳
12.017 N
氮
14.018 O
氧
16.009 F
氟
19.0010Ne
氖
20.183 11Na
钠22.9912Mg
镁24.3113 Al
铝26.9814 Si
硅28.0915 P
磷30.9716 S
硫32.0617 Cl
氯35.4518 Ar
氩39.95
(1)地壳中含量仅次于氧的非金属元素符合是 ▲ 。
(2)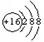 所表示的粒子符号为 ▲ ,它的原子最外层电子数为 ▲ 。
所表示的粒子符号为 ▲ ,它的原子最外层电子数为 ▲ 。
(3)由原子序数为8和12的两种元素组成的化合物是 ▲ (写化学式)。
(4)元素周期表同一横行元素的排列规律是:从左至右 ▲ 。 穿越的小J1年前1
穿越的小J1年前1 -
 周润发是狗 共回答了20个问题
周润发是狗 共回答了20个问题 |采纳率90%(1)Si (2)S 2- 6 (3)MgO (4)核电荷数依次增加等
分析:(1)地壳中含量仅次于氧的非金属元素名称是硅元素;该元素原子的质子数为14;
(2)根据质子数与核外电子数的关系判断粒子的种类:质子数=核外电子数,呈中性,为原子进行解答;
(3)从元素周期表查出8、12号元素,写出化合物的化学式.
(4)从元素周期表可以进行解答.
(1)地壳中含量仅次于氧的非金属元素名称是硅元素;该元素原子的质子数为14;
(2)质子数与核外电子数的关系判断粒子的种类:质子数<核外电子数,带负电,为离子,所表示的粒子符号为S 2- ;它的最外层电子数为6;
(3)从元素周期表查出8、12号元素为氧元素和镁元素,组成的化合物是氧化铝,化学式为MgO .
故答案为:(1)硅; 14;(2)S;6;(3)A1 2 O 3 .
(4)元素周期表同一横行元素的排列规律是从左至右:原子序数(核电荷数)依次增大.1年前查看全部
- 求一张周期表s区p区d区ds区f区划分图.
 为你而妖1年前1
为你而妖1年前1 -
 蜜糖泪 共回答了22个问题
蜜糖泪 共回答了22个问题 |采纳率86.4%1年前查看全部
- 钋(Po)是周期表中第84号元素,是居里夫人在1898年发现的.钋-210属极毒放射性核素.据报道,最近俄罗斯的前特工利
钋(po)是周期表中第84号元素,是居里夫人在1898年发现的.钋-210属极毒放射性核素.据报道,最近俄罗斯的前特工利特维年科的死亡与钋-210的***有关.对钋-210的叙述正确的是
a.钋是一种银白色金属,能在黑暗中发光
b.钋的原子核内有210个中子
c.钋-210原子中中子数与核外电子数之差为126
d.钋-210的摩尔质量为210 g walkingsinger1年前1
walkingsinger1年前1 -
 m7841762 共回答了13个问题
m7841762 共回答了13个问题 |采纳率100%答案A
本题考查的是元素周期率与原子结构的知识.由元素周期表知钋为第六周期ⅥA的元素,据递变规律是银白色金属,具有放射性,所以A对;质量数=质子数+中子数,质量数为210,质子数为84,所以中子数=210-84=126,B错;又核外电子数=质子数,所以中子数-核外电子数=126-84=42,C错;D中摩尔质量的单位为g/mol,错.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息。
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息。
请认真分析表中信息,回答下列问题:H
氢He
氦Li
锂Be
铍B
硼C
碳N
氮O
氧F
氟Ne
氖Na
钠Mg
镁Ar
铝Si
硅P
磷S
硫Cl
氯Ar
氩
(1)地壳中含量仅次于氧的非金属元素名称是 ,该元素原子的质子数为 。
(2)由原子序数为8和13的两种元素组成的化合物是 (写化学式)。
(3)元素周期表同一横行元素的排列规律是:从左至右
(4)表中不同种元素最本质的区别是 (填序号):
A.质子数不同 B.中子数不同 C.相对原子质量不同 五一长假不够长1年前1
五一长假不够长1年前1 -
 龙姓氏 共回答了17个问题
龙姓氏 共回答了17个问题 |采纳率100%(1)元素名称是 硅 ,质子数为 14 。
(2)化合物是 Al 2 O 3 (写化学式)。
(3)从左至右 金属元素→非金属元素→稀有气体元素
(4)本质的区别是 A (填序号):
:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,因此地壳中含量仅次于氧的非金属元素名称是硅;该元素原子的质子数为 14;
(2)根据当核电荷数=质子数=核外电子数,为原子;表示的粒子符号为S;由结构示意图可知最外层电子数为 6;
(3)从周期表中查出原子序数为8和13的两种元素分别是O和Al,已知铝元素的化合价为+3价,氧元素的化合价为-2价,利用化合价数值交叉法书写,组成的化合物的化学式为:Al 2 O 3 ;
(4)根据元素周期表中每一个周期都从金属元素开始,到非金属元素,到稀有气体元素结束(第一周期从非金属元素氢开始)(或原子序数(核电荷数)依次增大);
(5)根据不同种元素之间的本质区别是质子数不同,表中不同种元素最本质的区别是质子数不同;
故答案为:(1)硅; 14;
(2)S;6;
(3)Al 2 O 3 ;
(4)金属元素→非金属元素→稀有气体元素;(或原子序数(核电荷数)依次增大)
(5)A.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
请认真分析表中信息,回答下列问题:
(1)原子序数为15的原子质子数为______,最外层有______个电子;
(2)原子序数为13的原子形成的离子符号为______,画出它的离子结构示意图______
(3)我发现如下规律:①原子序数与元素原子核电荷数在数值上相等;
②______③______. yyt2007021年前1
yyt2007021年前1 -
 背靠路灯 共回答了18个问题
背靠路灯 共回答了18个问题 |采纳率100%解题思路:(1)原子序数=核电荷数=核内质子数,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,据此进行分析解答.
(2)原子序数为13的原子是铝原子,其最外层电子数为3,据此进行分析解答.
(3)根据元素周期律及图表中的信息进行分析解答.(1)原子序数=核电荷数=核内质子数,故原子序数为15的原子质子数为15;其原子核外最外层有5个电子.故填:15;5;
(2)原子序数为13的原子是铝原子,其最外层电子数为3,在化学反应中易失去3个电子而形成带3个单位正电荷的铝离子,其离子符号为:Al3+.故填:Al3+; ;
;
(3)根据元素周期律及图表中的信息可总结:
电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;同一周期原子的最外层电子数从左到右逐渐增加;
故答案为:同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;(或最右纵行的原子结构均为稳定结构;或同一周期原子的最外层电子数从左到右逐渐增加)(答案合理即可).点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.1年前查看全部
- 活泼非金属和金属元素指什么,分布在周期表哪里?
 2283304511年前4
2283304511年前4 -
 zhangxian123 共回答了14个问题
zhangxian123 共回答了14个问题 |采纳率100%主族元素
活泼金属主要在左边1到2两列的元素,包括锂,钠,钾,钙等元素.
活泼非金属主要是氧族和卤素两族,还有就是氢元素.分布在除了惰性气体外的最右边
副族元素,
全是金属元素,里面的铁铬等元素也是化学性质比较活泼的元素1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请你阅读后,回答下列问题:
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请你阅读后,回答下列问题:
(1)11号元素原子在化学反应中形成的离子符号是Na+Na+.1H
+12He
03Li
+14Be
+25B
+36C
+4-47N
+5-38O
-29F
-110Ne
011Na
+112Mg
+213Al
+314Si
+4-415P
+5-316S 17Cl
+7-118Ar
0
(2)请你推测,16号元素的最高正化合价的氧化物的化学式为SO3SO3.
(3)X3+的结构示意图如图所示,该元素位于周期表中第33周期,它与地壳中含量最多的元素形成化合物的化学式为Al2O3Al2O3;
(4)从化合价角度分析,我们可以发现一些规律.请写出其中的一个:同一横行(周期)从左到右元素的最高正化合价逐渐升高同一横行(周期)从左到右元素的最高正化合价逐渐升高. bird5201年前1
bird5201年前1 -
 天媲天蓝 共回答了19个问题
天媲天蓝 共回答了19个问题 |采纳率84.2%(1)可知11号元素是钠元素,最外层有1个电子,容易失去,在化学反应中形成带一个单位正电荷的阳离子,故答案为:Na+
(2)16号元素是硫,最外层有六个电子,故最高正化合价为+6,氧化物的化学式为SO3,故答案为:SO3.
(3)X3+的核外有10个电子,说明X原子有13个电子,质子数为13,是铝元素,故该元素位于周期表中第 3周期,它与地壳中含量最多的元素形成化合物是氧化铝,化学式为 Al2O3;故答案为:3;Al2O3
(4)根据元素周期表中可知:同一横行(周期)从左到右元素的最高正化合价逐渐升高,故答案为:同一横行(周期)从左到右元素的最高正化合价逐渐升高.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
(1)列出的18种元素中,有______种属于金属元素.
(2)从原子结构角度看,同一周期(横行)元素的原子具有相同的______数.
(3)如图为硫原子的结构示意图,硫原子在化学反应中容易______电子,而形成的硫离子的符号为______. quandeshouyu1年前1
quandeshouyu1年前1 -
 wsq624 共回答了15个问题
wsq624 共回答了15个问题 |采纳率100%解题思路:(1)根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,进行解答;
(2)根据元素周期律:同一周期元素的原子具有相同的电子层数,进行解答;
(3)根据原子结构示意图的特点:非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子.(1)根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,由此可知,列出的18种元素中,有锂,铍、钠,镁,铝 5种金属元素;
(2)根据元素周期律:同一周期元素的原子具有相同的电子层数;
(3)硫原子的结构示意图,硫原子在化学反应中容易得到电子;而形成的硫离子的符号为:S2-.
故答案为:(1)5; (2)电子层; (3)得到;S2-.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;元素的简单分类;化学符号及其周围数字的意义.
考点点评: 本题考查学生对元素周期律知识与微粒结构示意图的理解,及在解题中应用的能力.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息。 请认真分析表中信息,回答下列问题:
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息。 
请认真分析表中信息,回答下列问题:
①地壳中含量仅次于氧的非金属元素名称是______,该元素原子的质子数为________。
②所表示的粒子符号为________,它的最外层电子数为_______。
③由原子序数为8和13的两种元素组成的化合物是_________(写化学式)。
④元素周期表同一横行元素的排列规律是:从左至右__________________________。 ccco1年前1
ccco1年前1 -
 阳光下的旮旯 共回答了17个问题
阳光下的旮旯 共回答了17个问题 |采纳率88.2%①硅;14
②S;6
③Al 2 O 3
④元素原子中质子数依次增大1年前查看全部
- 元素周期表,每一横行即(-----):周期表每一横行叫做一个周期.共有----个横行,有----个周期
元素周期表,每一横行即(-----):周期表每一横行叫做一个周期.共有----个横行,有----个周期
每一纵行即(---):周期表的18个纵行中,除8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫做一个族,共16个族 津的男的也挺1年前1
津的男的也挺1年前1 -
 闲话使者 共回答了21个问题
闲话使者 共回答了21个问题 |采纳率100%元素周期表,每一横行即(周期):周期表每一横行叫做一个周期.共有(7)个横行,有(7)个周期每一纵行即(族):周期表的18个纵行中,除8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫做一个族,共16个族.1年前查看全部
- (2012•盐城二模)X、Y、Z、W、Q是原子序数依次增大的5种短5周期主族元素,X、Z同主族,Y、Q同主族,X是周期表
(2012•盐城二模)X、Y、Z、W、Q是原子序数依次增大的5种短5周期主族元素,X、Z同主族,Y、Q同主族,X是周期表中所有元素原子半径最小的,Y是所有元素中非金属性最强的元素,W元素所处周期的序数等于其族序数.下列说法正确的是( )
A.离子半径:Q<Y<Z<W
B.Z3WY6是工业上冶炼W的助熔剂
C.Y与X、Y与Z形成的化合物化学键类型相同
D.Z、Q形成的化合物水溶液通入Y单质可置换出单质Q 爱渺然1年前1
爱渺然1年前1 -
 shanqunzhu 共回答了18个问题
shanqunzhu 共回答了18个问题 |采纳率77.8%解题思路:X、Y、Z、W、Q是原子序数依次增大的5种短5周期主族元素,X是周期表中所有元素原子半径最小的,则X为氢元素,Y是所有元素中非金属性最强的元素,故Y为氟元素;X、Z同主族,Z的原子序数大于氟元素,故Z为Na元素;Y、Q同主族,则Q为Cl元素,W元素原子序数大于钠元素,处于第三周期,所处周期的序数等于其族序数,故W为Al元素,据此解答.X、Y、Z、W、Q是原子序数依次增大的5种短5周期主族元素,X是周期表中所有元素原子半径最小的,则X为氢元素,Y是所有元素中非金属性最强的元素,故Y为氟元素;X、Z同主族,Z的原子序数大于氟元素,故Z为Na元素;Y、Q同主族,则Q为Cl元素,W元素原子序数大于钠元素,处于第三周期,所处周期的序数等于其族序数,故W为Al元素,
A.电子层结构相同核电荷数越大离子半径越小,故离子半径Al3+<Na+<F-,最外层电子数相同电子层越多离子半径越大,故离子半径F-<Cl-,故离子半径Al3+<Na+<F-<Cl-,即W<Z<Y<Q,故A错误;
B.工业上用电解熔融的氧化铝冶炼Al,通常用冰晶石Na3AlF6,降低氧化铝熔点,做助熔剂,故B正确;
C.HF属于共价化合物,只含共价键,NaF属于离子化合物,含有离子键,二者含有化学键类型不同,故C错误;
D.氟气通入NaCl水溶液,与水反应置换出氧气,故D错误;
故选B.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查结构性质位置关系、半径比较、化学键、化学工业等,难度中等,推断元素的解题的关键,BD选项为易错点,知识点较生疏.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请你阅读后,回答下列问题:
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请你阅读后,回答下列问题:
(1)11号元素原子在化学反应中形成的离子符号是Na+Na+.1H
+12He
03Li
+14Be
+25B
+36C
+4-47N
+5-38O
-29F
-110Ne
011Na
+112Mg
+213Al
+314Si
+4-415P
+5-316S 17Cl
+7-118Ar
0
(2)请你推测,16号元素的最高正化合价的氧化物的化学式为SO3SO3.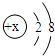
(3)X3+的结构示意图如图所示,该元素位于周期表中第33周期,它与地壳中含量最多的元素形成化合物的化学式为Al2O3Al2O3;
(4)从化合价角度分析,我们可以发现一些规律.请写出其中的一个:同一横行(周期)从左到右元素的最高正化合价逐渐升高同一横行(周期)从左到右元素的最高正化合价逐渐升高. lzt7710201年前1
lzt7710201年前1 -
 硕儿 共回答了15个问题
硕儿 共回答了15个问题 |采纳率80%(1)可知11号元素是钠元素,最外层有1个电子,容易失去,在化学反应中形成带一个单位正电荷的阳离子,故答案为:Na+
(2)16号元素是硫,最外层有六个电子,故最高正化合价为+6,氧化物的化学式为SO3,故答案为:SO3.
(3)X3+的核外有10个电子,说明X原子有13个电子,质子数为13,是铝元素,故该元素位于周期表中第 3周期,它与地壳中含量最多的元素形成化合物是氧化铝,化学式为 Al2O3;故答案为:3;Al2O3
(4)根据元素周期表中可知:同一横行(周期)从左到右元素的最高正化合价逐渐升高,故答案为:同一横行(周期)从左到右元素的最高正化合价逐渐升高.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息. 1H
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
请认真分析表中信息,回答下列问题:1H
氢2He
氦3Li
锂4Be
铍5B
硼6C
碳7N
氮8O
氧9F
氟10Ne
氖llNa
钠12Mg
镁13A1
铝14Si
硅15P
磷16S
硫17Cl
氯18Ar
氩
(1)地壳中含量仅次于氧的非金属元素名称是______,该元素原子核内的质子数为______.
(2)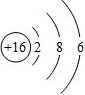 所表示的粒子符号为______.
所表示的粒子符号为______.
(3)由原子序数为8和13的两种元素组成的化合物是______(写化学式).
(4)在元素周期表中存在很多规律,例如:元素的排列规律是按原子序数(或核电荷数)依次增大来进行排列的.你还能总结的一条规律是______. jb3q1年前1
jb3q1年前1 -
 zyfwy2006 共回答了18个问题
zyfwy2006 共回答了18个问题 |采纳率72.2%解题思路:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,进行解答;从元素周期表中可查硅元素的质子数;
(2)根据粒子结构示意图,核电荷数与核外电子数的关系进行解答;
(3)从元素周期表中分别查出原子序数为8和13的两种元素,写出其化合物即可;
(4)根据对元素周期表的观察和元素周期律进行分析解答本题.(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,可知:地壳中含量仅次于氧的非金属元素名称是硅;从元素周期表中可查硅元素的质子数为:14;故答案为:硅;14;
(2)根据粒子结构示意图,可知:核电荷数=核外电子数=16,从元素周期表中可查核电荷数为16的元素符号为:S;
故答案为:S;
(3)从元素周期表中分别查出原子序数为8和13的两种元素分别为:O,Al,其化合物化学式为:Al2O3;故答案为:Al2O3;
(4)根据对元素周期表的观察可总结:元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始);故答案为:每周期都是以稀有气体元素结束(或由金属元素逐渐过渡到非金属元素).点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;地壳中元素的分布与含量;化学式的书写及意义.
考点点评: 本题考查学生对元素周期表中的一些变化规律的归纳和总结以及对元素周期表的应用.1年前查看全部
- 有没有很顺口的化学周期表记忆法
 骑拖把的少年1年前4
骑拖把的少年1年前4 -
 happy_ending 共回答了20个问题
happy_ending 共回答了20个问题 |采纳率85%一价请驴脚拿银,(一价氢氯钾钠银)
二价羊盖美背心.(二价氧钙镁钡锌)
一价钾钠氢氯银,二价氧钙钡镁锌;
三铝四硅五价磷,二三铁、二四碳;
一至五价都有氮,铜汞二价最常见.
正一铜氢钾钠银,正二铜镁钙钡锌;
三铝四硅四六硫,二四五氮三五磷;
一五七氯二三铁,二四六七锰为正;
碳有正四与正二,再把负价牢记心;
负一溴碘与氟氯,负二氧硫三氮磷.
初中常见原子团化合价口决:
负一硝酸氢氧根,负二硫酸碳酸根,
还有负三磷酸根,只有铵根是正一.
氢氦锂铍硼,碳氮氧氟氖;
钠镁铝硅磷,硫氯氩钾钙.
记化合价,我们常用下面的口诀:
一价氢氯钾钠银,二价钙镁钡氧锌.
二铜三铝四七锰,二四六硫二四碳,
三价五价氮与磷,铁有二三要记清.
记金属活动性顺序表可以按照下面的口诀来记:
钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请认真分析表中信息,回答下列问题:
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请认真分析表中信息,回答下列问题:
(1)Ne的化学性质______;决定元素化学性质是根据______.1 H
氢2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8 O
氧9 F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫X Cl
氯18 Ar
氩19 K
钾20 Ca
钙…
(2)地壳中含量最多的元素名称是______,该元素原子的质子数为______;从原子结构角度看,同一周期元素的原子具有相同的______数.某粒子结构示意图为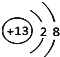 ,该粒子所属元素位于周期表的第______周期.
,该粒子所属元素位于周期表的第______周期.
(3)中科院院士张青莲教授测定核电荷数为63的铕元素的相对原子质量新值为152,则该元素的原子中质子数=______,中子数=______.
(4)元素周期表同一横行元素的排列规律是:从左至右______. 红妹1年前1
红妹1年前1 -
 hocking123 共回答了16个问题
hocking123 共回答了16个问题 |采纳率87.5%解题思路:质子数决定元素种类,最外层电子数决定元素的化学性质,元素周期表是按照原子序数递增的顺序排列的.在原子中,质子数=核电荷数=核外电子数;中子数+质子数=相对原子质量.(1)氖原子最外层电子数为8,不易得失电子,化学性质稳定.最外层电子数决定元素的化学性质;
(2)地壳中含量最多的元素是氧元素,质子数为8;位于同一周期的原子具有相同的电子层数.由粒子结构示意图可知,此粒子是铝离子,是由铝原子失去最外层的3个电子形成的,铝原子有3个电子层,位于第三周期;
(3)在原子中,质子数=核电荷数=核外电子数;中子数=相对原子质量-质子数,所以铕元素的质子数=63;中子数=152-63=89;
(4)同一横行中元素原子的质子数依次增大.
故答案为:(1)稳定;最外层电子数;(2)氧元素;8;电子层;三;(3)63;89;(4)质子数依次增大.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 明确质子数决定元素种类,最外层电子数决定元素的化学性质,元素周期表是按照原子序数递增的顺序排列的,知道原子结构示意图中各部分含义.1年前查看全部
- (2010•南通模拟)元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
(2010•南通模拟)元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
请认真分析表中信息,回答下列问题:
(1)上表18种元素中,属于金属元素有55种;原子序数为8的氧元素原子的质子数为88.1 H
氢2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8O
氧9F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫17 Cl
氯18 Ar
氩
(2)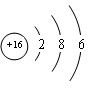 所表示的粒子符号为SS,它的最外层电子数为66.
所表示的粒子符号为SS,它的最外层电子数为66.  沧桑aa1年前1
沧桑aa1年前1 -
 miaoxin_231 共回答了21个问题
miaoxin_231 共回答了21个问题 |采纳率100%解题思路:(1)由汉语名称的“偏旁”可知,属于金属元素的有几种;根据“原子序数=核内质子数”,可知原子的质子数;(2)根据质子数和核外电子数的比较,判断其粒子类型;由图可知其最外层电子数.(1)由汉语名称可知,属于金属元素的有:锂、铍、钠、镁、铝5种元素;根据“原子序数=核内质子数”,可知原子序数为8的氧元素原子的质子数为8;
(2)根据质子数和核外电子数的比较,即质子数=核外电子数,故为硫原子,则粒子符号为S;由结构示意图可知,其最外层电子数为6.
故答为:(1)5;8;(2)S;6.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;元素的简单分类.1年前查看全部
- 1898年,居里夫人发现了放射性元素镭(Ra),因而获得诺贝尔化学奖,已知镭是周期表第7周期IIA族的元素,下列关于镭说
1898年,居里夫人发现了放射性元素镭(Ra),因而获得诺贝尔化学奖,已知镭是周期表第7周期IIA族的元素,下列关于镭说法不正确的是( )
A.在化合物中呈现正二价
B.单质能与水剧烈反应放出氢气
C.碳酸盐难溶于水
D.氢氧化物呈两性 cuiy8951年前1
cuiy8951年前1 -
 鱼米映红椒 共回答了24个问题
鱼米映红椒 共回答了24个问题 |采纳率83.3%解题思路:镭是周期表第7周期IIA族的元素,与Mg、Ca等金属同主族,根据同主族元素对应单质、化合物的性质的相似性和递变性解答该题.A.镭是周期表第7周期IIA族的元素,最外层有2个电子,则在化合物中呈现正二价,故A正确;
B.镭的金属性比Ca、Ba等强,能与水发生剧烈反应,故B正确;
C.已知碳酸镁、碳酸钙难溶于水,根据同主族元素对应单质、化合物的性质的相似性可知,碳酸盐难溶于水,故C正确;
D.Ca、Ba为金属性很强的元素,同主族元素从上到下元素的金属性逐渐增强,则镭对应的氢氧化物具有强碱性,故D错误.
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查同主族元素性质的相似性和递变性,题目难度不大,本题有类推的方法思考.1年前查看全部
- 元素周期表 每行可容纳元素个数周期表每行可容纳元素个数为2,8,8,18,18,32,32,50,50…… 这是为什么呢
元素周期表 每行可容纳元素个数
周期表每行可容纳元素个数为2,8,8,18,18,32,32,50,50……
这是为什么呢 而且 过了50 后 每行的容纳数又会怎么样 禁猎メ天使1年前2
禁猎メ天使1年前2 -
 好吃的毛毛虫 共回答了23个问题
好吃的毛毛虫 共回答了23个问题 |采纳率91.3%2=1^2*2
8=2^2*2
18=3^2*2
32=4^2*2
50=5^2*2
后面是:72=6^2*2,98=7^2*2……1年前查看全部
- 根据电子排布的特点,Cu在周期表属于( )
根据电子排布的特点,Cu在周期表属于( )
A.s区
B.p区
C.d区
D.ds区 aiwa09251年前1
aiwa09251年前1 -
 bluesecret 共回答了17个问题
bluesecret 共回答了17个问题 |采纳率94.1%解题思路:周期表分为s区、p区、d区、ds区、f区,根据Cu的外围电子排布式分析.周期表分为s区、p区、d区、ds区、f区,Cu的外围电子排布式为3d104s1,Cu属于第IB族元素,在周期表中位于ds区,
故选D.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查元素周期表的结构及应用,为高频考点,把握外围电子排布式及最后填充的电子为解答的关键,注重基础知识的考查,题目难度不大.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请认真分析表中信息,回答下列问题:族
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.请认真分析表中信息,回答下列问题:
(1)地壳中含量仅次于氧的非金属元素符号是______.族
周期ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA O 2 3 Li
锂
6.9414 Be
铍
9.0125 B
硼
10.816 C
碳
12.017 N
氮
14.018 O
氧
16.009 F
氟
19.0010Ne
氖
20.183 11Na
钠22.9912Mg
镁24.3113 Al
铝26.9814 Si
硅28.0915 P
磷30.9716 S
硫32.0617 Cl
氯35.4518 Ar
氩39.95
(2)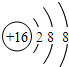 所表示的粒子符号为______,它的原子最外层电子数为______.
所表示的粒子符号为______,它的原子最外层电子数为______.
(3)由原子序数为8和12的两种元素组成的化合物是______(写化学式).
(4)元素周期表同一横行元素的排列规律是:从左至右______. creton1年前1
creton1年前1 -
 yzsamsung 共回答了19个问题
yzsamsung 共回答了19个问题 |采纳率89.5%解题思路:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,正确书写元素符号即可;(2)根据当核电荷数=质子数<核外电子数,为阴离子;离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性;根据结构示意图:圈内的数字表示核内质子数,在原子中,原子序数=质子数=核电荷数=核外电子数,进行解答;(3)查出原子序数为8和12的两种元素,依据书写化学式的方法进行解答;(4)根据元素周期律:同一周期原子的原子序数(或核电荷数或最外层电子数)从左到右逐渐增加,进行解答.(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,所以地壳中含量仅次于氧的非金属元素符号为:Si;故答案为:Si;
(2)根据当核电荷数=质子数<核外电子数,为阴离子;离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性;因此表示的粒子符号为:S2-;
根据结构示意图:圈内的数字表示核内质子数,在原子中,原子序数=质子数=核电荷数=核外电子数,可知图示原子最外层电子数为 6;
故答案为:S2-;6;
(3)原子序数为8和12的两种元素分别是O,Mg,组成的化合物的化学式为:MgO;
故答案为:MgO;
(4)根据元素周期律:同一周期原子的原子序数(或核电荷数或最外层电子数)从左到右逐渐增加,
故答案为:原子序数(或核电荷数).点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期表及元素周期律知识的理解与在解题中灵活应用的能力.1年前查看全部
- 在元素周期表中小题1:周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。ⅡA族后面是第___
在元素周期表中
小题1:周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。
ⅡA族后面是第_______族。所含元素的种类最多的是____________族;
小题2: 同一周期,从左向右,原子半径逐渐_____________,金属性逐渐__________;
小题3:同一主族,从上到下,原子半径逐渐_____________,还原性逐渐__________;
小题4: 同一元素的阴离子半径________相应的原子半径,电子层结构相同的离子,
核电荷数越多,半径越__________。 xifang77771年前1
xifang77771年前1 -
 摇曳VS多姿 共回答了21个问题
摇曳VS多姿 共回答了21个问题 |采纳率100%小题1: 18 15 ⅢB ⅢB
小题2:减小 减弱
小题3: 增大 增强
小题4: 大于 小
小题1: 18 15 ⅢB ⅢB
小题2:减小 减弱
小题3: 增大 增强
小题4: 大于 小1年前查看全部
- (2014•沂水县模拟)元素周期律和周期表是学习化学的重要工具.下表是元素周期表的部分信息. 1 H
(2014•沂水县模拟)元素周期律和周期表是学习化学的重要工具.下表是元素周期表的部分信息.
(1)列出的18种元素中,有______种属于金属元素.1 H
氢2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8 O
氧9 F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫17 Cl
氯18 Ar
氩
(2)从原子结构角度看,同一周期元素的原子具有相同的______数.某粒子结构示意图为 ,该粒子所属元素位于周期表的第______周期.
,该粒子所属元素位于周期表的第______周期.
(3)观察硫原子结构示意图,在下图中填空:
 笨笨虫哥哥1年前1
笨笨虫哥哥1年前1 -
 svd712 共回答了14个问题
svd712 共回答了14个问题 |采纳率85.7%解题思路:(1)由汉语名称的“偏旁”可知,属于金属元素的有几种;
(2)同一周期的元素具有相同的电子层数;
(3)非金属元素的最外层电子多余四个,易得电子,而变成阴离子,金属元素易失去电子而变成阳离子;(1)根据汉语名称带钅字旁的为金属元素,所以共有5种金属元素;
(2)从原子结构角度看,同一周期元素的原子具有相同的电子层数,比较图中的电子和质子数可以知道,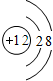 失掉了两个电子,所以其原子应该有三个电子层;
失掉了两个电子,所以其原子应该有三个电子层;
(3)硫元素最外层为六个电子,易得两个电子而变成阴离子,而钠元素的最外层有一个电子已失去而带一个单位的正电荷,变成阳离子,故其组成的化学式为:Na2S;
故答案为:(1)5
(2)电子层; 三;
(3)得;Na2S;点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;元素的简单分类.
考点点评: 了解元素周期表的特点及其应用;了解元素的简单分类;了解原子结构示意图与离子结构示意图的特点.1年前查看全部
- (1)元素周期律和周期表是学习化学的重要工具,回答下列问题:
(1)元素周期律和周期表是学习化学的重要工具,回答下列问题:
①地壳中含量仅次于氧的非金属元素名称是______,该元素原子的质子数为______
②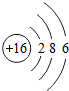 所表示的粒子符号为______,它的最外层电子数为______.
所表示的粒子符号为______,它的最外层电子数为______.
③由原子序数为8和13的两种元素组成的化合物是______(写化学式). 超J超1年前1
超J超1年前1 -
 郡儿公主 共回答了23个问题
郡儿公主 共回答了23个问题 |采纳率87%解题思路:①根据地壳中各元素含量解答;
②根据原子结构示意图各部分含义解答;
③根据化合物化学式的写法解答;①地壳中元素含量由高到低的顺序是氧硅铝铁,仅次于氧的非金属元素名称是硅,硅原子的质子数为14;
②图中粒子质子数为16,核外电子数为16,为硫原子,符号为S;最外层上有6个电子;
③原子序数为8和13的元素分别为氧和铝元素,两元素组成的化合物为氧化铝,已知铝元素的化合价为+3价,氧元素的化合价为-2价,利用化合价数值交叉法书写化学式,化学式为Al2O3
故答案为:①硅、14 ②S、6 ③Al2O3点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;地壳中元素的分布与含量;元素的简单分类;化学式的书写及意义.
考点点评: 本题考查化学式的书写及意义以及原子结构示意图的特点.1年前查看全部
- (2010•抚顺二模)有M、A、B、D、E五种短周期元素,其原子序数依次增大,M元素的原子半径是周期表所有元素中最小的.
 (2010•抚顺二模)有M、A、B、D、E五种短周期元素,其原子序数依次增大,M元素的原子半径是周期表所有元素中最小的.A、B、D、E分别在下表中(周期表的一部分)不同的空格内占有相应的位置,它们的原子序数之和为37.请回答:
(2010•抚顺二模)有M、A、B、D、E五种短周期元素,其原子序数依次增大,M元素的原子半径是周期表所有元素中最小的.A、B、D、E分别在下表中(周期表的一部分)不同的空格内占有相应的位置,它们的原子序数之和为37.请回答:
(1)元素符号:A______,B______,D______,E______;
(2)D、E两种元素分别与M元素形成的最简单化合物中,相对稳定的是______(填化学式),沸点较高的是______(填化学式);
(3)A、B、D、M可组成多种18电子的分子,其中的两种结构可分别表示为M2B-BM2和AM3-BM2,请再写出2种具有18电子的有机物的结构简式______、______;
(4)M、B、D以原子个数比4:2:3所形成的离子化合物,其水溶液呈______性.0.1mol/L该化合物的水溶液中各离子的浓度由大到小的排序是______. supper_cat1年前1
supper_cat1年前1 -
 fjld 共回答了27个问题
fjld 共回答了27个问题 |采纳率88.9%解题思路:有M、A、B、D、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,所以M是H元素;A、B、D、E的原子序数之和为37,设A的原子序数为x,结合它们在周期表中的位置可知:B为x+1,c为x+2,E为x+10,所以x+x+1+x+2+x+10=37,x=6,即A为C,B为N、D为O,E为S,然后结合元素及其单质、化合物的性质来解答.有M、A、B、D、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,所以M是H元素;A、B、D、E的原子序数之和为37,设A的原子序数为x,结合它们在周期表中的位置可知:B为x+1,c为x+2,E为x+10,所以x+x+1+x+2+x+10=37,x=6,即A为C,B为N、D为O,E为S,
(1)由上述分析可知,A为C,B为N、D为O,E为S,
故答案为:C;N;O;S;
(2)D、E元素的最简单氢化物分别是:水、硫化氢,元素的非金属性越强其氢化物越稳定,非金属O>S,故H2O更稳定,水分子之间存在氢键,常温下为液态,二硫化氢为气态,故水的沸点较高,
故答案为:H2O;H2O;
(3)C、N、O、H可组成多种18电子分子,具有18电子的有机物一定含有碳、氢元素,结合电子数目可知,含有碳原子数目为2,则CH3CH3含有18个电子,一个O原子与一个CH2含有电子数相等,则代换可得CH3OH,
故答案为:CH3CH3、CH3OH;
(4)H、N、O以原子个数比4:2:3所形成的离子化合物为NH4NO3,溶液中NH4+水解,溶液呈酸性,水解程度不大NH4+浓度远大于H+,故0.1mol/L该化合物的水溶液中各离子的浓度由大到小的排序是:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;c(NO3-)>c(NH4+)>c(H+)>c(OH-).点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查位置结构性质的关系及应用,元素的推断是解答本题的关键,涉及元素周期律、氢键、盐类水解等,题目难度中等,注意掌握常见10电子、18电子微粒.1年前查看全部
- 核电荷数是决定元素本质的属性,但是如此大的周期表,原子量竟然能如此巧合的顺着质子数增加,仅仅有两处倒减呢?
核电荷数是决定元素本质的属性,但是如此大的周期表,原子量竟然能如此巧合的顺着质子数增加,仅仅有两处倒减呢?
这是仅仅是奇异的巧合,还是说明了原子量和元素本性还是有一定必然的联系的? 阿凡不提之家园1年前3
阿凡不提之家园1年前3 -
 流行伤感 共回答了25个问题
流行伤感 共回答了25个问题 |采纳率80%原子量是主要由质子与中子数决定的,而中子虽然不带电,但在原子核中起着稳定质子的作用(想想看那么多带正电的质子聚在一起怎么不会因静电排斥而分开呢),科学研究表明,原子核中中子数与质子数较为接近时比较稳定,所以核中质子数多时,中子数也必然多,自然原子量就会大了.元素本性还与核外电子、原子半径有关,不过原子半径与核外电子有关,核外电子又与质子数相同,所以集中的表现就为核电荷数是决定元素本质的属性.1年前查看全部
- 宇宙中有地球没有的元素吗如周期表外的元素.地球上有全宇宙都不会有的元素吗,比如周期表最后部分的元素
 男人不都坏1年前4
男人不都坏1年前4 -
 qy2240 共回答了13个问题
qy2240 共回答了13个问题 |采纳率100%自然界的重金属元素都是恒星死亡后的产物,一般来说地球之外存在的元素在地球上都能找到.然而周期表最后的部分的元素都是极不稳定的,会在形成的一瞬间衰变.周期表后面还有人造的元素,这些元素一般在自然条件下很难形成,不过也不排除存在这种极端的环境.1年前查看全部
- 元素周期表巧记谁能给一些及化学公式滴口诀.在这里给大家鞠躬了~周期表真的好难记滴!
 kgbhnhn7744111年前1
kgbhnhn7744111年前1 -
 楚dd的友 共回答了13个问题
楚dd的友 共回答了13个问题 |采纳率76.9%氢 氦 ---- 侵害
锂 铍 硼 碳 氮 氧 氟 氖 ---- 鲤皮捧碳 蛋养福奶
钠 镁 铝 硅 磷 硫 氯 氩 ---- 那美女桂林留绿牙(那美女鬼 流露绿牙)
钾 钙 钪 钛 钒 铬 锰 ---- 嫁改康太反革命
铁 钴 镍 铜 锌 镓 锗 ---- 铁姑捏痛新嫁者
砷 硒 溴 氪 ---- 生气 休克
铷 锶 钇 锆 铌 ---- 如此一告你
钼 锝 钌 ---- 不得了
铑 钯 银 镉 铟 锡 锑 ---- 老把银哥印西堤
碲 碘 氙 ---- 地点仙
铯 钡 镧 铪 ----(彩)色贝(壳)蓝(色)河
钽 钨 铼 锇 ---- 但(见)乌(鸦)(引)来鹅
铱 铂 金 汞 砣 铅 ---- 一白巾 供它牵
铋 钋 砹 氡 ---- 必不爱冬(天)
钫 镭 锕 ---- 很简单了~就是---- 防雷啊1年前查看全部
- 钠铝铁铜银还原性由强到弱的顺序是不是和金属活动周期表有观呀
 天空的雾1年前2
天空的雾1年前2 -
 再掩饰vivian 共回答了18个问题
再掩饰vivian 共回答了18个问题 |采纳率88.9%就这个顺序.钾钙钠镁铝,锌铁锡铅氢,铜贡银铂金1年前查看全部
- 高一化学 周期表a.在周期表中,主族元素所在的族序数等于原子核外电子数b.在周期表中,元素所在的周期数等于原子核外电子层
高一化学 周期表
a.在周期表中,主族元素所在的族序数等于原子核外电子数
b.在周期表中,元素所在的周期数等于原子核外电子层数
这两句哪个正确?为什么呢? 冷冷星儿1年前3
冷冷星儿1年前3 -
 anyue123 共回答了19个问题
anyue123 共回答了19个问题 |采纳率89.5%正确
a应为族序数等于原子核外最外层电子数1年前查看全部
- 根据周期表对角线规则,回答下列问题:
根据周期表对角线规则,回答下列问题:
1.写出氢氧化钡分别与盐酸和氢氧化钠溶液反应的化学方程式.
2.氯化钡溶液和氯化镁溶液可用什么加以鉴别?现象是? hwj_681年前3
hwj_681年前3 -
 1024520 共回答了24个问题
1024520 共回答了24个问题 |采纳率95.8%确定是Ba(OH)2氢氧化钡?不是Be(OH)2氢氧化铍?
1、氢氧化铍Be(OH)2性质类似于氢氧化铝Al(OH)3
Be(OH)2 + 2 HCl = BeCl2 + 2 H2O
Be(OH)2 + 2 NaOH = Na2BeO2 + 2 H2O
2、BeCl2溶液和MgCl2溶液.
鉴别:加入NaOH溶液,产生白色沉淀并且一直不溶解的是MgCl2.
产生白色沉淀,NaOH过量后又溶解的是BeCl21年前查看全部
- 锝为何是放射性元素锝所在周期表附近的元素都有稳定的同位素,而锝却都是放射性元素?一般的理解,放射性元素都是在周期表最后部
锝为何是放射性元素
锝所在周期表附近的元素都有稳定的同位素,而锝却都是放射性元素?一般的理解,放射性元素都是在周期表最后部分吧 佬巴乡1年前1
佬巴乡1年前1 -
 wkc124 共回答了26个问题
wkc124 共回答了26个问题 |采纳率96.2%这个是因为锝的所有的同位素的质量都与前后相邻元素的某个同位素的质量相同,按照Mattauch isobar rule,这是不稳定的1年前查看全部
- 化学的周期表各元素的读音谁会化学元素周期表里面所有元素的读法,比如钙=gai 铁=tie 铜=tong.我要全部的读法拼
化学的周期表各元素的读音
谁会化学元素周期表里面所有元素的读法,比如钙=gai 铁=tie 铜=tong.我要全部的读法拼音就行了,我信高分之下必有莽夫!谁给我最全的我就选谁.【要准,不准乱打】 dxy55551年前3
dxy55551年前3 -
 jining0537 共回答了12个问题
jining0537 共回答了12个问题 |采纳率83.3%元素读音
第一周期元素:1 氢(qīng) 2 氦(hài)
第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi)
第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà) 第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè)
第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)
第六周期元素:55 铯(sè) 56 钡(bèi ) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)
第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 钅卢(lú) 105 钅杜(dù) 106 钅喜(xǐ) 107 钅波(bō) 108 钅黑(hēi) 109 钅麦(mài) 110 钅达(dá) 111 钅仑(lún)
希望能对你有帮助,望采纳1年前查看全部
- 为什么有的化学元素的名称在周期表没有 如;水 高猛甲酸
 叶宣55661年前10
叶宣55661年前10 -
 骑猪上京城 共回答了11个问题
骑猪上京城 共回答了11个问题 |采纳率81.8%囧~~~水和高锰酸钾是化学元素吗?这是化合物啊,水中含有氢元素和氧元素,而高锰酸钾中含有钾、锰、氧元素啊1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息 请认真分析表中信息,回答下列问题:
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息 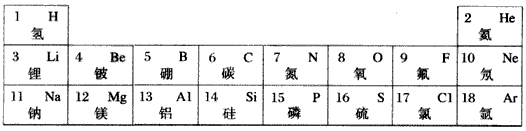
请认真分析表中信息,回答下列问题:
(1)空气中含量最多的元素名称是 ,该元素原子的质子数为 。
(2) 所表示的粒子符号为 ,它的最外层电子数为 。
所表示的粒子符号为 ,它的最外层电子数为 。
(3)由原子序数为8和13的两种元素组成的化合物是 (写化学式)。
(4)元素周期表同一横行元素的排列规律是从左至右 。 jing76041年前1
jing76041年前1 -
 距离仙境10米 共回答了13个问题
距离仙境10米 共回答了13个问题 |采纳率107.7%(1)N;7
(2)S;6
(3)A1 2 O 3
(4)原子序数(核电荷数)依次增大、(或由金属逐渐过渡到非金属)(合理即可)1年前查看全部
- 元素推断题a.b.c.d四种元素在周期表分别处于元素x的四周 已知x的最高价氧化物x2o5(o为氧).且五种元素中有其中
元素推断题
a.b.c.d四种元素在周期表分别处于元素x的四周 已知x的最高价氧化物x2o5(o为氧).且五种元素中有其中一种元素的原子半径是他们所处同族中最小的.
1.a-- b--
c-- d---
2.其最高价氧化物对应水化物
3.其气态化合物
(五分钟内答出追加20分) adbikf1年前2
adbikf1年前2 -
 失落的曼陀罗 共回答了20个问题
失落的曼陀罗 共回答了20个问题 |采纳率95%1.a--N b--As
c--Si d---S
2 HNO3 H3AsO4 H4SiO4 H2SO4
3 NH3 AsH3 SiH4 H2S1年前查看全部
- 高一化学必修二第一章规律总结就是元素周期律,周期表那些递变性,比较稳定性,酸性…越全越好,
 chenkesheng1年前1
chenkesheng1年前1 -
 _小猪鲁鲁_ 共回答了15个问题
_小猪鲁鲁_ 共回答了15个问题 |采纳率93.3%主族元素同一周期中,元素的碱性从左到右递减,酸性从左到右递增,原子半径随着原子序数的增加而减小.在同一族中,元素的碱性从上到下递增,酸性从上到下递减,原子半径随着原子序数的增加而增大.1年前查看全部
- 利用周期表判断N和Cl的非金属性强弱
利用周期表判断N和Cl的非金属性强弱
Cl的上一周期同主族元素是F,F原子序数比N大,F非金属性〉N
且F〉Cl.
然后该怎么判断啊?. wuyzhang1年前1
wuyzhang1年前1 -
 孙oo兵 共回答了17个问题
孙oo兵 共回答了17个问题 |采纳率82.4%原子半径等数据判断1年前查看全部
- 下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题
下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是______(写出元素名称),请设计一个简单的实验证明这一结论______.纵行 1 18 横行 1 A 2 13 14 15 16 17 2 B C D E 3 F G H I
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
______
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
(4)I元素在周期表里的位置在第______周期、第______族.
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C 1 上发生反应的电极反应式______.
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(K W =1.00×10 -14 ) fiank21年前1
fiank21年前1 -
 叔梁圪 共回答了13个问题
叔梁圪 共回答了13个问题 |采纳率84.6%根据元素周期表知,A是H元素,B是C元素,C是N元素,D是O元素,E是F元素,F是Na元素,G是Al元素,H是Si元素,I是Cl元素;
(1)B、C两元素中非金属性较强的是氮元素,非金属的非金属性越强,其最高价氧化物的水化物酸性越强,用碳酸钠或碳酸氢钠与稀硝酸反应,观察是否有有无色无味的气体产生,如果能产生无色无味的气体,则说明氮元素的非金属性大于碳元素,
故答案为:氮;取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO 3 +NaHCO 3 ═NaNO 3 +H 2 O+CO 2 ↑,或2HNO 3 +Na 2 CO 3 ═2NaNO 3 +H 2 O+CO 2 ↑;
(2)氧化铝是两性氧化物,氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子反应方程式为:Al 2 O 3 +2OH - ═2AlO 2 - +H 2 O,故答案为:Al 2 O 3 +2OH - ═2AlO 2 - +H 2 O;
(3)氧元素和氢元素能形成原子个数比为1:1和1:2的两种共价化合物H 2 O 2 和H 2 O,氧元素元素还能钠元素构成离子个数比为1:1和1:2的两种离子化合物Na 2 O 2 和Na 2 O,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na 2 O 2 +2H 2 O═4NaOH+O 2 ↑,故答案为:2Na 2 O 2 +2H 2 O═4NaOH+O 2 ↑;
(4)氯元素的原子结构示意图为:
,所以氯元素处于第三周期,第VIIA族,故答案为:三;VIIA;
①电解时阳极上氯离子放电生成氯气,电极反应式为:2Cl - -2e - =Cl 2 ↑,故答案为:2Cl - -2e - =Cl 2 ↑;
②设氢氧根离子浓度为xmol/L,电池反应式为:
2Cl - +2H 2 O=H 2 ↑+Cl 2 ↑+2OH -
22.4L 2mol
0.112L0.1xmol
x=
0.112L×2mol
22.4L×0.1mol =0.1,溶液中c(H + )=
1 0 -14
0.1 mol/L=10 -13 mol/L,所以pH=13,
故答案为:13.1年前查看全部
大家在问
- 1仿写 你不能左右天气,但你可以改变心情;你不能改变容貌,但你可以展现笑容.
- 2如右图,大扇形半径是6厘米,小扇形半径是3厘米.求阴影部分的面积.
- 3设地球的质量为M,半径为R,自转角速度为ω,万有引力常量为G,同步卫星离地心高度为r,地表重力加速
- 4A、B、C三种物质各15g,当它们相互反应完成时,生成30g新物质D.若再增加10gC,它们又继续反应到完成时,A与C恰
- 510分之9-8分之5÷7分之5
- 6已知关于a的三次多项式中,常数项为-1,一次项系数为2,二次项系数为0三次项系数为5,该多项式为?急
- 7关于劳动的宋词.是宋词!不是诗词(强调)老师布置的作业啊!
- 8化合价的数值的多少问题O Na Mg N原子中在化合物中呈现化合价的数值最多的是谁. 清说明为什么,
- 9铅酸电瓶英文缩写单位新购的太阳能庭院灯蓄电瓶上面标了JP-DfS-65-12,请问,交替电瓶,和铅酸电瓶的英文缩写是什么
- 10be necessary for的用法
- 11Linda is writing a litter to her pen pal.(改否定句)
- 12查字减一画是什么字?我会非常感激的!
- 13救命啊..二元一次方程组!已知二元一次方程2x+3y=m+1 3x-y=2m-3的解互为相反数,则m等于?如果来不及就直
- 14ProE 如何进行面的装配?把8个面装配成一个4棱体,下口为矩形,上口也为矩形,两个矩形大小不一样,并且有空间上的角度.
- 151毫米镀锌板 孔距是5毫米孔的直径是5毫米.每平方的重量是多少?