放热反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mo
 jerry_xujin2022-10-04 11:39:541条回答
jerry_xujin2022-10-04 11:39:541条回答A.K2 和K1的单位均为mol/L
B.K2<K1
C.c2(CO)=c2(H2O)
D.c1(CO)>c2(CO)

已提交,审核后显示!提交回复
共1条回复
 暮春秋色 共回答了19个问题
暮春秋色 共回答了19个问题 |采纳率94.7%- 解题思路:A.根据CO(g)+H2O(g)⇌CO2(g)+H2(g)写出平衡常数表达式,则K的单位不是mol/L;
B.正向反应是放热反应,升高温度平衡向逆反应方向移动,据此判断;
C.t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,浓度之比等于化学计量数之比1:1,二者转化率相等,据此判断;
D.升高反应体系的温度至t2时,平衡逆向进行,CO浓度增大.A、由化学平衡CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,则平衡常数表达式K=
c(CO2)c(H2)
c(CO)c(H2O),所以K的单位为1,不是mol/L,故A错误;
B、升高反应体系的温度至t2时,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行,K2<K1,故B正确;
C、t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,浓度之比等于化学计量数之比1:1,二者转化率相等,故新平衡状态下,c2(CO)和c2(H2O)仍相同,故C正确;
D、升高反应体系的温度至t2时,平衡逆向进行,所以c2(CO)>c1(CO),故D错误;
故选BC.点评:
本题考点: 化学平衡常数的含义.
考点点评: 本题考查了化学平衡的影响因素、化学平衡常数等,难度不大,注意平衡常数只是随温度变化. - 1年前
相关推荐
- 放热反应CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1
放热反应CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)=1.0mol/L,其平衡常数为K 1 .升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则( ) A.K 2 和K 1 的单位均为mol/L B.K 2 <K 1 C.c 2 (CO)=c 2 (H 2 O) D.c 1 (CO)>c 2 (CO)  半条口相糖1年前1
半条口相糖1年前1 -
 jjy2992789 共回答了18个问题
jjy2992789 共回答了18个问题 |采纳率83.3%A、由化学平衡CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)△H<0,则平衡常数表达式K=
c(C O 2 )c( H 2 )
c(CO)c( H 2 O) ,所以K的单位为1,不是mol/L,故A错误;
B、升高反应体系的温度至t 2 时,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行,K 2 <K 1 ,故B正确;
C、t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)=1.0mol/L,浓度之比等于化学计量数之比1:1,二者转化率相等,故新平衡状态下,c 2 (CO)和c 2 (H 2 O)仍相同,故C正确;
D、升高反应体系的温度至t 2 时,平衡逆向进行,所以c 2 (CO)>c 1 (CO),故D错误;
故选BC.1年前查看全部
- 放热反应CO(g)+H 2 O(g) CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1
放热反应CO(g)+H 2 O(g) 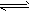 CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)= 1.0mol·L -1 ,其平衡常数为K 1 ,升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 [ ]
CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)= 1.0mol·L -1 ,其平衡常数为K 1 ,升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 [ ]A.K 2 和K 1 的单位均为mol·L -1
B.K 21
C.c 2 (CO)=c 2 (H 2 O)
D.c 1 (CO)>c 2 (CO) chongling_821年前1
chongling_821年前1 -
 yuehouse 共回答了24个问题
yuehouse 共回答了24个问题 |采纳率100%BC1年前查看全部
- 放热反应CO(g)+H 2 O(g) CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1
放热反应CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)=1.0 mol·L -1 ,其平衡常数为K 1 。升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 ( )
CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)=1.0 mol·L -1 ,其平衡常数为K 1 。升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 ( )A.K 2 和K 1 的单位均为 mol·L -1 B.K 2 >K 1 C.c 2 (CO)=c 2 (H 2 O) D.c 1 (CO)>c 2 (CO)  cjb00001年前1
cjb00001年前1 -
 yijian1976 共回答了20个问题
yijian1976 共回答了20个问题 |采纳率95%C
温度升高反应向逆反应方向移动,平衡常数为K 21 ,均无单位,c 1 (CO) 2 (CO),C正确。 1年前查看全部
- 放热反应CO(g)+H 2 O(g) CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1
放热反应CO(g)+H 2 O(g) 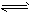 CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)=1.0mol·L -1 ,其平衡常数为K 1 。升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 [ ]
CO 2 (g)+H 2 (g)在温度t 1 时达到平衡,c 1 (CO)=c 1 (H 2 O)=1.0mol·L -1 ,其平衡常数为K 1 。升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 [ ]A.K 1 =K 2
B.K 2 >K 1
C.c 2 (CO)=c 2 (H 2 O)
D.c 1 (CO)>c 2 (CO) 鸟空湿妹1年前1
鸟空湿妹1年前1 -
 lcw7981 共回答了17个问题
lcw7981 共回答了17个问题 |采纳率100%C1年前查看全部
- 放热反应CO(g)+H 2 O(g) CO 2 (g)+H 2 (g)在温度t 1 时达到平衡, c 1 (CO)=c
放热反应CO(g)+H 2 O(g)
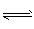 CO 2 (g)+H 2 (g)在温度t 1 时达到平衡, c 1 (CO)=c 1 (H 2 O)=1.0 mol·L -1 ,其平衡常数为K 1 。其他条件不变升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 [ ]
CO 2 (g)+H 2 (g)在温度t 1 时达到平衡, c 1 (CO)=c 1 (H 2 O)=1.0 mol·L -1 ,其平衡常数为K 1 。其他条件不变升高反应体系的温度至t 2 时,反应物的平衡浓度分别为c 2 (CO)和c 2 (H 2 O),平衡常数为K 2 ,则 [ ]A.若增大CO浓度,K 2 和K 1 都增大
B.c 2 (CO)=c 2 (H 2 O)
C.K 2 >K 1
D.c 1 (CO)>c 2 (CO) 61035251年前1
61035251年前1 -
 leavesspring 共回答了22个问题
leavesspring 共回答了22个问题 |采纳率77.3%B1年前查看全部
- 放热反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mo
放热反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol•L-1,其平衡常数为K1.其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A. 若增大CO浓度,K2和K1都增大
B. K2>K1
C. c2(CO)=c2(H2O)
D. c1(CO)>c2(CO) z_starry1年前1
z_starry1年前1 -
 见贤思齐1995 共回答了16个问题
见贤思齐1995 共回答了16个问题 |采纳率87.5%解题思路:A.平衡常数只与温度有关,与物质的浓度无关;
B.正向反应是放热反应,升高温度平衡向逆反应方向移动,据此判断;
C.t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,浓度之比等于化学计量数之比1:1,二者转化率相等,据此判断;
D.升高反应体系的温度至t2时,平衡逆向进行,CO浓度增大.依据化学平衡CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行;
A、平衡常数只与温度有关,与物质的浓度无关,增大CO的浓度,平衡向正反应方向移动,平衡常数不变,故A错误;
B、升高反应体系的温度至t2时,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行,K2<K1,故B错误;
C、t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,浓度之比等于化学计量数之比1:1,二者转化率相等,故新平衡状态下,c2(CO)和c2(H2O)仍相同,故C正确;
D、升高反应体系的温度至t2时,平衡逆向进行,所以c2(CO)>c1(CO),故D错误;
故选C.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查了化学平衡的影响因素、化学平衡常数等,难度不大,注意平衡常数只是随温度变化.1年前查看全部
大家在问
- 1初中物理关于摩擦力的题目如图,物体A重20N,物体B重20N,A与B,A与地面间的最大静摩擦均为它们相互压力的0.4倍,
- 2下列关于神经系统活动的叙述,错误的是 [ ] A.条件反射是在非条件反射
- 3实际功率与额定功率怎么理解
- 42月4日,一根电线长240米,把它截成3段,使第一段比第二段长20米,第三段是第一段的2倍,这三段电线各长多少米呢?
- 5谁帮我写一份自我介绍是用英语写 姓名:李文凯 性别:男 年龄:19 习惯,爱好这些随便写 我
- 6某商品的需求函数为Q=Q(P)=75-P的平方
- 7一道语文题那是一个晴朗的秋日,天空明净地没有一丝流云.是什么描写?漏了一句:也没有风,哪怕是一丝微风也没有。作用是?!到
- 8如果你的父母不在 if your parents —— 英文
- 9平均速度物理公式的推导我想请问一下,下面这个求平均速度的公式:平均速度=2×V1×V2/(V1+V2)是怎样推导出来的?
- 10一个物体在真空中振动,是否会产生声音?
- 11(2014•海淀区二模)下列变化中,属于化学变化的是( )
- 12面对困难每个人都迸发出坚定的信念.改为双重否定句.
- 13季羡林《我的童年》中 作者在文章中提到了现在儿童的生活,表达了作者什么样的看法
- 14如图所示,小灯泡上标有“2.5V 1.25W’字样,变阻器R2的阻值范围为0-10欧,电源电压保持不变.求:
- 15一个“皮”,左边是“〈〈〈”,打个成语
