火箭推进剂中用N2H4与H2O2的优点
 updying2022-10-04 11:39:542条回答
updying2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 mugua2000 共回答了35个问题
mugua2000 共回答了35个问题 |采纳率88.6%- N2H4和H2O2反应剧烈,产生大量热能,产物有N2,H2,H2O,O2.
而H2和O2进一步燃烧形成H20.
在高温作用下H20汽化形成巨大反推力. - 1年前
 李家成 共回答了19个问题
李家成 共回答了19个问题 |采纳率- 放出大量的热,热效率高
生成物在高温下全是气体,推进力大
产物无毒无害。化学式N2H4+H2O2=(点燃)=N2+2H2+O2=N2+2H2O - 1年前
相关推荐
- NH4Cl04(高锰酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成物质是?A.CO2 B.Cl2 C.O2 D.N
NH4Cl04(高锰酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成物质是?A.CO2 B.Cl2 C.O2 D.N2
 ivyshen1年前3
ivyshen1年前3 -
 zhiguoma 共回答了5个问题
zhiguoma 共回答了5个问题 |采纳率80%d1年前查看全部
- 火箭推进剂的成分是什么?
 海那边我的身影1年前1
海那边我的身影1年前1 -
 forever爱dd 共回答了15个问题
forever爱dd 共回答了15个问题 |采纳率86.7%在液体燃料的火箭中是不会用铝的.
在固体燃料的火箭中,固体推进剂有聚氨酯、聚丁二烯、端羟基聚丁二烯、硝酸酯增塑聚醚等.也有用复合推进剂,由氧化剂,金属燃料,和高分子粘结剂组成.
1.氧化剂 最常用的是:过氯酸铵,其他的有过氯酸钾、钠、锂,硝酸铵、钾、钠、锂;
2.金属燃料 最常用的是铝,其他的有氢,碳,锂,铍,硼,镁……;
3.粘结剂 使氧化剂和金属燃料等固体粒子粘结在一起成为弹性基体,并提供C,H等燃料元素.有聚氯乙烯,聚氨酯,聚丁二烯等.
另外还有固化剂、增塑剂等.1年前查看全部
- (2013•庆阳)NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
(2013•庆阳)NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
A.CO2
B.Cl2
C.O2
D.N2 2005新概念1年前1
2005新概念1年前1 -
 徐威xu 共回答了11个问题
徐威xu 共回答了11个问题 |采纳率63.6%解题思路:根据已有的知识进行分析,化学反应前后元素的种类不变,据此解答.NH4ClO4中含有N、H、Cl、O四种元素,则生成的物质也含有这些元素;
A、CO2中含有碳元素,而NH4ClO4中不含有碳元素,故不可能生成二氧化碳,故A错误;
B、NH4ClO4中含有Cl元素,故可能生成氯气,故B正确;
C、NH4ClO4含有O元素,故可能生成氧气,故C正确;
D、NH4ClO4含有N元素,故可能生成氮气,故D正确;
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了质量守恒定律的应用,完成此题,可以依据已有的知识进行.1年前查看全部
- 一种火箭推进剂是由液态肼(N2H4)和液态双氧水组成,当它们混合反应时,即产生大量氮气和水蒸汽,并放出大量热.已知0.4
一种火箭推进剂是由液态肼(N2H4)和液态双氧水组成,当它们混合反应时,即产生大量氮气和水蒸汽,并放出大量热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸汽,放出256.65kJ的热量.
(1)写出肼(N2H4)的电子式______;
(2)反应的热化学方程式为______;
(3)反应中的氧化剂是______;
(4)当有1mol氮气生成时,反应转移的电子数为______NA;
(5)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______. limingchenhui1年前0
limingchenhui1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 火箭推进剂中用N2H4与H2O2的优点
火箭推进剂中用N2H4与H2O2的优点
N2H4与H2O2反应的优点。 qdplay1年前1
qdplay1年前1 -
 樱花琪琪 共回答了13个问题
樱花琪琪 共回答了13个问题 |采纳率100%C2H8N2+2N2O4 = 2CO2+3N2+4H2O
放出大量的热,热效率高
生成物在高温下全是气体,推进力大
产物无毒无害1年前查看全部
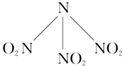
- (2011•安徽)科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是10
 (2011•安徽)科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
(2011•安徽)科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
A.分子中N、O间形成的共价键是非极性键
B.分子中四个氧原子共平面
C.该物质既有氧化性又有还原性
D.15.2g该物质含有6.02×1022个原子 starly19791年前1
starly19791年前1 -
 jb7991 共回答了11个问题
jb7991 共回答了11个问题 |采纳率100%解题思路:根据信息中该分子中N-N-N键角都是108.1°及N(NO2)3的结构应与氨气相同,则分子中四个氮原子不共平面,利用元素的化合价来分析其性质,利用是否同种元素之间形成共用电子对来分析极性键.A、N(NO2)3是一种共价化合物,N、O原子之间形成的化学键是极性键,故A错误;
B、根据题干信息知该分子中N-N-N键角都是108.1°,推知分子中4个氮原子在空间呈四面体型,
所以分子中四个氧原子不可能共平面,故B错误;
C、该分子中的氮元素为+3价,+3价氮既有氧化性又有还原性,故C正确;
D、N(NO2)3的相对分子质量为152,15.2 g N(NO2)3为0.1mol,该物质的分子中所含原子为1NA即6.02×1023个原子,故D错误.
故选:C.点评:
本题考点: 极性键和非极性键;物质分子中的原子个数计算;键能、键长、键角及其应用.
考点点评: 作为2011年的安徽理综高考题,题干信息比较新颖,同时考查大家熟悉的化学键、分子结构、氧化还原反应和物质的量的相关计算.1年前查看全部
- 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图已知该分子中 N-N-N 键
 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图已知该分子中 N-N-N 键角都是108.1°,下列有关 N(NO2)3 的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图已知该分子中 N-N-N 键角都是108.1°,下列有关 N(NO2)3 的说法正确的是( )
A.分子中 N、O 间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.15.2g 该物质含有 6.02×1022个原子 风冰云冻1年前1
风冰云冻1年前1 -
 旅人倚征棹 共回答了12个问题
旅人倚征棹 共回答了12个问题 |采纳率91.7%解题思路:A.根据不同元素形成的共价键为极性键;同元素形成的共价键为非极性键;
B.根据信息中该分子中N-N-N键角都是108.1°及N(NO2)3的结构应与氨气相似,则分子中四个氮原子不共平面;
C.利用元素的化合价来分析其性质;
D.根据该物质的物质的量以及一个物质中含有10个原子来计算.A、N(NO2)3是一种共价化合物,N、O原子之间形成的化学键是极性键,故A错误; B、该分子中N-N-N键角都是108.1°,推知分子中4个氮原子在空间呈四面体型,所以分子中四个氧原子不可能共平面,故B错误;C...
点评:
本题考点: 极性键和非极性键;重要的氧化剂;重要的还原剂.
考点点评: 本题题干信息比较新颖,同时考查大家熟悉的化学键、分子结构、氧化还原反应和物质的量的相关计算.1年前查看全部
- 物质N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
物质N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
A.N(NO2)3由三种元素组成
B.N(NO2)3属于有机高分子化合物
C.一个N(NO2)3分子中含有8个原子
D.N(NO2)3中氮元素的质量分数为36.8% 永在我鑫1年前1
永在我鑫1年前1 -
 seaeyes 共回答了29个问题
seaeyes 共回答了29个问题 |采纳率89.7%解题思路:A、根据N(NO2)3化学式的含义进行分析判断.
B、有机高分子化合物是指相对分子质量很大的有机物,简称有机高分子.
C、根据物质的构成情况进行分析判断.
D、根据化合物中元素的质量分数的计算方法来分析.A.N(NO2)3是由氮、氧两种元素组成的,故选项说法错误.
B.N(NO2)3是不含碳的化合物,不属于有机物,不是有机高分子化合物,故选项说法错误.
C.1个N(NO2)3分子是由4个氮原子和6个氧原子构成的,则每个N(NO2)3分子中含有4个氮原子,故选项说法错误.
D.N(NO2)3中氮元素的质量分数为
14×4
14+(14+16×2)×3×100%≈36.8%,故选项说法正确.
故选D.点评:
本题考点: 化学式的书写及意义;有机物与无机物的区别;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- N(NO2)3是科学家近年来新发现的一种新型火箭推进剂的原料.下列有关说法正确的是______
N(NO2)3是科学家近年来新发现的一种新型火箭推进剂的原料.下列有关说法正确的是______
A.N(NO2)3由三种元素组成B.N(NO2)3属于有机物
C.N(NO2)3的相对分子质量152D.N(NO2)3中氮、氧元素的质量比为______. 伤心的天使21年前1
伤心的天使21年前1 -
 北冥指间沙 共回答了17个问题
北冥指间沙 共回答了17个问题 |采纳率94.1%解题思路:A、根据N(NO2)3化学式的含义进行分析判断.
B、根据有机物是含有碳元素的化合物分析.
C、根据相对分子质量为组成分子的各原子的相对原子质量之和,进行分析判断.
D、根据化合物中元素质量比的计算方法来分析.A、N(NO2)3是由氮、氧两种元素组成的,故选项说法错误.
B、N(NO2)3中不含有碳元素,不属于有机物,故选项说法错误.
C、N(NO2)3的相对分子质量为14+(14+16×2)×3=152,故选项说法正确.
D、N(NO2)3中氮与氧两种元素的质量比为(14×4):(16×2×3)=7:12.
故答案为:C;7:12.点评:
本题考点: 化学式的书写及意义;有机物与无机物的区别;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义、有关计算进行分析问题、解决问题的能力.1年前查看全部
- 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1
 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°.下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°.下列有关N(NO2)3的说法正确的是( )
A.分子中N、O原子间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.分子中四个氮原子围成一个空间正四面体 bj16020801年前1
bj16020801年前1 -
 顶ll楼主 共回答了13个问题
顶ll楼主 共回答了13个问题 |采纳率84.6%解题思路:该分子中N-N-N键角都是108.1°,其结构类似于氨气分子,将氨气分子中H原子换为-NO2即可得到该物质分子结构,
A.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;
B.该物质分子为三角锥形结构;
C.该分子中的N元素化合价为+5价和-3价;
D.该物质分子为三角锥形结构.该分子中N-N-N键角都是108.1°,其结构类似于氨气分子,将氨气分子中H原子换为-NO2即可得到该物质分子结构,
A.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,所以N、O原子之间形成的共价键是极性键,故A错误;
B.该物质分子为三角锥形结构,所以四个N原子不共面,故B错误;
C.该分子中的N元素化合价为+5价和-3价,所以该物质既有氧化性又有还原性,故C正确;
D.该分子中四个氮原子围成一个空间三角锥形结构,故D错误;
故选C.点评:
本题考点: 不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查分子空间构型、物质的性质、极性键和非极性键等知识点,侧重考查基本理论、基本概念,会根据已知知识采用知识迁移的方法进行分析是解本题关键,注意该物质中N元素化合价判断,为易错点.1年前查看全部
- (2012•山东)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(2012•山东)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是______.
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)⇌2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为______(填“吸热”或“放热”)反应.
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是______.若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=______ mol/(L•s)-1.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是______(用离子方程式表示).向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为[a/200b][a/200b]mol•L-1.(NH3•H2O的电离平衡常数取Kb=2×10-5 mol•L-1)
 李京BJ1年前1
李京BJ1年前1 -
 蓝天下的傻瓜 共回答了18个问题
蓝天下的傻瓜 共回答了18个问题 |采纳率94.4%解题思路:(1)依据化学反应前后元素化合价变化分析判断,元素化合价降低的物质做氧化剂;
(2)二氧化氮是红棕色气体,四氧化二氮气体是无色气体,依据平衡移动原理分析判断;升高温度,平衡向吸热反应方向移动;
(3)K=
;化学平衡常数只与温度有关,与物质的浓度无关,根据v=[△c/△t] 计算NO2的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算,得到四氧化二氮的反应速率v(N2O4);c2(NO2) c(N2O4)
(4)依据铵根离子水解分析回答;依据同粒子效应,一水合氨对铵根离子水解起到抑制作用;依据一水合氨的电离平衡常数计算得到氨水浓度.(1)反应(I)中,N2O4(l)中N元素得电子化合价降低,所以N2O4(l)是氧化剂,故答案为:N2O4;
(2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中;
a、密度等于质量除以体积,平衡体系质量不变,反应体积增大,密度在反应过程中减小,密度不变说明反应达到平衡,故a符合;
b、反应的焓变和反应物与生成物能量总和之差计算,与平衡无关,故b不符合;
c、图象只表示正反应速率变化,不能证明正逆反应速率相同,故c不符合;
d、N2O4(l)转化率不变,证明反应达到平衡,故d符合;
示意图正确且能说明反应达到平衡状态的是ad;K=
c2(NO2)
c(N2O4),化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;v(NO2)=[△c/△t]=
0.6mol
1L
3s=0.2mol/L.s,则v(N2O4)=[1/2]v(NO2)=0.1mol/L.s;
故答案为:ad;不变;0.1;
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH4++H2O⇌NH3•H2O+H+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将a mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-);NH3•H2O的电离平衡常数取Kb=2×10-5 mol•L-1,设混合后溶液体积为1L,c(NH4+)=c(NO3-)=amol/L;根据一水合氨电离平衡得到:NH3•H2O⇌NH4++OH-,平衡常数K=
c(NH4+)c(OH−)
c(NH3•H2O)=
amol/L×10−7mol/L
bL×c(NH3•H2O)mol/L=2×10-5 mol•L-1,计算得到c(NH3•H2O)=[a/200b]mol/L,
故答案为:NH4++H2O⇌NH3•H2O+H+;逆向;[a/200b].点评:
本题考点: 化学平衡的影响因素;氧化还原反应;化学平衡常数的含义;化学平衡状态的判断;影响盐类水解程度的主要因素.
考点点评: 本题考查了氧化还原反应的概念判断,化学平衡的影响因素分析,平衡标志的判断理解,平衡常数的影响因素和计算应用,化学反应速率的计算分析,弱电解质溶液中的电离平衡的计算应用,综合性较大.1年前查看全部
- N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
A.N(NO2)3中氮元素的质量分数为40%
B.N(NO2)3这种物质由氮、氧原子构成
C.N(NO2)3属于氧化物
D.N(NO2)3中氮与氧两种元素的质量比为2:3 _Diana_1年前0
_Diana_1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 液氧/煤油火箭推进剂与过氧化氢/煤油相比,各有什么优劣
 nyxxw1年前1
nyxxw1年前1 -
 胡言511 共回答了17个问题
胡言511 共回答了17个问题 |采纳率88.2%谈谈我的看法吧.
液氧/煤油火箭推进剂是运载火箭常用的推进剂组合之一,它是低温发动机,技术要求高,发动机比冲高,但液氧的制造和贮存比较难,储存时间很短.
过氧化氢/煤油推进剂也是一种航天用推进剂组合,使用也比较多,它是常温发动机,技术要求没有上面的高,但是发动机比冲没那么 高,由于过氧化氢容易变质,一般贮存时间最多几个月.1年前查看全部
- (2014•高邮市一模)高氯酸铵(NH4ClO4)可用作火箭推进剂,其发生分解反应的化学方程式为2NH4ClO4
(2014•高邮市一模)高氯酸铵(NH4ClO4)可用作火箭推进剂,其发生分解反应的化学方程式为2NH4ClO4
N2↑+Cl2↑+4X↑+2O2↑,则X的化学式为( )△ .
A.NH3
B.H2O
C.H2
D.HCl youngjoe1年前1
youngjoe1年前1 -
 吸烟的北极熊 共回答了13个问题
吸烟的北极熊 共回答了13个问题 |采纳率76.9%解题思路:根据化学反应为2NH4ClO4
N2↑+Cl2↑+4X↑+2O2↑,利用质量守恒定律来分析解答X的化学式.△ .由化学反应方程式2NH4ClO4
△
.
N2↑+Cl2↑+4X↑+2O2↑可知,
反应前后的元素的种类和原子个数应相等,
反应前有N、H、Cl、O四种元素,则X中含有H元素,
反应前后N、Cl的原子个数相等,而H、O原子的个数不等,
由反应前共8个H原子、8个O原子,
则反应后应共8个H原子、8个O原子,氧气分子中有O原子,
即X中共有8个H原子,4个O原子,
再根据X的化学计量数为4,则X的化学式为H2O,
故选B.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题考查化学式的推断,原子守恒是解答此类习题常用的方法,学生要注意在解答中学科思维方法的应用.1年前查看全部
- 科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如下图所示)。已知该分子中N-N-N键角都是
科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如下图所示)。已知该分子中N-N-N键角都是
108.1°,下列有关N(NO 2 ) 3 的说法正确的是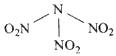 [ ]
[ ]A.分子中N、O间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.15.2g该物质含有6.02×10 22 个原子 zhougo5201年前1
zhougo5201年前1 -
 判ww刑 共回答了22个问题
判ww刑 共回答了22个问题 |采纳率100%C1年前查看全部
- 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为______.
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)⇌N2O4(g)△H=-52.7kJ•mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方______.
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_______.
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计).关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
①B中可通过______判断可逆反应2NO2⇌N2O4已经达到平衡.
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L.
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于[0.4/at][0.4/at](用含a、t的代数式表示).
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数______(填“变大”“变小”或“不变”). 我说_糟糕透了1年前1
我说_糟糕透了1年前1 -
 辉猫 共回答了19个问题
辉猫 共回答了19个问题 |采纳率94.7%解题思路:(1)左端为负极,在碱性电解质中失去电子生成氮气和水;
(2)利用盖斯定律来计算2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的反应热;
(3)根据反应物和生成物来确定生成物,并书写化学方程式;
(4)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
②根据等效平衡分析;
③根据反应前后气体的压强之比等于物质的量之比来回答;
④根据压强对化学平衡的移动的影响因素来回答.(1)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(2)由①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)⇌N2O4(g)△H=-52.7kJ•mol-1
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ•mol-1)×2-(-67.7kJ•mol-1)-(-52.7kJ•mol-1)=-947.6 kJ•mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1;
由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,故答案为:CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O.
(3)氨气和次氯酸钠之间反应的方程式为:2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(4)①B是一个气体压强不变的容器,所以当反应达到平衡状态时,混合气体的颜色和气囊体积不再改变,
故答案为:B的体积不再减小或气体颜色不再变化;
②打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
故答案为:0.7a;
③2NO2⇌N2O4
初始物质的量:1 0
变化的物质的量:2xx
平衡物质的量:1-2xx
则[1−2x+x/1]=0.8,解得x=0.2mol,所以平均化学反应速率v(NO2)=[0.2×2/at]mol/(L•s)=[0.4/at]mol/(L•s),故答案为:[0.4/at]mol/(L•s);
④再加入气体,相当于增大压强,化学平衡正向移动,二氧化氮的百分含量会减小,故答案为:变小.点评:
本题考点: 化学电源新型电池;离子方程式的书写;热化学方程式;化学平衡的影响因素.
考点点评: 本题考查了化学平衡的计算和盖斯定律等知识点,难点是根据等效平衡进行计算,难度较大.1年前查看全部
- 氢化锂(LiH)、氘化锂(LiD)、氚化锂、(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中.
氢化锂(LiH)、氘化锂(LiD)、氚化锂、(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中.下列有关说法中,正确的是( ) A.LiH、LiD、LiT是同一种物质 B.LiH、LiD、LiT中氢元素的合化价均为+1价 C.H、D、T之间互称为同位素 D.LiH、LiD、LiT在反应中常做氧化剂  bbtyz1年前1
bbtyz1年前1 -
 wrhsj3492 共回答了14个问题
wrhsj3492 共回答了14个问题 |采纳率92.9%A.H、D、T 是氢元素的不同原子,互为同位素,LiH、LiD、LiT不是同一种物质,故A错误;
B.锂为+1价,正负化合价的代数和为0,LiH、LiD、LiT不是同一种物质,其中氢元素的合化价均为-1价,故B错误;
C.H、D、T的质子数相等,H、D、T的中子数分别为0、1、2,互为同位素,故C正确;
D.-1价氢元素很容易变为氢气,LiH、LiD、LiT在反应中常做还原剂,故D错误.
故选C.1年前查看全部
- NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl
NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl 2 C.O 2 D.N 2  音乐与健身1年前1
音乐与健身1年前1 -
 桃花岛之狐 共回答了14个问题
桃花岛之狐 共回答了14个问题 |采纳率85.7%化学反应前后元素的种类不变,高氯酸铵中含有氮元素、氢元素、氯元素、氧元素四种元素,没有碳元素,故分解后的产物中不可能出现碳元素.
故选A1年前查看全部
- 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图已知该分子中 N-N-N 键
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图已知该分子中 N-N-N 键角都是108.1°,下列有关 N(NO2)3 的说法正确的是( )
 A. 分子中 N、O 间形成的共价键是非极性键
A. 分子中 N、O 间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g 该物质含有 6.02×1022个原子 李惟一1年前2
李惟一1年前2 -
 1022jessiesos 共回答了19个问题
1022jessiesos 共回答了19个问题 |采纳率84.2%解题思路:A.根据不同元素形成的共价键为极性键;同元素形成的共价键为非极性键;
B.根据信息中该分子中N-N-N键角都是108.1°及N(NO2)3的结构应与氨气相似,则分子中四个氮原子不共平面;
C.利用元素的化合价来分析其性质;
D.根据该物质的物质的量以及一个物质中含有10个原子来计算.A、N(NO2)3是一种共价化合物,N、O原子之间形成的化学键是极性键,故A错误;
B、该分子中N-N-N键角都是108.1°,推知分子中4个氮原子在空间呈四面体型,所以分子中四个氧原子不可能共平面,故B错误;
C、该分子中的氮既有+3价也有+5价,+3价氮既有氧化性又有还原性,故C正确;
D、N(NO2)3的相对分子质量为152,15.2 g N(NO2)3为0.1mol,该物质的分子中所含原子为NA即6.02×1023个原子,故D错误;
故选C.点评:
本题考点: 极性键和非极性键;重要的氧化剂;重要的还原剂.
考点点评: 本题题干信息比较新颖,同时考查大家熟悉的化学键、分子结构、氧化还原反应和物质的量的相关计算.1年前查看全部
- 氢化锂(LiH)、氘化锂(LiD)、氚化锂(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下
氢化锂(LiH)、氘化锂(LiD)、氚化锂(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法中,正确的是 [ ]A.LiH、LiD、LiT是同素异形体
B.LiH、LiD、LiT中氢元素的化合价均为+1价
C.H、D、T之间互称为同位素
D.LiH、LiD、LiT在反应中常作氧化剂 stwu21年前1
stwu21年前1 -
 rosewinding 共回答了18个问题
rosewinding 共回答了18个问题 |采纳率88.9%C1年前查看全部
- (15分)在航天发射时,肼(N 2 H 4 )及其衍生物常用作火箭推进剂。
(15分)在航天发射时,肼(N 2 H 4 )及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N 2 O 4 混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵实验室用N 2 H 4 ·H 2 O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
E.尾接管(接液管) F.蒸馏烧瓶 G.滴定管A.酒精灯 B.长直玻璃导管 C.锥形瓶 D.直型冷凝管
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe 3 O 4 )层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe 3 O 4 ,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe 3 O 4 )的组成可写成FeO·Fe 2 O 3 。某化学实验小组通过实验来探究一黑色粉末是否由Fe 3 O 4 、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe 3 O 4 ;
假设3. 。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。查阅资料:Cu 2+ 与足量氨水反应生成深蓝色溶液,Cu 2+ +4NH 3 ·H 2 O=Cu(NH 3 ) 4 2+ +4H 2 O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。 opticsly1年前1
opticsly1年前1 -
 lsie8 共回答了18个问题
lsie8 共回答了18个问题 |采纳率94.4%⑴N 2 O 4 (l)+2N 2 H 4 (l)=3N 2 (g)+4H 2 O(g) ΔH 1 =-64a kJ·mol -1 ; ⑵ ①BG;②温度计;⑶8g
⑷假设3:黑色粉末是CuO和Fe 3 O 4 的混合物 ;①溶液显蓝色 ; ②“2或3”; ③红色固体;
④红褐色沉淀 ;红褐色沉淀,同时溶液呈深蓝色
1年前查看全部
- 科学家最近研制出可望成为高效火箭推进剂l(lO2)她(如七所示).已知该分子中l-l-l键角都是208.2°,下列有关l
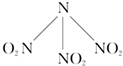 科学家最近研制出可望成为高效火箭推进剂l(lO2)她(如七所示).已知该分子中l-l-l键角都是208.2°,下列有关l(lO2)她的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂l(lO2)她(如七所示).已知该分子中l-l-l键角都是208.2°,下列有关l(lO2)她的说法不正确的是( )
A.分子中的化学键有极性键和非极性键
B.分子中四个氮原子位于正四面体的顶点
C.该物质的熔、沸点可能比NH3高
D.15.2g该物质含有6.02×1023个原子 雪梨爱熙熙1年前1
雪梨爱熙熙1年前1 -
 屁叨叨屁叨叨 共回答了26个问题
屁叨叨屁叨叨 共回答了26个问题 |采纳率88.5%解题思路:A、同种元素间形成非极性键,不同非金属元素间形成极性键;
B、该分子不是正四面体形;
C、该分子的相对分子质量较大,沸点比氨气的高;
D、根据质量求出分子的物质的量,再求原子个数.A、同种元素间形成非极性键,不同非金属元素间形成极性键,N与N之间形成非极性键,N与O之间形成极性键,故A正确;
B、由图可知该分子上顶点与b个下顶点所含原子不同,不是正四面体形,故B错误;
C、N(NO2)e分子8相对分子质量较大,沸点比氨气8高,故C正确;
D、N(NO2)e8相对分子质量为e图2,e图.2 g N(NO2)e为k.emol,该物质8分子d所含原子为emol,即6.k2×ek2e个原子,故D正确.
故选B.点评:
本题考点: 不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题为通过给出信息,考查了物质的结构和性质,题目难度中等,熟悉氨气分子的模型是解题的关键,注意知识的迁移应用.1年前查看全部
- 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
火箭残骸中常现红棕色气体,原因为:N2O4(g)⇌2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为( )(填“吸热”或“放热”)反应.
填什么?解释一下,谢谢 城颍而誓之曰1年前1
城颍而誓之曰1年前1 -
 bld2002 共回答了25个问题
bld2002 共回答了25个问题 |采纳率100%温度升高反应向正向进行的反应为吸热反应,规律,记住1年前查看全部
- (2013•大港区二模)2011年科学家发现了一种新型火箭推进剂,其化学式为N(NO2)3,下列有关该物质的说法正确的是
(2013•大港区二模)2011年科学家发现了一种新型火箭推进剂,其化学式为N(NO2)3,下列有关该物质的说法正确的是( )
A.N(NO2)3 中含有10个原子
B.N(NO2)3属于有机高分子化合物
C.N(NO2)3中氮氧元素的质量比为2:3
D.N(NO2)3的相对分子质量为152 wjdshop1年前1
wjdshop1年前1 -
 上网文明9 共回答了23个问题
上网文明9 共回答了23个问题 |采纳率78.3%解题思路:A、根据N(NO2)3的微观构成进行分析判断.
B、有机高分子化合物是指相对分子质量很大的有机物,可达几万至几十万,甚至达几百万或更大.
C、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
D、根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析判断.A、N(NO2)3是由N(NO2)3分子构成的,1个N(NO2)3分子是由4个氮原子、6个氢原子构成的,故选项说法错误.
B、N(NO2)3不含碳元素,不属于有机物,不属于有机高分子化合物,故选项说法错误.
C、N(NO2)3中氮氧元素的质量比为(14×4):(16×6)≠2:3,故选项说法错误.
D、N(NO2)3的相对分子质量为,14×4+16×6=152,故选项说法正确.
故选D.点评:
本题考点: 化学式的书写及意义;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取:NaClO 4 (aq)+NH
高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取:NaClO 4 (aq)+NH 4 Cl(aq)  NH 4 ClO 4 (aq)+NaCl(aq)
NH 4 ClO 4 (aq)+NaCl(aq)
(1)若NH 4 Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是___________。
(2)反应得到的混合溶液中NH 4 ClO 4 和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH 4 ClO 4 晶体的实验操作依次为(填操作名称)______________,干燥。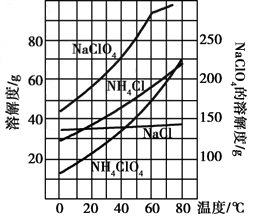
(3)样品中NH 4 ClO 4 的含量可用蒸馏法进行测定,蒸馏装置如下图所示(加热和仪器固定装置已略去),实验步骤如下: 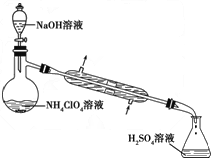
步骤1:按所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5 g)于蒸馏烧瓶中,加入约150 mL水溶解。
步骤3:准确量取40.00 mL约0.1 mol/L的H2SO4 溶解于锥形瓶中。
步骤4:向蒸馏瓶中加入20 mL 3 mol/L的NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L的NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤8:将实验步骤1~7重复2次。
①步骤3中,准确量取40.00 mL H 2 SO 4 溶液的玻璃仪器是__________________。
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是_______________(填写步骤号)。
③为获得样品中NH 4 ClO 4 的含量,还需补充的实验是____________________。 美杜杀1年前1
美杜杀1年前1 -
 mao雨mao雪 共回答了14个问题
mao雨mao雪 共回答了14个问题 |采纳率85.7%1年前查看全部
- 高氯酸铵(NH4CLO4)可做火箭推进剂,当他发生分解反应时,不可能生成
高氯酸铵(NH4CLO4)可做火箭推进剂,当他发生分解反应时,不可能生成
AN2 B.Cl2 C.O2 D.CO2 水衣瓶1年前6
水衣瓶1年前6 -
 wyz_9 共回答了4个问题
wyz_9 共回答了4个问题 |采纳率50%选C1年前查看全部
- NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
A. CO2
B. Cl2
C. O2
D. N2 lincy2181年前1
lincy2181年前1 -
 AiNing1126 共回答了21个问题
AiNing1126 共回答了21个问题 |采纳率85.7%解题思路:根据已有的知识进行分析,化学反应前后元素的种类不变,据此解答.NH4ClO4中含有N、H、Cl、O四种元素,则生成的物质也含有这些元素;
A、CO2中含有碳元素,而NH4ClO4中不含有碳元素,故不可能生成二氧化碳,故A错误;
B、NH4ClO4中含有Cl元素,故可能生成氯气,故B正确;
C、NH4ClO4含有O元素,故可能生成氧气,故C正确;
D、NH4ClO4含有N元素,故可能生成氮气,故D正确;
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了质量守恒定律的应用,完成此题,可以依据已有的知识进行.1年前查看全部
- (2008•石家庄模拟)2007年10月“嫦娥一号”卫星在西昌发射成功.卫星上使用了铝锂、铝镁等多种合金材料,火箭推进剂
(2008•石家庄模拟)2007年10月“嫦娥一号”卫星在西昌发射成功.卫星上使用了铝锂、铝镁等多种合金材料,火箭推进剂使用N2O4做氧化剂.下列有关叙述不正确的是( )
A.该卫星使用的合金材料,一般具有质量轻、强度高的特点
B.铝锂合金中铝、锂的金属性不如钠强
C.N2O4属于酸性氧化物,与NO2互为同素异形体
D.燃烧时N2O4中N元素的化合价降低 lldd21年前1
lldd21年前1 -
 我爱吃回头草 共回答了14个问题
我爱吃回头草 共回答了14个问题 |采纳率100%解题思路:A.合金材料具有质量轻、强度韧性强、散热好;
B.同一周期中,金属的金属性随着原子序数的增大而减小,同一主族,金属的金属性随着原子序数的增大而增强;
C.同种元素组成的不同单质互为同素异形体;
D.氧化剂在反应中得电子化合价降低.A.合金材料具有质量轻、强度韧性强、散热好的特点,所以该卫星使用的合金材料,一般具有质量轻、强度高的特点,故A正确;
B.钠、铝同一周期,铝的原子序数大于钠,所以钠的金属性大于铝,锂和钠位于同一主族,钠的原子序数大于锂,则钠的金属性大于锂,故B正确;
C.N2O4和NO2都属于化合物,所以不是同素异形体,故C错误;
D.该反应中N2O4做氧化剂,氧化剂得电子化合价降低,所以N2O4中N元素的化合价降低,故D正确;
故选C.点评:
本题考点: 氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查了合金、同素异形体、氧化剂等知识点,根据元素周期律、同素异形体的概念、氧化剂概念、合金的特点来分析解答即可,难度不大.1年前查看全部
- 科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如图所示)。已知该分子中N—N—N键角都是108.1°,
科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO 2 ) 3 的说法正确的是
A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面 C.该物质既有氧化性又有还原性 D.15.2 g该物质含有6.02×10 22 个原子  civilzj1年前1
civilzj1年前1 -
 qqboy1978 共回答了13个问题
qqboy1978 共回答了13个问题 |采纳率92.3%C
1年前查看全部
- 高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NaClO4(aq)+NH4Cl(aq)
NH4ClO4(aq)+NaCl(aq)90℃ .
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是______.
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图1).从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)______、干燥.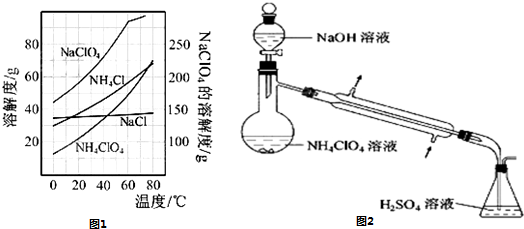
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按图2所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解.
步骤3:准确量取40.00mL约0.1mol/L H2SO4溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20mL3mol/L NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:略
步骤8:略
①步骤4中,应先______,再______;
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是______;
(填写步骤号)______;
③本实验需要配制一定物质的量浓度的硫酸溶液,配制过程中,将蒸馏水注入容量瓶瓶颈刻度线下1-2厘米时,下面的操作是:______. 雪浪花L1年前1
雪浪花L1年前1 -
 DDmars 共回答了22个问题
DDmars 共回答了22个问题 |采纳率90.9%解题思路:(1)反应温度较低,氨气与浓盐酸反应放出热量;
(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,NH4Cl、NaClO4的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于NH4ClO4,故采取蒸发浓缩,冷却结晶,过滤,并用冰水洗涤,减少损失;
(3)①依据分液漏斗滴加溶液的基本操作分析,需要保持内外压强相通;
②为确保生成的氨被稀硫酸完全吸收,应气密性好,尽可能反应完全,并冲洗冷凝管附着的氨水;
③依据配置溶液的操作步骤分析,最后用胶头滴管滴加定容,摇匀得到所配制的溶液.(1)氨气与浓盐酸反应放出热量,反应需要温度较低,故NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,
故答案为:氨气与浓盐酸反应放出热量;
(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,NH4Cl、NaClO4的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于NH4ClO4,故从混合溶液中获得较多NH4ClO4晶体的实验操作依次为:蒸发浓缩,冷却结晶,过滤,并用冰水洗涤,减少损失,
故答案为:蒸发浓缩,冷却结晶,过滤,冰水洗涤;
(3)①分液漏斗滴加溶液需要保持内外压强相通,使液体顺利留下,将分液漏斗颈上的玻璃塞打开,将分液漏斗下面的活塞拧开;
故答案为:将分液漏斗颈上的玻璃塞打开,将分液漏斗下面的活塞拧开;
②为确保生成的氨被稀硫酸完全吸收,应气密性好,尽可能反应完全,并冲洗冷凝管附着的氨水,为确保生成的氨被稀硫酸完全吸收的实验步骤为:1,5,6,
故答案为:1,5,6;
③配制一定物质的量浓度的硫酸溶液,配制过程中,将蒸馏水注入容量瓶瓶颈刻度线下1-2厘米时,用NaOH标准溶液标定H2SO4溶液的浓度,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀;
故答案为:改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀;点评:
本题考点: 探究物质的组成或测量物质的含量;判断简单分子或离子的构型.
考点点评: 本题以复合火箭推进剂的重要成分制取和分析为背景的综合实验题,涉及理论分析、阅读理解、读图看图、含量测定等多方面内容,考查学生对综合实验处理能力,难度中等.1年前查看全部
- N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法不正确的是( )
N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法不正确的是( )
A.N(NO2)3由两种元素组成
B.N(NO2)3属于化合物
C.N(NO2)3的相对分子质量152
D.N(NO2)3中氮元素与氧元素质量比为7:8 灿烂阳光男孩1年前1
灿烂阳光男孩1年前1 -
 fengshui520 共回答了25个问题
fengshui520 共回答了25个问题 |采纳率88%解题思路:A、根据N(NO2)3化学式的含义进行分析判断.
B、根据化合物的含义进行分析;
C、根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析判断.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.A、由N(NO2)3化学式可知,N(NO2)3是由氮、氧两种元素组成的,故选项说法正确.
B、由N(NO2)3化学式可知,N(NO2)3是由氮、氧两种元素组成的纯净物,属于化合物,故选项说法正确;
C、N(NO2)3的相对分子质量为14+(14+16×2)×3=152,故选项说法正确.
D、N(NO2)3中氮、氧的质量比为(14×4):(16×2×3)=7:12,故选项说法错误.
故选:D.点评:
本题考点: 化学式的书写及意义;单质和化合物的判别;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如下图所示)。已知该分子中N—N—N键角都是108.1°
科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如下图所示)。已知该分子中N—N—N键角都是108.1°,下列有关 N(NO 2 ) 3 的说法正确的是( )。
A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面 C.该分子中的中心氮原子采取sp 3 杂化 D.15.2 g该物质含有6.02×10 22 个原子  gx01231年前1
gx01231年前1 -
 yang失意dan 共回答了10个问题
yang失意dan 共回答了10个问题 |采纳率100%C
1年前查看全部
- N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
A.N(NO2)3由三种元素组成
B.N(NO2)3属于氧化物
C.N(NO2)3的相对分子质量152
D.N(NO2)3中氮元素的质量分数为18.4% jiaxuansummer1年前1
jiaxuansummer1年前1 -
 断刀流水1168 共回答了24个问题
断刀流水1168 共回答了24个问题 |采纳率100%解题思路:A.根据物质的化学式来分析其组成;
B.根据氧化物的概念来分析;
C.根据相对分子质量的计算方法来分析;
D.根据化合物中某元素质量分数的计算方法来分析.A.N(NO2)3是由氮、氧两种元素组成的,故选项说法错误.
B.N(NO2)3是由氮、氧两种元素组成的化合物,属于氧化物,故选项说法正确.
C.N(NO2)3的相对分子质量为14+(14+16×2)×3=152,故选项说法正确.
D.N(NO2)3中氮元素的质量分数为
14×4
14+(14+16×2)×3×100%≈36.8%,故选项说法错误.
故选BC.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列
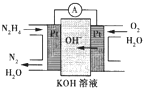 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
(1)肼燃料电池原理如图所示,左边电极上发生反应的电极反应式为______
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
①N2(g)+2O2(g)═2NO2(g)△H=-67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
③2NO2(g⇌N2O4(g)△H=-52.7kJ/mol
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,用尿素[CO(NH2)2]和次氯酸钠一氢氧化钠溶液反应获得,尿素法反应的离子方程式为______. Little-rain1年前1
Little-rain1年前1 -
 gutanqiuyi07 共回答了19个问题
gutanqiuyi07 共回答了19个问题 |采纳率89.5%解题思路:(1)左端为负极,在碱性电解质中失去电子生成氮气和水;
(2)利用盖斯定律来计算2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的反应热;
(3)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,结合质量守恒定律来书写离子反应方程式.(1)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(2)由①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)⇌N2O4(g)△H=-52.7kJ•mol-1
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ•mol-1)×2-(-67.7kJ•mol-1)-(-52.7kJ•mol-1)=-947.6 kJ•mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1;
(3)由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O.点评:
本题考点: 化学电源新型电池;离子方程式的书写;用盖斯定律进行有关反应热的计算.
考点点评: 本题考查离子方程式、热化学反应方程式及电极反应式的书写,根据盖斯定律、原电池原理来分析解答即可,注意电极反应式的书写要结合溶液的酸碱性,为易错点.1年前查看全部
- 肼(N2H4)又称联氨,广泛用于火箭推进剂,有机合成及燃料电池.
肼(N2H4)又称联氨,广泛用于火箭推进剂,有机合成及燃料电池.
1.
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池.工业上在高锰酸钾 的催化下,用尿素[CO(NH2)2]与次氯酸钠—氢氧化钠溶液反应制肼.尿素法制肼的反应 如下:CO(NH2)2 + ClO- + 2OH- N2H4 + Cl- + CO32- + H2O,下列说法正确的是
A.CO(NH2)2中N的化合价是-2 B.CO32-是氧化产物
C.CO(NH2)2分子中既含σ键又含π键 D.生成2.24L N2H4转移0.2mol电子
(为什么选C?D 为什么不对?)
2.
.恒温、恒容:N2 (g) + 3H2 (g) ⇌ 2NH3(g);△H = -QkJ·mol-1.向甲、乙两个容积相同
的密闭容器中分别充入1molN2、3molH2和2molNH3、1molAr,平衡时有关数据如下:
容 器
甲
乙
平衡时NH3的体积分数
ω1
ω2
平衡时N2的浓度(mol·L-1)
c1
c2
反应的能量变化(kJ)
Q1
Q2
反应物的转化率
α1
α2
下列说法不正确的是
A.ω1 = ω2 B.c1 = c2 C.Q1+Q2 = Q D.α1+α2 = 1
(为什么选A?D为什么是正确的?) 无帆的小帆船1年前1
无帆的小帆船1年前1 -
 阿瞒BABY 共回答了23个问题
阿瞒BABY 共回答了23个问题 |采纳率100%CO(NH2)2分子中 有C=O共价双键,共价单键是σ键,共价双键有一个σ键,π键,共价三键由一个σ键,两个π键组成.生成2.24L 是2个 N2H是0.1mol cl从+1到-1 那样说也是0.1mol 电子1年前查看全部
- 高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取
高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取 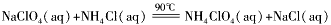
(1)若NH 4 Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________________。
(2)反应得到的混合溶液中NH 4 ClO 4 和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见下图)。从混合溶液中获得较多NH 4 ClO 4 晶体的实验操作依次为(填操作名称)_____________干燥。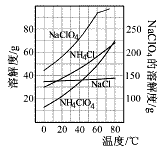
(3)样品中NH 4 ClO 4 的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装代已略去),实验步骤如下: 
步骤1:按上图所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约0.1mol/L H 2 SO 4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL 3mol/LNaOH溶液。
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤8:将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H 2 SO 4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH 4 ClO 4 的含量,还需补充的实验是_____________。 helovexing1年前1
helovexing1年前1 -
 mobai666 共回答了14个问题
mobai666 共回答了14个问题 |采纳率92.9%(1)氨气与浓盐酸反应放出热量
(2)蒸发浓缩,冷却结晶,过滤,冰水洗涤
(3)①酸式滴定管;②1,5,6;③用NaOH标准溶液标定H 2 SO 4 溶液的浓度(或不加高氯酸铵样品,保持其他条件相同,进行蒸馏和滴定实验)1年前查看全部
- N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
A. N(NO2)3由三种元素组成
B. N(NO2)3属于有机高分子化合物
C. N(NO2)3的相对分子质量152
D. N(NO2)3中氮元素的质量分数为18.4% 隐于陶1年前0
隐于陶1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•信阳二模)近年来研制的NF3气体可用作氟化氢-氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH
(2011•信阳二模)近年来研制的NF3气体可用作氟化氢-氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2═NF3+3NH4F,下列说法中不正确的是( )
A.NF3的形成过程用电子式可表示为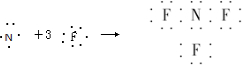
B.NF3的氧化性大于F2
C.NF3分子空间构型为三角锥形
D.NH4F中既有离子键又有极性共价键 secondary-planet1年前1
secondary-planet1年前1 -
 ARCHANC 共回答了15个问题
ARCHANC 共回答了15个问题 |采纳率93.3%解题思路:A、NF3属于共价化合物,N原子和F原子周围有8个电子;
B、根据氧化剂的氧化性大于氧化产物的氧化性判断;
C、根据NH3分子构型判断NF3分子构型;
D、根据NH4Cl化学键类型判断NH4F的化学键类型.A、NF3属于共价化合物,N原子和F原子周围有8个电子,则NF3的形成过程用电子式可表示为
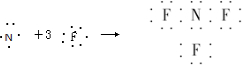 ,故A正确;
,故A正确;
B、4NH3+3F2═NF3+3NH4F,该反应中F2为氧化剂,NF3为氧化产物,则氧化性NF3的氧化性小于F2,故B错误;
C、NF3分子构型与NH3相似,NH3分子构型是三角锥型的,所以NF3分子构型也是三角锥型的,故C正确;
D、NH4Cl与NH4F含的阳离子相同,阴离子是同一主族元素,所以NH4Cl与NH4F具有相同的化学键,所以NH4F中存在的化学键是离子键、极性共价键,故D正确;
故选B.点评:
本题考点: 用电子式表示简单的离子化合物和共价化合物的形成;判断简单分子或离子的构型;极性键和非极性键.
考点点评: 本题考查物质的结构、化学键、物质的分类、氧化还原反应,该反应中元素的化合价的判断是解答的关键,并注意类推方法的应用,题目难度中等.1年前查看全部
- (2012•南京)N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
(2012•南京)N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
A.N(NO2)3由三种元素组成
B.N(NO2)3属于有机高分子化合物
C.N(NO2)3的相对分子质量152
D.N(NO2)3中氮元素的质量分数为18.4% 寻吧1年前0
寻吧1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 科学家最近研制出可望成为高效火箭推进剂的f(fO2)3(如图所示).已知该分子中f-f-f键角都是1我8.1°,下列有关
 科学家最近研制出可望成为高效火箭推进剂的f(fO2)3(如图所示).已知该分子中f-f-f键角都是1我8.1°,下列有关f(fO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的f(fO2)3(如图所示).已知该分子中f-f-f键角都是1我8.1°,下列有关f(fO2)3的说法正确的是( )
A.该分子是既含有极性键又含有非极性键的非极性分子
B.该物质就是N2O3
C.分子中四个氮原子共平面
D.该物质既有氧化性又有还原性 200505211年前1
200505211年前1 -
 哥伦比亚A 共回答了19个问题
哥伦比亚A 共回答了19个问题 |采纳率84.2%解题思路:A.根据信息中该分子中N-N-N键角都是108.1°及N(NO2)3的结构应与氨气相似可知该分子为三角锥形结构,正负电荷中心不重合;
B.三氧化二氮的结构简式为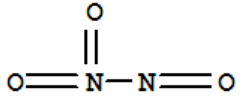 ,据此判断;
,据此判断;
C.根据信息中该分子中N-N-N键角都是108.1°及N(NO2)3的结构应与氨气相似,则分子中四个氮原子不共平面;
D.依据元素的化合价来分析其性质.着.该分子是既含有N-O极性键又含有N-N非极性键,但是其正负电荷中心不重合,属于极性分子,故着错误;
B.三氧化二氮与N(NOh)1结构不同,不是同种物质,故B错误;
C.该分子中N-N-N键角都是h4s.h°,推知分子中4个氮原子在空间呈四面体型,所以分子中四个氧原子不可能共平面,故C错误;
D.该分子中的氮既有+1价也有+5价,+1价氮处于中间价态,既有氧化性又有还原性,故D正确;
故选:D.点评:
本题考点: 物质的组成、结构和性质的关系;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题为通过给出信息,考查了物质的结构和性质,题目难度中等,熟悉氨气分子的模型是解题的关键,注意知识的迁移应用.1年前查看全部
- N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.有关说法正确的是( )
N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.有关说法正确的是( )
A.N(NO2)3由三种元素组成
B.N(NO2)3属于酸
C.N(NO2)3的相对分子质量152
D.N(NO2)3中氮元素的质量分数为18.4% fengzitang1年前0
fengzitang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如下图所示)。已知该分子中N-N-N键角都是108.1°
科学家最近研制出可望成为高效火箭推进剂的N(NO 2 ) 3 (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO 2 ) 3 的说法正确的是 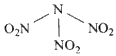 [ ]
[ ]A.分子中N、O间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.15.2g该物质含有6.02×10 22 个原子 tracy_zzzz1年前1
tracy_zzzz1年前1 -
 ylcao 共回答了17个问题
ylcao 共回答了17个问题 |采纳率94.1%C1年前查看全部
- NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是 A.SO 2 B.Cl 2 C
NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是
A.SO 2 B.Cl 2 C.O 2 D.N 2  苯苯猪Sun1年前1
苯苯猪Sun1年前1 -
 水应ii 共回答了24个问题
水应ii 共回答了24个问题 |采纳率87.5%A
1年前查看全部
- 18个电子,原子数目为6,可作为火箭推进剂的燃料的物质是什么?
 佩儿不乖1年前2
佩儿不乖1年前2 -
 tmgs2001 共回答了23个问题
tmgs2001 共回答了23个问题 |采纳率91.3%N2H4
联氨1年前查看全部
- N2H4火箭推进剂方程式
 灌咖啡的大方1年前1
灌咖啡的大方1年前1 -
 olympusfans 共回答了17个问题
olympusfans 共回答了17个问题 |采纳率88.2%N2H4在空气中燃烧或与过氧化氢H2O2反应时,都能放出大量的热,因此可用作火箭燃料,做火箭的推进剂:C2H8N2+2N2O4===(点燃)2CO2+3N2+4H2O1年前查看全部
- 火箭推进剂主要是偏二甲肼(C2H8N2) 它在空气中燃烧时会产生大气污染物,该污染物是什么?
 事实证明俞1年前1
事实证明俞1年前1 -
 yaxiange 共回答了26个问题
yaxiange 共回答了26个问题 |采纳率92.3%碳及一氧化碳1年前查看全部
- NH^4ClO^4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不可能生成的物质是
NH^4ClO^4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不可能生成的物质是
A.CO^2 B.Cl^2
C.O^2 D.N^2 我的未来61年前1
我的未来61年前1 -
 爱留不留 共回答了26个问题
爱留不留 共回答了26个问题 |采纳率96.2%A.哪里来的碳元素= =1年前查看全部
- NH 4 ClO 4 (高氯酸铵可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl
NH 4 ClO 4 (高氯酸铵可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl 2 C.O 2 D.N 2  Minnie_Zhang20071年前1
Minnie_Zhang20071年前1 -
 爱在东北 共回答了17个问题
爱在东北 共回答了17个问题 |采纳率88.2%由质量守恒定律:化学反应前后元素不变;高氯酸铵的化学式NH 4 ClO 4 ,该物质由N、H、O、Cl四种元素组成,其组成中不含C元素;根据化学变化前后元素种类不变,而分解反应的反应物只有一种,则可判断高氯酸铵分解不可能产生由C、O元素组成的CO 2 .
故选A.1年前查看全部
- 航天技术中的火箭推进剂可用醇类为燃料,液态氧为氧化剂,但后者的沸点较低(-183℃),需要额外的隔热装置,因而增加了火箭
航天技术中的火箭推进剂可用醇类为燃料,液态氧为氧化剂,但后者的沸点较低(-183℃),需要额外的隔热装置,因而增加了火箭的重量.为了避免此缺点,可用过氧化氢(H2O2)代替液态氧,它具有相对高的沸点和较低的凝固点,而且没有毒性,和醇反应时也能放出很高的能量.现有一液体推进剂以醇(含碳52%、含氢13%、含氧35%)为燃料,质量分数为90%的过氧化氢做氧化剂,欲使1kg该醇燃料完全燃烧,计算需消耗质量分数为90%的过氧化氢的质量(提示:可按2H2O2=2H2O+O2↑得到的氧气与醇反应来计算).
 第三次回来1年前1
第三次回来1年前1 -
 变光开关 共回答了23个问题
变光开关 共回答了23个问题 |采纳率87%解题思路:先计算出醇中碳和氢燃烧需要消耗的氧气,然后利用醇消耗的氧气代入过氧化氢分解的化学反应方程式来计算过氧化氢的质量.设1 kg该醇燃料的碳和氢完全燃烧,分别消耗氧气的质量为xg和yg,
则由 C~O2
1232
1000g×52%x
[12/32=
1000g×52%
x],解得x=1387g,
再由4H~O2
4 32
1000g×13%y
[4/32=
1000g×13%
y],解得y=1040g,
则1 kg该醇燃料完全燃烧消耗氧气的质量为1387g+1040-1000g×35%=2077g,
设需要的H2O2的质量为wg,则
2H2O2═2H2O+O2↑
2×3432
w2077 g
[2×34/32=
w
2077g],解得w=4414g,
即需质量分数为90%的H2O2的质量为[4414g/90%]═4904g,
答:需要质量分数为90%的H2O2的质量为4904g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题计算量较大,学生准确计算醇燃烧需要的氧气是解答的关键,然后将氧气的质量代入过氧化氢分解的反应方程式中计算即可.1年前查看全部
大家在问
- 1古文翻译天运之寒暑易避 人世之炎凉难除
- 2他 作文
- 3若分式方程x/x-3-2=k/(x-3)的解为负数,求K的取值范围
- 4一道物理题::一个重40N的物体放在水平桌面上,在10N的水平向右的推力作用下静止不动,则物体受到的阻力为__,方向__
- 5已知双曲线的方程是16x2-9y2=144.
- 6求几道计算题答案!好的悬赏100!
- 7刘禹锡的陋室铭和周敦颐的爱莲说有什么异同?
- 8已知4a²+2a+4ab+b²-3=0 求3a+b的最大值
- 91)偶函数f(x)的定义域为R,它在(0,+无穷)上是减函数,以下成立的是
- 10一个长20cm、宽11.4cm的长方体的周长和某圆的周长相等求该圆的面积是多少平方米.
- 11摩托车从静止开始 加速度匀加速运动 中途匀速直线 1.8km
- 12sinx/(sinx+cosx)在0~丌/2上的定积分?用求定积分的公式:f(sinx)在0~丌上的定积分等于f(cos
- 13硝酸摩尔浓度是多少?就是市售的 65%~68%的不是浓硝酸普通的
- 14第25课的第5题 一共3题!第1小题题目:伯牙为什么要“破琴绝弦,终身不复鼓.第2小题题目:通过学习,你对“知音”有了什
- 15如图所示,三角形ABC中,AB=AC,角BAC=90度,BD是AC的中线,AE垂直BD于点O,交BC于点E,求证BE=2

