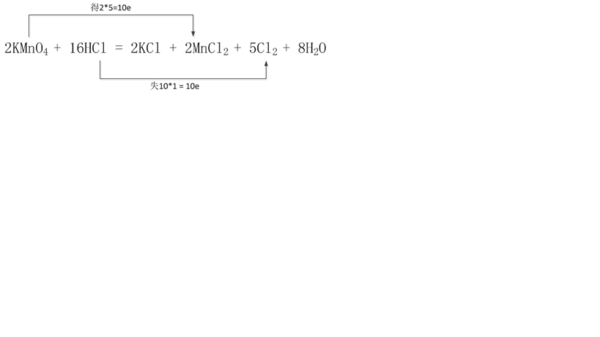
在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O的反应中,氧化剂是______,还原剂是____
 维圣2022-10-04 11:39:541条回答
维圣2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 t花蜜 共回答了18个问题
t花蜜 共回答了18个问题 |采纳率83.3%- 解题思路:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,该反应中转移10e-,以此来解答.
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,则KMnO4为氧化剂,Cl元素的化合价由-1价升高为0,则HCl为还原剂,该反应中转移电子为2×(7-2)=10e-,由反应可知,16molHCl参加反应时...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确反应中元素的化合价变化即可解答,注意HCl在反应中的作用,Cl的化合价升高时作还原剂被氧化,而生成盐时作酸,题目难度不大. - 1年前
相关推荐
- 反应2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是______,还原剂是______
反应2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是______,还原剂是______,若生成71g Cl2,被氧化的HCl是______g.
 金陵智者1年前2
金陵智者1年前2 -
 shawnhuang 共回答了19个问题
shawnhuang 共回答了19个问题 |采纳率100%解题思路:反应中Mn元素化合价降低,Cl元素化合价升高,根据元素的化合价的变化可判断相关概念,结合方程式计算相关物理量.反应中Mn元素化合价降低,Cl元素化合价升高,则KMnO4为氧化剂,HCl为还原剂,n(Cl2)=[71g/71g/mol]=1mol,则被氧化的HCl为2mol,质量为2mol×36.5g/mol=73g,
故答案为:KMnO4;HCl;73.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的概念和计算问题,侧重于相关概念的考查,题目较为基础,注意从化合价升降的角度分析.1年前查看全部
- 有反应①2H2O+Cl2+SO2===H2SO4+2HCl,②2KMnO4+16HCl===2KCl+2MnCl2+5C
有反应①2H2O+Cl2+SO2===H2SO4+2HCl,②2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O.
针对上述两个反应回答:
(1)两反应中的氧化剂的氧化性强弱顺序为______,还原剂的还原性强弱顺序为________.
(2)反应①中氧化产物和还原产物质量比为______.
(3)反应②中氯化氢表现出的性质是________.
a.还原性 b.酸性 c.氧化性 anonlyaya11年前1
anonlyaya11年前1 -
 iamfox1984 共回答了15个问题
iamfox1984 共回答了15个问题 |采纳率73.3%解析:
反应通式:
强氧化剂 + 强还原剂 → 弱还原剂(还原产物) + 弱氧化剂(氧化产物)
对照
①2H2O + Cl2 + SO2 → H2SO4 + 2HCl,
②2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
化合价上升,被氧化,为还原剂;化合价降低,被还原,为氧化剂
(1)所以可知
①中氧化性:Cl2 > H2SO4 ;还原性:SO2 > HCl
②中氧化性:K2MnO4 > Cl2 ;还原性:HCl > MnCl2
所以总顺序为:氧化性:K2MnO4 > Cl2 > H2SO4
还原性:SO2 > HCl > MnCl2
(2)①中氧化产物为H2SO4,还原产物为HCl,
质量比为m(H2SO4):m(HCl)= 98:36.5*2 = 98:73
(3)反应②中氯化氢表现出的性质是为 a 还原性 和 b 酸性,只有部分-1价氯元素被氧化为0价,其余则未改变价态,只起到酸性作用.1年前查看全部
- 弱酸制强酸的方程式那这些算不5SO2+2KMnO4+2H2O=K2SO4+MnSO4+2H2SO4SO2+Cl2+2H2
弱酸制强酸的方程式
那这些算不
5SO2+2KMnO4+2H2O=K2SO4+MnSO4+2H2SO4
SO2+Cl2+2H2O=H2SO4+2HCl 一月十日阴1年前5
一月十日阴1年前5 -
 mumuyouxia 共回答了14个问题
mumuyouxia 共回答了14个问题 |采纳率71.4%弱酸制强酸,不一定非得通过氧化还原反应来制取.
给你一个复分解的反应例子:CuSO4 + H2S = CuS沉淀 + H2SO4
不懂的可以Hi1年前查看全部
- 氧化还原反应双线桥 很急~2kmno4加热分解为k2mno4+mno2+o2 双线桥单线桥.那天早上缺课,对这种同一元素
氧化还原反应双线桥 很急~
2kmno4加热分解为k2mno4+mno2+o2 双线桥单线桥.那天早上缺课,对这种同一元素被两个物质所分为不同的化合价怎么计算得失电子数不太清楚怎么做. lqm703921061年前3
lqm703921061年前3 -
 蓝星晨 共回答了18个问题
蓝星晨 共回答了18个问题 |采纳率88.9%2KMnO4〓▲K2MnO4+MnO2+O2↑(▲是加热符)
双线桥:KMnO4指向K2MnO4(桥上标:得到1e-)和MnO2(得到3e-),或者一起写,得到4e-,氧化剂
2KMnO4指向O2,失去4e-,还原剂
单线:2KMnO4的0指向Mn,4e(单线不用写得失,因为本来就代表电子的流向,从O硫到Mn)1年前查看全部
- 在反应2KMnO4+16HCl=2KCl+2mNcl2+5Cl2+8H2O中 (1)氧化产物与还原产物的质量比;
在反应2KMnO4+16HCl=2KCl+2mNcl2+5Cl2+8H2O中 (1)氧化产物与还原产物的质量比;
(2)被氧化与未被氧化的HCl的质量之比是
(3)若有73gHCl被氧化,电子转移的总数为——;产生Cl2的质量为——克 uu让我更快乐11年前1
uu让我更快乐11年前1 -
 FreshOutlook 共回答了17个问题
FreshOutlook 共回答了17个问题 |采纳率82.4%1.m(cl2):m(MnCl2)= 355:252
2.5:3
3.2mole-,71克1年前查看全部
- 高锰酸钾与硫酸锰反应2KMnO4+3MnSO4+2H2O===5MnO2+2H2SO4+K2SO4(反应产物里的MnO2
高锰酸钾与硫酸锰反应
2KMnO4+3MnSO4+2H2O===5MnO2+2H2SO4+K2SO4
(反应产物里的MnO2+H2SO4会反应啊?)
这两个方程的ph都是5。
MnO4-+3Fe2++7H2O=3Fe(OH)3↓+ MnO2+5H+(生成物氢氧化铁和氢离子也会反应啊?可是实验是生成了氢氧化铁沉淀) 上海滩之大亨1年前3
上海滩之大亨1年前3 -
 sfw0415 共回答了21个问题
sfw0415 共回答了21个问题 |采纳率85.7%反应产物里的MnO2+H2SO4会反应
稀H2SO4不反应
浓H2SO4反应
Fe(OH)3在酸性能沉淀,0.1mol/LFeCl3 在PH=2开始沉淀,PH=4沉淀完全1年前查看全部
- 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中( )
在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中( )
A.Cl2是还原产物
B.□处对应的物质为H2O
C.氧化剂与还原剂物质的量之比为1:8
D.若1mol KMnO4参加反应,转移的电子的物质的量是5mol 右印记1年前1
右印记1年前1 -
 zeroflower 共回答了23个问题
zeroflower 共回答了23个问题 |采纳率87%解题思路:在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中,Mn元素化合价降低,被还原,在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,由质量守恒可知,还应生成H2O,以此解答.A.反应中Cl元素化合价升高,被氧化,Cl2为氧化产物,故A错误;
B.由质量守恒可知,□处对应的物质为H2O,故B正确;
C.反应中HCl表现为酸性和还原性,由方程式可知,当2molKMnO4参加反应,则有10molHCl被还原,则氧化剂与还原剂物质的量之比为1:5,故C错误;
D.反应中Mn元素化合价由+7价降低到+2价,化合价变化5价,则若1mol KMnO4参加反应,转移的电子的物质的量是5mol,故D正确.
故选BD.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的特点,从元素化合价的角度解答该题,难度不大.1年前查看全部
- 在常温下,发生下列几种反应①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
在常温下,发生下列几种反应①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O ②Cl2+2NaBr=2NaCl+Br2 ③Br2+2FeBr2=2FeBr3根据上述反应,下列结论正确的是( )
A.还原性强弱顺序为:Br->Fe2+>Cl-
B.氧化性强弱顺序为:MnO4->Cl2>Br2>Fe3+
C.反应①中,当生成1mol Cl2时,被氧化的HCl为3.2mol
D.溶液中可发生反应:2Fe3++2Cl-=2Fe2++Cl2↑ guye12761年前1
guye12761年前1 -
 solomark 共回答了17个问题
solomark 共回答了17个问题 |采纳率82.4%解题思路:A、根据还原剂的还原性>还原产物还原性判断.
B、根据氧化剂的氧化性>氧化产物氧化性判断.
C、反应①中只有氯元素被氧化,根据氯原子守恒计算.
D、氯气氧化性比Fe3+强,该离子反应不能发生.①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂为KMnO4,氧化产物为Cl2,所以氧化性KMnO4>Cl2;还原剂为HCl,还原产物为 MnCl2,所以还原性HCl>MnCl2;
②Cl2+2NaBr=2NaCl+Br2 ,氧化剂为Cl2,氧化产物为Br2,所以氧化性Cl2>Br2;还原剂为NaBr,还原产物为NaCl,所以还原性NaBr>NaCl;
③Br2+2FeBr2=2FeBr3,氧化剂为Br2,氧化产物为,所以氧化性Br2>Fe3+;还原剂为Fe2+,还原产物为Br-,所以还原性Fe2+>Br-;
A、由上述分析可知,还原性强弱顺序为:Fe2+>Br->Cl-,故A错误;
B、由上述分析可知,氧化性强弱顺序为:MnO4->Cl2>Br2>Fe3+,故B正确;
C、反应①中只有氯元素被氧化,氯原子守恒可知,1mol Cl2时,被氧化的HCl为2mol,参加反应的HCl为3.2mol,故C错误;
D、由上述分析可知,氧化性强弱顺序为:MnO4->Cl2>Br2>Fe3+,所以氯气能将亚铁离子氧化为铁离子,Fe3+不能氧化Cl-,故D错误.
故选:B.点评:
本题考点: 氧化性、还原性强弱的比较;氧化还原反应的计算.
考点点评: 考查氧化还原反应概念判断、氧化性还原性强弱判断、守恒计算等,难度中等,关键根据元素化合价变化判断氧化剂与还原剂、还原产物与氧化产物.1年前查看全部
- kMno4是一种常用的氧化剂,工业上常用电解法制备,总反应式2k2MnO4+2H2O==(电解)2kMnO4+2kOH+
kMno4是一种常用的氧化剂,工业上常用电解法制备,总反应式2k2MnO4+2H2O==(电解)2kMnO4+2kOH+H2.电解一定时间后,向电解质溶液中滴加酚酞,哪个极呈红色
 zhouxu8309011年前1
zhouxu8309011年前1 -
 装嫩从头开始 共回答了18个问题
装嫩从头开始 共回答了18个问题 |采纳率100%阴极先变红,阴极反应2H+ + 2e- == H2 H+放电后促进了H2O的电离,使阴极的OH-浓度变大.1年前查看全部
- 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H
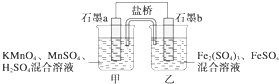 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
(1)此原电池的正极是石墨______(填“a”或“b”),发生______反应.
(2)电池工作时,盐桥中的SO42-移向______(填“甲”或“乙”)烧杯.
(3)两烧杯中的电极反应式分别为
甲______,
乙______.
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5mol•L-1,则反应中转移的电子为______mol. dhallan1年前1
dhallan1年前1 -
 danmawang 共回答了19个问题
danmawang 共回答了19个问题 |采纳率84.2%解题思路:(1)反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,KMnO4作氧化剂,发生还原反应;
(2)电池工作时,阴离子向负极移动;
(3)甲烧杯中的电极发生还原反应;乙烧杯中的电极发生氧化反应;
(4)溶液中的MnSO4浓度由1mol•L-1变为1.5mol•L-1,计算物质的量,结合化合价的变化可计算转移电子的物质的量.(1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,故答案为:a;还原;
(2)电池工作时,SO42-向负极移动,即向乙烧杯移动,故答案为:乙;
(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+═Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-═5Fe3+,
故答案为:MnO4-+5e-+8H+═Mn2++4H2O;5Fe2+-5e-═5Fe3+;
(4)溶液中的MnSO4浓度由1mol•L-1变为1.5mol•L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5mol•L-1×0.2L=0.1mol,转移的电子为0.1mol×5=0.5mol.
故答案为:0.5.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查原电池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握原电池的工作原理,答题时注意体会电极方程式的书写方法,难度不大.1年前查看全部
- 在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是______,氧化产物是____
在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是______,氧化产物是______,氧化产物与还原产物物质的量之比是______,被氧化与未被氧化的HCl的质量之比为______,若有7.3g HCl被氧化,则产生Cl2的质量为______g,转移的电子数为______ mol.
 以永今朝1年前1
以永今朝1年前1 -
 十里的小vv 共回答了19个问题
十里的小vv 共回答了19个问题 |采纳率73.7%解题思路:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,结合氧化还原反应中基本概念来解答.2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,则KMnO4为氧化剂,被还原,还原产物为MnCl2;HCl为还原剂,被氧化,所以Cl2为氧化产物,氧化产物与还原产物物质的量之比是5:2,16molHCl中10mol作还原剂被氧化,则被氧化与未被氧化的HCl的质量之比为10mol:6mol=5:3,若有7.3g HCl被氧化,n(HCl)=[7.3g/36.5g/mol]=0.2mol,由Cl原子守恒可知生成氯气的质量为0.2mol×35.5g/mol=7.1g,转移电子为0.2mol×[0-(-1)]=0.2mol,
故答案为:KMnO4;Cl2;5:2;5:3;7.1;0.2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及转移电子的考查,注重基础知识的巩固,题目难度不大.1年前查看全部
- 在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2+8H2O中,氧化剂是______,氧化产物是_____
在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2+8H2O中,氧化剂是______,氧化产物是______.
 薇安451年前1
薇安451年前1 -
 给自己足够的空间 共回答了15个问题
给自己足够的空间 共回答了15个问题 |采纳率86.7%解题思路:2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,从化合价的角度判断相关概念,以此解答.2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,被氧化,则氧化产物为Cl2,
故答案为:KMnO4;Cl2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 关于Mn的化学反应问题 5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2此反应中,H2
关于Mn的化学反应问题
5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2
此反应中,H2O2被氧化,氧气中的氧全是H2O2中的氧来的,为什么KMnO中的氧不会提供氧气中的氧呢?
请不要以化学式配平的角度来解答此问题,
另外,氧化还原反应中的不交叉定律我也知道,有没有可能KMnO4中的氧一部分变为氧气中零价的氧,一部分还是-2价的氧,而H2O2中的氧全部变为0价的氧呢?
这也满足氧化还原反应中的不交叉定律啊?
回答时请说详细点 谢 qiu听雨1年前3
qiu听雨1年前3 -
 kan1984 共回答了15个问题
kan1984 共回答了15个问题 |采纳率100%这个反应的条件是正常条件
我们通过经验知道,像SO4^2-、PO4^3-、MnO4-这类含氧酸根是很稳定的,一般条件的化学反应难以破坏
反而,H2O2的结构为H-O-O-H,其中有很容易断裂的过氧键,可以释放出O原子,O原子又结合成氧分子
基于这些道理,可以相信氧气中的氧全是H2O2中的氧来的
并且用同位素标记应该也能证明这一结论
这属于客观科学事实
这样讲可以理解么?1年前查看全部
- 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,表现还原性的HCl与表现酸性的HC
在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,表现还原性的HCl与表现酸性的HCl的质量之比是( )
A. 1:10
B. 10:1
C. 3:5
D. 5:3 gzl200820081年前1
gzl200820081年前1 -
 yinyin420 共回答了18个问题
yinyin420 共回答了18个问题 |采纳率83.3%解题思路:在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,生成KCl和MnCl2的Cl元素的化合价都为-1价,HCl表现为酸性,生成Cl2中Cl元素的化合价为0价,HCl被氧化,表现为还原性.在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,当有16molHCl参加反应时,生成KCl和MnCl2的Cl元素的化合价都为-1价,HCl表现为酸性,物质的量为6mol,生成Cl2中Cl元素的化合价为0价,HCl被氧化,表现为还原性,物质的量为10mol,则表现还原性的HCl与表现酸性的HCl的质量之比是10:6=5:3,
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,题目难度不大,注意从化合价变化的角度分析,盐酸在反应中起到酸性和还原剂的作用.1年前查看全部
- 高锰酸钾与盐酸反应一定要浓盐酸才发生16HCl+2KMnO4=5Cl2气体符号+8H2O+2MnCl2+2KCl 这个反
高锰酸钾与盐酸反应
一定要浓盐酸才发生16HCl+2KMnO4=5Cl2气体符号+8H2O+2MnCl2+2KCl 这个反应么? angelababy1年前3
angelababy1年前3 -
 沙发之王 共回答了14个问题
沙发之王 共回答了14个问题 |采纳率92.9%稀盐酸也反应,但如果要制取Cl2,那么最好用浓盐酸,这样产率比较高.因为Cl2能溶于水,如果盐酸太稀,那么CL2就直接溶于水而无法制的Cl2了1年前查看全部
- 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O的反应中,氧化剂是______,还原剂是____
在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O的反应中,氧化剂是______,还原剂是______,电子转移的总数为______,被氧化与未被氧化的HCl的物质的量之比为______.
 麦子_麦子1年前1
麦子_麦子1年前1 -
 wangtao0120 共回答了11个问题
wangtao0120 共回答了11个问题 |采纳率100%解题思路:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,该反应中转移10e-,以此来解答.2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,则KMnO4为氧化剂,Cl元素的化合价由-1价升高为0,则HCl为还原剂,
该反应中转移电子为2×(7-2)=10e-,
由反应可知,16molHCl参加反应时,其中10molHCl作还原剂,6mol作酸,则被氧化与未被氧化的HCl的物质的量之比为10mol:6mol=5:3,
故答案为:KMnO4;HCl;10e-;5:3.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确反应中元素的化合价变化即可解答,注意HCl在反应中的作用,Cl的化合价升高时作还原剂被氧化,而生成盐时作酸,题目难度不大.1年前查看全部
- 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,被氧化与被还原物质的物质的量之比为(
在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,被氧化与被还原物质的物质的量之比为( )
A.1:8
B.2:5
C.1:5
D.5:1 冰城美人1年前1
冰城美人1年前1 -
 手和的 共回答了15个问题
手和的 共回答了15个问题 |采纳率100%解题思路:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,结合氧化还原反应中基本概念来解答.2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,则KMnO4为氧化剂,被还原,还原产物为MnCl2;HCl为还原剂,被氧化,所以Cl2为氧化产物,16molHCl中10mol作还原剂被氧化,则被氧化与被还原物质的物质的量之比为10mol:2mol=5:1,
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意从元素化合价变化的角度认识氧化还原反应的相关概念和物质的性质,难度不大.1年前查看全部
- 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,______是氧化剂,_____
在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,______是氧化剂,______元素被氧化,氧化产物是______,此反应中,HCl表现的性质有______性和______性.
 chenbiao312554681年前1
chenbiao312554681年前1 -
 elizabethsh 共回答了21个问题
elizabethsh 共回答了21个问题 |采纳率85.7%解题思路:氧化还原反应中个,化合价降低元素所在的反应物是氧化剂,该元素被还原,对应产物是还原产物;化合价升高元素所在的反应物是还原剂,该元素被氧化,对应产物是氧化产物,还原剂具有还原性.在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,Mn元素化合价降低,所以KMnO4 是氧化剂,
HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,对应产物Cl2是氧化产物,
盐酸中的Cl有部分转化为化合价不变的氯化钾中去,也体现了盐酸的酸性,
故答案为:KMnO4 ;Cl(或氯);Cl2;酸;还原.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查学生氧化还原反应中的基本概念,可以根据所学知识进行回答,难度不大.1年前查看全部
- 双线桥画法在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O这个反应中,Mn从﹢7变到﹢2,
双线桥画法
在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O这个反应中,Mn从﹢7变到﹢2,不是得到5个电子嘛?为什么那个线桥上面是2*5个电子捏?这个2是从哪里来的? k90821年前1
k90821年前1 -
 西点幽灵 共回答了16个问题
西点幽灵 共回答了16个问题 |采纳率87.5%1年前查看全部
- 在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2+8H2O中,氧化剂是______,氧化产物是_____
在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2+8H2O中,氧化剂是______,氧化产物是______.
 miguantang1年前1
miguantang1年前1 -
 yannanfei_2006 共回答了15个问题
yannanfei_2006 共回答了15个问题 |采纳率93.3%解题思路:2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,从化合价的角度判断相关概念,以此解答.2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,被氧化,则氧化产物为Cl2,
故答案为:KMnO4;Cl2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,表现还原性的HCl与表现酸性的HC
在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,表现还原性的HCl与表现酸性的HCl的质量之比是
HCl表现为酸性,物质的量为6mol,生成Cl2中Cl元素的化合价为0价,HCl被氧化,表现为还原性,物质的量为10mol,如何判断多少的HCL被还原,多少的HCL呈酸性 怎么回忆1年前1
怎么回忆1年前1 -
 zj_924 共回答了11个问题
zj_924 共回答了11个问题 |采纳率90.9%从生成物看,生成5个Cl2,有10个HCl被氧化,有6个Cl的化合价没有变化,起的是酸的作用,所以
表现还原性的HCl与表现酸性的HCl的质量之比是10:6=5:3.1年前查看全部
- 氧化还原反应综合题:在反应2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂...
氧化还原反应综合题:在反应2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂...
氧化还原反应综合题:
在反应2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是,氧化产物是;若有1mol KMnO4参加反应时,该反应转移电子的个数是;若反应生成11.2LCl-2(标准状况)则被氧化的氯化氢为mol;请在下面方框中用“单线桥法”表示该反应中电子转移的方向和数目.
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O 海边来客1年前0
海边来客1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O反应中还原剂是______,还原产物是______
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O反应中还原剂是______,还原产物是______.
大家帮帮忙啊,
Cu+4HNO3=Cu(NO3)2+2NO2+2H2O氧化剂是_____ 氧化产物是_____,还原剂是______,还原产物是______.
谢谢.
在问下 在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O 氧化剂是____
氧化产物是______. 飘柔风中1年前4
飘柔风中1年前4 -
 丽妮 共回答了13个问题
丽妮 共回答了13个问题 |采纳率92.3%Cu+4HNO3=Cu(NO3)2+2NO2+2H2O,氧化剂是HNO3 氧化产物NO2,还原剂是_Cu_,还原产物是Cu(NO3)2.
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O反应中还原剂是___HCl___,还原产物是__Cl2____1年前查看全部
- 在反应2KMnO4+16HCl=2KCl+2mNcl2+5Cl2+8H2O中
在反应2KMnO4+16HCl=2KCl+2mNcl2+5Cl2+8H2O中
当反应生成0.05mol Cl2时,反应中有——个电子发生转移,有——mol盐酸参加反应,——mol盐酸被氧化 shenyanyi1年前1
shenyanyi1年前1 -
 柳细细 共回答了17个问题
柳细细 共回答了17个问题 |采纳率94.1%当反应生成0.05mol Cl2时,反应中有0.1个电子发生转移,有0.16mol盐酸参加反应,0.1mol盐酸被氧化1年前查看全部
- 反应2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是(填化学式)______,氧化产物
反应2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是(填化学式)______,氧化产物是(填化学式)______,若生成7.1gCl2,被氧化的HCl是______mol.转移电子的数目是______.
 夏小七1年前1
夏小七1年前1 -
 lujun203 共回答了15个问题
lujun203 共回答了15个问题 |采纳率80%解题思路:2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,则KMnO4为氧化剂,Cl元素的化合价升高,失去电子被氧化,则Cl2为氧化产物;若生成7.1gCl2,其物质的量为[7.1g/71g/mol]=0.1mol,由Cl原子守恒可知被氧化的HCl是0.2mol,转移电子为0.2mol×[0-(-1)]×NA=0.2NA,
故答案为:KMnO4;Cl2; 0.2;0.2NA.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子计算的考查,题目难度不大.1年前查看全部
- 反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O 若生成标准状况下氯气11.2L则参加反应HC
反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O 若生成标准状况下氯气11.2L则参加反应HCL的量为 多少
还原剂HCL占多少(填分说)
在整个反映中转移的电子数为 远方的女孩子1年前5
远方的女孩子1年前5 -
 cmjdksifuasdi 共回答了15个问题
cmjdksifuasdi 共回答了15个问题 |采纳率93.3%反应中,消耗16 mol HCl,
只有10 mol HCl被氧化为5 mol Cl2,
剩余6 mol HCl的Cl-进入到MnCl2中
生成标准状况下氯气 0.5 mol,所以消耗 1.6 mol HCl
被氧化的HCl只有 1 mol,即还原剂HCl为1 mol
1.6 mol 1 mol
1.6mol 转移电子数为1mol1年前查看全部
- 己知反应中2KMNO4+16HCL(浓)=2KCL+MNCL2+5CKL2↑+8H2O,若有71克cl2生成.求:(1)
己知反应中2KMNO4+16HCL(浓)=2KCL+MNCL2+5CKL2↑+8H2O,若有71克cl2生成.求:(1)参加反应的HCL的质量?(2)被氧化的HCL的质量?
 繁华有憔悴1年前1
繁华有憔悴1年前1 -
 waxbnmklpe 共回答了16个问题
waxbnmklpe 共回答了16个问题 |采纳率68.8%2KMNO4+16HCL(浓)=2KCL+MNCL2+5CL2↑
16*36.5 5*71
116.8g 71g
(1)参加反应的HCL的质量 116.8g
(2)被氧化的HCL的质量
被氧化的HCL和没有被氧化的物质的量的比为10:6
被氧化的HCL的质量116.8g*(10/16)=73g1年前查看全部
- 化学2KMnO4+16HBr=5Br2 +2MnBr2+2KBr+8H2O
化学2KMnO4+16HBr=5Br2 +2MnBr2+2KBr+8H2O
如果消耗 0点2 Mol的氧化剂,那被氧化的还原剂是 多少 Mol《提示,高门酸甲是 氧化剂》 yanzh1年前1
yanzh1年前1 -
 weihe 共回答了21个问题
weihe 共回答了21个问题 |采纳率76.2%被还原的是HBr,Br从-1价变到了0价
KMnO4中的Mn从+7变到了+2
根据电子转移守恒
所以氧化剂和还原剂的反应比例应该是1:5
所以消耗0.2mol的氧化剂,被氧化的还原剂是1.0mol1年前查看全部
- 5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S+8H2O
5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S+8H2O
1.___是还原剂
2___是氧化剂
3还原产物是___
4被氧化的物质是___
5被氧化的物质是___
6.发生氧化反应的物质是—
7.被还原的物质是---
8 发生还原反应的物质是-- 淘金者1年前2
淘金者1年前2 -
 nntt 共回答了18个问题
nntt 共回答了18个问题 |采纳率88.9%高锰酸钾是氧化剂,硫化氢是还原剂.还原产物硫酸锰.氧化产物硫.被氧化的物质硫化氢.被还原的物质是高锰酸钾.发生氧化反应的物质是硫化氢.发生还原反应的是高锰酸钾1年前查看全部
- (2012•镇江二模)已知①5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4(无色溶液)②SO2
(2012•镇江二模)已知
①5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4(无色溶液)
②SO2能漂白某些有色物质,如将SO2通入品红溶液中,品红溶液褪色.
③一些含硫物质的溶解性(20℃):
含硫物质 K2SO4 MnSO4 CaSO4 CaSO3 FeSO4 Fe2(SO4)3 溶解性 溶 溶 微溶 难溶 溶 溶 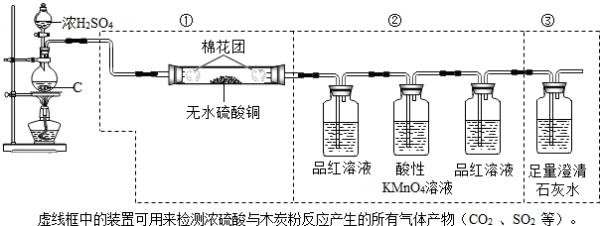
请回答下列问题:
(1)写出圆底烧瓶中反应的化学方程式:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O△ .C+2H2SO4(浓).
2SO2↑+CO2↑+2H2O△ .
(2)装置中第①部分的作用是______,可观察到的现象是______.第②部分最后一个洗气瓶中品红溶液的作用是______.
(3)若将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则不能检出的物质是______.
(4)若将仪器的连接顺序改为①、③、②,则只可检出的物质是______. jokerbao1年前1
jokerbao1年前1 -
 howardzj 共回答了23个问题
howardzj 共回答了23个问题 |采纳率82.6%解题思路:根据题目提供的信息,二氧化硫也能使澄清石灰水变浑浊,是因为二氧化硫和氢氧化钙反应生成亚硫酸钙白色沉淀和水的缘故.由信息知,二氧化硫具有能使石灰水变浑浊和使高锰酸钾溶液、品红溶液褪色的性质,二氧化碳也能使澄清的石灰水变浑浊.无水硫酸铜是检验是否有水生成的,只要白色变蓝色,就一定有水生成;木炭和浓硫酸在加热的条件下反应生成二氧化碳和二氧化硫和水,因此②中品红溶液和高锰酸钾溶液都变无色,③中澄清石灰水变浑浊.检验生成物时,为避免干扰,要先检验水,再检验二氧化硫,最后检验二氧化碳.(1)木炭和浓硫酸在加热的条件下反应生成二氧化碳和二氧化硫和水,配平即可;故答案为:C+2H2SO4(浓)
△
.
2SO2↑+CO2↑+2H2O
(2)无水硫酸铜是检验是否有水生成的,只要白色变蓝色,就一定有水生成;第②部分最后一个洗气瓶中品红溶液是检验二氧化硫是否被完全除去;故答案为:检验是否有水生成;白色变蓝色;检验二氧化硫是否被完全除去
(3)若将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则不能检出的物质是水蒸气,因为品红和高锰酸钾溶液中都有水;故答案为:水蒸气
(4)若将仪器的连接顺序改为①、③、②,则只可检出的物质是水蒸气,因为二氧化硫和二氧化碳都能使澄清石灰水变浑浊,故答案为:水蒸气点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于实验探究题,既有气体的性质又有气体与水反应后生成物的检验,还有化学方程式的书写,综合性比较强.本题根据题目提供的信息,结合实验探究的一般步骤和酸的性质等知识来解决,还要注意化学方程式的书写和配平.本考点主要出现在实验题中.1年前查看全部
- 在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,未被氧化的HCl与被氧化的HCl的物质
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,未被氧化的HCl与被氧化的HCl的物质的量之比是( )
A. 16:5
B. 2:5
C. 1:4
D. 3:5 sophia96661年前1
sophia96661年前1 -
 海风花妞妞 共回答了17个问题
海风花妞妞 共回答了17个问题 |采纳率94.1%解题思路:反应中盐酸起到氧化剂和酸性的所用,生成Cl2被氧化,生成KCl和MnCl2表现为酸性,以此解答该题.在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,当有16molHCl参加反应时,生成5molCl2,Cl元素化合价升高,被氧化,则被氧化的HCl为10mol,未被氧化的HCl为16mol-10mol=6mol,未被氧化的HCl与被氧化的HCl的物质的量之比为6mol:10mol=3:5,
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及守恒法应用为解答的关键,侧重分析与计算能力的综合考查,题目难度不大.1年前查看全部
- 在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,未被氧化的HCl与被氧化的HCl的物质
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,未被氧化的HCl与被氧化的HCl的物质的量之比是( )
A. 16:5
B. 2:5
C. 1:4
D. 3:5 jack19liu1年前1
jack19liu1年前1 -
 lv0712 共回答了21个问题
lv0712 共回答了21个问题 |采纳率90.5%解题思路:反应中盐酸起到氧化剂和酸性的所用,生成Cl2被氧化,生成KCl和MnCl2表现为酸性,以此解答该题.在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,当有16molHCl参加反应时,生成5molCl2,Cl元素化合价升高,被氧化,则被氧化的HCl为10mol,未被氧化的HCl为16mol-10mol=6mol,未被氧化的HCl与被氧化的HCl的物质的量之比为6mol:10mol=3:5,
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及守恒法应用为解答的关键,侧重分析与计算能力的综合考查,题目难度不大.1年前查看全部
- 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,被氧化与被还原物质的物质的量之比为(
在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,被氧化与被还原物质的物质的量之比为( )
A. 1:8
B. 2:5
C. 1:5
D. 5:1 xie6268765411年前1
xie6268765411年前1 -
 Aeasky 共回答了22个问题
Aeasky 共回答了22个问题 |采纳率90.9%解题思路:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,结合氧化还原反应中基本概念来解答.2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,则KMnO4为氧化剂,被还原,还原产物为MnCl2;HCl为还原剂,被氧化,所以Cl2为氧化产物,16molHCl中10mol作还原剂被氧化,则被氧化与被还原物质的物质的量之比为10mol:2mol=5:1,
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意从元素化合价变化的角度认识氧化还原反应的相关概念和物质的性质,难度不大.1年前查看全部
- 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,
在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,
(1)氧化剂是______,氧化产物是______.
(2)被氧化与未被氧化的HCl的质量之比为______,若有7.3gHCl被氧化,产生Cl2的质量为______g,转移电子______ mol. ℡冷焰血凝シ1年前1
℡冷焰血凝シ1年前1 -
 撒琳娜 共回答了19个问题
撒琳娜 共回答了19个问题 |采纳率89.5%解题思路:反应中Mn元素化合价降低,KMnO4被还原,则为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,根据方程式可知当有16molHCl参加反应,有10molHCl被氧化,6mol
HCl表现为酸性,以此解答该题.(1)反应中Mn元素化合价降低,KMnO4被还原,则为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,
故答案为:KMnO4;Cl2;
(2)根据方程式可知当有16molHCl参加反应,有10molHCl被氧化,6molHCl表现为酸性,被氧化与未被氧化的HCl的质量之比为10:6=5:3,
n(HCl)=[7.3g/36.5g/mol]=0.2mol,则生成0.1molCl2,m(Cl2)=0.1mol×71g/mol=7.1g,
转移电子为0.2mol,
故答案为:5:3;7.1;0.2.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,题目难度中等,注意根据元素的化合价的变化判断物质在反应中表现出的性质.1年前查看全部
- (1)、在反应2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O中,电子转移总数为----
(1)、在反应2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O中,电子转移总数为--------.
当有1mol电子转移时,有------mol-------(物质名称)被还原.当有80gS析出时,有-----gH2S被-----(氧化/还原)
(2)/ 已知反应:5RxO42-+(4x-6)MnO4-+(12x-8)H+====5xRO2+(4x-6)Mn2++(6x-4)H2O,如有0.2molRxO4^2-参加反映,则反应过程中共转移0.4mol电子.试回答下列问题:
①x的值为
②参加反应的H+物质的量是----
(3)、氧化铜在高温下发生分解反应,其反应方程式可表示为:4CuO=2Cu2O+O2,
①氧化剂是?还原剂?氧化产物?还原产物?
若反应中转移电子的物质的量为1mol,则在标准状况下产生气体的体积为多少升?
②现将80gCuO进行灼烧,测得固体残渣含铜的质量分数为86%,请通过计算该CuO的分解百分率. zzx995271年前1
zzx995271年前1 -
 soplarcini 共回答了14个问题
soplarcini 共回答了14个问题 |采纳率100%(1)只有Mn的化合价是降低的,由高锰酸钾中的+7价,变到了硫酸锰中的+2价,降低了5价,前边的化学计量数是2,5乘2等于10,所以电子转移总数为10,10mol电子转移,对应2mol高锰酸钾被还原,所以1mol电子转移时,有0.2mol高锰酸钾被还原.此反应中一共有5mol×32g/mol=160g S 生成,即有5mol S 被还原,所以当有80g S 析出时有2.5mol×34=85g H2S被氧化1年前查看全部
- 化学KClO3催化分解MnO2催化KClO3分解为2KClO3+2MnO2=2KMnO4+O2+2Cl2KMnO4=K2
化学KClO3催化分解
MnO2催化KClO3分解为
2KClO3+2MnO2=2KMnO4+O2+2Cl
2KMnO4=K2MnO4+MnO2+O2
K2MnO4+2Cl=2KCl+MnO2+O2
那么CuO如何催化? 曾经的绿叶棕1年前3
曾经的绿叶棕1年前3 -
 LXCFY007 共回答了18个问题
LXCFY007 共回答了18个问题 |采纳率88.9%2KClO3+2CUO=2KCUO3+O2+2Cl
2KCUO3=K2CUO3+CUO+O2
K2CUO3+2Cl=2KCl+CUO+O21年前查看全部
- 在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是______,氧化产物是____
在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是______,氧化产物是______,氧化产物与还原产物物质的量之比是______,被氧化与未被氧化的HCl的质量之比为______,若有7.3g HCl被氧化,则产生Cl2的质量为______g,转移的电子数为______ mol.
 蚂蚁VS上帝1年前1
蚂蚁VS上帝1年前1 -
 fenghuanle 共回答了25个问题
fenghuanle 共回答了25个问题 |采纳率80%解题思路:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,结合氧化还原反应中基本概念来解答.2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,则KMnO4为氧化剂,被还原,还原产物为MnCl2;HCl为还原剂,被氧化,所以Cl2为氧化产物,氧化产物与还原产物物质的量之比是5:2,16molHCl中10mol作还原剂被氧化,则被氧化与未被氧化的HCl的质量之比为10mol:6mol=5:3,若有7.3g HCl被氧化,n(HCl)=[7.3g/36.5g/mol]=0.2mol,由Cl原子守恒可知生成氯气的质量为0.2mol×35.5g/mol=7.1g,转移电子为0.2mol×[0-(-1)]=0.2mol,
故答案为:KMnO4;Cl2;5:2;5:3;7.1;0.2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及转移电子的考查,注重基础知识的巩固,题目难度不大.1年前查看全部
- 二氧化硫和高锰酸钾、水反应生成硫酸锰,硫酸钾和硫酸 5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2S
二氧化硫和高锰酸钾、水反应生成硫酸锰,硫酸钾和硫酸 5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
可是这个方程式中并未体现氢离子,那就相当于在中性溶液中发生的,为什么又要求是在酸性溶液中发生 jenny_present1年前4
jenny_present1年前4 -
 舞起狂澜陈 共回答了18个问题
舞起狂澜陈 共回答了18个问题 |采纳率88.9%KMnO4的氧化性与溶液的酸碱度有很大的关系.在高中阶段,要求学生了解KMnO4的氧化性随pH的升高而降低.在酸性条件下,KMnO4能被还原为Mn2+;在中性条件下,KMnO4能被还原为MnO2;在碱性条件下,KMnO4只能被还原为K2MnO4,其中,酸性条件和碱性条件下的KMnO4的氧化性是必须熟练掌握的.在上述方程式中,KMnO4被还原为Mn2+,表明是在酸性条件下进行反应.此外,氢离子在这个反应中起到的作用是增大氧化剂的电位差(这是大学内容),换言之,它改变了氧化剂的氧化性,改变了反应产物,使反应发生实质性的变化,而不是起催化作用(催化剂只是改变了反应的过程,不改变反应的结果).1年前查看全部
- 5H2S+2KMnO4+3H2SO4=5S+2MnSO4+K2SO4+8H2O如果反应中消耗0.3摩尔氢离子,转移电子的
5H2S+2KMnO4+3H2SO4=5S+2MnSO4+K2SO4+8H2O如果反应中消耗0.3摩尔氢离子,转移电子的物质的量为?要详解说
 美宏1年前1
美宏1年前1 -
 hayku 共回答了21个问题
hayku 共回答了21个问题 |采纳率85.7%H2S 是弱电解质 电离的H+ 可以忽略不计 所以 溶液中只有 硫酸电离的H+ 在上面的平衡式中H+的系数就是6,过程中负二价的S 变为零价 同时 正七价的 Mn 变为 正二价 这个过程中转移的电子量为10个 按照化学方程式的原理 列方程式
H+ .e-
6 .10
0.3 .x
计算可得
本题的答案为 0.5mol电子1年前查看全部
- 反应 2KMnO4+16HCl=2KCl+2mNcl2+5Cl2+8H2O 中
反应 2kmno4+16hcl=2kcl+2mncl2+5cl2+8h2o 中
若有73ghcl被氧化,电子转移总数为 产生cl2的质量为
你会拯救我的 拯救***一个人才 hero12341年前1
hero12341年前1 -
 钓鱼翁123 共回答了7个问题
钓鱼翁123 共回答了7个问题 |采纳率100%16HCl中有有10HCl被氧化,转移电子10个
10HCl-----5Cl2--- 转移电子数10
365---------355-------10
73-----------Y-----------X
X=2摩尔,Y=71克
电子转移总数为 2NA 产生cl2的质量为71克1年前查看全部
- 氧化还原反应问题2KMnO4+16HCl----2KCl+2Mncl2+5Cl2+8H2o中当反应生成1120ml (标
氧化还原反应问题
2KMnO4+16HCl----2KCl+2Mncl2+5Cl2+8H2o中
当反应生成1120ml (标准状况)氯气时有____mol盐酸参加反应,______mol盐酸被氧化 upgu1年前2
upgu1年前2 -
 hnzy123 共回答了13个问题
hnzy123 共回答了13个问题 |采纳率84.6%有0.16mol盐酸参与反应,0.1mol的盐酸被氧化.
需要过程请追问~~
很高兴为您解答 ~~满意请采纳(手机版点“满意”即可)1年前查看全部
- 已知:(1)2FeCl2+Cl2==2FeCl3(2)2KMnO4+16HCl==2KCl+2MnCl2+8H2O+5C
已知:(1)2FeCl2+Cl2==2FeCl3(2)2KMnO4+16HCl==2KCl+2MnCl2+8H2O+5Cl2↑
已知:(1)2FeCl2+Cl2==2FeCl3(2)2KMnO4+16HCl==2KCl+2MnCl2+8H2O+5Cl2↑(3)2FeCl3+KI==2FeCl2+2KCl+I2.某溶液中含有Fe2+和I-,现欲只除去I-,可加入过量的试剂是?
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
我选的答案是C.但我同学说正确答案是A,听他分析好像也有道理.为什么要选A?C为什么错?正确答案是什么?求分析. 放纵丿夜1年前4
放纵丿夜1年前4 -
 meihao2 共回答了18个问题
meihao2 共回答了18个问题 |采纳率94.4%正确答案应该是C.因为A会氧化Fe2+ 与要求不符1年前查看全部
- 10HBr+2KMnO4+3H2SO4=5Br2+2MnSO4+K2SO4+8H2O 离子方程式
 wuhanxumin1年前1
wuhanxumin1年前1 -
 五亭 共回答了16个问题
五亭 共回答了16个问题 |采纳率87.5%+ - - 2+
16H +10Br +2MnO4 =5Br2=2Mn +8H2O1年前查看全部
- 写出下列化学反应方程式:(1)加热高锰酸钾制氧气2KMnO4 △ . K2MnO4+MnO2+O2↑2KMnO4
写出下列化学反应方程式:
(1)加热高锰酸钾制氧气2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4
K2MnO4+MnO2+O2↑△ .
(2)加热氯酸钾与二氧化锰的混合物制氧气2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3
2KCl+3O2↑MnO2 .△
(3)实验室用过氧化氢二氧化锰的混合物制氧气2H2O2
2H2O+O2↑MnO2 .2H2O2
2H2O+O2↑MnO2 .
(4)实验室用稀盐酸与石灰石反应制二氧化碳______. 草字惊1年前1
草字惊1年前1 -
 huangyuan8900 共回答了11个问题
huangyuan8900 共回答了11个问题 |采纳率81.8%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式是2KMnO4
△
.
K2MnO4+MnO2+O2↑.
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
(3)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2
MnO2
.
2H2O+O2↑.
(4)实验室用稀盐酸与石灰石反应制二氧化碳,同时生成氯化钙、水,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)2KMnO4
△
.
K2MnO4+MnO2+O2↑;(2)2KClO3
MnO2
.
△2KCl+3O2↑;(3)2H2O2
MnO2
.
2H2O+O2↑;(4)CaCO3+2HCl═CaCl2+H2O+CO2↑.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等1年前查看全部
- 二氧化硫与酸性高锰酸钾溶液反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4为什么没有沉淀气体
二氧化硫与酸性高锰酸钾溶液反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4为什么没有沉淀气体水什么的生成?
这样为什么可以反应啊 1__t1年前1
1__t1年前1 -
 asdgjawrklrtsg 共回答了16个问题
asdgjawrklrtsg 共回答了16个问题 |采纳率81.3%这是一个氧化还原反应,不是复分解反应,你所说的沉淀气体水是复分解反应发生的条件1年前查看全部
- 解释一下原因:4KMnO4+4H2O2+6H2SO4=2K2SO4+4MnSO4+10H2O+7O2和2KMnO4+5H
解释一下原因:4KMnO4+4H2O2+6H2SO4=2K2SO4+4MnSO4+10H2O+7O2和2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O
同样的反应物和生成物,为什么有两种配平?若反应转移了2mol电子,则产生的气体在标准状况下的体积为多少升?(解释尽量详细!快!在线等!)
第二个反应写错了,应该是2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2 wangxujun071年前3
wangxujun071年前3 -
 一烟难烬 共回答了17个问题
一烟难烬 共回答了17个问题 |采纳率100%这只是高锰酸钾与双氧水谁过量的问题,高锰酸钾过量就是第一个反应,反之就第二个;有时候当双氧水过量的时候先发生第一个反应,随着反应的发生双氧水会减少,可能会发生第二个反映,高中出题常这样出.;第一个反应转移两摩尔电子,标况下产生15.68升氧气:反应第二个产生22.4升氧气1年前查看全部
- 3SO2+2KMNO4+2H2SO4==K2SO4+2MNSO4+2H2O 二氧化硫能使高锰酸钾(酸性)褪色的方程式对吗
 huang11421年前1
huang11421年前1 -
 风林海啸 共回答了22个问题
风林海啸 共回答了22个问题 |采纳率86.4%你自己数都知道S原子不守恒了,而且你反应物也错了,难怪你配不平.
5SO2+2H2O+2KMnO4=2MnSO4+2H2SO4+K2SO41年前查看全部
- 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,表现还原性的HCl与表现酸性的HC
在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,表现还原性的HCl与表现酸性的HCl的质量之比是( )
A.1:10
B.10:1
C.3:5
D.5:3 alian2141年前1
alian2141年前1 -
 迷失的海岛 共回答了17个问题
迷失的海岛 共回答了17个问题 |采纳率94.1%解题思路:在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,生成KCl和MnCl2的Cl元素的化合价都为-1价,HCl表现为酸性,生成Cl2中Cl元素的化合价为0价,HCl被氧化,表现为还原性.在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,当有16molHCl参加反应时,生成KCl和MnCl2的Cl元素的化合价都为-1价,HCl表现为酸性,物质的量为6mol,生成Cl2中Cl元素的化合价为0价,HCl被氧化,表现为还原性,物质的量为10mol,则表现还原性的HCl与表现酸性的HCl的质量之比是10:6=5:3,
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,题目难度不大,注意从化合价变化的角度分析,盐酸在反应中起到酸性和还原剂的作用.1年前查看全部
- 高锰酸钾见光时分解成什么?3楼的振振有辞,高锰酸钾见光的确能分解,所以才用灰色玻璃瓶,而且谁都知道2KMnO4=K2Mn
高锰酸钾见光时分解成什么?
3楼的振振有辞,高锰酸钾见光的确能分解,所以才用灰色玻璃瓶,而且谁都知道2kmno4=k2mn04+mno2+o2(气体符号) 条件加热
自己***还说别人! 金陵玉殿莺啼晓1年前1
金陵玉殿莺啼晓1年前1 -
 tiy836324880 共回答了19个问题
tiy836324880 共回答了19个问题 |采纳率89.5%见光和加热的反应是一样的~加热也只是为反应提供能量,
光照的效果是一样的~有区别的就是反应强度的不同1年前查看全部
大家在问
- 1给水通电后,水会分解成氧气和氢气
- 21.5的取值范围是多少
- 3初一数学换元法二分之x+y+三分之x-y=7三分之x+y-四分之x-y=-1快呀!~
- 4我们的还是他们的用英文怎么说
- 5已知函数f(x)=b−2x2x+1为定义在区间[-2a,3a-1]上的奇函数,则a+b=______.
- 6设函数f(x)=x2ex-1+ax3+bx2,已知x=-2和x=1为f(x)的极值点.
- 7(10分)如图所示,一质量为M=1.2kg的物块静止在桌面边缘,桌面离水平地面的高度为h=1.8m。一质量为m=20g的
- 8等效氢相关问题请一一回答,并说明相关理由,万分感谢乙烷CH3CH3有几种环境的氢?一氯乙烷CH3CH2Cl有几种环境的氢
- 9根据以下资料回答问题.氨气在通常情况下是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,水溶液为氨水,氨气能与硫
- 10数学锐角三角函数,Rt三角形ABC中,角C=90度,且sinA+cosB=根号下3,则角A为多少度?
- 11难道你要违背人类的真理吗?(换个说法,使句子意思不变)
- 12我们未来的能源 作文
- 13一些英语情态动词用法的空情态动词后接___,没有___和___的变化.其否定形式是在后面直接加____
- 14有段物理描述我看不懂 文字说的不清楚
- 15把不可实现之事付诸与实践乃非凡毅力之体现,英文翻译字幕说,因为是茨威格的,所以麻烦翻译的到位点