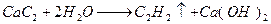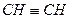碳化钙与氢氧化钙反应会生成什么?
 扇残月魄羞难遮2022-10-04 11:39:544条回答
扇残月魄羞难遮2022-10-04 11:39:544条回答某电石厂的培训手册里面有如下反应:cac2+ca(OH)2=2ca+c2H2 我以为他只是把氧弄丢了。这两者在2000多度的高温下也不反应吗?

已提交,审核后显示!提交回复
共4条回复
 花轩阁 共回答了21个问题
花轩阁 共回答了21个问题 |采纳率100%- 不是任何两个物质放在一起就会反应的.
这两种物质放在一起,不会发生反应.
CaC2+2H2O=C2H2+Ca(OH) 2这是常见的反应,你说的那个反应,真不知道.要说氧没了,可能生成物有氧气?猜测而已,帮不到你很抱歉. - 1年前
 daisy741031 共回答了1345个问题
daisy741031 共回答了1345个问题 |采纳率- 不符合复分解反应发生的条件,所以碳化钙与氢氧化钙不会发生反应,也就没有新物质的生成。某电石厂的培训手册里面有如下反应:cac2+ca(OH)2=2ca+c2H2 我以为他只是把氧弄丢了。这两者在2000多度的高温下也不反应吗?电石CaC2可以水反应 CaC2 + 2H2O = Ca(OH)2 + C2H2↑...
- 1年前
 sunliar 共回答了2个问题
sunliar 共回答了2个问题 |采纳率- 两者之间不反应哎
- 1年前
 多七 共回答了336个问题
多七 共回答了336个问题 |采纳率- 不会发生反应。
但碳酸钙和水反应可以生成氢氧化钙,方程式子如下:
CaC2+2H2O=Ca(OH)2+C2H2(乙炔气体) - 1年前
相关推荐
- (5分)乙炔(C 2 H 2 )是一种重要化工原料,在实验室里可以用碳化钙(CaC 2 )与水反应制取,该反应的化学方程
(5分)乙炔(C 2 H 2 )是一种重要化工原料,在实验室里可以用碳化钙(CaC 2 )与水反应制取,该反应的化学方程式为CaC 2 + 2H 2 O = Ca(OH) 2 + C 2 H 2 ↑。若生成52g乙烯气体,同时可以生成多少熟石灰?
 婧婧Jean1年前1
婧婧Jean1年前1 -
 lookforclover 共回答了11个问题
lookforclover 共回答了11个问题 |采纳率100%(5分)同时可以生成熟石灰的质量为x
CaC 2 + 2H 2 O = Ca(OH) 2 + C 2 H 2 ↑
74 26
x 52g
74∶26 =x∶52g
x = 148g
答:同时可以生成熟石灰的质量为148g。
本题就是一道关于化学方程式的计算题1年前查看全部
- 少许氮化镁投入水中现象是什么?少许碳化钙投入饱和食盐水中现象是什么?
 yuhuan67891年前1
yuhuan67891年前1 -
 naomilau 共回答了18个问题
naomilau 共回答了18个问题 |采纳率100%都生成沉淀和气体
方程式是Mg3N2+6H2O===3Mg(OH)2沉淀+2NH3气体
CaC2+2H2O==Ca(OH)2沉淀+C2H2气体
该反应为实验室制取乙炔,1年前查看全部
- 乙炔(C 2 H 2 )是一种难溶于水、密度比空气略小、易燃烧的气体。实验室常用碳化钙固体(俗称电石,化学式为CaC 2
乙炔(C 2 H 2 )是一种难溶于水、密度比空气略小、易燃烧的气体。实验室常用碳化钙固体(俗称电石,化学式为CaC 2 )与水反应制备乙炔,同时生成氢氧化钙。 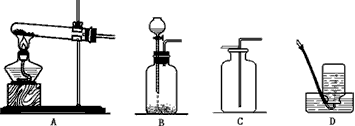
(1)写出制取乙炔的化学方程式: ;
(2)根据上图回答:制取乙炔的反应装置应选用 (填序号,下同),收集方法用 ;
(3)点燃乙炔之前要先 。 爱上深夜1年前1
爱上深夜1年前1 -
 嫦娥奔月0 共回答了14个问题
嫦娥奔月0 共回答了14个问题 |采纳率100%1年前查看全部
- 关于CaC2(碳化钙)和CS2(二硫化钙)电子式的问题
关于CaC2(碳化钙)和CS2(二硫化钙)电子式的问题
前者电子式是Ca2+[:C三C:]- 后者是 :S::C::S:
电子式为什么要这样写呢?
成多少个键怎么看呀? rainyprince1年前1
rainyprince1年前1 -
 aibingzhu 共回答了20个问题
aibingzhu 共回答了20个问题 |采纳率85%成几个键,就是有几个共用电子对.Ca2+[:C三C:]- 这个就是成了三键 :S::C::S:成双键1年前查看全部
- 用氯化氢和乙炔加成生成氯乙烯时,所用的乙炔是由碳化钙置于水中分解出来的,故在乙炔气中含有水蒸气.如果水蒸汽气压超过乙炔气
用氯化氢和乙炔加成生成氯乙烯时,所用的乙炔是由碳化钙置于水中分解出来的,故在乙炔气中含有水蒸气.如果水蒸汽气压超过乙炔气总压的0.1%(乙炔气总压为202kPa),则将会使上述加成反应的汞催化剂中毒失去活性,所以工业生产中要采取冷冻法除去乙炔气中过多的水蒸气.已知冰的蒸气压在0℃时为611Pa,在-15℃时为165Pa,问冷冻乙炔气的温度应为多少?
 劈头士1年前1
劈头士1年前1 -
 晓锵 共回答了19个问题
晓锵 共回答了19个问题 |采纳率84.2%这个,说个思路,前面大部分基本属于废话,只有一句“如果水蒸汽气压超过乙炔气总压的0.1%(乙炔气总压为202kPa)”有用.这句话的意思就是要把水蒸气的压力控制在202pa一下.那么后面让求温度,这就和克克方程联系在一起了.
所以,通过后面两个温度与压力的关系,代入克克方程求出升华焓,然后随便选一个以及压力为202pa再一次代入克克方程就求出温度了1年前查看全部
- “乙炔炭黑”是由碳化钙法或石脑油(粗汽油)热解时副产气分解精制得到的纯度99%以上的乙炔,经连续热解后得到的炭黑.下列关
“乙炔炭黑”是由碳化钙法或石脑油(粗汽油)热解时副产气分解精制得到的纯度99%以上的乙炔,经连续热解后得到的炭黑.下列关于“乙炔炭黑”的说法中不正确的是( )
A.常温下化学性质活泼
B.具有吸附性
C.在一定条件下可还原氧化铜
D.在氧气中完全燃烧的产物是CO2 忧郁胡渣1年前1
忧郁胡渣1年前1 -
 gxbjwt 共回答了21个问题
gxbjwt 共回答了21个问题 |采纳率85.7%解题思路:根据碳在常温下化学性质活泼,具有可燃性、还原性,结合题意进行分析判断.A、“乙炔炭黑”是由碳化钙法或石脑油(粗汽油)热解时副产气分解精制得到的纯度99%以上的乙炔,经连续热解后得到的炭黑,常温下化学性质不活泼,故选项说法错误.
B、由碳的物理性质可知,炭黑不具有吸附性,故选项说法错误.
C、碳具有还原性,在一定条件下可还原氧化铜,故选项说法正确.
D、碳具有可燃性,在氧气中完全燃烧的产物是CO2,故选项说法正确.
故选:AB.点评:
本题考点: 碳的化学性质;碳单质的物理性质及用途.
考点点评: 本题难度不大,掌握碳单质的物理性质与化学性质(可燃性、还原性等)并能灵活运用是正确解答本题的关键.1年前查看全部
- (2014•海南)实验室常用块状固体碳化钙与水反应制备乙炔(C2H2),该反应比二氧化锰催化剂过氧化氢分解更加剧烈.所选
(2014•海南)实验室常用块状固体碳化钙与水反应制备乙炔(C2H2),该反应比二氧化锰催化剂过氧化氢分解更加剧烈.所选发生装置最合适的是( )
A.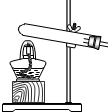
B.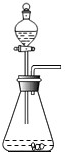
C.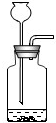
D.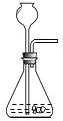
 漫漫烟花1年前1
漫漫烟花1年前1 -
 a1b2 共回答了18个问题
a1b2 共回答了18个问题 |采纳率88.9%解题思路:制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室常用块状固体碳化钙与水反应制备乙炔(C2H2),因此不需要加热;该反应比二氧化锰催化剂过氧化氢分解更加剧烈,分液漏斗可以控制反应的速度;C装置是一个错误装置,长颈漏斗的下端应该在液面以下;D装置不能控制反应的速度,因此不可以.A、如果用高锰酸钾或氯酸钾制氧气就需要加热,不适合制乙炔,故选项错误;
B、实验室常用块状固体碳化钙与水反应制备乙炔(C2H2),因此不需要加热;该反应比二氧化锰催化剂过氧化氢分解更加剧烈,分液漏斗可以控制反应的速度;故选项正确;
C、C装置是一个错误装置,长颈漏斗的下端应该在液面以下,故选项错误;
D、D装置不能控制反应的速度,因此不可以,故选项错误;
故选B点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 本考点主要考查了气体的制取装置的选择,同时考查了装置的优缺点.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- (2013•河北)如图,乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块
(2013•河北)如图,乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式
为CaC2)与水反应生成,同时生成一种白色固体.
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:______;猜想三:Ca(OH)2.
他的依据是______.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:______.
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到______,证明猜想二不成立.
(二)取少量白色固体加入到水中,取上层清液,______,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:
______.
结论:白色固体是Ca(OH)2.
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小.实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是______(选填图中装置序号).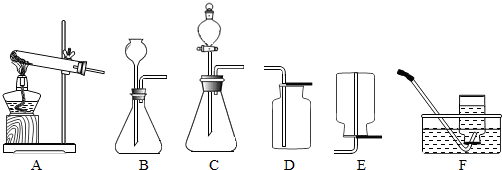
 honeyhedan1年前1
honeyhedan1年前1 -
 rene25 共回答了22个问题
rene25 共回答了22个问题 |采纳率59.1%【做出猜想】
猜想一:CaO;猜想二CaCO3:;猜想三:Ca(OH)2.
他的依据是化学变化过程中元素不变.
故填:CaCO3;化学变化过程中元素不变.
【交流反思】
经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:CaO能与水反应.
故填:CaO能与水反应.
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,证明猜想二不成立.
故填:气泡放出.
(二)取少量白色固体加入到水中,取上层清液,通入二氧化碳气体,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故填:通入二氧化碳气体;Ca(OH)2+CO2=CaCO3↓+H2O.
【拓展应用】
装置C中的分液漏斗能使反应随时发生、随时停止,乙炔的密度比空气略小,不能用排空气法收集,只能够用排水法收集.
故填:C、F.1年前查看全部
- (2013•南安市质检)乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,该反应的化学
(2013•南安市质检)乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,该反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑.若要制取2.6g乙炔气体,需要碳化钙的质量是多少克?
 认得1年前1
认得1年前1 -
 ddih 共回答了24个问题
ddih 共回答了24个问题 |采纳率95.8%解题思路:可根据乙炔的质量,写出化学方程式,求出乙炔和碳化钙的质量比,列出比例式,进行求解.设需要碳化钙的质量为x
CaC2+2H2O=Ca(OH)2+C2H2↑
6426
x 2.6g
[64/x=
26
2.6g]
x=6.4g
答:需要碳化钙的质量是6.4g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据化学方程式进行计算,关键有两点,一是化学方程式必须配平,二是解题步骤必须规范.1年前查看全部
- 乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙.若要制取13g乙炔
乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙.若要制取13g乙炔气体,需要碳化钙的质量是多少克?______.
 aa两可1年前1
aa两可1年前1 -
 apple_jean 共回答了24个问题
apple_jean 共回答了24个问题 |采纳率100%解题思路:可根据乙炔的质量,写出化学方程式,求出乙炔和碳化钙的质量比,列出比例式,进行求解.设需要碳化钙的质量是x.
CaC2+2H2O═Ca(OH)2+C2H2↑
64 26
x 13g
[64/x=
26
13g]
x=32g
答:需要碳化钙的质量是32g.点评:
本题考点: 根据化学反应方程式的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据化学方程式进行计算,关键有两点,一是化学方程式必须配平,二是解题步骤必须规范.1年前查看全部
- 乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙.若要制取13g乙炔
乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙.若要制取13g乙炔气体,需要碳化钙的质量是多少克?______.
 灵感天蝎1年前2
灵感天蝎1年前2 -
 快乐别人 共回答了19个问题
快乐别人 共回答了19个问题 |采纳率78.9%解题思路:可根据乙炔的质量,写出化学方程式,求出乙炔和碳化钙的质量比,列出比例式,进行求解.设需要碳化钙的质量是x.
CaC2+2H2O═Ca(OH)2+C2H2↑
64 26
x 13g
[64/x=
26
13g]
x=32g
答:需要碳化钙的质量是32g.点评:
本题考点: 根据化学反应方程式的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据化学方程式进行计算,关键有两点,一是化学方程式必须配平,二是解题步骤必须规范.1年前查看全部
- 写出下列化学式氯化钡 氢氧化钠 硫化钾 硝酸铜悔氯化钾 硫化氢 硫酸铁 氩气 碳化钙还有一个过氧化氢
 wf151年前4
wf151年前4 -
 chen12546 共回答了22个问题
chen12546 共回答了22个问题 |采纳率86.4%氯化钡——BaCl2
氢氧化钠——NaOH
硫化钾——K2S
硝酸铜——Cu(NO3)2
氯化钾——KCl
硫化氢 --H2S
硫酸铁 ——Fe2(SO4)3
氩气 ——Ar
碳化钙——Ca2C1年前查看全部
- 乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为CaC2
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性.
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:______;猜想三:Ca(OH)2.他的依据是______.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:______.
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到______,证明猜想二不成立.
(二)取少量白色固体加入到水中,取上层清液,通入______,有白色浑浊出现,证明猜想三成立.该反应的化学方程式为:______.
结论:白色固体是Ca(OH)2.
【拓展应用】某市一辆满载电石的货车遇大雨引发熊熊大火,其中的可燃物是______,且该反应放出大量热,使可燃物达到______.
【交流反思】通过上述实验可知,电石在保存和运输时的注意事项______. ytyt191年前1
ytyt191年前1 -
 谁爱你 共回答了29个问题
谁爱你 共回答了29个问题 |采纳率89.7%解题思路:【做出猜想】
根据质量守恒定律可知,白色固体可能是氧化钙,或碳酸钙,或氢氧化钙;
【交流反思】
氧化钙能和水反应生成氢氧化钙;
【进行实验】
碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能使澄清的石灰水变浑浊;
根据反应物和生成物利用质量守恒定律写化学方程式.
【拓展应用】据物质燃烧的条件回答;
【交流反思】利用电石与水反应的性质分析.【做出猜想】
猜想一:CaO;猜想二CaCO3:;猜想三:Ca(OH)2.
他的依据是根据质量守恒定律;
故填:CaCO3;根据质量守恒定律
【交流反思】
经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:CaO能与水反应.
故填:氧化钙与水反应也生成氢氧化钙.
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,证明猜想二不成立.
故填:气泡放出.
(二)取少量白色固体加入到水中,取上层清液,通入二氧化碳气体,有白色沉淀出现,证明猜想三成立.故填:通入二氧化碳气体;
二氧化碳与澄清的石灰水反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O
【拓展应用】电石无可燃性,但电石与水反应生成的乙炔气体具有可燃性,且这一反应放出热量,使可燃物的温度达到着火点.
【交流反思】据题可知电石遇水反应生成可燃性气体乙炔,存在危险,所以电石在保存和运输时的注意事项是防止与水接触.
故答案:
【做出猜想】
碳酸钙 根据质量守恒定律
【交流反思】氧化钙与水反应也生成氢氧化钙
【进行实验】
(-)有气泡冒出
(二)二氧化碳气体 Ca(OH)2+CO2=CaCO3↓+H2O
【拓展应用】乙炔或C2H2着火点
【交流反思】防止与水接触点评:
本题考点: 实验探究物质的组成成分以及含量;生石灰的性质与用途;酸的化学性质;碱的化学性质;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式;燃烧与燃烧的条件.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.1年前查看全部
- 用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体,后者
用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体,后者
用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体,后者完全燃烧时,需要3倍体积的氧气,则金属钠与碳化钙的物质的量之比是 ( )
A.2:1 B.1:2 C.4:1 D.1:4 差500分上清华1年前3
差500分上清华1年前3 -
 zhuxinfengtop 共回答了23个问题
zhuxinfengtop 共回答了23个问题 |采纳率95.7%写出NA以及CAC2与水化学方程式配平
第一步反映生成的气体是H2和C2H2他们两在催化剂的作用下可能生成C2H4以及CH4最后题目说生成的1气体消耗了3体积的氧气,那么写出C2H4和CH4与氧气的反映方程式配平后可以判断出该气体为C2H4 那么C2H2与H2 1比1反映生成C2H4
2份NA生成1分H2 1份CAC2生成1份C2H2所以答应是A1年前查看全部
- 据报道,某市一运输电石的汽车因未做好防水工作,在运输途中突降小雨,引发车厢内着火.已知电石(主要成分是碳化钙,化学式为C
据报道,某市一运输电石的汽车因未做好防水工作,在运输途中突降小雨,引发车厢内着火.已知电石(主要成分是碳化钙,化学式为CaC2)本身不可燃,与水反应后生成一种无色具有可燃性的气体乙炔(化学式C2H2).
(1)电石与水反应属于______反应(填“吸热”或“放热”);
(2)碳化钙中碳元素的化合价为______;
(3)电石与水反应的化学方程式为:CaC2+2H2O=X+C2H2↑,则X的化学式为______;
(4)根据上述信息,你认为电石应______保存. 伍立新1年前1
伍立新1年前1 -
 大力水手popeye 共回答了25个问题
大力水手popeye 共回答了25个问题 |采纳率88%解题思路:(1)燃烧的条件:可燃物、温度达着火点、与氧气接触;由题意“电石(CaC2)不可燃,与水接触剧烈反应产生乙炔(C2H2)”,既然燃烧,温度肯定达着火点;所以反应放出热量;
(2)根据化合价原则由化学式求出元素的化合价.
(3)根据质量守恒定律反应前后原子的种类、数目不变,推测X的化学式;
(4)根据电石的性质分析保存的方法.(1)燃烧的条件:可燃物、温度达着火点、与氧气接触;由题意“电石(CaC2)不可燃,与水接触剧烈反应产生乙炔(C2H2)”,既然燃烧,温度肯定达着火点;所以反应放出热量;
(2)在CaC2种由钙元素显+2价,可求出碳元素的化合价为-1价;
(3)根据质量守恒定律和化学方程式可知,X中含有Ca的个数为1,含有C的个数为2-2=0,含有H的个数为2×2-2=2,含有O的个数为2;则X的化学式为:Ca(OH)2;
(4)由于电石能与水反应,电石应密封防水保存.
故答为:(1)放热;(2)-1;(3)Ca(OH)2;(4)密封防水.点评:
本题考点: 物质发生化学变化时的能量变化;有关元素化合价的计算;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 碳化钙与氧化钙混合的问题(急)碳化钙与氧化钙同比例混合,为何过一段时间后比例会发生变化?
 刺激过度1年前1
刺激过度1年前1 -
 teddy18cn 共回答了19个问题
teddy18cn 共回答了19个问题 |采纳率94.7%完全密闭情况下不会发生反应,比例不变.
如果放在空气中水中,会发生化学反应的地方,比例会变1年前查看全部
- CaC2(即碳化钙,又叫电石)是怎么达到稳定结构的?
 skyland20041年前1
skyland20041年前1 -
 dkrth 共回答了20个问题
dkrth 共回答了20个问题 |采纳率90%CaC2中,其中C与C之间和乙炔一样,是通过共价键连接在一起.但是C2(两个C)与Ca之间是通过电子的得失连接在一起的.并不是共价.
所以结构为:Ca2+C22-(Ca失去两个电子,C2得到两个电子).1年前查看全部
- 碳化钙与酸类会发生什么反应
 门前的那棵树1年前5
门前的那棵树1年前5 -
 xw260 共回答了26个问题
xw260 共回答了26个问题 |采纳率92.3%发生复分解反应,生成乙炔和对应钙盐1年前查看全部
- 写出碳化钙与水反应的化学方程式
 johnzhuwj1年前1
johnzhuwj1年前1 -
 m3nlhp 共回答了24个问题
m3nlhp 共回答了24个问题 |采纳率79.2%CaH2+2H2O=Ca(OH)2+2H21年前查看全部
- 实验室常用电石(主要成分碳化钙CaC2)与水反应制取乙炔(C2H2),该反应化学方程式为CaC2+2H2O=Ca(OH)
实验室常用电石(主要成分碳化钙CaC2)与水反应制取乙炔(C2H2),该反应化学方程式为CaC2+2H2O=Ca(OH)2+C2H2↑欲制取5.2g乙炔气体,则需要含碳化钙80%的电石多少克?
 梦幻星蝶1年前4
梦幻星蝶1年前4 -
 kevinye 共回答了19个问题
kevinye 共回答了19个问题 |采纳率94.7%CaC2+2H2O=Ca(OH)2+C2H2↑
64 26
x*80% 5.2g
x==16g
则需要含碳化钙80%的电石16克1年前查看全部
- 乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为CaC2
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:______;猜想三:Ca(OH)2,他的依据是______.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:______.
【进行实验】
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小,难溶于水.实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是(填图中装置序号)______.实验操作 实验现象 实验结论 取少量白色固体放入试管中,滴加稀盐酸. ______. 猜想二不成立:不是CaCO3. 取少量白色固体加入到水中,取上层清液,______. ______. 猜想三成立:白色固体是Ca(OH)2 
 OnlyLoveU1年前1
OnlyLoveU1年前1 -
 花之幽幽 共回答了13个问题
花之幽幽 共回答了13个问题 |采纳率84.6%解题思路:【做出猜想】
根据质量守恒定律可知,白色固体可能是氧化钙,或碳酸钙,或氢氧化钙;
【交流反思】
氧化钙能和水反应生成氢氧化钙;
【进行实验】
碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能使澄清的石灰水变浑浊;
【拓展应用】根据反应物的状态和反应条件确定发生装置,根据气体的密度和溶水性确定收集装置.【做出猜想】
根据质量守恒定律,化学反应前后元素的种类不变,根据反应前的物质CaC2与水可确定猜想一:CaO;猜想二CaCO3;猜想三:Ca(OH)2.
故他的依据是质量守恒定律;
故填:CaCO3;质量守恒定律
【交流反思】
经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:CaO能与水反应.
故填:氧化钙与水反应也生成氢氧化钙.
【进行实验】
(一)根据碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;如果取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,则证明猜想二不成立.
(二)根据二氧化碳能使澄清的石灰水变浑浊;则取少量白色固体加入到水中,取上层清液,通入二氧化碳气体,有白色沉淀出现,证明猜想三成立.
【拓展应用】乙炔由碳化钙(块状固体,化学式为CaC2)与水常温下反应生成,但反应非常剧烈,故反应装置可选C,因分液漏斗可通过控制水的量,控制反应,随时发生、随时停止,分液漏斗通过旋转活栓能够分次加液体,当收集完气体后,可不再滴加液体达到节约的目的,而长颈漏斗则不可以;因乙炔密度比空气略小,难溶于水,故欲收集纯净的乙炔,可选择装置F,故实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是CF.
故答案为:
【做出猜想】
碳酸钙 质量守恒定律
【交流反思】氧化钙与水反应也生成氢氧化钙
【进行实验】
(-)没气泡
(二)通入二氧化碳气体;有白色沉淀出现
【拓展应用】CF点评:
本题考点: 实验探究物质的组成成分以及含量;常用气体的发生装置和收集装置与选取方法;生石灰的性质与用途;碱的化学性质;盐的化学性质.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.1年前查看全部
- 乙炔(C 2 H 2 )是一种重要的化工原料,实验室常用碳化钙(CaC 2 )与水反应制取乙炔,该反应方程式为:CaC
乙炔(C 2 H 2 )是一种重要的化工原料,实验室常用碳化钙(CaC 2 )与水反应制取乙炔,该反应方程式为:CaC 2 + 2H 2 O =Ca(OH) 2 + C 2 H 2 ↑。计算:要制取52g乙炔气体,需要碳化钙的质量。
 365040801年前1
365040801年前1 -
 ppnonww7 共回答了21个问题
ppnonww7 共回答了21个问题 |采纳率85.7%128g
1年前查看全部
- 某同学设计了如图1所示的实验装置来粗略地测定电石中碳化钙的质量分数。
某同学设计了如图1所示的实验装置来粗略地测定电石中碳化钙的质量分数。
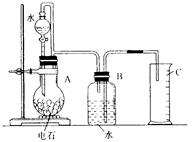
图1
(1)烧瓶中发生反应的化学方程式为_______;装置B、C的作用是_______;烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了_______。
(2)所用电石质量不能太大,否则________;也不能太小,否则________;若容器B的容积为250 mL,则所用电石的质量应在________g左右(从后面数据中选填:0.03,0.60,1.00,1.50,2.00)。
(3)分液漏斗往烧瓶里滴加水的操作方法是________。
(4)实验中测得排入量筒中水的体积为V L、电石的质量为W g。则电石中碳化钙的质量分数是________%(不计算导管中残留的水,气体中饱和的水蒸气等也忽略不计)。 我mm番茄酱1年前1
我mm番茄酱1年前1 -
 prettylois 共回答了21个问题
prettylois 共回答了21个问题 |采纳率85.7%1年前查看全部
- 一摩尔碳化钙有多少阴离子?
 258qwerty1年前1
258qwerty1年前1 -
 fds33333 共回答了25个问题
fds33333 共回答了25个问题 |采纳率96%一摩.1年前查看全部
- 关于共价键、离子键那个1.7钙的电负性是1.00,碳的电负性是2.55,相差不到1.7,为啥碳化钙还是离子化合物?不是说
关于共价键、离子键那个1.7
钙的电负性是1.00,碳的电负性是2.55,相差不到1.7,为啥碳化钙还是离子化合物?
不是说电负性相差达到1.7才能形成离子键么 e献殷勤1年前2
e献殷勤1年前2 -
 snakera 共回答了17个问题
snakera 共回答了17个问题 |采纳率100%这是说直接形成的简单离子化合物,比如NaCl这样的.[C2]2-是一个复杂离子,就像硫酸根、硝酸根一样,碳的简单离子应为[C]4-,如果是Ca2C就肯定是共价性显著,离子性几乎没有了.1年前查看全部
- 乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为CaC2
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
[提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:______;猜想三:Ca(OH)2.
他的依据是______.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:______.
【进行试验】
【实验结论】白色固体是Ca(OH)2.实验操作 实验现象 结论 实验一 取样于试管中,
滴加稀盐酸______ 猜想二:不成立 实验二 ______ ______ 猜想三:成立
写出碳化钙与水反应制取乙炔的化学方程式______. etoiledunord1年前1
etoiledunord1年前1 -
 韓川 共回答了19个问题
韓川 共回答了19个问题 |采纳率100%解题思路:【做出猜想】
根据质量守恒定律可知,白色固体可能是氧化钙,或碳酸钙,或氢氧化钙;
【交流反思】
氧化钙能和水反应生成氢氧化钙;
【进行实验】
碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能使澄清的石灰水变浑浊;
【实验结论】根据反应物和生成物利用质量守恒定律写化学方程式.【做出猜想】
猜想一:CaO;猜想二CaCO3:;猜想三:Ca(OH)2.
他的依据是根据质量守恒定律;
故填:CaCO3;根据质量守恒定律
【交流反思】
经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:CaO能与水反应.
故填:氧化钙与水反应也生成氢氧化钙.
【进行实验】
(一)根据碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;如果取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,则证明猜想二不成立.
(二)根据二氧化碳能使澄清的石灰水变浑浊;则取少量白色固体加入到水中,取上层清液,通入二氧化碳气体,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
【实验结论】碳化钙与水反应制取乙炔的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑
答案:
【做出猜想】
碳酸钙 根据质量守恒定律
【交流反思】氧化钙与水反应也生成氢氧化钙
【进行实验】
(-)没气泡
(二)取少量白色固体加水溶解,取上层清液,通入二氧化碳气体
有白色沉淀出现
【实验结论】CaC2+2H2O=Ca(OH)2+C2H2↑点评:
本题考点: 实验探究物质的组成成分以及含量;生石灰的性质与用途;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.1年前查看全部
- 乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,该反应方程式为:CaC2+2H2O=
乙炔(C2H2)是一种重要的化工原料,实验室常用碳化钙(CaC2)与水反应制取乙炔,该反应方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑.计算:要制取52g乙炔气体,需要碳化钙的质量.
 ljj2477639491年前1
ljj2477639491年前1 -
 313666725 共回答了15个问题
313666725 共回答了15个问题 |采纳率86.7%解题思路:根据制取的乙炔的质量,通过化学方程式可以计算需要的碳化钙的质量.设需要碳化钙的质量为x,
CaC2+2H2O=Ca(OH)2+C2H2↑,
64 26
x 52g
[64/26]=[x/52g],
x=128g;
答:要制取52g乙炔气体,需要128g碳化钙.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题比较简单,主要考查运用化学方程式进行计算的能力.1年前查看全部
- 有关电石和电石气的问题用电石和电石气分别表示碳化钙和乙烯,那么,请问电石和电石气这两个名称是怎么来的?注:解释的越清楚越
有关电石和电石气的问题
用电石和电石气分别表示碳化钙和乙烯,那么,请问电石和电石气这两个名称是怎么来的?
注:解释的越清楚越好,并且不要讲废话! wfzx11年前1
wfzx11年前1 -
 steven_hl76 共回答了20个问题
steven_hl76 共回答了20个问题 |采纳率85%电石是CaO和焦炭(C)在埋弧式电炉内,通过电阻电弧产生的高温反应制得,CaO+3C→CaC2+CO
电石与水反应生成乙炔(不是乙烯,楼主错了),所以乙炔也叫电石气.1年前查看全部
- 求乙炔产率 1.34g 碳化钙与水反应 产生的乙炔气体用排水法收集,体积为0.471L,若此时温度为23℃.大气压为99
求乙炔产率
1.34g 碳化钙与水反应 产生的乙炔气体用排水法收集,体积为0.471L,若此时温度为23℃.大气压为99.0KPa.该反应的产率为多少(23℃水的饱和蒸汽压为2.8Kpa! 狂暴的cc1年前1
狂暴的cc1年前1 -
 风释漪 共回答了23个问题
风释漪 共回答了23个问题 |采纳率78.3%CaC+H2O=Ca(OH)2+C2H2
产生的乙炔气体为0.471L , 23℃=296K , 99.0KPa-2.8KPa=96.2KPa
根据PV=nRT得:n=PV/RT=0.0184mol
电石(CaC2)为1.34/64=0.021mol
产率为0.0184/0.021=88%1年前查看全部
- 碳元素显-1、+2价的原理?如CaC2碳化钙
 hongxia091年前1
hongxia091年前1 -
 xiatt120 共回答了16个问题
xiatt120 共回答了16个问题 |采纳率87.5%答:“前头捉了张辉瓒”,电石是一种离子化合物,不错!但是我只知道乙炔就是sp杂化形成的共价直线形分子,但是我实在不明白电石中既然钙的电子完全失去了,这些电子又为什么不是完全归于碳.我想这可能是“离子化合物”和“共价化合物”没有非常严格的界限的一个例子.
碳元素电子层的最外层有四个电子,它们只会偏转,形成的都是共价化合物.本来碳原子外层是正四面体结构,在形成共价化合物的时候通常先形成高能态的杂化轨道.
例如:CO:+2价
CO2:+4价(sp杂化轨道)(直线形分子)
C2H2(乙炔):-1价(sp杂化轨道)(直线形分子)
CH4:-4价.(sp3杂化,正四面体)
CF4:+4价.(sp3杂化,正四面体)
C2H4:-2价(sp2杂化轨道)平面型,键角120度.
有几个核外电子形成了共用电子对,我们就说它是多少价;而正负化合价则取决于共用电子对偏向于谁;电负性大于碳的碳元素显负价;电负性小于碳的则碳显正价.1年前查看全部
- 碳化钙加水制乙炔为什么不能用启普发生器
 lyphon1年前1
lyphon1年前1 -
 rlqhu 共回答了16个问题
rlqhu 共回答了16个问题 |采纳率87.5%1:此反应大量放热.会损坏启普发生器
2:生成的氢氧化钙是糊状物.会堵塞反应容器.使水面难以升降1年前查看全部
- 碳化钙和碳化铝分别与水反应,为什么前者生成乙炔后者生成甲烷,而不是都是生成乙炔或都是生成甲烷呢?谢
 2854095601年前1
2854095601年前1 -
 guoyanhui 共回答了21个问题
guoyanhui 共回答了21个问题 |采纳率71.4%我们可以来看看他们的化学式:
CaC2 其中C显然是-1价
Al4C3 其中C显然是-4价
我们知道,他们2个和水反应是一个简单的水解反应,显然水解反应是复分解反应而不是氧化还原反应,所以C的价态应该是不变的
乙炔C2H2,C为-1价即是CaC2的产物
而甲烷CH4,C为-4价即为Al4C3的产物1年前查看全部
- 乙炔(C2H2)气体和氧气反应能产生高温火焰--氧炔焰,工人师傅常用氧炔焰切割或焊接金属.乙炔可由碳化钙(块状固体,化学
乙炔(C2H2)气体和氧气反应能产生高温火焰--氧炔焰,工人师傅常用氧炔焰切割或焊接金属.乙炔可由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
Ⅰ.定性探究
【提出问题】碳化钙(CaC2)与水反应时,生成的白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:______;猜想三:Ca(OH)2.他的依据是______.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:______.
【进行实验】
(1)甲同学取少量白色固体放入试管中,然后加入过量稀盐酸,没有观察到气泡放出,证明猜想二______(填“成立”或“不成立”).
(2)乙同学另取少量白色固体加入到适量水中,充分溶解后取上层清液于试管中,先向试管中加入几滴酚酞溶液,发现溶液变红,然后再加入一定量的碳酸钠溶液,观察到有沉淀产生,且溶液颜色______,证明猜想三成立,该反应的化学方程式为:______.
【得出结论】白色固体是Ca(OH)2.
【继续探究】丙同学在整理实验时,将甲、乙两同学的废液倒入同一烧杯中,静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是______(酸碱指示剂除外),可能含有的溶质是______.
Ⅱ.定量探究
【查阅资料】①氧炔焰是指乙炔(C2H2)与氧气在点燃条件下安静燃烧时产生的火焰. 乙炔燃烧的化学方程式为:2C2H2+5O2
2H2O+4CO2,氧炔焰由于温度通常可达3000摄氏度以上,故可用来金属焊接或切割金属.点燃 .
②焊接金属时应控制乙炔气过量,防止焊接部位的金属被氧化…
③切割金属时应控制氧气过量,目的是氧化被割金属形成熔融的金属氧化物,随后被气流吹走,形成割逢…
【提出问题1】2.6kg乙炔(C2H2)完全燃烧,需要多少千克氧气参加反应?
【提出问题2】工人师傅用氧炔焰切割金属时,应控制乙炔和氧气的质量比______.
A.>[13/40]B.<[13/40]C.=[13/40]D.任意比. huangshanmeng1年前1
huangshanmeng1年前1 -
 jeto 共回答了14个问题
jeto 共回答了14个问题 |采纳率85.7%解题思路:【做出猜想】
根据质量守恒定律可知,白色固体可能是氧化钙,或碳酸钙,或氢氧化钙;
【交流反思】
氧化钙能和水反应生成氢氧化钙;
【进行实验】
考虑碳酸钙与稀盐酸反应;
氢氧化钙溶液为碱性溶液,使酚酞溶液变红,考虑氢氧化钙溶液与碳酸钠溶液反应;
【继续探究】根据甲、乙两同学的反应后的溶液,进行分析;如果稀盐酸过量会与乙中的氢氧化钠反应,则推测溶质的可能性;
废液倒入同一烧杯中,一定即静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是 氯化钠(酸碱指示剂除外),可能含有的溶质是 稀盐酸.
【提出问题1】乙炔和氧气反应生成了二氧化碳和水,所以可以根据乙炔的质量结合化学方程式计算出需要消耗的氧气的质量.
【提出问题2】根据化学方程式进行考虑.【做出猜想】
猜想一:CaO;猜想二CaCO3;猜想三:Ca(OH)2.他的依据是根据质量守恒定律;
故填:CaCO3;根据质量守恒定律
【交流反思】
经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:CaO能与水反应.
故填:氧化钙与水反应也生成氢氧化钙.
【进行实验】
(一)根据碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;如果取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,则证明猜想二不成立.
(二)乙同学另取少量白色固体加入到适量水中,充分溶解后取上层清液于试管中,先向试管中加入几滴酚酞溶液,发现溶液变红,然后再加入一定量的碳酸钠溶液,观察到有沉淀产生,且溶液颜色不变,证明猜想三成立,该反应的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
【继续探究】甲同学的废液中有氯化钙、稀盐酸;乙同学的废液中可能有碳酸钠、氢氧化钠,则二者反应会生成氯化钠,碳酸钙等,故上层溶液中一定含有的溶质是氯化钠、氯化钙(酸碱指示剂除外),可能含有的溶质是稀盐酸.
【提出问题1】设理论上至少需要消耗氧气的质量为x.
2C2H2+5O2
点燃
.
4CO2+2H2O
52 160
2.6kg x
则[52/160=
2.6kg
x],解得:x=8kg
答:理论上至少需要消耗氧气8千克.
【提出问题2】根据化学方程式可知乙炔和氧气的质量比为13:40时恰好反应;考虑升级操作,故选A.
故答案为:
【做出猜想】CaCO3; 根据质量守恒定律.
【交流反思】氧化钙与水反应也生成氢氧化钙.
【进行实验】
(1)不成立;
(2)不变,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
【继续探究】氯化钠,稀盐酸.
Ⅱ.定量探究
【提出问题1】8kg
【提出问题2】A.点评:
本题考点: 实验探究物质的组成成分以及含量;生石灰的性质与用途;酸的化学性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.1年前查看全部
- 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
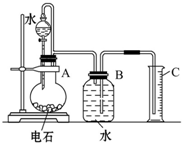 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
(1)烧瓶中发生反应的化学方程式为______.装置B、C的作用是______.
(2)分液漏斗与烧瓶间用乳胶管连接的目的是______.
(3)所用电石质量不能太大,否则______;也不能太小,否则______;若容器B的容积为250mL,则所用电石的质量应在______g左右(从后面数据中选填:0.03、0.60、1.00、1.50、2.00).
(4)为了得到比较平稳的乙炔气流,实验室通常用______代替水进行实验.
(5)实验中测得排入量筒中水的体积为VL、电石的质量为Wg.则电石中碳化钙的质量分数是
%0.29V W (不计算导管中残留的水,气体中饱和的水蒸气等也忽略不计).
%0.29V W  喜静勿扰1年前1
喜静勿扰1年前1 -
 Try_Fly_Sea 共回答了14个问题
Try_Fly_Sea 共回答了14个问题 |采纳率85.7%解题思路:(1)电石和水反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置BC是排水量气方法测定生成乙炔的体积;
(2)依据烧瓶内的气体压强和液体顺利滴下分析判断;
(3)若电石的质量太大,则生成C2H2太多,超过B的空间,无法测定其体积;若选择的电石的质量太小,则生成的C2H2太少,测定误差会更大.根据1molCaC2-1molC2H2,可计算产生250mLC2H2时所需电石的质量为0.71g,即需要电石的最大质量不能超过0.71g;
(4)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流.
(5)依据反应定量关系CaC2-----C2H2,计算得到乙炔的质量,计算电石中CaC2的质量分数;(1)电石和水反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置B用于贮水以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒C来测定生成乙炔的量;
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;装置B用于贮水以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒C来测定生成乙炔的量;
(2)反应发生后,烧瓶内的气体压强会使分液漏斗内的液体难于滴入瓶中,所以用乳胶管将分液漏斗和烧瓶连接成一个容器,便于液体顺利滴下;
故答案为:便于液体顺利滴下;
(3)若电石的质量太大,则生成C2H2太多,超过B的空间,无法测定其体积;若选择的电石的质量太小,则生成的C2H2太少,测定误差会更大.根据1molCaC2-1molC2H2,可计算产生250mLC2H2时所需电石的质量为0.71g,即需要电石的最大质量不能超过0.71g,结合题目信息,应选择0.60g电石进行实验;
故答案为:生成C2H2太多,超过B的空间;生成的C2H2太少,测定误差会更大;0.60;
(4)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
故答案为:饱和食盐水;
(5)设产生VmL气体需要CaC2的质量为mg,则
CaC2-----C2H2,
64g 22400mL
m VmL
解得m=0.0029V,则电石中CaC2的质量分数为
0.29V
W%;
故答案为:
0.29V
W%;点评:
本题考点: 探究物质的组成或测量物质的含量;乙炔炔烃.
考点点评: 本题考查了物质性质的探究实验分析判断,实验数据的分析和计算,乙炔性质和制备,掌握实验基本操作和实验设计方法是解题关键,题目难度中等.1年前查看全部
- 用氯化氢和乙炔加成生成氯乙烯时,所用的乙炔是由碳化钙置于水中分解出来的,故在乙炔气中含有水蒸气.如果水蒸汽气压超过乙炔气
用氯化氢和乙炔加成生成氯乙烯时,所用的乙炔是由碳化钙置于水中分解出来的,故在乙炔气中含有水蒸气.如果水蒸汽气压超过乙炔气总压的0.1%(乙炔气总压为202kPa),则将会使上述加成反应的汞催化剂中毒失去活性,所以工业生产中要采取冷冻法除去乙炔气中过多的水蒸气.已知冰的蒸气压在0℃时为611Pa,在-15℃时为165Pa,问冷冻乙炔气的温度应为多少?
 coco355895901年前1
coco355895901年前1 -
 wf666 共回答了15个问题
wf666 共回答了15个问题 |采纳率86.7%乙炔总气压为202KPa,按水蒸气0.1%计算,水蒸气分压为202Pa.
在0℃时为611Pa,在-15℃时为165Pa,你可以简单算出温度与压力的线性关系式.为
y = -29.7 x + 611.y为压力,x为摄氏度.当y=202Pa时,x= -13.8.也就是冷冻乙炔气的温度不能低于-13.8℃.1年前查看全部
- 一道高中化学概念理解题.为什么碳化钙里碳的化合价为负一价?
 2708191年前1
2708191年前1 -
 smartbaby1113 共回答了17个问题
smartbaby1113 共回答了17个问题 |采纳率94.1%钙的金属性很强,只能是正2价的1年前查看全部
- 乙炔气体可采用碳化钙与水反应制取,同时还有氢氧化钙生成,试写出化学方程式.在线= !很急
 1585479221年前6
1585479221年前6 -
 jerrydan 共回答了22个问题
jerrydan 共回答了22个问题 |采纳率95.5%催化剂
CaC2+2H2O====C2H2+Ca(OH)2
(碳化钙)+2(水)==(乙炔)+(氢氧化钙)1年前查看全部
- 若A是碳化钙,A与B反应只生成气体和碳酸钙和水,B是什么?
 lzmcxh1年前4
lzmcxh1年前4 -
 rongrong0721 共回答了17个问题
rongrong0721 共回答了17个问题 |采纳率94.1%B是碳酸(HCO3)1年前查看全部
- 碳化钙和水反应生成什么?
 No2imagewu1年前1
No2imagewu1年前1 -
 qqkf11 共回答了18个问题
qqkf11 共回答了18个问题 |采纳率83.3%方程式:
CaC2+2H2O==Ca(OH)2+C2H2↑
生成 氢氧化钙 和 乙炔1年前查看全部
- 碳化钙和氮化镁分别是强电解质还是弱电解质?
 永恒的修罗王1年前1
永恒的修罗王1年前1 -
 clove19 共回答了18个问题
clove19 共回答了18个问题 |采纳率100%既不是强电解质也不是弱电解质.因为和水反应,1年前查看全部
- 用水和电石(碳化钙)制乙炔后怎样验纯?
 风中小草1年前1
风中小草1年前1 -
 tuboshulq 共回答了23个问题
tuboshulq 共回答了23个问题 |采纳率82.6%因电石中含有杂质,与水反应会生成硫化氢,所以应将制得的的气体通入CuSO4溶液中,若生成黑色沉淀(CuS)则不纯,反之则纯1年前查看全部
- 碳化钙和水结合后产生什么新的物质
 坏女孩自白1年前1
坏女孩自白1年前1 -
 anitasweet 共回答了20个问题
anitasweet 共回答了20个问题 |采纳率95%乙烯1年前查看全部
- 教材上用碳化钙和水反应生成乙炔 为什么碳化铝和水反应不能生成乙炔 还有碳化镁呢?
 zzddq13251年前1
zzddq13251年前1 -
 sheik-li 共回答了17个问题
sheik-li 共回答了17个问题 |采纳率94.1%把金属换成等价的氢就行了.1年前查看全部
- 为什么碳化钙的碳原子最外层电子满足8电子结构
为什么碳化钙的碳原子最外层电子满足8电子结构
碳的最外层不是有4个电子吗?在碳化钙中它的化合价是负1价,相加根本不是8 呀
请从最外层电子的角度来解释!!!不要给我弄什么键数!!! parawain1年前1
parawain1年前1 -
 殷卫东 共回答了20个问题
殷卫东 共回答了20个问题 |采纳率95%我晕,碳化钙中是CaC2,碳与碳之间是碳碳叁键,也就是成了三个键,每个碳拿出三个电子形成一个σ键,两个π键,所以加上Ca给每个碳一个电子就可以满足8电子稳定结构了
你懂不懂,我可以在线告诉你
碳最外层电子数有四个,又有Ca提供一个,另一个碳提供三个所以可以满足8电子1年前查看全部
- CaC2 、CH4 可以说成“二碳化钙”、“四氢化碳”的形式吗?
CaC2 、CH4 可以说成“二碳化钙”、“四氢化碳”的形式吗?
我想知道化学上规定是如何的,知道的人快说下,就一天烦恼啊! 赤胆宗心1年前7
赤胆宗心1年前7 -
 amyququ 共回答了19个问题
amyququ 共回答了19个问题 |采纳率84.2%不可以!
中考阅卷要求,名称一定要遵守化学用语.(很严格的)
就比如 化学方程式前面的系数1一定要省略,否则算书写错误.1年前查看全部
- 碳和氧化钙,在1800~2100摄氏度下反应能生成碳化钙和一氧化碳;那温度更高呢,还是一样的反应吗?
 czxyingzi1年前1
czxyingzi1年前1 -
 qaz5432123 共回答了27个问题
qaz5432123 共回答了27个问题 |采纳率92.6%一样,只要碳足够,就不会再有CaO存在,而产物CaC2和CO也不可能再发生其他反应了.1年前查看全部
- 在用碳化钙(CaC2)和水制取乙炔(C2H2)气的时候,用饱和食盐水可以减缓反应速率,为什么?
在用碳化钙(CaC2)和水制取乙炔(C2H2)气的时候,用饱和食盐水可以减缓反应速率,为什么?
方程式:CaC2+2H2O=Ca(OH)2+C2H2 xietianyu1年前1
xietianyu1年前1 -
 pantianlin 共回答了16个问题
pantianlin 共回答了16个问题 |采纳率81.3%食盐水中食盐电离出的Na+和Cl-占据一定空间,它们的存在可以减少水与电石的接触面积,从而减缓水与电石的反应,防止因反应速度太快而生成大量的泡沫.1年前查看全部
- 电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.某化学兴趣小组对它的化学性质产生了浓厚的兴
电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.某化学兴趣小组对它的化学性质产生了浓厚的兴趣并进行下列探究.
【查阅资料】乙炔(C2H2)燃烧时伴有大量黑烟.CaO+H2O→Ca(OH)2.Ca(OH)2溶液能使酚酞变红.
【猜想与假设】
电石与水反应生成的可燃性气体是:O2、H2或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙.
大家讨论后一致认为该气体不可能是O2,原因是______,白色固体不可能是氧化钙,原因是______.
【实验探究】
【反思交流】载有电石的货车可以在雨中整整燃烧一天而不熄灭,说明电石与水的反应是______(填“吸热”或“放热”)反应.实验步骤 实验现象 实验结论 (1)取适量电石加水反应,收集生成的气体,验纯后点燃. 气体燃烧,产生黄色火焰并伴有浓烈黑烟. 电石与水反应产生的气体是______. (2)取适量反应后生成的固体于试管中,滴加过量稀盐酸. 固体溶解,______. 电石与水反应产生的固体不是碳酸钙 (3)取适量反应后生成的固体于试管中加水,向上层清液中滴加2~3滴______. 溶液变红 电石与水反应产生的固体是氢氧化钙  ww龙1年前1
ww龙1年前1 -
 颠僧 共回答了24个问题
颠僧 共回答了24个问题 |采纳率95.8%解题思路:【猜想假设】根据氧气不具有可燃性及氧化钙遇到水会产生氢氧化钙分析;
【实验探究】根据信息结合实验的现象分析产物的成分;根据碳酸钙和氢氧化钙的性质分析实验;
【反思交流】根据现象分析能量的变化.【猜想假设】由于电石与水反应生成的是可燃性气体,而氧气不具有可燃性,故不可能是氧气;因为氧化钙遇到水会产生氢氧化钙,所以白色固体不可能是氧化钙;
【实验探究】(1)资料中乙炔(C2H2)燃烧时伴有大量黑烟,而氢气燃烧不会产生黑烟,因此电石与水反应产生的气体是乙炔;
(2)因为结论电石与水反应产生的固体不是碳酸钙,因此加盐酸不会产生气泡;
(3)因为结论电石与水反应产生的固体是氢氧化钙,氢氧化钙的溶液呈现碱性,能够使酚酞试液变成红色;
【反思交流】根据满载电石的货车遇大雨着火的原因是电石主要成分碳化钙(CaC2)能与水反应生成可燃性气体,且该反应放热;
故答案为:【猜想假设】氧气不具有可燃性;氧化钙会和水反应产生氢氧化钙(或CaO+H2O═Ca(OH)2);
【实验探究】乙炔(C2 H2 );没有气泡产生;酚酞;
【反思交流】放热.点评:
本题考点: 实验探究物质的性质或变化规律;常见气体的检验与除杂方法;生石灰的性质与用途;酸的化学性质.
考点点评: 本题属于信息题的考查,可以依据题目提供的信息结合碳酸钙、氢氧化钙的化学性质等相关的知识进行分析得出结论,难度不大.1年前查看全部
- 下列几种物质是有机物吗?碳化钙CaC2碳化硅SiC四氟化硅SiF4碳化钙CaC2 碳化硅SiC 四氟化硅SiF4(它也是
下列几种物质是有机物吗?
碳化钙CaC2
碳化硅SiC
四氟化硅SiF4
碳化钙CaC2
碳化硅SiC
四氟化硅SiF4(它也是一种甲烷吧?) 千岛fds1年前1
千岛fds1年前1 -
 瞅瞅0716 共回答了14个问题
瞅瞅0716 共回答了14个问题 |采纳率100%CaC2 、SiC 、SiF4
均非有机物,前两种系碳化物,后一种是氟取代物、氟化物
SiF4 可以理解为硅烷的四氟化取代物,即如四氯甲烷.
理解四氟化硅为“也是一种甲烷吧?”是错误的1年前查看全部
大家在问
- 1内环境是人体进行正常,生命活动和细胞代谢的场所吗
- 2补写出下列名篇名句中的空缺部分。(任选3个小题)(6分)
- 3观察两个算式并回答问题63x67=6x(6+1)x100+3x7=4200+21=4221692x698=69x(69+
- 4western blot实验中加样的具体步骤?
- 5下列句子没有语病的一项是( )(2分) A.地球上最后一次完整的泛大陆大约是在2.25亿多年左右前
- 6下列各组物质能在酸性溶液中共存的是( )
- 7英语翻译"Galileo",says Hawking,"was the first scientist to start
- 8一个既一个旦念什么
- 9九年级学生小高在某德育报上发表了自己撰写的思想品德小论文,下列说法正确的是 [
- 10某一个 英文怎么说为了保密隐藏设备型号,用某一个代替,英文怎么翻译根据某一个飞机模型实验
- 111.近似数101与近似数0.101都有3个有效数字?
- 12高中生如何写作业我现在是高一下学期,我想考一所好点的大学,我也是挺努力的,但总觉得作业写得太慢了.我想请问一下各位专家,
- 13小学数学 四年级下册的寒假作业的第四十六页的最后一题是什么?知道答案的请告诉我 快!
- 14已知:如图,以△ABC的顶点A为圆心,r为半径的圆与边BC交于D、E两点,且AC2=CE•CB.
- 15一桶油,第一次用去4分子1,正好是3升,第二次又用去这桶油的6分子1,还剩多少升?