CuSO4•5H2O 是 酸/碱/盐?
 xjf102022-10-04 11:39:544条回答
xjf102022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 busesky 共回答了14个问题
busesky 共回答了14个问题 |采纳率100%- 盐,强酸弱碱盐
- 1年前
 hualu 共回答了8个问题
hualu 共回答了8个问题 |采纳率- 盐
- 1年前
 strugil 共回答了7个问题
strugil 共回答了7个问题 |采纳率- 结晶水合物
盐 - 1年前
 东北人饭庄 共回答了2个问题
东北人饭庄 共回答了2个问题 |采纳率- 是 盐
- 1年前
相关推荐
- 已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:CuSO4•5H2O(s)==CuSO4(s)+5H
已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:CuSO4•5H2O(s)==CuSO4(s)+5H2O(l) △H
已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4•5H2O(s)==CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2
C. Q1 不下雨的雨天1年前3
不下雨的雨天1年前3 -
 mm的饭团子 共回答了19个问题
mm的饭团子 共回答了19个问题 |采纳率89.5%比较热量的大小(题中"若将1mol无水硫酸铜溶解为溶液时放热Q2kJ")
无水硫酸铜溶解为溶液时,先放热Q1 KJ (变成五水的),五水的再溶
总的放Q2,Q2是Q1放的在减去某个吸热的值
所以是Q1>Q2,选A
要给分啊~)1年前查看全部
- 实验室由废铜屑制胆矾(CuSO4•5H2O)的实验流程如图:
实验室由废铜屑制胆矾(CuSO4•5H2O)的实验流程如图:

(1)洗涤铜屑油污的试剂为5% Na2CO3溶液,这是利用了Na2CO3溶液的______性.
(2)溶解铜屑一种方案是:将铜屑加入到稀硫酸与双氧水的混和液中并用30~40℃水浴加热,一段时间后,铜完全溶解,得到硫酸铜溶液.
①该反应的化学方程式为______.
②反应温度不能超过40℃的原因是______.
(3)由硫酸铜溶液获得胆矾的操作依次为______、______、过滤、洗涤、干燥. myheartgoes1年前1
myheartgoes1年前1 -
 司机2005 共回答了21个问题
司机2005 共回答了21个问题 |采纳率90.5%解题思路:(1)碳酸钠水解溶液呈碱性,能清除油污;
(2)①铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂;
②过氧化氢易分解;
(3)硫酸铜的溶解度随温度升高而增大,采用降温结晶,依据降温结晶的操作解答.(1)Na2CO3溶液中存在水解离子反应为CO32-+H2O⇌HCO3-+OH-,HCO3-+H2O⇌H2CO3+OH-,溶液呈碱性,油污在碱性条件下发生水解,所以洗涤铜屑油污的试剂为5% Na2CO3溶液,这是利用了Na2CO3溶液的碱性,故答案为:碱;
(2)①双氧水具有氧化性,铜屑加入到稀硫酸与双氧水的混和液中,双氧水将铜氧化成Cu2+,Cu2+与SO42-结合得到产物硫酸铜,反应为Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
②过氧化氢易分解,反应温度不能超过40℃,防止H2O2分解,故答案为:防止H2O2分解;
(3)硫酸铜的溶解度随温度升高而增大,可用结晶法提纯,在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质,蒸发浓缩,滤液冷却,析出硫酸铜,得到纯的硫酸铜,故答案为:蒸发浓缩;冷却结晶.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题主要考查了实验室由废铜屑制胆矾,依据实验流程图结合相关铜的化合物的性质是解答的关键,题目难度不大.1年前查看全部
- 现用胆矾(CuSO4•5H2O)配制0.1mol/L的硫酸铜溶液,下列操作中最合理的是( )
现用胆矾(CuSO4•5H2O)配制0.1mol/L的硫酸铜溶液,下列操作中最合理的是( )
A. 称取25g胆矾溶解在1L水中
B. 将16g胆矾溶于水,然后将此溶液稀释至1L
C. 称取25g胆矾溶于水,然后将此溶液稀释至1L
D. 将胆矾加热除去结晶水后,称取16g溶解在1L水中 酒中鱼1年前1
酒中鱼1年前1 -
 lailingyu 共回答了17个问题
lailingyu 共回答了17个问题 |采纳率82.4%解题思路:A.25g胆矾的物质的量=[25g/250g/mol]=0.1mol,溶于水配成1L溶液,其浓度为0.1mol/L;
B.根据n=cV计算硫酸铜的物质的量,硫酸铜物质的量等于胆矾的物质的量,再根据m=nM计算需要胆矾的质量;
C.根据n=[m/M]计算胆矾的物质的量,再根据c=[n/V]计算所得溶液的物质的量浓度;
D.胆矾加热除去结晶水后为硫酸铜,16g硫酸铜的物质的量为0.1mol,溶于水配成1L溶液,其浓度为0.1mol/L.A.25g胆矾的物质的量=[25g/250g/mol]=0.1mol,溶于水配成1L溶液,其浓度为0.1mol/L,体积1L是指溶液的体积,不是溶剂体积,故A错误;
B.需要硫酸铜的物质的量=1L×0.1mol/L=0.1mol,硫酸铜物质的量等于胆矾的物质的量,故需要胆矾的质量=0.1mol×250g/mol=25g,故B错误;
C.25g胆矾的物质的量=[25g/250g/mol]=0.1mol,溶于水配成1L溶液,其浓度为0.1mol/L,故C正确;
D.胆矾加热除去结晶水后为硫酸铜,16g硫酸铜的物质的量为0.1mol,溶于水配成1L溶液,其浓度为0.1mol/L,体积1L是指溶液的体积,不是溶剂体积,故D错误,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度,比较基础,注意对概念、公式的理解与灵活应用.1年前查看全部
- 化学CuSO4•5H2O是纯净物还是混合物
化学CuSO4•5H2O是纯净物还是混合物
为什么 爱情步行街1年前8
爱情步行街1年前8 -
 心·迷途 共回答了19个问题
心·迷途 共回答了19个问题 |采纳率100%结晶水合物(就比如胆矾CuSO4·5H2O),从化学式看,有CuSO4和H2O,似乎是混合物,孰不知CuSO4和H2O不是简单地混合,而是二者之间有强烈的相互作用,按照一定的质量比化合CuSO4+5H2O=CuSO4·5H2O)成新物质——一胆矾,因此CuSO4·5H2O是纯净物.
由同一种物质组成的物质称为纯净物,CuSO4•5H2O是一种物质,上面带的5个水分子不是作为一种单独的物质掺杂在其中的,而是分子整体的一部分.
所以CuSO4•5H2O是纯净物.1年前查看全部
- CuSO4的风化若用式CuSO45H2O(s) CuSO4(s)+5H2O(g)表示.在25℃,若空气中水蒸气相对湿度为
CuSO4的风化若用式CuSO45H2O(s) CuSO4(s)+5H2O(g)表示.在25℃,若空气中水蒸气相对湿度为60%,在敞开容器中上述反应的ΔG是多少?此时CuSO45H2O是否会风化?
 麦子A1年前1
麦子A1年前1 -
 家在东明 共回答了20个问题
家在东明 共回答了20个问题 |采纳率80%硫酸铜的结晶体在25度60的湿度下,是會风化的,戴耳它G的克数要按硫酸铜结晶体物质的量算.1年前查看全部
- (2009•徐汇区二模)硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)
(2009•徐汇区二模)硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:温度(℃) 20 40 60 80 100 石膏 0.32 0.26 0.15 0.11 0.07 胆矾 32 44.6 61.8 83.8 114
(1)红棕色滤渣的主要成分是______;
(2)写出浸出过程中生成硫酸铜的化学方程式______;
(3)操作I的操作温度应该控制在______℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为______、洗涤、干燥;
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是______;
②指出你认为不合理的方案存在的问题______;
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案______. 蓝剑11年前1
蓝剑11年前1 -
 chuwei59 共回答了19个问题
chuwei59 共回答了19个问题 |采纳率89.5%解题思路:(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁.
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水.
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯.
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.
(5)确认Fe3+是否除净应注意铜离子的颜色造成的干扰
(6)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用.(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3,故答案为:Fe(OH)3.
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100℃;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶、过滤;
(5)①方案一:取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在;方案二:径向层析→喷KSCN溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,不但可以分辨出铁离子还能辨别出含有铜离子,故答案为:方案二;
②取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在,故答案为:Cu2+的蓝色对检验有干扰;
(6)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,故答案为:4NO+3O2+H2O=4HNO3.点评:
本题考点: 制备实验方案的设计;常见金属元素的单质及其化合物的综合应用;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、作图能力等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.1年前查看全部
- (1)请仔细阅读硫酸铜晶体(CuSO4•5H2O)加热过程中依次发生的反应:
(1)请仔细阅读硫酸铜晶体(CuSO4•5H2O)加热过程中依次发生的反应:
CuSO4•5H2O
CuSO4+5H2OCuSO4加热 .
CuO+SO3↑ 4CuO高温 .
2Cu2O+O2↑1000°C ═
现称取25.0g硫酸铜晶体加热,使之均匀、缓慢地升温至1 000℃并恒温1小时左右.请回答下列问题(不考虑实验操作所带来的误差):
①最终固体的质量为______g;
②如果甲同学做此实验时称得最后所得的固体质量为7.6g,试判断该固体的组分是______(写化学式),其物质的量之比是______.
(2)臭氧层是地球生命的保护伞,臭氧比氧气具有更强氧化性.
实验室制臭氧:3O2
2O3放电 .
①若在反应中有30%的氧气转化为臭氧,则所得的混合气体的平均摩尔质量为______.(保留一位小数)
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为______L.
③实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20g铜粉(足量)的反应器中,充分加热后,粉末质量变为21.6g,则原混合气体中的臭氧的体积分数为______.(在加热条件下氧气和臭氧都能与铜发生反应)
④若在一定条件下,有a L O2和O3的混合气体,当其中的O3全部转化为O2时,体积变为1.3a L,求原混合气中O2和O3的体积比为______,O3的质量分数为______. wozhubalou1年前1
wozhubalou1年前1 -
 redpillow 共回答了17个问题
redpillow 共回答了17个问题 |采纳率94.1%解题思路:(1)①先计算出硫酸铜晶体的物质的量,然后根据反应求出气态化合物的不同范围;
②根据极限法计算出硫酸铜、氧化铜、氧化亚铜的质量,根据计算结果判断残留固体成分,然后列式计算出残留固体的物质的量之比;
(2)①平均摩尔质量等于气体的总质量与总物质的量之比;
②用差量法解题;
③根据氧原子守恒解题;
④根据差量法进行计算.(1)①25.0g硫酸铜晶体为0.1mol,1 000℃并恒温1小时左右,固体反应产物只有Cu2O,根据Cu原子守恒可知Cu2O为0.05mol,即7.2g.故答案为:7.2;
②如果全部生成CuO,物质的量为0.1mol,即8g,全部生成Cu2O为7.2g,最终固体的质量介于两者之间,应为两者的混合物.设Cu2O、CuO的物质的量分别为x mol、y mol,则有:
2x+y=0.1
144x+80y=7.6
可得:x=0.025 y=0.05
则x:y=1:2,
故答案为:Cu2O、CuO;1:2;
(2)①假设有1mol O2,则 3O2
放电
.
2O3
开始 1mol 0
反应 0.3mol 0.2mol
平衡 0.7mol 0.2mol
发生反应的O2为1 mol×30%=0.3 mol.
生成的O3为0.2 mol,故反应后所得气体为0.2 molO3和(1-0.3)=0.7molO2.
故M=[0.7mol×32g/mol+0.2mol×48g/mol/0.7mol+0.2mol]=35.6 g/mol
故答案为:35.6 g/mol;
②此题应根据差量法计算设生成臭氧的体积为X,则:
3O2
放电
.
2O3 △V
3 2 1
X 8-6.5=1.5(L)
列方程式得:[2/X=
3−2
(8−6.5)L]; X=3L
故答案为:3;
③n(混合气体)=[0.896L/22.4L/mol]=0.04(mol)
设臭氧的体积分数为a,根据氧原子守恒
0.04mol×a×3+0.04mol×(1-a)×2=[21.6−20/16] mol
解得a=0.5=50%,
故答案为:50%;
④设O2为XL,O3为YL,
2O3
放电
.
3O2
23
YL 1.5YL,根据题意
X+Y=aL
X+1.5Y=1.3aL
解得X=0.4aL,Y=0.6aL,
原混合气中O2和O3的体积比为0.4aL:0.6aL=2:3;
3mol×48g/mol
2mol×32g/mol+3mol×48g/mol×100%=69.2%;
故答案为:2:3;69.2%.点评:
本题考点: 铜金属及其重要化合物的主要性质;臭氧.
考点点评: 本题考查了有关化学反应的有关计算,题目难度中等,注意掌握根据化学方程式进行的简单计算方法,(2)为易错点,注意最终得到的沉淀为硫酸钡,注意差量法的应用.1年前查看全部
- 测定CuSO45H2O中CuSO4含量的步骤
 tgirl1年前1
tgirl1年前1 -
 Firewood_ 共回答了16个问题
Firewood_ 共回答了16个问题 |采纳率100%1、准确称取一定量的五水硫酸铜放入坩埚中
2、将坩埚转移到沙盘中,用酒精喷灯加热到280度左右约几分钟,直至所有样品变成白色
3、将坩埚取出,稍冷后转移到干燥器中彻底冷却
4、准确称量坩埚+无水硫酸铜质量,减去坩埚质量,得到硫酸铜质量1年前查看全部
- 工业上需要利用一批回收的含铜废料制造胆矾(CuSO4•5H2O).该废料中各种成份含量如下:Cu和CuO约占87%,其它
工业上需要利用一批回收的含铜废料制造胆矾(CuSO4•5H2O).该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质.工艺流程为:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
回答:沉淀物 Al(OH)3 Fe(OH)3 Cu(OH)2 Mg(OH)2 Fe(OH)2 pH 5.2 3.1 6.7 9.4 9.7
(1)步骤①中为什么要将含铜废料研磨成粉状?______
(2)步骤②中的离子方程式(写出2个即可):______、______.
步骤⑤中H2O2参加反应的离子方程式:______
(3)步骤⑥中调节溶液pH时适宜的物质是______(填序号);
A.NaOHB.氨水C.Cu2(OH)2CO3D.Cu(OH)2E.MgCO3
步骤⑥中滤渣主要成份的化学式______
(4)步骤⑦中用硫酸调节pH=2~3的原因是______
步骤⑧的分离方法是______. zxb262421年前1
zxb262421年前1 -
 大亚里士多德 共回答了22个问题
大亚里士多德 共回答了22个问题 |采纳率90.9%解题思路:(1)反应物的接触面积与反应速率成正比;(2)铝、硅及氧化铝、二氧化硅都能与碱反应;过氧化氢具有强氧化性,会把亚铁离子氧化为铁离子;(3)调节pH不能引入新的杂质;根据阳离子沉淀的pH可知生成的沉淀;(4)考虑铜离子的水解;(5)从溶液中得到晶体一般采取蒸发浓缩、冷却结晶、过滤的方法.(1)反应物的接触面积与反应速率成正比,将含铜废料研磨成粉状,增大固体反应物的接触面积,加快了反应速率.
故答案为:增大固体反应物的表面积,增大化学反应的速率;
(2)铝、硅及氧化铝、二氧化硅都能与碱反应,Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,过氧化氢具有强氧化性,会把亚铁离子氧化为铁离子,本身被还原为水,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑; Si+2OH-+H2O=SiO32-+2H2↑;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调节pH不能引入新的杂质,A项会引入钠离子,B项会引入铵根离子、E项会引入镁离子,C、D项物质会和氢离子反应调节pH,同时生成铜离子,不会引入新的杂质;根据阳离子沉淀的pH可知,在pH为5.2时,铁离子沉淀完全生成氢氧化铁,
故答案为:C、D;Fe(OH)3;
(4)铜离子为弱碱阳离子能水解,水解方程式为:Cu2++2H2O⇌Cu(OH)2+2H+,加热时会促进水解,加入硫酸,增大了H+离子浓度,会抑制铜离子水解.故答案为:加热蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质,从溶液中得到晶体一般采取蒸发浓缩、冷却结晶、过滤的方法.
故答案为:蒸发浓缩、冷却结晶、过滤.点评:
本题考点: 金属的回收与环境、资源保护;难溶电解质的溶解平衡及沉淀转化的本质;铜金属及其重要化合物的主要性质.
考点点评: 本题以流程图的形式考察了物质的分离与提纯、离子方程式的书写、水解平衡等知识.分离和提纯时一定不能引入新的杂质,调节pH一般加入含提纯物质中的离子的化合物,避免引入新的杂质.如本题制取胆矾晶体,用Cu2(OH)2CO3、Cu(OH)2调节pH,除去杂质.1年前查看全部
- (2010•句容市一模)某实验小组欲用10克胆矾(CuSO4•5H2O)制取氧化铜并证明氧化铜能加快H2O2的分解.
(2010•句容市一模)某实验小组欲用10克胆矾(CuSO4•5H2O)制取氧化铜并证明氧化铜能加快H2O2的分解.
Ⅰ.请你完成他们制取氧化铜的实验步骤.(提示:氢氧化铜受热分解生成氧化铜和水)
(1)称取10克胆矾,将其放入小烧杯中,再______.
(2)向步骤(1)中的烧杯内滴加一定量的______溶液,产生大量的沉淀.
(3)将步骤(2)所得混合物过滤、洗涤.
(4)检验滤液中是否含硫酸铜,操作方法是______.
(5)检验步骤(3)固体残渣是否洗涤干净,操作方法是______.
(6)将洗涤干净的固体残渣加热直至全部变为黑色的氧化铜.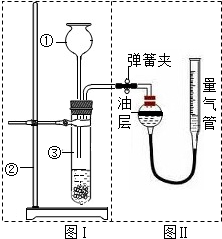 Ⅱ.小明设计了右图实验装置来证明氧化铜能加快双氧水(溶质质量分数约5%)的分解并与二氧化锰的催化效果进行比较(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
Ⅱ.小明设计了右图实验装置来证明氧化铜能加快双氧水(溶质质量分数约5%)的分解并与二氧化锰的催化效果进行比较(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
(1)从设计装置来看,有一个明显的缺陷,你认为如何纠正______.序号 双氧水体积 催化剂 待测数据 ① 15mL 无 ② 15mL CuO(0.5g) ③ 15mL MnO2(0.5g)
(2)从设计原理看,实验中的“待测数据”可以是指______.
(3)实验时气体收集在图Ⅱ的球型漏斗中.若要保证读取的气体体积没有误差,在读数前应进行的操作是______.若要检验产生的气体是氧气,应打开单孔橡皮塞,______.
(4)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):a.证明CuO的化学性质没有改变;b.______.
(5)如果三个实验中所用双氧水溶质质量分数不同,对实验结果______(选填“有”或“没有”)明显影响.
Ⅲ.(1)写出双氧水在氧化铜的催化作用下分解产生氧气的方程式2H2O2
2H2O+O2↑CuO .2H2O2.
2H2O+O2↑CuO .
(2)已知该双氧水中溶质质量分数为5%,若产生氧气0.16g,那实际消耗的过氧化氢溶液质量是多少?(要有计算过程) annettenini1年前1
annettenini1年前1 -
 花之隐逸 共回答了15个问题
花之隐逸 共回答了15个问题 |采纳率73.3%解题思路:I.由硫酸铜制取氧化铜时应经过由硫酸铜转化为氢氧化铜,氢氧化铜在加热时生成氧化铜,这一过程要经历溶解、过滤洗涤等,其中的牵扯的操作较多;重点是铜离子、硫酸根离子的检验
II.(1)设计的装置中长颈漏斗下端的位置不正确.
(2)此题设计的是不同催化剂使用时的反应速度比较,因此应该测量反应的速度.
(3)气密性的好坏是减小误差的最主要因素.
(4)催化剂有两个重要特征:化学反应前后一是质量不变;二是化学性质不变.
(5)比较的是不同催化剂催化效果,创设的其它因素应该相同.
III.氧化铜作催化剂时双氧水的分解,与实验室制取氧气的方程式类似;据方程式的计算是已知生成物求反应物.I.(1)先配置硫酸铜的溶液,故答案为:加水溶解
(2)把硫酸铜转化为氢氧化铜的沉淀,需加入一种碱的溶液,故答案为:氢氧化钠的溶液
(4)检验滤液中是否有硫酸铜,主要是看溶液中是否有铜离子,再加入碱的溶液看有无蓝色沉淀生成.
故答案为:再向滤液中滴加氢氧化钠,看有无蓝色沉淀生成
(5)沉淀是否洗干净就是检验洗涤液中是否有硫酸根离子存在,故滴加氯化钡看是否有白色沉淀生成即可
故答案为:再次洗涤把洗涤后的水中滴加氯化钡,看有无白色沉淀生成
II.(1)设计的装置中长颈漏斗下端的位置不正确.存在于液面以上气体会从长颈漏斗跑出.
故答案为:长颈漏斗应伸入到液面以下
(2)此图表反映的是催化剂不同时其他因素相同时反应的快慢,因此应该通过测量反应的速度,验证结论.
故答案为:收集相同体积的氧气所需的时间
(3)要是测量的误差变小,必须保证装置的气密性较好.检验氧气的存在一般采用大火星的木条.
故答案为:检查装置的气密性;伸入带火星的木条进行检验
(4)判断一种物质是催化剂,除能改变反应速度外,还要验证:一是质量不变,二是其化学性质不变.
故答案为:证明氧化铜的质量没有增减
(5)实验的目的是比较不同催化剂催化效果,创设的其它因素应该相同.
故答案为:有
III.氧化铜作催化剂时双氧水的分解,产物是水与氧气,据方程式的计算是已知生成物求反应物.
故答案为:2H2O2
CuO
.
2H2O+O2↑
设:消耗的双氧水溶液质量是X
2H2O2
CuO
.
2H2O+O2↑
68 32
X×5%0.16g
68:32=X×5%:0.16g
解得:X=6.8g
答:需要双氧水的质量是6.8g点评:
本题考点: 影响化学反应速率的因素探究;实验探究物质的性质或变化规律;催化剂的特点与催化作用;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 此题考查了物质的转化,分离提纯以及不同催化剂效果的比较,训练了学生逻辑思维能力,强化了学生多方面知识的训练.1年前查看全部
- (2009•长宁区二模)晶体有各种不同的种类,有些晶体中常含有结晶水,例如硫酸铜晶体(CuSO4•5H2O).
(2009•长宁区二模)晶体有各种不同的种类,有些晶体中常含有结晶水,例如硫酸铜晶体(CuSO4•5H2O).
(1)该物质俗名是胆矾或蓝矾胆矾或蓝矾,所属类别是盐盐(填“酸”、“碱”或“盐”).
(2)硫酸铜晶体中所含结晶水的质量分数为36%36%.
(3)该物质的摩尔质量为250g/mol250g/mol,2mol硫酸铜晶体中含有6.02×10246.02×1024个水分子.
(4)加热一定量的硫酸铜晶体至完全反应后,可观察到的现象是蓝色晶体变白色蓝色晶体变白色,该变化的化学方程式为CuSO4•5H2O
CuSO4+5H2OCuSO4•5H2O△ .
CuSO4+5H2O.△ .  135886621911年前1
135886621911年前1 -
 仁宗aa 共回答了19个问题
仁宗aa 共回答了19个问题 |采纳率78.9%解题思路:只有熟悉物质的名称、俗名、性质、各类物质的概念、质量分数的计算方法、摩尔的概念,才能得出正确的答案.(1)硫酸铜晶体俗称胆矾或蓝矾;
硫酸铜是由金属离子和酸根离子构成的化合物,符合盐的概念,属于盐.
(2)硫酸铜晶体中结晶水的质量分数为
18×5
250×100%=36%
(3)摩尔质量的单位是g/mol,数值为物质的相对分子质量.
硫酸铜晶体的相对分子质量为64+32+16×4+18×5=250
因此硫酸铜晶体的摩尔质量为250g/mol.
1摩尔硫酸铜晶体的分子个数为6.02×1023.
1个硫酸铜晶体分子中含有5个结晶水分子.
因此2mol硫酸铜晶体中含有结晶水分子的个数为
5×6.02×1023×2=6.02×1024
(4)硫酸铜晶体呈蓝色,硫酸铜呈白色.
硫酸铜晶体在加热条件下反应生成硫酸铜和水,因此反应的现象是蓝色晶体变白色.
该反应的化学方程式为:CuSO4•5H2O
△
.
CuSO4+5H2O.
故答案为:
(1)胆矾或蓝矾;盐.
(2)36%.
(3)250g/mol;6.02×1024.
(4)蓝色晶体变白色;CuSO4•5H2O
△
.
CuSO4+5H2O.点评:
本题考点: 化学式的书写及意义;常见的氧化物、酸、碱和盐的判别;相对分子质量的概念及其计算;元素的质量分数计算;反应现象和本质的联系;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质的名称、俗名、性质、各类物质的概念、质量分数的计算方法、摩尔的概念,难度稍大.1年前查看全部
- (2013•泰安一模)硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4•5H2O)
(2013•泰安一模)硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4•5H2O),其中一种流程如下:

(1)操作I具体为______、______、过滤、烘干.
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是______(填字母代号).
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气.反应完全后向其中加入过量______(填化学式,下同),调节pH至4,生成______沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4].
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O).
烧瓶内发生反应的离子方程式为______;
图2是图1的改进装置,其优点有①______,②______.
 苔丝21年前1
苔丝21年前1 -
 银月弯刀 共回答了14个问题
银月弯刀 共回答了14个问题 |采纳率64.3%解题思路:(1)从溶液中获取晶体的方法是:蒸发浓缩、冷却结晶、过滤、烘干;
(2)铜能被部分有机物还原;
(3)调节溶液PH,加入的物质能和溶液中氢离子反应,从而提高溶液PH,但不能引入新的杂质;
(4)铜和浓硝酸反应生成硝酸铜和二氧化氮,和稀硝酸反应生成硝酸铜和一氧化氮,
图2装置能防止倒吸且有毒气体能完全被吸收.(1)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、冷却结晶;
(2)a.灼烧过程中部分氧化铜被有机物还原生成铜单质,故正确;
b.灼烧不充分.铜未被完全氧化导致含有铜单质,故正确;
c.氧化铜在加热过程中不会分解生成铜,故错误;
d.加热条件下铜易被氧气氧化,故错误;
故选ab;
(3)除杂的原则,保证不引入杂质,加入氧化铜或碱式碳酸铜都能和酸反应从而提高溶液PH,且不引进新的杂质,铁离子生成氢氧化铁沉淀,从而得到纯净的硫酸铜晶体,
故答案为:CuO;Fe(OH)3;
(4)铜和浓硝酸反应生成硝酸铜和二氧化氮,和稀硝酸反应生成硝酸铜和一氧化氮,
离子反应方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
图2装置中充入氧气能平衡压强,所以能防止倒吸,二氧化氮和一氧化氮有毒,不能直接排空,且一氧化氮不易溶于水,充入氧气能使一氧化氮转化为二氧化氮,从而使二氧化氮、一氧化氮能全部被氢氧化钠溶液吸收,防止污染大气,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
①防止氢氧化钠溶液倒吸进入发生装置;②一氧化氮、二氧化氮有毒气体能被完全吸收.点评:
本题考点: 铜金属及其重要化合物的主要性质;制备实验方案的设计.
考点点评: 本题考查了实验方案的设计、评价等知识点,明确物质的性质是解本题关键,难点是实验方案的评价,从实验的可操作性、简便性、安全性、环保等方面考虑,难度较大.1年前查看全部
- 下列10种物质:①水、②空气、③铁、④二氧化碳、⑤硫酸、⑥氢氧化钙、⑦五水硫酸铜[CuSO4•5H2O]、⑧Fe(OH)
下列10种物质:①水、②空气、③铁、④二氧化碳、⑤硫酸、⑥氢氧化钙、⑦五水硫酸铜[CuSO4•5H2O]、⑧Fe(OH)3胶体、⑨碳酸氢钙[Ca(HCO3)2]、⑩钢铁.
(1)属于混合物的是______;
(2)属于氧化物的是______;
(3)属于碱的是______;
(4)属于盐的是______.(填序号) 你的心事我不懂1年前1
你的心事我不懂1年前1 -
 28789224 共回答了25个问题
28789224 共回答了25个问题 |采纳率96%解题思路:(1)由两种或两种以上的物质混合而成的物质是混合物;
(2)由两种元素组成的且其中一种是氧元素的化合物是氧化物;
(3)碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;
(4)盐是指由金属离子(或铵根离子)和酸根离子构成的化合物.(1)空气中含有氮气和氧气等物质,Fe(OH)3胶体是分散系;钢铁是铁和碳的合金,属于混合物,故答案为:②⑧⑩;(2)水、二氧化碳是由两种元素组成的且其中一种是氧元素的化合物,属于氧化物,故答案为:①④;(3...
点评:
本题考点: 混合物和纯净物;酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题考查酸、碱、盐、氧化物的概念及其相互联系,题目难度不大,注意概念的区别.1年前查看全部
- 某同学为了测定硫酸铜晶体(CuSO4•5H2O)中结晶水的含量,设计了如下步骤:
某同学为了测定硫酸铜晶体(CuSO4•5H2O)中结晶水的含量,设计了如下步骤:
A.把适量的硫酸铜晶体放入坩埚,测得总质量a克
B.对坩埚加热,至不再有水蒸气产生
C.用天平测出干燥空坩埚的质量为b克
D.冷却后称量,测得总质量为c克
(1)上述操作步骤合理的顺序是______
(2)硫酸铜晶体中,含结晶水的质量分数的表达式为[a−c/a−b×100% fantasy_su1年前0
fantasy_su1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 欲用胆矾(CuSO4•5H2O)配制480mL 0.1mol•L-1的CuSO4溶液.根据题意填空:
 欲用胆矾(CuSO4•5H2O)配制480mL 0.1mol•L-1的CuSO4溶液.根据题意填空:
欲用胆矾(CuSO4•5H2O)配制480mL 0.1mol•L-1的CuSO4溶液.根据题意填空:
(1)如图所示仪器,配制上述溶液肯定不需用到的是______(填字母),配制上述溶液还需要的玻璃仪器有______(填仪器名称).
(2)配制该溶液应选用______ mL容量瓶.
(3)配制该溶液应用托盘天平称取______ g胆矾.
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是______(填编号).
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,俯视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线. 人面寿心1年前1
人面寿心1年前1 -
 奇客全麦饼 共回答了21个问题
奇客全麦饼 共回答了21个问题 |采纳率90.5%解题思路:(1)根据配制一定物质的量浓度的溶液使用的仪器进行判断图示仪器中不需要的仪器;根据已有的玻璃仪器分析还需要的玻璃仪器;
(2)根据实验室具有的容量瓶的规格及配制的溶液体积选择容量瓶;
(3)根据实际配制500mL0.1mol•L-1的CuSO4溶液中含有的硫酸铜的物质的量计算出需要胆矾的质量;
(4)根据cB=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.nB V (1)配制一定物质的量浓度的溶液一定不会使用B分液漏斗和C锥形瓶,使用的玻璃仪器,除了锥形瓶和玻璃棒,还需要烧杯和胶头滴管,
故答案为:BC;烧杯、胶头滴管;
(2)配制480mL 0.1mol•L-1的CuSO4溶液,实验室没有480mL容量瓶,需要选用500mL容量瓶进行配制,
故答案为:500mL;
(3)配制500mL 0.1mol•L-1的CuSO4溶液,溶液中含有的硫酸铜的物质的量为:0.1mol•L-1×0.5L=0.05mol,
需要胆矾的质量为:250g/mol×0.05mol=12.5g,
故答案为:12.5;
(4)①被称量物与砝码的位置放颠倒了,称量的溶质的质量减小,物质的量偏小,根据cB=
nB
V可得,配制的溶液浓度偏低,故①正确;
②烧杯及玻璃棒未用蒸馏水洗涤,导致配制的溶液中溶质的物质的量偏小,根据cB=
nB
V可得,配制的溶液浓度偏低,故②正确;
③转移溶液前容量瓶内有少量蒸馏水,不影响溶质的物质的量,对配制结果没有影响,故③错误;
④定容时,俯视容量瓶的刻度线,导致加入的蒸馏水体积偏小,根据cB=
nB
V可得,配制的溶液浓度偏高,故④错误;
⑤定容后摇匀,发现液面降低,又补加少量水,导致配制的溶液体积偏大,根据cB=
nB
V可得,配制的溶液浓度偏低,故⑤正确;
故选①②⑤.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度中等,试题基础性强,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,该题的难点在于误差分析,需要明确的是根据cB=nBV可得,关键要看配制过程中引起nB和V怎样的变化.1年前查看全部
- 某化学课外小组用含铜96%的废铜屑(杂质不与酸反应且不溶于酸)制取胆矾(CuSO4・5H2O),将铜屑放入稀硫酸中,加热
某化学课外小组用含铜96%的废铜屑(杂质不与酸反应且不溶于酸)制取胆矾(CuSO4・5H2O),将铜屑放入稀硫酸中,加热并不断鼓入空气可制得.
(1)写出生成硫酸铜反应的化学方程式:______.
(2)现用2kg这种铜屑,理论上能制取胆矾______kg.
(3)若要得到较纯的胆矾,在反应完成后还需要哪几步实验操作:______(依次写出操作名称).
(4)将胆矾与生石灰、水按1:0.56:100的质量比混合配成波尔多液(常用于杀灭果树害虫),此波尔多液中钙元素与铜元素的物质的量的比为______(最简整数比). 伊斯坦堡得小铁匠1年前1
伊斯坦堡得小铁匠1年前1 -
 wx302 共回答了25个问题
wx302 共回答了25个问题 |采纳率88%解题思路:(1)根据铜、氧化铜的化学性质解答,铜能与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜;
(2)依据铜元素守恒计算得到;
(3)依据晶体析出的实验过程分析;
(4)依据胆矾与生石灰、水按质量比依次为1:0.56:100混合液中质量计算物质的量之比.(1)铜在氧气的作用下生成氧化铜,氧化铜和硫酸反应生成硫酸铜,化学方程式为:2Cu+O2
△
.
2CuO、CuO+H2SO4═CuSO4+H2O,也可以合并为:2Cu+O2+2H2SO4=2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(2)铜元素守恒计算得到,设生成胆矾质量为x
Cu~CuSO4•5H2O
64 250
2Kg×96% x
x=[2×0.96/64]×250=7.5(kg);
故答案为:7.5;
(3)若要得到较纯的胆矾,在反应完成后还需要实验操作为:蒸发浓缩,冷却结晶,过滤析出,
故答案为:蒸发浓缩,冷却结晶,过滤析出;
(4)胆矾与生石灰、水按质量比依次为1:0.56:100混合,Ca2+离子和Cu2+离子的物质的量比=[0.56/56]:[1/250]=5:2,
故答案为:5:2.点评:
本题考点: 铜金属及其重要化合物的主要性质.
考点点评: 本题考查了化学方程式的计算应用,物质制备过程的分析判断,题目难度中等.1年前查看全部
- 测定CuSO45H2O中H2O含量的详细步骤
测定CuSO45H2O中H2O含量的详细步骤
主要是要称量几次每次是怎么样的目的 linzp00981年前1
linzp00981年前1 -
 laura72 共回答了26个问题
laura72 共回答了26个问题 |采纳率88.5%1.用天平准确称量出干燥试管的质量,然后称取已研碎的CuSO4·5H2O并放入干燥的试管.CuSO4·5H2O应铺在试管底部.
②把装有CuS04·5H20的试管用试管夹夹住,使管口向下倾斜,用酒精灯慢慢加热.应先从试管底部加热,然后将加热部位逐步前移,至CuS04·5H2O完全变白:当不再有水蒸气逸出时,仍继续前移加热,使冷凝管在试管壁上的水全部变成气体逸出.
③待试管冷却后,在天平上迅速称出试管和 CuSO4的质量.
④加热,再称量,至两次称量误差不超过0.1为止.
至少称量4次...1年前查看全部
- 大一无机及分析化学,求大神解答药典中规定测定CuSO45H2O含量的方法为:取本品0.5g,精确称量,置于碘瓶中加蒸馏水
大一无机及分析化学,求大神解答
药典中规定测定CuSO45H2O含量的方法为:取本品0.5g,精确称量,置于碘瓶中加蒸馏水50 mL,溶解后加醋酸4 mL,KI 2g,用0.1 mol/L NaS2O3标准溶液滴定,近终点时加入淀粉指示剂2 mL,继续滴定至蓝色消失.
(1)写出上述测定反应的主要方程式
(2)为何在近终点时加入淀粉指示剂?
(3)写出CuSO45H2O含量计算公式?
 快乐美人1年前1
快乐美人1年前1 -
 花飞蝶舞剑 共回答了15个问题
花飞蝶舞剑 共回答了15个问题 |采纳率93.3%(1)CUSO4+2KI=CU+K2SO4+I2,还有碘量法的公式.
(2)为了更好指示滴定终点,减少由操作带来的误差.
(3)《分析化学》中去找氧化还原中的碘量法.1年前查看全部
- 写出能实现下列变化的化学方程式①CuSO4•5H2O △ . Cu
写出能实现下列变化的化学方程式
①CuSO4•5H2O
CuSO4+5H2O△ .CuSO4•5H2O
CuSO4+5H2O△ .
②______
③______
④Cu(OH)2
CuO+H2O△ .Cu(OH)2.
CuO+H2O△ . 踩王子的白马1年前1
踩王子的白马1年前1 -
 66小yy 共回答了17个问题
66小yy 共回答了17个问题 |采纳率94.1%解题思路:根据物质的性质,选取生成物质符合变化要求的反应,用化学方程式完成转化关系.①CuSO4•5H2O→CuSO4,根据CuSO4•5H2O的性质可知,CuSO4•5H2O受热分解能得到CuSO4,反应的化学方程式为:CuSO4•5H2O
△
.
CuSO4+5H2O;
②CuSO4→Cu(OH)2,要想得到氢氧化铜需要硫酸铜和一种碱反应,故这种碱可以是氢氧化钠,反应的化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
③CuSO4→BaSO4,要想得到硫酸钡需要硫酸铜和一种含钡的盐或碱反应,故这种碱可以是氢氧化钡,反应的化学方程式为:CuSO4+Ba(OH)2=Cu(OH)2↓+Ba2SO4↓;
④Cu(OH)2→CuO,根据氢氧化铜的性质可知,Cu(OH)2受热分解能得到氧化铜,反应的化学方程式为:Cu(OH)2
△
.
CuO+H2O.
故答案为:(1)CuSO4•5H2O
△
.
CuSO4+5H2O;(2)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;(3)CuSO4+Ba(OH)2=Cu(OH)2↓+Ba2SO4↓;(4)Cu(OH)2
△
.
CuO+H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 根据转化关系中的反应物、生成物的要求,选取合适的反应.难度稍大,只有学生熟悉掌握各物质的性质才能做出正确的解答.1年前查看全部
- (2013•港北区二模)某园林工人配制波尔多液时,将胆矾(CuSO4•5H2O)晶体、生石灰(CaO)分别与水按1:50
(2013•港北区二模)某园林工人配制波尔多液时,将胆矾(CuSO4•5H2O)晶体、生石灰(CaO)分别与水按1:50的质量比混合(胆矾溶于水得到CuSO4溶液),然后把得到的两种液体在木桶里混合并充分搅拌.(1)两种液体在木桶里反应的化学方程式为______;(2)若要检验所配的波尔多液中是否还含有CuSO4,实验方法是______.
 醉卧人生路1年前1
醉卧人生路1年前1 -
 xizhi28 共回答了21个问题
xizhi28 共回答了21个问题 |采纳率100%解题思路:可以根据物质的性质和用途等方面进行分析、判断,从而得出正确的结论.例如,检验所配的波尔多液中是否还含有CuSO4时,可以根据硫酸铜能和铁发生置换反应方面进行实验,从而可以判断出溶液中是否含有硫酸铜.(1)生石灰和水反应生成氢氧化钙,氢氧化钙和硫酸铜反应的化学方程式为:Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
(2)可以用铁检验溶液中是否含有硫酸铜,具体操作是:将一根光亮的铁丝插入波尔多液中,观察铁丝表面是否变红,如果变红色说明溶液中含有硫酸铜.点评:
本题考点: 常用盐的用途;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题的关键是要掌握物质之间相互作用时的实验现象及其反应实质,只有这样才能对问题做出正确的判断.1年前查看全部
- 胆矾(CuSO4•5H2O)是重要的化工原料,工业上用Cu与浓H2SO4、浓HNO3反应制备该物质,采取间歇加热、逐渐加
胆矾(CuSO4•5H2O)是重要的化工原料,工业上用Cu与浓H2SO4、浓HNO3反应制备该物质,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺.模拟制备装置如图所示,根据题意回答下列问题.
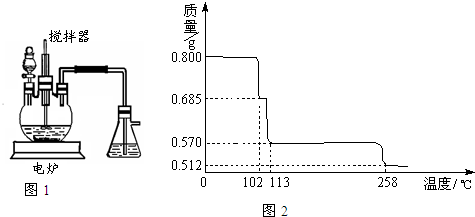
(1)如图1装置中,分液漏斗内装的液体是______(填“浓硝酸”或“浓硫酸”),该发应会产生有毒气体NO、NO2等,锥形瓶中液体可以吸收该气体,反应原理为:NO+NO2+2NaOH=2NaNO2(该物质化学名是______)+H2O.该装置中搅拌器的作用是______.反应所得产品在______ (填“三颈烧瓶”或“锥形瓶”)中.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中常常含有的杂质是一种硝酸盐,其化学式是______,已知10℃、20℃时有关物质的溶解度为:CuSO4•5H2O(17.4g、20.7g);该硝酸盐(95.3g、125.1g),提纯CuSO4•5H2O的实验操作是______.
(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是______,检验该气体的实验操作是______.
(4)将0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.
①由图2中可以看出,CuSO4•5H2O分解的最低温度是______.
②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为CuSO4•5H2O
CuO+SO3↑+5H2O↑△ .CuSO4•5H2O.
CuO+SO3↑+5H2O↑△ . 贝尔母1年前1
贝尔母1年前1 -
 爱情没了cc在 共回答了11个问题
爱情没了cc在 共回答了11个问题 |采纳率81.8%解题思路:(1)由生成的物质可推断加入的物质,依据盐的化学式读法书写NaNO2的名称,依据搅拌器在反应时的作用,依据叙述可知所得的产品存在的装置;
(2)依据铜与硝酸也可以反应生成硝酸铜分析判断;依据硫酸铜晶体的溶解度随温度变化的情况,分析采用的方法;
(3)依据双氧水可以分解生成氧气的知识进行猜想并验证即可;
(4)由图象中物质的变化情况分析硫酸铜晶体分解的最低温度,依据238℃时固体物质的质量数据进行分析即可,依据信息中关于反应的叙述书写方程式即可;(1)由生成的物质有气体NO、NO2等可推断加入的物质是浓硝酸,依据盐的化学式读法可知NaNO2可知其化学名称为亚硝酸钠,在反应中搅拌器在反应时的作用是充分接触,加快反应速率,依据叙述可知所得的产品存在的装置应该是在三颈烧瓶中;
(2)因为铜与浓硝酸也可以反应生成硝酸铜,所以制取的硫酸铜晶体中常含有硝酸铜的杂质;因为硫酸铜晶体的溶解度随温度变化不明显,而硝酸铜的溶解度随温度变化很明显,所以采用重结晶法可提纯硫酸铜晶体;
(3)因为双氧水可以分解生成氧气,所以可猜想是铜离子起到了催化作用使双氧水分解生成了氧气,在检验是否是氧气时一般是采用带火星的木条看是否复燃完成;
(4)①由图象中的信息可知CuSO4•5H2O样品受热脱水过程中在102℃物质的质量开始变小,所以硫酸铜晶体分解的最低温度是102℃;
②设238℃时晶体化学式是CuSO4•xH2O
CuSO4•5H2O
△
.
CuSO4•xH2O+(5-x)H2O
250160+18x
0.800g 0.570g
[250/160+18x]=[0.800g/0.570g]
x=1
该晶体化学式是CuSO4•H2O.
③依据题中的信息可知产物是氧化铜、三氧化硫和水,所以化学方程式为:CuSO4•5H2O
△
.
CuO+SO3↑+5H2O↑;
故答案为:(1)浓硝酸;亚硝酸钠;充分接触,加快反应速率;三颈烧瓶;
(2)Cu(NO3)2; 重结晶(或冷却结晶);
(3)铜离子作催化剂,双氧水分解出氧气;用带火星木条检验,看是否复燃.
(4)①102℃; ②CuSO4•H2O;CuSO4•5H2O
△
.
CuO+SO3↑+5H2O↑;点评:
本题考点: 物质的相互转化和制备;常见气体的检验与除杂方法;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题对同学们熟悉的化学知识进行重组创新,将实验探究内容融合在其中,从原理分析、化学实验基本操作、实验计算等全方位考查同学们驾驭知识的能力.为此同学们在平时的实验学习中要精益求精,关注课本实验,理解实验的要求和目的,这对提升同学们的实验能力具有极大的益处.1年前查看全部
- (2011•上海)CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是CuSO4•5H2O的实验室制备流程图.
(2011•上海)CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是CuSO4•5H2O的实验室制备流程图.

根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:______、______.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是______,除去这种杂质的实验操作称为______.
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取0.1000g提纯后的CuSO4•5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4•5H2O______g.
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用______.在滴定中,准确读数应该是滴定管上蓝线______所对应的刻度.
(5)如果采用重量法测定CuSO4•5H2O的含量,完成下列步骤:①______②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)在过滤前,需要检验是否沉淀完全,其操作是______
(6)如果1.040g提纯后的试样中含CuSO4•5H2O的准确值为1.015g,而实验测定结果是l.000g 测定的相对误差为______. zaxialian1年前1
zaxialian1年前1 -
 枫叶再次红 共回答了18个问题
枫叶再次红 共回答了18个问题 |采纳率88.9%解题思路:(1)根据铜与浓硝酸反应的产物判断现象;
(2)根据反应物判断可能存在的杂质,溶解度不同的可溶性盐可用重结晶法分离;
(3)根据氢氧化钠的物质的量求出硫酸铜的物质的量,进而求出质量;
(4)滴定管使用前要洗涤并用用标准液润洗,防止测定浓度偏小;在滴定中,准确读数应该是滴定管上蓝线粗细交界点;
(5)测量固体的含量,要先称量一定质量的固体,经溶解、沉淀、过滤、干燥、称量等操作,要验证是否洗涤完全,向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全;
(6)相对误差为相对值除以准确值.(1)铜与浓硝酸反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸铜和二氧化氮气体,故答案为:溶液呈蓝色,有红棕色气体生成;
(2)混有硝酸铜杂质,需利用溶解度的不同,用重结晶的方法进行分离,故答案为:Cu(NO3)2、重结晶;
(3)根据化学方程式计算,所含硫酸铜晶体的质量为
0.1000mol/L×(28.00×10−3L−20.16×10−3L)
2×250g/mol═0.0980g,故答案为:0.0980g;
(4)滴定管要用标准液润洗,准确读数应该是滴定管上蓝线粗细交界点,故答案为:标准盐酸溶液润洗2~3次;粗细交界点;
(5)测量固体的含量,要先称量一定质量的固体,经溶解、沉淀、过滤、干燥、称量等操作,其中沉淀需要洗涤,且要验证是否洗涤完全,向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全,故答案为:称取样品;在上层清液中继续滴加加氯化钡溶液,观察有无沉淀产生;
(6)相对误差为
1.000g−1.015g
1.015g× 100%═-1.48%,故答案为:-1.5%(-1.48%).点评:
本题考点: 制备实验方案的设计;化学方程式的有关计算;硝酸的化学性质;中和滴定.
考点点评: 本题主要考察实验现象等观察、物质的提纯,中和滴定、实验过程设计及有关计算,注意滴定管的使用,以及相对误差的计算方法.1年前查看全部
- (2009•徐汇区二模)胆矾(CuSO4•5H2O)是果农配制杀虫剂波尔多液的主要物质之一,其摩尔质量为______,胆
(2009•徐汇区二模)胆矾(CuSO4•5H2O)是果农配制杀虫剂波尔多液的主要物质之一,其摩尔质量为______,胆矾中铜元素的质量分数______ (保留到0.1%);用化学方程式表示波尔多液不能放在铁制容器中配制的原因______.
 ll神童1年前0
ll神童1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 秤取160g CuSO4(160g/mol)250g CuSO4•5H2O(250g/mol)分别溶
秤取160g CuSO4(160g/mol)250g CuSO4•5H2O(250g/mol)分别溶于水时,前者释热66kJ/mol,后者吸热11kJ/mol.则CuSO4(s)+5H2O(l)=CuSO4•5H2O (s) 的热效应是( )
A. 释热77 kJ/mol
B. 释热55 kJ/mol
C. 吸热77 kJ/mol
D. 吸热55 kJ/mol wuweifeng06251年前1
wuweifeng06251年前1 -
 冰玫ミ蓝潇 共回答了16个问题
冰玫ミ蓝潇 共回答了16个问题 |采纳率100%解题思路:将0.1mol CuSO4、0.1mol CuSO4•5H2O固体分别溶于足量水时,前者放热6.6kJ,后者吸热1.1kJ,热化学方程式为:CuSO4(s)→CuSO4(aq)△H=-66KJ/mol;CuSO4•5H2O (s)=CuSO4(s)+5H2O(l)△H=+11KJ/mol,CuSO4(s)+5H2O(l)=CuSO4•5H2O (s)变化为硫酸铜和水形成五水合硫酸铜溶液,然后从溶液中析出两个过程,据此结合盖斯定律解答;胆矾溶于水看成二个过程,第一个过程是:CuSO4•5H2O
△
.
CuSO4(s)+5H2O,这一过程是吸出热量CuSO4•5H2O (s)=CuSO4(s)+5H2O(l)△H=+11KJ/mol;第二过程是:无水硫酸铜制成溶液的过程,此过程是放出热量;160g CuSO4(160g/mol)物质的量为0.1mol,①CuSO4(s)→CuSO4(aq)△H=-66KJ/mol,
250g CuSO4•5H2O(250g/mol)物质的量为0.1mol,②CuSO4•5H2O (s)=CuSO4(s)+5H2O(l)△H=+11KJ/mol,
CuSO4(s)+5H2O(l)=CuSO4•5H2O (s)变化为硫酸铜和水形成五水合硫酸铜溶液,然后从溶液中析出两个过程,所以依据盖斯定律①-②计算得到:
CuSO4(s)+5H2O(l)=CuSO4•5H2O (s)△H=-77KJ/mol.
故选A.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查了物质溶解过程中的能量变化,理解物质溶解过程中的能量变化是解题关键,题目难度不大.1年前查看全部
- I.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
I.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
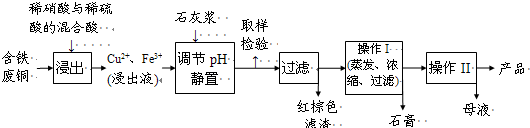
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:温度(℃) 20 40 60 80 100 石膏 0.32 0.26 0.15 0.11 0.07 胆矾 32 44.6 61.8 83.8 114
(1)红棕色滤渣的主要成分是______;
(2)写出浸出过程中生成硫酸铜的化学方程式______;
(3)操作I的操作温度应该控制在______℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为______、洗涤、干燥;
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;
方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是______;
②指出你认为不合理的方案存在的问题______;
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案______.
II.(12分)复印机使用的墨粉主要成份是Fe3O4,图是氧化沉淀法生产Fe3O4的工艺: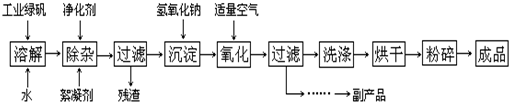
已知:
①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3═Fe3O4•4H2O
请回答下列问题:
(1)铁的常见氧化物有______;
(2)Fe3O4与盐酸反应的化学方程式是:______,检验反应后的溶液中含Fe3+的方法:______;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:______;
(4)生产中可获得的副产品是______,提取该副产品的操作顺序是:______(填写序号)
a.过滤b.加热浓缩c.冷却d.结晶e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为______m3/h(假设反应在标准状态下进行,空气中O2占20%). 无奈的右手无名指1年前1
无奈的右手无名指1年前1 -
 yujie1996 共回答了16个问题
yujie1996 共回答了16个问题 |采纳率75%解题思路:Ⅰ.(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁;
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;
(5)确认Fe3+是否除净应注意铜离子的颜色造成的干扰;
(6)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4;
(2)根据铁元素的化合价+2、+3价写出生成物的两种金属氯化物的化学式,然后再根据式子两边各元素的原子个数相等配平方程式,Fe3+与硫氰化钾溶液反应,使溶液变红色,据此解答;
(3)氢氧化亚铁易被氧气氧化;
(4)根据从硫酸钠溶液中分离出硫酸钠的方法分析操作过程;
(5)根据反应的化学方程式进行分析.Ⅰ.(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3,
故答案为:Fe(OH)3;
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,
反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100℃;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶、过滤;
(5)①方案一:取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在;方案二:径向层析→喷KSCN溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,不但可以分辨出铁离子还能辨别出含有铜离子,
故答案为:方案二;
②取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在,
故答案为:Cu2+的蓝色对检验有干扰;
(6)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,
故答案为:4NO+3O2+H2O=4HNO3;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4,
故答案为:FeO、Fe2O3、Fe3O4;
(2)四氧化三铁与盐酸反应生成氯化亚铁、氯化铁与水,配平后方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,
Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验是否含Fe3+离子的方法为:取少量待测液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+;
(3)Fe(OH)2不稳定,易被氧气氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)氢氧化钠和硫酸亚铁溶液反应后生成氢氧化亚铁和硫酸钠,所以副产品是硫酸钠,由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:加热浓缩,冷却,结晶,过滤,洗涤,即bcdae,
故答案为:Na2SO4•10H2O(或芒硝,写Na2SO4也可);bcdae;
(5)鼓入的空气应恰好与FeSO4完全反应,
12.16 kg工业绿矾中含FeSO4的物质的量:[12160g×52.5%/152g/mol]=42mol,设鼓入空气的速率应为Vm3/h,
根据:6 FeSO4~O2~2 Fe3O4
6mol 22.4L
42mol Vm3×103L/m3×1/5
解得:V=0.784,
故答案为:0.784.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;铁的氧化物和氢氧化物;铜金属及其重要化合物的主要性质.
考点点评: 本题为拼合型题目,题量大,对学生的心理素质有非常高的要求,考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、离子检验,化学计算等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.1年前查看全部
- (2009•杭州)胆矾(CuSO4•5H2O)是一种常见的化学药品,下列关于胆矾的说法错误的是( )
(2009•杭州)胆矾(CuSO4•5H2O)是一种常见的化学药品,下列关于胆矾的说法错误的是( )
A.CuSO4•5H20是纯净物
B.胆矾溶液中铜离子和硫酸根离子的电荷总数相等
C.游泳池的池水中往往定期加一些胆矾,是因为铜离子有一定的杀菌作用
D.金属钠放入胆矾溶液中有红色的铜被置换出 Blue_Halle1年前1
Blue_Halle1年前1 -
 十三号星期五 共回答了21个问题
十三号星期五 共回答了21个问题 |采纳率71.4%解题思路:根据胆矾的化学组成和性质回答,在金属活动性顺序的应用中,不用钾钙钠置换盐溶液中的金属,因为钾钙钠活动太强,会与水反应生成碱.A、CuSO4•5H20是纯净物,正确,因为胆矾中只有一种成分.
B、胆矾溶液中铜离子和硫酸根离子的电荷总数相等,正确,因为铜离子和硫酸根离子所带的电荷数相等,电性相反.
C、泳池的池水中往往定期加一些胆矾,是因为铜离子有一定的杀菌作用,此说法正确.
D、钠放入胆矾溶液中,会和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀.故说法错误,符合题意.
故选D点评:
本题考点: 常用盐的用途;纯净物和混合物的判别;金属活动性顺序与置换反应.
考点点评: 根据物质的组成判断物质的有关性质,知道某些化学规则中的特殊情况,如钾钙钠和盐溶液反应的特点.1年前查看全部
- 4、在100摄氏度下加热0.125g的CuSO4•5H2O(五水合硫酸铜),获得0.089g的剩余固体.则剩
4、在100摄氏度下加热0.125g的CuSO4•5H2O(五水合硫酸铜),获得0.089g的剩余固体.则剩余固体的化学式是________.
 晓夜孤_zz1年前1
晓夜孤_zz1年前1 -
 linglongcao 共回答了18个问题
linglongcao 共回答了18个问题 |采纳率88.9%CuSO4.H2O1年前查看全部
- (2013•台州一模)CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是实验室以抛光厂的废铜屑(含有少量铁粉、
(2013•台州一模)CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是实验室以抛光厂的废铜屑(含有少量铁粉、油污)为原料来制备、提纯CuSO4•5H2O及含量测定的流程:
步骤1、铜的提纯
将3克废铜屑放入蒸发皿,灼烧至表面变黑,立即停止加热;冷却备用
步骤2、硫酸铜晶体粗产品的制备
步骤3、硫酸铜的提纯
步骤4、硫酸铜的纯度检验
请回答下列问题:
(1)步骤1中废铜屑进行灼烧的主要目的为:Ⅰ.使铜屑部分氧化成氧化铜;
Ⅱ.______
(2)步骤3中要进行多次过滤,可采用如图1的方法,其名称为______,下列关于该过滤方法的说法不正确的是______
A.该方法适用于过滤胶状沉淀或颗粒较小的沉淀
B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤
C.这种过滤方法可以避免沉淀过早堵塞滤纸小孔而影响过滤速度
D.该操作中玻璃棒的作用为引流
本步骤中滤液要进行两次调节pH,其主要目的依次为:______;______.(请结合离子方程式和简要的语言来描述)
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取 0.1000g提纯后的CuSO4•5H2O试样于锥形瓶中,加入0.1000mol•L-1氢氧化钠溶液25.00mL,待反应完全后,过量的氢氧化钠用0.1000mol•L-1盐酸滴定至终点,耗用盐酸17.32mL,则 0.1000g该试样中含CuSO4•5H2O______g.
(4)上述实验中,用25.00mL移液管量取0.1000mol•L-1氢氧化钠溶液25.00mL之前,先用蒸馏水洗净后,再用待装液润洗.吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时,______.然后将移液管垂直放入稍倾斜的锥形瓶中,使管尖与内壁接触…
(5)如果铜屑、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是______,除去这种杂质的实验操作名称为______.
附:溶解度表及溶解度曲线
温度 0℃ 20℃ 40℃ 60℃ 80℃ CuSO4•5H2O 23.1 32.0 46.4 61.8 83.8 Cu(NO3)2•6H2O 81.8 125.1 Cu(NO3)2•3H2O 160 178.5 208  aqdpkhl5c1年前1
aqdpkhl5c1年前1 -
 芽孢杆菌 共回答了22个问题
芽孢杆菌 共回答了22个问题 |采纳率90.9%解题思路:(1)废铜屑含有少量铁粉、油污,废铜屑放入蒸发皿,灼烧至表面变黑,立即停止加热,冷却备用,目的是除去表面的油污,使铜被氧化为黑色氧化铜的作用;
(2)图1的分离方法为倾析法;沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离.
依据流程图分析可知,第一次调节溶液PH是为了沉淀铁离子生成氢氧化铁沉淀,第二次调节溶液PH是为了抑制铜离子的水解;
(3)依据题干数据结合实验过程分析,依据数据计算和硫酸铜反应的氢氧化钠物质的量,得到CuSO4•5H2O的物质的量计算含量;
(4)依据移液管的使用方法回答;
(5)根据反应物判断可能存在的杂质,溶解度不同的可溶性盐可用重结晶法分离;(1)废铜屑含有少量铁粉、油污,废铜屑放入蒸发皿,灼烧至表面变黑,立即停止加热,目的是除去表面的油污,使铜被氧化为黑色氧化铜的作用;
故答案为:除去铜屑表面油污;
(2)图1的分离方法为倾析法;沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离;沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离.沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离;
A.该方法适用于过滤颗粒较大的沉淀,沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离,故A不正确;
B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤,符合此过滤操作,故B正确;
C.倾析法过滤可以避免沉淀过早堵塞滤纸小孔而影响过滤速度,故C正确;
D.该操作中玻璃棒的作用为引流作用,故D正确;
故选A.
依据流程图分析可知,第一次调节溶液PH是为了沉淀铁离子生成氢氧化铁沉淀,第二次调节溶液PH是为了抑制铜离子的水解;
第一次调节pH:因pH升高,平衡Fe3++3H2O⇌Fe(OH)3+3H+向右移动,产生Fe(OH)3沉淀而除去Fe3+;
第二次调节pH:是为了抑制铜离子水解Cu2++2H2O⇌Cu(OH)2+2H+,而提高产率;
故答案为:倾析法,A;第一次调节pH:因pH升高,平衡Fe3++3H2O⇌Fe(OH)3+3H+向右移动,产生Fe(OH)3沉淀而除去Fe3+;第二次调节pH:是为了抑制铜离子水解Cu2++2H2O⇌Cu(OH)2+2H+,而提高产率;
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取 0.1000g提纯后的CuSO4•5H2O试样于锥形瓶中,加入0.1000mol•L-1氢氧化钠溶液25.00mL,待反应完全后,过量的氢氧化钠用0.1000mol•L-1盐酸滴定至终点,耗用盐酸17.32mL,计算得到沉淀铜离子需要的氢氧化钠物质的量=0.1000mol•L-1×0.025.00L-0.1000mol•L-1×0.01732mL=0.000768mol,依据CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 反应的化学方程式定量关系计算得到硫酸铜物质的量=0.000384mol,则 0.1000g该试样中含CuSO4•5H2O的质量=0.000384mol×250g/mol=0.0960g;
故答案为:0.0960;
(4)吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹面最低处与标线相切,立即按紧管口,然后将移液管垂直放入稍倾斜的锥形瓶中,使管尖与内壁接触;
故答案为:立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹面最低处与标线相切,立即按紧管口;
(5)铜屑、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是混有硝酸铜杂质,需利用溶解度的不同,用重结晶的方法进行分离;
故答案为:Cu(NO3)2•6H2O,重结晶;点评:
本题考点: 探究物质的组成或测量物质的含量;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了实验探究物质含量的测定方法和实验设计验证,主要是镏出分析判断,过程中的定量计算应用,掌握基础是关键,题目难度中等.1年前查看全部
大家在问
- 1以72km/h的速度行驶的汽车,紧急刹车后做匀减速直线运动
- 2五年级语文暑假作业在成语中找出诗人的名字1.首屈一指 星火燎原 ( )2.张冠李戴 白驹过隙 ( )3.山高水低 无所适
- 3arctan1等于多少要计算过程
- 4一个田字.上面有九个点.横着数,竖着数,斜着数.可以数八排出来,而且上面有三个点.
- 5我觉得绿色比白色好看 英语翻译
- 6已知两条直线L1:x+(1+m)y=2-m,L2:2mx+4y+16=0,为何值时L1与L2 1、相
- 7小时侯,我肚子痛,妈妈就煮了个鸡蛋,然后切开一个小口,将一个银戒指放入蛋黄中,然后就用鸡蛋在我的肚子上滚来滚去,过了一会
- 8又失败了?再次尝试!英语是不是:Fail again?Try again!是不是这个?)
- 9某生物的基因型是AaBb,如图是体内一个正在进行减数分裂的细胞示意图,下列说法正确的是
- 10从数字1,2,3,4,5,中任意3个组成三位数,求所得三位数是偶数的概率
- 11已知△ABC的三边的垂直平分线交点在△ABC的边上,则△ABC的形状为( )
- 12在比例尺是1:4000000的地图上,量得两地的距离是12厘米.甲、乙两辆汽车同时从
- 13已知关于x的二次三项式2*x的平方+mx+n因式分解的结果为(2x-1)(x+4\1),求m和n的
- 14以“自然之声”为中心写一篇作文500字,学霸们,帮帮忙啦。
- 15根据首字母填空 I live w___my grandparents in the country.There are

