11月27日化学45分钟 1.下列关于平衡常数K的说法中,正确的是
 shwhq2022-10-04 11:39:542条回答
shwhq2022-10-04 11:39:542条回答
11月27日化学45分钟 1.下列关于平衡常数K的说法中,正确的是
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关
A.①② B.②③ C.③④ D.①③
我的问题是:答案说①是对的,它说只与反应本身及温度有关,什么是与反应本身有关,不懂哦.
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关
A.①② B.②③ C.③④ D.①③
我的问题是:答案说①是对的,它说只与反应本身及温度有关,什么是与反应本身有关,不懂哦.

已提交,审核后显示!提交回复
共2条回复
 傍晚的太阳 共回答了24个问题
傍晚的太阳 共回答了24个问题 |采纳率91.7%- 反应本身有两个方面:
一个方面简称是反应物是什么:比如H+和OH-反应生成H2O这个反应的K值,要远远大于2SO2 + O2 = 2SO3 这个反应的K值的.这个是反应物本身.
还有一个方面,简称是反应系数是什么:比如 SO2 + 1/2 O2 = SO3 和2SO2 + O2 = 2SO3这个反应的反应物是相同的,但系数是不同的.因此K值也是不同的. - 1年前
 kingchen76 共回答了3个问题
kingchen76 共回答了3个问题 |采纳率- 例如H2+I2=2HI K1
2H2+2I2=4HI k2
( k1)^2=K2
和温度与反应方程式的系数有关 - 1年前
相关推荐
- 11月27日 8月13日 英语怎么说
11月27日 8月13日 英语怎么说
口语的 和书写的都要 胖子Barry1年前4
胖子Barry1年前4 -
 slx123321 共回答了23个问题
slx123321 共回答了23个问题 |采纳率95.7%口语
November the twenty-seventh
August the thirteenth
书写
November 27th or Nov.27th
August 13th or Aug.13th1年前查看全部
- 11月27日化学9.体积完全相同的两个容器A和B,已知A装有SO2和O2各1g,B装有SO2和O2各2g,
 今生没爱情1年前2
今生没爱情1年前2 -
 怪怪的老妇人 共回答了18个问题
怪怪的老妇人 共回答了18个问题 |采纳率94.4%2SO2 + O2 ==可逆== 2SO3,
A:11(SO2转化率a%)
B:2 2 (SO2转化率b%)
这一题定温定容,刚才说了若反应物有多种,加入其中一种我们看浓度变化,这种情况是等比例加入所有反应物,我们要看压强变化(即体积,化学计量数变化),这种情况B就相当于是在A的基础上增大压强,那么反应要向气体体积减小的方向移动,即化学计量数减小的方向,即正方向移动,B中反应物的转化率都要高于A,且转化率增加的比例也相等
所以b>a,且转化率BSO2/ASO2=BO2/AO2
我把定温定容的所有情况都列出来:
①对于反应物只有一种,加入反应物,我们看压强变化(即气体体积和化学计量数的变化)
例如:2HI ==可逆== H2 + I2(要讨论HI的转化率)
②对于反应物有多种,我们只加入其中一种(比如A),我们看浓度的变化,这里A的浓度增加了,平衡就要向使A浓度减小的方向移动
例如:N2 + 3H2 ==可逆== 2NH3(要讨论N2或者H2的转化率)
③对于反应物有多种,我们等比例变化所有反应物,我们看压强变化(即气体体积和化学计量数的变化)
例如:N2 + 3H2 ==可逆== 2NH3(等比例变化N2和H2的物质的量,讨论N2或者H2的转化率)
上面这一段就是我刚才给你回答的几道题目的总结,基本上考点都在这里了,要判断转化率的变化首先是要看适用于哪一条判断法则,从而判断出平衡的移动情况,继而判断出转化率的变化
无论题目怎么变,万变不离其宗!1年前查看全部
- 11月27日化学名师17页7.COCl2俗名光气,是有毒气体,在一定条件下,可发生化学反应为:
11月27日化学名师17页7.COCl2俗名光气,是有毒气体,在一定条件下,可发生化学反应为:
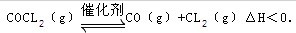
下列有关说法正确的是( )
A.在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.当反应达平衡时,恒温恒压条件下通人Ar,能提高COCl2的转化率
C.单位时间内生成CO和CL2的物质的量比为1:1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 ph_wf1年前3
ph_wf1年前3 -
 LY-xmbsb 共回答了17个问题
LY-xmbsb 共回答了17个问题 |采纳率88.2%答案:B
A:催化剂只能加快反应速率,对化学平衡是无影响的.
B:恒温恒压下通入Ar(气体),相当于扩充容器的体积.体积增大了,平衡则向生成气体系数较多的方向移动,对应反应式就是向生成CO和Cl2的方向移动.这样,COCl2的转化率就增大了.
C:由于CO和Cl2系数比例为1:1,因此CO和Cl2产量在反应的任何时间内比例都是1:1.所以不能根据这个判断平衡.
D:由于正反应是放热的,升高温度的话平衡会逆向移动;导致生成物减少,平衡常数变小.1年前查看全部
- 今天是11月27日,exo灿烈的生日,我想对他说声生日快乐,而明天11月28日是exo出道600周
今天是11月27日,exo灿烈的生日,我想对他说声生日快乐,而明天11月28日是exo出道600周
日的纪念日,exo600周日快乐!翻译成英语怎么说呢? frog_zhang1年前1
frog_zhang1年前1 -
 fwzxw 共回答了23个问题
fwzxw 共回答了23个问题 |采纳率82.6%Today is November 27th,exo chanyeol's birthday,I want to say Happy birthday to him,and tomorrow is exo's debut in November 28th 600 in Sunday's anniversary,exo 600 happy Sunday!1年前查看全部
- 11月27日化学(II)对于分解反应来说,要视反应前后物质的计量数而定,
11月27日化学(II)对于分解反应来说,要视反应前后物质的计量数而定,
(II)对于分解反应来说,要视反应前后物质的计量数而定,如对2HI(g)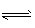 H2(g)+I2(g),无论是增大还是减小HI的浓度,HI的转化率都不变;对2NH3(g)
H2(g)+I2(g),无论是增大还是减小HI的浓度,HI的转化率都不变;对2NH3(g)  N2(g)+3H2(g),增大NH3的浓度,NH3的转化率减小.
N2(g)+3H2(g),增大NH3的浓度,NH3的转化率减小.
请帮忙详细解释这段话话,点都不懂, z1t4r21年前2
z1t4r21年前2 -
 hcx9501 共回答了18个问题
hcx9501 共回答了18个问题 |采纳率61.1%这个就是上个问题我给你总结的,你仔细看看:
说了这么多,可能你还不是很理解怎么看定温定容条件下的平衡移动,下面两点很重要:
①对于反应物只有一种,加入反应物,我们看压强变化(即气体体积的变化)
②对于反应物有多种,我们只加入其中一种(比如A),我们看浓度的变化,这里A的浓度增加了,平衡就要向使A浓度减小的方向移动
2HI = H2 + I2
2NH3 = N2 + 3H2
仔细看,我们要看HI和NH3的转化率变化,他们都是只有一种反应物,用上面①方法来判断平衡移动,由于化学计量数相等,压强(体积)不会改变,平衡不会移,HI转化率不变
而加入NH3,平衡要向体积减小的方向移动,即化学计量数减小的方向,即逆方向,所以NH3的转化率降低1年前查看全部
- 11月27日化学名师导学:40页:(4)判断平衡移动方向
 kinsim1年前2
kinsim1年前2 -
 超凡的想 共回答了12个问题
超凡的想 共回答了12个问题 |采纳率83.3%Q和K的表示形式都是一样的,在这道题里:
[c^p (C).c^q (D)]
Q = ————————— K的表示形式也是这个.不过二者意义有些区别.
[c^m (A).c^n (B)]
K表示的意义:反应物和生成物的浓度(系数次幂),达到K这个比例时,即达到平衡.
而Q的意义:仅仅表示反应物和生成物的浓度(系数次幂)的一个比例.
由于二者的表现形式是一样的,也就是说当Q=K时:反应物和生成物的浓度(系数次幂)正好达到平衡时(K值)的比例.这样,就表示反应达到了平衡;平衡状态时V正 = V逆 .
由于Q的表示形式,分子是生成物浓度,分母是反应物浓度.这样,Q值越大时,就代表反应此时生成物的浓度越大;反之,Q值越小时,则代表反应物的浓度越大.这样:
当Q < K 时,说明此时体系中反应物的浓度较大,因此正反应的速率较大.V正 > V逆;
当Q < K 时,说明此时体系中生成物的浓度较大,因此逆反应的速率较大.V正 < V逆.1年前查看全部
- 11月27日化学名师对话17页:5.在一密闭容器中充入1mol NO2气体,建立如下平衡:
11月27日化学名师对话17页:5.在一密闭容器中充入1mol NO2气体,建立如下平衡:
2NO2

N2O4,测得NO2转化率为a%,在温度,体积不变时,再通入1mol NO2待新平衡建立时,测得NO2的转化率为b%,a与b比较:
A a>b B b>a C a=b D无法确定 FiFi6281年前2
FiFi6281年前2 -
 Aleepo 共回答了20个问题
Aleepo 共回答了20个问题 |采纳率100%2NO2 ==可逆== N2O4 (T和V不变)
定温定容情况下加入NO2,平衡向气体体积减小的方向移动,即正方向,NO2的转化率要增大,b>a
选B,b>a
这里要注意,定温定容的情况下:
①对于反应物质有一种,加入反应物,该反应物的转化率看平衡移动情况肯(例如此题)
②对于反应物有两种或者更多,加入反应物A,则A的转化率肯定降低,B的转化率肯定升高
对于②情况,例如:
N2 + 3H2 ==可逆== 2NH3
定温定容情况下加入N2,则N2转化率肯定降低,反应向N2浓度减小方向移动,即正方向移动,那么H2转化率升高
如果将上面题目倒过来:
N2O4 ==可逆== 2NO2
之前N2O4转化率为a%,定温定容加入N2O4后,转化率变为b%,求a与b的大小关系
定温定容加入N2O4,平衡向气体体积减小的方向移动,即逆向移动,N2O4的转化率要降低,那么a>b,结论和上面刚好相反
说了这么多,可能你还不是很理解怎么看定温定容条件下的平衡移动,下面两点很重要:
①对于反应物只有一种,加入反应物,我们看压强变化(即气体体积的变化)
②对于反应物有多种,我们只加入其中一种(比如A),我们看浓度的变化,这里A的浓度增加了,平衡就要向使A浓度减小的方向移动
望采纳!1年前查看全部
- 我是1996年出生的我的生日是11月27日.用英语怎么说
我是1996年出生的我的生日是11月27日.用英语怎么说
请大家帮忙谢谢 asis1年前7
asis1年前7 -
 zzxxlj 共回答了15个问题
zzxxlj 共回答了15个问题 |采纳率100%I was born in nineteen ninety six. My birthday is November twenty seven.1年前查看全部
- 英语翻译我是****的工作人员,我们德国公司的key Account manager Frank 将于11月27日到达成
英语翻译
我是****的工作人员,我们德国公司的key Account manager Frank 将于11月27日到达成都,请问您是否有时间在11月28日与我们见面及会谈,以方便我们以后更好的合作! saliona1年前4
saliona1年前4 -
 budsu 共回答了11个问题
budsu 共回答了11个问题 |采纳率100%I am xx from ****.Frank,our Key Account Manager in Germany,will arrive in Chengdu on November 27.Will you be available to meet us on November 28 so that we can have a brief discussion for a better cooperation later / in future.Thanks.
没有照楼主的直译,根据我的语感做了小小的改动.1年前查看全部
- 第十六届亚运会于2010年11月12日晚8时在广州隆重开幕,11月27日闭幕。据此完成1~2题。 1.第十六届亚运会于开
第十六届亚运会于2010年11月12日晚8时在广州隆重开幕,11月27日闭幕。据此完成1~2题。 1.第十六届亚运会于开幕时,伦敦(零时区)的区时是 [ ]
A.11月12日8时
B.11月12日0时
C.11月12日12时
D.11月13日0时2.第十六届亚运会举办期间,太阳直射点的位置和移动方向是 [ ]
A.北半球,向南移
B.北半球,向北移
C.南半球,向南移
D.南半球,向北移 youyici2221年前1
youyici2221年前1 -
 小_林哥哥 共回答了21个问题
小_林哥哥 共回答了21个问题 |采纳率100%1、C
2、C1年前查看全部
- 2道区时和太阳直射点的题9月27日下午16时30分,西八区可能处于几点11月27日,太阳直射点在——半球(南或北),并向
2道区时和太阳直射点的题
9月27日下午16时30分,西八区可能处于几点
11月27日,太阳直射点在——半球(南或北),并向——(南或北)移动 dtkzt1年前1
dtkzt1年前1 -
 暗香浮涌 共回答了15个问题
暗香浮涌 共回答了15个问题 |采纳率66.7%北京时间9月27日下午16时30分,西八区可能处于0点30分;
11月27日,太阳直射点在南半球(南或北),并向南(南或北)移动!1年前查看全部
大家在问
- 1musters,please translate this for me ,thanks .you are so coo
- 2请问酸性KMnO4氧化乙烯的完整方程式是什么
- 3如图,矩形纸片ABCD中,AB=8,将纸片折叠,使顶点B落在边AD的E点上,BG=10.
- 4求中国地图上任意两座城市的图上距离,并根据中国地图上的比例尺算出实际距离.急.
- 5已知定点A(-1,3),B(4,2),以A,B为直径的端点作圆,与x轴有交点C,则交点C的坐标___.
- 6给你两个如图所示的装置,锥形瓶里面插相同植物的枝条,一枝有叶,一枝无叶.两瓶内水面高度相同.请设计一个实验,探究植物的叶
- 72012年某企业生产的单位商品价值量用货币表示为60元。假设2013年该商品的社会劳动生产率提高了20%,该企业的劳动生
- 8在物理中表达式和计算式有没有区别
- 9爱国名言
- 10已知x,y是有理数,且(|x|-1)2+(2y+1)2=0,则x-y的值是多少?
- 112010年,在银行存50万RMB ,定期一年有多少利息?
- 122k1+k2=5 3k1+k2/2=6 一元二次的方程解
- 13(1)函数y=1/3的根号x-1次方的值域(2)函数y=1/2的2x-x²次方的值域
- 14《写给老师的一封信》 400~500字
- 15阅读下面“2009年和2010年房产交易变化信息对照表”,回答后面的问题。


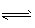 pC(g)+qD(g)在任意状态下,生成物的浓度和反应物的浓度之间的关系用Q=[c^p (C).c^q (D)]/[c^m (A).c^n (B)]表示,则:
pC(g)+qD(g)在任意状态下,生成物的浓度和反应物的浓度之间的关系用Q=[c^p (C).c^q (D)]/[c^m (A).c^n (B)]表示,则: