某化工厂采用新技术后……某化工厂采用新技术后,每天用原料14吨,这样,原来7天用的材料,现在可以用10天.如果原来每天用
 cooltree2022-10-04 11:39:541条回答
cooltree2022-10-04 11:39:541条回答某化工厂采用新技术后,每天用原料14吨,这样,原来7天用的材料,现在可以用10天.如果原来每天用原料a吨,这个工厂现在每天比过去每天节约多少吨原料?

已提交,审核后显示!提交回复
共1条回复
 tony1st 共回答了16个问题
tony1st 共回答了16个问题 |采纳率100%- 14*10/7-14=6T
- 1年前
相关推荐
- 化工厂原来有甲乙两堆煤,共重24吨,若甲加4吨,乙用去四分之一,两堆的质量正好相等甲乙原来各有几吨煤拜
 tonylzs1年前1
tonylzs1年前1 -
 散步的猫一宇 共回答了16个问题
散步的猫一宇 共回答了16个问题 |采纳率87.5%设甲厂有a吨煤,乙厂有B吨煤.则a+b=24;a+4=b*3/4.所以a=8,b=16.甲厂有8吨,乙厂有16吨.1年前查看全部
- 某综合实验活动小组的同学,对某化工厂排放的污水进行检测,发现主要的污染物为氢氧化钠.
某综合实验活动小组的同学,对某化工厂排放的污水进行检测,发现主要的污染物为氢氧化钠.
为测定污水中氢氧化钠的含量,取100g污水于烧杯中,加入36.5g质量分数为10%的稀盐酸,恰好完全反应.(假设污水中其他成分不与稀盐酸反应)求:(1) 100g污水中氢氧化钠的质量.(2)污水中氢氧化钠的质量分数
(求具体~) 蓝8冰1年前1
蓝8冰1年前1 -
 soxx888 共回答了20个问题
soxx888 共回答了20个问题 |采纳率95%设污水中NaOH的质量为X
HCl + NaOH = NaCl + H2 O
36.5 40
36.5*10% X
36.5/(36.5*10%)=40/X
解出X=4
即100g水中含有4g的氢氧化钠
污水中氢氧化钠的质量分数为4/100*100%=4%1年前查看全部
- 某化工厂排出的废液中含有AgNO3、Zn(NO3)2和Cu(NO3)2三种物质.请你设计方案回收金属银、铜和硝酸锌.注
 薄荷花茶1年前1
薄荷花茶1年前1 -
 luyufeng 共回答了25个问题
luyufeng 共回答了25个问题 |采纳率84%先加Cu后加Zn1年前查看全部
- 某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气
某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气体,下列说法正确的是:
1.废液中一定有CO3(2-) 2.废液中有H2SO4
3.废液中一定有Ag+ 4.废液中一定有SO4(2-)
答案是1和4,可是我不明白为什么说1和3不行呢? plaum1年前1
plaum1年前1 -
 Virusaga 共回答了18个问题
Virusaga 共回答了18个问题 |采纳率88.9%氯化银在稀硝酸中是不溶解的.通常废银化合物的回收就是用浓硝酸将废银溶解以后,加入稀氯化钠水溶液,析出沉淀来.过滤就可以得到氯化银了.1年前查看全部
- 某化工厂现有甲种原料290千克,乙种原料212千克,计划用这两种原料生产A、B两种产品共18件,
某化工厂现有甲种原料290千克,乙种原料212千克,计划用这两种原料生产A、B两种产品共18件,
生产一件A产品需要5千克,乙种原料1.5千克,生产成本是120元;生产一件B种产品需要甲种原料2.5千克,乙种原料3.5千克,生产成本是200元.
(1)该化工厂现有原料能否保证生产?若能的话,有几种生产方案?请设计出来.
(2)试分析你设计的哪种生产方案总造价最低?最低造价是多少?
呃 不好意思哈 是A、B两种产品共80件 要用x来解.设方程的 坏吉他1年前1
坏吉他1年前1 -
 zzzzzynx 共回答了10个问题
zzzzzynx 共回答了10个问题 |采纳率100%第一问有18种,第二问甲18件乙0件最少,2160元.1年前查看全部
- 某化工厂计划1月份生产一批化肥,上半月完成了计划的5分之3,下半月完成月计划的4分之3,这个厂1月份有没有完成任务?如果
某化工厂计划1月份生产一批化肥,上半月完成了计划的5分之3,下半月完成月计划的4分之3,这个厂1月份有没有完成任务?如果下半月完成了计划的4分之3呢?上述两种情况,如果没有完成任务,那么还剩计划的几分之几?如果完成了,那么超过计划的几分之几?
 疯了那什么1年前1
疯了那什么1年前1 -
 剑雨潇香 共回答了23个问题
剑雨潇香 共回答了23个问题 |采纳率95.7%5分之3+4分之3=20分之27,超额完成计划的20分之7.1年前查看全部
- 某化工厂现存甲原料360千克,乙原料290千克,计划利用这两种原料生产A,B两种产品共50件
某化工厂现存甲原料360千克,乙原料290千克,计划利用这两种原料生产A,B两种产品共50件
已知生产一件A产品,需要甲种原料9kg,乙种原料3kg,生产一件B产品,需用甲种原料4kg,乙种原料10kg,请你根据要求设计A,B两种产品的生产方案 脱俗觉醒1年前1
脱俗觉醒1年前1 -
 深雪茗 共回答了16个问题
深雪茗 共回答了16个问题 |采纳率87.5%根据题意,设生产x件A产品,y件B产品,然后列出方程组:
x+y=50
9x+4y1年前查看全部
- 写一篇有关化工厂污染环境的英语作文
写一篇有关化工厂污染环境的英语作文
某学校附近拟建一座化工厂.请你以该校学生的名义,写一篇短文,陈述反对建此化工厂的理由.短文中要包括以下几点:
1.不仅你本人,大部分同学都反对建这个化工厂.
2.尽管该工厂可以为本市赚不少钱,但危害大于好处.
3.严重污染饮用水,防范措施不充分.
4.造成严重空气污染.
5.侵占学生们游戏、玩耍的场所 mengzhan3131年前1
mengzhan3131年前1 -
 左左左28 共回答了15个问题
左左左28 共回答了15个问题 |采纳率86.7%On Building a Chemical Works
Most students of out, school, includingme, think it is wrong to build a chemical works near our school. Although the works will make a lot of money for our city, we do think it will do us more harm than good. First, the drinking water will be badly polluted. Of course, they have promised to do something to prevent the water from being polluted, but it is far from enough. Second, the air over the city will be polluted, too. We will never be able to breathe fresh air. How can we live here any longer? What's more, the site of the chemical works has been the only place where we students play games and have sports after school. Where would we go if it were occupied? For the above reasons, we do hope the project will be cancelled.
关于兴建化工厂
我们学校的大多数同学,包括我在内,认为在我们学校附近兴建化工广是不对的.尽管该厂可为本市赚不少钱,但危害大于好处.首先,严重污染饮用水.他们当然答应将来取措施防止水的污染,但这是远远木够的.其次,也造成本市的空气污染.我们将不能再呼吸到新鲜空气,怎能在此生活呢?而且,所选的厂址是我们学生放学后做游戏和运动的唯一场所,如果被占用了,我们到哪里去呢?由于上述原因,我们真的希望取消这项工程.1年前查看全部
- 下列句子没有语病的一项是(2分) A.这家化工厂排出大量废气和噪声,周边居民对此意见很大,纷纷打电话到环保部门投诉。 B
下列句子没有语病的一项是(2分)
A.这家化工厂排出大量废气和噪声,周边居民对此意见很大,纷纷打电话到环保部门投诉。 B.在阅读文学名著过程中,常常能够使我们明白许多做人的道理,悟出世间人生的真谛。 C.真正地亲近自然,融入自然,这样,我们的情感就会更加丰富,我们的生活就会更加美好。 D.是否保持一颗平常心是考试正常发挥的关键。  wangtao791年前1
wangtao791年前1 -
 yg1981 共回答了22个问题
yg1981 共回答了22个问题 |采纳率81.8%C
A中噪声不能排出;B中成分残缺,缺少主语;D中前后不一致“是否”与“是”不能对应。1年前查看全部
- 我市某化工厂从2008年开始节能减排,控制二氧化硫的排放.图③,图④分别是该厂2008-2011年二氧化硫排放量(单位:
我市某化工厂从2008年开始节能减排,控制二氧化硫的排放.图③,图④分别是该厂2008-2011年二氧化硫排放量(单位:吨)的两幅不完整的统计图,根据图中信息回答下列问题. 
(1)该厂2008-2011年二氧化硫排放总量是______吨;这四年平均每年二氧化硫排放量是______吨.
(2)把图中折线图补充完整.
(3)2008年二氧化硫的排放量对应扇形的圆心角是______度,2011年二氧化硫的排放量占这四年排放总量的百分比是______. 蔷薇_紫陌1年前1
蔷薇_紫陌1年前1 -
 Dieu_Grido 共回答了17个问题
Dieu_Grido 共回答了17个问题 |采纳率88.2%(1)∵该厂2009年二氧化硫的排放量20吨,占2008-2011年二氧化硫的排放总量的20%.
∴该厂2008-2011年二氧化硫的排放总量是 20÷20%=100(吨),
∴2010年二氧化硫排放量是100×30%=30(吨),
2011年二氧化硫排放量是100-40-20-30=10(吨),
∴这四年二氧化硫排放量分别是40、20、30、10,
∴这四年二氧化硫排放量的平均数为:100÷4=25(吨),
故答案为:100、25.
(2)正确补全折线图(如图所示),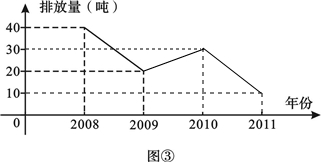 ;
;
(3)∵2008年二氧化硫的排放量是40吨,
∴2008年二氧化硫的排放量对应扇形的圆心角是 360×
40
100 =144°,
∵2011年二氧化硫的排放量是10吨,
∴2011年二氧化硫的排放量占这四年排放总量的百分比是
10
100 ×100%=10%.
故答案为:144、10%.1年前查看全部
- (2009•毕节地区)烧碱是一种重要的化工原料.某化工厂有一袋放置已久的烧碱,化验员对它的有效成份进行检验.取3克该物质
(2009•毕节地区)烧碱是一种重要的化工原料.某化工厂有一袋放置已久的烧碱,化验员对它的有效成份进行检验.取3克该物质与盐酸反应后生成0.9g二氧化碳.该物质中有效成份的质量分数是多少?
 shihuabingshb1年前1
shihuabingshb1年前1 -
 代清春 共回答了13个问题
代清春 共回答了13个问题 |采纳率92.3%解题思路:烧碱变质后的产物为碳酸钠,碳酸钠可以和盐酸反应生成二氧化碳,所可以根据碳酸钠和稀盐酸反应的化学方程式结合生成的二氧化碳的质量可以计算出碳酸钠的质量,进而计算出氢氧化钠的质量.设碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x0.9g
[106/x]=[44/0.9g]
解得:x=2.17g
所以烧碱的质量为3g-2.17g=0.83g
该物质中有效成份的质量分数是[0.83g/3g]×100&=27.7%
答:该物质中有效成份的质量分数是27.7%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查根据化学方程式计算方面的知识,根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量,同时要注意由于氢氧化钠变质过程伴随着潮解和变质的过程,所以在所取的烧碱样品中除了碳酸钠外还有水分,题给的解题过程只是在本题现有的条件下的一个解答.1年前查看全部
- 化工厂要用一种药与水按1:200的比例配制药水8.04升,需要多少药和水?
 lnrbapple1年前1
lnrbapple1年前1 -
 富江鱼 共回答了20个问题
富江鱼 共回答了20个问题 |采纳率90%药和水一共有201份,8.04升,每份就是0.04升
所以水占200X0.04=8升,药占1X0.04=0.04升1年前查看全部
- (1)某化工厂排放的废液中只含有ZnCl2和CuCl2两种溶质,为回收金属Cu并得到ZnCl2固体,化学小组的同学们设计
(1)某化工厂排放的废液中只含有ZnCl2和CuCl2两种溶质,为回收金属Cu并得到ZnCl2固体,化学小组的同学们设计并进行了实验,你认为他们应该向废液中加入(用符号表示)______固体,充分搅拌后过滤,滤液中的物质是______(用化学式表示)
(2)分析比较Na2SO4、(NH4)2SO4、CuSO4在组成、性质等方面的异同,回答下列问题.①Na2SO4、(NH4)2 SO4中含有的相同离子是(用符号表示)______;
②这三种固体能检验水的是(用名称表示)______;
(3)完成下列反应的化学方程式,并回答有关问题.
①实验室制取氢气:______,基本反应类型是______.
②大理石和稀盐酸恰好完全反应:______.
③氯化铵晶体(NH4Cl)和熟石灰混合研磨生成氯化钙和水,同时生成一种氨臭味的气体(NH3)______. 十二月酷暑1年前1
十二月酷暑1年前1 -
 班长扑倒团rr 共回答了17个问题
班长扑倒团rr 共回答了17个问题 |采纳率94.1%解题思路:(1)根据在金属活动性顺序中只有前面的金属才可以和排在它后面的金属从盐溶液中置换出来,再结合题意分析加入的金属等;
(2)①比较物质的构成,找出相同离子,写出符号;
②根据白色的无水硫酸铜能与水反应,生成蓝色的硫酸铜晶体分析;
(3)根据制取气体的原理,写出反应的方程式并判断有关的反应类型.(1)由金属活动性顺序表可知,锌的活动性比铜强,所以回收金属Cu可以加入Zn将铜先置换出来,同时生成ZnCl2;
(2)①Na2SO4、(NH4)2 SO4中含有的相同离子是SO42-;
②由于白色的无水硫酸铜能与水反应,生成蓝色的硫酸铜晶体.所以,能检验水的是无水硫酸铜;
(3)①实验室常用锌和稀硫酸反应制取制取氢气,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑,该反应由一种单质和化合物反应,生成了另一种单质和化合物,属于置换反应;
②大理石和稀盐酸恰好完全反应生了氯化钙、水和二氧化碳,反应的方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③氯化铵晶体(NH4Cl)和熟石灰混合研磨生成氯化钙和水,同时生成一种氨臭味的气体(NH3),反应的方程式是:2NH4Cl+Ca(OH)2=CaCl2+2 NH3↑+2H2O.
故答为:(1)Zn,ZnCl2; (2)SO42-,无水硫酸铜;(3)①Zn+H2SO4=ZnSO4+H2↑;②CaCO3+2HCl=CaCl2+H2O+CO2↑;③.2NH4Cl+Ca(OH)2=CaCl2+2 NH3↑+2 H2O.点评:
本题考点: 金属活动性顺序及其应用;化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 该题主要是回收金属和化学方程式的书写.化学方程式重要的化学用语,应加强化学方程式的书写.1年前查看全部
- 用浓硫酸吸收SO3可得发烟硫酸(H2SO4•SO3).某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)
用浓硫酸吸收SO3可得发烟硫酸(H2SO4•SO3).某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)______m3(保留2位小数).
 快乐绅士55881年前1
快乐绅士55881年前1 -
 zhupolong 共回答了18个问题
zhupolong 共回答了18个问题 |采纳率77.8%解题思路:先根据浓硫酸的体积、质量分数、密度计算出含有的硫酸、水的物质的量,从而计算出发烟硫酸的物质的量,然后设与水混合后的硫酸溶液的体积为VmL,根据稀释过程中硫酸的质量不变计算出V,再将计算结果转换成单位为m3的硫酸体积即可.1.5m3 98.3%的浓硫酸(密度为1.84g/mL)中含有硫酸的质量为:m(H2SO4)=1.5×106mL×1.84g/mL×98.3%≈2.713×106g,硫酸的物质的量为:
2.713×106g
98g/mol≈2.769×104mol,
1.5m3 98.3%的浓硫酸(密度为1.84g/mL)中含有水的质量为:1.5×106mL×1.84g/mL×(1-98.3%)=4.692×104g,水的物质的量为:
4.692×104g
18g/mol≈2.607×103mol,水与三氧化硫反应生成硫酸的物质的量等于水的物质的量,
所以用水吸收后形成发烟硫酸的物质的量为:2.769×104mol+2.607×103mol=3.0297×104mol,
用水稀释后的溶液中含有硫酸的物质的量为:2×3.0297×104mol=6.0294×104mol,
设稀释后溶液的体积为VmL,则:VmL×1.79g/mL×95%=6.0294×105mol×98g/mol,
解得:V≈3.49×106mL=3.49m3,
故答案为:3.49.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了有关物质的量的计算,题目难度中等,注意掌握浓硫酸的水能够与三氧化硫反应生成硫酸,计算发烟硫酸的物质的量时不能漏掉浓硫酸与水反应生成的硫酸的物质的量.1年前查看全部
- 某化工厂采用新技术后,每天用原料14吨.这样,原来7天用的原料,现在可以用10天.这个厂现在比过去每天节约多少吨原料?(
某化工厂采用新技术后,每天用原料14吨.这样,原来7天用的原料,现在可以用10天.这个厂现在比过去每天节约多少吨原料?( )
A. 14×7÷10-14
B. 14×10÷7-14
C. 14-14×10÷7
D. 14-14×7÷10 kaiting1年前1
kaiting1年前1 -
 zilili2001 共回答了15个问题
zilili2001 共回答了15个问题 |采纳率100%解题思路:采用新技术后,每天用原料14吨,则10天共要用14×10吨,现在10天的原来用7天,则原来每天用14×10÷7吨,所以现在比过去每天节约14×10÷7-14吨.根据题意列式为:14×10÷7-14.
故选:B.点评:
本题考点: 整数、小数复合应用题.
考点点评: 首先根据乘法与除法的意义求出原来每天用的吨数是完成本题的关键.1年前查看全部
- 某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe 3+ .Ba 2+ .Na + .OH - .C
某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe 3+ .Ba 2+ .Na + .OH - .Cl - .CO 3 2- .SO 4 2- 为了进一步确认,进行实验检测:
(1)取污水仔细观察,呈无色、透明、均一状态。
(2)向取出的污水中滴加稀硫酸有大量白色沉淀产生,再滴加稀硝酸白色沉淀不消失。
(3)用 pH试纸测定污水的pH 为11。
由此可知,该污水中肯定含有的离子是________________,肯定没有的离子是_______________,可能含有的离子是_______________。 wmc19941年前1
wmc19941年前1 -
 kingwjx 共回答了24个问题
kingwjx 共回答了24个问题 |采纳率79.2%Ba 2+ .OH - Fe 3+ .CO 3 2- .SO 4 2- Na + .Cl -1年前查看全部
- 小红、小华、小军等几位同学为一家化工厂的污水设计排污方案.请你参与他们的探究过程并回答有关问题.
小红、小华、小军等几位同学为一家化工厂的污水设计排污方案.请你参与他们的探究过程并回答有关问题.
首先用pH试纸检测污水的酸碱性.三位同学分别进行如下实验:
小红:取pH试纸于玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
小华:取pH试纸于玻璃片上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
小军:取pH试纸直接浸入待测液中,测得pH<7.
以上三位同学中操作规范的是______. 小河一条1年前1
小河一条1年前1 -
 aliuzhibin 共回答了23个问题
aliuzhibin 共回答了23个问题 |采纳率95.7%解题思路:根据PH值的正确测定方法来考虑,否则测得的结果会产生误差;根据pH和溶液酸碱性的关系分析;测PH值的正确测定方法是:取pH试纸放在玻璃片上,用玻璃棒蘸取待测溶液沾在pH试纸上,将试纸显示的颜色与标准比色卡比较,即可得到PH值,所以小华同学、小军同学操作都是错误的,用蒸馏水将pH试纸润湿再测该酸性溶液PH值,结果会偏大;将pH试纸直接浸入溶液中会污染试剂;测得废水的pH<7,说明显酸性;
答案:小红点评:
本题考点: 溶液的酸碱度测定.
考点点评: 测PH值的正确测定方法是:取pH试纸放在玻璃片上,用玻璃棒蘸取待测溶液沾在pH试纸上,将试纸显示的颜色与标准比色卡比较,即可得到PH值,所以乙同学、丙同学操作都是错误的,用蒸馏水将pH试纸润湿再测该酸性溶液PH值,结果会偏大;将pH试纸直接浸入溶液中会污染试剂;测得废水的pH<7,说明显酸性;1年前查看全部
- (2010•平谷区二模)某化工厂发生硫酸泄漏事故.为减少污染,可向事故现场喷洒( )
(2010•平谷区二模)某化工厂发生硫酸泄漏事故.为减少污染,可向事故现场喷洒( )
A.食盐
B.干冰
C.熟石灰
D.硫酸铜 水蓝雁1年前1
水蓝雁1年前1 -
 minjianyiyao 共回答了14个问题
minjianyiyao 共回答了14个问题 |采纳率78.6%解题思路:A、食盐不和硫酸反应,无法减少硫酸污染,还造成人为浪费.
B、干冰是固态的二氧化碳,二氧化碳不与硫酸反应,亦无法减少硫酸污染.
C、熟石灰是一种常见的碱能与硫酸发生中和反应生成硫酸钙和水,可减少硫酸的污染.
D、硫酸铜与硫酸不反应,无法减少硫酸污染.A、食盐不和硫酸反应,无法减少硫酸污染,还造成人为浪费.因此答案不能选 A;
B、干冰是固态的二氧化碳,二氧化碳不与硫酸反应,亦无法减少硫酸污染.因此答案不能选 B;
C、熟石灰是一种常见的碱能与硫酸发生中和反应生成硫酸钙和水,可减少硫酸的污染.因此答案能选 C;
D、硫酸铜与硫酸不反应,无法减少硫酸污染.因此答案不能选 D.
故选:C点评:
本题考点: 酸的化学性质.
考点点评: 考查酸分别与氧化物、碱、盐的反应关系,建议学生掌握好复分解反应的条件,并能熟练应用,还要把握好氧化物与酸碱的反应情况.1年前查看全部
- 某化工厂采用新技术后,每天用原料14吨.这样,原来7天用的原料,现在可以用10天.这个厂现在比过去每天节约多少吨原料?(
某化工厂采用新技术后,每天用原料14吨.这样,原来7天用的原料,现在可以用10天.这个厂现在比过去每天节约多少吨原料?( )
A. 14×7÷10-14
B. 14×10÷7-14
C. 14-14×10÷7
D. 14-14×7÷10 luocaiyu1年前1
luocaiyu1年前1 -
 wilsonfu 共回答了27个问题
wilsonfu 共回答了27个问题 |采纳率88.9%解题思路:采用新技术后,每天用原料14吨,则10天共要用14×10吨,现在10天的原来用7天,则原来每天用14×10÷7吨,所以现在比过去每天节约14×10÷7-14吨.根据题意列式为:14×10÷7-14.
故选:B.点评:
本题考点: 整数、小数复合应用题.
考点点评: 首先根据乘法与除法的意义求出原来每天用的吨数是完成本题的关键.1年前查看全部
- 某化工厂产生的废水中含有的一定浓度的重金属离子,处理此废水可采用什么方法?(cr3+离子 中和
某化工厂产生的废水中含有的一定浓度的重金属离子,处理此废水可采用什么方法?(cr3+离子 中和
某化工厂产生的废水中含有的一定浓度的重金属离子,处理此废水可采用什么方法?(cr3+离子 中和 沉淀还是氧化还原) 燕子A东东1年前1
燕子A东东1年前1 -
 ieutye 共回答了17个问题
ieutye 共回答了17个问题 |采纳率88.2%沉淀1年前查看全部
- 甲和乙两个相邻的化工厂,排放的污水中含有以下八种离子中各不相同
甲和乙两个相邻的化工厂,排放的污水中含有以下八种离子中各不相同
的四种,Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-,若单独排放会污
染环境,如果将甲乙两厂的污水按适当比例充分混合,经沉淀后排放出
的污水转变为无色且澄清的硝酸钠溶液,污染程度大为降低,又经测得
甲厂污水PH值大于7;
推断 甲厂污水中含有的4种离子
乙厂污水中含有的4种离子
我要的是思路
wen 答案是不是甲厂OH-、NO3-、Ag+、Ba2+ 乙厂是Fe3+、Na+、Cl-、SO42-
快 阿茶奶樽1年前1
阿茶奶樽1年前1 -
 jayki 共回答了20个问题
jayki 共回答了20个问题 |采纳率95%甲厂污水PH值大于7,显碱性,所以含OH-,不含能和OH-反应的Ag+、Fe3+(这两种离子在乙厂),由于Cl-、SO42-要和Ag+反应,所以只能在甲厂,Ba2+要和SO42-反应,所以在乙厂,甲厂不可能都是阴离子,所以还有Na+,同理乙厂还有NO3-.
甲厂OH-、Cl-、SO42- 、 Na+、 乙厂是Fe3+、NO3-、Ag+、Ba2+1年前查看全部
- 初中化学题,要分解,快某化工厂原来用氢氧化钠溶液中和所排废水中的硫酸,现改用氢氧化钾溶液中和以得到钾肥,若氢氧化钾溶液的
初中化学题,要分解,快
某化工厂原来用氢氧化钠溶液中和所排废水中的硫酸,现改用氢氧化钾溶液中和以得到钾肥,若氢氧化钾溶液的溶质质量分数与原来所用氢氧化钠溶液的溶质质量分数相同,则此时碱流量阀应如何调节
A.无需变动
B.减小流量
C.加大流量
D.无法确定
 pepsljay1年前1
pepsljay1年前1 -
 baihuayuan 共回答了13个问题
baihuayuan 共回答了13个问题 |采纳率92.3%C,相同质量的情况下,氢氧化钾的微粒个数比氢氧化钠少,所以中和等量的硫酸需要质量更多1年前查看全部
- 化工厂排放的酸性污水和乙化工厂排放的污水,共含有以下六种离子中的各三种:K+,OH-,碳酸根离子,Ba2+,H+,NO3
化工厂排放的酸性污水和乙化工厂排放的污水,共含有以下六种离子中的各三种:K+,OH-,碳酸根离子,Ba2+,H+,NO3-.则乙化工厂排放的污水中所含的三种离子是:A K+,OH-,H+ B K+ ,OH- ,碳酸根离子 C Ba2+,OH-,NO3- D OH-,K+,Ba2+ 为什么?
 ma0417_19841年前1
ma0417_19841年前1 -
 差一点为零 共回答了19个问题
差一点为零 共回答了19个问题 |采纳率94.7%甲酸性H在甲,则OH.CO3在乙,然后因为CO3与Ba不共存,所以Ba在甲,又因为甲乙均成电中性,所以No3在甲,K在乙1年前查看全部
- 某化工厂生产的纯碱产品中含有少量氯化钠工厂的化验员对每批产品进行检测标出各种成份后
某化工厂生产的纯碱产品中含有少量氯化钠工厂的化验员对每批产品进行检测标出各种成份后

做不下去了 最多产生二氧化碳怎么看的!没有盐酸浓度怎么求各成分质量! zero-sum1年前1
zero-sum1年前1 -
 鸡排22 共回答了12个问题
鸡排22 共回答了12个问题 |采纳率91.7%200g+147g-329.4g=17.6g
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
x 17.6g
106/x=44/17.6g
x=42.4g
44g样品中含碳酸钠 42.4g 氯化钠 44g-42.4g=1.6g1年前查看全部
- 某化工厂生产了某种化肥,每吨化肥的出厂价为1780元,其成本为900元,但在生产过程中,平均每吨化肥有280立方米的有害
某化工厂生产了某种化肥,每吨化肥的出厂价为1780元,其成本为900元,但在生产过程中,平均每吨化肥有280立方米的有害气体排出,为保护环境,工人需要对有害气体进行处理,现有两种处理方案可供选择:
①若有害气体通过管道送交废气处理厂统一处理,则每立方米需付费3元;
②若自行引进处理设备处理有害气体,则每立方米需原料费0.5元,且设备每月管理、损耗费为28000元. skymili1年前1
skymili1年前1 -
 思维时间 共回答了21个问题
思维时间 共回答了21个问题 |采纳率100%答案:(1)方案①y1=40x;方案②y2=740x-28000;
(2)产量<40吨时,应选方案①;产量=40吨时,两种方案都可选;产量>40吨时,应选方案②1年前查看全部
- 某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数______.
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升______mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
试在坐标系中绘出溶液温度变化与加入盐酸体积之间的变化关系图.加入盐酸的体积(V)/mL 2 4 6 8 10 溶液温度变化(△t)/℃ 5.2 9.6 13.0 16.0 18.2 
(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.______. 沐浴心灵1年前1
沐浴心灵1年前1 -
 xugod 共回答了21个问题
xugod 共回答了21个问题 |采纳率90.5%解题思路:根据反应的化学方程式可以计算稀盐酸的质量分数,溶液稀释前后溶质的质量不变,根据表中数据可以分析、判断实验结论.(1)①设氯化氢的质量为X.
NaOH+HCl═NaCl+H2O
40 36.5
20g×2%X
[40/36.5]=[20g×2%/X]
X=0.365g
稀盐酸的质量分数为:[0.365g/50g]×100%=0.73%
②溶液稀释前后溶质的质量不变,应量取38%的盐酸(密度为1.19g/cm3)的体积为:
[100×1.05×10%/1.19×38%]=23.22(mL)
故答案为:0.73%;23.22;
(2)先根据对应的数值描点,连线即可.作图如下: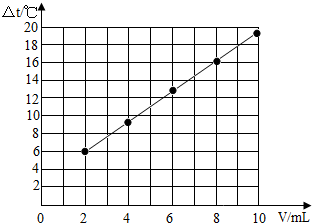
(3)由表中数据可知,随着盐酸和氢氧化钠溶液反应的不断进行,溶液的温度逐渐升高,说明中和反应是放热反应.故填:中和反应是放热反应.点评:
本题考点: 中和反应及其应用;实验数据处理或者误差分析的探究;有关溶质质量分数的简单计算;物质发生化学变化时的能量变化;根据化学反应方程式的计算.
考点点评: 本题主要考查了根据化学方程式进行相关方面的计算及其中和反应是否放热等方面的内容,可以依据已有的知识结合题干提供的数据进行.1年前查看全部
- 初三英语书面表达我的家乡位于山脚下,一条小河从旁边流过.两年前,这里建起一座化工厂,排出大量废气、废水,造成严重污染,影
初三英语书面表达
我的家乡位于山脚下,一条小河从旁边流过.两年前,这里建起一座化工厂,排出大量废气、废水,造成严重污染,影响人们健康.如今政府采取了一系列保护环境、防止污染的措施.我的家乡正变得越来越美.
要求:1.文章必须包括以上主要内容,可以适当增加细节,使内容连贯;2.80词左右 dianzi0611年前1
dianzi0611年前1 -
 童话2046 共回答了22个问题
童话2046 共回答了22个问题 |采纳率72.7%My hometown is located at the foot of the mountain,with a stream running alongside.Two years ago people built a chemical factory here.It produced a lot of waste gases and water,which made serious pollution and do harm to people's health.Luckily,the government has taken a series of measures to protect the environment and prevent pollution now.I am very glad that my hometown is becoming more and more beautiful.1年前查看全部
- 英语作文!假如你是The Greener的记者王威,你发现你家附近的一家化工厂在大量排出废气,污染了空气.请根据下面的提
英语作文!假如你是The Greener的记者王威,你发现你家附近的一家化工厂在大量排出废气,污染了空气.请根据下面的提示,写一封80词左右的书信给这家工厂.我们周围的空气对每个人来说是重要的.没有空气,我们就不能生存.空气在其他方面也很重要.每有空气,就没有声音,也没有火.没有空气就没有风和云.没有空气就没有天气.晚上太冷,白天太热.我们需要大气层(atmosphere)来保护我们免遭太阳光(the sun’s ray)的直接照射.希望这家工厂能尽快解决废气排出问题,为保护空气做出贡献.
 百川纳海1年前1
百川纳海1年前1 -
 mccmovie 共回答了15个问题
mccmovie 共回答了15个问题 |采纳率86.7%自己百度翻译吧..1年前查看全部
- (2003•镇江)酸雨是pH<5.6的降水,我国南方某地区所降酸雨主要是由居民和工厂燃烧含硫的煤以及某些化工厂生产过程中
(2003•镇江)酸雨是pH<5.6的降水,我国南方某地区所降酸雨主要是由居民和工厂燃烧含硫的煤以及某些化工厂生产过程中排放的一种无色有刺激性气味的气体经一系列化学反应而形成,有许多植物如广玉兰、夹竹桃等在它们能忍受的浓度下可以吸收这种有害气体.
(1)你认为该有害气体是二氧化硫二氧化硫.
(2)请写出测定地区雨水的pH操作方法用玻璃棒蘸取雨水,滴在PH试纸上,再与标准比色卡对照用玻璃棒蘸取雨水,滴在PH试纸上,再与标准比色卡对照.
(3)为减少酸雨对该地区环境的危害,请你提出两条合理化建议 减少煤的燃烧,化工厂的尾气处理后再排放. lycyb1年前1
lycyb1年前1 -
 wyw8n6jy 共回答了19个问题
wyw8n6jy 共回答了19个问题 |采纳率94.7%(1)煤燃烧生成二氧化硫等气体,二氧化硫是形成酸雨的主要气体.故填:二氧化硫.
(2)用玻璃棒蘸取雨水,滴在pH试纸上,再与标准比色卡对照.
(3)减少煤的燃烧,化工厂的尾气处理后再排放.1年前查看全部
- 1.球的体积公式为V=4/3πR³.若某化工厂的球罐要储存5500立方米的化工原料,则球罐直径至少是多少米?
1.球的体积公式为V=4/3πR³.若某化工厂的球罐要储存5500立方米的化工原料,则球罐直径至少是多少米?
2.若-三次根号2x+4与三次根号3x+2互为相反数,求三次根号3x+2的平方根 broer21年前1
broer21年前1 -
 AntonyloveJackie 共回答了20个问题
AntonyloveJackie 共回答了20个问题 |采纳率95%1、有公式得到:5500=4/3πR³ 所以R=5√33∏
2、由题意得2x+4=3x+2,所以得x=2,所以3x+2=8
因此3x+2的平方根等于2√21年前查看全部
- 作文一家化工厂偷排污水导致从些水厂水源被分类物质污染请你根据对材料的理解
 wxinmeng1年前1
wxinmeng1年前1 -
 zhoukou01 共回答了18个问题
zhoukou01 共回答了18个问题 |采纳率94.4%如果体裁不限的活,可以写成像纪录片一样,刚看了柴静有关雾霾的纪录片,挺不错,在腾讯视频中可以搜到,希望对你有帮助1年前查看全部
- 如图所示,河岸边分布甲、乙、丙、丁四座化工厂,环保人员为监测水质来到河边,观察到如下现象:b处出现红褐色浑浊,c处河水由
如图所示,河岸边分布甲、乙、丙、丁四座化工厂,环保人员为监测水质来到河边,观察到如下现象:b处出现红褐色浑浊,c处河水由浑浊变澄清,d处河水冒气泡.测得a处水样pH=12,M处水样pH=5.已知两个化工厂排放的废液中含下列物质中的各一种:Na2CO3、FeCl3、HCl和Ba(OH)2.请你帮助环保人员推断,丙厂排放的是______,丁厂排放的是______,M处一定不含有的阴离子是______.

请写出:
b处生成沉淀的化学方程式______
c处河水由浑浊变澄清的化学方程式______. 无风亦有浪1年前1
无风亦有浪1年前1 -
 颜料 共回答了22个问题
颜料 共回答了22个问题 |采纳率95.5%解题思路:根据a处水样pH=12,说明a处存在大量的氢氧根离子,甲厂的废水中含有氢氧化钡;在乙处会出现出现红褐色浑浊,说明生成了氢氧化铁沉淀,乙厂的废水中含有氯化铁,c处河水由浑浊变澄清,说明丙厂的废水中含有盐酸,d处河水冒气泡,说明丁厂的废水中含有碳酸钠,M处水样pH=5,存在大量的氢离子,就不会存在氢氧根离子和碳酸根离子;
根据推导出的物质书写方程式.a处水样pH=12,说明a处存在大量的氢氧根离子,甲厂的废水中含有氢氧化钡;在乙处会出现出现红褐色浑浊,说明生成了氢氧化铁沉淀,乙厂的废水中含有氯化铁,c处河水由浑浊变澄清,说明丙厂的废水中含有盐酸,d处河水冒气泡,说明丁厂的废水中含有碳酸钠,M处水样pH=5,存在大量的氢离子,就不会存在氢氧根离子和碳酸根离子;
氢氧化钡和氯化铁生成氢氧化铁沉淀和氯化钡;
氢氧化铁和盐酸反应生成氯化铁和水;
故答案为:HCl,Na2CO3,OH-和CO3 2-
3Ba(OH)2+2FeCl3=2Fe(OH)3↓+3BaCl2
Fe(OH)3+3HCl=FeCl3+3H2O点评:
本题考点: 离子或物质的共存问题;水资源的污染与防治;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析各处的现象,然后结合离子之间的共存问题进行分析.1年前查看全部
- 排列组合:某化工厂生产中需依次投放2种化工原料,现已知有5种原料可用,但甲乙两种原料
排列组合:某化工厂生产中需依次投放2种化工原料,现已知有5种原料可用,但甲乙两种原料
某化工厂生产中需依次投放2种化工原料,现已知有5种原料可用,但甲乙两种原料不能同时使用,且依次投料时,若使用甲原料,则甲必须先投放,则不同投放方法是? happybebe1年前1
happybebe1年前1 -
 飘渺峰上 共回答了18个问题
飘渺峰上 共回答了18个问题 |采纳率88.9%这里甲属于特殊个体那么就把甲单独列出来
(1)有甲原料 那么甲必须第一个放 还不能有已 只有3种
(2)没有甲原料 剩下的四种没什么要求 就是A 4 2 知道怎么写吧 A右下角4 右上角2
4*3=12 3+12=15
即 15种1年前查看全部
- 在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾.该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵.向该复盐的浓
在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾.该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液.将发生一系列变化.已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A102-+H2O=Al(0H)3↓+NH3↑试回答:
(1)硫酸铝铵在水溶液中的电离方程式为______;
(2)在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀逐渐减少.请回答各种现象由先到后出现的顺序是(用序号回答):______;
(3)写出滴入氢氧化钠溶液的过程中,有关反应的离子方程式:
①______;
②______;
③______. aqzl9111年前1
aqzl9111年前1 -
 地球人爱地球 共回答了20个问题
地球人爱地球 共回答了20个问题 |采纳率85%解题思路:(1)硫酸铝铵在水溶液中完全电离出铝离子、铵根离子、硫酸根离子;
(2)铵根和铝离子在溶液中共存时,铝离子先和氢氧根离子生成沉淀,然后是铵根离子和碱的反应,接下来是氢氧化铝和氢氧根离子的反应,根据铵根离子、铝离子、偏铝酸根和氢氧根之间的反应的离子方程式确定离子的量的多少;
(3)根据物质的性质以及离子方程式的书写进行解答.(1)硫酸铝铵为类似于明矾的复盐,在水溶液中完全电离出NH4+、A13+、SO42-,电离方程式为:NH4Al(SO4)2=NH4++Al3++2SO42-,
故答案为:NH4Al(SO4)2=NH4++Al3++2SO42-;
(2)加入NaOH溶液,OH-能与NH4+和A13+作用,但由于 A13++3NH3•H2O=A1(OH)3↓+3NH4+,
即碱性NaOH>NH3•H2O>Al(OH)3,则先发生反应的是Al3+与OH-,最后 Al(OH)3逐渐溶解生成A1O2-故反应的顺序是:①③②⑤④,
故答案为:①③②⑤④;
(3)先发生反应的是Al3+与OH-,然后是NH4+、OH-之间的反应,最后 Al(OH)3逐渐溶解生成A1O2-,
即①Al3++3OH-=Al(OH)3↓②NH4++OH-=NH3↑+H2O③Al(OH)3+OH-=A1O2-+2H2O,
故答案为:①Al3++3OH-=Al(OH)3↓;②NH4++OH-=NH3↑+H2O;③Al(OH)3+OH-=A1O2-+2H2O.点评:
本题考点: 离子方程式的书写;镁、铝的重要化合物.
考点点评: 本题考查了铝的重要化合物性质、电离方程式、离子方程式的书写,题目难度中等,注意掌握常见元素单质及其化合物性质,明确离子方程式、电离方程式的书写原则.1年前查看全部
- 该城市常年主导风向为东北风,为减少化工厂对城市的污染,该厂应建在城市的哪个方向
 内斯塔abc1年前1
内斯塔abc1年前1 -
 月下青竹 共回答了10个问题
月下青竹 共回答了10个问题 |采纳率90%主导风的下风向.1年前查看全部
- 填空,判断1.化工厂10份用电量比9月份节约16分之1,10月份用电量是9月份的()2.一根绳子剪去4分之3还剩4分之3
填空,判断
1.化工厂10份用电量比9月份节约16分之1,10月份用电量是9月份的()
2.一根绳子剪去4分之3还剩4分之3米,这根绳子剪去了()米
3.把一根不帮锯成同样长的小段,7次锯完,每小段占这根木棒的()分之()
4.一件工作,甲单独做15天完成,乙单独做12天完成.两人合作4天可以完成这项工作的()分之()
5.林场柳树16800棵,松树是柳树的10分之9,两种树共有几棵?正确算式是()
6.一条公路修了全长的4分之1,离中点还有40千米,(这个不是重点,是中间的那个点),这条路全长多少米?正确算式是()
判断
1.汽车速度比火车速度慢3分之1,也就是说,火车速度比汽车快3分之1.()
2.一台洗衣机先提价6分之1后,再降价6分之1出售,现价和原价相同.()
3.一条公路3千米,一修完3分之1,还剩下3分之2千米.()
应用题
1.电冰箱厂男职工与女职工人数比是5:4,已知该厂共有职工198人,这个厂有男、女职工各几人?
2一个长方体的周长是28米,长与宽的比是4:3,这个长方形的面积是多少平方米? 亦星1年前1
亦星1年前1 -
 cc小青菜 共回答了21个问题
cc小青菜 共回答了21个问题 |采纳率100%1.化工厂10份用电量比9月份节约16分之1,10月份用电量是9月份的(15 /16)
2.一根绳子剪去4分之3还剩4分之3米,这根绳子剪去了(3)米
3.把一根不帮锯成同样长的小段,7次锯完,每小段占这根木棒的(8)分之(1)
4.一件工作,甲单独做15天完成,乙单独做12天完成.两人合作4天可以完成这项工作的(5)分之(3)
5.林场柳树16800棵,松树是柳树的10分之9,两种树共有几棵?正确算式是(16800*(1+9/10)或者16800+16800*9/10)
6.一条公路修了全长的4分之1,离中点还有40千米,(这个不是重点,是中间的那个点),这条路全长多少米?正确算式是(40除于(1/2-1/4))
判断
1.汽车速度比火车速度慢3分之1,也就是说,火车速度比汽车快3分之1.(错)
2.一台洗衣机先提价6分之1后,再降价6分之1出售,现价和原价相同.(错)
3.一条公路3千米,一修完3分之1,还剩下3分之2千米.(错)
应用题
1.电冰箱厂男职工与女职工人数比是5:4,已知该厂共有职工198人,这个厂有男、女职工各几人?
设男职工为x人,得5:4=x:198-x
4x=5*198-5x
9x=5*198
x=5*198/9
x=110人
198-110=88人(女)
2一个长方体的周长是28米,长与宽的比是4:3,这个长方形的面积是多少平方米?
设长为x米,得:4:3=x:(28/2-x)解得x=8,28/2-8=6
8*6=48平方米
另一种方法:28/2=14米(长加宽的和)
4+3=7份(把长加宽的和分成7份,长占4份,宽占3份)
14*4/7=8米(长)14*3/7=6米(宽)
8*6=48平方米1年前查看全部
- (2008•杭州)某化工厂排出的废水中含有硝酸银,硝酸钡,为了不污染环境并充分利用资源,需要从废水中回收金属银并制得碳酸
(2008•杭州)某化工厂排出的废水中含有硝酸银,硝酸钡,为了不污染环境并充分利用资源,需要从废水中回收金属银并制得碳酸钡,操作步骤和实验结果如下表,请填出表中未完成部分(写化学式)
操作步骤 实验结果 (1)向废水中加入适量______后过滤 分离出滤液A和滤出物______ (2)向滤液A中加入______溶液后过滤 滤出物是蓝色沉淀,滤液B中只含一种溶质 (3)向滤液B中加入______溶液后过滤 得到碳酸钡晶体  xiaonn8208211年前1
xiaonn8208211年前1 -
 oo是Id 共回答了12个问题
oo是Id 共回答了12个问题 |采纳率83.3%解题思路:根据题意:要从废水中回收金属银,可向废水中加入适量的排在银前的金属,由(2)滤出物是蓝色沉淀,说明该沉淀是氢氧化铜,可知(1)中加入的金属是铜,与硝酸银反应生成硝酸铜和银;(2)向滤液A中加入溶液过滤得到氢氧化铜沉淀,说明加入的是一种碱,又滤液B中只含一种溶质,说明该碱溶液与硝酸铜反应生成氢氧化铜和硝酸钡,据复分解反应原理可知加入的是氢氧化钡溶液;硝酸钡溶液可与碳酸钠、碳酸钾溶液反应生成碳酸钡沉淀.要从废水中回收金属银,可向废水中加入适量的排在银前的金属,由(2)滤出物是蓝色沉淀,说明该沉淀是氢氧化铜,由此说明(1)中加入的金属是铜,与硝酸银反应生成硝酸铜和银;(2)向滤液A中加入溶液过滤得到氢氧化...
点评:
本题考点: 金属的化学性质;盐的化学性质.
考点点评: 了解顺序表中前面的金属可将后面的金属从其盐溶液中置换出来,氢氧化铜是蓝色沉淀,及复分解反应的原理,才能结合题意正确分析解答,本题能很好考查学生依据所学分析、解决问题的能力.1年前查看全部
- 某化工厂排放的废水中只含有盐酸和MgCl2两种物质.小明同学向采集来的62.8g废水样品中,慢慢加入20%的NaOH溶液
某化工厂排放的废水中只含有盐酸和MgCl2两种物质.小明同学向采集来的62.8g废水样品中,慢慢加入20%的NaOH溶液至恰好完全反应时,消耗NaOH溶液60g.将生成的沉淀物过滤出,经水洗、干燥后称重为5.8g.
(1)写出向废水中加入NaOH溶液发生反应的化学方程式:______;
(2)请求出上述废水样品完全反应后的溶液里溶质的质量分数(要有计算过程)
【相对分子质量:MgCl2-95、NaOH-40、HCl-36.5、NaCl-58.5、Mg(OH)2-58、H2O-18.】 hyf1987101年前1
hyf1987101年前1 -
 弹散 共回答了14个问题
弹散 共回答了14个问题 |采纳率100%解题思路:废水中的盐酸和MgCl2两种物质都可与加入的氢氧化钠溶液发生反应,盐酸与氢氧化钠发生中和反应,生成氯化钠和水,而只有MgCl2与氢氧化钠溶液反应生成氢氧化镁沉淀,同时生成氯化钠;因此恰好完全反应时所得溶液为氯化钠溶液,其中溶质氯化钠质量为两个反应生成氯化钠的质量和,利用质量守恒计算出所得溶液的质量,最后使用溶液中溶质质量分数公式,计算废水样品完全反应后的溶液里溶质的质量分数.(1)废水中盐酸与氢氧化钠可以发生中和反应,方程式为HCl+NaOH═NaCl+H2O;氯化镁与氢氧化钠发生复分解反应,方程式为MgCl2+2NaOH═2NaCl+Mg(OH)2↓;
故答案为:HCl+NaOH═NaCl+H2O,MgCl2+2NaOH═2NaCl+Mg(OH)2↓;
(2)设生成5.8g沉淀氢氧化镁沉淀时,消耗氢氧化钠溶液的质量为x,生成氯化钠的质量为y
MgCl2+2NaOH═2NaCl+Mg(OH)2↓
80 117 58
x×20% y5.8g
[80/x×20%]=[58/5.8g] x=40g
[117/y]=[58/5.8g] y=11.7g
则与盐酸反应的氢氧化钠溶液的质量=60g-40g=20g,设生成氯化钠的质量为z
HCl+NaOH═NaCl+H2O
4058.5
20g×20% z
[40/20g×20%]=[58.5/z] z=5.85g
废水样品完全反应后的溶液里溶质的质量分数=[11.7g+5.85g/62.8g+60g−5.8g]×100%=15%
答:废水样品完全反应后的溶液里溶质的质量分数为15%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据质量守恒定律,废水样品完全反应后的溶液里溶质的质量=所取废水的质量+所加入氢氧化钠溶液的质量-生成沉淀的质量.1年前查看全部
- 读下图,完成1—2题。 1、下列工厂布局比较合理是 [ ] A、①啤酒厂 ②钢铁厂 ③印刷厂 ④化工厂 B、①钢
读下图,完成1—2题。
1、下列工厂布局比较合理是 [ ]A、①啤酒厂 ②钢铁厂 ③印刷厂 ④化工厂
B、①钢铁厂 ③啤酒厂 ④化工厂 ⑤水果罐头厂
C、③水果罐头厂 ④钢铁厂 ⑥印刷厂 ⑦啤酒厂
D、①印刷厂 ②化工厂 ⑥电子软件厂 ⑦啤酒厂2、该城市对外交通的说法正确的是 [ ]A、过境公路穿过城市中心区域,有利于市民出行
B、铁路经过城市外围,避免进入市区产生干扰
C、铁路货运线路绕过城市外围,客运线应经过市中心
D、过境客运公路应经过市中心,货运公路绕过城市外围 caly61年前1
caly61年前1 -
 wangxile 共回答了16个问题
wangxile 共回答了16个问题 |采纳率100%1、B
2、B1年前查看全部
- (2006•长沙)我市捞刀河某化工厂发生硫酸泄漏事件.为了减少硫酸对环境的污染,有关部门采取了紧急措施,在泄漏的硫酸上面
(2006•长沙)我市捞刀河某化工厂发生硫酸泄漏事件.为了减少硫酸对环境的污染,有关部门采取了紧急措施,在泄漏的硫酸上面喷洒了一种化学试剂,你认为这种试剂是( )
A.熟石灰
B.硫酸铜
C.食盐
D.干冰 白云深处31年前1
白云深处31年前1 -
 summer1111 共回答了18个问题
summer1111 共回答了18个问题 |采纳率100%解题思路:已知硫酸为酸,而为了减少硫酸对环境的污染,则用碱进行中和硫酸,而使用廉价易得的碱为氢氧化钙.为了减少硫酸对环境的污染,应喷洒碱性物质,而使用廉价易得的碱为氢氧化钙,利用酸碱中和减少污染.
故选A.点评:
本题考点: 中和反应及其应用.
考点点评: 通过中和反应在实际生产中的应用,培养学生联系实际生活实践的能力;通过中和反应和在生活的应用的学习,强化学生学已致用的意识和热爱化学的情感.1年前查看全部
- 海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性.请写出加入盐酸后发生反应的离子方程式______.2−4
(2)海水里的镁元素处于______(游离、化合)态,从海水中提取氯化镁的反应______(“是”或“不是”)氧化还原反应,理由______.
(3)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液里加入石灰乳的作用是______.
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却______
A.H2 B.CO2C.空气D.O2. 祈愿鸟1年前1
祈愿鸟1年前1 -
 我爱柠檬1979 共回答了14个问题
我爱柠檬1979 共回答了14个问题 |采纳率100%解题思路:(1)依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,硫酸根离子、镁离子,钙离子和钡离子均转化为沉淀,过滤后加盐酸,与NaOH、Na2CO3溶液反应;
(2)海水里的镁元素以化合物存在,从海水中提取氯化镁,向海水中加氢氧化钙、然后加盐酸;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应;
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化.(1)依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,硫酸根离子、镁离子,钙离子和钡离子均转化为沉淀,过滤后加盐酸,与NaOH、Na2CO3溶液反应,反应的离子反应分别为OH-+H+═H2O、CO32-+2H+═H2O+CO2↑,故答案为:OH-+H+═H2O、CO32-+2H+═H2O+CO2↑;
(2)海水里的镁元素以化合态存在,从海水中提取氯化镁,向海水中加氢氧化钙、然后加盐酸,均为复分解反应,没有元素的化合价变化,则不是氧化还原反应,
故答案为:化合;不是;因为没有发生化合价变化;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,将Mg2+沉淀为Mg(OH)2,故答案为:将Mg2+沉淀为Mg(OH)2;
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化,B、C、D都能使Mg再被氧化,则A中氢气可防止镁被氧化,故答案为:A.点评:
本题考点: 离子方程式的书写;氧化还原反应;电解原理;海水资源及其综合利用.
考点点评: 本题考查较综合,涉及离子反应、粗盐提纯、金属的冶炼等,为高考常见题型,把握发生的化学反应为解答的关键,注意离子反应与氧化还原反应的分析,题目难度不大.1年前查看全部
- (2005•朝阳区二模)一个地处海边的化工厂按如下步骤进行生产,(1)以煤为燃料煅烧石灰石,(2)用加压降温的方法使产生
(2005•朝阳区二模)一个地处海边的化工厂按如下步骤进行生产,(1)以煤为燃料煅烧石灰石,(2)用加压降温的方法使产生的CO2气体变成雪状的固体,(3)将得到的生石灰与水反应,(4)将海水引入水池中,加入熟石灰,使熟石灰与海水中所含氯化镁发生反应,(5)用盐酸溶解氢氧化镁,再将所得溶液浓缩,得到一种晶体.
(1)该厂用于生产的原料是______.
(2)该厂生产的产品是______.
(3)该厂生产过程中,涉及到的化学反应方程式有:CaCO3
CaO+CO2↑;CaO+H2O=Ca(OH)2 ;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2=MgCl2+2H2O.高温 .CaCO3.
CaO+CO2↑;CaO+H2O=Ca(OH)2 ;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2=MgCl2+2H2O.高温 . 69051年前0
69051年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 2005年1月1日起,各地环保部门将对实验室类污染实施严格的环境监管.某校实验室里有50kg氢氧化钠废液,该校用某化工厂
2005年1月1日起,各地环保部门将对实验室类污染实施严格的环境监管.某校实验室里有50kg氢氧化钠废液,该校用某化工厂废弃的稀硫酸来中和后排放.当测得溶液pH=7时,中和后溶液的总质量为100kg,测得反应后的溶液中溶质的质量分数为7.1%,求:
(1)反应生成的硫酸钠的质量是多少?
(2)所用的稀硫酸中溶质的质量分数为多少?
(3)该校实验室的氢氧化钠废液中溶质的质量分数是多少? 芙蓉影1年前1
芙蓉影1年前1 -
 永恒一日 共回答了18个问题
永恒一日 共回答了18个问题 |采纳率88.9%(1)100kg×7.1%=7.1kg;
(2)设参与反应的H 2 SO 4 的质量为x,参与反应的NaOH的质量为y,
2NaOH+H 2 SO 4 =Na 2 SO 4 +2H 2 O
8098 142
y x 7.1kg
∴98:142=x:7.1kg,80:142=y:7.1kg,
解之得:x=4.9kg,y=4kg,
4.9kg
100kg-50kg ×100% =9.8%;
(3)
4kg
50kg × 100% =8%.
答:(1)反应生成的硫酸钠的质量是7.1kg;
(2)所用的稀硫酸中溶质的质量分数为9.8%;
(3)该校实验室的氢氧化钠废液中溶质的质量分数是8%.1年前查看全部
- 二次函数题,写好有赏!某化工厂一月份生产某种产品200t,三月份生产yt,则y与月平均增长率x的关系是_________
二次函数题,写好有赏!
某化工厂一月份生产某种产品200t,三月份生产yt,则y与月平均增长率x的关系是____________. lnvnc1年前1
lnvnc1年前1 -
 夫妻在线 共回答了28个问题
夫妻在线 共回答了28个问题 |采纳率92.9%y=200﹙1+x﹚²1年前查看全部
- 某化工厂排放的废液中含有大量的硫酸锌和硫酸铜,化学兴趣小组的同学根据所学知识设计了一个方案,用来回收金属铜并得到硫酸锌晶
某化工厂排放的废液中含有大量的硫酸锌和硫酸铜,化学兴趣小组的同学根据所学知识设计了一个方案,用来回收金属铜并得到硫酸锌晶体,主要过程如图所示:

请回答下列问题:
(1)步骤②中分离物质的方法是______.
(2)固体A的成分是______.
(3)步骤②中发生反应的化学方程式为______,
(4)步骤③中加入的B物质是______. 老汤1年前1
老汤1年前1 -
 lclclc20909 共回答了15个问题
lclclc20909 共回答了15个问题 |采纳率80%解题思路:一般的除杂质题必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.根据题目给出的流程图和信息:固体与液体分开的方法叫过滤;硫酸锌和硫酸铜的混合液中加入过量的锌粉,锌与硫酸铜反应生成硫酸锌和铜,过滤后固体A是铜和锌的混合物,滤液是硫酸锌溶液;铜和锌的混合物中加入适量的稀硫酸,铜不反应,锌与硫酸反应生成硫酸锌和氢气,过滤得到铜,滤液是硫酸锌;然后把硫酸锌溶液蒸发结晶得到硫酸锌晶体.(1)固体与液体分开的方法叫过滤,故答案为:过滤
(2)硫酸锌和硫酸铜的混合液中加入过量的锌粉,锌与硫酸铜反应生成硫酸锌和铜,过滤后固体A是铜和锌的混合物,滤液是硫酸锌溶液;故答案为:锌和铜
(3)锌与硫酸铜反应生成硫酸锌和铜,故答案为:Zn+CuSO4═Cu+ZnSO4
(4)铜和锌的混合物中加入适量的稀硫酸,铜不反应,锌与硫酸反应生成硫酸锌和氢气,过滤得到铜,滤液是硫酸锌;故答案为:稀硫酸点评:
本题考点: 物质除杂或净化的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于物质的除杂或净化的探究,还考查了化学方程式的书写,是中考的一个难点,也是学生经常出错的题型.根据物质的溶解性和除杂质的条件,要认真分析,综合把握.还要加强记忆除去常用离子的方法和物质的溶解性,从而突破难点,本考点经常出现在填空题和实验题中.1年前查看全部
- 下列过程不会造成空气污染的是( ) A.石油化工厂排放出的废气 B.氢气燃烧生成水 C.煤燃烧生成二氧化碳、二氧化硫等
下列过程不会造成空气污染的是( ) A.石油化工厂排放出的废气 B.氢气燃烧生成水 C.煤燃烧生成二氧化碳、二氧化硫等 D.汽车排出的尾气  CHEN888HONG1年前1
CHEN888HONG1年前1 -
 markto 共回答了11个问题
markto 共回答了11个问题 |采纳率90.9%A、石油化工厂排放出的废气中含有二氧化硫、二氧化氮、一氧化碳等空气污染物,会造成空气污染,故A不符合题意;
B、氢气燃烧生成水,水不会造成空气污染,故B符合题意;
C、煤燃烧产生的烟雾中含有二氧化硫、二氧化氮、一氧化碳等空气污染物,会造成空气污染,故C不符合题意;
D、汽车排放的废气是城市空气污染的主要途径,会产生大量的CO、氮氧化合物、碳氢化合物,严重时会造成光化学烟雾;会造成空气污染,故D不符合题意.
故选:B.1年前查看全部
- (2007•番禺区一模)某化工厂常用电解纯净的饱和食盐水的方法来得到烧碱溶液,再经浓缩、蒸发等步骤制造固体烧碱.某化学兴
(2007•番禺区一模)某化工厂常用电解纯净的饱和食盐水的方法来得到烧碱溶液,再经浓缩、蒸发等步骤制造固体烧碱.某化学兴趣小组要分析该化工厂仓库里的固体烧碱样品.
(1)小组成员猜测该样品中含有碳酸钠,支持这种猜测的依据是(用化学方方程式表示)______.小组成员选用了三种不同类别的试剂,进行实验,验证猜想,并得出结论,碳酸钠确实存在.请你将实验过程中涉及的化学方程式填在下表中.
(2)现已知样品中含有氯化钠、氢氧化钠、碳酸钠,设计一个实验方案,来证实一定含有氯化钠存在.化学方程式 试剂1 试剂2 试剂3 
请写出试剂X的化学式______
请写出①反应的化学方程式______
请写出②反应的化学方程式______. 烟雨楼家族之烟灰1年前1
烟雨楼家族之烟灰1年前1 -
 钱之光 共回答了20个问题
钱之光 共回答了20个问题 |采纳率85%解题思路:(1)烧碱易潮解,潮解之后容易和空气中的二氧化碳反应,检验烧碱变质的方法就是根据碳酸钠的化学性质来选择合适的试剂来鉴别
(2)加入试剂A后生成了气体可知X为酸,但是考虑到后边的反应中加入了硝酸银,所以此时要排除氯离子和硫酸根离子的干扰,故应该选择稀硝酸,可以据此答题(1)烧碱露置于空气中时易于空气中的二氧化碳反应而变质,在验证烧碱是否变质实际上就是验证碳酸钠的存在,故可以据其性质来区分,要注意的是当用盐酸时要向把氢氧化钠反应掉,然后才会有气体产生,故本题的答案为:CO2+2NaOH=Na2CO3+H2O
化学方程式
试剂1 Na2CO3 +CaCl2═2NaCl+CaCO3↓
试剂2 Na2CO3+Ca(OH)2═2NaOH+CaCO3↓
试剂3
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O (2)加入X生成了气体可知X为酸,但是考虑到后边的反应中加入了硝酸银,所以此时要排除氯离子和硫酸根离子的干扰,故应该选择稀硝酸,当加入稀硝酸时除了和碳酸钠反应,还要和氢氧化钠发生中和反应,在混合物中能和硝酸银生成白色沉淀的是氯化钠,
故本题答案为:HNO3 NaOH+HNO3=NaNO3+H2O; Na2CO3+2HNO3=2NaNO3+CO2↑+H2ONaCl+AgNO3=AgCl↓+NaNO3点评:
本题考点: 酸、碱、盐的鉴别;电解水实验.
考点点评: 解答本题要求学生熟练掌握酸、碱、盐的化学性质,并能根据物质之间能否反应及其反应的实验现象来得出结论,熟记化学方程式:CO2+2NaOH=Na2CO3+H2O;Na2CO3+Ca(OH)2═2NaOH+CaCO3↓; NaOH+HCl=NaCl+H2O.1年前查看全部
- 某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气
某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,某同学设计了一个除去废水中重金属离子的实验方案如下:
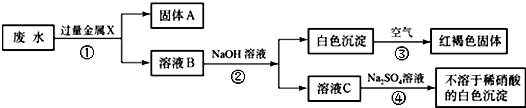
(1)固体A中一定含有的物质为______(写化学式).
(2)B溶液中的溶质一定含有______(写化学式).
(3)请写出③、④的化学方程式:______、______. 水ww泉1年前1
水ww泉1年前1 -
 yetta2008 共回答了25个问题
yetta2008 共回答了25个问题 |采纳率84%解题思路:由题中的框图可知:已知红褐色固体是氢氧化铁,可知X是金属铁,铁把银、铜置换出来,故固体A为Ag、Cu、Fe;又由于加入过量的铁和出现的白色沉淀,所以B溶液中一定有Fe(NO3)2和Ba(NO3)2.书写化学方程式时要注意配平和沉淀符号.(1)由题中的图知:废水加过量固体X,然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀,由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁;可知金属X是铁,废水中含有银离子、钡离子和铜离子,铁可将银离子和铜离子置换出来,还有过量的铁,所以固体A中一定含有Fe、Ag和Cu;
(2)溶液中含有没参加反应的硝酸钡和生成的硝酸亚铁,硝酸铜和硝酸银完全被过量的铁置换出来,所以B溶液中的溶质一定含有Fe(NO3)2、Ba(NO3)2;
(3)反应③是白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,因此反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
溶液C为Ba(NO3)2,加入硫酸钠发生反应的方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
故答案为:(1)Fe、Cu、Ag;(2)Ba(NO3)2、Fe(NO3)2;(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3;Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 .点评:
本题考点: 物质的鉴别、推断;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
- 某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气
某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气体,下列说法正确的是:
1.废液中一定有CO3(2-) 2.废液中有H2SO4
3.废液中一定有Ag+ 4.废液中一定有SO4(2-)
答案是1和4,可是我不明白为什么说1和3不行呢? lyyong12341年前1
lyyong12341年前1 -
 doudoufly 共回答了22个问题
doudoufly 共回答了22个问题 |采纳率90.9%“俊狼猎英”团队为您解答.
分析:通过“再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气体”可知,溶液中一定含有CO3(2-),那么如果有CO3(2-)的话,就一定没有H2SO4和Ag+,因为CO3(2-)和酸是不能共存的(反应会产生二氧化碳),CO3(2-)和Ag+结合会变成碳酸银沉淀,如果没有Ag+的话,那么再加入足量稀硝酸,沉淀部分溶解,说明有不溶于硝酸的沉淀,就不是氯化银,而是硫酸钡沉淀了,所以溶液中一定含有SO4(2-),明白么?不明白可以追问!1年前查看全部
大家在问
- 1请问you tell tpo18里lecture4的professor在上课 然后学生在提问,或者是在验证什么然后pro
- 2求英语序数词是由1~20,然后就是21,32,43,54,65,76,87,98,109,110,121,132,143
- 3若|x|=-x,则x是 正数还是负数还是负数或零还是正数或零?
- 4把一个体积是186立方分米的圆柱形木料削成一个最大的圆锥体,则削去的部分的体积
- 5The fate of such an arrangement is helpless……什么意思
- 6《九章算术》中:有人用车把米从甲地运到乙地,装有米的车日行50里,返回空车日行70里,5日往返3次.两地间的路程是多少?
- 7标准状况下,67.2gCO2是 mol,质量为 g,含有 个CO2分子,其中含有 mol氧原子.
- 8从小到大排列 33.3 3分之1 33.3% 0.334
- 9(2013•通辽)在客观、微观和符号之间建立联系是化学学科的特点.
- 10初三英语作文:AdvantagesandDis
- 11作业帮中财富商城只要有财富值就能换物品是真的吗?
- 12图中3乘3方格式从日历表上取下的正中方格的日期是N,请填入适当的代数式表示所填入空格的日期,然后比较两
- 13下列哪些科学贡献不是由麦克斯韦做出的( )
- 14SECTION C (25 points)Directions: Write an English compositio
- 15unusual独特的 怎么读
