将CaSO4和BaSO4的饱和溶液等体积混合后,再加入足量的浓NaSO4溶液
 maku20032022-10-04 11:39:541条回答
maku20032022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 frfsh369 共回答了23个问题
frfsh369 共回答了23个问题 |采纳率91.3%- 无论怎样沉淀,总是满足Ksp不变.在本题中,c(SO42-)受加入的Na2SO4溶液控制,是定值.Ksp(CaSO4) = c(Ca2+) *c(SO42-),Ksp(BaSO4) = c(Ba2+) *c(SO42-).
由于CaSO4是微溶,BaSO4是难溶,故 Ksp(CaSO4) > Ksp(BaSO4)所以溶液中c(Ca2+) > c(Ba2+)
但是!由于初始的c(Ca2+) > c(Ba2+) (因二者饱和溶液等体积混合,而CaSO4溶解度大)所以无法直接判断CaSO4、BaSO4哪一个沉淀的更多.需要计算.
计算的结果是 CaSO4沉淀更多.
抱歉,这个题 http://zhidao.baidu.com/question/1893998481179268860.html?oldq=1我弄错了. - 1年前
相关推荐
- 一个饱和溶液,温度降低析出晶体,那么现在的溶液的浓度和原来一样吗,还是饱和溶液吗
 greedisland1年前2
greedisland1年前2 -
 jiangwenjing 共回答了20个问题
jiangwenjing 共回答了20个问题 |采纳率85%还是饱和溶液,但是浓度是不同的.1年前查看全部
- 1.20℃时食盐的溶解度为36克,20℃时将20克食盐放入50克水中,充分溶解后,所得饱和溶液的质量为:( )
1.20℃时食盐的溶解度为36克,20℃时将20克食盐放入50克水中,充分溶解后,所得饱和溶液的质量为:( )
A.70克 B.69克 C.68克 D.67克
2.(多选题)100克质量分数为10%的氯化钠溶液,若其变为20%的溶液,可采用的措施为:( )
A.加入10克氯化钠 B.蒸发掉50克水 C.蒸发掉45克水 D.加入12.5克氯化钠
3.(多选题)将某物质溶液蒸发50克水后,温度降到t℃,析出晶体8克,在蒸发50克水,温度降到t℃,又析出晶体10克,那么原溶液欲变成t℃饱和溶液,至少应( )
A.蒸发10克水 B.加入2克溶质 C.蒸发15克水 D.加入8克溶质 ywj011年前1
ywj011年前1 -
 八桂第一枪 共回答了30个问题
八桂第一枪 共回答了30个问题 |采纳率96.7%1.C.100克水溶解36克食盐,所以50克水溶解18克食盐,故溶液质量为50+18=68克;
2.AB.因为体积的变化忽略不计,所以加入10克食盐也可以;
3.AB.因为第一次蒸发结晶后溶液为饱和状态,所以由第二次蒸发50克水析出10克晶体,得溶解度为20克,所以第一次之所以蒸发50克水只有8克晶体析出,就是因为多出了10克水,其中没有溶解有2克溶质,故既可以蒸发10克水,又可以加入2克溶质来给那多出的10克水溶解.1年前查看全部
- 如图所示是甲、乙、丙三种物质的溶解度曲线,当他们接近饱和时,可以分别通过加溶质、蒸发溶剂、升温等方法变为饱和溶液的是(
如图所示是甲、乙、丙三种物质的溶解度曲线,当他们接近饱和时,可以分别通过加溶质、蒸发溶剂、升温等方法变为饱和溶液的是( ) A.甲溶液 B.乙溶液 C.丙溶液 D.甲、乙混合溶液 
 79853541年前1
79853541年前1 -
 xinhuun 共回答了15个问题
xinhuun 共回答了15个问题 |采纳率80%A、甲的溶解度随温度升高而增大,所以加溶质,蒸发溶剂都能使接近饱和的甲溶液变为饱和溶液;升高温度甲的溶解度增大,接近饱和的甲溶液不会变为饱和溶液,故A不选.
B、乙的溶解度随温度升高而增大,所以加溶质,蒸发溶剂都能使接近饱和的甲溶液变为饱和溶液;升高温度乙的溶解度增大,接近饱和的乙溶液不会变为饱和溶液,故B不选.
C、丙的溶解度随温度升高而减小,所以加溶质,蒸发溶剂都能使接近饱和的丙溶液变为饱和溶液;升高温度丙的溶解度减小,接近饱和的丙溶液会变为饱和溶液,故C选.
D、甲和乙解度随温度升高而增大,所以加溶质,蒸发溶剂都能使接近饱和的甲溶液变为饱和溶液;但升高温度他们的溶解度都增大,都不能变为饱和溶液,故D不能选.
故答案选C.1年前查看全部
- 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,结果中AgCl沉淀与AgBr沉淀大小比较
 lipingpan1年前5
lipingpan1年前5 -
 风之客 共回答了18个问题
风之客 共回答了18个问题 |采纳率66.7%参与反应的氯化银的沉淀多,因为氯化银溶解度大,故饱和溶液中他的浓度大则生成的沉淀多 .
但是,溶液中的沉淀量是溴化银的大,因为溴化银的溶解度小1年前查看全部
- 高二化学对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间的关系类似于Kw=[H+ ]•[OH- ],
高二化学对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间的关系类似于Kw=[H+ ]•[OH- ],
3.对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间的关系类似于Kw=[H+ ]•[OH- ],存在等式Ksp=[M+]•[X-].一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序正确的是( ) ①20ml0.01mol/LKCl溶液 ②30ml0.02mol/L CaCl2溶液 ③40ml 0.03mol/LHCl溶液 ④10 ml蒸馏水 ⑤50ml0.05mol/LAgNO3溶液 A.①﹥②﹥③﹥④﹥⑤ B.④﹥①﹥③﹥②﹥⑤ C.⑤﹥④﹥②﹥①﹥③ D.④﹥③﹥⑤﹥②﹥①
为什么选B tceae1年前4
tceae1年前4 -
 5048953 共回答了23个问题
5048953 共回答了23个问题 |采纳率100%AgCl的 Ksp=[Ag+]•[Cl-]
因为 Ksp反应了该物质的溶解能力,它是个定值,不变的
所以要比较在溶液中的溶解度,哪里含有该物质的阴阳离子浓度越多,它的溶解能力越小,也就说含有[Ag+]或者[Cl-]浓度越高,溶解能力越小
比较五个选项:
①含有0.01mol/L [ Cl-]
②含有0.04mol/L [ Cl-]
③含有0.03mol/L [ Cl-]
④不含有
⑤含有0.05mol/L [Ag+]
AgCl中是有一个[Ag+]和 Cl-]组成,之与浓度有关系与溶液体积没有关系
所以
.④﹥①﹥③﹥②﹥⑤
所以选B
不明白HI1年前查看全部
- "20摄氏度时,同种溶质的溶液,饱和溶液一定比不饱和溶液浓一些"这句话对吗?
"20摄氏度时,同种溶质的溶液,饱和溶液一定比不饱和溶液浓一些"这句话对吗?
那么就从两个选一个错的吧!
A、20摄氏度时,同种溶质的溶液,饱和溶液一定比不饱和溶液浓一些
B、潜水员在水中看岸上的树木变低了
(别说两个都错,这是今天上午的一模试题,有两个选项我确定是对的,现在是心急如焚啊!就只有这题可能错了!) 毕宿五121年前6
毕宿五121年前6 -
 sunshineb 共回答了16个问题
sunshineb 共回答了16个问题 |采纳率87.5%不对.因为溶剂可能不同.例如,碘可微溶于水,但易溶于四氯化碳.因此在20摄氏度的条件下,即使不饱和的碘的四氯化碳溶液,也很容易比碘的水溶液浓度高.
补充一下:
A错误,B也错误
画画光路图就知道了,应该是变高.1年前查看全部
- 25摄氏度时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)不变?
25摄氏度时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)不变?
为什么不变?不是应该增大吗? 亲jia1年前2
亲jia1年前2 -
 逍遥mike 共回答了16个问题
逍遥mike 共回答了16个问题 |采纳率100%往 Mg(OH)2 的饱和溶液中加入 NH4Cl,由于 NH4 水解,溶液中 OH- 浓度降低,破坏了 Mg(OH)2 的溶解平衡.
对于悬浊液而言,此时固体 Mg(OH)2 会溶解,使 Mg(OH)2 溶解平衡回归平衡状态.由于固体 Mg(OH)2 的溶解,因此溶液中 Mg2 浓度增大
而澄清饱和溶液没有维持平衡的能力,Mg(OH)2 溶解平衡破坏后不能恢复,没有新的 Mg(OH)2 溶解进来,因此 Mg2 浓度保持不变.1年前查看全部
- 20℃时,20mL NaCl饱和溶液质量为24g,将其蒸干后得食盐6.34g,则20℃时,食盐的溶解度为______,此
20℃时,20mL NaCl饱和溶液质量为24g,将其蒸干后得食盐6.34g,则20℃时,食盐的溶解度为______,此时食盐饱和溶液的质量分数为______,物质的量浓度为______.
 星星之我星1年前1
星星之我星1年前1 -
 Sid_Mclaren 共回答了16个问题
Sid_Mclaren 共回答了16个问题 |采纳率100%解题思路:计算溶液中水的质量,进而计算100g水能够溶解NaCl质量,即为该温度下NaCl溶解度;溶液质量分数=
×100%;根据n=[m/M]计算NaCl的物质的量,再根据c=[n/V]计算NaCl溶液物质的量浓度.m(溶质) m(溶液) 水的质量=24g-6.34g=17.64g,令溶解度为s,则100g:s=17.64g:6.34g,解得s=35.9g;
溶液质量分数w=[6.34g/24g]×100%=26.4%;
溶液的物质的量浓度c=
6.34g
58.5g/mol
0.02L=5.42 mol/L,
故答案为:35.9 g;26.4%;5.42mol/L.点评:
本题考点: 溶液中溶质的质量分数及相关计算.
考点点评: 本题考查溶液浓度的计算,涉及溶解度、质量分数、物质的量浓度,比较基础,注意对溶解度概念及公式的理解.1年前查看全部
- 同种物质在不同温度下的饱和溶液浓度一样么?
同种物质在不同温度下的饱和溶液浓度一样么?
如题. 最好说明为什么,先谢谢了!
 602133881年前1
602133881年前1 -
 wahreliebe 共回答了15个问题
wahreliebe 共回答了15个问题 |采纳率86.7%肯定不一样!
不同程度的受温度的影响!
最典型的要数初中的KNO3 和NaCl,KNO3受温度影响较大而NaCl受影响不大!
气体主要受气压影响,固体与焓有关!1年前查看全部
- 对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液浓
对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液浓
对么?反例? smlala1年前3
smlala1年前3 -
 诺基呀 共回答了13个问题
诺基呀 共回答了13个问题 |采纳率84.6%不一定 溶解度跟温度有关 如果设置为:
温度一定 那么 同一溶质的溶液而言,饱和溶液一定比不饱和溶液浓1年前查看全部
- 摄示度时将W克胆矾溶解于V毫升水中配制成饱和溶液(该饱和溶液密度为P克/立方厘米),则T摄示度时硫酸铜的溶
摄示度时将W克胆矾溶解于V毫升水中配制成饱和溶液(该饱和溶液密度为P克/立方厘米),则T摄示度时硫酸铜的溶
求改溶液的质量分数 物质的量的浓度 谢. 等待是快乐1年前1
等待是快乐1年前1 -
 大大只佬 共回答了18个问题
大大只佬 共回答了18个问题 |采纳率88.9%m(CuSO4)=160W/250
m(溶液)=W+V
CuSO4%=m(CuSO4)/m(溶液)
n(CuSO4)=W/250
V(溶液)=m(溶液)/P
c=n/V(溶液)1年前查看全部
- 把60度的282克硝酸钾饱和溶液冷却降温到20度将析出多少可硝酸钾才能使溶液冲洗达到饱和
 exina1年前1
exina1年前1 -
 SALCE 共回答了14个问题
SALCE 共回答了14个问题 |采纳率92.9%200.9克1年前查看全部
- 1.在一定温度下,氯化钠饱和溶液的质量为13.6克,把它蒸干后,得到3.6克氯化钠.
1.在一定温度下,氯化钠饱和溶液的质量为13.6克,把它蒸干后,得到3.6克氯化钠.
计算:
(1)该温度时氯化钠饱和溶液中溶质质量分数.
(2)配制该温度下的氯化钠饱和溶液1000克,需要氯化钠固体和水各多少克?
2.把1000克98%的浓硫酸稀释成10%的稀硫酸,需要加水多少克? 西子小隐1年前1
西子小隐1年前1 -
 buliwo12 共回答了21个问题
buliwo12 共回答了21个问题 |采纳率95.2%1.溶剂是10g水,溶质是3.6gNaCl
所以饱和溶液的质量分数是3.6/13.6=26.47%
2.NaCl质量是1000×0.2647=264.7g
水是1000-264.7=735.3g
3.溶质质量守恒
溶质的质量是980g
稀释以后溶液的质量是980/0.1=9800g
加入的水是9800-1000=8800g1年前查看全部
- 乙醇和乙酸的反应,导管不能插入碳酸钠饱和溶液是因为防倒吸.倒吸是因为受热不均.这里的受热不均是什么意思
 我爱吃鱼1年前2
我爱吃鱼1年前2 -
 mingchao919 共回答了25个问题
mingchao919 共回答了25个问题 |采纳率92%倒吸是因为内外气压不平衡,温度忽然变冷的话,压强变小,就会将外界的液体吸进来.1年前查看全部
- 在40°C时,73克NH4CL的饱和溶液中含有NH4CL23克,求此温度下NH4CL的溶解度?
在40°C时,73克NH4CL的饱和溶液中含有NH4CL23克,求此温度下NH4CL的溶解度?
而且是初二的那种运算过程 光辉メ岁月1年前1
光辉メ岁月1年前1 -
 宋benben 共回答了19个问题
宋benben 共回答了19个问题 |采纳率78.9%溶解度的定义:100g溶剂中最多能溶解多少克溶质.
73克NH4CL的饱和溶液中含有NH4CL23克
溶剂是50g,溶质是23g
所以,溶解度是46g.1年前查看全部
- 20℃时氯化钠的溶剂度为36克,则此温度下氯化钠饱和溶液的溶质质量分数为_______;当把改溶液蒸发掉10克水再降温至
20℃时氯化钠的溶剂度为36克,则此温度下氯化钠饱和溶液的溶质质量分数为_______;当把改溶液蒸发掉10克水再降温至20℃后,剩余溶液的溶质质量分数_________
 垃圾我都踢1年前1
垃圾我都踢1年前1 -
 老街区 共回答了13个问题
老街区 共回答了13个问题 |采纳率92.3%20℃时氯化钠的溶剂度为36克,则此温度下氯化钠饱和溶液的溶质质量分数为_36g/(36g+100g)*100%=26.47%______;当把改溶液蒸发掉10克水再降温至20℃后,剩余溶液的溶质质量分数__26.47%__
温度没变,溶解度不变,溶质质量分数不变.1年前查看全部
- (2014•工业园区一模)如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克M、80克N固体
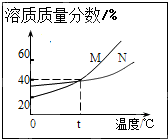 (2014•工业园区一模)如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是( )
(2014•工业园区一模)如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是( )
A.M、N两溶液的溶质质量分数相等
B.只有N析出晶体
C.M、N均有晶体析出
D.M、N两溶液均是饱和溶液 艰难的旅行1年前1
艰难的旅行1年前1 -
 mootty 共回答了12个问题
mootty 共回答了12个问题 |采纳率91.7%解题思路:根据题意,加水150克,加热溶解,同时蒸发掉50克水,冷却至t℃,这一系列变化后,相当于在t℃时用150g-50g=100g水分别去溶解50克M和80克N固体,判断此时的溶解情况;因此可根据饱和溶液的溶质质量分数随温度变化的曲线,算出t℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,从而对所做的判断进行评价.首先计算t℃时M、N两物质的溶解度:根据饱和溶液的溶质质量分数随温度变化的曲线,t℃时M、N两物质的饱和溶液的溶质质量分数相等都为40%,根据饱和溶液的溶质质量分数与溶解度的关系:溶质质量分数=[溶解度/溶解度+100g]×100%,可知此时两物质的溶解度相等,设为x,则有[x/100g+x]×100%=40%,解得x≈67g;
然后根据溶解度判断两物质在t℃时的溶解情况:t℃时M、N两物质的溶解度为67g,即此时100g水最多溶解M、N物质的质量都为67g,所以,加入的50gM可以全部溶解且形成不饱和溶液,加入的80gN不能全部溶解而成为饱和溶液;故B正确,CD错误;
综合以上分析,当降温到t℃时固体M不会析出,而固体N物质析出80g-67g=13g;由于此时M溶液是不饱和溶液而N溶液为饱和溶液,因此两溶液的溶质质量分数也不相等;故A错误;
故选:B.点评:
本题考点: 固体溶解度曲线及其作用;晶体和结晶的概念与现象.
考点点评: 解题时一定要注意:所给的曲线不是溶解度曲线,而是饱和溶液的溶质质量分数随温度变化的曲线,并使用饱和溶液中溶质质量分数与溶解度的关系进行分析解答.1年前查看全部
- 如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入
如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题: 
(1)乙物质的溶解情况是 _____________________。
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号:__________;
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是_____________;(用甲、乙、丙填空)
(4)40℃时,等质量饱和溶液中含水最少的是______物质。
(5)40℃时,甲溶液中溶质质量分数____大于丙溶液中溶质质量分数;(填“一定”或“不一定”)。 198307071年前1
198307071年前1 -
 hncr 共回答了18个问题
hncr 共回答了18个问题 |采纳率94.4%(1)乙固体质量增多
(2)acb
(3)丙>甲>乙
(4)甲
(5)不一定1年前查看全部
- (2011泸州)下列有关饱和溶液的说法中,正确的是
 chunshisanshao1年前2
chunshisanshao1年前2 -
 323029 共回答了14个问题
323029 共回答了14个问题 |采纳率92.9%饱和溶液就是在温度和溶解剂一定的情况下,溶质达到的最大量1年前查看全部
- 饱和溶液是什么意思?怎样去除自来水中的氯离子?
 djf0001年前1
djf0001年前1 -
 66637360 共回答了19个问题
66637360 共回答了19个问题 |采纳率100%如:酒精与水的溶液).溶质溶于溶剂的溶解过程中,首先是溶质在溶剂中的扩散作用,在溶质表面的分子或离子开始溶解,进而扩散到溶剂中.被溶解了的分子或离子在溶液中不断地运动,当它们和固体表面碰撞时,就有停留在表面上的可能,这种淀积作用是溶解的逆过程.当固体溶质继续溶解,溶液浓度不断增大到某个数值时,淀积和溶解两种作用达成动态平衡状态,即在单位时间内溶解在溶剂中的分子或离子数,和淀积到溶质表面上的分子或离子数相等时,溶解和淀积虽仍在不断地进行,但如果温度不改变,则溶液的浓度已经达到稳定状态,这样的溶液称为饱和溶液,其中所含溶质的量,即该溶质在该温度下的溶解度.由此可见,在饱和溶液中,溶质的溶解速率与它从溶液中淀积的速率相等,处于动态平衡状态.去除自来水中的氯离子,只要将水烧沸即可.1年前查看全部
- 在一定温度下,向一定量的Ca(OH)2饱和溶液中加入少量的CaO并维持温度不变,则下列说法中正确的是( )
在一定温度下,向一定量的Ca(OH)2饱和溶液中加入少量的CaO并维持温度不变,则下列说法中正确的是( )
A. 溶液的pH增大
B. 溶液的pH减小
C. 溶液中的Ca2+总数减少
D. 溶液中的Ca2+总数增加 freda_zheng1年前1
freda_zheng1年前1 -
 败人摸你黑 共回答了22个问题
败人摸你黑 共回答了22个问题 |采纳率86.4%解题思路:在一定温度下,向一定量的Ca(OH)2饱和溶液中加入少量的Ca0并维持温度不变,氧化钙溶于水反应放热,氢氧化钙溶解度随温度升高减小,溶液中会析出氢氧化钙,恢复温度不变,溶液中离子浓度不变.A、氧化钙溶于水反应放热,氢氧化钙溶解度随温度升高减小,溶液中会析出氢氧化钙,恢复温度不变,溶液中离子浓度不变,pH不变,故A错误;
B、氧化钙溶于水反应放热,氢氧化钙溶解度随温度升高减小,溶液中会析出氢氧化钙,恢复温度不变,溶液中离子浓度不变,pH不变,故B错误;
C、向一定量的Ca(OH)2饱和溶液中加入少量的Ca0并维持温度不变,氧化钙溶于水反应放热,氢氧化钙溶解度随温度升高减小,溶液中会析出氢氧化钙,所以溶液中钙离子数减小,故C正确;
D、依据C分析可知D错误;
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查饱和溶液中,条件改变溶质变化分析判断,溶液PH变化分析的依据,注意氢氧化钙溶解度随温度升高减小,题目难度中等.1年前查看全部
- (2000•湖北)一定温度下,某物质的饱和溶液一定是( )
(2000•湖北)一定温度下,某物质的饱和溶液一定是( )
A.浓溶液
B.不能再溶解其它物质的溶液
C.含100克溶剂的溶液
D.均一、稳定的混合物 万州小崽儿1年前1
万州小崽儿1年前1 -
 飞跃狗狗 共回答了14个问题
飞跃狗狗 共回答了14个问题 |采纳率92.9%解题思路:在一定温度下,某物质的饱和溶液可能是浓溶液,也可能是稀溶液;仍然能溶解其它溶质;不能再溶解该物质.饱和溶液是指在一定的温度下,在一定量的溶剂里不能再继续溶解该种物质的溶液.
A、在一定温度下,某物质的饱和溶液可能是浓溶液,也可能是稀溶液,因为和溶质的溶解度有关.故A错误;
B、在一定温度下,某物质的饱和溶液仍然能溶解其它溶质.故B错误;
C、在一定温度下,某物质的饱和溶液中溶剂的质量不一定是100克.故C错误;
D、一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物是溶液.故D正确.
故选:D.点评:
本题考点: 饱和溶液和不饱和溶液;溶液的概念、组成及其特点.
考点点评: 溶液的浓稀和是否是饱和溶液没有必然的联系,因为浓溶液可能是饱和溶液,也可能是不饱和溶液.要充分理解饱和溶液的含义,只有这样才能对问题做出正确的判断.1年前查看全部
- 60摄氏度时硝酸钾饱和溶液中,溶质82.5克,溶剂75克,求60摄氏度时硝酸钾的溶解度
 jinxupeng1年前1
jinxupeng1年前1 -
 mikeleeni 共回答了17个问题
mikeleeni 共回答了17个问题 |采纳率94.1%82.5*(100/75)=110克1年前查看全部
- 一道科学问题在一定温度下,一定量水中最多能溶解15克硝酸钾就形成饱和溶液.现在等量水中加入14克硝酸钾,所得溶液是不饱合
一道科学问题
在一定温度下,一定量水中最多能溶解15克硝酸钾就形成饱和溶液.现在等量水中加入14克硝酸钾,所得溶液是不饱合(为什么)溶液;若能加入2克硝酸钾,则此溶液中溶解硝酸钾为15(为什么)克. lkcytlk1年前1
lkcytlk1年前1 -
 michelle5515 共回答了21个问题
michelle5515 共回答了21个问题 |采纳率100%因为它最多能容这些(15g)而且容了15g才算饱和,所以
而且 加了16g,它只能溶15g,所以有一克沉淀了
就像一个容器只能装那么多,装再多只会溢出1年前查看全部
- (2008•浦东新区二模)如图是A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线
(2008•浦东新区二模)如图是A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,现将20gA和40gB分别置于100g水中,加热使其完全溶解,然后再冷却到t℃,下列有关叙述中正确的是( )

A.t℃时,A溶液的质量百分比浓度(溶质质量分数)小于B
B.t℃时,A、B溶液均达到饱和状态
C.t℃时,A、B溶液中均无固体物质析出
D.t℃时,A物质的溶解度小于B adang14971年前1
adang14971年前1 -
 单行道上的色盲 共回答了25个问题
单行道上的色盲 共回答了25个问题 |采纳率88%解题思路:A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,t℃时,A、B两种物质的饱和溶液的质量百分比浓度(溶质质量分数)相等,均为20%,由饱和溶液中溶质的质量分数=
×100%,计算出t℃时的溶解度;据此结合选项进行分析判断.溶解度 溶解度+100g t℃时,A、B两种物质的饱和溶液的质量百分比浓度(溶质质量分数)相等,均为20%,由饱和溶液中溶质的质量分数=
溶解度
溶解度+100g×100%,设t℃时,A、B两种物质的溶解度为S,则
S
S+100g×100%=20%,S=25g;将20gA和40gB分别置于100g水中,加热使其完全溶解,然后再冷却到t℃,A为不饱和溶液,B有晶体析出,为饱和溶液.
A、t℃时,A、B两种物质的溶解度均为25g,则t℃时,100g水中溶解20gA,能溶解25gB,则A溶液的质量百分比浓度(溶质质量分数)小于B,故选项说法正确.
B、t℃时,A溶液未达到饱和状态,B溶液达到饱和状态,故选项说法错误.
C、t℃时,A溶液中无固体物质析出,B溶液中有固体物质析出,故选项说法错误.
D、t℃时,A物质的溶解度等于B,故选项说法错误.
故选A.点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 本题难度不大,主要考查了A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,通过本题可以培养学生应用知识解决问题的能力.1年前查看全部
- 5道化学题1.20°C时,在100g水中溶解11.1gK2SO4恰好达到饱和,此饱和溶液的密度为1.08g/cm³.将3
5道化学题
1.20°C时,在100g水中溶解11.1gK2SO4恰好达到饱和,此饱和溶液的密度为1.08g/cm³.将350mL此温度下的K2SO4饱和溶液用水稀释至500mL.计算稀释后溶液中K2SO4的物质的量的浓度.
2.将一定体积的密度为1.19g/cm³,质量分数为36.5%的浓盐酸稀释至50mL时,溶液中H+的物质的量浓度为1.02mol/L.计算所用浓盐酸的体积.
3.制取500g质量分数为14.6%的盐酸,需要标准状况下HCl气体的体积是多少?
4.在t°C时,ag某化合物饱和溶液的体积为bmL.将其蒸干后得到cg摩尔质量为dg/mol的不含结晶水的固体物质.计算t°C时此化合物的饱和溶液中溶质的物质的量的浓度.
5.将1.721gCaSO4·xH2O加热,使其失去全部结晶水,这时剩余固体物质的质量是1.361g.计算1mol此结晶水合物种所含结晶水的物质的量.
 七七yy1年前1
七七yy1年前1 -
 爱吾爱琴 共回答了18个问题
爱吾爱琴 共回答了18个问题 |采纳率100%1、稀释后溶液中K2SO4的物质的量的浓度
C={1.08*350*[11.1/(100+11.1)]/174}/0.5=0.434 mol/L
2、浓盐酸物质的量浓度=(1000*1.19*36.5%)/36.5=11.9 mol/L
所用浓盐酸的体积=1.02*50/11.9=26.8 mL
3、需要标准状况下HCl气体的体积=[(500*14.6)/36.5]*22.4=44.8 L
4、此化合物的饱和溶液中溶质的物质的量的浓度=1000c/db mol/L
5、x=[(1.721-1.361)/1.361]*(136/18)=21年前查看全部
- 在同一温度下,甲乙两物质的饱和溶液溶解度相等,那么它们的饱和溶液中所含甲乙两物质相等,为什么是错的?
在同一温度下,甲乙两物质的饱和溶液溶解度相等,那么它们的饱和溶液中所含甲乙两物质相等,为什么是错的?
既然溶解度相等,那么不就暗示了它们的溶液质量相等吗?【溶液质量=溶剂质量+溶质质量=100g+溶解度】
本人中考生, 娃娃鱼3681年前1
娃娃鱼3681年前1 -
 百合花香啦 共回答了13个问题
百合花香啦 共回答了13个问题 |采纳率100%这里如果说溶液的质量是相同的,是正确的.
如果甲溶液是1g,乙溶液是100000g,它们溶质的质量会相等吗?1年前查看全部
- 打天汽水瓶盖,冒出气泡后,瓶内剩余的液体是该气体的饱和溶液还是不饱和溶液
 sezwb1年前1
sezwb1年前1 -
 小虫7525 共回答了20个问题
小虫7525 共回答了20个问题 |采纳率100%饱和.强压使大量气体充入,开盖之后释放到常压的饱和状态1年前查看全部
- 已知20℃时,NaCl的溶解度为36g,NaCl饱和溶液的密度为1.12g/cm3,则在该温度下,NaCl饱和溶液的物质
已知20℃时,NaCl的溶解度为36g,NaCl饱和溶液的密度为1.12g/cm3,则在该温度下,NaCl饱和溶液的物质的量浓度为( )
A. 0.15mol•L-1
B. 1.36mol•L-1
C. 5.07mol•L-1
D. 6.15mol•L-1 我SB1年前1
我SB1年前1 -
 谢培质 共回答了15个问题
谢培质 共回答了15个问题 |采纳率86.7%解题思路:根据溶解度计算NaCl饱和溶液的质量分数,根据c=[1000ρω/M]计算氯化钠的物质的量浓度.20℃时,NaCl的溶解度为36g,NaCl饱和溶液的质量分数为[36/136].
NaCl饱和溶液的密度为1.12g/cm3,
所以氯化钠溶液的物质的量浓度为c=
1000×1.12×
36
136
58.5mol/L=5.07mol/L.
故选:C.点评:
本题考点: 物质的量浓度的相关计算;溶解度、饱和溶液的概念.
考点点评: 考查物质的量浓度与溶解度的关系计算,难度中等,也可根据物质的量的定义式计算.1年前查看全部
- 在20°C时,硝酸钾饱和溶液的质量分数为24%,计算硝酸钾的溶解度
 狐狸朱1年前1
狐狸朱1年前1 -
 布衣羊 共回答了12个问题
布衣羊 共回答了12个问题 |采纳率91.7%(100-24):24=100:S
S=31.58
在20°C时,硝酸钾饱和溶液的质量分数为24%,意思是:100克饱和溶液中含有24克硝酸钾,所以计算得到该温度下,硝酸钾的溶解度是31.58克.1年前查看全部
- 溶解度与溶质质量分数的关系.选择题里问使硝酸钾饱和溶液溶质质量分数发生变化的有:
溶解度与溶质质量分数的关系.选择题里问使硝酸钾饱和溶液溶质质量分数发生变化的有:
A,升高温度
B,降低温度
C,恒温加溶质
D,恒温蒸发溶剂. 随风飘dh1年前1
随风飘dh1年前1 -
 杰才杰色 共回答了16个问题
杰才杰色 共回答了16个问题 |采纳率81.3%答案选A,B,由于已经是饱和溶液,因此升高或降低温度可以改变溶解度(溶解度与温度有关,具体我不记得硝酸钾的溶解度是随温度上升而增大还是降低了,总之可以改变溶解度),至于C,恒温的情况再加溶质已经加不进去了,恒温蒸发溶剂的话,溶液也一直是饱和的,质量分数不变,蒸发掉了溶剂相应就有溶质析出1年前查看全部
- 20度时,蔗糖饱和溶液15g,其中有10克溶质,求此温度时的溶解度?
 cdwls123151年前1
cdwls123151年前1 -
 lysuna 共回答了15个问题
lysuna 共回答了15个问题 |采纳率86.7%溶质除以溶液乘以百分之百1年前查看全部
- 室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,若使硝酸钾溶液变为饱和溶液,可想大烧杯中加入的固体物质是(
室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,若使硝酸钾溶液变为饱和溶液,可想大烧杯中加入的固体物质是( )
A.硝酸钾 B 氯化钠 C,硝酸铵 D.氢氧化钠
这道题的道理应该是,硝酸钾溶液溶解度减小变为饱和溶液,即温度减小,需要一个吸热的物体,我的疑问是A 和C都是吸热的物体,应该都选,为什么正确答案选C? dcboysky1年前2
dcboysky1年前2 -
 柳叶刀等号 共回答了20个问题
柳叶刀等号 共回答了20个问题 |采纳率90%你的思路是对的,但是吸热的只有硝酸铵,一般铵盐溶于水都吸热,而硝酸钾溶解并没有明显的吸热或放热,氯化钠也没有明显吸热或放热,氢氧化钠放热1年前查看全部
- t摄氏度,硫化铜的饱和溶液中加入5克硫酸铜粉末,容剂怎么样?溶质怎么样?溶液怎么样?说出理由
 梦到无梦1年前1
梦到无梦1年前1 -
 ss倾向 共回答了16个问题
ss倾向 共回答了16个问题 |采纳率100%硫酸铜和水结合生成五水硫酸铜,溶液中水减少,所以溶剂减少,部分硫化铜析出,所以溶质减少,总溶液减少.1年前查看全部
- ccl4与碘的饱和溶液混合后为什么呈紫色,上层是什么,下层是什么
 alexdp521年前1
alexdp521年前1 -
 ywq1390 共回答了14个问题
ywq1390 共回答了14个问题 |采纳率92.9%CCl4能将碘从碘水中萃取出来.因为CCl4密度比水大,所以碘的CCl4溶液在下层,水在上层.
所以上层是水,下层是碘的CCl4溶液.
上层无色水状,下层紫红色油状.1年前查看全部
- t摄氏度时,a毫升某物质的饱和溶液的质量为b克,将其蒸干,得到晶体c克,则该物质的溶液在t摄氏度时的质量
 yy0081921年前4
yy0081921年前4 -
 yanligl 共回答了13个问题
yanligl 共回答了13个问题 |采纳率84.6%该物质的溶液在t摄氏度时的质量为b克
该物质的溶液在t摄氏度时的质量分数为c/b*100%1年前查看全部
- 一定温度时,向密闭容器里的食盐饱和溶液中加入5G食盐晶体,经过一段时间后( )
一定温度时,向密闭容器里的食盐饱和溶液中加入5G食盐晶体,经过一段时间后( )
A.饱和溶液质量增大
B.晶体的质量不变
很奇怪,为什么给出答案是A?
加入5克食盐晶体, 愤然居士1年前1
愤然居士1年前1 -
 yyhuohu75430 共回答了20个问题
yyhuohu75430 共回答了20个问题 |采纳率100%B.
首先是在一定温度下,密闭容器里水分不会蒸发. 而且它原本就是食盐饱和溶液,溶质质量为100%.当它加入5克食盐晶体,它不会再继续溶解. 不排除很多习题集难免会有答案印刷错误的情况.1年前查看全部
- 在20℃时,将100克蔗糖溶于水中.配成150克饱和溶液,求溶液的质量百分比浓度和溶解度
 cyzzdz1年前1
cyzzdz1年前1 -
 zw1998kj2 共回答了24个问题
zw1998kj2 共回答了24个问题 |采纳率87.5%w(蔗糖)=100/150*100%=66.7%
S(蔗糖)=100/(150-100)*100=200(g/100g H2O)1年前查看全部
- 溶质,溶剂,在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.
溶质,溶剂,
在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.饱和溶液中的溶质增加4.饱和溶液中的溶剂减小5.饱和溶液中的溶剂增加6.饱和溶液的总质量不变.以下判断正确的一组是:
A,1.2.4
B:1.3.5
C:3.4.6
D:2.5.6 巴山劲松21年前1
巴山劲松21年前1 -
 redmapleleaf 共回答了25个问题
redmapleleaf 共回答了25个问题 |采纳率92%A 1、2、4
白色粉末是CuSO4,加水后变成五水硫酸铜(CuSO4·5H2O),水减少所以溶剂减少,溶剂减少所以蓝色晶体析出,蓝色晶体析出所以溶质减少,1年前查看全部
- 取60g的氯化钾饱和溶液,将其恒温蒸发10g水,剩余溶液的质量为45g,则剩余溶液中所含
 令狐倾倾01年前1
令狐倾倾01年前1 -
 iori2000 共回答了22个问题
iori2000 共回答了22个问题 |采纳率86.4%剩余溶液中所含氯化钾质量为 45g*[(60g-45g-10g)/(60g-45g)]=15g1年前查看全部
- 一道关于硫酸铜的竞赛题t℃时,无水硫酸铜在水中的溶解度是X克,现取3X克无水硫酸铜溶于水中,恰好形成饱和溶液;再取3X克
一道关于硫酸铜的竞赛题
t℃时,无水硫酸铜在水中的溶解度是X克,现取3X克无水硫酸铜溶于水中,恰好形成饱和溶液;再取3X克无水硫酸铜,加入该饱和溶液,析出Z克硫酸铜晶体(CuSO4·5H2O),最后将该Z克硫酸铜晶体溶于M克水中,又恰好得到N克饱和溶液(温度维持不变).下列说法正确的是:(多选)
A.Y=M=300
B.Y=300,N小于300
C.(3X·25/16)=Z
D.(3X·25/16)小于Z jasonwu20061年前1
jasonwu20061年前1 -
 hyuber 共回答了10个问题
hyuber 共回答了10个问题 |采纳率90%t℃时,无水硫酸铜在水中的溶解度是X克,现取3X克无水硫酸铜溶于Y克水中,恰好形成饱和溶液;Y=300
CuSO4+5H2O=CuSO4.5H2O
160 250
3X 3X*25/16
水参与反应,饱和溶液要析出CuSO4.5H2O晶体,所以.(3X*25/16)小于Z
Z克硫酸铜晶体溶于M克水中,又恰好得到N克饱和溶液(温度维持不变).M=300
所以选 AD1年前查看全部
- 使不饱和溶液变成饱和溶液的方法,在不改变温度的情况下,3种
 gracerose8631年前1
gracerose8631年前1 -
 swhll008 共回答了25个问题
swhll008 共回答了25个问题 |采纳率88%1、加溶质 2、蒸发溶剂 3、个别溶液如:石灰水,可以加生石灰与水发生反应,也可达到饱和状态1年前查看全部
- 20度时20g某物质溶解在水中形成饱和溶液,所以20度是该物质的溶解度为20
20度时20g某物质溶解在水中形成饱和溶液,所以20度是该物质的溶解度为20
这句话哪儿错了 jerry5121年前3
jerry5121年前3 -
 雪梦黧 共回答了18个问题
雪梦黧 共回答了18个问题 |采纳率88.9%应该说:20度时20g某物质溶解在【100克】水中形成饱和溶液,所以20度是该物质的溶解度为20克.1年前查看全部
- 已知AgCl溶解度大于AgBr,现将AgCl,AgBr的饱和溶液等体积混合,再加入浓AgNO3溶液,发生的反应为:
已知AgCl溶解度大于AgBr,现将AgCl,AgBr的饱和溶液等体积混合,再加入浓AgNO3溶液,发生的反应为:
A.只有AgBr沉淀生成.
B,AgBr沉淀多于AgCl
C.AgBr沉淀少于AgCl
选什么,并请解释以下
请用化学平衡原理解释,教科书上说溶解度小的沉淀转化成溶解度大的沉淀容易实现 又见边城1年前4
又见边城1年前4 -
 红白菜 共回答了22个问题
红白菜 共回答了22个问题 |采纳率77.3%这里氯化银和溴化银的溶解度都变小.
根据勒夏特列原理,向反应物中加入同种离子(AgNO3),迫使沉淀溶解平衡向左移动,所以两种沉淀的溶解度都小了.
根据沉淀溶解平衡常数(Ksp)
即Ksp(AgCl)=(氯离子浓度*银离子浓度)/氯化银浓度
AgCl=Cl-+Ag+
Ksp(AgBr)=(银离子浓度*溴离子浓度)/溴化银浓度
AgBr=Br-+Ag+
因为Ksp(AgCl)大于Ksp(AgBr)
所以沉淀向(AgBr)移动 选B1年前查看全部
- 30℃时,甲杯中盛有80克食盐饱和溶液,乙杯中盛有40克食盐饱和溶液.若各自蒸发掉20克水后再冷却到30℃时,甲杯中析出
30℃时,甲杯中盛有80克食盐饱和溶液,乙杯中盛有40克食盐饱和溶液.若各自蒸发掉20克水后再冷却到30℃时,甲杯中析出m1克食盐晶体,乙杯中析出m2克食盐晶体,则m1与m2的大小关系是(填大于、小于、相等)__________________.30℃时食盐的溶解度是_____________________(用含有m1或m2的式子表示).
是5m1,我要解题的思路和过程 kjwdszy1年前1
kjwdszy1年前1 -
 鱼翅 共回答了17个问题
鱼翅 共回答了17个问题 |采纳率88.2%1因为都是饱和溶液,质量分数相等,蒸发同样多的水,析出的晶体相同.所以相等.
2.因为20克水溶解m1克盐饱和,而都是饱和溶液,质量分数相等,所以设溶解度为x,
m2/(m2+20)=x/(x+100),解得x=5m1
(问一句,你也是初二的吗)1年前查看全部
- 将足量的下列物质放入水中 其中不能形成饱和溶液的是
将足量的下列物质放入水中 其中不能形成饱和溶液的是
A nacl和水 B ca(oh)2 和水 C kno3和水 D酒精和水 为什么 一个一个解释 xmcissy1年前1
xmcissy1年前1 -
 zhubenjun 共回答了18个问题
zhubenjun 共回答了18个问题 |采纳率94.4%因为饱和的定义是再加入该物质会析出,而酒精与水是互溶的,加入无限多的酒精也不会析出1年前查看全部
- 溶解度变小,原来的饱和溶液质量分数怎么变
 优雅的mm1年前1
优雅的mm1年前1 -
 陈鹏123 共回答了16个问题
陈鹏123 共回答了16个问题 |采纳率93.8%不变1年前查看全部
- 关于溶液下列说法正确的是什么?关于溶液下列说法正确的是:A 饱和溶液一定是浓溶液B T摄氏度时,100克某物质的饱和溶液
关于溶液下列说法正确的是什么?
关于溶液下列说法正确的是:
A 饱和溶液一定是浓溶液
B T摄氏度时,100克某物质的饱和溶液中含该物质18克,则该物质在T摄氏度时的溶解度为18克.
C 饱和溶液指一定温度下一定量溶剂中不能继续溶解某种物质的溶液.
D 不饱和溶液加溶剂可以变为饱和溶液
(注:最好是有说明.) louyizhi1年前1
louyizhi1年前1 -
 hahali163 共回答了24个问题
hahali163 共回答了24个问题 |采纳率83.3%C
A错,如果溶解度小,饱和溶液也是稀溶液,比如氢氧化钙溶液.
B错,100克水中溶解18克,则溶解度为18克,即118克饱和溶液中含有18克的话,溶解度才是18克.
C对
D错,加溶质才有可能1年前查看全部
- 33度时,有250克硝酸钾溶液,若向该溶液加入30克硝酸钾,恰好成为饱和溶液,若原溶液恒温蒸发掉60克水也恰好成为饱和溶
33度时,有250克硝酸钾溶液,若向该溶液加入30克硝酸钾,恰好成为饱和溶液,若原溶液恒温蒸发掉60克水也恰好成为饱和溶液,求33度时硝酸钾的溶解度
 muxi06231年前1
muxi06231年前1 -
 Metadata 共回答了20个问题
Metadata 共回答了20个问题 |采纳率95%说明30克硝酸钾加入60克水可以配成饱和溶液
所以溶解度是50克1年前查看全部
大家在问
- 1某厂制造某种商品,原来每件产品的成本100元,由于提高生产技术,所以连续两次降低成本,降低后的成本是64元
- 2希望有人能帮帮忙.太阳从东边升起,西边落下,是地球的自然现象,但在某些条件下,在纬度较高的地区上空飞行的飞机上,旅客可以
- 3某工厂排放的废水中含有硫酸,原来采用氢氧化钠溶液处理,通过调节流量阀,最终排出的溶液呈中性
- 4甲、乙、丙三人各出9元钱合伙买了一批练习本,由于分配时甲比丙少拿15本,乙和丙拿的一样多,因此,乙和丙
- 5人注视从远到近飞来的东西,眼中的晶状体是如何变化的?
- 6Hcl+Ca(oh)2的方程式是什么
- 7某物质能与水反应 将少量该物质加到饱和石灰水中 溶液变浑浊 该物质一定是二氧化碳
- 8小明将一张正方形纸片剪去一个宽为4厘米的长条后,再从剩下的长方形上剪去一个宽为5厘米的长条.如果两...
- 9食堂大米有150千克早上用了38千克下午用了35千克 全天一共用了总数的几分之几
- 10已知数列an中,a1=5,且an=2a(n-1)+2^n-1(n大于等于2,n属于正整数)
- 11由数字012345组成没有重复数字的六位数,其中个位数字小于十位数字的概率是多少
- 12由数字0,1,2,3,4,5可以组成无重复数字且奇偶数字相间的六位数的个数有( )
- 13机床厂造机床原来每台需要1.5吨钢材,经改造后实际每台节约0.25吨钢材,比原计划多造出10台机床.原计划能造多少机床?
- 14机床厂制造某种机床,计划每台用钢材1.5吨,实际每台节约0.25吨.结果共制作机床12台,比原计划多造多少台
- 15函数f(x)=4x的三次方 +ax的平方+bx+5的图象在x=1处的切线方程为y=-12x 求函数解析式
