用Mg、MgO、Mg(OH)2、H2SO4溶液、CuSO4溶液五种物质两两进行反应,能得到MgSO4的方法有( )
 RRRRRR2022-10-04 11:39:541条回答
RRRRRR2022-10-04 11:39:541条回答A. 三种
B. 四种
C. 五种
D. 无法确定

已提交,审核后显示!提交回复
共1条回复
 yaoli1983 共回答了11个问题
yaoli1983 共回答了11个问题 |采纳率90.9%- 解题思路:根据置换反应与复分解反应的条件进行分析即可:初中阶段常用的置换反应:金属和酸→盐和氢气(金属必须是在金属活动性表中氢前的金属,酸一般指稀硫酸和稀盐酸),金属和盐→新金属和新盐(在金属活动性顺序中,前面的金属可以把排在它后面的金属从盐溶液中置换出来,钾、钙、钠除外),复分解反应有:金属氧化物和酸、酸和碱、酸和盐、碱和盐、盐和盐反映,必须有水、沉淀或气体生成.
根据置换反应与复分解反应的条件,只发生四组反应:
Mg+H2SO4=MgSO4+H2↑,Mg+CuSO4=Cu+MgSO4,MgO+H2SO4=MgSO4+H2O,Mg(OH)2+H2SO4=MgSO4+2H2O,故选B.点评:
本题考点: 酸的化学性质;金属活动性顺序及其应用.
考点点评: 本题难度不是很大,主要考查了金属活动性顺序的应用、复分解反应的条件的应用,培养学生的应用知识的能力和解决问题的能力. - 1年前
相关推荐
- 我要过程!现有MG,+MGO,+MG(OH)2,MGCO3四种物质的混合物100克,测得其中镁元素的质量分数为24%,向
我要过程!
现有MG,+MGO,+MG(OH)2,MGCO3四种物质的混合物100克,测得其中镁元素的质量分数为24%,向其中加入足量的稀盐酸充分反应后将溶液蒸干,所得固体的质量为多少?
 周公达1年前1
周公达1年前1 -
 东兔西乌 共回答了16个问题
东兔西乌 共回答了16个问题 |采纳率81.3%Mg + 2HCl = MgCl2 + H2↑
MgO + 2HCl = MgCl2 + H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O
Mg、MgO、Mg(OH)2、MgCO3的混合物加入盐酸后蒸干,得到MgCl2,混合物中的镁元素都转移入MgCl2中,混合物中Mg元素的质量与产物MgCl2中Mg元素质量相等.
混合物中含有Mg元素:100g × 24% = 24g
含24gMg元素的MgCl2质量为:24g ÷ 24/95 = 95g
(但将MgCl2溶液蒸干得到MgCl2固体并不是太简单的,需要在HCl气氛中进行,不然MgCl2要水解,生成难溶的Mg(OH)Cl或者Mg2OCl2)1年前查看全部
- 下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2中
下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2中,既可以和盐酸反应也可以和NaOH溶液反应的是( )
A.①③④
B.①②③④
C.②③④
D.①③④⑤ ctsacyl1年前1
ctsacyl1年前1 -
 灵魂飞鸟 共回答了18个问题
灵魂飞鸟 共回答了18个问题 |采纳率94.4%解题思路:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应.以此解答本题.①NaHCO3属于弱酸的酸式盐,能和盐酸反应生成氯化钠、水和二氧化碳,也能和氢氧化钠溶液反应生成碳酸钠,故正确;
②(NH4)2SO4属于强酸的铵盐,和盐酸不反应,故错误;
③Al2O3属于两性氧化物,既能和盐酸反应生成盐和水,也能和氢氧化钠溶液反应生成盐和水,故正确;
④(NH4)2CO3属于弱酸的铵盐,能和盐酸反应生成氯化铵、二氧化碳和水,也能和氢氧化钠溶液反应生成氨气,故正确;
⑤Mg(OH)2属于碱,中和盐酸反应生成氯化镁,故错误;
故选A.点评:
本题考点: 两性氧化物和两性氢氧化物;钠的重要化合物.
考点点评: 本题考查了物质间的反应,明确物质的性质是解本题关键,能根据物质的性质总结规律,难度中等.1年前查看全部
- 您好~煮沸Mg(HCO3)2为什么生成Mg(OH)2而不是MgCO3?
 蜀中山人1年前1
蜀中山人1年前1 -
 gracefulling 共回答了18个问题
gracefulling 共回答了18个问题 |采纳率94.4%双水解所致.普通的化合物 比如醋酸钠,虽然水解,但是只是单水解,从而在加热蒸干的时候,水解被抑制,蒸干了,生成的原产物.而Mg(HCO3)2 因阳离子都可以水解,导致水解反应大大向正反有的方向进行,何况生成的2中产物一种是...1年前查看全部
- (2013•宁波模拟)实验室中利用复分解反应制取Mg(OH)2.实验数据和现象如下表所示(溶液体积均取用1mL):
(2013•宁波模拟)实验室中利用复分解反应制取Mg(OH)2.实验数据和现象如下表所示(溶液体积均取用1mL):
①现象Ⅲ是______;组别 药品1 药品2 实验现象 Ⅰ 0.01mol/L NaOH溶液 0.01mol/L MgCl2溶液 生成白色沉淀 Ⅱ 0.01mol/L氨水 0.01mol/L MgCl2溶液 无现象 Ⅲ 0.1mol/L氨水 0.1mol/L MgCl2溶液 ______ IV 0.1mol/L氨水 0.01mol/L MgCl2溶液 生成白色沉淀 V 0.01mol/L氨水 0.1mol/L MgCl2溶液 无现象
②如果向0.028mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到______mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)=5.6×10-12).
③MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq)+2NH3•H2O(aq)⇌2NH4+(aq)+Mg(OH)2(s)该反应化学平衡常数的表达式为K=c2(NH4+) c(Mg2+)×c2(NH3•H2O) ,列出该反应平衡常数K与Kb(NH3•H2O)、Ksp(Mg(OH)2)的关系式c2(NH4+) c(Mg2+)×c2(NH3•H2O) K=Kb2 Ksp K=.Kb2 Ksp  2624798421年前1
2624798421年前1 -
 TAEKWONDO1996 共回答了20个问题
TAEKWONDO1996 共回答了20个问题 |采纳率90%解题思路:①根据IV来分析判断,浓度较大时氨水与氯化镁反应生成氢氧化镁沉淀;
②根据Ksp(Mg(OH)2)和镁离子的浓度计算氢氧化钠的浓度;
③根据反应的方程式和K的含义书写表达式,固体不能写入表达式;①IV中0.1mol/L氨水与0.01mol/L MgCl2溶液混合产生表示沉淀,则Ⅲ中0.1mol/L氨水与0.1mol/L MgCl2溶液混合,溶液中的氢氧根离子和镁离子的浓度较大,二者结合生成白色沉淀Mg(OH)2;
故答案为:生成白色沉淀;
②向0.028mol/L的MgCl2溶液中加入等体积的NaOH溶液,则c(Mg2+)=0.014mol/L,所以c(OH-)=
5.6×10−12
0.014=2×10-5 mol/L;则原溶液中氢氧化钠的浓度为
4×10-5mol/L;
故答案为:4×10-5mol/L;
③MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq)+2NH3•H2O(aq)⇌2NH4+(aq)+Mg(OH)2(s),则该反应化学平衡常数的表达式为
K=
c2(NH4+)
c(Mg2+)×c2(NH3•H2O),
K=
c2(NH4+)
c(Mg2+)×c2(NH3•H2O)=
c2(NH4+).c2(OH−)
c(Mg2+).c2(NH3.H2O).c(OH−)=
Kb2
Ksp;
故答案为:
c2(NH4+)
c(Mg2+)×c2(NH3•H2O);K=
Kb2
Ksp.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了溶度积常数的含义和计算,题目难度中等,注意把握Ksp的表达式的书写方法,固体和纯液体不能写入Ksp的表达式.1年前查看全部
- 用Mg、MgO、MgCO3、Mg(OH)2、盐酸、CuCl2溶液来制取MgCl2的方法有( )种 A 、3 B、4 C、
用Mg、MgO、MgCO3、Mg(OH)2、盐酸、CuCl2溶液来制取MgCl2的方法有( )种 A 、3 B、4 C、5 D、6
我已经知道用前四个和盐酸都可以 这样已确定四个
还有疑问的是 1、Mg和CuCl2溶液,
2、MgCO3和CuCl2溶液,
我现在的疑问就是MgCO3和CuCl2溶液,
到底微溶制取难溶考虑在内吗?
到底是选C还是D? 诗郁儿1年前1
诗郁儿1年前1 -
 wangjian555 共回答了17个问题
wangjian555 共回答了17个问题 |采纳率82.4%这两种方法应该都是可以的,Mg可以把铜从溶液中置换出来,MgCO3和CuCl2溶液也是可以得到的,因为MgCO3的溶度积比CuCO3的大,也就是说CuCO3比MgCO3更容易沉淀.希望对你有用.1年前查看全部
- 现有六种物质:Fe粉、CO2、Mg(OH)2、CuSO4溶液、稀H2SO4和BaCl2溶液,两两混合后,能发生的反应有(
现有六种物质:Fe粉、CO2、Mg(OH)2、CuSO4溶液、稀H2SO4和BaCl2溶液,两两混合后,能发生的反应有(
现有六种物质:Fe粉、CO2、Mg(OH)2、CuSO4溶液、稀H2SO4和BaCl2溶液,两两混合后,能发生的反应有( )
A.5个
B.6个
C.7个
D.4个
 freedancer1年前1
freedancer1年前1 -
 阳光果冻520 共回答了23个问题
阳光果冻520 共回答了23个问题 |采纳率87%因Fe粉能与CuSO4溶液、稀H2SO4发生化学反应,则有2个反应;
CO2不能与任何物质反应;
Mg(OH)2是难溶性的碱,只能与稀H2SO4发生化学反应,则有1个;
CuSO4溶液能与BaCl2溶液发生化学反应,则有1个;
稀H2SO4能与BaCl2溶液发生化学反应,则有1个;
则两两混合,共发生5个反应,
故选A.1年前查看全部
- 取少量NAOH,CUSO4,NA2CO3,BACL2,MG(OH)2,稀HCL等六种物质的溶液,使其两两混合,发生的反应
取少量NAOH,CUSO4,NA2CO3,BACL2,MG(OH)2,稀HCL等六种物质的溶液,使其两两混合,发生的反应有几个?
如题 chenjia_1271年前3
chenjia_1271年前3 -
 Oo蓝色忧郁oO 共回答了24个问题
Oo蓝色忧郁oO 共回答了24个问题 |采纳率95.8%2 NaOH + CuSO4 = Cu(OH)2 ↓ + Na2SO4
NaOH + HCl = NaCl + H2O
CuSO4 + Na2CO3 = CuCO3↓ + Na2SO4
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
Na2CO3 + BaCl2 = BaCO3↓ + 2 NaCl
Na2CO3 + 2 HCl = 2 NaCl + CO2↑ + H2O
Mg(OH)2 + 2 HCl = MgCl2 + 2 H2O
一共7个反应1年前查看全部
- 海水中含量最多的物质是( )A.NaClB.CaCO3C.H2OD.Mg(OH)2
 davtin1年前1
davtin1年前1 -
 一路神风 共回答了14个问题
一路神风 共回答了14个问题 |采纳率100%解题思路:根据海水的成分分析,海水中主要是H2O,其次是NaCl.海水中的含水量是96.5%,所以海水中含量最多的物质应该是水.
故选C点评:
本题考点: 海洋中的资源.
考点点评: 海水中含量最多的是水,其次是氯化钠.1年前查看全部
- 高中化学沉淀的溶解部分已知常温下Mg(OH)2饱和溶液的pH是n,则在此温度下Mg(OH)2的溶解度就是多少?这类问题初
高中化学沉淀的溶解部分
已知常温下Mg(OH)2饱和溶液的pH是n,则在此温度下Mg(OH)2的溶解度就是多少?
这类问题初次遇到,不知怎么解,望高手赐教,谢谢!
急~~~~~~~~~~~~~~~~~~ hehhya1年前3
hehhya1年前3 -
 samuel 共回答了16个问题
samuel 共回答了16个问题 |采纳率75%Mg(OH)2溶解掉的部分完全电离:Mg(OH)2 = Mg2+ + 2OH-
pH是n ,c(H+)=10的-n次方 mol/L
c(OH-)=Kw/c(H+)=10的(n-14)次方 mol/L
设Mg(OH)2饱和溶液的的体积为 1L
OH-的物质的量 n(OH-)=10的(n-14)次方 mol
溶解的Mg(OH)2的物质的量=1/2* n(OH-)=1/2*10的(n-14)次方(根据电离方程式)
溶解的Mg(OH)2的的质量=58*1/2*10的(n-14)次方=29*10的(n-14) g
由于溶解的Mg(OH)2的的质量很小很小,所以可以近视地认为 1LMg(OH)2饱和溶液里水的质量等于1000g,那么100g水里溶解的Mg(OH)2质量就是2.9*10的(n-14) g,这个就是此温度下Mg(OH)2的溶解度1年前查看全部
- (2014•赤峰模拟)已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/10
(2014•赤峰模拟)已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g水;
②25℃时,亚磷酸(H3PO3,二元酸)的Ka1=3.7×10-2,Ka2=2.9×10-7;草酸(H2C2O4)的Ka1=5.6×10-2,Ka2=5.4×10-5
③相同条件下电离出S2-的能力:FeS>H2S>CuS,以下离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca+4OH-═Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S═CuS↓+2H+
C.FeS+2H+═H2S↑+Fe2+
D.H2PO3-+C2O42-═HPO32-+HC2O4- 妖精2401年前1
妖精2401年前1 -
 神行太保 共回答了7个问题
神行太保 共回答了7个问题 |采纳率57.1%解题思路:A.由①可知,Mg(OH)2更难溶,则碳酸氢镁与氢氧化钙反应生成碳酸钙、氢氧化镁、水;
B.由③可知,CuS易结合S2-;
C.由③可知,电离出S2-的能力:FeS>H2S;
D.由②可知,HC2O4-的Ka2=5.4×10-5>H2PO3-的Ka2=2.9×10-7.A.由①可知,Mg(OH)2更难溶,则碳酸氢镁与氢氧化钙反应生成碳酸钙、氢氧化镁、水,离子反应为Mg2++2HCO3-+2Ca+4OH-═Mg(OH)2↓+2CaCO3↓+2H2O,故A正确;B.由③可知,CuS易结合S2-,则Cu2++H2S═CuS↓+2H+,故...
点评:
本题考点: 离子方程式的书写;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查离子反应的书写,为高频考点,把握习题中的信息为解答的关键,侧重分析能力、信息处理能力及知识综合应用能力的考查,题目难度中等.1年前查看全部
- (1)已知某温度时,Ksp[Mg(OH)2]=4.0×10-11,Kw=1.0×10-13.在0.01mol•L-1Mg
(1)已知某温度时,Ksp[Mg(OH)2]=4.0×10-11,Kw=1.0×10-13.在0.01mol•L-1MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是______(已知lg2=0.3)
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.6×10-12,现在向0.001mol•L-1 K2CrO4和0.01mol•L-1 KCl混合液中滴加0.01mol•L-1 AgNO3溶液,刚出现Ag2CrO4沉淀时,溶液中c(Cl-)=______.(设混合溶液体积不变) 天美_1年前1
天美_1年前1 -
 zhanghu98 共回答了21个问题
zhanghu98 共回答了21个问题 |采纳率95.2%解题思路:(1)已知c(MgCl2)=0.01mol•L-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,可根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算c(OH-),然后根据Kw=1.0×10-13计算
c(H+),进而计算pH;
(2)根据刚出现Ag2CrO4沉淀时溶液中银离子的浓度结合Ksp(AgCl),求出Cl-的物质的量浓度.(1)已知c(MgCl2)=0.01mol•L-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,浓度应小于1.0×10-5mol/L,c(OH-)=
4.0×10−11
1×10−5mol/L=2×10-3mol/L,
c(H+)=
1.0×10−13
2×10−3mol/L=[1/2]×10-10mol/L,pH=10.3,
故答案为:10.3;
(2)Ag2CrO4饱和所需Ag+浓度c(Ag+)=
Ksp
c(CrO42−)=
1.6×10−12
0.001mol/L=4.×10-5mol/L,
由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度.
C(Cl-)=
Ksp
C(Ag+)=
1.8×10−10
4.×10−5=4.5×10-6 mol•L-1.
故答案为:4.5×10-6 mol•L-1.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了难溶电解质的溶解平衡及沉淀转化的本质,知道当刚出现Ag2CrO4沉淀时溶液中的银离子浓度,是利用Ksp(Ag2CrO4)求出的银离子浓度,不是用Ksp(AgCl)计算出的银离子浓度,然后利用Ksp(AgCl)计算出氯离子的浓度即可,这是解(2)题的关键.1年前查看全部
- MgO 怎么一部反应成Mg(OH)2
MgO 怎么一部反应成Mg(OH)2
给出方程 jzp11151年前2
jzp11151年前2 -
 alvin_ 共回答了18个问题
alvin_ 共回答了18个问题 |采纳率100%氧化镁+水=氢氧化镁1年前查看全部
- 海水中含量最多的物质是( )A. NaClB. CaCO3C. H2OD. Mg(OH)2
 hyw0080011年前1
hyw0080011年前1 -
 hebeixtlvsen 共回答了15个问题
hebeixtlvsen 共回答了15个问题 |采纳率93.3%解题思路:根据海水的成分分析,海水中主要是H2O,其次是NaCl.海水中的含水量是96.5%,所以海水中含量最多的物质应该是水.
故选C点评:
本题考点: 海洋中的资源.
考点点评: 海水中含量最多的是水,其次是氯化钠.1年前查看全部
- 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),要
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而C(Mg2+)不变,可采取的措施是( )
A. 加MgSO4
B. 加HCl溶液
C. 加NaOH
D. 加水 sweetvanessa1年前1
sweetvanessa1年前1 -
 k9mznj 共回答了16个问题
k9mznj 共回答了16个问题 |采纳率93.8%解题思路:要使Mg(OH)2固体减少,应使平衡向正向移动,但c(Mg2+)不变,说明仍为饱和溶液,可加入水,以此解答该题.A.加入固体MgSO4,增大了c(Mg2+),使溶解平衡逆向移动,悬浊液中Mg(OH)2固体的质量增加,故A错误;
B.加适量盐酸,消耗了氢氧根离子,使溶解平衡正向移动,悬浊液中Mg(OH)2固体的质量减少,c(Mg2+)增加,故B错误;
C.加入NaOH固体,增大了c(OH-),使溶解平衡逆向移动,悬浊液中Mg(OH)2固体的质量增加,c(Mg2+)减小,故C错误;
D.加入适量水,使溶解平衡正向移动,悬浊液中Mg(OH)2固体的质量减少,由于加水后仍是Mg(OH)2的饱和溶液,所以c(Mg2+)不变,故D正确;
故选:D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡和沉淀的转化,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意从平衡移动的角度解答该题.1年前查看全部
- Mg(OH)2 (Ca(OH)2)怎么除去括号里的杂质?
 hd131年前6
hd131年前6 -
 asolkj 共回答了29个问题
asolkj 共回答了29个问题 |采纳率93.1%加入过量氯化镁,因为Mg(OH)2比Ca(OH)2难溶,在溶液中反应总是向着更难溶的方向进行,所以这时就会发生离子方程式Mg(2+)+Ca(OH)2==Ca(2+)+Mg(OH)2.沉淀中也就只有Mg(OH)2,不知这样楼主能明白不1年前查看全部
- (2014•安徽模拟)已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定
(2014•安徽模拟)已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-12 mol•L-1
B.所加的烧碱溶液pH=12.0
C.所得溶液中由水电离产生的c(OH-)=1.0×10-12mol•L-1
D.所得溶液中的c(Mg2+)=5.6×10-8 mol•L-1 edmondchem1年前1
edmondchem1年前1 -
 czf_10 共回答了19个问题
czf_10 共回答了19个问题 |采纳率100%解题思路:A.根据c (H+)=10-PHmol•L-1计算;
B.根据烧碱与MgCl2溶液反应生成沉淀,消耗了NaOH溶液;
C.溶液中由水电离产生的c(OH-)水=c (H+)水=10-PHmol•L-1;
D.先根据水的离子积常数求出c(OH-),然后再溶度积计算.A.pH=12的溶液中,c (H+)=10-12mol/L,故A正确;
B.烧碱与MgCl2溶液反应生成沉淀,消耗了NaOH溶液,向MgCl2溶液中加NaOH溶液后混合溶液的pH=12,则所加NaOH溶液pH>12,故B错误;
C.溶液中由水电离产生的c(OH-)水=c (H+)水=10-12mol/L,故C正确;
D.溶液中c(OH-)=
1×10 −14
1.0×10 −12 =10-2mol/L,溶液中的c (Mg2+)=
5.6×10 −12
10−2×10 −2=5.6×10-8 mol•L-1,故D正确;
故选:B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;pH的简单计算.
考点点评: 本题考查难溶电解质的溶解平衡的相关计算和判断,题目难度中等,本题注意溶度积常数的利用.1年前查看全部
- 哪个酸性较强?那个碱性较强?(1)H2CO3和H3BO3 (2)HNO3和H3PO4 (3)NaOH和Mg(OH)2
 fjqlwlx1年前1
fjqlwlx1年前1 -
 rsljjd 共回答了14个问题
rsljjd 共回答了14个问题 |采纳率100%(1)H2CO3和H3BO3
碳酸酸性比硼酸要强
(2)HNO3和H3PO4
HNO3是强酸 H3PO4是中强酸 HNO3酸性更强
(3)NaOH和Mg(OH)2
NaOH是强碱 Mg(OH)2是中强碱 NaOH是碱性更强1年前查看全部
- 海水中镁离子的浓度为5*10-2mol/L,欲除去百分之99的镁离子,PH应大于多少?已知Ksp(Mg(OH)2)=1.
海水中镁离子的浓度为5*10-2mol/L,欲除去百分之99的镁离子,PH应大于多少?已知Ksp(Mg(OH)2)=1.8*10-11.答案是10.28,
 tidusfirst1年前1
tidusfirst1年前1 -
 豌豆0223 共回答了25个问题
豌豆0223 共回答了25个问题 |采纳率88%Mg2+ + 2 OH- = Mg(OH)2
Ksp = [Mg2+][OH-]^2 = 1.8*10^(-11)
除去99%的Mg2+,则剩余Mg2+的物质的量浓度[Mg2+] = 5*10^(-2) * 1% = 5*10^(-4) mol/L
所以[OH-] = √(1.8*10^(-11) ÷ 5*10^(-4) ) = 1.9*10^(-4) mol/L
pOH = - lg [OH-] = 3.72,
pH = 14 - 3.72 = 10.281年前查看全部
- 烧水用的铝壶内壁上的水垢[主要含CaCO3和Mg(OH)2],可用盐酸除去,但加入的盐酸不能过量.
烧水用的铝壶内壁上的水垢[主要含CaCO3和Mg(OH)2],可用盐酸除去,但加入的盐酸不能过量.
(1)简要分析盐酸不能过量的原因,并写出有关反应的化学方程式______;
(2)写出盐酸除去水垢反应的化学方程式______. 不忍远离1年前1
不忍远离1年前1 -
 23sd12fa3 共回答了16个问题
23sd12fa3 共回答了16个问题 |采纳率100%解题思路:弄清能够和酸发生反应的物质:酸碱指示剂、活泼金属、金属氧化物、碱、盐及物质间反应的条件.(1)由于金属铝是活泼金属,能与稀盐酸反应,因此除水垢时盐酸不能过量,否则过量的盐酸就和铝壶反应.
故答案为:2Al+6HCl═2AlCl3+3H2↑.
(2)由于水垢中的碳酸钙是难溶性的碳酸盐,氢氧化镁是一种碱,都可以和酸溶液反应.
故选CaCO3+2HCl=CaCl2+H2O+CO2↑; Mg(OH)2+2HCl=MgCl2+2H2O点评:
本题考点: 酸的化学性质;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 主要考查了酸的化学性质及物质间反应的条件,培养学生应用知识解决问题的能力.1年前查看全部
- (2009•宣城三模)在一定温度下,氢氧化镁存在如下沉淀溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq
(2009•宣城三模)在一定温度下,氢氧化镁存在如下沉淀溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq)试推断氢氧化镁在下列物质中的溶解度最大的是( )
A.0.1mol•L-1MgCl2溶液
B.0.1mol•L-1KOH溶液
C.0.1mol•L-1KCl溶液
D.0.1mol•L-1NH4Cl溶液 重庆麻辣烫1年前0
重庆麻辣烫1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 镁和沸水反应Mg(OH)2沉淀吗,为什么?
 dd人1年前2
dd人1年前2 -
 dj7xr 共回答了21个问题
dj7xr 共回答了21个问题 |采纳率81%沉淀 因为Mg(OH)2难溶
楼上错了 Mg也可以和水加热反应
加热
Mg+2H2O = Mg(OH)2+H2↑ 但是Mg(OH)2 沉淀不需要打沉淀符号 因为Mg是固体1年前查看全部
- 已知:Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12;溶液中某种离子的浓度
已知:Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12;溶液中某种离子的浓度小于1.0×10-5mol•L-1,可认为该离子不存在.现有1L含有Mg2+、Ca2+分别为0.05mol和0.001mol的某溶液,向其中加入4.2g NaOH固体,充分反应后过滤得到滤液M和沉淀N.下列说法不正确的是( )
A.加入NaOH过程中,首先生成的是溶度积较小的Mg(OH)2沉淀
B.滤液M中无Mg2+剩余
C.沉淀N中含有Mg(OH)2和Ca(OH)2
D.继续向M中加入NaOH溶液,溶液会变浑浊,生成Ca(OH)2沉淀 稻草人971年前1
稻草人971年前1 -
 sari2502 共回答了20个问题
sari2502 共回答了20个问题 |采纳率90%解题思路:c(OH-)=
=0.105mol/L,4.2g 40g/mol 1L
A.Ca(OH)2和Mg(OH)2组成相似,溶度积越小,越易生成沉淀;
B.根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算;
C.根据Mg2+、Ca2+的物质的量结合溶度积判断反应的程度;
D.溶液中含有较多的钙离子,溶液会变浑浊,应生成Ca(OH)2沉淀.c(OH-)=
4.2g
40g/mol
1L=0.105mol/L,
A.Ca(OH)2和Mg(OH)2组成相似,溶度积的计算公式类似,则溶度积越小,越易生成沉淀,故A正确;
B.首先发生Mg2++2OH-=Mg(OH)2↓,反应后剩余c(OH-)=0.105mol/L-0.1mol/L=0.005mol/L,则Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.61×10-12,
可解得c(Mg2+)=
5.61×10−12
0.0052=0.2244×10-6mol•L-1<1.0×10-5mol•L-1,则无Mg2+剩余,故B正确;
C.反应后剩余c(OH-)=0.105mol/L-0.1mol/L=0.005mol/L,则c(Ca2+)×c2(OH-)=0.001×0.0052=2.5×10-8<Ksp[Ca(OH)2],没有Ca(OH)2生成,故C错误;
D.继续向M中加入NaOH溶液,溶液中含有较多的钙离子,溶液会变浑浊,应生成Ca(OH)2沉淀,故D正确.
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡以及转化等知识,题目难度中等,注意根据溶度积常数计算并进行判断,答题中注意梳理做题思路.1年前查看全部
- NH4Cl与Mg(oH)2反映的化学方程式是什么?
 zjsafeway1年前4
zjsafeway1年前4 -
 songacha 共回答了20个问题
songacha 共回答了20个问题 |采纳率95%楼主有条件吗?
没有条件是不反应的,一楼三楼的都胡说
在溶液中Mg(oH)2是沉淀不会反应
如果是固体加热的话Mg(oH)2部分变成MgO
部分和NH4Cl反应
2NH4Cl+Mg(OH)2——MgCl2+2NH3(气体符号)+2H2O1年前查看全部
- 为什么这个方程式不是复分解反应?Mn(OH)2+MgCl2=MnCl2+Mg(OH)2↓
为什么这个方程式不是复分解反应?Mn(OH)2+MgCl2=MnCl2+Mg(OH)2↓
为什么这个方程式不是复分解反应?
Mn(OH)2+MgCl2=MnCl2+Mg(OH)2↓ Jay_07111年前1
Jay_07111年前1 -
 120028 共回答了20个问题
120028 共回答了20个问题 |采纳率85%要求两种反应物均可溶,生产物中有沉淀或气体才能发生,属于复分解反应
复分解反应发生的条件:
生成物起码具备下列三个条件之一:① 有沉淀析出;② 有气体放出;③ 有水生成.1年前查看全部
- (2011•绵阳)人们常在可燃物建筑材料中添加阻燃剂以防止火灾,Mg(OH)2是一种常见的阻燃剂,在380℃时分解成水蒸
(2011•绵阳)人们常在可燃物建筑材料中添加阻燃剂以防止火灾,Mg(OH)2是一种常见的阻燃剂,在380℃时分解成水蒸气和耐高温的MgO,并吸收大量的热.下列说法错误的是( )
A.Mg(OH)2分解吸热能降低可燃物的着火点
B.Mg(OH)2分解吸热能降低可燃物的温度
C.Mg(OH)2分解的产物能使可燃物与氧气隔绝
D.MgCO3比CaCO3易分解,也可作阻燃剂 szjcf1年前1
szjcf1年前1 -
 wmbgmmt 共回答了30个问题
wmbgmmt 共回答了30个问题 |采纳率80%解题思路:根据灭火的原理:(1)清除可燃物或使可燃物与其他物品隔离,(2)隔绝氧气或空气,(3)使温度降到可燃物的着火点以下,解答本题.A、着火点是物质的固有的属性,是不会改变的,只能改变可燃物的温度,故A错误,
B、可以使温度降到可燃物的着火点以下,故B正确,
C、隔绝氧气或空气,故C正确,
D、碳酸镁和碳酸钙都不具有可燃性受热都会分解出氧化物,故D正确,
故选A.点评:
本题考点: 灭火的原理和方法.
考点点评: 本题考查了根据灭火原理的知识进行解题的能力.1年前查看全部
- Mg(OH)2是强碱还是弱碱?分NaHC03在水中的电离&水解情况.
 ee的圣徒1年前1
ee的圣徒1年前1 -
 wangpi2002 共回答了19个问题
wangpi2002 共回答了19个问题 |采纳率100%1年前查看全部
- 完成下列化学方程式Fe+ H2SO4=AI+ HCI=Fe2O3+ HCI=AL2O3+ H2SO4=Mg(OH)2+
完成下列化学方程式
Fe+ H2SO4=
AI+ HCI=
Fe2O3+ HCI=
AL2O3+ H2SO4=
Mg(OH)2+ H2SO4=
Ba(OH)2+ H2SO4=
Ba(NO3)4+ H2SO4=
BaCO3+ HNO3=
希望大家帮帮我!在线等!会做的赶紧给答案!谢谢啦! xzlkclk23jlkjfas1年前1
xzlkclk23jlkjfas1年前1 -
 interact2003 共回答了15个问题
interact2003 共回答了15个问题 |采纳率80%Fe+ H2SO4=FeSO4+H2↑
AI+ 6HCI=AlCl3+3H2↑
Fe2O3+ 6HCI=2FeCl3+3H2O
AL2O3+3H2SO4=AL2(SO4)3+3H2O
Mg(OH)2+ H2SO4=MgSO4+2H2O
Ba(OH)2+ H2SO4=BaSO4↓+2H2O
Ba(NO3)2+ H2SO4=BaSO4↓+2HNO3
BaCO3 +2HNO3 ==Ba(NO3)2 +H2O+CO2↑1年前查看全部
- 下列排序正确的是( )A.热稳定性:H2O>HF>H2SB.碱性:Mg(OH)2>Al(OH)3C.酸性:H2CO3>
下列排序正确的是( )
A.热稳定性:H2O>HF>H2S
B.碱性:Mg(OH)2>Al(OH)3
C.酸性:H2CO3>H3PO4>H2SO4
D.原子半径:N>C fclock1年前1
fclock1年前1 -
 开发区 共回答了23个问题
开发区 共回答了23个问题 |采纳率87%解题思路:A.元素的非金属性越强,其气氢化物的热稳定性越强;
B.元素金属性越强,最高价氧化物对应水化物的碱性越强,同周期元素金属性从左到右依次减弱;
C.元素的非金属性越强,最高价氧化物对应水化物的酸性越强;
D.同周期元素原子半径依次减小.A.元素的非金属性越强,其气氢化物的热稳定性越强,非金属性:F>O>S,所以热稳定性顺序:HF>H2O>H2S,A错误;
B.同周期元素金属性从左到右依次减弱,金属性:Mg>Al,所以碱性:Mg(OH)2>Al(OH)3,B正确;
C.元素的非金属性:C<P<S,所以酸性:H2CO3<H3PO4<H2SO4,C错误;
D.同周期元素原子半径依次减小,所以半径:N<C,D错误.
故:选D.点评:
本题考点: 元素周期律的作用.
考点点评: 本题考查了元素金属性、非金属性的判断依据、元素性质的递变规律,题目难度小属于基础题,注意理解并记住相应的递变规律.1年前查看全部
- 已知:25摄氏度时,Ksp:【Mg(OH)2】=5.61*10负12次方,Ksp【MgF2】=7.42*10负11次方
已知:25摄氏度时,Ksp:【Mg(OH)2】=5.61*10负12次方,Ksp【MgF2】=7.42*10负11次方
问:(1)25摄氏度时,Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大.
(2)25摄氏度时,在氢氧化镁悬浊液中加入氟化钠溶液后,氢氧化镁不可能转化为氟化镁.
1是对的2是错的,但是为什么呢?我觉得2是对的呀.
Ksp不能用来比较不同类型物质的溶解度大小,但是氢氧化镁和氟化镁算是不同类型的物质么?怎么样就算是不同类型的物质了呢?还有,如果算是不同类型的物质,那应该怎样转化才能比较它们的溶解度大小呢? 星星小丸子1年前2
星星小丸子1年前2 -
 mmfine 共回答了22个问题
mmfine 共回答了22个问题 |采纳率90.9%问得很辛苦吧
直接说题目.1是对的,2是错的,现在来解释一下.
(1)Mg(OH)2的悬浊液说明有Mg(OH)2的不溶物,即Mg(OH)2溶解是饱和的.加入NH4Cl固体后,强电解质嘛,相当于是加入了铵根离子,铵根离子发生水解与氢氧根离子结合,使得溶液中氢氧根离子的浓度降低,更多的镁离子将会溶解进来,所以镁离子浓度增大了.这个过程一定要很清楚,以后分析问题都是这个思路.
(2)同样是悬浊液,这次加入的是氟离子,虽然Ksp【MgF2】是要小于Ksp【Mg(OH)2】的,但是我们注意分析,只要氟离子浓度足够大,很少量的镁离子就能形成氟化镁沉淀,所以氢氧化镁转化成氟化镁完全是可行的,只是要求氟离子的浓度要足够高.
你最后面的问题,就不太好回答了,关于溶解度和Ksp的关系,不管你们课本上是怎么写的,你可以从本质上来看一下这个关系,溶解度是100g水所能溶解的溶质质量,Ksp(溶度积)就不多说了,是离子浓度的关系,离子浓度是离子物质的量和溶液体积之比,好吧,关系显得很凌乱了,我们这样想,如果已知某种难溶物质的溶度积,要求它的溶解度,我们必须知道物质的离子比例、摩尔质量,还要建立溶液体积和溶解了溶质的100g水的关系,定量计算时要列方程求解,当然也可以近似,忽略溶解的溶质的的质量(难溶嘛),再近似100g溶液就是0.1升,我们称这一串近似叫做“近似A”.此时所谓的同类型物质就有意义了,同类型的物质离子比例是相同的,摩尔质量有规律,比如氯化银、溴化银、碘化银,氢氧化镁、氢氧化钙,这样的物质可以在近似A的条件下分析,但是由于是近似,也并不严密,但是一般情况下还是比较可靠的.
综上所述,虽然溶解度和溶度积都反映了溶解性的大小,但是是从不同的角度进行度量,定量关系可以计算,过程比较繁琐,意义不大,定性可以在同类型物质间做近似分析.从考试的角度来看,从溶度积来分析溶解度的题目还是不多见的,因为这个本身就不严密,尤其是不同类型的物质之间,你只要知道他们两个没有确定的关系就好了,分析问题直接用溶度积,不用考虑溶解度.
有点乱,不明白的再追问吧1年前查看全部
- Al(OH)2受热,Al(OH)2分解不是同一反应么 MG(OH)2呢
 小mm的哥哥1年前2
小mm的哥哥1年前2 -
 腐草共萤对月华 共回答了10个问题
腐草共萤对月华 共回答了10个问题 |采纳率70%铝的化合价是+2?
Al(OH)3才对吧?
2Al(OH)3=△=Al2O3 +3H2O↑
铝的氢氧化物不稳定,受热会分解.受热和分解是同一反应.
氢氧化镁受热分Mg(OH)2=△=MgO+H2O↑1年前查看全部
- 初中化学,急求解答。为什么在久置的NaOH中加入盐酸后,一开始不产生气体 而 在Mg(OH)2和稀硫酸的混合溶液加入足量
初中化学,急求解答。
为什么在久置的NaOH中加入盐酸后,一开始不产生气体 而 在Mg(OH)2和稀硫酸的混合溶液加入足量Ba(OH)2会立刻生成沉淀。
氢氧化镁打错了,是硫酸镁(不含杂质) ee中的灯1年前1
ee中的灯1年前1 -
 bluestar1983 共回答了22个问题
bluestar1983 共回答了22个问题 |采纳率86.4%Mg(OH)2+H2SO4=MgSO4+2H2O,而MgSO4+Ba(OH)2=Mg(OH)2+BaSO4,而BaSO4是不溶于水的,是沉淀。
对于在久置的NAOH中加入盐酸不会立即有气泡的原因是:盐酸先和没变为Na2CO3的NaOH产生中和反应,然后再和Na2CO3产生反应,生产CO21年前查看全部
- 为什么离子化合物是强电解质?Mg(OH)2是离子化合物(离子化合物是强电解质),但是是弱碱属于弱电解质,到底是强电解质还
为什么离子化合物是强电解质?
Mg(OH)2是离子化合物(离子化合物是强电解质),但是是弱碱属于弱电解质,到底是强电解质还是弱电解质啊?
那为什么说离子化合物是强电解质呢 这句话是对的还是错的 wange4871年前1
wange4871年前1 -
 青风无情 共回答了14个问题
青风无情 共回答了14个问题 |采纳率92.9%你把问题想复杂啦!或者说你是想错了.是否是强电解质不在于碱性强弱,而是在于溶解于水的那部分物质电离了多少!所以你理解的不对,Mg(OH)2溶解度很小且溶于水的不完全电离,故,应是所弱电解质!
你只要记住一点吧:溶于水的部分电离的多就是强电解质,反之为弱电解质.只看溶于水后的那部分啊!1年前查看全部
- 由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%.取该混合物10g,将其投入110g的稀硫酸中恰
由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%.取该混合物10g,将其投入110g的稀硫酸中恰好完全反应,所得溶液中溶质的质量分数为( )
A. 12%
B. 24%
C. 20%
D. 30% 挑战之星1年前1
挑战之星1年前1 -
 超级咸鱼 共回答了27个问题
超级咸鱼 共回答了27个问题 |采纳率88.9%解题思路:根据镁元素的质量分数可计算镁元素的质量,利用反应后的溶质为硫酸镁,根据镁原子守恒来计算硫酸镁的质量,混合物与酸的质量和为溶液质量,最后计算溶质的质量分数.混合物中镁元素的质量为10g×48%=4.8g,
设恰好完全反应后溶液中硫酸镁的质量为xg,
由镁元素守恒可知,
Mg~MgSO4
24 120
4.8g x
[24/4.8g=
120
x]
解得x=24g,
反应后溶液质量为10g+110g=120g,
则溶液中溶质的质量分数为[24g/120g]×100%=20%,
故选:C.点评:
本题考点: 有关溶质质量分数的简单计算;质量守恒定律及其应用.
考点点评: 本题考查溶液中溶质质量分数的计算,学生应能利用元素守恒的方法来计算溶质的质量是解答中的关键,不可盲目利用化学方程式来计算溶质质量.1年前查看全部
- 水中的钙镁化合物会转化成Ca(OH)2和Mg(OH)2吗?是如何转化的?
 96星1年前1
96星1年前1 -
 lgw_2000 共回答了14个问题
lgw_2000 共回答了14个问题 |采纳率100%会转化,是和水中电离出来的氢氧根离子反应,但只是少量,可以忽略不计1年前查看全部
- 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙(CaCO3)和氢氧化镁(Mg(OH)2
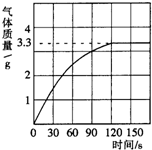 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙(CaCO3)和氢氧化镁(Mg(OH)2).他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙(CaCO3)和氢氧化镁(Mg(OH)2).他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是______g.
(2)水垢中碳酸钙的质量分数是多少?(CaCO3+2HCI═CaCI2+H2O+CO2↑) hunterhb1年前1
hunterhb1年前1 -
 赵旭 共回答了18个问题
赵旭 共回答了18个问题 |采纳率94.4%解题思路:(1)根据反应产生气体的情况图,当反应到120s时放出二氧化碳气体达最大值,为3.3g;
(2)放出二氧化碳达最大值时,水垢中碳酸钙完全反应,根据反应的化学方程式,由放出二氧化碳的质量计算出样品中碳酸钙质量,碳酸钙质量与水垢样品质量比可计算水垢中碳酸钙的质量分数.(1)由反应产生气体的情况图,可知12.5g水垢与盐酸反应后生成的二氧化碳最多是3.3g;
故答案为:3.3;
(2)设12.5g水垢中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x3.3g
[100/x=
44
3.3g]
x=7.5g
水垢中碳酸钙的质量分数[7.5g/12.5g]×100%=60%
答:
(1)3.3
(2)水垢中碳酸钙的质量分数是60%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 产生CO2气体的情况曲线折点表明此时放出气体二氧化碳达最大值,即水垢是碳酸钙完全反应.1年前查看全部
- (2012•济南)有一无色溶液X,分成三等分,向其中分别加入少量的BaSO4固体、CaCO3固体、Mg(OH)2固体,产
(2012•济南)有一无色溶液X,分成三等分,向其中分别加入少量的BaSO4固体、CaCO3固体、Mg(OH)2固体,产生的现象如下表.则该无色溶液X是下列各项中的( )
加入物质 BaSO4固体 CaCO3固体 Mg(OH)2固体 现象 固体仍难溶解 固体逐渐溶解,产生无色气体 固体溶解
A.水
B.稀盐酸
C.Na2CO3溶液
D.酚酞试液 天剑ww1年前1
天剑ww1年前1 -
 h_nocile 共回答了30个问题
h_nocile 共回答了30个问题 |采纳率83.3%解题思路:根据BaSO4固体是不溶于酸的白色沉淀、CaCO3固体不溶于水但能溶于酸、Mg(OH)2固体不溶于水但能溶于酸.A、BaSO4固体、CaCO3固体、Mg(OH)2固体都是不溶于水的沉淀,而题干中碳酸钙和氢氧化镁都溶解了,所以不可能是水,故A错;B、BaSO4固体是不溶于酸的白色沉淀、CaCO3固体不溶于水但能溶于酸,与盐酸反应生成氯化钙、...
点评:
本题考点: 物质的鉴别、推断.
考点点评: 解答本题关键是要知道一般的沉淀不溶于水,但能溶于酸,硫酸钡沉淀和氯化银沉淀是既不溶于水,也不溶于酸.1年前查看全部
- 一些化合物在相同温度下的溶解能力:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,FeS>CuS,不正确的是( )
一些化合物在相同温度下的溶解能力:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,FeS>CuS,不正确的是( )A
一些化合物在相同温度下的溶解能力:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,FeS>CuS,不正确的是( )
A.Zn2++S2-+2H2O→Zn(OH)2↓+H2S↑
B.Mg2++2HCO32-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O
C.Cu2++FeS→CuS+Fe2+
D.Cu2++H2S→CuS+2H+
 lykgl1年前1
lykgl1年前1 -
 tianshui2008 共回答了27个问题
tianshui2008 共回答了27个问题 |采纳率85.2%A.由Zn(OH)2>ZnS可知,则ZnS不会与H2O反应生成Zn(OH)2,故A错误;B.由溶解性MgCO3>Mg(OH)2可知,发生Mg2++2HCO32-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O,故B正确;C.由FeS>CuS可知,能发生沉淀转化为...1年前查看全部
- 化学方程式Mg+CuCl=还有Mg(OH)2+HCl=
 gqf681年前1
gqf681年前1 -
 夜阑若水 共回答了17个问题
夜阑若水 共回答了17个问题 |采纳率88.2%Mg+CuCl2=MgCl2+Cu
Mg(OH)2+2HCl=MgCl2+2H2O1年前查看全部
- 已知:25°C时,Ksp[Mg(OH)2]=5.61*10^-12 ,Ksp[ MgF2]=7.42*10^-11.下列
已知:25°C时,Ksp[Mg(OH)2]=5.61*10^-12 ,Ksp[ MgF2]=7.42*10^-11.下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20ml 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
答案是选B可是我不明白D为什么错呀,怎么说Mg(OH)2的Ksp比MgF2的Ksp小了一个数量级,沉淀应该是向溶解度减少的方向转化的呀.如果是Mg(OH)2转化为MgF2那不就是往溶解度增大的方向转化了吗? 阿虎杰08271年前1
阿虎杰08271年前1 -
 爱的跨越 共回答了17个问题
爱的跨越 共回答了17个问题 |采纳率88.2%两个只相差10倍,所以是可以转化的
基础知识,是BaSO4的Ksp比BaCO3小,是1/50,但是饱和Na2CO3溶液可以将BaSO4转化为BaCO3
此处类似1年前查看全部
- 已知在温室时,Mg(OH)2的溶度积K=5.6×10﹣¹²,求室温下Mg(OH)2饱和溶液中Mg²﹢和OH﹣的物质的量浓
已知在温室时,Mg(OH)2的溶度积K=5.6×10﹣¹²,求室温下Mg(OH)2饱和溶液中Mg²﹢和OH﹣的物质的量浓度
 zhuzhang1年前1
zhuzhang1年前1 -
 宴平乐 共回答了15个问题
宴平乐 共回答了15个问题 |采纳率93.3%Mg(OH)2的Ksp=c(Mg2+).c2(OH-)=5.6*10-12
假设镁离子浓度为X,则氢氧根的浓度为2X(根据氢氧化镁的电离式)
带入上式即可解得,求出应该是约数1年前查看全部
- 下列离子方程式书写正确的是( )A.硫酸镁与氢氧化钾反应:MgSO4+2OH-=Mg(OH)2↓+SO42-B.氧化铜
下列离子方程式书写正确的是( )A.硫酸镁与氢氧化钾反应:MgSO4+2OH-=Mg(OH)2↓+SO42-B.氧化铜与
下列离子方程式书写正确的是( )
A.硫酸镁与氢氧化钾反应:MgSO4+2OH-=Mg(OH)2↓+SO42-
B.氧化铜与稀硫酸反应:O2-+2H+=H2O
C.碳酸钙与醋酸反应:CO32-+2H+=CO2↑+H2O
D.氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O
 只想和他在一起1年前1
只想和他在一起1年前1 -
 ccnyky 共回答了26个问题
ccnyky 共回答了26个问题 |采纳率92.3%A.硫酸镁与氢氧化钾反应的离子方程式:Mg2++2OH-=Mg(OH)2↓,故A错误;
B.氧化铜与稀硫酸反应的离子方程式:CuO+2H+=H2O+Cu2+,故B错误;
C.碳酸钙与醋酸反应离子方程式:CaCO3+2CH3COOH=CO2↑+Ca2++2CH3COO-+H2O,故C错误;
D.氧化亚铁溶于稀盐酸反应的离子方程式:FeO+2H+=Fe2++H2O,故D正确;
故选:D.1年前查看全部
- 电解MgCl2和Mg(OH)2电解MgCl2溶液 和Mg(OH)2分别得到什么.其中我记得MgCl2溶液不能得到Mg,为
电解MgCl2和Mg(OH)2
电解MgCl2溶液 和Mg(OH)2分别得到什么.
其中我记得MgCl2溶液不能得到Mg,为什么? 小卢手机1年前1
小卢手机1年前1 -
 雪狼子007 共回答了17个问题
雪狼子007 共回答了17个问题 |采纳率88.2%1电解MgCl2溶液不能得到纯净的单质Mg
因为:电解时,阳极因为氯离子放电,产生氯气,而阴极处是水中的H+放电产生H2,这样H2的增加破坏了水原来的平衡:H2O≈H+ +OH-,(由于H+减少变为H2,使这个平衡向右移动,结果使得溶液中的OH-浓度增加,当OH-增加到一定程度时会和其中的镁离子结合成Mg(OH)2↓不溶于水)
2氢氧化镁不可能电解
原因:1、氢氧化镁固体不导电
2、氢氧化镁不溶
3、氢氧化镁在熔融前分解 (氢氧化镁受热容易分解)1年前查看全部
- 焦亚硫酸钾 和 CaCO3 加热生成什么?焦亚硫酸钾和 Mg(OH)2加热生成什么?
 yinggangchenggon1年前1
yinggangchenggon1年前1 -
 db1753213 共回答了15个问题
db1753213 共回答了15个问题 |采纳率93.3%复分解反应,生成焦亚硫酸钙和碳酸钾
第二个是焦亚硫酸镁和氢氧化钾
绝对正确我们老师说过1年前查看全部
- 下列说法正确的是( )A.Li是最活泼金属,F是最活泼非金属B.Mg(OH)2碱性比Ca(OH)2强C.X2+的核外电
下列说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.X2+的核外电子数目为18,则X在第四周期第ⅡA族
D.H2S的稳定性比HCl强 飘漂在ss1年前1
飘漂在ss1年前1 -
 aaavv 共回答了17个问题
aaavv 共回答了17个问题 |采纳率94.1%解题思路:A.最活泼的金属在元素周期表的左下角,最活泼的非金属元素在周期表的右上角;
B.根据同主族元素的金属性的递变规律分析;
C.X2+的核外电子数目为18,则原子核外应有4个电子层,最外层电子数为2;
D.根据同周期元素的非金属性的递变规律解答.A.元素周期表中,同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的金属性逐渐增强,非金属性逐渐减弱,则最活泼的金属在元素周期表的左下角,最活泼的非金属元素在周期表的右上角,故A错误;
B.同主族元素从上到下元素的金属性逐渐增强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则Mg(OH)2碱性比Ca(OH)2弱,故B错误;
C.X2+的核外电子数目为18,则原子核外应有4个电子层,最外层电子数为2,应位于周期表第四周期第ⅡA族,故C正确;
D.同周期元素从左到右元素的非金属性逐渐增强,非金属性越强,对应氢化物的稳定性越强,则H2S的稳定性比HCl弱,故D错误.
故选C.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期律的递变规律,题目难度不大,注意元素的金属性、非金属性与对应单质、化合物的性质之间关系的判断.1年前查看全部
- (2008•黑龙江)长时间使用的热水壶底部有一层水垢,主要成分是CaC03和Mg(OH)2.学校化学研究性学习小组同学通
(2008•黑龙江)长时间使用的热水壶底部有一层水垢,主要成分是CaC03和Mg(OH)2.学校化学研究性学习小组同学通过实验想测定水垢中CaC03的含量为多少.他们取200g水垢,加入过量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表
计算:①4min后,水垢中的CaC03是否反应完全?时间/min 1 2 3 4 5 生成CO2的质量/g 30 50 60 66 66
②该水垢中CaC03的质量分数是多少? jsy0yy1年前1
jsy0yy1年前1 -
 已知的未知的 共回答了19个问题
已知的未知的 共回答了19个问题 |采纳率84.2%解题思路:根据是否继续产生二氧化碳对表中数据进行对比分析,可以确定碳酸钙完全反应时的时间.
由生成二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出水垢中碳酸钙的质量分数.①从测量数据表中看出,4分钟以后二氧化碳的质量不再增加,说明水垢中的CaC03已经反应完全,最后只能产生CO2气体66g.
②设水垢中CaC03的质量分数为x.
CaC03+2HCl═CaCl2+H2O+CO2↑
100 44
200g×x 66g
[100/44]=[200g×x/66g],
x=75%
答:4分钟后,水垢中的CaC03反应完全,该水垢中CaC03的质量分数为75%.点评:
本题考点: 实验探究物质的组成成分以及含量;实验数据处理或者误差分析的探究;碳酸钠、碳酸氢钠与碳酸钙;根据化学反应方程式的计算.
考点点评: 本题主要考查对表格数据比较分析能力和有关化学方程式的计算,难度较大.1年前查看全部
- (2010•漳州二模)25℃时,已知:Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10
(2010•漳州二模)25℃时,已知:Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是( )
A. 饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 在Mg(OH)2悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化为MgF2
C. 在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
D. Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小 漂在海角边1年前1
漂在海角边1年前1 -
 修养与素质 共回答了17个问题
修养与素质 共回答了17个问题 |采纳率100%解题思路:根据氢氧化镁与氟化镁的化学式相似,由题中数据可知氢氧化镁的溶度积小,其饱和溶液中Mg2+浓度较小;氢氧化镁存在着微弱的电离,产生的氢氧根和氯化铵电离出来的铵根结合,产生一水合氨,使平衡正向移动,所以镁离子的浓度增加;Ksp只与温度有关;不管氢氧化镁的ksp有多小,只要加入的氟化钠溶液的浓度适合的话,使c(Mg2+)×c(F-)2>7.42×10-11,可以使氢氧化镁转化为氟化镁沉淀.A、因氢氧化镁溶度积小,由Ksp计算则其Mg2+浓度小,故A错误;
B.二者Ksp接近,使用浓NaF溶液可以使氢氧化镁转化,故B错误;
C.NH4+结合OH-使氢氧化镁溶解平衡正向移动,Mg2+增大,故C正确;
D.Ksp不随浓度变化,只与温度有关,故D错误.
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡和沉淀转化,注意比较两种物质的溶度积大小,特别提醒是的不同物质的溶度积比较应是在化学式相似的情况下具有可比性.1年前查看全部
- 向少量Mg(OH)2固体中加饱和氯化铵或醋酸铵溶液,固体完全溶解,用平衡移动原理解释
 shang1112221年前3
shang1112221年前3 -
 lalala_j 共回答了11个问题
lalala_j 共回答了11个问题 |采纳率90.9%答:Mg(OH)2 ↔Mg2++2OH¯
加入饱和NH4Cl后,NH4+结合OH¯,使OH¯浓度减小,平衡右移,所以Mg(OH)2溶解.
加入NH4Ac后,NH4+结合OH¯,使OH¯浓度减小,平衡右移,所以Mg(OH)2溶解.1年前查看全部
- 长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定
长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定
水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量,结果如下表:
时间/min 1 2 3 4 5质量/g 30 50 60 66 66
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3(填已或未)反应完全?
2)该水垢中CaCO3的质量分数是多少?考点:碳酸钠、碳酸氢钠与碳酸钙;根据化学反应方程式的计算. 爱神眼泪1年前1
爱神眼泪1年前1 -
 redsekkou 共回答了12个问题
redsekkou 共回答了12个问题 |采纳率83.3%(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3(已)反应完全.
(2)设这种石灰石矿石中碳酸钙的质量分数为X%
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
200×X% 66
100/200×X% =44/66
X=75%1年前查看全部
- (2013•河南模拟)已知298K时Mg(OH)2的溶度积常数Ksp=5.6×10-12,MgCO3的溶度积常数Ksp=
(2013•河南模拟)已知298K时Mg(OH)2的溶度积常数Ksp=5.6×10-12,MgCO3的溶度积常数Ksp=6.8×10-6.取适量的MgCl2溶液加入一定量的烧碱溶液达到沉淀溶解平衡状态测得溶液的pH=13.0.则下列说法中不正确的是( )
A.Mg(OH)2是水垢的成分之一
B.MgCO3悬浊液中加入适量的烧碱溶液可以生成Mg(OH)2沉淀
C.沉淀溶解平衡时溶液中的c(Mg2+)=5.6×10-10 mol/L
D.298 K时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)大 frgthy111年前1
frgthy111年前1 -
 lzr328 共回答了12个问题
lzr328 共回答了12个问题 |采纳率83.3%解题思路:A、氢氧化镁溶解度小于碳酸镁,生成的碳酸镁加热会转化为氢氧化镁;
B、氢氧化镁溶解度小于碳酸镁,MgCO3悬浊液中加入适量的烧碱会发生沉淀转化;
C、依据氢氧化镁的溶度积常数结合溶液PH计算氢氧根离子浓度,计算得到镁离子浓度;
D、依据溶度积常数计算分析.A、水中的碳酸氢镁受热分解生成碳酸镁会继续反应生成更难溶的氢氧化镁沉淀,所以Mg(OH)2是水垢的成分之一,故A正确;
B、氢氧化镁溶解度小于碳酸镁,MgCO3悬浊液中加入适量的烧碱会发生沉淀转化,生成Mg(OH)2沉淀,故B正确;
C、取适量的MgCl2溶液加入一定量的烧碱溶液达到沉淀溶解平衡状态测得溶液的pH=13.0,溶液中c(OH-)=0.1mol/L,由氢氧化镁溶度积常数计算镁离子浓度,Ksp=c(Mg2+)c2(OH-)=5.6×10-12 ,代入计算得到c(Mg2+)=5.6×10-10 mol/L,故C正确;
D、298K时Mg(OH)2的溶度积常数Ksp=5.6×10-12,Ksp=c(Mg2+)c2(OH-)=5.6×10-12,c(Mg2+)=1.1×10-4mol/L;MgCO3的溶度积常数Ksp=6.8×10-6.Ksp=c(Mg2+)c(CO32-)=6.8×10-6,得到c(Mg2+)=2.6×10-3mol/L,则298 K时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)小,故D错误;
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡的相关计算和判断,题目难度中等,本题注意溶度积常数的利用.1年前查看全部
大家在问
- 1在△ABC内任取一点P.探究∠APB与∠C的大小关系,并说明你的理由.
- 2好读书 不读好书 好读书 不读好书怎么读
- 3Ⅰ.在一定条件下,在一容积可变的密闭容器中,将SO 2 和O 2 混合发生反应:
- 4英国过年习俗(中英文)急
- 5请问?今晚月食是几点,
- 6浮力问题什么时候用物体本身的重量,什么时候用排开液体体积
- 7长者子捉船的概述话少一点,最好是一句话到三句话,但要求精练,好的我会追加分数的,帮个忙,
- 8The coal miners________in the coal mine for 10 hours before
- 9比喻目光短浅,所见有现的成语
- 10用英语ring(戒指)造句
- 11《归园田居》 丛“无尘杂”,到“有余闲”,最后到“返自然” 试说说这三者之间的关系?
- 12来啊‘‘‘‘英语的mean,decorate,give,want,bring,cut,把这些动词造句‘‘‘每个动词造2句
- 13卡西欧 FX-5800P我是一个测量员我买个卡西欧FX-5800P计算器 求一个坐标计算公式 我工作一般用全站仪放样 需
- 14重庆工商大学英语须口试吗?
- 15用英语翻译下列句子:现在人们不珍惜用水,用过的污水随便倒,工厂到处排放污水,导致水污染严重.

