某一元酸HX配成0.1mol/L的溶液,测得其ph=4那么这是强还是弱电解质?怎么判断
 2007年4月14日2022-10-04 11:39:541条回答
2007年4月14日2022-10-04 11:39:541条回答这个一元酸HX电离可逆吗

已提交,审核后显示!提交回复
共1条回复
 silent_day 共回答了14个问题
silent_day 共回答了14个问题 |采纳率100%- 弱电解质.
强电解质的ph应该等于1.
是不完全电离,也就是可逆. - 1年前
相关推荐
- 某一元酸HX配成0.1mol/L的溶液,测得其PH=4,试写出它的电离方程式
 八三佳人1年前1
八三佳人1年前1 -
 rong122 共回答了17个问题
rong122 共回答了17个问题 |采纳率88.2%PH=4说明氢离子浓度为10^(-4)mol/L,而HX的浓度为0.1mol/L,说明该酸是一种弱酸,且电离度为10^(-4)/0.1=10^(-3),电离方程式为HX=H+ +X-(此反应可逆)1年前查看全部
- 是什么决定一元酸\二元酸\三元酸的分类的?
 liyanjin1年前1
liyanjin1年前1 -
 飘过星空的泪 共回答了19个问题
飘过星空的泪 共回答了19个问题 |采纳率78.9%1 常规上是指最多能电离出的氢离子数(看有几个氢离子)
如一元强酸:盐酸,二元强酸:硫酸,三元弱酸:磷酸(可电离出一到三个氢离子,视环境而定)
2 例外的:硼酸(H3BO3)结合一个水电离出的氢氧根,即水解出一个氢离子.所以是一元酸1年前查看全部
- 等体积等浓度的弱酸和强酸,谁的H+浓度大?(都是一元酸)
等体积等浓度的弱酸和强酸,谁的H+浓度大?(都是一元酸)
比如1mol/L的HA弱酸,这个1mol/L指的是未电离时的浓度吗? 世外闲人11年前2
世外闲人11年前2 -
 耀眼的钻石 共回答了19个问题
耀眼的钻石 共回答了19个问题 |采纳率89.5%是未电离的,所以,是强酸大1年前查看全部
- 怎样 区分一种一元酸是强酸还弱酸
 苍穹下漫步1年前3
苍穹下漫步1年前3 -
 53271007 共回答了18个问题
53271007 共回答了18个问题 |采纳率94.4%这个并不难啊.
取一定量的这种酸,再取相同物质的量的NaOH,两者进行反应.得到的为两者的盐.用pH试纸去测这个盐的pH值.若为中性,则酸为一元强酸,若盐为碱性,则说明是一元弱酸.1年前查看全部
- 一元酸被一元强酸准确滴定的条件是什么
 hainanhyh1年前1
hainanhyh1年前1 -
 linzi133 共回答了20个问题
linzi133 共回答了20个问题 |采纳率95%酚酞试剂由无色变为红色并持续半分钟不褪色1年前查看全部
- 一元酸 一元碱 二元碱 二元酸 三元酸是什麽呀
 猪喊鸣1年前1
猪喊鸣1年前1 -
 culimuch 共回答了26个问题
culimuch 共回答了26个问题 |采纳率96.2%1元碱就是1mol该碱含有1molOH-,酸也是一样,以此类推.1年前查看全部
- 常温下,0.1mol/L某一元酸(HA)溶液中 c(OH-)/c(H+)=1×10-8,下列叙述正确的是
常温下,0.1mol/L某一元酸(HA)溶液中 c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10mol/L B.溶液中c(H+)+c(A-)=0.1mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
重点在C、D.答案给的是C 灿烂天使1年前1
灿烂天使1年前1 -
 随风的飘 共回答了11个问题
随风的飘 共回答了11个问题 |采纳率100%常温下,c(OH-)xc(H+)=10^-14,联立 c(OH-)/c(H+)=10^-8,可解得:c(OH-)=10^-11,c(c(H+)=10^-3,即POH=11,则PH=3.因为一元酸的浓度为0.1mol/l,其PH=3,则说明该酸为弱酸.
A:因为POH=13,则 水电离出的c(OH-)=c(H+)=10^-11
B:根据电离平衡,cOH- +cA- = cH+ ,质子守恒cA+cA- = 0.1mol/l ,导不出 (H+)+c(A-)=0.1mol/L
C:HA==(可逆)H+ + A-,当加入醋酸钠晶体,其醋酸根水解会增加氢氧根;加水的时候,是稀释该酸,越稀释越电离,故氢氧根继续增大.
D:等体积混合反应后后相当于,0.025mol/lNaA、0.025mol/lHA的混合,根据溶液呈电中性即有
cH+ + cNa+ = cOH- +cA-,而该溶液相当于是盐和酸混合,则混合后呈酸性,即有cH+>cOH-,cNa=0.025mol/l,A-以HA和A-形式存在,故其浓度小于0.05mol/l,但是大于0.025mol/l.
c(A-)>c(Na+)>c(H+)>c(OH-)
综上,选择C1年前查看全部
- 为什么一元酸没有酸式盐还有一题全部电离的为强酸 或者强碱怎么判断才是全部电离啊?举例说明,
 泰山北斗1231年前2
泰山北斗1231年前2 -
 人在旅途l 共回答了17个问题
人在旅途l 共回答了17个问题 |采纳率82.4%酸式盐可以这样理解就是有H
一元酸的话有酸式盐的话就是酸加上金属离子或铵根
但这样的话你会发现化合价什么的都不对了
全部电离就是写方程时要写等号
部分就是可逆
绝大多数盐 强酸强碱等都是全部电离的
希望对你有所帮助1年前查看全部
- 高中化学题 分别在体积均为100mL某一元酸溶液和烧碱溶液中加入足量的铝,充分反应后放出H2
高中化学题 分别在体积均为100mL某一元酸溶液和烧碱溶液中加入足量的铝,充分反应后放出H2
高中化学题
分别在体积均为100mL某一元酸溶液和烧碱溶液中加入足量的铝,充分反应后放出H2
的量相同.下列判断中正确的是
A.酸溶液一定是弱酸 B..酸溶液一定是强酸 C. 酸溶液的物质的量浓度是碱溶液物质的量浓度的3倍 D. 酸溶液的pH与碱溶液pH之和一定等于14 浩瀚湖泊1年前1
浩瀚湖泊1年前1 -
 859801239 共回答了14个问题
859801239 共回答了14个问题 |采纳率92.9%酸为一元酸,无论强弱,其中的氢都可以完全电离,在铝足量的前提下,等体积等物质的量浓度的一元酸产生氢气相同,AB错误.根据2Al+6HCl=2AlCl3+3H2、2Al+2NaOH+2H2O=2NaAlO2+ 3H2,可以看出要生成等量的氢气,氯化氢的物质的量必须是氢氧化钠的三倍,盐酸与氢氧化钠溶液等体积时,盐酸的物质的量浓度必然是氢氧化钠溶液的三倍,C正确.D中根据酸为强弱时pH不同就可以推断D错误.1年前查看全部
- 高一化学,请问这句话怎么错了? 根据酸电离产生H离子的个数将酸分为一元酸、二元酸等
 我来说一句吧1年前1
我来说一句吧1年前1 -
 我爱胡炯 共回答了14个问题
我爱胡炯 共回答了14个问题 |采纳率85.7%不是电离出的个数1年前查看全部
- 根据酸电离产生H离子的个数将酸分为一元酸、二元酸等 .这句话怎么错了?
 疏影-青儿1年前1
疏影-青儿1年前1 -
 summermemetea 共回答了22个问题
summermemetea 共回答了22个问题 |采纳率86.4%应该说是根据每个分子在水中电离产生氢离子的个数1年前查看全部
- 饱和一元酸通式怎么求出来的
 8美丽81年前1
8美丽81年前1 -
 LFF261 共回答了19个问题
LFF261 共回答了19个问题 |采纳率94.7%和酯类一样CnH2nO21年前查看全部
- 这句话错哪了?根据酸电离产生H离子的个数将酸分为一元酸、二元酸等
 灰色心情lh1年前1
灰色心情lh1年前1 -
 海风细碎 共回答了15个问题
海风细碎 共回答了15个问题 |采纳率93.3%还少了一个条件,是在一个酸分子中1年前查看全部
- 电解质,酸氯气不是电解质也不是非电解质?这句话对吗?为什么?碳酸是一元酸还是二元酸?醋酸是一元酸还是四元酸?为什么
 黑羽竹秋1年前1
黑羽竹秋1年前1 -
 xuyuan324 共回答了15个问题
xuyuan324 共回答了15个问题 |采纳率86.7%你好
呵呵
电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等.凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等.
氯气不是电解质也不是非电解质这句话对的
碳酸主要是根据其一个分子可以电离出的最大氢离子数目来判断 碳酸是二元酸 因为存在盐 碳酸钠
醋酸 是一元羧酸
对于有机物中酸的元是根据-COOH的个数来判断 无机物中的 有氧酸是几元酸的问题是 根据其-OH 结构来判断1年前查看全部
- 饱和一元酸的反应通式和饱和一元醇反应通式
 落那儿的鸟1年前1
落那儿的鸟1年前1 -
 lulubenny 共回答了14个问题
lulubenny 共回答了14个问题 |采纳率92.9%R1-COOH+R2-OH-------浓H2SO4,加热------R1-CO-O-R2+H2O1年前查看全部
- 为什么用来调节滴定基准物 草酸钠 的酸度的要用硫酸?用一元酸或其它多元酸会怎样?
 朝天门的水1年前1
朝天门的水1年前1 -
 eerr 共回答了20个问题
eerr 共回答了20个问题 |采纳率95%用盐酸貌似都可以1年前查看全部
- 常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
请回答:实验
编号HA物质的量 NaOH物质的量 混合溶液 浓度(mol•L-1) 浓度(mol•L-1) 的pH ① 0.1 0.1 pH=9 ② c 0.2 pH=7 ③ 0.2 0.1 pH<7
(1)根据①组实验情况(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)______.
A.c(Na+)+c(H+)═c(OH-)+c(A-)
B.c(Na+)═c(HA)+c(A-)
C.c(HA)+c(H+)═c(OH-)+c(Na+)
D.c(Na+)+c(H+)═c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c______0.2mol•L-1(选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)______c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度______NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是______. 我爱老戴1年前1
我爱老戴1年前1 -
 lilychenyuyao 共回答了22个问题
lilychenyuyao 共回答了22个问题 |采纳率90.9%解题思路:(1)等体积等浓度的氢氧化钠与HA混合,恰好生成NaA,溶液显示碱性,说明NaA为强碱弱酸盐,根据电荷守恒、物料守恒比较溶液中各离子浓度之间的关系;
(2)根据c=0.2mol/L时,溶液显示碱性,则加入的HA的物质的量应该稍大,则c应该大于0.2mol/L;根据溶液的pH=7及电荷守恒可知钠离子与A-的浓度相等;
(3)由③组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,并由离子的浓度比较大小.(1)等体积等浓度混合,恰好生成正盐,溶液的pH=9,则生成强碱弱酸盐,所以HA为弱酸,A-水解导致溶液显示碱性,水解方程式为:H2O+A-⇌HA+OH-;
A.溶液中一定满足电荷守恒,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(A-),故A正确;
B.溶液中密度电荷守恒,根据物料守恒可得:c(Na+)=c(HA)+c(A-),故B正确;
C.由电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-)、物料守恒c(Na+)=c(HA)+c(A-)可知,c(HA)+c(H+)=c(OH-),故C错误;
D.由电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-)可知,c(Na+)+c(H+)<c(OH-)+c(A-)+c(HA),故D错误;
故答案为:CD;
(2)若酸为强酸时,等体积、等浓度的二者混合,溶液的pH=7,由于HA为弱酸,等体积、等浓度混合时溶液的pH大于7,若要满足溶液的pH=7,则酸应该稍过量,即酸的浓度大于0.2mol/L;
由电荷守恒可知:c(Na+)+c(H+)=c(A-)+c(OH-),由于c(H+)=c(OH-),则c(A-)=c(Na+),
故答案为:>;=;
(3)由③组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,电离显酸性,c(H+)>c(OH-),电离大于水解,则c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:>;c(A-)>c(Na+)>c(H+)>c(OH-).点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了酸、碱反应后溶液的酸碱性判断,题目难度中等,明确“谁强谁显性、谁弱谁水解”的规律是解本题的关键,注意弱电解质的电离特点结合电荷守恒解答该题.1年前查看全部
- T摄氏度时,水的离子积为KW,该温度下将A摩尔每升一元酸HA与B摩尔每升一元碱等体积混合,要使混合液..
T摄氏度时,水的离子积为KW,该温度下将A摩尔每升一元酸HA与B摩尔每升一元碱等体积混合,要使混合液..
T摄氏度时,水的离子积为KW,该温度下将A摩尔每升一元酸HA与B摩尔每升一元碱等体积混合,要使混合液中性,必要条件是混合液中C{H+}= shenrenxin1年前1
shenrenxin1年前1 -
 pchyj 共回答了22个问题
pchyj 共回答了22个问题 |采纳率95.5%要使混合液中性,必要条件是混合液中C{H+}= √Kw
因为如果溶液中性的话,有c(H+) = c(OH-)
而在水溶液中,有:c(H+) * c(OH-) = Kw
所以c(H+) = c(OH-) = √Kw1年前查看全部
- (1)已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
该溶液中c(H+)=______.HA的电离平衡常数K=______;
(2)有甲、乙两份等体积的浓度均为0.1mol•L-1的氨水,pH为11.甲用蒸馏水稀释100倍,则NH3•H2O的电离平衡向______(填“促进”或“抑制”)电离的方向移动,溶液的pH将为______ (填序号).
A.9~11之间B.11C.12~13之间D.13
(3)乙用0.1mol•L-1的氯化铵溶液稀释100倍.稀释后的乙溶液与稀释后的甲溶液比较,pH______(填“甲大”、“乙大”或“相等”).
(4)氯化铵水溶液呈酸性,原因是(用离子方程式表示):______.
(5)在干燥的氯化氢气流中加热水含氯化镁(MgCl2•6H2O)晶体,得到的固体物质是______. luobupo1年前1
luobupo1年前1 -
 深兰色海底 共回答了23个问题
深兰色海底 共回答了23个问题 |采纳率91.3%解题思路:(1)0.1mol/L的某一元酸HA在水中有0.1%发生电离,则溶液中c(H+)=0.1mol/L×0.1%=10-4mol/L,pH=-lgc(H+);电离平衡常数K=
,将溶液中各数据代入即可;c(A−).c(H+) c(HA)
(2)加水稀释促进弱电解质的电离;将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的[1/100];
(3)氯化铵电离生成的铵根离子能抑制一水合氨的电离;
(4)氯化铵溶液呈酸性的原因是弱碱阳离子水解引起的;
(5)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解.(1)0.1mol/L的某一元酸HA在水中有0.1%发生电离,则溶液中c(H+)=0.1mol/L×0.1%=1.0×10-4 mol/Lmol/L,
电离平衡常数K=
c(A−).c(H+)
c(HA)=
10−4×10−4
0.1=1×10-7,
故答案为:1.0×10-4 mol/L;1×10-7;
(2)加水稀释促进弱电解质的电离,甲用蒸馏水稀释100倍,则NH3•H2O的电离平衡向促进电离的方向移动;将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的[1/100],则溶液的pH应该9-11之间;
故答案为:促进;A;
(3)氯化铵电离生成的铵根离子能抑制一水合氨的电离,乙用0.1mol•L-1的氯化铵溶液稀释100倍,则NH3•H2O的电离程度比甲中的小,所以甲溶液的氢氧根离子浓度大,PH大,
故答案为:甲大;
(4)氯化铵溶液呈酸性的原因,是弱离子的水解,离子方程式NH4++H2O⇌NH3•H2O+H+,故答案为:NH4++H2O⇌NH3•H2O+H+;
(5)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2;
故答案为:MgCl2.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了溶液中氢离子浓度的计算、弱电解质的电离常数、盐的水解,注意对影响盐的水解和弱电解质电离平衡的因素的分析和掌握,题目难度中等.1年前查看全部
- 25度时,a摩尔每升一元酸HA与b摩尔每升氢氧化钠等体积混合后,ph等于7,这下的关系定正确的是.Aa等于b.Ba大于b
25度时,a摩尔每升一元酸HA与b摩尔每升氢氧化钠等体积混合后,ph等于7,这下的关系定正确的是.Aa等于b.Ba大于b.C.a离子浓度等于Na浓度.Da离子浓度小于Na离子浓度.
 fzy71031年前1
fzy71031年前1 -
 孙wo空 共回答了11个问题
孙wo空 共回答了11个问题 |采纳率63.6%是c 因为离子平衡,所以正离子浓度和等于负离子浓度和,又因为PH=7所以氢离子浓度等于氢氧根离子浓度,所以得出c结论1年前查看全部
- :有两种一元酸(HA、HB)的钠盐溶液,其物质的量溶液相等.现向这两种盐溶液中通入适量的CO2,发生的反应如下:NaA
:有两种一元酸(HA、HB)的钠盐溶液,其物质的量溶液相等.现向这两种盐溶液中通入适量的CO2,发生的反应如下:NaA + CO2(少量) + H2O = HA + NaHCO3 ,2NaB + CO2(少量) + H2O = 2HB + Na2CO3
比较HA、HB酸性强弱正确的是 ( )
A.HA较强 B.HB较强 C.两者相同 D.无法比较 shuiyu3361年前4
shuiyu3361年前4 -
 凌小小1129 共回答了16个问题
凌小小1129 共回答了16个问题 |采纳率87.5%选A
您就想 相当于是B-抓H+能力比较强 因为A-还给CO32-留了一个H+
比较强说明什么呢
就是HA电离出H+的能力要比HB强
也就是酸性强1年前查看全部
- 常温下0.1mol/L某一元酸(HA)溶液的pH值不等于1,而0.1mol/L BOH 溶液里c(H+)/c(OH-)=
常温下0.1mol/L某一元酸(HA)溶液的pH值不等于1,而0.1mol/L BOH 溶液里c(H+)/c(OH-)=10-12(-12次方).将此两种溶液等体积混合后,所得溶液呈的各离子的浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-)
B.c(H+) 影锋1年前1
影锋1年前1 -
 0Hyeah 共回答了17个问题
0Hyeah 共回答了17个问题 |采纳率94.1%常温下0.1mol/L某一元酸(HA)溶液的pH值不等于1------HA是弱酸
0.1mol/L BOH 溶液里c(H+)/c(OH-)=10^-12,结合c(H+)*c(OH-)=10^-14
则c(OH-)=0.1mol/L,所以BOH是强碱
两种溶液等体积混合后,酸碱完全中和,且生成的BA发生水解呈碱性
所以选B1年前查看全部
- “根据酸分子中含有的H原子个数将酸分为一元酸,二元酸等”这句话难道不对吗,
 yjdream1年前1
yjdream1年前1 -
 鲍三介 共回答了23个问题
鲍三介 共回答了23个问题 |采纳率95.7%不对
如:醋酸CH3COOH是一元酸,但它的一个分子中有4个氢原子
改为:根据酸的每个分子在水溶液中电离出的氢离子的个数将酸分为一元酸,二元酸等1年前查看全部
- 若H2A是强电解质,是强酸,则NAHA呈弱酸性吗?是一元酸吗?
 音乐and咖啡1年前3
音乐and咖啡1年前3 -
 yzsbc 共回答了16个问题
yzsbc 共回答了16个问题 |采纳率81.3%H2A是强酸 它形成的NaHA 是显酸性的 而且酸性还不弱 H2A是二元强酸 NaHA是酸式盐1年前查看全部
- 一元酸定义多元酸呢
 846651年前3
846651年前3 -
 feiyangtian 共回答了20个问题
feiyangtian 共回答了20个问题 |采纳率75%一元酸是一个酸分子只能电离出一个H+离子,如HCl
“元”指的是对应的官能团,几“元”指的就是几个相对应的官能团.因此判断几元就必须判断有几个对应的官能团.例如 对于无机无氧酸HCl,HF,H2S等就看氢原子个数;
对于无机含氧酸H2SO4,HNO3,HClO3,H3PO4,H2SiO3,H2CO3等则要看-OH的个数,光看氢原子的个数是不准确的.比如H3PO4是三元酸,H2SO4是二元酸,HNO3是一元酸 但是H3BO3(硼酸)除外,虽含有三个-OH,但它是一元弱酸,因为其电离其实发生的是H+与B(OH)4 -的形式. 对于有机羧酸CH3COOH,HCOOH,HOOC-CH2-COOH等则看羧基-COOH的个数.
对于醇类CH3OH,HOCH2CH2OH等只需看-OH个数即可.1年前查看全部
- 什么是一元酸,二元酸和多元酸啊?它到底是按原子数量来分还是离子啊?
什么是一元酸,二元酸和多元酸啊?它到底是按原子数量来分还是离子啊?
我怎么区分一种盐到底是正盐还是碱式盐还是酸式盐?中盐就是正盐吗? 玫瑰宁宁1年前6
玫瑰宁宁1年前6 -
 万亩田 共回答了15个问题
万亩田 共回答了15个问题 |采纳率93.3%能提供一个H+的是一元酸,如HNO3,HCl.
有金属阳离子和酸根组呀的化合物是盐,同时有H+或OH-在里面,分别就是酸式盐或碱式盐.1年前查看全部
- 酸的电离方程式H该怎么处理强酸和弱酸 一元酸和多元酸的
 nancy-lee1年前1
nancy-lee1年前1 -
 adibif 共回答了25个问题
adibif 共回答了25个问题 |采纳率88%给你几个方程式:
多元强酸:H2SO4 = 2H+ + SO42-
多元弱酸:H2CO3 =可逆= H+ HCO3-
HCO3- =可逆= H+ + CO32-
一元强酸:HNO3 = H+ + NO3-
一元弱酸:HAc =可逆= H+ + Ac-1年前查看全部
- 什么叫一元酸?什么叫二元酸?怎么区分?
 栎m1年前2
栎m1年前2 -
 ajie103 共回答了20个问题
ajie103 共回答了20个问题 |采纳率90%并不是几个氢就是几元酸 如原硅酸 H4SiO4是二元酸 硼酸不是电离产生氢离子,而是结合氢氧根使溶液中氢离子浓度大于氢氧根浓度,而使溶液显酸性,类似于盐的水解,硼酸分子只能结合一个氢氧根,所以是一元酸 根据一个酸分子电离的氢离子个数来判断1年前查看全部
- 一元酸和二元酸(强酸)的酸碱中和滴定曲线有区别吗?区别在哪里?
 hsjwar21年前4
hsjwar21年前4 -
 飞树99 共回答了19个问题
飞树99 共回答了19个问题 |采纳率89.5%如果是二元弱酸就有区别,会有两个滴定突跃,强酸两个H离子几乎是一起滴定的,没区别1年前查看全部
- 化学——一元酸我说,硫酸氢钠,也就是NaHSO4是不是一元酸?一元酸是单指酸还是酸性物质啊?这个硫酸氢钠好像是酸性的……
 manehip1年前6
manehip1年前6 -
 优雅的菠萝 共回答了25个问题
优雅的菠萝 共回答了25个问题 |采纳率96%硫酸氢钠可以看作是过量的硫酸(强酸)与少量的氢氧化钠(强碱)反应生成的酸式盐,是盐的一种,不属于酸;一元酸是单指酸.1年前查看全部
- 加入ph=4的一元酸HA,pH刚好等于7,假设反应前后体积不变,则对反应后溶液的叙述
加入ph=4的一元酸HA,pH刚好等于7,假设反应前后体积不变,则对反应后溶液的叙述
在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(K+)+c(A-)=c(H+)+c(OH-) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.混合后溶液的体积≤20mL D.混合后溶液的体积≥20mL
只需要讲解CD选项就行了!我怎么觉得要选D,而不是C, sthyuuo1年前3
sthyuuo1年前3 -
 gxning 共回答了13个问题
gxning 共回答了13个问题 |采纳率92.3%因为他说的是氢离子浓度啊1年前查看全部
- (2013•焦作一模)常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
(2013•焦作一模)常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
下列判断不正确的是( )实验编号 c(HA)/mol•L-1 c(NaOH)/mol•L-1 反应后溶液pH 甲 0.1 0.1 pH=9 乙 c1 0.2 pH=7
A.c1一定大于0.2 mol•L-1
B.HA的电离方程式是HA⇌H++A-
C.甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+)
D.乙反应后溶液中:c(Na+)<c(HA)+c(A-) boney1年前1
boney1年前1 -
 youxicun 共回答了9个问题
youxicun 共回答了9个问题 |采纳率77.8%解题思路:依据实验甲可知等体积等浓度反应溶液呈碱性,判断HA是弱酸,在溶液中存在电离平衡;
A、依据混合溶液PH=7说明溶液呈中性,依据电荷守恒分析判断;
B、依据判断HA是弱酸存在电离平衡;
C、甲反应后生成NaA溶液,A-离子水解显碱性;
D、依据溶液中电荷守恒分析判断;A、溶液中一定存在c(OH-)+c(A-)=c(Na+)+c(H+),混合溶液PH=7说明溶液呈中性,c(OH-)=c(H+),所以c(A-)=c(Na+),原溶液浓度c1>0.2 mol•L-1;故A正确;
B、HA是弱酸存在电离平衡,HA的电离方程式是HA⇌H++A-,故B正确;
C、反应后生成NaA溶液,A-离子水解显碱性,溶液中离子浓度大小c(Na+)>c(A-)>c(OH-)>c(H+),故C错误;
D、乙溶液中一定存在c(OH-)+c(A-)=c(Na+)+c(H+),混合溶液PH=7说明溶液呈中性,c(OH-)=c(H+),所以c(A-)=c(Na+),c(Na+)<c(HA)+c(A-),故D正确;
故选C.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱反应后溶液酸碱性的分析判断,弱电解质分析,溶液中电荷守恒的应用,题目难度中等.1年前查看全部
- 常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10的负8次方,该一元酸溶液的PH=1 为什
常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10的负8次方,该一元酸溶液的PH=1 为什么是错的?
HA=(双箭头) H+ + A-
0.1 0.1
[H+]不是0. 麦记意粉1年前1
麦记意粉1年前1 -
 再见上飞 共回答了22个问题
再见上飞 共回答了22个问题 |采纳率95.5%正是因为双箭头,所以说原来HA为1mol,电离出的氢离子就不足1mol,即电离不完全,
也就是说,此酸不是一元强酸(盐酸、硝酸),而是一元弱酸(如:氢氟酸等)
像带双箭头的方程式计算,都是应用三段式:
反应前:xx xx 0 0 (反应前一般生成物是0,除非原来就有)
物质转换了多少:xx xx xx xx(反应前后之差的绝对值)
反应后(平衡):xx xx xx xx(反应后达到平衡,但反应物不可能一点不剩)
这是化学平衡中的溶液电离问题.1年前查看全部
- (12分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反
(12分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。
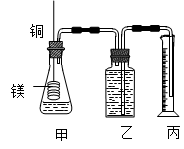
该实验的主要操作步骤如下:
a.配制浓度均为1 mol·L -1 盐酸和醋酸溶液;
b.用 ① 量取10.00 mL1 mol·L -1 盐酸和醋酸溶液分别加入两个锥形瓶中;
c.分别称取除去表面氧化膜的镁带 a g,并系于铜丝末端, a 的数值至少为 ② g;d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录 ③ ;
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ④ ,读出量筒中水的体积为 V mL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述d检查该装置气密性的操作与观察方法: ⑤ 。
(2)本实验中应选用 ⑥ (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)简述速率不等的原因 ⑦ ,铜丝不与酸接触的原因是 ⑧ 。 balangzi1年前1
balangzi1年前1 -
 匆匆风风 共回答了20个问题
匆匆风风 共回答了20个问题 |采纳率100%①酸式滴定管 (1分) ② 0.12 (2分)③反应时间 ( 1分) ④将量筒缓缓向下移动,使乙、丙中液面相平(或调节乙、丙仪器中的液面使之相平) ( 2分)
⑤两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(只要表述明确、合理均可) ;(2分)
⑥B;( 1分) ⑦酸的浓度相同时c(H + )不同 ( 2分)
⑧防止形成原电池,干扰实验现象的观察 ( 1分)
1年前查看全部
- 常温下0.1mol/L某一元酸(HA)溶液中,c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
常温下0.1mol/L某一元酸(HA)溶液中,c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A. 该溶液中由水电离的c(H+)=1×10-10mol/L
B. pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C. 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合后所得溶液中c(H+)+c(HA)=c(OH-) sygr1年前1
sygr1年前1 -
 RyanL_iu 共回答了23个问题
RyanL_iu 共回答了23个问题 |采纳率69.6%解题思路:常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,依据溶液中离子积常数计算酸溶液中氢离子浓度判断是强酸或弱酸,溶液中c(OH-)/c(H+)=1×10-8,c(H+)•c(OH-)=10-14,计算得到c(H+)=10-3mol/L,说明酸是弱酸,依据弱酸存在的电离平衡分析计算;A、溶液中c(OH-)/c(H+)=1×10-8,c(H+)•c(OH-)=10-14,计算得到c(H+)=10-3mol/L,由水电离的c(H+)=1×10-11mol/L,故A错误;
B、pH=3的HA的浓度大于pH=11的NaOH溶液的浓度,等体积混合后,醋酸剩余,显示酸性,c(A-)>c(Na+)>c(H+)>c(OH-),故不CW;
C、浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,HA的电离程度大于A-的水解程度,所以c(A-)>>c(Na+)>c(H+)>>c(OH-),故C错误;
D、0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合后所得溶液是NaA溶液,溶液中存在质子守恒:c(H+)+c(HA)=c(OH-),故D正确.
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查学生弱电解质的电离和盐的水解原理的应用知识,注意知识的迁移和应用是关键,难度中等.1年前查看全部
- 根据下到实验不能证明一元酸HR为弱酸的是( )
根据下到实验不能证明一元酸HR为弱酸的是( )
A.室温下,NaR溶液的pH大于7
B.加温NaR溶液时,溶液的pH变小
C.HR溶液加入少量NaR固体,溶解后溶液的pH变大
D.70℃时,0.011mol•L-1的HR溶液pH=2.8 依海盼鱼1年前1
依海盼鱼1年前1 -
 猪能有吗 共回答了13个问题
猪能有吗 共回答了13个问题 |采纳率84.6%解题思路:要证明一元酸HR为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.A.常温下,测得NaR溶液的pH>7,说明NaR为强碱弱酸盐,水解呈碱性,可证明HR为弱酸,故A不选;
B.升高温度,水的Kw增大,如溶液呈中性时,pH也变小,不能证明HR为弱酸,故B选;
C.HR溶液加入少量NaR固体,溶解后溶液的pH变大,说明HR存在电离平衡,则证明HR为弱酸,故C不选;
D.常温下,测得0.011mol•L-1的HR溶液pH=2.8,说明HR没有完全电离,可证明HR为弱酸,故D不选.
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质的电离,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累,难度不大.1年前查看全部
- 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 起始浓度/(mol•L-1) 反应后溶液的pH c(HA) c(KOH) ① 0.1 0.1 9 ② x 0.2 7
A.实验①反应后的溶液中:c(A-)>c(K+)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
mol/LKw 1×10−9
C.实验②反应后的溶液中:c(A-)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH-)=c(H+)+c(A-) wangchbb1年前1
wangchbb1年前1 -
 电脑学习02 共回答了16个问题
电脑学习02 共回答了16个问题 |采纳率75%解题思路:A、酸和碱等浓度等体积混合反应恰好反应生成盐,盐溶液显碱性证明,酸是弱酸,酸根离子水解;
B、根据电荷守恒计算氢氧根离子浓度;
C、依据混合后溶液PH=7 常温下呈中性是弱酸过量,结合溶液中电荷守恒分析;
D、依据混合液显示中性及电荷守恒分析判断.A、将0.1mol/L的一元酸HA的溶液和0.1mol/L的KOH溶液等体积混合,恰好反应生成KA盐溶液,溶液pH=9,说明溶液呈碱性,HA为弱酸,A-离子水解,其浓度减小,c(K+)>c(A-),则溶液中离子浓度大小为:c(K+)>c(A-)>c(OH-)>c(H+),故A错误;
B、反应后的溶液中存在电荷守恒:c(K+)+c(H+)=c(A-)+c(OH-),则c(OH-)-c(H+)=c(K+)-c(A-)=
Kw
1×10−9 mol/Lmol/L-10-9 mol/L,故B错误;
C、混合后溶液pH=7 常温下呈中性是弱酸HA过量,溶液中是HA和KA的混合溶液,HA的强酸浓度大于0.2mol/L,实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L,故C错误;
D、混合后溶液PH=7,c(OH-)=c(H+),溶液中存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(A-),则:c(K+)=c(A-),所以混合液中一定满足:c(K+)+c(OH-)=c(H+)+c(A-),故D正确;
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合的定性判断及溶液中离子浓度大小的比较,题目难度中等,根据电荷守恒、物料守恒及盐的水解原理进行分析解答即可,试题有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.1年前查看全部
- 某种一元酸(HA)某种一元酸(HA)溶液中加入一定量的一种强碱(MOH)溶液后,恰好完全反应,则有关反应后溶液的判断中一
某种一元酸(HA)
某种一元酸(HA)溶液中加入一定量的一种强碱(MOH)溶液后,恰好完全反应,则有关反应后溶液的判断中一定正确的是
A.C[A-]≤[M+]
B.C[A-]≥[M+]
C.若反应生成的MA不水解,则【H+]>[OH-]
D.若反应生成的MA水解,则[H+]≤[OH-]
为什么? zzd821年前1
zzd821年前1 -
 jwdxgx 共回答了20个问题
jwdxgx 共回答了20个问题 |采纳率95%答案错,选A.
设HA为强酸,完全中和则MA是强酸强碱盐,中性,因此A-=M+,H+=OH-,C错.
若HA为弱酸,完全中和则Ma是强碱弱酸盐,碱性,因此A-1年前查看全部
- 请老师们赐教常温下,0.2mol/L的一元酸HA和0.1mol/L NaOH溶液混合后pH大于7,比较HA分子和A-离子
请老师们赐教
常温下,0.2mol/L的一元酸HA和0.1mol/L NaOH溶液混合后pH大于7,比较HA分子和A-离子的浓度.
老师的答案:c(HA)7
所以②式反应程度更大.为了方便计算,设①②反应程度分别为a,b.b>a
得n(HA):(1-a)×1+b×1
得n(A-) :(1-b)×1+a×1
作差后发现n(HA)>n(A-)
即c(HA)>c(A-).
希望老师指点错误或提供更好的算法
抱歉,等体积混合是题目给出的,我忘记打上去了. 超级ii牛1年前1
超级ii牛1年前1 -
 rain-cao 共回答了19个问题
rain-cao 共回答了19个问题 |采纳率89.5%你开始的假设就是错的
HA,0.2mol/L;NaOH,0.1mol/L;如果等体积混合,HAc剩余一半,溶液怎么能是碱性?
我这样给你解释吧:
HA,0.2mol/L;NaOH,0.1mol/L,混合后pH>7,说明NaOH的物质的量大于或等于HA
总之反应后两种可能性:
一,酸、碱等物质的量
最终是NaA的水溶液,离子包含Na+,H+,OH-,A-;
浓度[Na+]>[A-]>>[OH-]>[H+]
HA由水解产生两很少
显然[A-]》[HA]
二、碱过量
最终是NaOH,和NaA的混合溶液,离子包含Na+,H+,OH-,A-;
浓度[Na+]>[A-]>[OH-]>[H+] 或 [Na+]>[OH-]>[A-]>[H+]
HA几乎不存在(水解被抑制)
显然[A-]》》[HA]
如果如你所说,也没必要麻烦
酸的物质的量浓度是碱的两倍,两者等体积混合
反应后是这个弱酸酸和他的盐1:1混合
酸的电离,和他的盐的水解是相互抑制的
如果溶液显碱性说明水解相对占优势,就不考虑酸电离了
[A-]【A-】
所以你的结论是对的
你的计算也是没问题的
问问老师,题
是不是看错了1年前查看全部
- 一元酸、多元酸是什么意思?有三元酸这种称呼吗?
一元酸、多元酸是什么意思?有三元酸这种称呼吗?
那醋酸里面不是有4个氢离子吗?为什么是一元酸 沙漠之蛙1年前6
沙漠之蛙1年前6 -
 ak77777 共回答了25个问题
ak77777 共回答了25个问题 |采纳率84%“元”指的是对应的官能团,几“元”指的就是几个相对应的官能团.因此判断几元就必须判断有几个对应的官能团.例如
对于无机无氧酸HCl,HF,H2S等就看氢原子个数;
对于无机含氧酸H2SO4,HNO3,HClO3,H3PO4,H3PO3,H3PO2等则要看-OH的个数,光看氢原子的个数是不准确的,要看能电离的氢离子个数.比如H3PO4是三元酸,H3PO3是二元酸,
H3PO2是一元酸.
对于有机羧酸CH3COOH,HCOOH,HOOC-CH2-COOH等则看羧基-COOH的个数.
对于醇类CH3OH,HOCH2CH2OH等只需看-OH个数即可.1年前查看全部
- 常温下0.1mol•L -1 某一元酸(HA)溶液中c(OH - )/c(H + )=1×10 -8 ,下列正确是(
常温下0.1mol•L -1 某一元酸(HA)溶液中c(OH - )/c(H + )=1×10 -8 ,下列正确是( ) A.该溶液中由水电离出的c(H + )=1×10 -11 mol•L -1 B.浓度均为0.1mol•L -1 的HA和NaA溶液等体积混合后,若溶液呈酸性,则有:c(A - )>c(HA)>c(Na + )>c(H + )>c(OH - ) C.0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后所得溶液中:c(A - )+c(HA)=c(Na + ) D.0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后所得溶液中:c(H + )+c(HA)=c(OH - )  tianviv1年前1
tianviv1年前1 -
 770707chen 共回答了23个问题
770707chen 共回答了23个问题 |采纳率95.7%A、根据
c(O H - )
c( H + ) =1 0 -8 和c(H + )×c(OH - )=10 -14 可知,溶液中
c( H + )
10 -14
c( H + ) = 10 8 ,解之得c(H + )=0.001mol/L,该溶液中由水电离出的
c(H + )=c(OH - )=
Kw
0.001 mol/L=10 -11 mol/L,故A正确;
B、浓度均为0.1mol•L -1 的HA和NaA溶液等体积混合后,若溶液呈酸性,,说明溶液中HA的电离程度大于A - 离子的水解程度,则有c(Na + )>c(HA),故B错误;
C、0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后,根据物料守恒应有c(A - )+c(HA)=2c(Na + ),故C错误;
D、0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后所得溶液中,根据溶液的电中性可知溶液中存在c(H + )+c(Na + )=c(OH - )+c(A - ),根据物料守恒应有
c(A - )+c(HA)=2c(Na + ),则有2c(H + )+c(A - )+c(HA)=2c(OH - )+2c(A - ),即2c(H + )+c(HA)=2c(OH - )+c(A - ),故D错误.
故选A.1年前查看全部
- 根据分子中含有的氢原子个数将酸分为一元酸,二元酸等,这句话对吗?为何?
 coolseav1年前3
coolseav1年前3 -
 完蛋了完蛋了 共回答了16个问题
完蛋了完蛋了 共回答了16个问题 |采纳率81.3%不对.如乙酸,有4个氢,但它是一元酸.再如硼酸H3BO3,有3个氢,但它是一元弱酸,它不是电离出氢离子,而是结合OH-,使水中的H+增加.
H3BO3+H2OB(OH)4- + H+1年前查看全部
- 常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH−)c(H+)=1×10−8,下列叙述正确的是( )
常温下,0.1mol•L-1某一元酸(HA)溶液中
=1×10−8,下列叙述正确的是( )c(OH−) c(H+)
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的c(H+)=1×10-11mol•L-1
C.该溶液中水的离子积常数为1×10-22
D.用pH=11的NaOH溶液V1L与V2L0.1 mol•L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2 淡定自若间1年前1
淡定自若间1年前1 -
 uu不是狼 共回答了22个问题
uu不是狼 共回答了22个问题 |采纳率95.5%解题思路:根据溶液中c(OH-)与c(H+)的比值结合溶液的离子积常数Kw计算出溶液的c(H+),判断出酸的强弱性质,再根据与碱反应的性质判断反应后溶液的pH;
A.根据溶液中氢离子浓度计算溶液的PH;
B.酸溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
C.温度不变,水的离子积常数不变;
D.氢氧化钠是强碱,HA是弱酸,要使混合溶液呈中性,则酸应该稍微过量.A.常温下,0.1mol•L-1某一元酸(HA)溶液中
c(OH−)
c(H+)=1×10−8mol/L结合c(H+)×c(OH-)=10-14可知,溶液中氢离子浓度=
Kw
c(H+)
C(H+)=10-8mol/L,所以c(H+)=0.001mol/L,氢离子浓度小于酸浓度,所以该酸是弱酸,溶液的PH=3,故A错误;
B.酸溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以该溶液中由水电离出的c(H+)=1×10-11mol•L-1,故B正确;
C.温度不变,水的离子积常数不变,所以该溶液中水的离子积常数为1×10-14,故C错误;
D.pH=11的NaOH溶液中氢氧化钠的浓度=0.001mol/L,氢氧化钠是强碱,HA是弱酸,要使混合溶液呈中性,则酸应该稍微过量,所以0.001mol/L×V1L<V2 L×0.1 mol•L-1,0.01V1<V2 ,故D错误;
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质的电离、pH的简单计算等知识点,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,为易错点.1年前查看全部
- 化学:下列说法正确的一组是①不溶于水的盐(CaCO3,BaSO4等)都是弱电解质②可溶于水的盐都是强电解质③所有一元酸中
化学:下列说法正确的一组是
①不溶于水的盐(CaCO3,BaSO4等)都是弱电解质
②可溶于水的盐都是强电解质
③所有一元酸中氢离子浓度都相等
④强酸溶液中氢离子浓度不一定大于弱酸溶液中氢离子浓度.
⑤强电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电 自游游自在在1年前4
自游游自在在1年前4 -
 Kylin755 共回答了13个问题
Kylin755 共回答了13个问题 |采纳率76.9%①不溶于水的盐(CaCO3,BaSO4等)都是弱电解质
错,CaCO3,BaSO4都可完全电离,是强电解质.
②可溶于水的盐都是强电解质
错,醋酸铅可溶于水,是弱电解质.
③所有一元酸中氢离子浓度都相等
错,没有指明酸的浓度和电离度相同的酸.
④强酸溶液中氢离子浓度不一定大于弱酸溶液中氢离子浓度.
对,当强酸溶液浓度极其低时.
⑤强电解质溶液导电的原因是溶液中有自由移动的阴阳离子
对
⑥熔融的电解质都能导电
错,只有离子化合物才能这么说.比如水,导电能力极弱,忽略不计.1年前查看全部
- 常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A. 该溶液中水电离出的c(H+)=1×10-10mol•L-1
B. 该溶液中c(H+)+c(A-)+c(HA)=0.1mol•L-1
C. 该溶液与0.05mol•L-1NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D. 向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 ookii1年前11
ookii1年前11 -
 282983647 共回答了14个问题
282983647 共回答了14个问题 |采纳率78.6%解题思路:根据溶液中c(OH-)与c(H+)的比值结合溶液的离子积常数Kw计算出溶液的c(H+),判断出酸的强弱性质,再根据与碱反应的性质判断反应后溶液的pH,进而判断反应后溶液中离子浓度的大小比较.
A、依据c(OH-)/c(H+)=1×10-8和水的离子积Kw=1×10-14,计算得到酸溶液中的氢离子浓度为c(H+)=0.001mol/L,C(OH-)=10-11mol/L;
B、依据溶液中的物料守恒可知c(A-)+c(HA)=0.1mol•L-1;
C、依据反应得到的是HA和盐NaA的混合液,根据计算判断酸是弱酸,溶液中的电荷守恒来判断离子浓度大小比较的正误;
D、依据弱电解质的电离平衡影响因素影响平衡移动的方向分析;A、溶液中c(OH-)/c(H+)=1×10-8,Kw=c(H+)•c(OH-)=1×10-14,两式中的氢离子浓度是溶液中酸电离出的,氢氧根离子浓度是水电离出的,联立解得c(H+)=0.001mol/L,确定为弱酸溶液,所以溶液中c(OH-)=10-11mol/L,即水电离出的氢离子浓度为10-11mol/L;故A错误;
B、0.1mol•L-1某一元酸(HA)溶液中存在电离平衡,所以根据物料守恒可知c(A-)+c(HA)=0.1mol•L-1,所以c(H+)+c(A-)+c(HA)=0.1mol•L-1是错误的,故B错误;
C、0.1mol•L-1某一元酸(HA)溶液与0.05mol•L-1NaOH溶液等体积混合后反应,反应后的溶液为等浓度的酸HA和盐NaA的混合液,溶液中一定存在电荷守恒;[H+]+[Na+]=[OH-]+[A-],按照选项中的离子浓度大小,若c(A-)>c(Na+),根据电荷守恒应有c(OH-)<c(H+),故C错误;
D、通过计算可知酸为弱酸存在 电离平衡HA⇌H++A-,加水稀释促进电离,氢离子浓度减小,加入一定量NaA晶体,溶解生成的A-离子抑制了酸的电离,氢离子浓度减小,根据温度一定时溶液中氢离子浓度与氢氧根离子浓度乘积为常数,加入水和加入一定量NaA晶体,使氢离子浓度减小,氢氧根离子浓度增大,故D正确;
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查酸碱混合后溶液pH的判断,题目难度不大,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),判断出HA为弱酸.1年前查看全部
- 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:\x10想问一下 为
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:x10想问一下 为
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:x10想问一下为什么选项C为什么不是大于0.2

 _bre_bddni65b41年前3
_bre_bddni65b41年前3 -
 1g1hc 共回答了17个问题
1g1hc 共回答了17个问题 |采纳率94.1%你没有考虑体积变化 加入两种溶液后体积为原来两倍 而HA物质的量没变 浓度为原来一半1年前查看全部
- 常温下, 某一元酸(HA)溶液中 ,下列叙述正确的是 [ ] A.该溶液
常温下,  某一元酸(HA)溶液中
某一元酸(HA)溶液中 ,下列叙述正确的是[ ]
,下列叙述正确的是[ ]A.该溶液中由水电离出的 
B.该溶液中
C.该溶液与 溶液等体积混合后所得溶液中
溶液等体积混合后所得溶液中
D.向该溶液中加入一定量的水,溶液中离子的浓度均减小 heavenwind1年前1
heavenwind1年前1 -
 zeroleonhart 共回答了17个问题
zeroleonhart 共回答了17个问题 |采纳率88.2%1年前查看全部
- 强酸 弱酸 一元酸 二元酸 等导电能力由强到弱顺序是怎样的?
 wtt2011年前1
wtt2011年前1 -
 阳光无风 共回答了17个问题
阳光无风 共回答了17个问题 |采纳率94.1%其导电能力由电离电子决定,电离粒子越多,导电性越好,所以强酸大于弱酸,二元酸大于一元酸1年前查看全部
- 1mol/L甲酸(一元酸)溶液的导电性能比同浓度的盐酸的导电性弱 是否正确
 少堂1年前1
少堂1年前1 -
 东洋浪人 共回答了14个问题
东洋浪人 共回答了14个问题 |采纳率92.9%是的.因为甲酸是弱酸,不完全电离
导电能力比较是比较总离子浓度
盐酸是 2mol/L 总的
甲酸不到2mol/L
所以比较弱1年前查看全部
大家在问
- 1英语翻译GYEONGNAM INTL FOREIGN SCH#451-2,49-22 JODONG-GI,SANAM M
- 29、将棱长为2厘米的小正方体按下图方式摆放在地上,露在外面的面积是( )平方厘米,这个立体图的体积是
- 3微分方程e^(y^2+x)dx+ydy=0
- 4解二元一次方程x²+2x-2=0
- 5一个二氧化硅分子是由一个硅原子与两个氧原子构成的.
- 6与“嫦娥二号”卫星发射有关的成语
- 7W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;
- 8格拉斯哥维度谁能告诉我格拉斯哥(英国城市之一,在苏格兰)的维度啊,现在这时候晚上9点了,还亮着呢,到了夏至日,能有极昼不
- 9Bayfield Shopping Coupons(赠券)
- 10哪些动物会发出次超声波,要4种
- 11把一堆苹果平均分给六个小朋友每人分到三个后还剩下若干个请问这堆苹果最少有多少最多有多少个
- 12999.9*999.9+199.99巧算
- 13关于物质的熔化和凝固,下列叙述中正确的是( )
- 14日有所思,夜有所梦的意思
- 15匀加速直线运动公式变形的时间公式 即x=v0t+1/2at^2中t=?





