联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12
 lyp04202022-10-04 11:39:541条回答
lyp04202022-10-04 11:39:541条回答(1)生成二氧化碳气体的质量是______g.
(2)该厂生产的纯碱中碳酸钠的质量分数.(计算结果精确到0.1%)
(3)反应后所得溶液中溶质的质量分数.

已提交,审核后显示!提交回复
共1条回复
 coramomo 共回答了19个问题
coramomo 共回答了19个问题 |采纳率94.7%- 解题思路:反应前后的质量差即为反应生成二氧化碳的质量;
根据二氧化碳的质量可以计算碳酸钠的质量、生成氯化钠的质量,进一步可以计算纯碱中碳酸钠的质量分数和反应后所得溶液中溶质的质量分数.(1)生成二氧化碳气体的质量为:12g+73g-80.6g=4.4g,
故填:4.4.
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 117 44
x y 4.4g
[106/x]=[117/y]=[44/4.4g],
x=10.6g,y=11.7g,
该厂生产的纯碱中碳酸钠的质量分数为:[10.6g/12g]×100%=88.3%,
答:该厂生产的纯碱中碳酸钠的质量分数为88.3%.
(3)反应后所得溶液中溶质的质量分数为:
11.7g+(12g−10.6g)
80.6g×100%=16.3%,
答:反应后所得溶液中溶质的质量分数为16.3%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性. - 1年前
相关推荐
- 我国著名化学家侯德榜发明的联合制碱法的碱是指什么
 夜寒jin1年前4
夜寒jin1年前4 -
 如此而已吧 共回答了19个问题
如此而已吧 共回答了19个问题 |采纳率89.5%化学原理
侯氏制碱法又名联合制碱法
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
即:①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (溶解度一般,因为不断添加原料达到溶液饱和才沉淀)
②2NaHCO3(加热)=Na2CO3+H2O+CO2↑
优点 保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序. 注:纯碱就是碳酸钠1年前查看全部
- (2014•大港区一模)我国化学家侯德榜的“联合制碱法”工艺简洁效率高.其主要反应如下:
(2014•大港区一模)我国化学家侯德榜的“联合制碱法”工艺简洁效率高.其主要反应如下:
①NH3+H2O+CO2═NH4HCO3
②NaCl(饱和)+NH4HCO3═NH4Cl+NaHCO3↓
③2NaHCO3
Na2CO3+H2O+CO2↑△ .
下列说法正确的是( )
A.①反应是化合反应,②反应是置换反应
B.③反应过程中碳元素的化合价发生改变
C.③反应后的H2O和CO2可以被循环使用
D.反应结束后,只得到一种产物Na2CO3 nongmin20071年前1
nongmin20071年前1 -
 玩仙界 共回答了17个问题
玩仙界 共回答了17个问题 |采纳率76.5%解题思路:A、根据化合反应和置换反应的含义进行解答;
B、根据2NaHCO3
Na2CO3+H2O+CO2↑中中碳元素的化合价发生不变进行解答;△ .
C、根据反应可知H2O和CO2可以被循环使用进行解答;
D、根据反应结束后,得到两种产物Na2CO3和NH4Cl进行解答.A、NH3+H2O+CO2═NH4HCO3属于化合反应,而NaCl(饱和)+NH4HCO3═NH4Cl+NaHCO3↓属于复分解反应,故A错误;
B、由2NaHCO3
△
.
Na2CO3+H2O+CO2↑中中碳元素的化合价发生不变,故B错误;
C、由反应可知H2O和CO2可以被循环使用,故C正确;
D、反应结束后,得到两种产物Na2CO3和NH4Cl,故D错误.
故选:C.点评:
本题考点: 纯碱的制取;有关元素化合价的计算;反应类型的判定.
考点点评: 化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写以及反应类型的判断.1年前查看全部
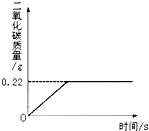
- (2007•沈阳)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na
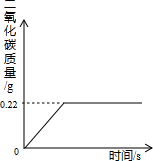 (2007•沈阳)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3
(2007•沈阳)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3
Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.△ .
请解答下列问题:
(1)反应过程中生成二氧化碳的质量为______g;
(2)100g混合物中NaHCO3的质量;
(3)100g混合物中Na2CO3的质量分数. 转换插头1年前1
转换插头1年前1 -
 SHENAI深蓝 共回答了24个问题
SHENAI深蓝 共回答了24个问题 |采纳率87.5%解题思路:(1)由反应过程中生成二氧化碳气体的质量与反应时间的关系曲线,反应过程中生成二氧化碳质量为0.22g;
(2)根据受热分解的化学方程式,由产生二氧化碳的质量计算分解的碳酸氢钠的质量;
(3)样品质量与碳酸氢钠质量的差即样品中碳酸钠的质量,该质量与样品质量比可计算100g混合物中Na2CO3的质量分数.(1)由反应过程中生成二氧化碳气体的质量与反应时间的关系曲线,反应过程中生成二氧化碳质量为0.22g;
故答案为:0.22g;
(2)设混合物中NaHCO3的质量为x
2NaHCO3
△
.
Na2CO3+H2O+CO2↑
168 44
x 0.22g
[168/x]=[44/0.22g],x=0.84g
(3)Na2CO3的质量分数为:[100g−0.84g/100g]×100%=99.16%
答:混合物中NaHCO3的质量为0.84g,Na2CO3的质量分数为99.16%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 反应过程中生成二氧化碳气体的质量与反应时间的关系曲线的折点即完全反应时放出二氧化碳达最大值.1年前查看全部
- 我国著名化学家侯德榜发明的联合制碱法,主要原理是:向浓氨水(NH3•H2O)中通入足量的CO2生成NH4HCO3(碳酸氢
我国著名化学家侯德榜发明的联合制碱法,主要原理是:向浓氨水(NH3•H2O)中通入足量的CO2生成NH4HCO3(碳酸氢铵),然后加入食盐充分搅拌,两者发生复分解反应,由于碳酸氢钠的溶解度很小,便呈晶体析出,将析出的碳酸氢钠加热得碳酸钠,二氧化碳和水.请写出上述原理的三个化学方程式:
①______;
②______;
③______. 断线风筝131年前1
断线风筝131年前1 -
 彻底疯了 共回答了21个问题
彻底疯了 共回答了21个问题 |采纳率100%解题思路:①根据浓氨水和二氧化碳反应生成碳酸氢铵进行分析,
②根据碳酸氢钠的溶解度很小,以晶体形式析出,两者交换成分进反应,
③根据碳酸氢钠受热分解出碳酸钠来判断.①浓氨水和二氧化碳反应生成碳酸氢铵,故答案为:NH3•H2O+CO2=NH4HCO3,
②碳酸氢钠的溶解度很小,表现为沉淀,所以可以发生复分解反应,碳酸氢铵和氯化钠反应生成碳酸氢钠和氯化铵,故答案为:NH4HCO3+NaCl=NH4Cl+NaHCO3↓,
③碳酸氢钠在受热的条件下生成碳酸钠、水和二氧化碳,故答案为:2NaHCO3
△
.
Na2CO3+H2O+CO2↑点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析应用的原理,然后根据反应物、生成物书写方程式,注意盐遵守书写规则.1年前查看全部
- 用“侯氏联合制碱法”制取的纯碱(Na 2 CO 3 )中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠
用“侯氏联合制碱法”制取的纯碱(Na 2 CO 3 )中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g。
试计算:
⑴产生二氧化碳气体的质量是_____g。
⑵该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%) 情系西北1年前1
情系西北1年前1 -
 学则思 共回答了18个问题
学则思 共回答了18个问题 |采纳率94.4%(1)4.4g
(2)设12g纯碱试样中碳酸钠的质量为x
Na 2 CO 3 +2HCl==2NaCl+H 2 O+CO 2 ↑
106 44
x 4.4g
106:44=x:4.4g
解得x=10.6g
碳酸钠的质量分数为:10.6g/12g×100%=88.3%
答:该厂生产的纯碱中碳酸钠的质量分数88.3%。1年前查看全部
- 侯氏联合制碱法的三个化学方程式分别是:一、向浓铵水中通入足量co2生成碳铵。二、再加入食盐细末搅拌。三、碳酸氢钠加热。
 烟台八仙过海1年前2
烟台八仙过海1年前2 -
 青出于蓝_007 共回答了18个问题
青出于蓝_007 共回答了18个问题 |采纳率77.8%1 向已经氨化的饱和食盐水中通入二氧化碳
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出)
2 加热碳酸氢钠,得到碳酸钠
2NaHCO3=Na2CO3+H2O+CO2
3 利用碳酸钠通入石灰水,制得氢氧化钠
Na2CO3+Ca(OH)2=2NaOH+CaCO3
4 培烧碳酸钙,得到二氧化碳循环
CaCO3=CaO+CO2
CaO+H2O=Ca(OH)2
ps:
嗯..你说的:
一、向浓铵水中通入足量CO2生成碳铵
NH3 +H2O +CO2 = NH4HCO3
二、再加入食盐细末搅拌
NH4HCO3 +NaCl = NH4Cl +NaHCO3 (析出)
三、碳酸氢钠加热
2NaHCO3 = Na2CO3 +H2O +CO2 (气体)1年前查看全部
- 侯氏联合制碱法的碱是?
 45961年前4
45961年前4 -
 ashidu 共回答了26个问题
ashidu 共回答了26个问题 |采纳率88.5%是碳酸钠 属于盐的一种 化学式是Na2CO3 水溶液呈碱性1年前查看全部
- 侯德榜发明的侯式制碱法就是联合制碱法?
 双头会1年前1
双头会1年前1 -
 悠悠蓝铃 共回答了22个问题
悠悠蓝铃 共回答了22个问题 |采纳率95.5%侯式制碱法,
联合制碱法是外国人发明的1年前查看全部
- 侯德榜的“联合制碱法”中的第2方程式为何加入的是磨细的食盐粉,这样的目的是什么?
侯德榜的“联合制碱法”中的第2方程式为何加入的是磨细的食盐粉,这样的目的是什么?
第2方程式:NH4HCO3+NaCl=NaHCO3(沉淀)+NH4Cl 大大波波1年前1
大大波波1年前1 -
 王牌空战 共回答了18个问题
王牌空战 共回答了18个问题 |采纳率100%磨细是为了增大接触面积,加快反应速率1年前查看全部
- (2014•济南模拟)1926年,我国著名化学家侯德榜先生创立了一种高效环保的纯碱生产方法--“联合制碱法”,又称侯氏制
 (2014•济南模拟)1926年,我国著名化学家侯德榜先生创立了一种高效环保的纯碱生产方法--“联合制碱法”,又称侯氏制碱法.其生产过程中有下列反应:
(2014•济南模拟)1926年,我国著名化学家侯德榜先生创立了一种高效环保的纯碱生产方法--“联合制碱法”,又称侯氏制碱法.其生产过程中有下列反应:
①NH3+CO2+H2O+NaCl═NH4Cl+NaHCO3②2NaHCO3
Na2CO3+H2O+CO2↑△ .
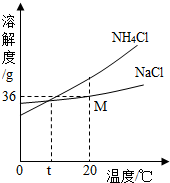
(1)在反应①中,生成的氯化铵和碳酸氢钠的质量比是53.5:______.
(2)如图为碳酸氢钠和氯化铵的溶解度曲线,30℃时,碳酸氢钠饱和溶液中的溶质质量分骜______(填“大于”、“等于”或“小于”)
氯化铵饱和溶液中的溶质质量分数.
(3)氨盐水吸收C02后生成了碳酸氢钠和氯化铵,请你根据溶解度曲线和生成物质量关系分析:为何碳酸氢钠首先结晶析出?______. friendly0171年前1
friendly0171年前1 -
 ylzhlj 共回答了9个问题
ylzhlj 共回答了9个问题 |采纳率88.9%解题思路:(1)根据化学方程式进行计算分析即可;
(2)根据相同温度下溶解度的大小来分析判断;
(3)根据物质的溶解度大小和产生的物质质量大小来分析.(1)根据化学方程式:NH3+CO2+H2O+NaCl═NH4Cl+NaHCO3
53.5 84
可知,生成的氯化铵和碳酸氢钠的质量比是53.5:84;
(2)由溶解度曲线可知,在30℃时,碳酸氢钠的溶解度是10g,氯化铵的溶解度是40g,也就是在该温度下,在100g水中达到饱和状态时,溶解的氯化铵比碳酸氢钠要多,故30℃时,碳酸氢钠饱和溶液中的溶质质量分数小于氯化铵饱和溶液中的溶质质量分数;
(3)由溶解度曲线的信息和生成氯化铵与碳酸氢钠的质量比可知,相同温度下,NaHCO3的溶解度比NH4Cl的溶解度小,相同时间内,产生NaHCO3的质量比NH4Cl的质量大,所以,NaHCO3首先在溶液中达到饱和,从而结晶析出.
故答案为:(1)84;(2)小于;(3)相同温度下,NaHCO3的溶解度比NH4Cl的溶解度小; 相同时间内,产生NaHCO3的质量比NH4Cl的质量大,所以,NaHCO3首先在溶液中达到饱和,从而结晶析出.点评:
本题考点: 纯碱的制取;固体溶解度曲线及其作用;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题难度不是很大,主要考查物质间的质量关系以及根据固体的溶解度曲线解决相关的问题等,培养分析问题、解决问题的能力.1年前查看全部
- 【化学--选修化学与技术】(1)纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.①“氨碱
【化学--选修化学与技术】
(1)纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:______;
②写出“联合制碱法”有关反应的化学方程式:______;
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?______;
(2)钢铁工业对促进经济和社会发展起了重要作用.
①炼钢时,加入硅、锰和铝的目的是______.
②不锈钢含有的Cr元素是在炼钢过程的氧吹______(填“前”或“后”)加入,原因是______.
③炼铁和炼钢生产中,尾气均含有的主要污染物是______.从环保和经济角度考虑,上述尾气经处理可用作______. 小猪大人1年前1
小猪大人1年前1 -
 9又二分之一 共回答了19个问题
9又二分之一 共回答了19个问题 |采纳率78.9%解题思路:纯碱是一种重要的化工原料,目前制碱工业主要有两种工艺:①氨碱法 2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O;②联合制碱法 NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl; 2NaHCO3
2NH3↑+CaCl2+2H2O;②联合制碱法 NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl; 2NaHCO3 Na2CO3+CO2↑+H2O.炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分. 因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去.炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理等来解题.
Na2CO3+CO2↑+H2O.炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分. 因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去.炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理等来解题.
(1)①氨碱法是由氯化铵和消石灰在加热条件下反应后生成氨气和氯化钙的反应,反应的化学方程式为:
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O,
2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
②联合制碱法是在氨的饱和NaCl溶液中二氧化碳气体,反应生成碳酸氢钠,解热碳酸氢钠即可制备碳酸钠,反应的有关方程式为,NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl; 2NaHCO3 Na2CO3+CO2↑+H2O,
Na2CO3+CO2↑+H2O,
故答案为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
③CO2是制碱工业的重要原料,氨碱法中CO2来源于石灰石煅烧,联合制碱法中CO2的来源于合成氨工业的废气,
故答案为:“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气;
(2)①炼钢时,加入硅、锰和铝主要是为了脱氧和调整钢的成分.
故答案为:脱氧和调整钢的成分;
②因为Cr易被氧化,为Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去.
故答案为:后; 避免Cr被氧化;
③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行尾气处理.一氧化碳是一种很好的还原剂还是一种燃料.
故答案为:CO;燃料.点评:
本题考点: 纯碱工业(侯氏制碱法);高炉炼铁;生活中常见合金的组成.
考点点评: 本题考查目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺的实验设计,题目难度较大,易出错点为化学方程式的书写,注意把握反应的原理,注重相关基础知识的积累.1年前查看全部
- 下列有关酸、碱、盐的说法合理的是( ) A.“侯氏联合制碱法”制得的碱是烧碱 B.生成了盐和水的反应就是中和反应 C.
下列有关酸、碱、盐的说法合理的是( ) A.“侯氏联合制碱法”制得的碱是烧碱 B.生成了盐和水的反应就是中和反应 C.硫酸铵与熟石灰混合、研磨,能闻到刺激性的气味 D.有咸味的工业用盐可以当食盐使用  dAiyu8881年前1
dAiyu8881年前1 -
 77205496 共回答了23个问题
77205496 共回答了23个问题 |采纳率73.9%A、“侯氏联合制碱法”制得的碱是纯碱,纯碱是碳酸钠的俗称,而烧碱是氢氧化钠的俗称,故选项说法错误.
B、中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水;生成盐和水的反应不一定是中和反应,如CO 2 +2NaOH═Na 2 CO 3 +H 2 O,故选项说法错误.
C、硫酸铵属于铵态氮肥,熟石灰属于碱,硫酸铵与熟石灰混合、研磨能放出有刺激性气味的氨气,故能闻到刺激性的气味,故选项说法正确.
D、有咸味的工业用盐亚硝酸钠有毒,不能代替食盐使用,故选项说法错误.
故选C.1年前查看全部
- (2011•乐山)利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化
(2011•乐山)利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
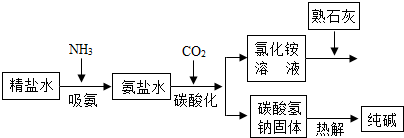
(1)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水).氨盐水比食盐水更容易吸收二氧化碳,其原因是______;
(2)写出氯化铵溶液与熟石灰反应的化学方程式______. 驿外梅花1年前1
驿外梅花1年前1 -
 彬56789 共回答了17个问题
彬56789 共回答了17个问题 |采纳率88.2%解题思路:氨水显碱性,有利于吸收二氧化碳气体;
氯化铵能和氢氧化钙反应生成氯化钙、水和氨气.(1)氨盐水比食盐水更容易吸收二氧化碳,其原因是氨盐水显碱性.故答案为:氨盐水显碱性.
(2)氯化铵能和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式为:
2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.点评:
本题考点: 纯碱的制取;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要理解二氧化碳的性质,即容易被显碱性的溶液吸收;要根据质量守恒定律的内容正确的书写化学方程式.1年前查看全部
- 请高手解释一下:联合制碱法中分离出NH4Cl 可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2.
请高手解释一下:联合制碱法中分离出NH4Cl 可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2.
说是使合成氨的原料气 CO 转化成 CO2.革除了 CaCO3 制 CO2 这一工序. 大汗血1年前2
大汗血1年前2 -
 dzdz333 共回答了14个问题
dzdz333 共回答了14个问题 |采纳率85.7%联合制碱法的NH3来自于合成氨厂,CO2也来自于合成氨的变换气(主要成分是N2,H2,CO2)1年前查看全部
- 联合制碱法的碱是什么
 zhengqing181年前1
zhengqing181年前1 -
 zuohuiziji 共回答了13个问题
zuohuiziji 共回答了13个问题 |采纳率100%纯碱1年前查看全部
- 侯德榜的联合制碱法的原理,
 A200101931年前1
A200101931年前1 -
 nxwzxkt5 共回答了22个问题
nxwzxkt5 共回答了22个问题 |采纳率77.3%(联合制碱法) (1)NH3+H2O+CO2=NH4HCO3(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓ (3)2NaHCO3=加热=Na2CO3+H2O+CO2↑即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3=加热=Na2CO3+H2O+CO2↑氨气与水和二氧化碳反...1年前查看全部
- 谁能详细的为我讲解一下侯俊德的侯氏联合制碱法的流程和其对应的化学方程式?
 mrsa1年前1
mrsa1年前1 -
 豆渣 共回答了13个问题
豆渣 共回答了13个问题 |采纳率100%1)NH3+H2O+CO2=NH4HCO3(首先通入氨气,然后再通入二氧化碳)(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(NaHCO3溶解度最小,所以析出.)(3)2NaHCO3=Na2CO3+CO2↑+H2O(NaHCO3热稳定性很差,受热容易分解)1年前查看全部
- 利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96
利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%。其原理流程如下图所示: 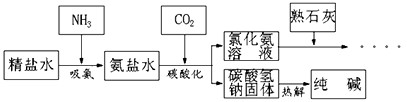
(1)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水)。氨盐水比食盐水更容易吸收二氧化碳,其原因是__________________;
(2)写出氯化铵溶液与熟石灰反应的化学方程式__________________。 咆哮信1年前1
咆哮信1年前1 -
 littleyaoyao 共回答了20个问题
littleyaoyao 共回答了20个问题 |采纳率85%(1)氨盐水显碱性
(2)NH 4 Cl+Ca(OH) 2 ==CaCl 2 +H 2 O+NH 3 ↑1年前查看全部
- (2013•长宁区一模)氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,
(2013•长宁区一模)氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,
下列表达不正确的是( )氨碱法 联合制碱法 A 原料 食盐、氨气、生石灰 食盐、氨气、二氧化碳 B 可能的副产物 氯化钙 氯化铵 C 循环物质 氨气、二氧化碳 氯化钠 D 评价 原料易得;设备复杂;能耗高 原料利用率高;废弃物少
A.A
B.B
C.C
D.D joyrock1年前1
joyrock1年前1 -
 耗儿爱上猫 共回答了19个问题
耗儿爱上猫 共回答了19个问题 |采纳率78.9%解题思路:氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱.先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液.其化学反应原理是:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品:2NaHCO3
Na2CO3+CO2↑+H2O,放出的二氧化碳气体可回收循环使用.△ .
含有氯化铵的滤液与石灰乳(Ca(OH)2)混合加热,所放出的氨气可回收循环使用,CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液.
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体.由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品.此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用.
联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.A、氨碱法原料有:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气,联合制碱法原料有:食盐、氨气、二氧化碳,故A错误;
B、氨碱法可能的副产物为氯化钙,联合制碱法可能的副产物氯化铵,故B正确;
C、氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠,二氧化碳,故C错误;
D、氨碱法原料(食盐和石灰石)便宜,产品纯碱的纯度高,副产品氨和二氧化碳都可以回收循环使用,制造步骤简单,适合于大规模生产,但设备复杂;能耗高,氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,故D正确;
故选AC.点评:
本题考点: 纯碱工业(侯氏制碱法).
考点点评: 本题主要考查了氨碱法(索氏)和联合制碱法(侯氏)的原理,掌握原理是解题的关键,难度中等以上.1年前查看全部
- 有关侯氏制碱法候德榜发明了联合制碱法.联合制碱法中的碱属于盐,它的浓溶液与澄清石灰水反应的化学方程式为----
 snowwie1年前1
snowwie1年前1 -
 yongyuan 共回答了14个问题
yongyuan 共回答了14个问题 |采纳率92.9%联合制碱法中的碱就是碳酸钠,它的浓溶液与澄清石灰水反应的化学方程式为:
Na2CO3 + Ca(OH)2 = CaCO3(沉淀) + 2NaOH1年前查看全部
- 求联合制碱法(候氏制碱法)化学式 好像是4个
 guilinmifen1年前2
guilinmifen1年前2 -
 riqi027 共回答了23个问题
riqi027 共回答了23个问题 |采纳率91.3%NH3+CO2+H20=NH4HCO3
NH4HCO3+NaCl(饱和食盐水)=NaHCO3(沉淀)+NH4Cl
2NaHCO3=加热=Na2CO3+H2O+CO2(气体)1年前查看全部
- 联合制碱法与氨碱法中的CO2的来源有何不同
 sailor0281年前2
sailor0281年前2 -
 超级老鼠 共回答了22个问题
超级老鼠 共回答了22个问题 |采纳率86.4%(联合制碱法)
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3=加热=Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
②2NaHCO3=加热=Na2CO3+H2O+CO2↑
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为他的溶解度较小.
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥.
此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序.
氨减法 CaCO3=CaO+CO2
NH3+CO2+H2O===NH4HCO3
NH4HCO3+NaCl===NaHCO3+NH4Cl
2NaHCO3===Na2CO3+CO2 +H2O
反应生成的CO2可以回收再用,而NH4Cl又可以与生石灰反应,产生NH3,重新作为原料使用:2NH4Cl+CaO===2NH3+CaCl2+H2O1年前查看全部
- 用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g.试计算:该厂生产的纯碱中碳酸钠的质量分数.(计算结果精确到0.1%)
 Q匠1年前1
Q匠1年前1 -
 媚色无边 共回答了25个问题
媚色无边 共回答了25个问题 |采纳率92%解题思路:碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,烧杯中的物质前后减少的质量为二氧化碳的质量,根据二氧化碳的质量可求出碳酸钠的质量,再根据 [碳酸钠的质量/样品的质量]×100%,可求出纯碱样品中碳酸钠的质量分数.生成二氧化碳的质量为:12g+73g-80.6g=4.4g
设12g纯碱试样中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 4.4g
[106/x]=[44/4.4g]
解得x=10.6g
所以碳酸钠的质量分数为:[10.6g/12g]×100%≈88.3%
答:该厂生产的纯碱中碳酸钠的质量分数88.3%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 当知道反应前后物质的质量时,通常要使用质量守恒定律,二氧化碳的质量根据质量守恒定律,这是解答本题的关键,然后根据方程式计算即可,注意解题格式要规范.1年前查看全部
- 我国著名化学家侯德榜发明的联合制碱法,主要原理是:向浓氨水(NH 3 •H 2 O)中通入足量的CO 2 生成NH 4
我国著名化学家侯德榜发明的联合制碱法,主要原理是:向浓氨水(NH 3 •H 2 O)中通入足量的CO 2 生成NH 4 HCO 3 (碳酸氢铵),然后加入食盐充分搅拌,两者发生复分解反应,由于碳酸氢钠的溶解度很小,便呈晶体析出,将析出的碳酸氢钠加热得碳酸钠,二氧化碳和水.请写出上述原理的三个化学方程式:
①______;
②______;
③______. szwolf1年前1
szwolf1年前1 -
 wvak9 共回答了23个问题
wvak9 共回答了23个问题 |采纳率95.7%①浓氨水和二氧化碳反应生成碳酸氢铵,故答案为:NH 3 •H 2 O+CO 2 =NH 4 HCO 3 ,
②碳酸氢钠的溶解度很小,表现为沉淀,所以可以发生复分解反应,碳酸氢铵和氯化钠反应生成碳酸氢钠和氯化铵,故答案为:NH 4 HCO 3 +NaCl=NH 4 Cl+NaHCO 3 ↓,
③碳酸氢钠在受热的条件下生成碳酸钠、水和二氧化碳,故答案为:2NaHCO 3
△
.
Na 2 CO 3 +H 2 O+CO 2 ↑1年前查看全部
- (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3
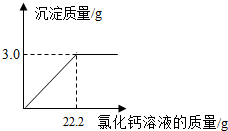 (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(1)该纯碱样品中碳酸钠的质量分数.(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数. uu11061年前1
uu11061年前1 -
 adslb214000 共回答了21个问题
adslb214000 共回答了21个问题 |采纳率95.2%解题思路:(1)欲求该纯碱样品中碳酸钠的质量分数,须先根据化学方程式求出样品中碳酸钠的质量,再利用质量分数公式计算即可.
(2)欲求所加入氯化钙溶液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=[溶质质量/溶液质量]×100%计算即可.设该纯碱样品中碳酸钠的质量为x,22.2g氯化钙溶液中溶质的质量为y,则Na2CO3+CaCl2=CaCO3↓+2NaCl106 111 100x y 3.0g...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生对物质质量分数和溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.1年前查看全部
- 我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:
我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:

(1)NH 3 溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液呈 色.
(2)写出反应I的化学方程式 ;该反应的基本类型为 .
(3)操作a的过程是蒸发浓缩、 、过滤.
(4)上述工艺流程中可循环利用的物质是 . _漏网之灵_1年前1
_漏网之灵_1年前1 -
 helloark 共回答了13个问题
helloark 共回答了13个问题 |采纳率100%1年前查看全部
- (2008•昌平区一模)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产
 (2008•昌平区一模)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3
(2008•昌平区一模)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3
Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.△ .
请解答下列问题:
(1)100g混合物中NaHCO3的质量分数是多少?
(2)反应后所得碳酸钠的质量是多少?
(3)小军要配制20℃时Na2CO3的饱和溶液,查找资料,得到下表.
根据上表数据计算,20℃时用43g Na2CO3配制成饱和溶液的质量为______g.温度溶解度盐 10℃ 20℃ 30℃ 40℃ Na2CO3 12.5g 21.5g 39.7g 49.0g NaHCO3 8.1g 9.6g 11.1g 12.7g  haibo77821年前0
haibo77821年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl 2 废弃物,写出该工艺中产生CaCl 2 的化学方程式:_________________________________________________;
②写出“联合制碱法”有关反应的化学方程式_________________ _; 。
③CO 2 是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO 2 的来源有何不同?________________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
①炼钢时,加入硅、锰和铝的目的是_______________________________。
②不锈钢含有的Cr元素是在炼钢过程的氧吹__ __(填“前”或“后”)加入。
③炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。 huamingxu12081年前0
huamingxu12081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 联合制碱法中副产品氯化铵的用途关于制碱环节的一种用途~
 白裸谁不裸1年前1
白裸谁不裸1年前1 -
 wanglekuqi 共回答了18个问题
wanglekuqi 共回答了18个问题 |采纳率94.4%化肥
焊药1年前查看全部
- (2013•樊城区模拟)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱
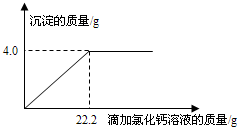 (2013•樊城区模拟)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品4.4g,充分溶解于27.4g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(2013•樊城区模拟)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品4.4g,充分溶解于27.4g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(1)该纯碱样品中碳酸钠的质量分数.(精确到0.1%)
(2)到恰好不再产生沉淀时为止所得溶液中溶质的质量分数. wangfan02141年前1
wangfan02141年前1 -
 荆棘无声 共回答了15个问题
荆棘无声 共回答了15个问题 |采纳率86.7%解题思路:根据图示中的数据可知碳酸钠和氯化钙反应生成的碳酸钙沉淀的质量为4.0g,然后根据化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl求出碳酸钠的质量,根据Na2CO3+CaCl2=CaCO3↓+2NaCl还可求出氯化钙和氯化钠的质量;根据质量守恒定律过滤后所得溶液的质量为4.4g+27.4g+22.2g-4.0g=50g,然后根据氯化钠溶液溶质质量分数等于氯化钠的质量比上氯化钠溶液的质量乘以100%即可解答.设原样品中含碳酸钠质量为X,到恰好不再产生沉淀时生成氯化钠质量为Y
Na2CO3+CaCl2=Ca CO3↓+2NaCl
106100117
x 4gy
[106/x=
100
4g=
117
y]
x=4.24g
y=4.68g
(1)该纯碱样品中碳酸钠的质量分数为:[4.24g/4.4g]×100%=96.4%
(2)到恰好不再产生沉淀时为止所得溶液中溶质的质量分数为
4.68g+(4.4g−4.24g)
27.4g+4.4g+22.2g−4g×100%=9.68%;
答:(1)该纯碱样品中碳酸钠的质量分数为:96.4%.
(2)到恰好不再产生沉淀时为止所得溶液中溶质的质量分数为9.68%;点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- (2010•东莞模拟)“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,实验步骤如下:
(2010•东莞模拟)“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,实验步骤如下:
①小明称取该纯碱样品3.3g,充分溶解于水中
②滴加氯化钙溶液产生沉淀,共用去氯化钙溶液22.2 g,经过过滤、洗涤、干燥、称量所得白色固3.0 g.
试求:
(1)实验过程中产生的不溶物是:______,它的质量为______g
(2)该纯碱样品中碳酸钠的质量分数.(精确到0.1%) 就是不想做淑女1年前1
就是不想做淑女1年前1 -
 阿速速 共回答了19个问题
阿速速 共回答了19个问题 |采纳率78.9%解题思路:(1)实验过程中产生的不溶物是碳酸钠与氯化钙反应生的碳酸钙沉淀.
(2)要求纯碱样品中碳酸钠的质量分数,必须要知道纯碱的质量和碳酸钠的质量.纯碱的质量已经知道,碳酸钠的质量不知道,但是知道碳酸钠和氯化钙反应生成的碳酸钙的质量,可根据碳酸钙的质量求出碳酸钠的质量.(1)实验过程中产生的不溶物是:CaCO3,它的质量为3g.
(2)设碳酸钠的质量为X,
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
X3g
106:X=100:3g
X=3.18g
纯碱样品中碳酸钠的质量分数=
3.18g
3.3g×100%=96.4%
答:纯碱样品中碳酸钠的质量分数为96.4%点评:
本题考点: 实验探究物质的组成成分以及含量;碳酸钠、碳酸氢钠与碳酸钙;根据化学反应方程式的计算.
考点点评: 本题是一道有关化学方程式的计算题,解第二小题这类题时要从问题着手考虑.1年前查看全部
- 侯式联合制碱法中的碱是
 甲戌1年前4
甲戌1年前4 -
 zyphre 共回答了23个问题
zyphre 共回答了23个问题 |采纳率78.3%Na2CO3就是日常生活中发酵用的碱1年前查看全部
- 我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:
我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:
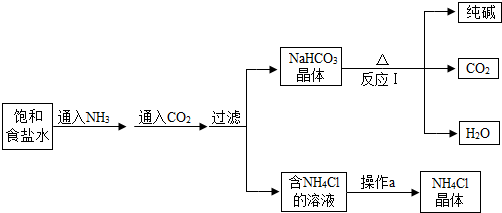
(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液呈______色.
(2)写出反应I的化学方程式2NaHCO3
Na2CO3+H2O+CO2↑△ .2NaHCO3;该反应的基本类型为______.
Na2CO3+H2O+CO2↑△ .
(3)操作a的过程是蒸发浓缩、______、过滤.
(4)上述工艺流程中可循环利用的物质是______. wuchao75391年前1
wuchao75391年前1 -
 wizardiecb 共回答了16个问题
wizardiecb 共回答了16个问题 |采纳率100%解题思路:(1)根据氨气的水溶液显碱性分析.
(2)根据反应写出反应的方程式,根据反应的特点分析反应的类型.
(3)根据从氯化铵的溶液中得到氯化铵的过程分析.
(4)观察分析工艺流程,找出可循环利用的物质.(1)NH3溶于水得到氨水,氨水显碱性,将无色酚酞溶液滴入氨水中,溶液呈红色.
(2)由工艺流程可知,碳酸氢钠受热分解生成了碳酸钠、二氧化碳和水,反应的方程式是:2NaHCO3
△
.
Na2CO3+H2O+CO2↑.该反应由一种物质生成了三种物质,属于分解反应.
(3)从氯化铵的溶液中得到氯化铵的过程是蒸发浓缩、结晶、过滤.
(4)由工艺流程中可知,向饱和的食盐水中通入了二氧化碳,在加热碳酸氢钠时又生成了二氧化碳,所以,可循环利用的物质是CO2.
故答为:(1)红;(2)2NaHCO3
△
.
Na2CO3+H2O+CO2↑,分解反应;(3)结晶;(4)CO2.点评:
本题考点: 纯碱的制取;酸碱指示剂及其性质;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学来源于生产、生活,又服务于生产、生活,本题很好的体现了这一理念;该题涉及化学方程式的书写,反应类型的判断等知识,要根据相关知识细心分析解答.1年前查看全部
- 联合制碱法中氨气的作用
 酷酷酷鱼1年前1
酷酷酷鱼1年前1 -
 姜子牙牙疼 共回答了22个问题
姜子牙牙疼 共回答了22个问题 |采纳率72.7%联合制碱法又称侯氏制碱法,用于在工业上制取纯碱(Na2CO3),由侯德榜于1943年发明,是世界上广泛采用的制纯碱法.
具体过程为:在饱和氨盐水中(氨气,氯化钠都达到饱和的溶液)通入二氧化碳从而发生如下反应:
NH3 + CO2 + H2O + NaCl = NH4Cl + NaHCO3↓
2NaHCO3 -加热→ Na2CO3 + CO2↑ + H2O
为了获取存留在溶液中的氯化铵,在废液中加入氯化钠,并在30~40°C下向废液中通入氨气,然后降温到10°C以下,由于氯化铵在30°C时的溶解度比氯化钠大,而在10°C下溶解度比氯化钠小,以及同离子效应,使氯化铵从母液析出,其母液又可作为下一次制碱的原料,重复利用.1年前查看全部
- 联合制碱法和氨碱法的区别
 快乐12451年前1
快乐12451年前1 -
 机秘行动 共回答了25个问题
机秘行动 共回答了25个问题 |采纳率80%1.把氨厂和碱厂建在一起,联合生产.由氨厂提供碱厂需要的氨和二氧化碳.
2.使食盐的利用率提高到 96 %
3.与合成氨厂联合,使合成氨的原料气CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序.
低调の小鑫 | 2011-06-12
3
01年前查看全部
- 我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
 我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
(1)纯碱(Na2CO3)属于______类物质(填“酸”、“碱”或“盐”).向纯碱的水溶液中滴入酚酞试液,试液变红色,则其pH______7(填“=”、“<”或“>”).
(2)“联合制碱法”生产过程用化学方程式可简要表示为:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl
③2NaHCO3
Na2CO3+H2O+CO2↑△ .
该过程中没有涉及到的基本反应类型是(______)
A.化合反应B.分解反应C.置换反应D.复分解反应
(3)第②步中加入的是磨细食盐粉.食盐磨细的目的是:______
(4)从图中溶解度曲线中,你能获得的信息有:(写出2条)
______
(5)将第②步所得滤液(NH4Cl与剩余NaCl的混合溶液)
降温,NH4Cl晶体大量析出,而NaCl却仍留在了溶液中.
结合上图,你认为可能原因是:______.
所得NH4Cl属于化学肥料中的______肥,其中氮元素的质量分数为______.(精确到0.1%) leehom131年前1
leehom131年前1 -
 雨打芭蕉1976 共回答了13个问题
雨打芭蕉1976 共回答了13个问题 |采纳率100%解题思路:(1)根据碳酸钠的组成和结构判断物质种类;根据碳酸钠溶液呈碱性判断其pH大小.
(2)根据四种基本反应类型的定义和特点回答.
(3)根据磨细食盐粉的表面积增大分析回答.
(4)根据溶解度曲线的含义和信息回答.
(5)根据氯化钠和氯化铵的溶解度受温度影响的情况回答前一空;根据氯化铵的组成回答第二空;根据氯化铵的化学式和元素质量分数的公式计算后一空.(1)碳酸钠是由钠离子和碳酸根离子构成的,属于盐类,其水溶液呈碱性,溶液的pH大于7.
(2)①NH3+CO2+H2O=NH4HCO3的特点是“多变一”,符合化合反应的定义和特点,为化合反应,
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl的特点是“两交换,价不变”,符合复分解反应的定义和特点,为复分解反应,③2NaHCO3
△
.
Na2CO3+H2O+CO2↑的特点是“一变多”,符合分解反应的定义和特点,为分解反应,缺少的基本反应类型是置换反应.
(3)磨细食盐粉的表面积增大,加快食盐溶解,增大食盐和碳酸氢铵的接触面积,进而加快反应速率.
(4)由图示的溶解度曲线可得多种信息,如:NH4Cl溶解度随温度升高而明显增大,或NaCl溶解度受温度影响不大,或t℃时,NH4Cl和NaCl的溶解度相同,或20℃时,NaCl的溶解度为36g等.
(5)NH4Cl溶解度受温度影响较大,且随温度降低而明显减小,而NaCl溶解度受温度影响不大,所以降温后NH4Cl晶体大量析出,而NaCl却仍留在了溶液中;氯化铵中含有氮元素,为氮肥;氯化铵的化学式为NH4Cl,其中氮元素的质量分数为[14/14+1×4+35.5]×100%=26.2%.
故答案为:
(1)盐;>;
(2)C;
(3)增大食盐和水的接触面积,加快食盐溶解,进而加快反应速率;
(4)NH4Cl溶解度随温度升高而NaCl溶解度受温度影响不大.(或t℃时,NH4Cl和NaCl的溶解度相同;20℃时,NaCl的溶解度为36g.);
(5)NH4Cl溶解度受温度影响较大,而NaCl溶解度受温度影响不大;氮;26.2%.点评:
本题考点: 纯碱的制取;影响溶解快慢的因素;固体溶解度的影响因素;固体溶解度曲线及其作用;溶液的酸碱性与pH值的关系;常见化肥的种类和作用;常见的氧化物、酸、碱和盐的判别;元素的质量分数计算;反应类型的判定.
考点点评: 学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,二氧化碳和氨气通入的顺序及原因,反应时析出碳酸氢钠的原因与物质溶解度的关系等重点内容.1年前查看全部
- 根据综合反应,联合制碱法的原子利用率怎么算
 32630561年前1
32630561年前1 -
 xiexm 共回答了13个问题
xiexm 共回答了13个问题 |采纳率100%一,把所有化学反应物都加起来,二,把所有化学生成物都加起来.三如果反应物和生成物有相同的就去掉,四,设目标产物为一摩尔,算出生成物的目标产物的质量,然后算出所有生成物的质量.五,用生成物的目标产物的质量除以所有生成物的质量=原子利用率1年前查看全部
- 在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱。某纯碱生产厂制得的产品Na 2 CO 3 中
在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱。某纯碱生产厂制得的产品Na 2 CO 3 中混有少量NaHCO 3 。为了测定产品中Na 2 CO 3 的质量分数,取100g混合物加热(2NaHCO 3
 Na 2 CO 3 +CO 2 ↑+H 2 O, Na 2 CO 3 受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
Na 2 CO 3 +CO 2 ↑+H 2 O, Na 2 CO 3 受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。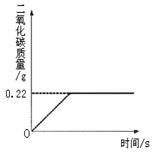
请解答下列问题:
(1)反应过程中生成二氧化碳的质量为 g
(2)100g混合物中NaHCO 3 的质量; 金巧巧1年前1
金巧巧1年前1 -
 翩翩越位 共回答了21个问题
翩翩越位 共回答了21个问题 |采纳率90.5%1年前查看全部
- 联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12
联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g.试计算:
(1)生成二氧化碳气体的质量是______g.
(2)该厂生产的纯碱中碳酸钠的质量分数.(计算结果精确到0.1%)
(3)反应后所得溶液中溶质的质量分数. wuweijuangjun1年前1
wuweijuangjun1年前1 -
 ZZ1616 共回答了23个问题
ZZ1616 共回答了23个问题 |采纳率91.3%解题思路:反应前后的质量差即为反应生成二氧化碳的质量;
根据二氧化碳的质量可以计算碳酸钠的质量、生成氯化钠的质量,进一步可以计算纯碱中碳酸钠的质量分数和反应后所得溶液中溶质的质量分数.(1)生成二氧化碳气体的质量为:12g+73g-80.6g=4.4g,
故填:4.4.
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 117 44
x y 4.4g
[106/x]=[117/y]=[44/4.4g],
x=10.6g,y=11.7g,
该厂生产的纯碱中碳酸钠的质量分数为:[10.6g/12g]×100%=88.3%,
答:该厂生产的纯碱中碳酸钠的质量分数为88.3%.
(3)反应后所得溶液中溶质的质量分数为:
11.7g+(12g−10.6g)
80.6g×100%=16.3%,
答:反应后所得溶液中溶质的质量分数为16.3%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- (2008•张家界)侯德榜先生潜必研究制碱技术,成功地发明了联合制碱法.其中关键一步的反应原理可表示为:NH3+CO2+
(2008•张家界)侯德榜先生潜必研究制碱技术,成功地发明了联合制碱法.其中关键一步的反应原理可表示为:NH3+CO2+H2O+NaCl═NaHCO3+X,则X的化学式为( )
A.NH3
B.NH3C1
C.NH4C1
D.NH5C1 hailuosun1年前1
hailuosun1年前1 -
 li598333861 共回答了22个问题
li598333861 共回答了22个问题 |采纳率81.8%解题思路:根据反应前后原子种类、数目不变,利用反应的化学方程式,判断生成物X的分子构成,确定物质X的化学式.反应的化学方程式NH3+CO2+H2O+NaCl═NaHCO3+X,可知可知反应前各原子个数为:
反应前 反应后
Na原子 1 1
Cl原子 1 0
N原子 1 0
H原子 5 1
C原子 1 1
O原子 3 3
根据反应前后原子种类、数目不变,可判断生成物X的一个分子由4个H原子、1个N原子、1个Cl原子构成,4个H原子与1个N原子可形成NH4+,因此可确定物质X的化学式可表示为NH4Cl.
故选C.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.1年前查看全部
- 用“侯氏联合制碱法”制取的纯碱中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放
用“侯氏联合制碱法”制取的纯碱中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g.
试计算:
(1)产生二氧化碳气体的质量是______g.
(2)该纯碱样品中氯化钠钠的质量.
(3)此次反应所得溶液中溶质质量分数.(计算结果精确到0.1%) very_boy1年前1
very_boy1年前1 -
 顶着风干 共回答了21个问题
顶着风干 共回答了21个问题 |采纳率76.2%解题思路:(1)烧杯中的物质前后减少的质量为二氧化碳的质量.
(2)根据二氧化碳的质量可求出碳酸钠的质量,进而可求出纯碱样品中碳酸钠的质量分数.
(3)依据反应方程式可求生成的氯化钠质量,同时可依据碳酸钠的质量求出原混合物中氯化钠的质量,进而依据反应后溶液的质量求出所得溶液的溶质质量分数;(1)二氧化碳的质量=12g+73g-80.6g=4.4g
(2)设样品中Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
[106/x=
117
y=
44
4.4g]
∴x=10.6g y=11.7g
纯碱样品中NaCl的质量═12g-10.6g=1.4g
(3)溶液中NaCl的总质量═11.7g+1.4g=13.1g
反应所得溶液中溶质质量分数═[13.1g/80.6g]×100%≈16.3%
故答案为:(1)4.4;(2)该纯碱样品中氯化钠的质量是1.4g;(3)答:此次反应所得溶液中溶质质量分数是16.3%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成二氧化碳的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.1年前查看全部
- 用‘侯氏联合制碱法’制得的纯碱常常含有少量的氯化钠,为测定某纯碱样品中碳酸钠的含量,小新称取该纯碱
 xiabin3500071年前1
xiabin3500071年前1 -
 a47249954 共回答了16个问题
a47249954 共回答了16个问题 |采纳率100%加入HCI
测气体的质量(初中)或体积(高中)
之后用比例式就可以算出百分数1年前查看全部
- 侯氏联合制碱法的化学反应与过程
 清幽一族1年前1
清幽一族1年前1 -
 runkey 共回答了25个问题
runkey 共回答了25个问题 |采纳率96%1 向已经氨化的饱和食盐水中通入二氧化碳
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出)
2 加热碳酸氢钠,得到碳酸钠
2NaHCO3=Na2CO3+H2O+CO2
3 利用碳酸钠通入石灰水,制得氢氧化钠
Na2CO3+Ca(OH)2=2NaOH+CaCO3
4 培烧碳酸钙,得到二氧化碳循环
CaCO3=CaO+CO2
CaO+H2O=Ca(OH)2
ps:
嗯.你说的:
一、向浓铵水中通入足量CO2生成碳铵
NH3 +H2O +CO2 = NH4HCO3
二、再加入食盐细末搅拌
NH4HCO3 +NaCl = NH4Cl +NaHCO3 (析出)
三、碳酸氢钠加热
2NaHCO3 = Na2CO3 +H2O +CO2 (气体)
参考资料:http://zhidao.baidu.com/question/18836654.html?fr=qrl31年前查看全部
- 常用于改良酸性土壤的物质是____ ,候氏联合制碱法所制得的碱是____,化学符号表示,急用
 happyxuanzi1年前2
happyxuanzi1年前2 -
 激发大家v从 共回答了17个问题
激发大家v从 共回答了17个问题 |采纳率100%答案:1、(Ca(OH)2又名:熟石灰)2、Na2CO31年前查看全部
- 用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g
(1)产生CO2的质量是---
(2)该厂生产的纯碱中碳酸钠的质量分数.(计算结果精确到0.1%) 南昌的叶子1年前1
南昌的叶子1年前1 -
 shahuwan 共回答了17个问题
shahuwan 共回答了17个问题 |采纳率94.1%m(CO2)=12+73-80.6=4.4g
设Na2CO3质量为X
则: Na2CO3+HCl== NaCl+H2O+CO2↑
106 44
x 4.4g
列比例式 106/x=44/4.4g
x=10.6g
质量分数=10.6g/12g*100=88.3%1年前查看全部
- 联合制碱法 用英文怎么说就是侯徳榜的那个
 看老天的脸色11年前2
看老天的脸色11年前2 -
 dd_cut 共回答了23个问题
dd_cut 共回答了23个问题 |采纳率100%Hou's process(for soda manufacture)
侯氏制碱法1年前查看全部
- (2012•庐阳区一模)“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示
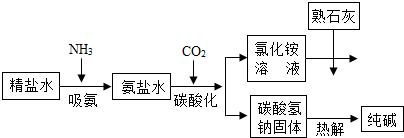 (2012•庐阳区一模)“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
(2012•庐阳区一模)“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
(1)写出流程中一种氧化物的化学式______.
(2)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合溶液(称为氨盐水).氨盐水比食盐水更容易吸收二氧化碳,其原因是______.
(3)工业生产纯碱的流程中,碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因是______.
(4)写出氯化铵溶液与熟石灰反应的化学方程式______.
(5)氯化钙常用于合成药物,青少年正处于生长发育阶段,需要摄入足够的钙,写出一个合理的补钙方法:______. ngsdfa1年前1
ngsdfa1年前1 -
 siku 共回答了24个问题
siku 共回答了24个问题 |采纳率87.5%解题思路:(1)流程中需要二氧化碳,碳酸氢钠受热分解能生成碳酸钠、水和二氧化碳,二氧化碳和水都属于氧化物;
(2)食盐水显中性,氨水显碱性,所以氨盐水显碱性,比食盐水更容易吸收二氧化碳;
(3)相同条件下,溶质的溶解度越小,越容易从溶液中析出;
(4)氯化铵溶液与熟石灰反应能生成氯化钙、水和氨气;
(5)钙元素在人体中含量较多,属于常量元素.(1)水和二氧化碳都属于氧化物,化学式分别为H2O、CO2.
故填:H2O或CO2.
(2)因为氨盐水显碱性,所以比食盐水更容易吸收二氧化碳.
故填:氨盐水显碱性.
(3)碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因是相同温度下,碳酸氢钠的溶解度小于碳酸钠的溶解度.
故填:相同温度下,碳酸氢钠的溶解度小于碳酸钠的溶解度.
(4)氯化铵和熟石灰反应能生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O.
故填:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O.
(5)多吃富含钙的食物可以为人体补充需要的钙元素.
故填:多吃富含钙的食物.点评:
本题考点: 纯碱的制取;从组成上识别氧化物;书写化学方程式、文字表达式、电离方程式;人体的元素组成与元素对人体健康的重要作用.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.1年前查看全部
- 我国著名化学家侯德榜发明的联合制碱法中的碱是指?
 forestcheng1年前1
forestcheng1年前1 -
 shaoyu6666 共回答了17个问题
shaoyu6666 共回答了17个问题 |采纳率100%侯氏制碱法:向饱和食盐水里通入足量的CO2和氨气,析出NaHCO3晶体
NH3+CO2+H20+NaCl====NaHCO3↓+NH4Cl
再加热NaHCO3固体,制得纯碱 Na2CO3
2NaHCO3=====Na2CO3+CO2↑+H2O
所以碱是Na2co31年前查看全部
- (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3
 (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(1)该纯碱样品中碳酸钠的质量分数.(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数. 催花东子1年前1
催花东子1年前1 -
 wangxinrong 共回答了21个问题
wangxinrong 共回答了21个问题 |采纳率95.2%设该纯碱样品中碳酸钠的质量为x,22.2g氯化钙溶液中溶质的质量为y,则
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
x y 3.0g
[106/x=
111
y=
100
3]
解之得:x=3.18g,y=3.33g
所以,该纯碱样品中碳酸钠的质量分数为:[3.18/3.3]×100%=96.4%
所加入氯化钙溶液的溶质质量分数为:[3.33/22.2]×100%=15%
答:该纯碱样品中碳酸钠的质量分数为96.4%,所加入氯化钙溶液的溶质质量分数为15%.1年前查看全部
大家在问
- 1If you look for a book as a present for a child, you will be
- 2;如何比较不同周期,不同主族,电子层不相同的离子的氧化性,还原性以及离子的半径,用自己话详细说明,别复制啊,太多了,看不
- 3刚长出来的树苗,细得像笔杆,红的像什么
- 4文章结尾在结构和内容上分别有什么作用?
- 5电力拖动题目在具有过载保护接触器自锁控制线路中,熔断器,热继电器和接触器是如何起到各种保护作用的.
- 6联通是130.131.132.133 移动是134.135.136.137.138.139 ,158,159
- 7简便计算 【15分之8-(12分之7—5分之2)】×15分之15
- 8等腰△ABC的腰长AB为10cm,底边BC为16cm,则底边上的高为______.
- 9如果a=0.5b,(a和b均为非0自然数),那么a与b的最大公因数是______.a和b成______比例.
- 1036名师生看电影,学生票每人20元,成人票每人30元,共付款760元.问老师和生学各几人(用方程解)
- 11经过抛物线y2=2p(x+2p)(p>0)的顶点A作互相垂直的两直线分别交抛物线于B、C两点,求线段BC的中点M轨迹方程
- 12eve制造蓝图里材料后面的括号代表什么意思
- 13I can swim.改同义句I can football同义句
- 14葡萄、苹果果胶含量
- 15切合和符合的区别中考作文平分标准里一类文是切合题意,二类文是符合题意.符合和切合的差别在哪呢?