(1)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原
 kevin11222022-10-04 11:39:541条回答
kevin11222022-10-04 11:39:541条回答(2)人工模拟酶是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
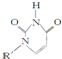 或C
或C(Ⅰ)如下图(Ⅰ表示化合价为+1)时,分别形成a和b:
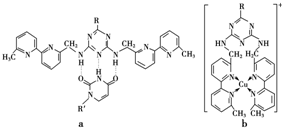
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有______键的特性.
②C、N、H、O四种元素的电负性由小到大的顺序为______.C与O构成的常见的CO2的电子式为______.写出N与O形成和CO2的等电子体物质的化学式为______.
③微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异______.
(③a中微粒间相互作用为分子间氢键和范德华力,b中是配位键)

已提交,审核后显示!提交回复
共1条回复
 hl_917 共回答了16个问题
hl_917 共回答了16个问题 |采纳率87.5%- 解题思路:(1)Ga是31号元素,其基态原子核外有31个电子,根据构造原理书写其原子核外电子排布式;
单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与但晶硅中Si的结构相似;
根据GaN的构成微粒确定晶体类型;
氮原子核外有7个电子,最外层有5个电子,最外层电子就是N元素价电子;
(2)①σ键可以旋转,π键不能旋转;
②元素的非金属性越强,其电负性越强,同一周期中,元素的电负性随着原子序数的增大而增大;二氧化碳分子中每个氧原子和碳原子形成共价双键;
原子个数相等价电子数相等的微粒为等电子体;
③a中含有含有氢键,b中含有配位键.(1)Ga原子是31号元素,Ga原子的电子排布式为1s22s22p63s23p63d104s24p1;GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体,氮原子核外有7个电子,最外层有5个电子,最外层电子就是N元素价电子,其价电子轨道表示式为,
 ,
,
故答案为:1s22s22p63s23p63d104s24p1;4;正四面体;原子; ;
;
(2)①σ键可以旋转,π键不能旋转,所以具有σ键的特点,故答案为:σ;
②元素的非金属性越强,其电负性越强,同一周期中,元素的电负性随着原子序数的增大而增大,所以C、N、H、O四种元素的电负性由小到大的顺序为H<C<N<O;二氧化碳分子中每个氧原子和碳原子形成共价双键,所以二氧化碳的电子式为 ,原子个数相等价电子数相等的微粒为等电子体,所以N与O形成和CO2的等电子体物质的化学式为N2O,
,原子个数相等价电子数相等的微粒为等电子体,所以N与O形成和CO2的等电子体物质的化学式为N2O,
故答案为:H<C<N<O; ;N2O;
;N2O;
③根据图片知,a中含有含有氢键,b中含有配位键,故答案为:a中含有含有氢键,b中含有配位键.点评:
本题考点: 原子核外电子排布;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了物质结构和性质,明确物质结构是解本题关键,结构决定性质,知道电负性大小的判断方法、电子式的书写规则,难度不大. - 1年前
相关推荐
- 1.某主族元素R的最高正价与最低负价的代数和为4,那么R一定是ⅥA族元素么?
1.某主族元素R的最高正价与最低负价的代数和为4,那么R一定是ⅥA族元素么?
2.在原子中对于第n层电子层,若他作为原子的最外层,则容纳的电子数最多与(n-1)层的相同;当他作为次外层时,则容纳的电子数比(n+1)层上电子数最多能多10个,则第n层为( )
A.L层 B.M层 C.N层 D.任意层
第二题答案选C 火舞凤翔1年前1
火舞凤翔1年前1 -
 squidGuard 共回答了21个问题
squidGuard 共回答了21个问题 |采纳率95.2%1.看着是对的,最高+6最低-2
2.M层,K最多2电子,L层8个,M层可以是8个或者18个.当它是最外层最多是8个电子,次外层的时候是18个所以应该是M1年前查看全部
- 下列说法正确的是( ) A.第IA族中的碱金属元素的金属性一定比ⅡA族元素的金属性强 B.第ⅦA族元素从上到下,其氢化
下列说法正确的是( ) A.第IA族中的碱金属元素的金属性一定比ⅡA族元素的金属性强 B.第ⅦA族元素从上到下,其氢化物的还原性依次减弱 C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 D.第三周期元素的离子半径从左到右逐渐减小  女五1年前1
女五1年前1 -
 mikepeters 共回答了14个问题
mikepeters 共回答了14个问题 |采纳率92.9%A.Li的金属性比Ba的弱,故A错误;
B.第ⅦA族元素从上到下,元素的非金属性逐渐减弱,其氢化物的还原性依次增强,故B错误;
C.P、S、Cl元素的非金属性逐渐增强,得电子能力逐渐增强,对应最高价氧化物对应的水化物的酸性依次增强,故C正确;
D.第三周期元素对应的离子有金属阳离子和阴离子,阳离子比阴离子少一个电子层,离子半径小于阴离子,故D错误.
故选C.1年前查看全部
- 下列叙述正确的是( )A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B.ⅠA族元素的金属性比
下列叙述正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.ⅥA族元素的氢化物中,稳定性最好的是H2O
D.第三周期元素的离子半径从左到右逐渐减小 zhangxiang221年前1
zhangxiang221年前1 -
 如冰若兰 共回答了19个问题
如冰若兰 共回答了19个问题 |采纳率94.7%解题思路:A.短周期元素中O、F没有正价;
B.Ca的金属性比Na强;
C.ⅥA族元素中,O的非金属性最强,气态氢化物越稳定;
D.电子层越多,半径越大;具有相同排布的离子,原子序数大的离子半径小.A.短周期元素中O、F没有正价,则除O、F外元素的最高化合价在数值上都等于该元素所属的族序数,故A错误;
B.Ca的金属性比Na强,在同一周期ⅠA族元素的金属性比ⅡA族元素的金属性强,故B错误;
C.ⅥA族元素中,O的非金属性最强,气态氢化物越稳定,则ⅥA族元素的氢化物中,稳定性最好的是H2O,故C正确;
D.电子层越多,半径越大;具有相同排布的离子,原子序数大的离子半径小,则第三周期元素的离子半径铝离子半径最小,阴离子半径大于阳离子半径,故D错误;
故选C.点评:
本题考点: 元素周期表的结构及其应用;元素周期律的作用.
考点点评: 本题考查元素周期表的结构及应用,为高频考点,把握元素的性质、位置及元素周期律为解答的关键,注重规律性知识的考查,题目难度不大.1年前查看全部
- 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
 borelist1年前3
borelist1年前3 -
 美丽寻粽 共回答了23个问题
美丽寻粽 共回答了23个问题 |采纳率95.7%对
8电子是稳定结构1年前查看全部
- 下列说法中正确的是( )A.分子中键能越大,键长越长,则分子越稳定B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子
下列说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间可能形成共价键
C.PCl5分子中P原子和Cl原子最外层都满足8电子结构
D.H-O键键能为463 kJ/mol,即18 gH2O分解成H2和O2时,消耗能量为2×463 kJ flyea1年前1
flyea1年前1 -
 猪头love猪猪 共回答了18个问题
猪头love猪猪 共回答了18个问题 |采纳率100%解题思路:A.根据键能、键长与分子稳定性的关系分析;
B.金属和非金属化合可能形成离子键,也可能形成共价键;
C.分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断;
D.1 molH2O中含2molH-O键,断开时需吸收2×463 kJ的能量形成气态氢原子和氧原子,再进一步形成H2和O2时,还需释放出一部分能量.A.分子中键能越大,键越短,则分子越稳定,故A错误;
B.金属和非金属化合可能形成离子键,也可能形成共价键,故B正确;
C.PCl5中,P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故C错误;
D.H-O键键能为463kJ/mol,指的是气态基态氢原子和氧原子形成1molH-O键时释放的最低能量,则拆开1molH-O键形成气态氢原子和氧原子所需吸收的能量也为463kJ,18gH2O 即1molH2O中含2molH-O键,断开时需吸收2×463 kJ的能量形成气态氢原子和氧原子,再进一步形成H2和O2时,还需释放出一部分能量,故D错误.
故选B.点评:
本题考点: 键能、键长、键角及其应用;共价键的形成及共价键的主要类型.
考点点评: 本题考查了键能、键长与分子稳定性的关系、共价键的形成、原子最外层电子、键能与能量的关系等知识点,难度不大,注意金属和非金属化合可能形成离子键,也可能形成共价键,如:氯化铝中氯元素和铝元素之间存在共价键.1年前查看全部
- 下列叙述中不正确的是( ) A.同周期元素中,ⅦA族元素的原子半径最小 B.常温时,
下列叙述中不正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最小 B.常温时,0族元素的单质都是气体 C.ⅠA族金属元素的单质,其原子序数越大,熔点越低 D.所有主族元素的原子,形成单原子离子时的化合价与它的族序数相等  芜茌荏1年前1
芜茌荏1年前1 -
 taly87 共回答了10个问题
taly87 共回答了10个问题 |采纳率70%1年前查看全部
- 下列有关物质结构和元素周期律的表述正确的是( ) A.ⅦA族元素是同周期中非金属性最强的元素 B.第二周期ⅣA族元素的
下列有关物质结构和元素周期律的表述正确的是( ) A.ⅦA族元素是同周期中非金属性最强的元素 B.第二周期ⅣA族元素的原子核电荷数和中子数分别为6 C.主族元素的最高正价均等于其族序数 D.非金属元素的气态氢化物溶于水后,水溶液均为酸性  madanhong7831年前1
madanhong7831年前1 -
 gfpp 共回答了17个问题
gfpp 共回答了17个问题 |采纳率88.2%A.因同周期从左向右元素的非金属性增强,则ⅦA族元素是同周期中非金属性最强的元素,故A正确;
B.第二周期ⅣA族元素的为C元素,则原子核电荷数一定为6,但中子数不一定为6,如13 C 的中子数为7,故B错误;
C.一般主族元素的最高正价均等于其族序数,但主族元素中F、O没有正价,则O、F除外,故C错误;
D.绝大多数非金属元素的气态氢化物溶于水后,水溶液为酸性,但氨气溶于水,溶于显碱性,故D错误;
故选A.1年前查看全部
- 下列叙述中正确的是( )A.同周期元素中,ⅦA族元素的原子半径最小,最易失去电子B.p轨道电子能量一定高于s轨道电子能
下列叙述中正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最小,最易失去电子
B.p轨道电子能量一定高于s轨道电子能量
C.键长越短,键能越大,含有该键的分子越稳定
D.s区、d区、ds区都是金属元素 mutouerhao1年前1
mutouerhao1年前1 -
 太平梳打加奶盐 共回答了20个问题
太平梳打加奶盐 共回答了20个问题 |采纳率65%解题思路:A.同周期,原子半径从左向右在减小,ⅦA族元素易得到电子;
B.3s电子能量大于2p电子能量;
C.共价键的键长短,共价键稳定;
D.s区含金属、非金属元素.A.同周期,原子半径从左向右在减小,则ⅦA族元素的原子半径最小,ⅦA族元素易得到电子形成8电子稳定结构,故A错误;
B.3s电子能量大于2p电子能量,应为相同能层时p轨道电子能量一定高于s轨道电子能量,故B错误;
C.分子的稳定性与共价键有关,则共价键的键长短,键能越大,含有该键的分子越稳定,故C正确;
D.s区含金属、非金属元素,如s区含H、N、O、F等非金属元素,故D错误;
故选C.点评:
本题考点: 元素周期表的结构及其应用;键能、键长、键角及其应用.
考点点评: 本题考查元素周期表的结构与应用,为高频考点,把握元素的位置及性质、元素周期律、分子稳定性及周期表中区的划分等为解答的关键,注重基础知识的考查,题目难度不大.1年前查看全部
- 下列说法错误的是( )A.第ⅤA族元素的几种气态氢化物中,NH3是稳定性最高的氢化物B.由于C22-和O22+为等电子
下列说法错误的是( )
A.第ⅤA族元素的几种气态氢化物中,NH3是稳定性最高的氢化物
B.由于C22-和O22+为等电子体,所以可以判断O22+的电子式为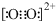
C.含离子键的纯净物一定存在金属元素
D.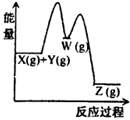 某反应X(g)+Y(g)⇌Z(g)△H<0 分两步进行:X(g)+Y(g)⇌W(g)△H>0和W(g)⇌Z(g)△H<0,反应过程中的能量变化如图
某反应X(g)+Y(g)⇌Z(g)△H<0 分两步进行:X(g)+Y(g)⇌W(g)△H>0和W(g)⇌Z(g)△H<0,反应过程中的能量变化如图  开不了口011年前1
开不了口011年前1 -
 dynason 共回答了23个问题
dynason 共回答了23个问题 |采纳率91.3%解题思路:A、原子的得电子能力越强,氢化物越稳定;
B、等电子体的结构相似,故O22+的电子式与C22-的电子式相似;
C、铵盐中含有离子键,属于离子化合物;
D、根据盖斯定律:化学反应的焓变只和反应物以及产物的能量有关,和路径无关.A、第ⅤA族元素的几种气态氢化物中,N原子的得电子能力越强,氢化物越稳定,所以NH3是稳定性最高的氢化物,故A正确;
B、根据等电子体的结构相似,O22+的电子式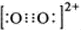 ,故B正确;
,故B正确;
C、铵盐是含离子键的纯净物,但是不存在金属元素,故C错误;
D、根据盖斯定律:X(g)+Y(g)⇌W(g)△H>0和W(g)⇌Z(g)△H<0,两个过程相加,可以得到反应X(g)+Y(g)⇌Z(g),根据图示,反应物的能量高于产物的能量,所以该反应△H<0,故D正确.
故选C.点评:
本题考点: 非金属在元素周期表中的位置及其性质递变的规律;离子键的形成;“等电子原理”的应用;反应热和焓变.
考点点评: 本题涉及元素周期律、等电子体的结构以及化学键、化学反应和能量变化间的关系等知识,属于综合知识的考查,难度不大.1年前查看全部
- 下列叙述正确的是( )A.ⅠA族元素单质的熔点从上往下逐渐降低B.分子晶体中一定存在共价键C.ⅥA族元素的氢化物中,稳
下列叙述正确的是( )
A.ⅠA族元素单质的熔点从上往下逐渐降低
B.分子晶体中一定存在共价键
C.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
D.同周期非金属氧化物对应的水化物的酸性从左往右依次增强 yual_19831年前1
yual_19831年前1 -
 似水年华-木头 共回答了17个问题
似水年华-木头 共回答了17个问题 |采纳率94.1%解题思路:A.碱金属单质的电荷相同,半径越大,单质的熔点越低;
B.稀有气体形成的晶体中不存在化学键;
C.ⅥA族元素的氢化物中,稳定性最好为水,含氢键;
D.同周期从左向右非金属性增强.A.碱金属元素的原子的半径随原子序数的增大而增大,则单质的熔点随原子序数的增大而降低,但H元素的单质最低,故A错误;
B.稀有气体形成的晶体中不存在化学键,则分子晶体中不一定存在共价键,故B错误;
C.ⅥA族元素的氢化物中,因O的非金属性最强,则稳定性最好为水,含氢键,则沸点最大,故C正确;
D.同周期从左向右非金属性增强,则非金属氧化物对应的水化物的酸性从左往右依次增强,但第二周期除外(O、F没有正价),故D错误;
故选C.点评:
本题考点: 元素周期表的结构及其应用;元素周期律的作用;共价键的形成及共价键的主要类型.
考点点评: 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,注意元素的性质特例,题目难度不大.1年前查看全部
- 下列叙述正确的是( )A.同周期元素中,ⅦA族元素的原子半径最大B.ⅠA族元素的原子,其半径越大,越容易得到电子C.室
下列叙述正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅠA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.所有主族元素的原子,形成单原子离子时的化合价与它的族序数相等 阿七哥1年前1
阿七哥1年前1 -
 huaqiaoty 共回答了18个问题
huaqiaoty 共回答了18个问题 |采纳率100%解题思路:A.同周期元素从左到右原子半径逐渐减小;
B.半径越大,越容易失去电子;
C.零族元素对应的晶体都是分子晶体,沸点较低;
D.一般来说,主族元素的最高正价与族序数相等.A.同周期元素从左到右原子半径逐渐减小,ⅦA族元素的原子半径最小,故A错误;B.半径越大,原子核对核外电子的吸引力越弱,越容易失去电子,故B错误;C.零族元素对应的晶体都是分子晶体,沸点较低,常温下都是气体...
点评:
本题考点: 同一主族内元素性质递变规律与原子结构的关系;同一周期内元素性质的递变规律与原子结构的关系.
考点点评: 本题考查元素周期律,为高考常见题型,侧重于学生的分析能力和基本概念的理解和运用的考查,难度中等,注意相关基础知识的积累.1年前查看全部
- ⅣA族元素单质的熔点随核电荷数的增加而逐渐升高?
ⅣA族元素单质的熔点随核电荷数的增加而逐渐升高?
是不是只有碱金属元素和卤素元素单质的熔点才会随核电荷数的增加而层周期性改变呢? 夏宇7241年前3
夏宇7241年前3 -
 dy98233 共回答了18个问题
dy98233 共回答了18个问题 |采纳率94.4%不是的,ⅣA族,碳是比较特殊的物质,他的溶沸点都在三四千度,因为它特殊的结构.而硅的熔点显然比碳低.
又如锡的熔点为231.9℃,铅的熔点为327.5℃.
在氧族元素也是这样的,但是决定熔点的不仅仅是核电荷数,最主要的还是成键方式,也就是化学键了.1年前查看全部
- A、B两元素为某周期ⅡA族和ⅢA族元素,若A族元素原子序数位m,则B元素的原子序数可能为?怎么作
 灵魂租借师1年前3
灵魂租借师1年前3 -
 沉静的火山 共回答了13个问题
沉静的火山 共回答了13个问题 |采纳率76.9%A在第2、3周期 B=m+1
A在第4周期 B=m+11
A在第5、6周期 B=m+25
主要考虑副族元素、镧系元素的存在1年前查看全部
- A、B两元素为某周期ⅡA族和ⅢA族元素,若A族元素原子序数位m,则B元素的原子序数可能为
A、B两元素为某周期ⅡA族和ⅢA族元素,若A族元素原子序数位m,则B元素的原子序数可能为
①m+1 ②m+81③m+11④m+18⑤m+25⑥m+32 markeii1年前1
markeii1年前1 -
 人生之旅你我他 共回答了21个问题
人生之旅你我他 共回答了21个问题 |采纳率100%1
3
51年前查看全部
- 下列叙述正确的是( )A.同周期元素中,ⅦA族元素的原子半径最大B.ⅥA族元素的原子,其半径越大,越容易得到电子C.室
下列叙述正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 dingxy_21年前1
dingxy_21年前1 -
 5uart 共回答了18个问题
5uart 共回答了18个问题 |采纳率94.4%解题思路:A.同周期从左到右,半径依次减小;
B.同主族,从上到下,半径逐渐增大,得电子能力依次减弱;
C.常温下,稀有气体都是气体;
D.注意一些元素的特殊性.A.VIIA族的原子半径是最小的,故A错误;
B.ⅥA族半径越大,说明非金属性越弱,越不容易得电子,故B错误;
C.零族元素俗称稀有气体,常温下呈气态,故C正确;
D.例如氯原子形成的单原子离子是Cl-,化合价是-1价,与其族序数不相等,氟只能形成-1价,而氟位于第7主族,故D错误;
故选C.点评:
本题考点: 元素周期律的作用;元素周期表的结构及其应用.
考点点评: 本题考查了元素周期律,注意元素周期表中的特殊元素结构和性质的特殊性.1年前查看全部
- 下列叙述中,正确的是( )A.同周期元素中,ⅦA族元素的原子半径最大B.ⅥA族元素的原子,其半径越大,越容易得到电子C
下列叙述中,正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB这8个纵行的元素都是金属元素 菲儿不哭1年前1
菲儿不哭1年前1 -
 vampirewolf 共回答了26个问题
vampirewolf 共回答了26个问题 |采纳率92.3%解题思路:A、同周期元素中原子半径从左向右逐渐减小;
B、同主族元素从上到下金属性增强,失去电子能力增强;
C、0族元素的单质为稀有气体;
D、元素周期表中从ⅢB到ⅡB,共10个纵行的元素都为过渡元素.A、因同周期元素中原子半径从左向右逐渐减小,则同周期元素中ⅦA族元素的原子半径最小,故A错误;
B、因同主族元素从上到下原子半径子增大,金属性在增强,失去电子能力增强,故B错误;
C、稀有气体在室温下均为气体,则室温时,0族元素的单质都是气体,故C正确;
D、因过渡元素都是金属元素,元素周期表中从ⅢB到ⅡB这10个纵行的元素都为过渡元素,故D错误;
故选C.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表和元素周期律,熟悉元素性质的变化规律及单质的性质、过渡元素的分布即可解答,难度不大.1年前查看全部
- 下列说法中正确的是 [ ] A.ⅠA、ⅡA族元素的原子,其半径越大,越难
下列说法中正确的是 [ ]A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.原子及其离子的核外电子层数等于该元素所在的周期数
D.所有主族元素的原子,都能形成单原子离子 空琥珀1年前1
空琥珀1年前1 -
 不能拉倒 共回答了22个问题
不能拉倒 共回答了22个问题 |采纳率90.9%B1年前查看全部
- 下列叙述正确的是 [ ] A.同周期元素中,ⅦA族元素的原子半径最大
下列叙述正确的是 [ ]A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.同一周期中,碱金属的第一电离能最小 天然酷丁茶1年前1
天然酷丁茶1年前1 -
 aachenaa 共回答了14个问题
aachenaa 共回答了14个问题 |采纳率78.6%CD1年前查看全部
- 下列叙述正确的是( )A.同周期元素中,VⅡA族元素的原子半径最大B.现已发现的零族元素的单质在常温常压下都是气体C.
下列叙述正确的是( )
A.同周期元素中,VⅡA族元素的原子半径最大
B.现已发现的零族元素的单质在常温常压下都是气体
C.ⅥA族元素的原子,其半径越大,越容易得到电子
D.所有的主族元素的简单离子的化合价与其族序数相等 fallenskull1年前1
fallenskull1年前1 -
 三月断心脉 共回答了23个问题
三月断心脉 共回答了23个问题 |采纳率91.3%A.同周期元素中,从左到右原子半径逐渐减小,VⅡA族元素的原子半径最小,故A错误;
B.零族元素常温下都为气体,故B正确;
C.ⅥA族元素的原子,其半径越大,原子序数越大,同主族元素原子序数越大,金属性越强,越易失去电子,故C错误;
D.主族元素的最高正价与族序数相等,而阴离子常常不同,故D错误.
故选B.1年前查看全部
- 下列叙述中正确的是( )A.同周期元素中,ⅦA族元素的原子半径最大B.同主族元素的原子,其半径越大,越容易得到电子C.
下列叙述中正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.同主族元素的原子,其半径越大,越容易得到电子
C.氧族元素的非金属性比同周期卤素的非金属性弱
D.所有主族元素形成单原子离子时的化合价都和它的族序数相等 百瑶芝1年前1
百瑶芝1年前1 -
 abuyue 共回答了21个问题
abuyue 共回答了21个问题 |采纳率81%解题思路:A、根据同周期元素原子半径的变化规律分析;
B、根据同主族元素性质的递变规律分析;
C、根据同周期元素的非金属性变化规律分析;
D、阴离子的化合价的绝对值与最高正价之和等于8,最高正价等于族序数.A、同周期元素原子半径从左到右逐渐减小,所以同周期元素中,ⅦA族元素的原子半径最小,故A错误;B、同主族元素从上到下原子半径逐渐增大,非金属性逐渐减弱,得电子能力逐渐减弱,故B错误;C、同周期元素从左到右非...
点评:
本题考点: 同一周期内元素性质的递变规律与原子结构的关系;同一主族内元素性质递变规律与原子结构的关系.
考点点评: 本题考查元素周期律,难度不大,注意对元素周期表中元素性质的递变规律的整体把握,侧重对基础知识的考查.1年前查看全部
- 下列关于稀有气体的叙述中,不正确的是( ) A.原子的最外电子层都有8个电子 B.其原子与同周期ⅥA、ⅦA族元素形成的
下列关于稀有气体的叙述中,不正确的是( ) A.原子的最外电子层都有8个电子 B.其原子与同周期ⅥA、ⅦA族元素形成的阴离子具有相同的核外电子排布 C.通常条件下,化学性质非常不活泼 D.原子核外电子的排布都达到了稳定结构  龙麒凤斗1年前1
龙麒凤斗1年前1 -
 xiezhigang1962 共回答了21个问题
xiezhigang1962 共回答了21个问题 |采纳率57.1%A.稀有气体氦原子的最外层电子数是2,故A错误;
B.同周期的第VIA、第VIIA族元素得到电子后,使最外层达到稳定结构,所以与其同周期的稀有气体电子层结构相同,故B正确;
C.稀有气体最外层达到稳定结构,所以稀有气体原子既不容易失电子也不容易得电子,导致其化学性质非常不活泼,故C正确;
D.第一能层作最外层最多排2个电子,其余能层作最外层最多排8个电子,稀有气体原子中最外层电子都排满,所以达到稳定结构,故D正确;
故选A.1年前查看全部
- 下列有关物质结构和元素周期律的表述正确的是 A.ⅦA族元素是同周期中非金属性最强的元素 B.第二周期ⅣA族元素的原子核电
下列有关物质结构和元素周期律的表述正确的是
A.ⅦA族元素是同周期中非金属性最强的元素 B.第二周期ⅣA族元素的原子核电荷数和中子数分别为6 C.主族元素的最高正价均等于其族序数 D.非金属元素的气态氢化物溶于水后,水溶液均为酸性  kfc_ly1年前1
kfc_ly1年前1 -
 明月踩花香 共回答了24个问题
明月踩花香 共回答了24个问题 |采纳率83.3%A
A正确,同周期从左到右,元素的非金属性逐渐增强;
B错,第二周期ⅣA族元素的原子为C原子,C原子有多种同位素,如碳-12、碳-13、碳-14等,中子数不一定为6。
C错,主族元素的最高正价均等于其族序数,但O、F除外,特别是F元素正价。
D错,非金属元素的气态氢化物溶于水后,水溶液不一定呈酸性,如氨气水溶液呈碱性。1年前查看全部
- 下列说法正确的是( )A.原子的L层上的电子数为奇数的元素一定是主族元素B.同一周期的ⅡA族和ⅢA族元素的原子序数之差
下列说法正确的是( )
A.原子的L层上的电子数为奇数的元素一定是主族元素
B.同一周期的ⅡA族和ⅢA族元素的原子序数之差一定为1
C.相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类
D.主族序数等于周期序数的元素一定为金属元素 小快乐1年前1
小快乐1年前1 -
 撑13587079234 共回答了19个问题
撑13587079234 共回答了19个问题 |采纳率84.2%解题思路:A.原子的L层上的电子数为奇数的元素,说明L层为填充满电子,元素为锂、硼、氮、氟;
B.在长周期中同周期ⅡA族和ⅢA族之间相差10列;
C.相邻两个周期的同一主族元素,如处于过渡元素之前,它们原子序数之差等于上一周期所含元素种类,若处于过渡元素之后,它们原子序数之差等于下一周期所含元素种类;
D.氢元素的主族序数等于周期序数.A.L层电子为奇数的所有元素为锂、硼、氮、氟,均为主族元素,故A正确;
B.短周期中,ⅡA族和ⅢA族元素相邻,原子序数之差为1,在长周期中同周期ⅡA族和ⅢA族之间相差10列,在四、五周期,原子序数形成11,六、七周期的第3列分别存在镧系元素、锕系元素,故在六、七周期,ⅡA族和ⅢA族之间相差25,故B错误;
C.相邻两个周期的同一主族元素,如处于过渡元素之前,它们原子序数之差等于上一周期所含元素种类,若处于过渡元素之后,它们原子序数之差等于下一周期所含元素种类,故C错误;
D.氢元素的主族序数等于周期序数,氢元素属于非金属元素,故D错误,
故选A.点评:
本题考点: 元素周期表的结构及其应用;元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表计算、核外电子排布等,难度不大,注意整体把握元素周期表的结构,注意列与族的关系.1年前查看全部
- 下列叙述正确的是( )A. 同周期元素中,ⅦA族元素的原子半径最大B. ⅥA族元素的原子,其半径越大,越容易得到电子C
下列叙述正确的是( )
A. 同周期元素中,ⅦA族元素的原子半径最大
B. ⅥA族元素的原子,其半径越大,越容易得到电子
C. 室温时,零族元素的单质都是气体
D. 所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 4611457811年前1
4611457811年前1 -
 公秦 共回答了17个问题
公秦 共回答了17个问题 |采纳率94.1%解题思路:A.同周期从左到右,半径依次减小;
B.同主族,从上到下,半径逐渐增大,得电子能力依次减弱;
C.常温下,稀有气体都是气体;
D.注意一些元素的特殊性.A.VIIA族的原子半径是最小的,故A错误;
B.ⅥA族半径越大,说明非金属性越弱,越不容易得电子,故B错误;
C.零族元素俗称稀有气体,常温下呈气态,故C正确;
D.例如氯原子形成的单原子离子是Cl-,化合价是-1价,与其族序数不相等,氟只能形成-1价,而氟位于第7主族,故D错误;
故选C.点评:
本题考点: 元素周期律的作用;元素周期表的结构及其应用.
考点点评: 本题考查了元素周期律,注意元素周期表中的特殊元素结构和性质的特殊性.1年前查看全部
- 下列说法中正确的是( )A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子B.元素周期表中从ⅢB族到ⅡB族10个纵行
下列说法中正确的是( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.原子及其离子的核外电子层等于该元素所在的周期数
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 czw86865691年前1
czw86865691年前1 -
 dczong 共回答了16个问题
dczong 共回答了16个问题 |采纳率87.5%解题思路:A.同主族自上而下金属性增强,越容易失去电子;
B.元素周期表中从ⅢB族到ⅡB族10个纵行属于过渡元素;
C.阳离子的电子层数不一定等于该元素所在的周期;
D.主族元素简单阴离子化合价不等于其所在主族族序数.A.同主族自上而下原子半径增大,金属性增强,越容易失去电子,故A错误;
B.元素周期表中从ⅢB族到ⅡB族10个纵行属于过渡元素,都是金属元素,故B正确;
C.阳离子的电子层数不一定等于该元素所在的周期,如钠离子有2个电子层,处于第三周期,简单阴离子的电子层等于其所在的周期数,故C错误;
D.主族元素简单阳离子的最高正化合价等于其族序数,但简单阴离子化合价不等于其所在主族族序数,故D错误,
故选B.点评:
本题考点: 元素周期表的结构及其应用;元素周期律的作用.
考点点评: 本题考查元素周期表与元素周期律的综合应用,难度不大,注意对基础知识的全面掌握,注意利用列举法进行解答.1年前查看全部
- 下列叙述中,正确的是( )A.同周期元素中,ⅦA族元素的原子半径最大B.ⅥA族元素的原子,其半径越大,越容易得到电子C
下列叙述中,正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB这8个纵行的元素都是金属元素 jfylrf1年前1
jfylrf1年前1 -
 落堇下世 共回答了15个问题
落堇下世 共回答了15个问题 |采纳率80%解题思路:A.同周期元素中,从左至右原子半径依次减小;
B.ⅥA族元素的原子,其半径越大,越不容易得电子;
C.室温时,0族元素的单质都是气体;
D.元素周期表中从ⅢB到ⅡB这8个纵行的元素都是金属元素.A.同周期元素中,从左至右原子半径依次减小;故错误;
B.ⅥA族元素的原子,其半径越大,越不容易得电子;故错误;
C.室温时,0族元素的单质都是气体;故正确;
D.元素周期表中从ⅢB到ⅡB这8个纵行的元素都是金属元素.故正确.
故选:CD.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查元素的性质,注意把握元素在周期表中的位置及元素周期律即可解答,题目难度大.1年前查看全部
- 下列说法中不正确的是( )A. ⅥA族元素的氢化物中,稳定性最强的其沸点也最高B. 由极性键形成的分子不一定是极性分子
下列说法中不正确的是( )
A. ⅥA族元素的氢化物中,稳定性最强的其沸点也最高
B. 由极性键形成的分子不一定是极性分子
C. 原子晶体的硬度大,不导电
D. 碘晶体升华时,化学键被破坏 softandsoft1年前1
softandsoft1年前1 -
 边效力 共回答了15个问题
边效力 共回答了15个问题 |采纳率100%解题思路:A.分子间存在氢键的物质,其沸点较高;
B.CH4、CO2中均是非极性分子,却都有极性键;
C.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体;
D.物质的熔沸点与分子间作用力有关.A.第ⅥA族元素的氢化物中稳定性最好的是H2O,因分子间存在氢键,其沸点也最高,故A正确;
B.非极性分子中不一定含有非极性键,如CH4、CO2中均是非极性分子,却都有极性键,故B正确;
C.熔点很高、硬度大、不导电等性质是原子晶体的特点,故C正确;
D.物质的熔沸点与分子间作用力有关,碘升华破坏分子间作用力,不破坏化学键,故D错误.
故选D.点评:
本题考点: 不同晶体的结构微粒及微粒间作用力的区别;极性分子和非极性分子.
考点点评: 本题考查微粒间的作用力,明确物质的晶体类型和微粒间的作用力是解题的关键,题目难度不大.1年前查看全部
- ⅤA族元素的价电子构型是?卤素按氟、氯、溴、碘的顺序排列,其结构或性质的变化规律是( ) A.原子半径依次增大 B.原子
ⅤA族元素的价电子构型是?
卤素按氟、氯、溴、碘的顺序排列,其结构或性质的变化规律是( )
A.原子半径依次增大 B.原子最外层电子数递增
C.各单质的化学活泼性依次增强 D.各单质与水反应的剧烈程度递增
E.各单质的颜色逐渐变浅。
17、能使碘化钾淀粉溶液变蓝的是( )
A.NaCl B.NaBr C.KF D.NaI E.氯水
18、下列卤化物中最稳定的是( )
A.NaF B.NaCl C.NaBr D.NaI E.KBr
19、下列各组溶液中不能发生化学反应的是( )
A.氯水和溴化钠 B.氯水和碘化钾
C.溴水和氯化钠 D.溴水和碘化钾
E.溴水和碘化钠
20、在含有溴化钾和碘化钾的混合液中通入过量氯气,然后将溶液蒸干,并将剩余残渣灼热最后留下的物质是( )
A.KCl B.KBr C.KI D.KBr和 KI E.碘 shenxiaomin1年前2
shenxiaomin1年前2 -
 DuFake 共回答了22个问题
DuFake 共回答了22个问题 |采纳率86.4%ⅤA族元素的价电子构型是ns2np3
1.A
B原子最外层电子数不变
C.各单质的化学活泼性依次减弱
D.各单质与水反应的剧烈程度依次减弱
E.各单质的颜色逐渐变深
2.E Cl2+2KI=2KCl+I2
3.A
4.C F Cl Br I
5.A 溴可气化、碘可升华1年前查看全部
- 下列叙述中正确的( )A. 同周期中,ⅦA族元素的原子半径最大B. 周期表中元素除了主族就是副族C. ⅥA族元素的原子
下列叙述中正确的( )
A. 同周期中,ⅦA族元素的原子半径最大
B. 周期表中元素除了主族就是副族
C. ⅥA族元素的原子,其半径越大,越容易得到电子
D. 元素周期表中从ⅢB族到ⅡB族这10个纵列的元素都是金属元素 lgz_qq1年前1
lgz_qq1年前1 -
 乖十一 共回答了14个问题
乖十一 共回答了14个问题 |采纳率92.9%解题思路:A.同周期自左而右原子半径减小;
B.元素周期表包含主族、副族、零族、第Ⅷ族;
C.同主族自上而下原子半径增大,失去电子能力增强;
D.过渡元素都是金属元素.A.同周期自左而右原子半径减小,同周期中,ⅦA族元素的原子半径最小,故A错误;
B.元素周期表包含7个主族、7个副族、1个零族、1个第Ⅷ族,故B错误;
C.同主族自上而下原子半径增大,原子核对核外电子吸引能力减弱,得电子能力减弱,失去电子能力增强,故C错误;
D.元素周期表中从ⅢB族到ⅡB族这10个纵列为过渡元素,都是金属元素,故D正确,
故选D.点评:
本题考点: 元素周期表的结构及其应用;元素周期律的作用.
考点点评: 本题考查元素周期表与元素周期律,比较基础,注意整体把握元素周期表的结构、理解元素周期律.1年前查看全部
大家在问
- 1广不数寸,
- 2关于月亮的美称有哪些
- 3zipper是什么意思
- 4被除数不变,除数扩大5倍时,商()
- 5一个英语句子的句式理解America's capacity utilisation,for example,hit hi
- 6Je Oui grand maison.`
- 7英语翻译Then ,one day I realized I could understand just about e
- 8关于bore的用法请问英语中:bore,bored和boring在语法上有什么区别最好举个例子,
- 9I will like my watch it think oId I I keep 连词成句
- 10一批零件、甲、乙两人合作12天可以完成,他们合作若干天后,乙因事请假,乙这时只完成了总任务的[3/10].甲继续做,从开
- 111.有三种正盐的混合溶液,含有0.2mol/l Na+(钠离子)、0.25mol/l Mg2+、0.4mol/l Cl-
- 12What time do you _____ lunch at school?(用have或has填空)
- 13为什么童话故事的结尾都是“从此,他们过着幸福的生活”?
- 14根据化学知识,下列说法正确的是( )
- 15铁在氧气中燃烧 铜和氧气在加热的条件系反应 甲烷燃烧 酒精燃烧 的化学方程式怎么写? 谢谢!