铜能将锌从锌酸盐溶液中置换出来吗?化学王级请进.
 冬天的水库2022-10-04 11:39:544条回答
冬天的水库2022-10-04 11:39:544条回答有没有反应:{Cu+Na2[Zn(OH)4]=微热=Na2[Cu(OH)4]+Zn}?
打好了我追十分!
可是我在一本化学竞赛培优书上看到说可以呀,到底行不行呀?

已提交,审核后显示!提交回复
共4条回复
 hzzxjj 共回答了21个问题
hzzxjj 共回答了21个问题 |采纳率90.5%- 看这个式子应该不叫做置换吧,应该是加热后含Zn的络合物分解,在有Cu存在的情况下与Cu结合成新的络合物,是一个平衡推动的问题吧...
不过如果是单质Cu的话还是真是很诡异..
上面胡扯...哪有那么个不活泼置换活泼更“稳定”的道理.CL从哪里来?Cu2+和Cu+与CL-生成的都是可溶的,2价的会有绿色络合物,记得配位数是6吧 - 1年前
 清水反应堆 共回答了211个问题
清水反应堆 共回答了211个问题 |采纳率- 不能
- 1年前
 Allen686868 共回答了2个问题
Allen686868 共回答了2个问题 |采纳率- 不能。Zn是两性物,而铜的两性远低于锌。故铜二价离子与氢氧根离子的配位能力比锌二价离子与氢氧根离子的配位能力底,所以锌酸比铜酸更稳定。请注意,在常温常压下,不稳定物能自发的生成稳定物,反之稳定物不能自发的生成不稳定物,即铜不能将锌从锌酸盐溶液中置换出来。...
- 1年前
 siymin 共回答了10个问题
siymin 共回答了10个问题 |采纳率- 竞赛很多都是大学里面的东西,比如这个反应可能就是大学无机化学讲得。所以你如果不参加竞赛,就没必要掌握这个,只需要记住金属活动性顺序表中前面的金属可以把后面的金属从盐中置换出来。如果你玩化学竞赛,那么你就必须好好学习大学课本,参考指定教材。因为大学里面很多知识与你高中学的是矛盾的,因为很多点在中学阶段学生根本理解不了,所以要在大学里面讲得更加深刻也就是真正的原理。
所以看你自己到底想怎么做了... - 1年前
相关推荐
- 电解类型如何记忆分类我有 但是记不住 有好办法吗(1)分解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4
电解类型如何记忆
分类我有 但是记不住 有好办法吗
(1)分解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4等)的电解.
阴极:4H++4e-=2H2↑ 阳极:4OH--4e-=O2↑+2H2O
总反应:2H2O 2H2↑+O2↑
阴极产物:H2;阳极产物:O2. 电解质溶液复原加入物质:H2O.
pH变化情况:原来酸性的溶液pH变小,原来碱性的溶液pH变大,强酸(含氧酸)强碱的正盐溶液pH不变.
(2)分解电解质型:无氧酸(除HF外)、不活泼金属的无氧酸盐(氟化物除外)的电解,如HCl、CuCl2等.
阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑
总反应:CuCl2 Cu+Cl2↑
阴极产物:酸为H2,盐为金属;阳极产物:卤素等非金属单质.
电解液复原加入物质为原溶质,如电解CuCl2溶液,需加CuCl2.
pH变化情况:如电解无氧酸溶液pH变大但不会超过7;如为盐溶液的电解则视无氧酸根的情况而定.
(3)放氢生碱型:活泼金属的无氧酸盐(氟化物除外)溶液的电解,如NaCl、MgBr2等.
阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑
总反应:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
阴极产物:碱和H2;阳极产物:卤素等非金属单质.电解饱和食盐水的产物分别为NaOH和H2以及Cl2.
电解液复原加入物质为卤化氢.电解饱和食盐水,要使电解质溶液复原需加入HCl.
pH变化情况:电解液pH显著变大
(4)放氧生酸型:不活泼金属的含氧酸盐溶液的电解,如CuSO4、AgNO3等.
阴极:2Cu2++4e-=Cu 阳极:4OH--4e-=O2↑+2H2O
总反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4
阴极产物:析出不活泼金属单质;阳极产物是该盐对应的含氧酸和氧气,本例中分别是Cu以及H2SO4、O2.
电解液复原加入物质为不活泼金属的氧化物(金属价态与原盐中相同).如电解CuSO4溶液,复原需加入CuO.
pH变化情况:溶液pH显著变小. 苹果的脸1231年前3
苹果的脸1231年前3 -
 伊谢尔伦 共回答了23个问题
伊谢尔伦 共回答了23个问题 |采纳率95.7%谁让你记这种分类的?
电解关键是离子的放电顺序
(1)阳极:
①惰性电极(如石墨、Pt、Au):
阴离子:S2->I->Br->Cl->OH->含氧酸根(SO42-、NO3-)
②活泼电极(金属活泼性在Ag及Ag之前):
本身失去电子溶解,如Fe —2e— ==Fe2+
(2)阴极:
阳离子:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+(水)>Al3+>Na+>K+1年前查看全部
- (16分)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保
(16分)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等。化学兴趣小组在实验室对Y中硫元素的价态进行探究:①将过量的稀硝酸加入少量样品中,振荡;②取少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀。甲认为不能由此确定Y中硫的价态为+6价。
(1)上述实验中产生的沉淀是 。
(2)你认为甲的判断是否正确 (填“是”或“否”),作出这种判断的依据是 。
(3)请完成对硫元素价态的探究:
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol·L -1 H 2 SO 4 、2mol·L -1 HCl、2mol·L -1 HNO 3 、3%H 2 O 2 、0.5mol·L -1 BaCl 2 、品红试纸、蒸馏水。
①提出合理假设
假设1,硫的价态是+4价
假设2,硫的价态是+6价
假设3,
②设计实验方案证明你的假设
③实验过程
根据②的实验方案,进行实验。请写出实验步骤、预期现象与结论。实验操作 预期的现象与结论 操作1 操作2  和弦一生1年前0
和弦一生1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 什么样的金属氧化物能与非金属氧化物生成含氧酸盐比如CaO+CO2可以生成CaCO3但ZnO与CO2不能生成ZnCO3?
什么样的金属氧化物能与非金属氧化物生成含氧酸盐比如CaO+CO2可以生成CaCO3但ZnO与CO2不能生成ZnCO3?
但SO3却又能与ZnO反应生成ZnSO4? hlm03191年前3
hlm03191年前3 -
 nihaoly 共回答了19个问题
nihaoly 共回答了19个问题 |采纳率94.7%这里涉及一个路易斯酸碱性的问题,首先CO2作为路易斯酸(可以接受离子或者分子的电子对),酸性不及SO3.CO2在水里溶解度远比SO3小,就是像H2O、CaO、ZnO,能给出电子对的均是氧,而CO2对负价氧的束缚吸引能力不及SO3,同时ZnO碱性弱于CaO,所以ZnO与CO2难生成ZnCO3.1年前查看全部
- 除了碱盐、酸盐,有没有非酸非碱的盐?
 haijunlove1年前1
haijunlove1年前1 -
 精灵熊 共回答了27个问题
精灵熊 共回答了27个问题 |采纳率88.9%如果您所说的碱盐,酸盐是根据该盐水解后的酸碱性来分,那么有中性盐,比如说氯化钠,硝酸钾都是中性的.如果您所说的是酸式盐或者碱式盐,那么除此之外有正盐,不电离出氢离子或者氢氧根的盐都是正盐.1年前查看全部
- 含氧酸盐读作什么?无氧酸盐又读作什么?
 十弦1年前1
十弦1年前1 -
 冷月冰心 共回答了21个问题
冷月冰心 共回答了21个问题 |采纳率66.7%含氧酸盐读作 某酸某 如Na2CO3 读作碳酸钠
无氧酸盐读作 某化某 如NaCl 读作氯化钠1年前查看全部
- 把下列盐连线归类正盐 NaCl 钠盐酸式盐 NH4Cl 铵盐无氧酸盐 NaHSO4 硫酸盐含氧酸盐 NH4HSO4 盐酸
把下列盐连线归类
正盐 NaCl 钠盐
酸式盐 NH4Cl 铵盐
无氧酸盐 NaHSO4 硫酸盐
含氧酸盐 NH4HSO4 盐酸盐 wrs021年前2
wrs021年前2 -
 zqs200302 共回答了15个问题
zqs200302 共回答了15个问题 |采纳率86.7%正盐 NaCl NH4Cl
酸式盐 NaHSO4 NH4HSO4
无氧酸盐 NaCl NH4Cl
含氧酸盐 NaHSO4 NH4HSO4
钠盐 NaCl NaHSO4
铵盐 NH4Cl NH4HSO4
硫酸盐 NaHSO4 NH4HSO4
盐酸盐 NaCl NH4Cl
.1年前查看全部
- 以H、S、Cu、O、C五种元素组成:含氧酸.无氧酸.含氧酸盐.无氧酸盐……
以H、S、Cu、O、C五种元素组成:含氧酸.无氧酸.含氧酸盐.无氧酸盐……
以H、S、Cu、O、C五种元素组成:
含氧酸—— 无氧酸——
含氧酸盐—— 无氧酸盐——
酸式盐—— 碱式盐——
酸性氧化物—— 酸性氧化物——
其他氧化物—— 单质—— 叮叮叮1年前4
叮叮叮1年前4 -
 徐刚915 共回答了21个问题
徐刚915 共回答了21个问题 |采纳率85.7%含氧酸H2SO3、H2SO4、H2CO3
无氧酸H2S
含氧酸盐CuSO3、CuSO4、CuCO3
无氧酸盐CuS、Cu2S
酸式盐Cu(HSO3)2、Cu(HSO4)2、Cu(HCO3)2
碱式盐Cu2(OH)2CO3、Cu2(OH)2SO3、Cu2(OH)2SO4
酸性氧化物CO2、SO2、SO3
碱性氧化物CuO
其他氧化物H2O、H2O2、CO
单质H2、S、Cu、O2、C1年前查看全部
- 酸和盐反应的条件有句口诀是“酸盐先看盐”那么盐要满足什么呢?生成物又要满足什么呢?那么能否给我解释下那句口诀呢?为什么酸
酸和盐反应的条件
有句口诀是“酸盐先看盐”那么盐要满足什么呢?生成物又要满足什么呢?
那么能否给我解释下那句口诀呢?为什么酸与盐反应要看盐?做反应物的酸和盐是一定要可溶吗?那么碳酸钙与稀盐酸反应又是怎么一回事?
谢谢!~ BK少壮派1年前1
BK少壮派1年前1 -
 汗水落地无声 共回答了16个问题
汗水落地无声 共回答了16个问题 |采纳率81.3%盐要可电离(比方硫酸钡和盐酸就不会反应,酸也有这个要求,只是高中接触到的水溶稀酸基本上都满足这一条件).
生成物要难电离(水、气体、常见的氯化银等难电离的盐).
总之是使电离平衡向正反应方向移动,才能保证反应持续进行.
(顺便纠正一下lin8504,盐酸和镁反应属于酸和单质反应;碳酸氢钠是碱式盐而非碱)1年前查看全部
- 盐盐,酸盐,酸碱,各一种方法,带上化学式最好,
 白骨精MM1年前1
白骨精MM1年前1 -
 scottlee 共回答了11个问题
scottlee 共回答了11个问题 |采纳率81.8%镁(过量)和硫酸反应:Mg+H2SO4=H2↑+MgSO4,
氢氧化镁(过量)和硫酸反应:Mg(OH)2+H2SO4=MgSO4+2H2O.过虑得到溶液,蒸发结晶就可得到固体.
硫酸与氧化镁反应
MgO+H2SO4=MgSO4+H2O
硫酸与碳酸镁反应
MgCO3+H2SO4=MgSO4+CO2↑1年前查看全部
- 将0.2 mol金属R的一种含氧酸盐在隔绝空气的条件下加热,使之完全分解,生成R的氧化物RO和CO、O 2 的混合气体。
将0.2 mol金属R的一种含氧酸盐在隔绝空气的条件下加热,使之完全分解,生成R的氧化物RO和CO、O 2 的混合气体。已知:该混合气体对氢气的相对密度为18,其体积为8.96 L(标准状况);金属R的原子核中质子数比中子数少4个。测得RO的质量比原含氧酸盐质量减轻一半。通过计算,求出该盐的化学式。
 nmb141年前1
nmb141年前1 -
 zddada 共回答了21个问题
zddada 共回答了21个问题 |采纳率100%FeC 2 O 4
生成CO、CO 2 的平均相对分子质量为:18×2=36,混合气体的物质的量为: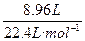 ="0.4" mol,质量为m 混 ="36" g·mol - 1 ×0.4 mol="14.4" g(为含氧酸盐的质量的一半)。
="0.4" mol,质量为m 混 ="36" g·mol - 1 ×0.4 mol="14.4" g(为含氧酸盐的质量的一半)。
设CO的物质的量为x,则CO 2 的物质的量为0.4-x,有:
28x+44(0.4-x)=14.4
x=0.2
即n(盐)∶n(CO)∶n(CO 2 )=0.2∶0.2∶0.2=1∶1∶1。
M(盐)=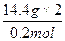 ="144" g·mol - 1
="144" g·mol - 1
M(RO)="144" g·mol - 1 -28 g·mol - 1 -44 g·mol - 1 ="72" g·mol - 1
M(R)="72" g·mol - 1 -16 g·mol - 1 ="56" g·mol - 1 故该盐的化学式为FeC 2 O 4 。1年前查看全部
- 给几个化学式金属+非金属-----无氧酸盐碱性氧化物+酸-----盐+水酸性氧化物+碱-----盐+水一类给一个,
 FlyXia1年前1
FlyXia1年前1 -
 ln198292 共回答了19个问题
ln198292 共回答了19个问题 |采纳率94.7%Cu+Cl2=(点燃)CuCl2
FeO+H2SO4=FeSO4+H2O
CO2+2NaOH=Na2CO3+H2O1年前查看全部
- 为什么会有正盐·碱盐·酸盐三种盐,请列举分类代表
为什么会有正盐·碱盐·酸盐三种盐,请列举分类代表
含有氢离子的应该是酸,为什么成酸盐了? wanchangh1年前1
wanchangh1年前1 -
 铁獠牙 共回答了19个问题
铁獠牙 共回答了19个问题 |采纳率78.9%通常来说,我们把含有氢离子的盐类称为酸式盐(如NaHCO3,NaHSO4等),含有氢氧根离子的盐类称为碱式盐(如碱式碳酸铜[Cu2(OH)2CO3]等),即不含氢离子也不含氢氧根的叫正盐(如CuSO4等)
初中里酸的定义应该是只电离出的阳离子只有氢离子的化合物,而不是能电离出氢离子的化合物,当然,事实上酸碱盐的定义并不是那么狭隘,所以其实酸式盐是可以视为酸的,甚至于某些碱也可以在某些时候视为酸,不过在初中里的定义比较狭隘.1年前查看全部
- 碱性氧化物和酸性氧化物反应生成含氧酸盐.这需要什么条件?我只知道碱性氧化物要可溶,其它呢?
 寻找zz1年前1
寻找zz1年前1 -
 我鑫悠悠 共回答了13个问题
我鑫悠悠 共回答了13个问题 |采纳率92.3%碱性氧化物:Na2O、CaO、BaO、K2O【一般是这几个可以与酸性氧化物反应】
酸性氧化物:CO2、SO2、SO3、N2O5【一般是这几个可以与碱性氧化物反应】
此外,其它的基本不能反应.
左边两种氧化物,右边是直接化合的一种盐1年前查看全部
- 什么是可溶性含氧酸盐?碳酸钠【Na2CO3】?硫酸钡【BaSO4】?
 h18y1年前2
h18y1年前2 -
 taotao886886 共回答了25个问题
taotao886886 共回答了25个问题 |采纳率88%碱性氧化物+酸性氧化物→含氧酸盐,如 Na2O+CO2=Na2CO3 CaO+Co2=CaCO3 大多数碱性氧化物和酸性氧化物可以进行这一反应.其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行.如: K2O(对应KOH,强碱)+SO3(对应H2SO4,强酸)=K2SO4 凡是含有氧元素的盐类都是含氧酸盐,例如硫酸钠,硫酸钡,碳酸氢钠等等
氧化钡溶解性 微溶于冷水,溶于热水、酸、乙醇.氧化钠溶于水时放热.所以碳酸钠是可溶性含氧酸盐,而硫酸钡不是.1年前查看全部
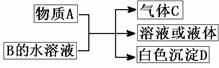
- 若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是 .【怎么推出硅酸的?】
若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是 .【怎么推出硅酸的?】
B、C、D均为只含短周期元素的中学化学常见物质,它们之间的反应关系如下图所示.
若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是.【怎么推出硅酸的?】
不能是BaSO4或者AgCl吗
 我家娘子的相公1年前1
我家娘子的相公1年前1 -
 lxmol 共回答了18个问题
lxmol 共回答了18个问题 |采纳率88.9%因为A为红红棕色气体,所以A为NO2.D为白色沉淀,我们常见的白色沉淀有AgCl,BaSO4,CaCO3,H2SiO3,Al(OH)3,Al2O3,Fe(OH)2,Ag2SO3,CaSO3等; 再根据D只含短周期元素,而D又不溶于盐酸,就能得到是硅酸了,不确定的话,带入进去,其实这个反应就是强酸制弱酸的反应(硝酸制硅酸)1年前查看全部
- 化学酸碱盐NaHCO3是含氧酸盐吗
 叫我匪穴1年前1
叫我匪穴1年前1 -
 予心适无事 共回答了19个问题
予心适无事 共回答了19个问题 |采纳率94.7%NaHCO3
是含氧酸盐
由含氧酸的酸根离子与金属离子构成的盐当然是含氧酸盐
其他的,如:Na2CO3,Na2SO4,NaHSO4,Na2HPO4,NaH2PO4等等都是含氧酸盐
(无)含氧酸盐不一定是正盐,如NaHS 就不是正盐
如帮到了你,
【你的10分满意,我们团队的无限动力】1年前查看全部
- 写出下列化合价对应的含碳物质Na2SO4 含氧酸盐 Na2SO4分类依据1:_________________K2SO4
写出下列化合价对应的含碳物质
Na2SO4 含氧酸盐 Na2SO4分类依据1:_________________
K2SO4 无氧酸盐 Na2SO4分类依据2:_________________
NaCl 钠盐 Na2SO4分类依据3:___________________
BaSO4 硫酸盐
练习1:每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,
将这种物质找出来.
(1)NaCl KCl NaClO Na2S 分类依据1:2:
(2)HClO3 KClO3 Cl2 NaClO3 分类依据1:2:
(3)H3PO4 H4SiO4 HCl H2SO4 分类依据1:
练习2:将下列钠家族的物质按树状分类法分类
Na Na2O、Na2O2 NaOH NaCl Na2SO4 Na2CO3 NaHCO3 NaNO3
所有空都填好不好么 我变我变我变变变1年前1
我变我变我变变变1年前1 -
 xueny 共回答了23个问题
xueny 共回答了23个问题 |采纳率87%Na2SO4 含氧酸盐 Na2SO4分类依据1:硫酸钠中含有氧元素,所以是含氧酸盐
K2SO4 无氧酸盐 Na2SO4分类依据2:硫酸钠中含有钠元素,所以是钠盐
NaCl 钠盐 Na2SO4分类依据3:硫酸钠中含有硫酸根,所以是硫酸盐;
BaSO4 硫酸盐
练习(1)1、NaClO是含氧酸盐,其余为无氧酸盐
2、KCl为钾盐,其余为钠盐
(2)1、Cl2为单质,其余为化合物,Cl2中氯元素的化合价为0,其余各元素的化合价为+5.
(3)HCl为无氧酸,其余为含氧
练习2、单质 Na
氧化物 Na2O、Na2O2
碱NaOH
盐:NaCl Na2SO4 Na2CO3 NaHCO3 NaNO3
希望我的回答对你的学习有帮助!1年前查看全部
- Mn2O7为什么是酸性氧化物Mn2O7能与什么反应形成含氧酸盐怎样判断金属氧化物是酸性氧化物
 miracleone1年前2
miracleone1年前2 -
 来来_回回 共回答了22个问题
来来_回回 共回答了22个问题 |采纳率81.8%Mn2O7+K2O=2KMnO4
简单的说,高价成酸,低价成碱.1年前查看全部
- 亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量.为检测某食品中亚硝 酸盐含量(通常以1kg样品中含N
亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量.为检测某食品中亚硝 酸盐含量(通常以1kg样品中含NaN02的质量计),某研究小组设计了如下两种实验方案:
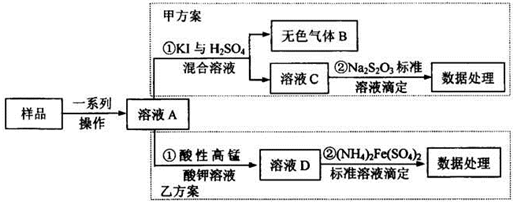
(1)无色气体B遇空气显红棕色,B的化学式为______写出甲方案①中反应的离子方程式______
(2)完成并配平乙方案①中反应的离子方程式
______MnO4-+______NO2+______=______Mn 2++______NO3-+______
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾 溶液(过童)与溶液A反应.反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色 溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液1O.OOmL.则1kg样品中 NaNO2的质量为[690/a][690/a]mg. 越狱5201年前1
越狱5201年前1 -
 恢复 共回答了12个问题
恢复 共回答了12个问题 |采纳率83.3%解题思路:(1)无色气体B遇空气显红棕色,说明是一氧化氮被氧气氧化为二氧化氮红棕色气体;甲方案①中反应是亚硝酸盐在酸性溶液中氧化碘离子为碘单质,本身被还原为一氧化氮;
(2)依据氧化还原反应电子守恒,结合元素化合价变化升降守恒配平书写离子方程式;
(3)依据配制溶液的操作步骤选择需要的仪器;定容方法是容量瓶中加入水至离刻度线1-2cm,改用胶头滴管滴加制液面与刻度线相切;
(4)利用高锰酸钾氧化亚硝酸根离子为硝酸根离子,过量的高锰酸钾被硫酸亚铁铵还原恰好反应,结合离子方程式的定量关系计算得到;(1)依据流程分析判断,无色气体B遇空气显红棕色,说明是一氧化氮被氧气氧化为二氧化氮红棕色气体;甲方案①中反应是亚硝酸盐在酸性溶液中氧化碘离子为碘单质,本身被还原为一氧化氮,反应的离子方程式为:2I-+2NO2-+4H+=I2+2NO↑+2H2O;
故答案为:NO,2I-+2NO2-+4H+=I2+2NO↑+2H2O;
(2)依据氧化还原反应元素化合价变化,锰元素化合价从+7价变化为+2价锰离子,氮元素化合价从+3价变化为+5价,依据化合价变化升降相同和原子守恒配平写出离子方程式为:2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
故答案为:2、5、6、2、5、3;
(3)配制溶液需要称量后在烧杯中溶解,用玻璃棒搅拌,引流转移到100ml容量瓶中加水至离刻度线1-2cm处改用胶头滴管滴加至液面到与刻度线相切;
故答案为:玻璃棒、100mL容量瓶、胶头滴管,向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
(4)依据反应过程和离子方程式加水得到
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
1 5
2×10-6mol0.0010mol/L×0.01L
与亚硝酸根离子反应的高锰酸钾物质的量=0.012.00L×0.0005mol/L-2×10-6mol=4×10-6mol;
2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
25
4×10-6mol 10-5mol
ag样品含 NaNO2的质量为69g/mol×10-5mol=6.9×10-4g;
1000g样品中含NaNO2的质量=
6.9×10−4mol×1000g
ag=[0.69/a]g=[690/a]mg;
故答案为:[690/a]mg;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了反应流程的分析判断,氧化还原反应的离子方程式书写和配平,物质性质的分析应用,滴定实验过程分析计算应用是解题关键,题目难度中等.1年前查看全部
- Na2SO4、K2S、NaCl、BaSO4、NaHCO3里那些事含氧酸盐 那些事无氧酸盐?
 其实我只是个mm1年前1
其实我只是个mm1年前1 -
 perolina 共回答了21个问题
perolina 共回答了21个问题 |采纳率81%含氧酸盐:Na2SO4 BaSO4 NaHCO3
无氧酸盐K2S NaCl1年前查看全部
- 含氧酸盐,无氧酸盐的定义
 lxyyf1年前2
lxyyf1年前2 -
 ahxlandy 共回答了20个问题
ahxlandy 共回答了20个问题 |采纳率85%含氧酸与碱反应,得到的盐,就是含氧酸盐,比如Na2SO4
无氧酸与碱反应,得到的盐,就是无氧酸盐,比如NaCl
其实,就是看酸根是不是含氧1年前查看全部
- 为什么非金属元素所形成的含氧酸盐中的该元素必为正价,
 laihuo1年前2
laihuo1年前2 -
 gasket 共回答了12个问题
gasket 共回答了12个问题 |采纳率91.7%含氧酸一般是非金属元素与氧气反应后生成酸性氧化物,如CO2,该酸性氧化物再与水反应,生成含氧酸.在第一个过程中,氧得电子显负价,非金属元素失电子显正价.第二个过程无电子转移.所以非金属元素最终就显正价.1年前查看全部
- 什么是氧酸盐,什么是含氧酸盐?Na2SO4.KHSO4.NaCl.BaSO4.NaHCO3中那些是氧酸盐,那些是含氧酸盐
什么是氧酸盐,什么是含氧酸盐?
Na2SO4.KHSO4.NaCl.BaSO4.NaHCO3中那些是氧酸盐,那些是含氧酸盐?
什么是氧酸盐?氧酸盐与含氧酸盐有什么区别? matata361年前3
matata361年前3 -
 m2818 共回答了21个问题
m2818 共回答了21个问题 |采纳率90.5%Na2SO4、KHSO4、NaHCO3、BaSO4是氧酸盐
NaCl是不含氧酸盐
主要是看酸根离子有没有含氧元素,有含,则为含氧酸,对应的盐为含氧酸盐.如Na2SO4,SO42-里含氧元素,所以为含氧酸盐.1年前查看全部
- 铁是目前应用最广泛的金属.铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
铁是目前应用最广泛的金属.铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
(1)铁在潮湿的空气中容易发生吸氧腐蚀而生锈,在该过程中,铁做______极,电极反应为______,
O2所在电极发生的反应为______
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-等物质的量发生交换.交换完成后,流出溶液的OH-用0.40mol•L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL.则0.54g该样品中n(Cl-)=______mol,x的值是______.
(3)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______.
(4)FeCl3与氢碘酸反应的离子方程式为:______. 雪儿之恋1年前1
雪儿之恋1年前1 -
 hongliang3721 共回答了14个问题
hongliang3721 共回答了14个问题 |采纳率92.9%解题思路:(1)依据原电池原理解答,Fe做负极发生氧化反应,氧气在正极发生还原反应;
(2)依据离子交换关系氢氧根离子物质的量等于氯离子物质的量等于氢离子物质的量,依据0.54g FeClx中氯离子物质的量计算x值;
(3)依据元素守恒计算氯化亚铁和氯化铁物质的量之比,进一步计算氯化铁质量分数;
(4)铁离子氧化碘离子成碘单质的反应.(1)依据原电池原理解答,Fe做负极发生氧化反应,氧气在正极发生还原反应,中性溶液中,氧气得电子生成氢氧根,铁失电子生成二价铁离子,注意正负极的电子守恒,电极反应式为:负极:2Fe-4e-=2Fe2+,正极:2H2O+O2+4e-=4OH-,
故答案为:负;2Fe-4e-=2Fe2+;2H2O+O2+4e-=4OH-;
(2)n(Cl)=n(H+)=n(OH-)=0.0250L×0.40 mol•L-1=0.010 mol,0.54g FeClx样品中含有氯离子物质的量为[0.54g/56+35.5x]=0.010 mol,解得x=3,
故答案为:0.010;3;
(3)FeCl2和FeCl3的混合物的样品中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=[1/9+1]×100%=10%;
故答案为:10%;
(4)FeCl3与氢碘酸反应就是铁离子氧化碘离子成碘单质的反应,离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2.点评:
本题考点: 金属的电化学腐蚀与防护;铁盐和亚铁盐的相互转变;有关混合物反应的计算;中和滴定.
考点点评: 本题考查学生阅读题目获取信息的能力、氧化还原反应,原电池的工作原理的应用,电极反应,电极产物的判断等,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.注意基础知识的全面掌握.1年前查看全部
- 关于酸碱盐的一个问题我知道碱盐,盐盐反应需要两种物质都是溶液,那酸碱、酸盐反应碱和盐都必须是溶液吗?我知道CaCO3是沉
关于酸碱盐的一个问题
我知道碱盐,盐盐反应需要两种物质都是溶液,那酸碱、酸盐反应碱和盐都必须是溶液吗?
我知道CaCO3是沉淀可以和酸反应,其他的沉淀呢?
是不是除了如AgCl、BaSO3这些不溶于酸不能与酸反应的沉淀外,能溶于酸的沉淀是不是就代表能和酸反应?(比如BaCO3之类的). goma1年前2
goma1年前2 -
 erwin_zhang 共回答了25个问题
erwin_zhang 共回答了25个问题 |采纳率80%与酸反应的盐要溶于酸,而且因为酸和盐反应都属于复分解反应,所以生成物要有水、气体或沉淀,具备以上条件才能反应1年前查看全部
- 无氧酸盐,含氧酸盐有哪些啊?
 hnhch1年前4
hnhch1年前4 -
 爱上浪漫的紫雨 共回答了20个问题
爱上浪漫的紫雨 共回答了20个问题 |采纳率80%NaF,Na2S,NaHS,NaCl,KBr,KI,CaCl2,MgCl2,FeCl2,FeCl3,AgBr,AgI.
Na2SO4、KHSO4、NaHCO3、BaSO41年前查看全部
- 次氯酸钠是氧化性盐吗?2012漳州模拟题,A.若考虑物质组成,则NaClO是氧化性盐、含氧酸盐.(这个选项是错的,)
 bassl1年前3
bassl1年前3 -
 秦小爱 共回答了20个问题
秦小爱 共回答了20个问题 |采纳率100%是氧化性盐没错,.但是跟物质组成有什麽关系?你能从Na,Cl,O元素中看得出是氧化性盐?1年前查看全部
- 除了硝酸盐都溶于水外还有那种哪种酸盐都溶于水(酸式酸根盐例外,如碳酸氢盐)
除了硝酸盐都溶于水外还有那种哪种酸盐都溶于水(酸式酸根盐例外,如碳酸氢盐)
我说的是阴离子盐不是钾盐钠盐铵盐之类的阳离子盐 zhengliupei1年前3
zhengliupei1年前3 -
 A烟波林野 共回答了19个问题
A烟波林野 共回答了19个问题 |采纳率73.7%醋酸盐1年前查看全部
- 如何检验四价硫的盐和六价硫的盐请写出方程式是含氧酸盐
 耳机效果暴好1年前1
耳机效果暴好1年前1 -
 强庄预言 共回答了20个问题
强庄预言 共回答了20个问题 |采纳率95%将其配成溶液,然后滴入加入BaCl2溶液.有沉淀产生的是六价,无沉淀的是4价
SO3^2- +2H^+ =SO2↑+H2O SO2与BaCl2溶液不反应
SO4^2- +H^+ 不反应,SO4^2- +Ba^2+=BaSO41年前查看全部
- 是不是一种物质与碱性氧化物反应会生成含氧酸盐也可以证明是酸性氧化物?
 歌哭1年前1
歌哭1年前1 -
 billj 共回答了13个问题
billj 共回答了13个问题 |采纳率100%当然不是.例如H2SO4可以与碱性氧化物反应生成含氧酸盐吧,但H2SO4是酸,不是酸性氧化物.1年前查看全部
- 「急」酸性氧化物能与含氧酸盐反应吗?如反应是生成碱性氧化物吗?
 川大黑猫1年前1
川大黑猫1年前1 -
 5monkey30 共回答了24个问题
5monkey30 共回答了24个问题 |采纳率91.7%有的能反应 但产物不是碱性氧化物
如制玻璃中的 二氧化硅(酸性氧化物)与碳酸钙(含氧酸盐)
在高温下反应生成 硅酸钙(含氧酸盐)+二氧化碳(酸性氧化物)
该反应能发生的原理是二氧化碳是气体1年前查看全部
- 酸盐碱在化学中到底是什么东西啊详细解释下
 tangxue1年前2
tangxue1年前2 -
 xiailing 共回答了23个问题
xiailing 共回答了23个问题 |采纳率91.3%酸碱盐
酸碱盐的定义:
酸:电离时产生的阳离子全部都是氢离子的化合物,叫酸
碱:电离时产生的阴离子全部都是氢氧根离子的化合物,叫碱
盐:酸根离子与金属离子的化合物,叫盐
举例说明:
酸:H2SO4(硫酸),HCL(盐酸),HNO3(硝酸)
碱:NaOH(氢氧化钠),KOH(氢氧化钾),NH4OH(氨水)
盐:Na2CO3(碳酸钠),CuSO4(硫酸铜)
什么是电离?
物质溶于水(或其他物质)时产生能够导电的离子,此为电离,酸碱盐的溶液都能
导电,是因为它们电离,阳离子和阴离子能够导电
举例说明:
H2SO4(硫酸),电离后形成H+和SO4(2-)
H2SO4====2H+ + SO4(2-)
HCl==== Cl- + H+
酸碱盐的通性:
酸的通性:
有腐蚀性,溶液程酸性,能与活泼金属,碱,某些盐和金属氧化物反应
碱的通性:
有腐蚀性,溶液程碱性,能与某些金属,酸,某些盐和非金属氧化物反应
盐的通性:
有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应
还能和其他某些化合物反应
酸碱盐的读法:
酸:含氧酸的读法是把氢氧去掉,剩什么叫什么酸
例:H2SO4,去掉氢和氧之后剩下硫,所以叫硫酸
无氧酸的读法是氢某酸
例:HCl,除去氢还剩氯,所以盐酸可以叫做氢氯酸
碱:碱的读法是氢氧化某
例:NaOH,去掉氢氧还有钠,所以叫氢氧化钠
盐:一般叫做某酸某,但是有些特殊的读法
酸式盐:叫某酸氢某(酸式盐就是有氢离子的盐)
亦可叫做酸式某酸某
例:NaHCO3叫碳酸氢钠
碱式盐:叫某酸氢氧化某(碱式盐就是有氢氧根离子的盐)
也可以叫碱式某酸某,羟基某酸某
例:Cu2(OH)2CO3叫碱式碳酸铜,Ca5(OH)(PO4)3叫羟基磷酸钙
下面详细说明:
酸的性质:
酸+碱=盐+水 反应条件:无 反应类型:复分解 例:H2SO4(酸)+Mg(OH)2(碱)=MgSO4(盐)+H2O(水)
酸+盐=新酸+新盐 反应条件:有气体或者水或者沉淀生成才能反应 反应类型复分解例:HCL(酸)+Na2CO3(盐)=H2CO3(新酸)+NaCl(新盐)
但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了
酸+活泼金属=盐+氢气 反应条件:金属是活泼金属 反应类型:置换
例:2HCl(酸)+Fe(活泼金属)=FeCl2(盐)+H2↑(氢气)
酸+金属氧化物=盐+水 反应条件:无 反应类型:复分解
例:H2SO4(酸)+CuO(金属氧化物)=CuSO4(盐)+H2O(水)
碱的性质:
碱+酸-(见酸的性质)
碱+盐=新碱+新盐 反应条件:碱和盐必须都溶于水,有沉淀生成(二者同时满足)
反应类型:复分解
例:Ca(OH)2(碱)+K2CO3(盐)=CaCO3↓(新盐)+2KOH(新碱)
碱+非金属氧化物=盐+水 反应条件:非金属氧化物是酸性氧化物 反应类型:?
例:Ca(OH)2(碱)+CO2(非金属氧化物)=CaCO3(盐)+H2O(水)
此反应用于鉴别CO2
盐的性质:
盐+酸-(见酸的性质)
盐+碱-(见碱的性质)
盐+盐=新盐+新盐 反应条件:盐必须都溶于水,生成物中有沉淀(二者同时满足)
反应类型:复分解
例:CuSO4(盐)+Ba(OH)2(盐)=Cu(OH)2↓(新盐)+BaSO4↓(新盐)
这是一个双沉淀的反应,当然只有一个沉淀也是可以的
盐+某些金属=新盐+新金属 反应条件:盐能溶于水,金属的活动性比盐中的大(二者同时满足) 反应类型:复分解
例:CuSO4(盐)+Fe(金属)=FeSO4(新盐)+Cu(新金属)
但是有些金属无法实现此反应,即除钾钙钠以外,因为他们和水就反应了
酸性氧化物:
溶于水之后程酸性的物质(一般是非金属氧化物)
例CO2溶于水后是碳酸,碳酸是酸性的,所以CO2是酸性氧化物
碱性氧化物:
同上类似,水合后是碱性的物质(一般是金属氧化物)
例CaO溶于水后溶液程碱性,故CaO是碱性氧化物 关于酸碱盐的反应性质,需要知道什么是可溶物,什么是不溶物
那么有一个口诀:
都溶硝酸钾钠铵 即意为:硝酸,钾,钠,铵的盐都是能溶于水的
碳酸没有三价盐 即意为:一般认为,碳酸盐中的金属离子没有3价的
盐酸除银汞 即意为:银和汞的氯化物不溶于水
硫酸去钡铅 即意为:钡和铅的硫酸盐不溶于水
碱溶有五位 .
钾钠铵钙钡 即意为(合上句):一般情况碱只有5个能溶于水:钾钠铵钙钡 (钙为微溶)
离子的鉴别:
氯离子:银盐(除氯化银)
硫酸根离子:钡盐(除硫酸钡)
铵根离子:碱(任意)
氢离子:碳酸盐和澄清石灰水
氢氧根离子:铵盐
铁离子:2价铁离子是浅绿色,3价是黄色(指溶液)
铜离子:2价铜离子是蓝色(指溶液)
故CaO是碱性氧化物
酸、碱、盐”疑点十问
1. 氯化钠晶体不能导电,是因为氯化钠晶体中不存在带有电荷的微粒,这句话对吗?
不对,因为氯化钠是典型的离子化合物,其中含有钠离子和氯离子(),但由于阴、阳离子的静电作用,氯化钠晶体中的和按一定规则紧密地排列着,只能在一定振幅范围内振动,不存在可以自由移动的离子.所以,干燥的氯化钠不导电是因为其中的带电微粒(即阴、阳离子)不能自由移动.
2. 氯化氢溶于水可电离产生,故氯化氢属于离子化合物,对吗?
不对,氯化氢是典型的共价化合物,它是由氯化氢分子构成.在氯化氢分子中氢原子和氯原子以一对共用电子对结合在一起,由于氯原子的得电子能力强于氢原子,所以共用电子对偏向氯原子,偏离氢原子.当氯化氢溶于水时,由于水分子的作用使该共用电子对完全由氯原子享用,即相当于氯原子完全获得了一个电子,形成,氢原子完全失去唯一的电子,形成了.类似的例子如硫酸,它属于共价化合物,但溶于水后可电离产生.
3. 酸溶液与酸性溶液是不是一回事?
酸溶液是酸的水溶液,它显酸性,溶液中的阳离子只有氢离子.酸性溶液是显酸性的溶液,溶液中也有氢离子,但阳离子不一定只有氢离子,因此酸性溶液不一定是酸溶液,例如溶于水时,电离产生的阳离子除了氢离子外还有钠离子,所以也表现出酸性,可使石蕊变红色.但只是呈酸性的溶液,不是酸溶液.
4. 只要在反应中能生成盐和水,则该反应一定是中和反应,对吗?
不对,因为中和反应是特指酸和碱之间发生的反应,它属于复分解反应,而反应中能生成盐和水,未必一定是复分解反应.如就不是复分解反应,那更谈不上中和反应,即使是生成盐和水的复分解反应也未必是中和反应,如,虽然能生成盐和水,但由于反应物不是酸与碱,所以不是中和反应.
5. 碱性氧化物一定是金属氧化物,此话对吗?
碱性氧化物是指能与酸起反应生成盐和水的氧化物,大多数金属氧化物是碱性氧化物,可以说碱性氧化物一定是金属氧化物,但不能说金属氧化物一定是碱性氧化物,如是金属氧化物但不是碱性氧化物.
6. 怎样保存氢氧化钠和氢氧化钙?怎样检验久置的氢氧化钠、氢氧化钙是否变质?
固体氢氧化钠吸湿性特强,易吸收空气中的水分而潮解;还能跟空气中的二氧化碳起反应生成碳酸钠而变质;氢氧化钙虽不像氧氧化钠那样潮解,但也有吸湿性,同时也容易与空气中的二氧化碳反应生成碳酸钙,所以氢氧化钠、氢氧化钙都必须密封保存.
不仅固态的氢氧化钠、氢氧化钙需密封保存,而且它们的水溶液由于容易吸收空气中的二氧化碳也必须密封保存.
久置的氢氧化钠、氢氧化钙,往往因吸收了空气中的二氧化碳,部分变质为碳酸钠、碳酸钙,要检验它们是否变质,只要加一些稀盐酸即可,如果有气体产生表示已变质,否则未变质.
7. 结晶水合物中通常含有两种或多种微粒.那么硫酸铜晶体究竟是纯净物还是混合物?
判断纯净物与混合物的依据是看该物质的组成(或构成)是否固定,而不是看该物质中所含微粒的种数.硫酸铜晶体的化学式为,即该晶体中微粒与分子之间的个数比是固定的,为1:5,所以硫酸铜晶体中各元素之间的质量比是固定的,由此可知硫酸铜晶体是纯净物.类似的碳酸钠晶体也是纯净物.
8. 碳酸钠属于盐,为什么其水溶液呈碱性?
碳酸钠溶于水后电离产生,和水分子发生如下反应:,溶液中产生一定量的离子,所以溶液显碱性,如果给碳酸钠溶液加热,可产生更多的,使溶液的碱性更强.
9. 为什么硝酸钾、硝酸钠、硫酸钡等物质一般不与其他物质发生复分解反应.
物质间发生复分解反应必须满足复分解反应发生的条件,即生成物中必须有水或气体或沉淀,硝酸钾是盐,盐能与酸、碱、盐起反应,分别生成新酸、新碱与新盐,但硝酸钾与酸、碱、盐反应后所生成的新酸是硝酸,生成的新碱是氢氧化钾,生成的新盐必定是硝酸盐或钾盐,其中既无气体也没有沉淀,而反应又不生成水,不具备复分解反应发生时对生成物的必要条件,同理,硝酸钠一般也不发生复分解反应.
根据复分解反应进行的条件,反应物必须可溶于水或酸,而硫酸钡既不溶于水又不溶于酸,所以硫酸钡不可能发生复分解反应.
10. 鉴别氯离子和硫酸根离子时,除了加溶液、溶液外,为什么还要加稀硝酸?以钠盐为例说明.
强碱,强酸,弱酸,弱碱
在含有氯离子或硫酸根离子的溶液鉴别反应中,必须加入稀硝酸以排除其它离子的干扰,如碳酸根离子,亚硫酸根离子等.
酸----在水溶液中电离出的阳离子全部是氢离子的化合物.所谓强酸、弱酸是相对而言,
----酸溶于水能发生完全电离的,属于强酸.如HCl、H2SO4、HNO3、HBr、HI、
----酸溶于水不能发生完全电离的,属于弱酸.如碳酸、H2S、HCN、HF、磷酸、甲酸、乙酸、等.
碱----在水溶液中电离出的阴离子全部是氢氧根离子的化合物.所谓强碱、弱碱是相对而言,
----碱溶于水能发生完全电离的,属于强碱.如KOH、NaOH、Ba(OH)2、CsOH、---活泼的金属对应的碱一般是强碱.
----碱溶于水不能发生完全电离的,属于弱碱.如一水和氨、氢氧化钙(中强碱)、氢氧化铝、氢氧化锌等.1年前查看全部
- 硫化钠为什么是无氧酸盐,为什么是盐,盐的定义是什么
 ganlufen1年前4
ganlufen1年前4 -
 lijie123456789 共回答了18个问题
lijie123456789 共回答了18个问题 |采纳率88.9%1,硫化钠不含氧元素的盐.
2,金属阳离子和酸根离子构成的化合物.而硫化钠是由:金属钠离子和氢硫酸根离子【无氧酸根】.1年前查看全部
- na2so4,caco3,nacl,是不是都属于正盐又属于含氧酸盐?求解
 小龙女19761年前1
小龙女19761年前1 -
 yy1221 共回答了19个问题
yy1221 共回答了19个问题 |采纳率100%氯化钠不是含氧酸盐,碳酸钙不属于正盐1年前查看全部
- 酸性氧化物和碱性氧化物生成含氧酸盐的反应规则,能不能结合化学方程式来具体说说,
酸性氧化物和碱性氧化物生成含氧酸盐的反应规则,能不能结合化学方程式来具体说说,
比如CO2+CaO_____CaCO3
能不能多列举几个化学方程式然后告诉我反应规律啊? wqb25881年前1
wqb25881年前1 -
 kate_cat_xhj 共回答了21个问题
kate_cat_xhj 共回答了21个问题 |采纳率100%你好:
首先要判断两个氧化物是否分别为酸性氧化物和碱性氧化物【如Na2O2不是碱性氧化物】
接着,写上反应物,右边直接将反应物化合就行,注意要写准生成物.
Na2O+CO2==Na2CO3
碱性氧化物:Na2O、CaO、BaO、K2O【一般是这几个可以与酸性氧化物反应】
酸性氧化物:CO2、SO2、SO3、N2O5【一般是这几个可以与碱性氧化物反应】
此外,其它的基本不能反应.
左边两种氧化物,右边是直接化合的一种盐
回答完毕,懂啦?
望采纳O(∩_∩)O1年前查看全部
- 什么是含氧酸盐?,无氧酸盐,钠盐,硫酸盐,酸式盐,还有盐的分类等等
 abcdcba1231年前1
abcdcba1231年前1 -
 ge_yecha 共回答了12个问题
ge_yecha 共回答了12个问题 |采纳率83.3%1.含氧酸盐就是含有含氧酸根的盐,常见的含氧酸根有:碳酸根,硫酸根,亚硫酸根,硝酸根,磷酸根
2.无氧酸盐指阴离子为无氧酸根的盐,一般指阴离子为氯离子的盐
3.钠盐就是阳离子为钠离子的盐
4.酸式盐就是由金属离子(包括铵根离子)、氢离子 酸根离子和非金属离子构成的盐
5.化学-盐的分类
①正盐:单由金属离子(包括铵根离子)和非金属离子构成 ②酸式盐:由金属离子(包括铵根离子)、氢离子 酸根离子和非金属离子构成
③碱式盐:由金属离子(包括铵根离子)、氢氧根离子 酸根离子和非金属离子构成
④复盐:由不同金属离子(包括铵根离子)和酸根离子构成
碱式盐详细解释 电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐.
酸跟碱反应时,弱碱中的氢氧根离子部分被中和,生成的盐为碱式盐.,二元碱或多元碱才有可能形成碱式盐.碱式盐的组成及性质复杂多样.碱式碳酸铜Cu2CO3和化镁Mg(OH)Cl等都属于碱式盐.
碱式盐是碱被酸部分中和的产物.
其他分类方式
按酸根:含氧酸盐:Na2SO4等
无氧酸盐:NaCl等
按形成:强酸强碱盐:Na2SO4等(呈中性)
强酸弱碱盐:AlCl3等(水解,水溶液呈酸性)
强碱弱酸盐:Na2CO3等(水解,水溶液呈碱性)
弱酸弱碱盐:(NH4)2CO3等(水解,谁强成谁性)
按组成:氯盐:NaCl,MgCl,GuCl等含氯离子的盐硫酸盐:Na2SO4,CuSO4等硝酸盐碳酸盐氯酸盐钠盐钾盐……1年前查看全部
- 酸碱反应,酸盐反应,碱盐反应,盐盐反应的条件都是什么,请列举!
酸碱反应,酸盐反应,碱盐反应,盐盐反应的条件都是什么,请列举!
可以的话举几个化学方程式.
感激不尽. muyaxiaoya1年前9
muyaxiaoya1年前9 -
 风中aiq承诺 共回答了10个问题
风中aiq承诺 共回答了10个问题 |采纳率80%酸、碱、盐通性的讲解
酸碱盐一章可以说是对整个初中化学知识的运用和综合.它在化学基本概念、化学基本理论的基础上,通过对酸、碱、盐基本性质的讲解,总结出学习无机化学的规律,即通过对一个具体事物的研究,掌握规律,继而得出一类事物的性质,这对我们学习知识,尤其是学习化学这门课程有着很好的启迪作用.下面我们从几个方面对酸碱盐进行讲解.
一、准确掌握酸、碱、盐的概念,明确它们的本质区别
酸碱盐一章的概念较多,能否正确理解概念,是学好酸、碱、盐的前提条件.
1.酸及酸的通性
对于酸的定义,我们说电离时生成的阳离子全部都是H+.这里我们要特别注意的是“阳离子”、“全部”、“H+”几个关键字.下面我们以常见的硫酸和盐酸为例来说明酸的通性.
酸的通性 盐 酸 硫 酸
酸使紫色石蕊试液变红,使无色酚酞试液不变色. 盐酸使紫色石蕊试液变红,
无色酚酞试液不变色 硫酸使紫色石蕊试液变红,
无色酚酞试液不变色.
金属+酸→盐+氢气 Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑
碱性氧化物+酸→盐+水 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
碱+酸→盐+水 NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O
盐+酸→另一种盐+另一种酸 AgNO3+HCl=AgCl↓+HNO3 BaCl2+H2SO4=BaSO4↓ +2HCl
注意:
(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸.因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;金属是指在金属活动顺序表中排在‘氢’前面的活泼金属,排在‘氢’后的金属不能置换酸中的氢.
(2)通过金属跟酸的反应情况导出金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短.
(3)浓硫酸具有吸水性,通常用它作为干燥剂.硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性.稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故.
2.碱及碱的通性
与酸雷同,我们可以将碱定义为:电离时生成的阴离子全部是OH-离子.这里我们也要特别注意的是“阴离子”、“全部”、“OH-”几个关键字.下面我们以常见的氢氧化钠和氢氧化钙为例来说明碱的通性.
常见的碱及碱的通性
碱的通性 氢氧化钠 氢氧化钙
碱使紫色石蕊试液变蓝,使无色酚酞试液变红. 氢氧化钠使紫色石蕊试液变蓝,无色酚酞试液变红. 氢氧化钙使紫色石蕊试液变蓝,无色酚酞试液变红.
酸性氧化物+碱→盐+水 2NaOH+CO2=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O
酸+碱→盐+水 NaOH+HCl=NaCl+H2O Ca(OH)2+H2SO4= CaSO4+2H2O
盐+碱→另一种盐+另一种碱 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
注意:
(1)只有可溶性碱才能跟一些非金属氧化物发生反应,这些非金属氧化物是酸性氧化物.酸性氧化物多数能溶于水,跟水化合生成酸.
(2)盐和碱反应时,必须两者都是可溶的,且生成物之一是沉淀,反应才能进行.
(3)书写碱跟某些金属氧化物反应的化学方程式
关于这类反应化学方程式的书写有人感到很困难,为此,可先写出非金属氧化物跟水反应,生成含氧酸的化学方程式,再以含氧酸和碱相互交换成分写出生成物.两式合并成一个化学方程式.如,三氧化硫跟氢氧化钠反应:
3.盐及盐的性质
对于盐的概念,我们可以这样认为:即酸碱电离后离子交换生成了盐和水.比如,我们把NaCl看作是HCl和NaOH电离后的产物.
常见的盐及盐的化学性质
盐的性质 实 例
盐溶液+金属→盐ˊ+金属ˊ CuSO4+Zn= ZnSO4+Cu
盐+酸→盐ˊ+ 酸ˊ BaCl2+H2SO4=BaSO4↓ +2HCl
盐溶液+碱溶液→盐ˊ+碱ˊ 3NaOH+FeCl3=3NaCl+Fe(OH)3 ↓
盐溶液+盐溶液→盐ˊ+盐ˊ AgNO3+NaCl=AgCl↓+NaNO3
注意:
在金属活动顺序表中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来.但K、Ca、Na三种金属与盐溶液的反应特殊,这里不要求.
二、明确复分解反应发生的本质,掌握酸碱盐反应的规律
1.复分解反应及其发生的条件
复分解反应的定义是:由两种化合物相互交换成分,生成另外两种化合物的反应.
通式:AB+CD=AD+CB
发生的条件:两种物质在溶液中相互交换离子,生成物中如果有沉淀析出、气体放出或有水生成,复分解反应均可以发生.
2.运用复分解反应发生的条件,正确书写本章涉及的化学方程式
有很多同学记住了酸、碱通性和盐的性质,但接触到具体物质发生的具体反应,用化学方程式来表达时,便感到困难.解决这一难点的办法有二:一是在学习酸的通性和碱的通性时,反复练习书写有关化学方程式,这两部分内容掌握了,学习盐的性质也就迎刃而解;二是要自学书后附录Ⅲ“部分酸、碱和盐的溶解性表”,从中找出溶与不溶的规律,再多练习书写有关反应的化学方程式,边写边巩固复分解反应条件.这样多次练习,你会觉得书写复分解反应的化学方程式,是有规律可循的,并不是难事.
3.碱与酸性氧化物反应不属于复分解反应
三、熟记酸、碱、盐的溶解性
酸、碱、盐的溶解性是判断复分解反应能否发生的一个重要依据,这里我们为你提供一个记忆口诀:
钾钠铵盐硝酸盐, 全部都属可溶盐.
硫酸盐不溶钡和铅; 酸易溶,碱难溶.
氯化物不溶银亚汞, 碳酸盐,多不溶.
四、几个常见离子的检验
Cl-、 、 的检验
实验操作 实验现象 实验结论 化学方程式
Cl- 取少量样品于试管中,滴加AgNO3溶液和稀HNO3 有不溶于稀硝酸的白色沉淀生成 样品含有Cl-
AgNO3+KCl=AgCl↓+KNO3
取少量样品于试管中,滴加Ba(NO3)2溶液和稀HNO3 有不溶于稀硝酸的白色沉淀生成 样品含有
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
取少量样品于试管中,滴加稀HCl,将生成的气体通入澄清石灰水 有无色气体生成,该气体使澄清石灰水变浑浊 样品含有
K2CO3+2HCl=2KCl+ CO2↑+H2O
CO2+Ca(OH)2= CaCO3↓+ H2O
糟糕 它不认识表格 你用下面的那个吧没表格的
酸碱盐知识归纳
一、概念:
1、 酸的组成——氢离子+酸根离子
2、 碱的组成——金属离子+氢氧根离子
3、 盐的组成——金属离子+酸根离子
4、 复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应.AB+CD=AD+CB
5、 稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里.
6、 中和反应——酸跟碱作用生成盐和水的反应叫做中和反应.
二、熟记常见元素和原子团的化合价口诀:
(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷.
(负价)负一价:氟、氯、溴、碘;
负二价:氧和硫.
(可变正价):一二铜汞,二三铁,二四碳,四六硫.
(原子团的化合价
负一价:氢氧根(OH),硝酸根(NO3),氯酸根(ClO3),高锰酸根(MnO4);
负二价:硫酸根(SO4),碳酸根(CO3),亚硫酸根(SO3),锰酸根(MnO4);
负三价:磷酸根(PO4);
正一价:铵根(NH4).
三、熟记下列反应方程式:
(一)酸的性质(1)与指示剂反应 紫色石蕊试液变红色,无色酚酞试液不变色.
(2)酸 + 碱 = 盐 + 水.
(3)酸 + 某些金属氧化物 = 盐 + 水.
(4)酸 + 活泼金属 = 盐 + 氢气.
(5)酸 + 盐 = 新盐 + 新酸.
1、 锌跟稀盐酸反应: Zn + 2HCl = ZnCl2 + H2 ↑ 有气泡产生,锌粒逐渐减少.
2、 锌跟稀硫酸反应: Zn + H2SO4 = ZnSO4 + H2 ↑
3、 铁跟稀盐酸反应: Fe + 2HCl = FeCl2 + H2 ↑ 有气泡产生,铁逐渐减少,
4、 铁跟稀硫酸反应: Fe + H2SO4 =FeSO4 + H2 ↑ 溶液变成浅绿色.
5、 铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,
6、 铁锈跟稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色
7、 氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,
8、 氧化铜跟稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O 溶液变成蓝色.
(二)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色.
(2)碱 + 多数非金属氧化物 = 盐 + 水
(3)碱 + 酸 = 盐 + 水
(4)碱+某些盐 = 另一种盐 + 另一种碱
1、 氢氧化钠跟二氧化碳反应:2NaOH + CO2 = Na2CO3 + H2O
2、 氢氧化钠跟二氧化硫反应:2NaOH + SO2 = Na2SO3 + H2O
3、 氢氧化钠跟三氧化硫反应:2NaOH + SO3 = Na2SO4 + H2O
4、 氢氧化钙跟二氧化碳反应:Ca(OH)2 + CO2 = CaCO3↓ + H2O 使澄清石灰水变浑浊
5、 氢氧化钠跟稀硫酸反应:2NaOH + H2SO4 = Na2SO4 + 2H2O
6、 氢氧化钠跟稀盐酸反应:NaOH + HCl = NaCl + H2O
7、 生石灰跟水反应:CaO + H2O =Ca(OH)2
(三)盐的性质:(1)盐 + 某些金属=另一种盐 + 另一种金属.
(2)盐 + 某些酸 = 另一种盐 + 另一种酸.
(3)盐 + 某些碱 = 另一种盐 + 另一种碱
(4)盐 + 某些盐 = 另一种盐 + 另一种盐
1、 硫酸铜溶液跟铁反应:CuSO4 + Fe = ZnSO4 +Fe 铁表面覆盖红色物质,溶液由蓝色变浅绿色
2、 碳酸钠跟盐酸反应:Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑有气泡产生固体逐渐减少
3、 碳酸氢钠跟盐酸反应:NaHCO3 + HCl = NaCl +H2O + CO2↑有气泡产生固体逐渐减少
4、 石灰石跟稀盐酸反应:CaCO3 + 2HCl = CaCl2 +H2O +CO2↑有气泡产生固体逐渐减少
5、 硝酸银跟稀盐酸反应:AgNO3 + HCl = AgCl↓ +HNO3 有白色沉淀产生
6、 氯化钡跟稀硫酸反应:BaCl2 + H2SO4 = BaSO4↓ + 2HCl 有白色沉淀产生
7、 氢氧化钙根碳酸钠溶液反应:Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 有白色沉淀产生
8、 硝酸银溶液跟氢氧化钠溶液反应:AgNO3 + NaCl = AgCl↓ + NaNO3有白色沉淀产生
9、 氯化钡溶液跟硫酸钠溶液反应:BaCl2 + Na2SO4 = 2NaCl + BaSO4↓有白色沉淀产生
四、金属活动性顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
五、溶解性表:
(1) 大多数酸可溶(HCl、HNO3、H2CO3有挥发性、浓H2SO4有吸水性.)
(2) 碱的溶解性:钾、钠、钡、铵溶、钙微溶,其余碱 全不溶.
(3) 盐的溶解性:
钾、钠、铵、硝四盐溶.
氯化物除AgCl不溶外,其余全溶.
硫酸盐除BaSO4不溶,Ag2SO4、CaSO4微溶外,其余全溶.
碳酸盐除钾、钠、铵盐全溶、MgCO3微外,其余全不溶.
六、反应条件:
1、 复分解反应的条件——生成物中有沉淀析出,或有气体放出,或有水生成
2、 金属跟酸反应的条件——
(1) 在金属活动性顺序表中,金属要排在氢前.
(2) 浓硫酸、硝酸跟金属反应不能生成氢气.
(3) 铁发生置换反应时,生成+2价的铁的化合物.
3、 金属跟盐反应的条件——
(1)在金属活动性顺序表中,单质的金属要比盐中金属活泼.
(2)反应物中的盐要可溶.
(3)K、Ca、Na、Ba等金属跟盐反应不能生成另一种盐和另一种金属.
4、 盐跟盐反应的条件——反应物都要可溶,生成物要有沉淀.
5、 盐跟碱反应的条件——反应物都要可溶,生成物要有沉淀或气体.
七、熟记常见物质的俗称和化学式:
生石灰—— CaO 熟石灰——Ca(OH)2 石灰石、大理石—— CaCO3
食盐——NaCl 火碱、烧碱、苛性钠—— NaOH 纯碱、苏打——Na2CO3
小苏打—— NaHCO3 铁锈、赤铁矿——Fe2O3 赤铁矿—— Fe3O4
金刚石、石墨—— C 干冰——CO2 冰—— H2O
天然气(甲烷)——CH4 酒精(乙醇)—— C2H5OH 醋酸(乙酸)——CH3COOH
八、熟记常见物质的颜色:
红色的固体——Cu、Fe2O3 、P(红磷)
黑色的固体——C、CuO、Fe3O4、FeO、MnO2
白色的固体——KClO3、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等
暗紫色的固体——KMnO4 黄色的固体—— S
蓝色的固体——CuSO4•5H2O 蓝色絮状沉淀——Cu(OH)2
红褐色絮状沉淀——Fe(OH)3 常见不溶于酸的白色沉淀——BaSO4、AgCl
溶于酸并放出使澄清石灰水变浑浊的气体的白色沉淀——BaCO3、CaCO3等不溶性碳酸盐的沉淀
溶于酸但不产生气体的白色沉淀——Mg(OH)2、Al(OH)3等不溶性碱的沉淀
蓝色的溶液—— CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液
浅绿色的溶液——FeSO4、FeCl2等含Fe2+溶液
黄色的溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液
九、物质的检验和鉴别:
1、 检验稀盐酸(或Cl-)——取少量待检液体于洁净的试管中,滴入几滴AgNO3溶液和稀HNO3,有白色沉淀产生.
2、 检验稀硫酸(或SO42-)——取少量待检液体于洁净的试管中,滴入几滴BaCl2溶液和稀HNO3,有白色沉淀产生.
3、 检验CO32-——取少量待检液体于洁净的试管中,滴入几滴稀HCl,有使澄清石灰水变浑浊的气体产生.
4、 检验NH4+——取少量待检物于洁净的试管中,滴入适量NaOH溶液并加热,有使湿的红色石蕊试纸变成蓝色的气体产生.
5、 鉴别稀盐酸和稀硫酸——分别取少量待检液体于两支洁净的试管中,各滴入几滴BaCl2溶液,有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸.
6、 鉴别Ca(OH)2和NaOH溶液——分别取少量待检液体于两支洁净的试管中,分别通入CO2气体(或各滴入几滴Na2CO3溶液),有白色沉淀产生的原溶液是Ca(OH)2,无现象产生的原溶液是NaOH.
◎补充下列反应方程式:
1、 氢氧化铜跟稀盐酸反应: Cu(OH)2 + 2HCl = CuCl2 + 2H2O 蓝色沉淀消失
2、 氢氧化铜跟稀硫酸反应: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O 变成蓝色溶液
3、 氢氧化钠跟硫酸铜溶液反应:2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 ↓ 有蓝色沉淀产生
4、 氢氧化钠跟氯化铁溶液反应:3NaOH + FeCl3 = Fe(OH)3↓ +3NaCl 有红褐色沉淀产生
◎判断溶液的酸碱性——用指示剂,溶液的酸碱度——用pH来表示.
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
中性
← 酸性增强 碱性增强 →
紫色石蕊 无色酚酞
pH7为碱性 显蓝色 显红色
◎干燥剂的选择:
1、浓硫酸可干燥:酸性气体(如:CO2、SO2、SO3、NO2、HCl、)
中性气体(如:H2、O2、N2、CO)
※不能干燥碱性气体(如:NH3)
2、氢氧化钠固体、生石灰、碱石灰可干燥:碱性气体(如:NH3)
中性气体(如:H2、O2、N2、CO)
※不能干燥酸性气体(如:CO2、SO2、SO3、NO2、HCl、)
3、无水硫酸铜固体遇水由白色变蓝色,可检验水的存在,并吸收水蒸气.1年前查看全部
- 问下,我按药典配制硫乙醇酸盐流体培养基,为何得到的培养基整瓶都是茶红色的?冷却,加热都无变化.
 xlb_d1b6it1ad91年前2
xlb_d1b6it1ad91年前2 -
 Infest 共回答了14个问题
Infest 共回答了14个问题 |采纳率85.7%1.要用新沸放冷的水配,记得沸的时间长一点.
2.分装的时候要边搅拌边分装.
3.灭菌好后使用前发现红色层过多(超过整个层高的1/5),可在沸水浴中加热一次(仅一次,时间不得过20分钟).1年前查看全部
- 生孢梭菌为什么要用硫乙醇酸盐作培养基
 nn船长1年前1
nn船长1年前1 -
 food_wfz 共回答了19个问题
food_wfz 共回答了19个问题 |采纳率94.7%生孢梭菌是一种厌氧菌,使用硫乙醇酸盐作培养基的原因是:硫乙醇盐是一种还原剂,能够为厌氧菌生长提供较低的氧化还原电位,防止过氧化物的积累对生孢梭菌产生毒性;同时其硫氢基团有钝化含砷、汞及其它重金属防腐剂的抑菌作用.1年前查看全部
- 现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元
现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元素质量比为7:8.为进一步确定该固体成分,现将4.68g该固体试样溶于水,滴加适量稀硫酸后,再加入2.24g铁粉,铁粉与酸根恰好完全反应生成Fe2+.向反应后的溶液中加入一定量的KOH溶液至刚好将Fe2+沉淀完全,过滤;将沉淀充分加热后得到Fe2O3 4.8g.将滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧酸正盐(不是复盐)A,测得其质量为13.92g.
(1)A的化学式为______.
(2)该盐含有的金属元素是______.
(3)通过计算推断该盐的化学式. 爱吃萝卜爱吃菜1年前1
爱吃萝卜爱吃菜1年前1 -
 Mshine520 共回答了27个问题
Mshine520 共回答了27个问题 |采纳率92.6%解题思路:(1)根据加入的试剂和元素守恒确定A的化学式;
(2)根据加入的铁粉和生成的氧化铁中铁是否相等判断是否含铁;根据加入的钾和硫酸钾中的钾是否相等,判断是否含钾元素;
(3)根据钾和酸根的量的关系初步写出化学式,根据相对分子质量计算出结晶水的含量,进一步写出化学式.(1)因在反应过程中加入了硫酸溶解该盐,后又加入了氢氧化钾来沉淀亚铁离子,根据原子守恒,滤液中溶质只能是硫酸钾,故答案为:K2SO4;
(2)2.24g铁粉的物质的量为:[2.24g/56g/mol]=0.04mol,4.8g氧化铁的物质的量为:[4.8g/160g/mol]=0.03mol,该氧化铁中含铁0.06mol,比加入的铁粉多0.02,根据铁粉与酸根恰好完全反应生成Fe2+,可知酸根由铁元素和氧元素组成,因二者质量比为7:8,故二者物质的量比为:[7/56]:[8/16]=1:4,0.04mol铁粉和0.02mol该酸根反应,设酸根中铁的化合价为x,根据得失电子守恒得:0.04×2=0.02×(x-2),解得x=6,故该酸根为:FeO42-.将Fe2+完全沉淀需氢氧化钾的物质的量为:0.06mol×2=0.12mol,硫酸钾的物质的量为:[13.92g/174g/mol]=0.08mol,含K+的物质的量为0.16mol,大于加入的氢氧化钾0.12mol,故该盐中含钾元素0.04mol,故该盐中含铁、钾两种金属元素;
故答案为:钾和铁;
(3)该盐中钾和酸根的物质的量之比为:0.04:0.02=2:1,该盐还有一种元素,只能以结晶水存在,故该盐可写成K2FeO4•nH2O的形式,
该盐的摩尔质量为:[4.68g/0.02mol]=234g/mol,即39×2+56+16×4+n×18=234,解得 n=2,故该盐的化学式为:K2FeO4•2H2O
答:该盐的化学式为K2FeO4•2H2O.点评:
本题考点: 复杂化学式的确定.
考点点评: 本题考查了复杂化学式的确定,题目较难,关键是利用已加物质和通过反应生成物质之间的某种元素的量的关系确定某元素是否存在,题目多次用到守恒法,要灵活运用.1年前查看全部
- 只有非金属能形成含氧酸或含氧酸盐 这句话对吗?
 zzsjw11年前2
zzsjw11年前2 -
 旎萝纭 共回答了24个问题
旎萝纭 共回答了24个问题 |采纳率79.2%错误,一些金属性较弱的金属元素也能形成.如:铝,形成偏铝酸根离子.NaAlO21年前查看全部
- 含氧酸盐中,一定有两种非金属元素,举例
 四月121年前1
四月121年前1 -
 chunqiner 共回答了21个问题
chunqiner 共回答了21个问题 |采纳率95.2%不对!锰酸钾中只有一种非金属元素,锰、钾是金属1年前查看全部
- 现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元
现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元素质量比为7:8.为进一步确定该固体成分,现将4.68g该固体试样溶于水,滴加适量稀硫酸后,再加入2.24g铁粉,铁粉与酸根恰好完全反应生成Fe2+.向反应后的溶液中加入一定量的KOH溶液至刚好将Fe2+沉淀完全,过滤;将沉淀充分加热后得到Fe2O3 4.8g.将滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧酸正盐(不是复盐)A,测得其质量为13.92g.
(1)A的化学式为______.
(2)该盐含有的金属元素是______.
(3)通过计算推断该盐的化学式. 希望简单爱1年前1
希望简单爱1年前1 -
 689jsp 共回答了19个问题
689jsp 共回答了19个问题 |采纳率89.5%解题思路:(1)根据加入的试剂和元素守恒确定A的化学式;
(2)根据加入的铁粉和生成的氧化铁中铁是否相等判断是否含铁;根据加入的钾和硫酸钾中的钾是否相等,判断是否含钾元素;
(3)根据钾和酸根的量的关系初步写出化学式,根据相对分子质量计算出结晶水的含量,进一步写出化学式.(1)因在反应过程中加入了硫酸溶解该盐,后又加入了氢氧化钾来沉淀亚铁离子,根据原子守恒,滤液中溶质只能是硫酸钾,故答案为:K2SO4;
(2)2.24g铁粉的物质的量为:[2.24g/56g/mol]=0.04mol,4.8g氧化铁的物质的量为:[4.8g/160g/mol]=0.03mol,该氧化铁中含铁0.06mol,比加入的铁粉多0.02,根据铁粉与酸根恰好完全反应生成Fe2+,可知酸根由铁元素和氧元素组成,因二者质量比为7:8,故二者物质的量比为:[7/56]:[8/16]=1:4,0.04mol铁粉和0.02mol该酸根反应,设酸根中铁的化合价为x,根据得失电子守恒得:0.04×2=0.02×(x-2),解得x=6,故该酸根为:FeO42-.将Fe2+完全沉淀需氢氧化钾的物质的量为:0.06mol×2=0.12mol,硫酸钾的物质的量为:[13.92g/174g/mol]=0.08mol,含K+的物质的量为0.16mol,大于加入的氢氧化钾0.12mol,故该盐中含钾元素0.04mol,故该盐中含铁、钾两种金属元素;
故答案为:钾和铁;
(3)该盐中钾和酸根的物质的量之比为:0.04:0.02=2:1,该盐还有一种元素,只能以结晶水存在,故该盐可写成K2FeO4•nH2O的形式,
该盐的摩尔质量为:[4.68g/0.02mol]=234g/mol,即39×2+56+16×4+n×18=234,解得 n=2,故该盐的化学式为:K2FeO4•2H2O
答:该盐的化学式为K2FeO4•2H2O.点评:
本题考点: 复杂化学式的确定.
考点点评: 本题考查了复杂化学式的确定,题目较难,关键是利用已加物质和通过反应生成物质之间的某种元素的量的关系确定某元素是否存在,题目多次用到守恒法,要灵活运用.1年前查看全部
- 铁的氧化物与含氧酸盐反应?铁的氧化物与那些含氧酸盐可以反应?写出反应方程式(可不配平).要求:生成含氧酸铁,化合价不管,
铁的氧化物与含氧酸盐反应?
铁的氧化物与那些含氧酸盐可以反应?写出反应方程式(可不配平).要求:生成含氧酸铁,化合价不管,但类型不能重复,不能在水溶液中反应,至少写三个,除FeO与NH4Cl反应.(声明,这是一道非常难的化学竞赛题,))
必须和含氧酸盐反应。 快乐的小米虫1年前4
快乐的小米虫1年前4 -
 xcx1965 共回答了19个问题
xcx1965 共回答了19个问题 |采纳率94.7%3FeO+Al2(SO4)3+3H2O==3FeSO4+2Al(OH)3
硫酸铝由于水解呈较强酸性,溶解氧化铁,进而促进其水解
18FeO+3NaClO3+27H20==FeCl3+3NaOH+17Fe(OH)3
氯酸钠水解生成氯酸,氧化二价铁
只有这两种:即和酸性物质反应、和氧化剂反应1年前查看全部
- 什么是酸式盐,什么是含氧酸盐.NaHCO3是含氧酸盐吗?
 向量波Mk21年前3
向量波Mk21年前3 -
 刘小飞 共回答了21个问题
刘小飞 共回答了21个问题 |采纳率95.2%酸式盐是指盐中氢离子没有被完全中和的盐,也就是在水中可以电离出氢离子的盐
含氧酸盐顾名思义就是 由含氧元素的酸根形成的盐,碳酸氢钠中,碳酸氢根含有氧元素所以是含氧酸盐1年前查看全部
- 一系列化学概念知识类问题!1.不管什么含氧酸盐或者无氧酸盐,为什么都叫酸盐而没有XX碱盐?XX酸盐和酸式盐碱式盐正盐又有
一系列化学概念知识类问题!
1.不管什么含氧酸盐或者无氧酸盐,为什么都叫酸盐而没有XX碱盐?
XX酸盐和酸式盐碱式盐正盐又有什么区别和联系?
2.为什么“风化(是化学上的风化,不是岩石被风吹的那种!)”属于化学变化?什么是风化?
3.Cl2与Fe的反应需要什么条件,是加热还是加水,卤素单质与金属什么条件下,什么样的卤素单质什么样的金属,能够反应.反应类型是什么?
第三个问题怎么你们的回答都不一致啊?到底CL2和Fe可以直接反应吗? 草色琉璃1年前7
草色琉璃1年前7 -
 随风飘 共回答了20个问题
随风飘 共回答了20个问题 |采纳率90%1.碱是金属阳离子和氢氧根,酸是氢离子和酸根,盐是金属阳离子和酸根组成,酸根大多数是非金属组成,多变价.所以酸式盐一般是阴离子带其他离子.如碳酸氢钠,硫代硫酸钠.酸式盐电离时生成的阳离子除金属离子(或NH4+)外还...1年前查看全部
- 复分解反应 物质微溶有以下两个关于复分解反应的问题:(1)复分解反应中有一个口诀:“碱盐盐盐需两溶,酸碱中和可一溶,酸盐
复分解反应 物质微溶
有以下两个关于复分解反应的问题:
(1)复分解反应中有一个口诀:“碱盐盐盐需两溶,酸碱中和可一溶,酸盐反应酸必溶” 那么反应物如果是微溶,算可溶还是不溶?
(2)判断反应物时,交换成分后,如有微溶物,算可溶还是微溶?
第二问打错了,是 判断生成物 不好意思。 lcx1234561年前3
lcx1234561年前3 -
 183764280 共回答了14个问题
183764280 共回答了14个问题 |采纳率92.9%微溶算不溶.
微溶.
你把他考虑成不溶即可,只是在标记时有时并不当成不溶物来看待.1年前查看全部
- 硫的不含氧酸盐是不是都不溶于水RT,像CuS什么的.此外,有没有什么特殊颜色的硫化物?THX!
 翠绿的心痕1年前2
翠绿的心痕1年前2 -
 何炜 共回答了11个问题
何炜 共回答了11个问题 |采纳率90.9%不全是,如Na2S就可溶.但大部分金属的硫化物均为不溶物或微溶物.1年前查看全部
- 为什么酸盐溶液能加快铁的锈蚀?有人回答过,是Fe会和酸碱盐溶液反应,那食盐水呢?
 土豆外婆1年前2
土豆外婆1年前2 -
 广西男人 共回答了19个问题
广西男人 共回答了19个问题 |采纳率78.9%这个不是普通的化学反应 是电化学反应 构成电化学中的铁的析氢腐蚀或吸氧腐蚀(酸性溶液是析氢腐蚀,中性盐溶液是吸氧腐蚀) 构成电化学腐蚀的条件要有 1.两个活性不同的电极 2 电解质溶液 3 闭合回路 4 要有一个电极能与电解质溶液(或电解质中溶解的氧气)发生自发氧化还原反应 生活中的铁中都有碳 铁做负极 碳做正极 而且电化学反应速率比化学反应要快1年前查看全部
大家在问
- 1化简:根号1+n平方分之1+括号n+1的平方分之1
- 2带两个一的成语
- 3What if 和What about、Why not的区别
- 4英语作文:设你去年去了加拿大请根据以下内容写一篇旅游见闻时间去年暑假人员你和父母出发地点北京
- 5m为何值时,关于x的方程3/x +6/x-1 =x+m/x(x-1)的解等于1/2?
- 6图A为呼吸系统的组成的示意图,图B为肺泡与毛细血管之间的;气体交换示意图,请根据图回答下列问题:
- 7一道很烦的数学题虽然会做但老师要求算式不能太多最好简单一点求各位帮忙
- 8短文是从哪些方面介绍鲸
- 9在等腰直角三角形ABC中,AB=BC角ABC的平分线交BC于E,EF垂直AC于F,FG垂直AB于G,求证AB^2=2FG
- 10狼羊过河一人带着3只狼和3只羊过河,船一次只能坐一人加两只动物,如狼的只数超过了或者等于羊的数量,狼会吃掉羊,只有羊的只
- 11还读过冰心奶奶的哪些文章的把题目写下来和大家交流一下.
- 12CRUSHONYOU这句英语什么意思
- 13Overcome ,otherwise翻译
- 14(2005•杭州二模)(x2+2x)6的二项展开式中,常数项有( )
- 15迎客松热情,陪客松耐心,那么送客松是什么?
