将煤炼制成煤气是化学变化还是物理变化?
 tianzou2022-10-04 11:39:542条回答
tianzou2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 mouse000 共回答了22个问题
mouse000 共回答了22个问题 |采纳率86.4%- 是化学变化 称 煤的干馏
- 1年前
 zero000 共回答了9个问题
zero000 共回答了9个问题 |采纳率- 化学变化,因为有新物质生成了。
- 1年前
相关推荐
- 物质A是一种重要的化工原料,主要由石油炼制得到.在一定条件下,A和B能发生化学反应生成C和D,如图是该反应的微观示意图,
物质A是一种重要的化工原料,主要由石油炼制得到.在一定条件下,A和B能发生化学反应生成C和D,如图是该反应的微观示意图,其中不同的“球”代表不同的原子.请回答下列问题:

(1)1个C分子中含______个原子.
(2)D物质的化学式为______.
(3)4种物质中,属于单质的是______(填图中字母).
(4)下列说法正确的是______.
A.反应前后,分子种类没有发生变化
B.反应前后,原子的种类、数目不变
C.A物质中一定含碳、氢元素,可能含氧元素
D.该反应的基本类型为置换反应. gengyuer1年前1
gengyuer1年前1 -
 260213 共回答了20个问题
260213 共回答了20个问题 |采纳率95%解题思路:从各粒子的模型图可以看出该粒子的构成并能写出化学式,可解决(1)(2)题;(3)从粒子的原子构成能判断物质的种类,根据质量守恒定律的实质和应用来解答(4)题.(5)根据质量守恒定律和A物质的相对分子质量,可推出A的化学式,进而可写出化学方程式.(1)从C分子的模型图看出,1个C分子中含3个原子(一个碳原子和两个氧原子),故C是二氧化碳.(2)D物质的分子由一个氧原子和两个氢原子构成,化学式为 H2O.(3)单质是由同种元素组成的纯净物,单质的分子含有一...
点评:
本题考点: 微粒观点及模型图的应用;单质和化合物的判别;化学式的书写及意义;反应类型的判定.
考点点评: 本题从对模型图的理解,质量守恒定律的应用和化学方程式的书写等方面进行了考查,是一道不错的习题.1年前查看全部
- 实验室炼制的铁和工业炼制出的铁最大的区别是
 胸大有痣1年前1
胸大有痣1年前1 -
 whanjiang 共回答了12个问题
whanjiang 共回答了12个问题 |采纳率91.7%1、来源:前者是含铁化合物,化合物本身就很纯;后者是铁矿石
2、制法:前者充其量是制铁;后者才有炼铁这一步
3、纯度:前者是化学纯或分析纯,纯度高;后者工业用,要求只是工业纯
4、成分:前者几乎就是纯铁,容易被腐蚀;后者经常掺入锡或者锌,分别为马口铁和白铁,各自有特殊的作用1年前查看全部
- 英语翻译晕 改为 俄油炼制的直馏柴油脱硫吸附剂的研究 了
 1山贼1年前1
1山贼1年前1 -
 zhuzhu047 共回答了23个问题
zhuzhu047 共回答了23个问题 |采纳率87%我也在做和这个相关的题目,不过你的题目有语病啊!研制一般说的是研制某东西,比如催化剂什么的.
如果是直馏柴油吸附脱硫的研究,那就可以下面这样翻译:
the research on desulfurization of straight-run diesel by adsorption way1年前查看全部
- B是家庭中常用到的某种调味品的主要成分,E是石油炼制的重要产物之一农业上用于催熟果实,F是一...
B是家庭中常用到的某种调味品的主要成分,E是石油炼制的重要产物之一农业上用于催熟果实,F是一...
B是家庭中常用到的某种调味品的主要成分,E是石油炼制的重要产物之一农业上用于催熟果实,F是一重要的塑料,B和C在一定条件下也可以生成A hngirl1年前1
hngirl1年前1 -
 风雨强渡 共回答了20个问题
风雨强渡 共回答了20个问题 |采纳率80%你的题目给的太不全了
E是乙烯,这个是肯定的
F哎,重要的塑料,根据题目相关度来说,聚乙烯
其他的没法答了,B应该是醋酸或者碳酸氢钠
你把其他的再补充补充吧1年前查看全部
- 青铜是由铜,锡,锌按44:5:1熔制而成的.现在要炼制800千克青铜,需铜锡锌多少千克?
 zhoubingwoaini1年前1
zhoubingwoaini1年前1 -
 SSDD45 共回答了15个问题
SSDD45 共回答了15个问题 |采纳率93.3%青铜是由铜,锡,锌按44:5:1熔制而成的.现在要炼制800千克
青铜,需铜锡锌多少千克?
44+5+1=50
铜:800×44/50=704(千克 )
锡:800×5/50=80(千克 )
锌:800×1/50=16(千克 )1年前查看全部
- 哈市正在施工的地铁工程某处工地,现需要700t含杂质4%的生铁制品,假设炼铁厂用含氧化铁80%的赤铁矿来炼制这些生铁,在
哈市正在施工的地铁工程某处工地,现需要700t含杂质4%的生铁制品,假设炼铁厂用含氧化铁80%的赤铁矿来炼制这些生铁,在炼制过程中损失了20%的铁元素,则该厂需要赤铁矿的质量?
 ksy12141年前5
ksy12141年前5 -
 pub11 共回答了12个问题
pub11 共回答了12个问题 |采纳率66.7%设需要赤铁矿的质量为x 吨
含有Fe2O3的质量就是:80% * x 吨
含有铁元素的质量就是80%x * 112 / 160 吨
损失后,铁的质量就是80%x * 112 * (1 - 20%) / 160 吨
对应生铁质量,有方程式如下:
80%x * 112 * (1 - 20%) / 160 = 700 * (1 - 4%)
解出 x = 1500
该厂需要赤铁矿的质量就是1500吨1年前查看全部
- (2010•重庆)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO
(2010•重庆)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO
(1)Ca元素在周期表中位置是______,其原子结构示意图______.
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为______,D的沸点比A与Si形成的化合物E的沸点______.
(3)配平用钙线氧脱鳞的化学方程式:______P+______FeO+______CaO→______Ca3(PO4)2+______Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为______;检测Mn+的方法是______(用离子方程式表达).
(5)取 1.6g钙线试样,与水充分反映,生成224ml H2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3______g. 默默深蓝1年前1
默默深蓝1年前1 -
 lzbwp 共回答了25个问题
lzbwp 共回答了25个问题 |采纳率92%解题思路:(1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,对于主族元素,电子层数=周期数,最外层电子数=族序数;
(2)最活跃的非金属元素A为F元素,钙与氟形成氟化钙,为离子化合物,氟元素与Si形成的化合物为SiF4,SiF4是分子晶体,离子晶体的沸点高于分子晶体;
(3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,据此配平;
(4)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,利用Fe3+与SCN-结合生成红色物质检验铁离子;
(5)钙与水反应生成氢氧化钙与氢气,根据n=
计算氢气的物质的量,根据电子转移守恒计算Ca的物质的量,根据氧化钙的质量分数计算氧化钙的质量,计算氧化钙的物质的量,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根据m=nM计算碳酸钙的质量.V Vm (1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,处于周期表中第四周期第ⅡA族,原子结构示意图为
 ,故答案为:第四周期第ⅡA族;
,故答案为:第四周期第ⅡA族; ;
;
(2)最活跃的非金属元素A为F元素,钙与氟形成氟化钙,为离子化合物,电子式为 ,氟元素与Si形成的化合物为SiF4,SiF4是分子晶体,离子晶体的沸点高于分子晶体,故沸点CaF2>SiF4;
,氟元素与Si形成的化合物为SiF4,SiF4是分子晶体,离子晶体的沸点高于分子晶体,故沸点CaF2>SiF4;
故答案为: ;高;
;高;
(3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,故Ca3(PO4)2系数为1,FeO的系数为5,P系数为2,CaO的系数为3,Fe的系数为5,故配平后方程式为2P+5FeO+3CaO=Ca3(PO4)2+5Fe,故答案为:2、5、3、1、5;
(4)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,Fe3+与SCN-结合生成红色物质检验Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe;Fe3++3SCN-=Fe(SCN)3;
(5)224mlH2的物质的量为[0.224L/22.4L/mol]=0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为[0.01mol×2/2]=0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为[0.056g/56g/mol]=0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g,
故答案为:1.1.点评:
本题考点: 位置结构性质的相互关系应用;电子式;氧化还原反应方程式的配平;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查结构与位置关系、常用化学用语书写、氧化还原反应、化学计算等,题目综合性较大,难度中等,(5)中注意利用守恒进行计算.1年前查看全部
- 下列说法不正确的是下列说法不正确的是A汞的炼制只能用还原剂法 B铝的一般炼制能用还原剂法
 daklyk1年前5
daklyk1年前5 -
 冷酷-到底 共回答了20个问题
冷酷-到底 共回答了20个问题 |采纳率100%A、错误.Hg是不活泼金属,可以用加热氧化物的方法制备:2 HgO ==△== 2 Hg + O2↑
B、错误.铝用电解法制备(电解氧化铝、冰晶石混合物),不是还原剂法
AB都错误1年前查看全部
- 石油炼制过程属于什么变化
 婕尽全力321年前3
婕尽全力321年前3 -
 景川渔夫 共回答了20个问题
景川渔夫 共回答了20个问题 |采纳率85%分馏
物理变化,利用的是物理性质--沸点不同
裂解
化学变化1年前查看全部
- 石油不仅仅是一种重要的能源,通过石油化工厂的炼制还可制得大量用于生产合成纤维、合成橡胶、塑料、农药、化肥、医药、油漆、合
石油不仅仅是一种重要的能源,通过石油化工厂的炼制还可制得大量用于生产合成纤维、合成橡胶、塑料、农药、化肥、医药、油漆、合成洗涤剂等等重要化工产品的原料.因此,石油有“黑色黄金”的美誉.开采石油必须钻井,钻井所用钻头的原料是( )
A.不锈钢
B.金刚石
C.铝合金
D.钨钢 土豆无语1年前1
土豆无语1年前1 -
 zikydang 共回答了18个问题
zikydang 共回答了18个问题 |采纳率94.4%解题思路:物质的性质决定物质的用途,根据金刚石是天然存在的最硬的物质,进行分析解答.A、钻井所用钻头的原料必须具备硬度大的性质,金刚石是天然存在的最硬的物质,钻井所用钻头的原料是金刚石,不是不锈钢,故选项错误.
B、钻井所用钻头的原料必须具备硬度大的性质,金刚石是天然存在的最硬的物质,钻井所用钻头的原料是金刚石,故选项正确.
C、钻井所用钻头的原料必须具备硬度大的性质,金刚石是天然存在的最硬的物质,钻井所用钻头的原料是金刚石,不是铝合金,故选项错误.
D、钻井所用钻头的原料必须具备硬度大的性质,金刚石是天然存在的最硬的物质,钻井所用钻头的原料是金刚石,不是钨钢,故选项错误.
故选:B.点评:
本题考点: 碳单质的物理性质及用途.
考点点评: 本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答本题的关键.1年前查看全部
- 如果说“我在之前已经炼制了一些丹药”是不是用过去完成式?是不是I had made some immortaily me
如果说“我在之前已经炼制了一些丹药”是不是用过去完成式?是不是I had made some immortaily medicine before?
 璀璨启空1年前1
璀璨启空1年前1 -
 zbh196839 共回答了17个问题
zbh196839 共回答了17个问题 |采纳率100%对的呀.是用had done1年前查看全部
- 某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁.若要炼制含铁96%的生铁63t,假设在炼制过程中损
某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁.若要炼制含铁96%的生铁63t,假设在炼制过程中损失10%铁元素,则理论上需要含杂质20%的赤铁矿石的质量是( )
A. 120t
B. 108t
C. 96t
D. 84t 蓝星光1年前1
蓝星光1年前1 -
 81620074 共回答了13个问题
81620074 共回答了13个问题 |采纳率100%解题思路:由已知“含铁96%的生铁63t”,可计算铁的质量;由铁的质量,可计算理论上所炼铁的质量;根据化学方程式可求氧化铁的质量,最后可求含杂质20%赤铁矿石的质量.含铁96%的生铁63t中铁的质量为:63t×96%;则理论上所炼铁的质量为63t×96%÷(1-10%)=63t×96%×[10/9];设需要含杂质20%的赤铁矿石的质量为x,
3CO+Fe2O3
高温
.
2Fe+3CO2
160112
(1-20%)x63t×96%×[10/9]
[160
(1-20%)x=
112
63t×96%×
10/9]
解得x=120t,
故选A.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 运用质量守恒定律的思想处理问题;学会计算化合物、混合物中某元素的质量的方法;掌握根据化学方程式计算的步骤、方法.1年前查看全部
- 物质A是一种重要的化工原料,主要由石油炼制得到.在一定条件下,A和B能发生化学反应生成C和D,下图是该反应的微观示意图,
物质A是一种重要的化工原料,主要由石油炼制得到.在一定条件下,A和B能发生化学反应生成C和D,下图是该反应的微观示意图,其中不同的“球”代表不同的原子.请回答下列问题:

(1)1个C分子中含______个原子.
(2)D物质的化学式为______,D物质由______构成.
(3)4种物质中,属于单质的是______(填图中字母).
(4)下列说法正确的是______.
A.反应前后,分子种类没有发生变化
B.反应前后,原子的种类、数目不变
C.A物质中一定含碳、氢元素,可能含氧元素
D.该反应的基本类型为置换反应
(5)若把一定质量的纯净物A和24 g的纯净物B在-定条件下发生如上反应,当B物质完全反应时,可生成22g C物质和9g D物质.则:若A的相对原子质量为28,请写出该反应的化学方程式C2H4+3O2
2CO2+2H2O点燃 .C2H4+3O2.
2CO2+2H2O点燃 . 长久成功1年前1
长久成功1年前1 -
 jacklee3063 共回答了16个问题
jacklee3063 共回答了16个问题 |采纳率87.5%解题思路:从各粒子的模型图可以看出该粒子的构成并能写出化学式,可解决(1)(2)题;(3)从粒子的原子构成能判断物质的种类,根据质量守恒定律的实质和应用来解答(4)题.(5)根据质量守恒定律和A物质的相对分子质量,可推出A的化学式,进而可写出化学方程式.(1)从C分子的模型图看出,1个C分子中含 3个原子,一个碳原子和两个氧原子,故C是二氧化碳.
(2)D物质由一个氧原子和两个氢原子构成,是水的结构,化学式为 H2O,水是由分子(或水分子)构成的;
(3)单质是由同种元素组成的纯净物,在这4种物质中,因为B的分子只含1种原子.所以属于单质,而其它物质的分子均是由不同的原子构成,所以是化合物的分子;
(4)A在化学反应中分子可分原子不可分,B反应前后原子的种类,质量、数目都不变,C元素的种类也不变,反应后有碳、氢、氧元素,反应物中也必须有这三种元素.D因为生成物都是化合物,故此反应不是置换反应.
(5)若A的相对分子质量为28,根据质量守恒定律推断因为A中一定含有碳氢元素,由碳(12)氢(1)氧(16)的相对原子质量可推断A中不含氧元素,因为一个碳原子和一个氧原子的相对原子质量的和就是28,就不能含有氢原子了,故A中不含氧元素,A由碳氢元素组成,其相对分子质量是28,则A的化学式只能是C2H4,由此可写出反应的化学方程式,注意配平和条件.
故答案为:(1)3.
(2)H2O.分子(或水分子)
(3)B.
(4)B、C
(5)C2H4+3O2
点燃
.
2CO2+2H2O点评:
本题考点: 微粒观点及模型图的应用;单质和化合物的判别;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题从对模型图的理解,质量守恒定律的应用和化学方程式的书写等方面进行了考查,能通过图示的模型判断出物质的种类,属于单质还是化合物,是解决此类题目的关键.1年前查看全部
- 石油化工中炼制方法中什么是物理方法什么是化学方法,急,求答案,谢谢您
 feng41241年前1
feng41241年前1 -
 爱上你我怕了 共回答了16个问题
爱上你我怕了 共回答了16个问题 |采纳率75%从石油中分出汽油,柴油,等这个是根据各种油类沸点不同,来分离的,是物理变化
还有就是石油裂解,这个是化学变化,可以百度搜一下,石油裂解1年前查看全部
- “予独爱炼制出淤泥而不染,濯清涟而不妖"为什么能成为名句啊!
 初冬231年前3
初冬231年前3 -
 来自三亚的鱼 共回答了14个问题
来自三亚的鱼 共回答了14个问题 |采纳率92.9%“出淤泥而不染,濯清涟而不妖”的意思是:莲花从污泥中长出来,却不受到污染,在清水里洗涤过但是不显得妖媚.
这句话写出了莲花身处污泥之中,却纤尘不染,不随世俗、洁身自爱和天真自然不显媚态的可贵精神,通过对莲的形象和品质的描写,歌颂了莲花坚贞的品格,从而也表现了作者洁身自爱的高洁人格和洒落的胸襟.1年前查看全部
- 工业炼制镁的反应,好像有两种方法.
 sxsh1年前1
sxsh1年前1 -
 薯仔曲奇 共回答了25个问题
薯仔曲奇 共回答了25个问题 |采纳率84%MgCl2==通电==Mg+Cl2↑ 1)CaCO3(贝壳的主要成分)==高温煅烧==CaO+CO2
2)CaO+H2O====Ca(OH)2
3)MgCl2(海水中的混合物)+Ca(OH)2====Mg(OH)2↓+CaCl2
4)Mg(OH)2+2HCl====MgCl2+2H2O1年前查看全部
- 200t含80%氧化铁的赤铁矿石最多能炼制出含杂质2%的生铁多少吨?
 qingtaie1年前2
qingtaie1年前2 -
 云的眼泪0306 共回答了17个问题
云的眼泪0306 共回答了17个问题 |采纳率94.1%设炼制出含杂质2%的生铁质量为x.
Fe2O3+3CO=2Fe+3CO2
160 112
200t*80% x/(1-2%)
160 112
分数线 === 分数线
200t*80% x/(1-2%)
x=114.29t
答:最多能炼制出含杂质2%的生铁114.29吨.1年前查看全部
- 50克精铁矿石可炼铁32克,照这样计算,要炼制纯铁128吨,需这种精铁石多少吨?
 狐狸和跑1年前1
狐狸和跑1年前1 -
 三瓶枪手 共回答了18个问题
三瓶枪手 共回答了18个问题 |采纳率100%设需要这种精铁石X吨.
50:32=X:128
32X=128*50
X=200
答:要这种精铁石200吨.1年前查看全部
- 石油炼制可以得到汽油煤油等成分,这是根据组成石油的各物质的什么性质不同
石油炼制可以得到汽油煤油等成分,这是根据组成石油的各物质的什么性质不同
A密度不同 B熔点不同 C溶解性不同 D沸点不同 潘帕斯之舞1年前2
潘帕斯之舞1年前2 -
 cocochen23 共回答了20个问题
cocochen23 共回答了20个问题 |采纳率95%D正确
汽油、煤油、柴油的区别在于成分中碳原子个数不同,所以沸点不同.所以通常使用分馏的方法来分离石油.1年前查看全部
- (2005•广东)汽油是石油炼制产品之一,是汽车的主要燃料.请回答:
(2005•广东)汽油是石油炼制产品之一,是汽车的主要燃料.请回答:
①汽油充分燃烧的产物是二氧化碳和水,由此可推断汽油的组成元素一定含有______元素.
②以汽油为燃料的汽车尾气中含有一氧化碳、氮的氧化物等大气污染物.目前,减少汽车尾气污染的措施之一,是在汽油中加入适量的乙醇.乙醇完全燃烧的化学方程式为:C2H5OH+3O2
2CO2+3H2O点燃 .C2H5OH+3O2.
2CO2+3H2O点燃 .
③下列能替代汽油的燃料中,燃烧产物最清洁的是______(填编号)
A.天然气;B.乙醇;C.氢气. brave0061年前1
brave0061年前1 -
 魂归梦想 共回答了12个问题
魂归梦想 共回答了12个问题 |采纳率100%解题思路:根据反应物和生成物可以判断物质的元素组成;根据反应物和生成物及其质量守恒定律可以书写化学方程式;氢气燃烧的生成物只有水,不污染环境.(1)反应前后元素的种类不变,生成物二氧化碳和水中的碳元素和氢元素来自汽油.故填:碳和氢.
(2)乙醇完全燃烧的化学方程式为:C2H5OH+3O2
点燃
.
2CO2+3H2O.
(3)天然气和乙醇燃烧都能生成二氧化碳,二氧化碳能够导致温室效应,氢气燃烧的生成物只有水,不污染环境.故填:C.点评:
本题考点: 常用燃料的使用与其对环境的影响;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要掌握质量守恒定律和节能环保等方面的内容,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- (2010•房山区一模)物质A是一种重要的化工原料,主要由石油炼制得到.在一定条件下,A和B能发生化学反应生成C和D,下
(2010•房山区一模)物质A是一种重要的化工原料,主要由石油炼制得到.在一定条件下,A和B能发生化学反应生成C和D,下图是该反应的微观示意图,其中不同的“球”代表不同的原子.请回答下列问题:

(1)1个C分子中含______个原子.
(2)D物质的化学式为______.
(3)4种物质中,属于单质的是______(填图中字母).
(4)下列说法正确的是______.
A.反应前后,分子种类没有发生变化
B.反应前后,原子的种类、数目不变
C.A物质中一定含碳、氢元素,可能含氧元素
D.该反应的基本类型为置换反应
(5)物质完全反应时,可生成22gC物质和9gD物质.则:若A的相对原子质量为28,请写出该反应的化学方程式C2H4+3O2
2CO2+2H2O点燃 .C2H4+3O2.
2CO2+2H2O点燃 . 风风晓晓1年前1
风风晓晓1年前1 -
 gg1982726 共回答了16个问题
gg1982726 共回答了16个问题 |采纳率93.8%(1)从C分子的模型图看出,1个C分子中含 3个原子,一个碳原子和两个氧原子,故C是二氧化碳.
(2)D物质由一个氧原子和两个氢原子构成,是水的结构,化学式为 H2O.
(3)单质是由同种元素组成的纯净物,在这4种物质中,属于单质的是 B,由氧原子构成,是氧气.
(4)A在化学反应中分子可分原子不可分,B反应前后原子的种类,质量、数目都不变,C元素的种类也不变,反应后有碳、氢、氧元素,反应物中也必须有这三种元素.D因为生成物都是化合物,故此反应不是置换反应.故答案BC.
(5)若A的相对分子质量为28,根据质量守恒定律推断因为A中一定含有碳氢元素,由碳(12)氢(1)氧(16)的相对原子质量可推断A中不含氧元素,因为一个碳原子和一个氧原子的相对原子质量的和就是28,就不能含有氢原子了,故A中不含氧元素,A由碳氢元素组成,其相对分子质量是28,则A的化学式只能是C2H4,由此可写出反应的化学方程式,注意配平和条件.
故答案为:(1)3.
(2)H2O.
(3)B.
(4)B、C
(5)C2H4+3O2
点燃
.
2CO2+2H2O1年前查看全部
- (3)石油炼制的产品之一是汽油.若汽油中的某分子X(相对分子质量为112)由碳、氢两元素组成,氢的质量分数为14.3%,
(3)石油炼制的产品之一是汽油.若汽油中的某分子X(相对分子质量为112)由碳、氢两元素组成,氢的质量分数为14.3%,写出X完全燃烧的化学方程式
 An_Act_of_God1年前1
An_Act_of_God1年前1 -
 singapore2006 共回答了17个问题
singapore2006 共回答了17个问题 |采纳率94.1%112*0.143=16
(112-16)/12=8
X分子式为C8H16
C8H16+12O2=8CO2+8H2O1年前查看全部
- 什么是石油炼制
 羽毛飘飘飞1年前1
羽毛飘飘飞1年前1 -
 六泡茶 共回答了21个问题
六泡茶 共回答了21个问题 |采纳率81%石油是十分复杂的烃类及非烃类化合物的混合物,组成是有的化合物的相对分子质量从几十到几千,相应的沸点从常温到500摄氏度以上,其分子结构也是多种多样的.因此,石油不能直接作为产品使用,必须经过各种加工过程,炼制成多种质量上符合使用要求的石油产品.石油产品种类繁多,包括燃料、润滑油、有机化工原料、沥青、蜡、石油焦等.1年前查看全部
- 有机化学-石油炼制,乙烯 (28 20:30:43)
有机化学-石油炼制,乙烯 (28 20:30:43)
将15g的CH4和C2H4的混合气体通入盛有足量的溴水容器中,溴水质量增加了7g,则混合气体中CH4与C2H4的体积比为()
A. 3:2
B. 2:3
C. 3:4
D. 4:3 WinMi1年前4
WinMi1年前4 -
 寻找灵魂的猫 共回答了18个问题
寻找灵魂的猫 共回答了18个问题 |采纳率88.9%甲烷与溴水不反应,而乙烯能够与溴水反应,所以题中溴水质量增加了7g,那么根据质量守恒定律,这个增重的质量就是乙烯的质量,所以:
质量比:m甲烷:m乙烯=8:7
摩尔比:n甲烷:n乙烯=8/16:7/28
标准状况下,摩尔比等于体积比,所以应该是2:11年前查看全部
- 某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁.若要炼制含铁98%的生铁1120t,则理论上需要含
某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁.若要炼制含铁98%的生铁1120t,则理论上需要含杂质20%的赤铁矿石的质量( )
A.1960t
B.2000t
C.1980t
D.1370t 偶太有才啦161年前1
偶太有才啦161年前1 -
 雪莲花开520 共回答了18个问题
雪莲花开520 共回答了18个问题 |采纳率88.9%解题思路:由已知“含铁98%的生铁1120t”,可计算铁的质量;由铁的质量根据化学方程式可求氧化铁的质量,最后可求含杂质20%赤铁矿石的质量.含铁98%的生铁1120t中铁的质量为:1120t×98%=1097.6t.
设需要含杂质20%的赤铁矿石的质量为x,
3CO+Fe2O3
高温
.
2Fe+3CO2
160112
(1-20%)x1097.6t
[160
(1−20%)x=
112/1097.6t]
解得x=1960t
故选A.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 运用质量守恒定律的思想处理问题;学会计算化合物、混合物中某元素的质量的方法;掌握根据化学方程式计算的步骤、方法.1年前查看全部
- 石油可以经过__炼制出汽油和柴油
 某日资软件1年前1
某日资软件1年前1 -
 tw7215 共回答了26个问题
tw7215 共回答了26个问题 |采纳率92.3%石油可以经过常压分馏炼制出汽油和柴油1年前查看全部
- 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________、__________. 品牌小戴1年前0
品牌小戴1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•浦东新区三模)如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸
(2013•浦东新区三模)如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )

A.吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B.电解过程中的阳极反应主要为:2Cl--2e-=Cl2↑
C.该工艺流程体现绿色化学思想
D.实验室可用点燃充分燃烧的方法消除H2S污染 jiaoming1年前1
jiaoming1年前1 -
 cjia7 共回答了14个问题
cjia7 共回答了14个问题 |采纳率85.7%解题思路:A、根据Fe3+的氧化性和H2S的还原性,再根据离子方程式正误的判断;
B、根据溶液中离子的还原性强弱判断;
C、根据H2S最终的产物判断;
D、根据H2S充分燃烧的产物判断.A、由图中的流程图可知,FeCl3与H2S反应生成S和Fe2+,离子方程式正确,得失电子数是守恒的,故A正确;
B、电解的是氯化亚铁和盐酸溶液,阳极发生的应该是氧化反应,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-(或根据图示循环),电解时阳极反应式为Fe2+-e-═Fe3+,故B错误;
C、该过程中吸收的H2S最后转化为H2和S,因此体现绿色化学,故C正确;
D、由于H2S充分燃烧的化学方程式为2H2S+3O2═2SO2+2H2O,生成的SO2也是一种有毒气体,故D错误.
故选:A、C点评:
本题考点: 硫化氢;电解原理;常见的生活环境的污染及治理.
考点点评: 本题考查的知识点较多,离子方程式正误判断,电极反应式的书写,H2S的化学性质,试题的综合性较强.1年前查看全部
- 某钢铁厂日产含杂质2%的生铁1600t,则需要含氧化铁80%的赤铁矿多少吨(已知在炼制过程中损失铁元素20%)
 泪无痕19831年前1
泪无痕19831年前1 -
 dfdfgdf 共回答了18个问题
dfdfgdf 共回答了18个问题 |采纳率88.9%Fe2O3+3CO=加热=2Fe+3CO2
160 112
x*80%*(1-20%) 1600t*(1-2%)
x=3500t1年前查看全部
- 可用于铁的炼制的有毒气体是什么?本人超急!
 lueming1年前1
lueming1年前1 -
 yuyong8472547 共回答了21个问题
yuyong8472547 共回答了21个问题 |采纳率76.2%一般铁的冶炼按中学课本而言,是利用焦炭,通入大量空气产生CO来高温还原铁矿石的.1年前查看全部
- 石油的炼制 要付具体理由 .物质的量相同的下列有机物,充分燃烧耗氧量最大的是 A.C2H4 B.C2H2 C.C3H8
石油的炼制 要付具体理由
.物质的量相同的下列有机物,充分燃烧耗氧量最大的是
A.C2H4 B.C2H2 C.C3H8 D.C4H8
相同条件下,相同质量的乙烯和CO具有相同的 ①分子数 ② 体积 ③ 密度 ④ 原子数
A.①② B.①②③ C.①②③④ D.以上都不相同
用来鉴别CH4和C2H4,又可除去CH4中混有C2H4的方法是
A.通入酸性KMnO4溶液中 B.通入足量的溴水中
C.点燃 D.能入H2后加热
在1.01×105Pa、120℃的条件下,某有机气体完全燃烧后恢复至原来的温度和压强,前后气体体积不发生变化,则该有机物可能是
A.C3H8x05B.C2H4 x05x05C.C3H6 x05x05D.C2H2
1mol C2H4与Cl2完全加成,再与Cl2彻底取代,两过程共用Cl2
A.2 mol x05x05B.4mol x05x05C.5molx05x05 D.6mol
标准状况下,0.56 L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28g (假设C2H4完全被吸收),则乙烯占混合气体体积的
A.20% x05x05 B.40% x05x05 C.60%x05x05 D.80%
能说明某烃分子里含有碳碳不饱和键的叙述中正确的是
A.分子组成中含碳氢原子数比为1:2
B.完成燃烧生产等物质的量的CO2和H2O
C.能与溴加成反应而使溴水褪色,还能使KMnO4酸性溶液褪色
D.空气中燃烧能产生黑烟
19.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水.下列说法正确的是
A.混合气体一定有甲烷 B.混合气体中一定是甲烷和乙烯
C.混合气体中一定没有乙烷 D.混合气体中一定有乙烯 乖乖柔儿1年前1
乖乖柔儿1年前1 -
 湘江上游 共回答了19个问题
湘江上游 共回答了19个问题 |采纳率84.2%1、
选D
烃的燃烧通式CxHy+(x+y/4)O2 →xCO2+(y/2)H2O
含C,H越多,耗氧越多
2、
选B
C2H4,CO2分子量均为28
分子量之比=密度之比 ③对
设两者均有28g(1mol)
即都是1mol分子 根据气体摩尔知体积也等
乙烯6个原子 故有6mol原子 CO2有3个原子 故有3mol原子 不等
3、
选B
乙烯含碳碳双键,能使溴水褪色,甲烷不能
即加入溴水能把乙烯反应掉,将其除去
A不能选,因为酸性KMnO4会将乙烯氧化成CO2 有新杂质
4、
选B
A C3H8+5O2=3CO2+4H20 B C2H4+3O2=2CO2+2H2O C 2C3H6+9O2=6CO2+6H2O
D 2C2H2+5O2=4CO2+2H2O
生成的H2O均是水蒸气,题目说“反应前后气体体积不变” ,即方程式等号左右两边气体的系数相同, 只有B左右两边都是4
5、
选C
加成时,碳碳双键打开后各连一CL原子,耗掉1molCL生成CH4CL2
每取代一个氢要消耗两个CL原子(另一个与H反应生成HCL) 有4个氢,需耗掉4molCL
合起来5mol
6、
选B
乙烯与溴水反应生成CH4Br2, 与甲烷不反应
溴水增重0.28g 而乙烯的分子量28g, 即吸收了0.01mol乙烯
1mol乙烯22.4L,0.01mol有0.224L
故0.224÷0.56=0.4
7、
选C
不饱和键即碳碳双键, 而碳碳双键特点是能使指示剂(如酸KMnO4溶液,溴水等)褪色 C对
AB只说明是CnH2n 结构 D只说明含碳量高
8、
选A,C
设两烃平均分子式为CxHy 3.6g水为0.2mol
由CxHy+(x+y/4)O2---xCO2 +(y/2)H2O有
1/0.1=x/0.16 得x=1.6
1/0.1=(y/2)/0.2 得y=4 即平均式为C1.6H4
即两种烃中碳原子一种要大于1.6,另一种要小于1.6 同理H也分别大于和小于4
故一定有CH4,A对.
烃要是气态,碳原子≤4 乙烷有6个碳原子,一定没有 C对1年前查看全部
- 下列几组情况:①煤的燃烧;②石油的炼制;③汽车排放的尾气;④大量使用化肥农药;⑤氢气在空气中燃烧.其中不会造成环境污染的
下列几组情况:①煤的燃烧;②石油的炼制;③汽车排放的尾气;④大量使用化肥农药;⑤氢气在空气中燃烧.其中不会造成环境污染的是( )
A.①②
B.③④
C.①②③④
D.⑤ 烟波小鱼19841年前1
烟波小鱼19841年前1 -
 qz53n 共回答了19个问题
qz53n 共回答了19个问题 |采纳率94.7%解题思路:粉尘与有害气体是造成空气污染的主要原因,其中有害气体包括一氧化碳、二氧化硫及二氧化氮等氮的氧化物.①煤燃烧产生烟,造成粉尘污染,生成的二氧化硫也会造成污染;
②石油的炼制会产生大量的空气污染物;
③汽车排放的尾气中的一氧化碳、氮的氧化物等造成有害气体污染;
④大量使用化肥农药,会造成水体和土壤的污染;
⑤氢气在空气中燃烧,生成物只有水,不会造成污染.
故选:D.点评:
本题考点: 空气的污染及其危害.
考点点评: 正确认识造成空气污染的主要原因--粉尘和有害气体,对于判断有关空气污染类问题来说是根本.1年前查看全部
- K,Ca,Na,Mg,Al用什么方法炼制?Zn,Fe,Sn,Pb,Cu呢?Hg,Ag,Pt,Au呢?
 feiming181年前1
feiming181年前1 -
 lvshizi88 共回答了20个问题
lvshizi88 共回答了20个问题 |采纳率90%电解熔融离子化合物
铝热法(热还原法)
热分解法,富集、浮选法1年前查看全部
- 在下列石油的炼制和加工过程中,属于化学变化的是( )
在下列石油的炼制和加工过程中,属于化学变化的是( )
A常压分馏
B减压分馏
C劣化
D裂解 xx2206001年前1
xx2206001年前1 -
 l161616 共回答了20个问题
l161616 共回答了20个问题 |采纳率100%C劣化
D裂解
这两个都属于化变.1年前查看全部
- 1.用含四氧化三铁80%的磁铁矿石2900吨可以炼制含杂质2.5%的生铁多少吨?
1.用含四氧化三铁80%的磁铁矿石2900吨可以炼制含杂质2.5%的生铁多少吨?
2.用这些生铁与稀硫酸反应,最多制得硫酸亚铁多少吨? plm14725801年前1
plm14725801年前1 -
 大天使88 共回答了13个问题
大天使88 共回答了13个问题 |采纳率92.3%四氧化三铁中铁的质量分数:(3×56)/(3×56+4×16)≈72.4%
铁的质量:2900×80%×72.4%=1680t
生铁的质量:1680÷(1-2.5%)≈1723t
①答:可以炼制含杂质2.5%的生铁1723吨
设制得硫酸亚铁X吨
Fe+H2SO4=FeSO4+H2↑
56 152
1680t X
56/1680=152/X
X=4560t
②答: 最多制得硫酸亚铁4560吨1年前查看全部
- 某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁.若要炼制
某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁.若要炼制
为什么是 63t*96%/(1-10%) 不是63t*96%*(1-10%) 硕士博士烈士1年前1
硕士博士烈士1年前1 -
 mcool 共回答了31个问题
mcool 共回答了31个问题 |采纳率93.5%纯-------->不纯
越变越多(只有除以小于1的数才能实现)
不纯-------->纯
越变越少(只有乘以小于1的数才能实现)
你的题目里,损失了10%的铁,所以应多炼些铁,要想越变越多(只有除以小于1的数才能实现)1年前查看全部
- 一种青铜,含铜88份,锡10份,锌2份.要炼制青铜500t,需要铜,锡,锌各多少吨?
 ronaldinho_821年前3
ronaldinho_821年前3 -
 wulaihuo 共回答了25个问题
wulaihuo 共回答了25个问题 |采纳率92%88+10+2=100
铜:500×(88÷100)=440(吨)
锡:500×(10÷100)=50(吨)
锌:500×(2÷100)=10(吨)
答:需要铜440吨,锡50吨,锌10吨.1年前查看全部
- 属于化学变化的是?用石墨制金刚石;用CO2制干冰;用石油炼制汽油;用浓硫酸配制稀硫酸.是什么?
 wangh0071年前1
wangh0071年前1 -
 fmoats 共回答了19个问题
fmoats 共回答了19个问题 |采纳率94.7%用石墨制金刚石是化学变化.虽然都是由碳元素构成,但结构和性质发生很大变化.
CO2制干冰只是物态变化;
用石油炼制汽油是蒸馏提纯;
用浓硫酸配制稀硫酸是改变浓度.1年前查看全部
- 铝在高温时有很强的-------(填空),可以用来炼制高熔点的金属.
铝在高温时有很强的-------(填空),可以用来炼制高熔点的金属.
要正确的! 鱼10221年前2
鱼10221年前2 -
 子夜冰河 共回答了18个问题
子夜冰河 共回答了18个问题 |采纳率83.3%还原性1年前查看全部
- 用含杂质20%的赤铁矿2000t炼铁,在炼制过程中损失率为5%,试计算最多可以练出含杂质3%的生铁多少吨?
 stellandrea1年前1
stellandrea1年前1 -
 准备干了 共回答了17个问题
准备干了 共回答了17个问题 |采纳率82.4%含杂质20%的赤铁矿2000t含Fe2O3是2000*(1-20%)=1600t
中间损失率为5%,不损失的是1600*(1-5%)=1520t
设最多可以练出含杂质3%的生铁的质量为x.
Fe2O3+3CO=高温=2Fe+3CO2
160 112
1520t (1-3%)x
160/1520=112/97%x
x=1097t
答:最多可以练出含杂质3%的生铁1097t.1年前查看全部
- 理论上炼制3.2千克铜,需要含杂质37%的铁多、少千克?
理论上炼制3.2千克铜,需要含杂质37%的铁多、少千克?
铁与硫酸铜反应 langrende1年前2
langrende1年前2 -
 三雷 共回答了16个问题
三雷 共回答了16个问题 |采纳率93.8%设需要Fe的质量为X
Fe+CuSO4=Cu+FeSO4
56 64
X 3.2
56:X=64:3.2
X=2.8千克
2.8/(1-37%)=4.4(千克)1年前查看全部
- 如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )
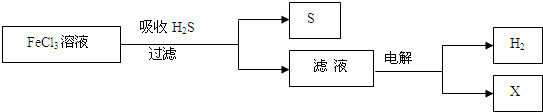
A.吸收H2S的离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+
B.电解过程中的阳极反应主要为:2Cl--2e-═Cl2↑
C.电解产物X在该工艺流程中可循环利用
D.实验室可用点燃充分燃烧的方法消除H2S污染 gexin537701年前1
gexin537701年前1 -
 想不到好名咋办 共回答了19个问题
想不到好名咋办 共回答了19个问题 |采纳率89.5%解题思路:A.根据Fe3+的氧化性和H2S的还原性,再根据离子方程式正误的判断;
B.根据溶液中离子的还原性强弱判断;
C.根据阳极反应Fe2+-e-═Fe3+进行判断;
D.根据H2S充分燃烧的产物的性质进行判断;A.由图中的流程图可知,FeCl3与H2S反应,FeCl3中+3价的铁具有氧化性,H2S中-2价的硫具有还原性,所以两者反应生成S和Fe2+,书写离子方程式时,硫化氢是气体,水是弱电解质写化学式,得失电子数守恒,所以离子方程式正确,故A正确;
B.电解的是氯化亚铁和盐酸溶液,阳极发生的应该是氧化反应,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-,电解时阳极反应式为Fe2+-e-═Fe3+,故B错误;
C.该流程图中过程中电解的是氯化亚铁和盐酸溶液,电解时阳极反应式为Fe2+-e-═Fe3+,所以X为FeCl3,可回收与H2S反应,所以电解产物X在该工艺流程中可循环利用,故C正确;
D.由于H2S充分燃烧的化学方程式为2H2S+3O2
点燃
.
2SO2+2H2O,生成的SO2也是一种有毒气体,故D错误;
故选:A、C.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;电解原理.
考点点评: 本题主要考查离子方程式正误判断,电极反应式的书写,H2S的化学性质等知识点,读懂流程图熟练运用氧化还原反应是解答的关键,题目难度不大.1年前查看全部
- 原油产生的 废气石油炼制的过程中原油 产生的 废气 有哪些?
 一叶枫红1年前1
一叶枫红1年前1 -
 kaloncn 共回答了19个问题
kaloncn 共回答了19个问题 |采纳率84.2%(1)石油炼制的过程中原油产生的废气--- CH4,C2H6,C3H8,C4H10 !
(2)液化石油气!1年前查看全部
- 急求古人炼制金属的先后顺序和名称
急求古人炼制金属的先后顺序和名称
我好像就记了个“湿法炼铜” 早晨阳光明媚1年前4
早晨阳光明媚1年前4 -
 yinseen 共回答了13个问题
yinseen 共回答了13个问题 |采纳率100%不可能是按金属活动性顺序表从后往前的顺序,我们有一次考试曾经考过,涉及过这个内容.炼钢是战国时期.湿法炼铜是西汉后期.春秋进入铁器时代.这个比较可信.不过我认为铜比较早,因为它容易保存,在氧气中可以与氧气发生化学反应,从而表面生成一层致密的薄膜,防止铜与氧气继续反应.1年前查看全部
- 一块长方体钢锭长8分米,宽6分米,把它炼制成底面积是12平方米的长方体,高是多少?
一块长方体钢锭长8分米,宽6分米,把它炼制成底面积是12平方米的长方体,高是多少?
分步解 抿aa棉裤1年前4
抿aa棉裤1年前4 -
 sztolieni 共回答了26个问题
sztolieni 共回答了26个问题 |采纳率100%该物品的体积是不变的
首先要换算好数量单位
8分米=0.8米 6分米=0.6米 3分米=0.3米
再算体积
长方体体积 = 长×宽×高 或者 底面积×高
0.8×0.6×0.3 = 0.144 立方米
利用体积不变的原理
体积÷底面积 = 高
0.144÷12 = 0.012 米
所以可以答了 高是0.012米1年前查看全部
- 某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96% 的生铁63 t ,假设在炼制过
某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96% 的生铁63 t ,假设在炼制过程中损失10% 铁元素,则理论上需要含杂质20% 的赤铁矿石的质量是 [ ]A. 120 t
B. 108 t
C. 96 t
D. 84 t HJY20021年前1
HJY20021年前1 -
 未激活276 共回答了22个问题
未激活276 共回答了22个问题 |采纳率90.9%A1年前查看全部
- 如图是某研究小组采用电解法处理石油炼制过程中产生的大量H 2 S废气的工艺流程.该方法对H 2 S的吸收率达99%以上,
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H 2 S废气的工艺流程.该方法对H 2 S的吸收率达99%以上,并可制取H 2 和S.下列说法正确的是( ) 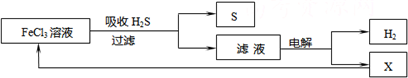
A.吸收H 2 S的离子方程式为:2Fe 3+ +H 2 S=2Fe 2+ +S↓+2H + B.电解过程中的阳极反应主要为:2Cl - -2e - =Cl 2 ↑ C.该工艺流程体现绿色化学思想 D.实验室可用点燃充分燃烧的方法消除H 2 S污染  vncldd01年前1
vncldd01年前1 -
 sunkiss83 共回答了30个问题
sunkiss83 共回答了30个问题 |采纳率100%A、由图中的流程图可知,FeCl 3 与H 2 S反应生成S和Fe 2+ ,离子方程式正确,得失电子数是守恒的,故A正确; B、电解的是氯化亚铁和盐酸溶液,阳极发生的应该是氧化反应,所得滤液中含有Fe 2+...1年前查看全部
- 石油炼制的过程是物理变化还是化学变化?
 sky_1101年前6
sky_1101年前6 -
 月明219 共回答了19个问题
月明219 共回答了19个问题 |采纳率94.7%既有化学变化,又有物理变化
工业上利用石油中各成分的不同沸点范围,通过常压分馏和减压分馏将石油的各
个成分分离出来.因为该过程没有生成任何新物质,所以属物理变化.
石油的裂化是为了获得轻质油,而采取的方法,它是在一定条件下,将相对分子
质量较大,沸点较高的烃分解为相对分子质量较小、沸点较低的烃.因为涉及化学键的断裂,所以是化学变化.
石油的裂解则是石油裂化的进一步,即深度裂化.
煤的汽化、液化、干馏均是复杂的化学反应过程.
在初中化学中,归纳为化学变化应该也算合理1年前查看全部
- 若炼制1000t百分之93.3纯度的铁,至少需要含氧化铁80百分之的赤铁矿多少吨
 一片风景1年前1
一片风景1年前1 -
 森林里的画展 共回答了19个问题
森林里的画展 共回答了19个问题 |采纳率84.2%FE2O3+3co=3co2+ 2fe
160 112
X=1332.85T 1000T*93.3%=933T
1332.85T/80%=1666.1T1年前查看全部
大家在问
- 1没下雨的时候买伞 以备后用的一个成语是啥
- 2形容宝石花颜色的四字词语
- 3(填上学过的诗句、谚语或俗语)我看见平时忙忙碌碌的陈师傅正悠闲地坐在小河边喝茶,真是”()”
- 4已知ae=ac++ad等于ab++则角d等于∠b吗
- 5GPS中两点坐标反算距离和全站仪实测距离相差较大,是什么原因造成的、
- 6请简要概括作者描写的生命现象,并说说作者对此产生的敬畏之情的原因
- 7Wu Peng won the girls______ race in the school sports meetin
- 8阅读下文,回答问题。诗圣与文士性格的塑造 王学泰宋代学者称杜甫为“圣于诗者”,这主要是指杜甫在诗歌史上地位
- 9kx2+kx+1>0,求k的取值范围.
- 10一面国旗上一个桃心里一个家字什么成语
- 11英语中怎么分辨副词和形容词比如说,什么价ly,less
- 12丑小鸭读后感150字马上啊
- 13以责任为话题的作文题目,只要作文题目
- 14没有期待就没有失望翻译成英语
- 15抛物线方程设抛物线的顶点在原点,焦点F在y轴上,抛物线上的点(k,-2)与F的距离为4,则k的值为?
