化学反应平衡正向移动 是什么东东??
 明媚妖娆2022-10-04 11:39:541条回答
明媚妖娆2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 abc2925218 共回答了1个问题
abc2925218 共回答了1个问题 |采纳率- 从左往右
- 1年前
相关推荐
- 在恒温恒容的容器中,有一个已经平衡的反应(如二氧化硫加氧气生成三氧化硫),向容器中加入惰性气体,问化学反应平衡是否移动.
在恒温恒容的容器中,有一个已经平衡的反应(如二氧化硫加氧气生成三氧化硫),向容器中加入惰性气体,问化学反应平衡是否移动.
我从两个方面想了这个问题,从浓度的角度,二氧化硫的物质的量不变,容器容积不变,因此平衡不移动
但是从另一个角度,即从压强的角度,容器中的压强变大,平衡应该移动
这是矛盾的,我找不出问题,请高手帮忙,谢谢 每个ww都有故事1年前4
每个ww都有故事1年前4 -
 盯盯 共回答了24个问题
盯盯 共回答了24个问题 |采纳率95.8%“但是从另一个角度,即从压强的角度,容器中的压强变大,平衡应该移动”
楼主,这句话是错误的.压强变大仅仅指同时同倍改变所有物质的浓度.压强的变化归根结底是浓度的变化.此时压强变化未引起浓度变化,所以如此.
建议楼主从反应的碰撞理论来理解.1年前查看全部
- 判断化学反应平衡A(g)+3B(g)=(可逆)2C(g)密闭容器中,以下是否正确:1.生成和分解C的速率相同2.容器内气
判断化学反应平衡
A(g)+3B(g)=(可逆)2C(g)
密闭容器中,以下是否正确:
1.生成和分解C的速率相同
2.容器内气体的密度不随时间改变而改变.
三楼。。该专家不合格 借海一月醉1年前4
借海一月醉1年前4 -
 乡女无情 共回答了13个问题
乡女无情 共回答了13个问题 |采纳率100%1可以,某物质生成速率和分解速率相等,是判断反应是否平衡的一个标准.
2不可以,应为反应是质量守恒的,且这个反应的两边都是气体.因此,气体的质量是不会变的.而气体的密度是=气体的质量/气体的体积,容器是密闭的,如果这个容器体积不变的话,那么,不论是否达到平衡,气体的密度都是不会改变的.1年前查看全部
- 化学反应平衡移动,是指在这一阶段化学反应不再平衡吗?那么移动后是怎么又建立新的平衡的?
化学反应平衡移动,是指在这一阶段化学反应不再平衡吗?那么移动后是怎么又建立新的平衡的?
新的平衡与原来的平衡有差吗?求高手举例分析,不甚了解的就不要误人子弟了. sanno1年前2
sanno1年前2 -
 wy750329 共回答了13个问题
wy750329 共回答了13个问题 |采纳率92.3%平衡移动动就是正逆反应速率不在相等,哪个反应速率大,平衡就向哪个方向移动.比如硫与氧气生成二氧化硫中,达到平衡后加入硫,正反应物浓度增加,正反应速率瞬间加大,后渐小.逆反应速率瞬间不变,后逐渐增大.但正反应速率始终大于逆反应速率.平衡就向正向移动,直至正逆反应速率相等,达到新的平衡.同时,因为正逆反应速率始终比原平衡大,所以新平衡的正逆反应速率虽相等,但也比原平衡的速率都要大.1年前查看全部
- 化学反应平衡转化率假设可逆反应 A+B=C+D 增加 C的物质的量 其他条件不改变 那么A B C D 的转化率变化是怎
化学反应平衡转化率
假设可逆反应 A+B=C+D 增加 C的物质的量 其他条件不改变 那么A B C D 的转化率变化是怎么样的
就像纯水的电离 加入氢氧化钠 氢氧根离子浓度增加 反应左移动 那平衡后水电离出的氢离子浓度和氢氧根浓度还相等吗 做题目的时候都说反应后[H]水=[OH]水呢 麻烦再说明下 阿泡哥1年前2
阿泡哥1年前2 -
 ye_john 共回答了19个问题
ye_john 共回答了19个问题 |采纳率94.7%有多种情况.
我们首先考虑全是气体的情况.
1.若C+D的化学计量数之和大于A+B,且容器体积不变:
这种情况下,加入C就相当于增大了压强,又因为这个反应随着压强的增大而向正向推进,所以A B转化率增大 C D转化率减小.
2.若C+D的化学计量数之和大于A+B,且压强不变.
则冲入哪种物质都不会影响转化率.
A+B小于C+D的情况与上述相同,在这里不予以重复解释~
再考虑有固体的情况.
无论是哪方有固体物质,都排除掉,单纯看左右两边气体物质化学计量数之和得比.比例详情也和上述一样了~
如果都是固体的话~加入C是什么都不影响的-w-~、
你补充的问题~是这样的~
水的化学式是H2O,一个它的分子电离出一个OH和一个H,所以在任何情况下,H2O电离出的H和OH都是相等的~1年前查看全部
- 化学反应平衡V正和V逆如何判断 有何规律
 大西岛1年前2
大西岛1年前2 -
 margaret1968 共回答了17个问题
margaret1968 共回答了17个问题 |采纳率88.2%确定平衡点
对比反应物浓度
浓度哪个相对低就往那个方向反应
一般来说 化学反应式是化学反应的正方向
要是按这个方向进行的为V正1年前查看全部
- 化学反应平衡时反应继续吗?化学反应平衡可不可以理解为 化学反应仍在进行 但是因为正逆向反应速率相同 所以反应物和生成物的
化学反应平衡时反应继续吗?
化学反应平衡可不可以理解为 化学反应仍在进行 但是因为正逆向反应速率相同 所以反应物和生成物的物质的量不变
还是说当反应平衡时 就不反应了? 雷诺阿的小艾琳1年前3
雷诺阿的小艾琳1年前3 -
 莹樱雪海 共回答了19个问题
莹樱雪海 共回答了19个问题 |采纳率89.5%你的理解完全正确.相信你的老师也是这样讲的.
反应还是继续,生成的量与反应掉的量相等,所以量才保持不变1年前查看全部
- 化学反应平衡 反应前后哪些物理量可能会改变
 weiweipingping1年前4
weiweipingping1年前4 -
 zzzz82 共回答了11个问题
zzzz82 共回答了11个问题 |采纳率81.8%物质的量,体积,压强,温度,物质的状态(固液气).1年前查看全部
- 化学反应平衡向正反应方向移动是什么意思 会对反应带来什么影响
 zhaodanyy1年前4
zhaodanyy1年前4 -
 gzzss 共回答了24个问题
gzzss 共回答了24个问题 |采纳率83.3%正反应指向生成物方向进行的反应,逆反应指向反应物方向进行的反应.
平衡向正反应方向移动:
改变影响平衡的一个条件,使正、逆反应的速率不相等,此时若正反应速率大于逆反应速率,就是在同一时间内生成的生成物多,而反应掉的生成物少,则达到新的平衡时生成物会增加.这就是向正反应方向移动的意思.
也可以这样理达到新的平衡时,跟改变条件时比,生成物增加了.即是向正反应方向移动的意思.1年前查看全部
- 化学反应平衡移动的问题 (第八题)
 晶鸣1年前1
晶鸣1年前1 -
 noulcew 共回答了16个问题
noulcew 共回答了16个问题 |采纳率87.5%的确是D 由图可以退出温度升高平衡向正方向移动,a与b点都是平衡时的点 c点反应向逆方向移动,d点反应向正方向移动1年前查看全部
- 在化学反应平衡 当平均相对分子质量一定或压强一定时 有mA(g)+nB(g)= pC(g)+qD(g)此为逆反应
在化学反应平衡 当平均相对分子质量一定或压强一定时 有mA(g)+nB(g)= pC(g)+qD(g)此为逆反应
在化学反应平衡中 mA(g)+nB(g)= pC(g)+qD(g)(此为逆反应 ) 当平均相对分子质量一定或压强一定时 有m+n=p+q 为不一定平衡 m+n不等于p+q 为平衡 lee10001年前1
lee10001年前1 -
 雁过无痕107 共回答了17个问题
雁过无痕107 共回答了17个问题 |采纳率94.1%当m+n=p+q时,反应不改变平均相对分子质量和压强,即平均相对分子质量和压强和反应进行程度无关的
而当 m+n不等于p+q 时,反应的进行会改变平均相对分子质量和压强,所以当平均相对分子质量一定或压强一定时反应肯定停止了,即达到了平衡1年前查看全部
- 化学反应平衡移动为什么增大压强...化学反应平衡向气体体积减小的方向移动?不是说平衡应该向能够减弱这种改变的方向移动吗?
化学反应平衡移动
为什么增大压强...化学反应平衡向气体体积减小的方向移动?
不是说平衡应该向能够减弱这种改变的方向移动吗?
增大压强气体体积应该减小 那么要减弱这种改变不应该是向气体体积增大的地方移动么? gz9361年前3
gz9361年前3 -
 冰冻叁尺 共回答了12个问题
冰冻叁尺 共回答了12个问题 |采纳率100%一楼正解,增大压强平衡向减弱变化方向进行,即体积减少方向.
你所说增大压强,体积应该减小,没错.但是需要注意体积减小这已经一个变化,是由于压强的增大而产生的变化.
平衡的变化方向需要根据状态改变(增大压强)而变,而不是根据状态改变而产生可能后果(体积减小)而变.
增大压强,体积减小.体积减小已经是对增大压强这一变化的减弱反应了.1年前查看全部
- 化学反应平衡移动后重新达到平衡状态,物质的浓度在新平衡时与旧平衡时相比有甚么变化
化学反应平衡移动后重新达到平衡状态,物质的浓度在新平衡时与旧平衡时相比有甚么变化
温度,压强,物质浓度,催化剂等不同条件使平衡移动时有不同的结果吗?新平衡时的各物质浓度与旧平衡时的浓度一样吗?平衡常数会不会改变?我觉得压强改变会影响平衡常数啊. 四季豆米汤1年前4
四季豆米汤1年前4 -
 如风随行 共回答了24个问题
如风随行 共回答了24个问题 |采纳率83.3%平衡常数是化学反应的特性常数.它不随物质的初始浓度(或分压)而改变,仅取决于反应的本性.一定的反应,只要温度一定,平衡常数就是定值
平衡移动的结果可用勒夏特列原理分析解释
勒夏特列原理:如果改变影响平衡的一个条件(如浓度,压强或温度等),平衡就向能够减弱这种改变的方向移动.
例如:在有气体参加或生成的可逆反应中,当增加压强时,平衡总是向体积缩小的方向移动,比如在N2+3H2 =2NH3这个可逆反应中,达到一个平衡后,对这个体系进行加压,比如压强增加为原来的两倍,这时旧的平衡要被打破,平衡向体积缩小的方向移动,即在本反应中向正反应方向移动,建立新的平衡时,增加的压强即被减弱,不再是原平衡的两倍,但这种增加的压强不可能完全被消除,也不是与原平衡相同,而是处于这两者之间.
分别描述:
1)浓度:增加某一反应物的浓度,则反应向着减少此反应物浓度的方向进行,即反应向正方向进行.减少某一生成物的浓度,则反应向着增加此生成物浓度的方向进行,即反应向正方向进行.反之亦然.
2)压强:增加某一气态反应物的压强,则反应向着减少此反应物压强的方向进行,即反应向正方向进行.减少某一气态生成物的压强,则反应向着增加此生成物压强的方向进行,即反应向逆方向进行.反之亦然.
3)温度:升高反应温度,则反应向着减少热量的方向进行,即放热反应逆向进行,吸热反应正向进行;降低温度,则反应向着生成热量的方向的进行,即放热反应正向进行,吸热反应逆向进行.
4)催化剂:仅改变反应进行的速度,不影响平衡的改变,即对正逆反应的影响程度是一样的. 从以上的分析可知:通常出现的一些情形都在勒夏特列原理的范围之内.因此,当我们遇到涉及平衡移动的问题时,只要正确运用勒夏特列原理来分析,都可以得出合适的答案的.1年前查看全部
- 化学反应平衡图像题(题目来源:2013届江西省南昌市高三上学期调研考试化学试卷 第21题)
化学反应平衡图像题(题目来源:2013届江西省南昌市高三上学期调研考试化学试卷 第21题)
向一容积不变密闭容器充入一定量A和B,发生如下反应:
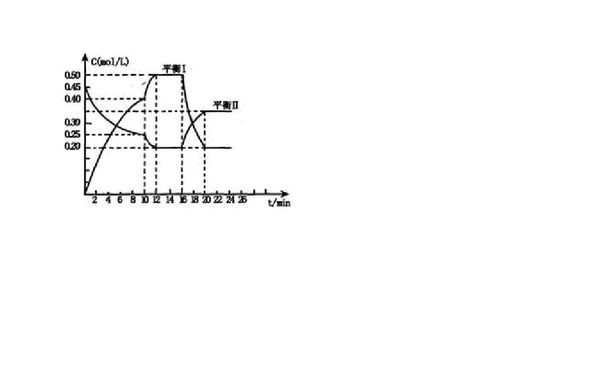
在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图.
推测第l0min引起曲线变化的反应条件可能是(试卷答案是④⑥)
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂 maisu1年前1
maisu1年前1 -
 love9alpha 共回答了19个问题
love9alpha 共回答了19个问题 |采纳率89.5%题目里貌似没有把反应式贴上来.但是即使没有反应式也可以根据图像得到答案.横坐标是时间,纵坐标是浓度,所以曲线的斜率体现的就是反应速率(A的消耗速率以及C的生成速率)在10min处,曲线的走势不变,而斜率变大了,说明反应速率加快了,提前达到了平衡.升温和加催化剂都可以加快反应速率,所以4和6可以.然后说说1、2、3、5为什么不行.减压.对于容积不变的密闭容器中的气体体系,减压的实质就是减小气体的浓度,那么反应速率会减慢,所以1不行增大A的浓度.增大A的浓度确实会加快A的消耗速率,但如果A的浓度在10min处增大了,A对应的曲线应该会在10min处上升,而图中是下降的,所以2不对增大C的量确实可以引起图中C曲线的上升,但不应引起A曲线的瞬间显著下降,所以3不行5. 降温会减慢反应速率,所以也不行.1年前查看全部
- 化学反应平衡图像 转化率—时间—压强 如何判断放热与吸热
化学反应平衡图像 转化率—时间—压强 如何判断放热与吸热
那个ΔH是如何判断的,还有那个T1T2代表的是什么的温度是反应前后的还是A和B的,

那个ΔH是如何判断的
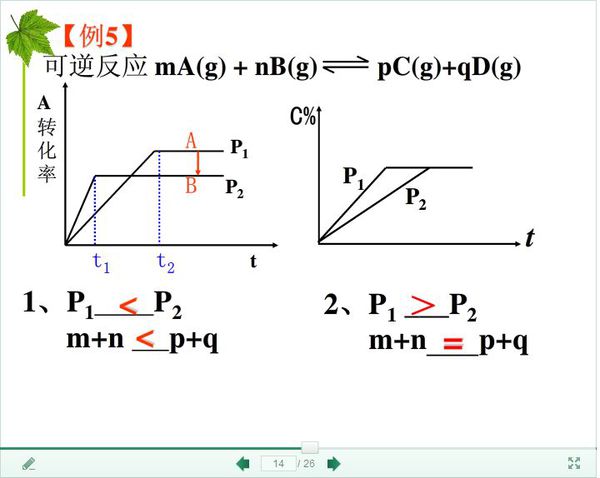
这个m+n 和p+q 又是怎么看出大小的 khdl1年前2
khdl1年前2 -
 jokey88 共回答了11个问题
jokey88 共回答了11个问题 |采纳率90.9%比较图像问题很简单,先看哪条线在前面,越前面的线反应条件越好.
例4:1、T2在前,所以T2>T1,从T1到T2,温度升高,生成物含量减少,说明逆向移动,所以是放热反应,第二个同理,就不写了
例五:1、p2>p1不解释!增大压强,反应物转化率降低,说明逆向移动,所以后面系数大
2、p1>p2不解释!转化率没变嘛,就=呗1年前查看全部
- 请问化学反应平衡如何判断呢?
 骑龙看唱本1年前4
骑龙看唱本1年前4 -
 不打球干什么 共回答了18个问题
不打球干什么 共回答了18个问题 |采纳率94.4%某可逆反应是否处于化学平衡状态,它们的标志可以通过化学平衡状态的本质特征来进行衡量
(1)V正=V逆,它是判断化学平衡状态的主要标志.正、逆反应速率相等是针对反应体系中的同一反应物或同一生成物而言.由于该物质的生成速率与消耗速率相等,才使这种物质的浓度保持不变,说明可逆反应己达到化学平衡状态.
(2)反应混合物中各组分的浓度保持不变,是判断化学平衡状态的另一个主要标志.如果反应混合物中某一种物质的量浓度,质量分数,体积分数(对气体而言)等保持一定,都说明可逆反应已达到平衡状态.
(3) 从其它角度也可以判断某可逆反应是否达到化学平衡状态,但要具体问题具体分析.例如对于反应前后气体分子数不相等的可逆反应,可以通过以下几种情况来判断:
①x09当体系中物质的总物质的量不随时间变化时,说明反应已达到平衡状态.
②x09当恒温恒容时,体系的总压强有发生变化或当恒温恒压时,体系的总体积不发生变化 都可以说明反应已达到平衡状态.
③x09混合气体的平均含量不发生变化,也可以说明反应已达平衡状态.
④x09对于反应前后气体分子数相等的反应,无论反应是否达到平衡,体系中物质的总物质的量,总压强,总体积或混合气体的平均含量都不发生变化,不能确定反应是否中达到平衡状态.1年前查看全部
- 化学反应平衡 恒容下增大反应物的量(生成物反应物全是气体)反应一定会正向移动吗
 ceju1年前2
ceju1年前2 -
 发现问题 共回答了16个问题
发现问题 共回答了16个问题 |采纳率100%增大反应物的量,反应物的正反应速率增大,V正>V逆时,反应一定向正方向移动1年前查看全部
- 化学反应平衡移动后是怎么建立新的平衡的?
化学反应平衡移动后是怎么建立新的平衡的?
新的平衡和旧平衡差别在哪里? 鹏城浮碧云1年前1
鹏城浮碧云1年前1 -
 xcchild 共回答了27个问题
xcchild 共回答了27个问题 |采纳率88.9%建立的新的平衡向减少影响的方向移动.1年前查看全部
- 化学谁能解释一下公式Kθ=kp(Pθ)^-△n 举例说明 Pθ怎么算?化学反应平衡常数
化学谁能解释一下公式Kθ=kp(Pθ)^-△n 举例说明 Pθ怎么算?化学反应平衡常数
某温度下反应PCl5(g)=PCl3(g)+Cl2(g)的平衡常数K=2.25,把一定量的PCl5引入一真空瓶内,达到平衡后,PCl5的分压为2.533*10^4 Pa,则PCl3的分压是? 茗香雪心1年前0
茗香雪心1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学反应平衡 高水平题在体积固定的密闭容器中通入各为1mol的A,C,D和xmolB发生反应:A+4B=2C+D(A,B
化学反应平衡 高水平题
在体积固定的密闭容器中通入各为1mol的A,C,D和xmolB发生反应:
A+4B=2C+D(A,B,C,D均是气体)
当x在一定范围内变化时,均可以通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol.若使起始反应向正方向进行,则的取值范围是多少?
key:(2,有分提高 benlyfet1年前4
benlyfet1年前4 -
 象一把匕首 共回答了15个问题
象一把匕首 共回答了15个问题 |采纳率100%该题一般用三行式的形式解答(起始量、变化量、平衡量,仅有变化量与方程的计量数成比例.注意反应可逆,不能完全进行)
设A反应了amol,因为起始反应向正向进行,
A--- +---- 4B2C---- + ----D
起始量1 ---------x---------1------- ----1
变化量a----------4a-------2a------------a
平衡量(1-a)--(x-4a)--(1+2a)--- (1+a)
因为平衡时保持容器中气体总物质的量为5mo,
所以有(1-a)+(x-4a)+(1+2a)+(1+a)=5
----x-2a=2
----x=2+2a
因为 01年前查看全部
- 化学反应平衡反应式左右两边的物质的量是否相等?
 凌波微步客1年前1
凌波微步客1年前1 -
 蓓薇BB 共回答了13个问题
蓓薇BB 共回答了13个问题 |采纳率92.3%可以说是分子物质的量不一定相等,但是原子物质的量一定是相等的.1年前查看全部
- 化学反应平衡~~ 转化率问题2X+Y=Z (都是气体) 已知 10L密闭容器 有 1mol X 1mol Y 达平衡后生
化学反应平衡~~ 转化率问题
2X+Y=Z (都是气体) 已知 10L密闭容器 有 1mol X 1mol Y 达平衡后生成0.3mol Z 60秒 达平衡 求 以A表示的 平衡反应速率?
解
2X + Y =Z
始 1 1 0
变 2 1 1
平 0.4 0.7 0.3
则 V=0.4/(10*60)
问一下 这样做对么 如果不对 请多多 指教~~~ koni901年前3
koni901年前3 -
 hail11w 共回答了13个问题
hail11w 共回答了13个问题 |采纳率84.6%不对,变 0.6 0.3 0.3 v=0.6/1(10*60)1年前查看全部
- 我怎么感觉盐的水解比化学反应平衡还难?而且我们老师交的真差就是照书读的,
 不的就不的1年前1
不的就不的1年前1 -
 路边的珈菲 共回答了22个问题
路边的珈菲 共回答了22个问题 |采纳率90.9%专业教师为你解答.(知识就是力量!)
在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解.盐类的水解所条件:盐必须溶于水,盐必须能电离出弱酸根离子或弱碱阳离子.
这就是水解的定义,实际上记住最关键的一条就行了.盐必须能电离出弱酸根离子或弱碱阳离子.
亲,(*^__^* *^__^* *^__^*),能够帮助你是我最大的快乐!
如果我的回答对你有帮助,请及时选为满意答案,谢谢
如有疑问请追问,祝你学习进步!1年前查看全部
大家在问
- 1序列x(n)=sin(n π/4)是一个周期序列.其周期为多少
- 2孔乙己的课后问题我到现在终于没有见——大约孔乙己的确死了.(既然是“大约”,为什么又说“的确”,这是否矛盾?作者为什么这
- 3一道初三数学函数应用题如图,平行四边形ABCD中,AB=4,BC=3,∠BAD=120度,E为BC上一动点(不与B重合)
- 4这个的作文立意是什么?狮王想给自己的儿子选一位老师,为此他伤透了脑筋,选狐狸吧,狐狸聪明伶俐,但太爱说谎,豹子呢?豹子勇
- 5分解因式:-9(a+2b)²+4(2a-b)²
- 6下列叙述正确的是
- 7(3x一1)2=(x十1)2解方程
- 8I like to fiy kites.改为一般疑问句
- 9请问方差分析的F临界值怎么选取
- 10少年中国说制出将来之少年中国者,则中国少年之责任也.彼老朽者何足道,彼与此世界作别之日不远矣,而我
- 11下列各组物质之间,一定互为同系物的是( )
- 12质量1.2kg体积0.002m3的木块漂浮在水面上,此时水离容器底30cm,水对容器压强
- 13已知:a<0,0<b<C 化简:(1)丨a-b丨-丨a-c丨-2丨c-b丨 (2)4丨3a-b丨-2丨3c-2a丨-3丨
- 14词义词意 这个义与意有什么区别 、
- 15已知向量a=2,向量b=1,(2向量a减3向量b)乘(2向量a加向量b)=9求向量a加向量b的值
