一道化学题 说明原因下列关于水的说法不正确的是 ( )A 自来水的生产要经过沉降,过滤 吸附,消毒等过程. B 水电解时
 wyj_29802022-10-04 11:39:541条回答
wyj_29802022-10-04 11:39:541条回答
一道化学题 说明原因
下列关于水的说法不正确的是 ( )A 自来水的生产要经过沉降,过滤 吸附,消毒等过程. B 水电解时负极产生H2,正极产生O2且H2和O2的质量比为2:1
下列关于水的说法不正确的是 ( )A 自来水的生产要经过沉降,过滤 吸附,消毒等过程. B 水电解时负极产生H2,正极产生O2且H2和O2的质量比为2:1

已提交,审核后显示!提交回复
共1条回复
 lovezhanglei119 共回答了17个问题
lovezhanglei119 共回答了17个问题 |采纳率100%- 下列关于水的说法不正确的是 (B )
A 自来水的生产要经过沉降,过滤 吸附,消毒等过程.
B 水电解时负极产生H2,正极产生O2且H2和O2的质量比为2:1
讲电解水H2和O2的体积比为2;1,而不是质量比. - 1年前
相关推荐
- 两道化学选择题!溶液一定中性的是-A.PH=7溶液B.C(H+)=C(OH-)=10-6mol/l溶液C.使石蕊试液呈紫
两道化学选择题!
溶液一定中性的是-A.PH=7溶液B.C(H+)=C(OH-)=10-6mol/l溶液C.使石蕊试液呈紫色溶液D.酸与碱恰好完全反应生成正盐溶液 同温,100ml0.01mol/l醋酸溶液与10ml0.1mol/l电离常数谁大?具体解释. ghp_001年前1
ghp_001年前1 -
 lilly2005 共回答了16个问题
lilly2005 共回答了16个问题 |采纳率93.8%答案B.
A没说明温度,pH=7不能说明中性
B氢离子浓度等于氢氧根离子浓度,说明溶液显中性
C石蕊变色范围较大,不灵敏,在pH6~8都呈紫色
D正盐有可能水解,使得溶液不呈中性
电离常数只跟温度有关,相同温度,电离常数相等1年前查看全部
- 【SOS】一道化学选择(高一)设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,5.6L四氯化碳含有的
【SOS】一道化学选择(高一)
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,铝跟过量氢氧化钠溶液反应生成3.36L氢气时,转移的电子数为0.3NA
C.标准状况下,14g氮气含有的核外电子数为5NA
D.标准状况下,2.24L氢气和氨气的混合气体中含有的分子总数为0.1NA
我认为B.C.D都对的,但最做只能选2个,那应该选?请说明原因, 蓁蓁其华1年前1
蓁蓁其华1年前1 -
 speedbird 共回答了16个问题
speedbird 共回答了16个问题 |采纳率75%A明显不对.B是对的.C混淆了核外电子和最外层电子概念.D是对的.1年前查看全部
- 急求两道化学题!1.由于氨气有毒,如果发生液氨泄露事故,除了立即关闭阀门,还应采取______方法,降低空气中氨气的浓度
急求两道化学题!
1.由于氨气有毒,如果发生液氨泄露事故,除了立即关闭阀门,还应采取______方法,降低空气中氨气的浓度
2.食盐的内部结构是怎样的?
 岭水村1年前1
岭水村1年前1 -
 zhangzui990101 共回答了19个问题
zhangzui990101 共回答了19个问题 |采纳率94.7%氨气没有毒.应该是CO吧.
打开门窗通风
2、NaCl, 食盐的主要成分,离子型化合物.纯净的氯化钠晶体是无色透明的立方晶体,由于杂质的存在使一般情况下的氯化钠为白色立方晶体或细小的晶体粉末,比重为2.165(25/4℃),熔点8011年前查看全部
- 做了一道化学题,说铅蓄电池使用一段时间后要补充浓硫酸,这到底对不对?我们生活中不是加蒸馏水吗?
 lovestyan1年前2
lovestyan1年前2 -
 romanticwang 共回答了21个问题
romanticwang 共回答了21个问题 |采纳率100%这是一道应用题.
按照蓄电池的化学反应原理:
正极:PbO2 + 2e + H2SO4→ PbSO4 + 2H2O
负极:Pb + HSO4- → PbSO4 + H+ + 2e
总反应:PbO2 + 2 H2SO4 + Pb == 2 PbSO4 + 2H2O
这是一个可逆的反应,从理论上讲,是不需要加硫酸的.这应该是该题目的答案.
但是在实际应用中,蓄电池在充电时会发生一个副反应:电解水:
2H2O→2H2↑+O2↑.
由于存在电解水,所有电池到一定时间要加入蒸馏水.
理论上水的电解后,损失的是水,但实际上在水被电解后,产生的气体会带走少量的硫酸,即我们在充电时闻到的酸味,时间长了,电池内部的硫酸就会减少,因此实际情况使用一段时间后除了加蒸馏水外,还要加入少量的硫酸,以补充硫酸的损失.
如果是化学题目,那就不需要考虑实际使用的情况了,按照物质守恒定律,直接回答不需要加入硫酸就可以了.如果是实际使用,可以根据实际情况,除了加入蒸馏水外,还可以加入少量的硫酸.注意硫酸不要加多,控制充电充足后电解液的比重在1.26~1.28g/cm^3就可以了1年前查看全部
- 常见的合金都有什么这是一道化学题说的是—合金在我们的生活 中广泛运用,请你举出常见的3种合金
 DANG1101年前3
DANG1101年前3 -
 yowoeiri 共回答了18个问题
yowoeiri 共回答了18个问题 |采纳率88.9%黄铜(铜锌合金)
白铁(铁锌合金)
不锈钢(铁和很多种金属非金属的合金)1年前查看全部
- 一道化学常识 是否所有的有机物都含有碳元素?有什么特例吗?
 shichangxs1年前1
shichangxs1年前1 -
 pierce1234 共回答了27个问题
pierce1234 共回答了27个问题 |采纳率81.5%没有特例,口诀:有机物一定含碳,但是含碳的不一定是有机物.1年前查看全部
- 一道化学题`关于元素质量的由氧化镁(MgO)和另外一种金属元素氧化物组成的混合物4G`经测定知其中含氧元素1.8G,则另
一道化学题`关于元素质量的
由氧化镁(MgO)和另外一种金属元素氧化物组成的混合物4G`经测定知其中含氧元素1.8G,则另一种金属氧化物是___ 大风车19781年前1
大风车19781年前1 -
 daisy88 共回答了20个问题
daisy88 共回答了20个问题 |采纳率100%含氧量=1.8÷4=45%
而大部分氧化物含氧量远远低于45%,因为氧的相对质量小
氧化镁是16÷40=40%
高于45%的常见的就只有三氧化二铝(16×3)÷(27×2+16×3)=47%
所以是
三氧化二铝
Al2O31年前查看全部
- 急~~ 一道化学题 主要是算溶质质量分数 要有解题过程
急~~ 一道化学题 主要是算溶质质量分数 要有解题过程
在农业上常用质量分数为16%的氯化钠溶液来选种,小华为了测定氯化钠溶液是否能用于选种,他取样品10g,向其中加入50g硝酸银溶液,恰好反映后过滤,洗涤,烘干,得到2.87g白色沉淀.
请回答并计算:
(1)反应后滤液的质量为多少
(2)样品溶液中溶质的质量分数是多少
(此氯化钠溶液是否能用于选种
 网络别针1年前1
网络别针1年前1 -
 cowclarke 共回答了23个问题
cowclarke 共回答了23个问题 |采纳率95.7%1.m=10+50-2.78=57.22g
2.NaCL+AgNO3===NaNO3+Agcl
58.5 143.5
X=1.17g 2.87
溶质的质量分数=1.17/10=11.7% 不能用来选种1年前查看全部
- 【一道化学选择提】一定要附原因!
 yh991991年前3
yh991991年前3 -
 6535116 共回答了15个问题
6535116 共回答了15个问题 |采纳率93.3%虽然氨水是弱电解质 但是因为和强酸反应 平衡朝水解方向进行,并且可以促进反应完全,因此楼上说的不全对.
回到刚才,氨水是弱电解质,因此水中并不是完全的离子状态,需要在酸作用下电离,电离作用是一个吸热的过程,放热57.3 吸热肯定大于零,因此小于57.3.1年前查看全部
- 一道化学题目(关于离子)某无色溶液中能最大共存的离子组是A.Na+ H+ Cl- Cu2+ B.OH- K+ SO4 2
一道化学题目(关于离子)
某无色溶液中能最大共存的离子组是
A.Na+ H+ Cl- Cu2+ B.OH- K+ SO4 2-
C.NO3- Mg2+ Cl- K+ D.Na+ OH- NO3- H+
要理由啊, 才发现已1年前1
才发现已1年前1 -
 Camoufleur 共回答了23个问题
Camoufleur 共回答了23个问题 |采纳率91.3%BC
A、Cu2+有色
B、可以共存
C、可以共存
D、OH- 和H+反应生成水1年前查看全部
- 做到一半就不知道如何下手干掉它的一道化学题.
做到一半就不知道如何下手干掉它的一道化学题.
某工厂用含淀粉质量分数为54%的薯干2吨开制取乙醇 如果发酵过程中有85%的淀粉转化为乙醇 制得的乙醇又含水50% 问可得这样的乙醇多少吨. 凌云潇笑11年前1
凌云潇笑11年前1 -
 宝贝天才 共回答了16个问题
宝贝天才 共回答了16个问题 |采纳率100%不好意思,我是复制过来的,自己没花花力气,直接剽窃了别人的劳动成果.不过对你应该有用.淀粉先水解生成葡萄糖:(C6H10O5)n + nH2O == nC6H12O6葡萄糖在酒化酶的作用下生成乙醇:C6H12O6 == 2C2H5OH + 2CO2所以淀粉转...1年前查看全部
- 这道化学题关于有机物分子的空间构型
这道化学题关于有机物分子的空间构型
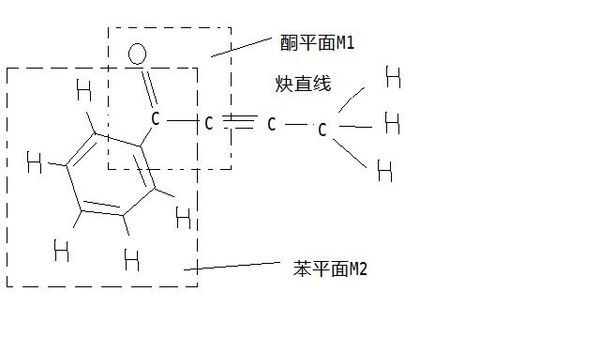
一定在同一平面上的原子最多有﹏个,答案为12,解释一下谢谢
 恋饰界1年前3
恋饰界1年前3 -
 v97v 共回答了21个问题
v97v 共回答了21个问题 |采纳率90.5%苯上有7个C,有5个H,苯上的原子一定在同一个平面,所以为12个1年前查看全部
- 一道化学必修2题已知电解饱和食盐水可制得Cl2,又已知铅蓄电池放电时发生如下反应:正极:PbO2+4H++SO4^2-+
一道化学必修2题
已知电解饱和食盐水可制得Cl2,又已知铅蓄电池放电时发生如下反应:正极:PbO2+4H++SO4^2-+2e-=PbSO4+2H2
,又已知铅蓄电池放电时发生如下反应:
正极:PbO2+4H++SO4^2-+2e-=PbSO4+2H2O
负极:Pb+SO^2-=PbSO4+2e-,
使用该电池电解CUSO4溶液,要想得到纯铜1.6克,这时铅蓄电池消耗H2SO4的物质的量是多少?
A 0.025mol B.0.05mol C.0.1mol D,0.2mol sddywll1年前2
sddywll1年前2 -
 区号0915 共回答了22个问题
区号0915 共回答了22个问题 |采纳率86.4%解析:Pb+PbO2+2H2SO4 = 2PbSO4 + 2H2O ------2e-
CUSO4---Cu ----2e-
所以有:Cu -----2H2SO4
64 2
1.6 n n = 0.05mol 所以选B1年前查看全部
- 一道化学题(与酸碱有关)分别在ph=1的酸溶液和ph=13的NaOH溶液中加入足量的Al,产生的氢气体积相同,下列说法正
一道化学题(与酸碱有关)
分别在ph=1的酸溶液和ph=13的NaOH溶液中加入足量的Al,产生的氢气体积相同,下列说法正确的是
A两溶液的体积相同,酸是弱酸
B两溶液的体积相同,酸是多元强酸
C酸是弱酸,酸的浓度比NaOH的浓度小
D酸溶液的体积比NaOH溶液的体积大
为什么?我选的D,为什么D不对呢?感觉也行啊``` fangyuyuan19761年前4
fangyuyuan19761年前4 -
 沽月楼 共回答了19个问题
沽月楼 共回答了19个问题 |采纳率84.2%H2--2H+ H2---2/3NaoH
所以产生的氢气一样多时,需要的酸多,而他们氢离子的浓度一样,所以酸必为弱酸.弱酸的浓度必然大于NaOH的浓度.
D答案是充分条件,而非必要条件,由题干推出不了D答案,小又怎样了.说小也正确吧.也可以满足吧!1年前查看全部
- 帮忙解解这道化学题,谢谢Mr(H2SO4)=
 adaclxf1年前3
adaclxf1年前3 -
 哲宜 共回答了14个问题
哲宜 共回答了14个问题 |采纳率92.9%98.071年前查看全部
- 关于氮族元素的几道化学题1.下列各组离子在水溶液中可以大量共存的是A.H+,K+,Fe2+,NO3-B.OH-,Na+,
关于氮族元素的几道化学题
1.下列各组离子在水溶液中可以大量共存的是
A.H+,K+,Fe2+,NO3-
B.OH-,Na+,NH4+,Cl-
C.NO3-,OH-,H2PO4-,K+
D.Mg2+,NO3-,H+,Al3+
2.一定条件下,将等体积的NO和O2的混合气体置于试管中,并将试管倒立于水槽中(水槽中有足量水),充分反应后剩余气体的体积约为原混合气体总体积的
A.1/4 B.3/4 C.1/8 D.3/8
3.什么气体和澄清石灰水反应会产生白色沉淀和NO?
请说明原因, 人何必认真1年前3
人何必认真1年前3 -
 游子杉 共回答了20个问题
游子杉 共回答了20个问题 |采纳率95%1.D A是硝酸根和氢离子组成硝酸有强氧化性氧化二价铁离子到三价 B是氨根和氢氧根生成一水合铵 C好像氢氧根和H2PO4-能反应
2.C 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO 找最小公倍数加一块得4NO+3O2+2H2O=4HNO3 NO和O2是四比三的关系 题中是等体积的剩了八分之一的氧气
三题我不会1年前查看全部
- 一道化学题.写出下列物质能与氢氧化钙反应的完成化学方程式
一道化学题.写出下列物质能与氢氧化钙反应的完成化学方程式
.写出下列物质能与氢氧化钙反应的完成化学方程式
(本题用时8分钟.请独立完成)
1. 硫酸 2. 盐酸 3.二氧化碳 4.二氧化硫 5.碳酸钠 6.硫酸铜 7.氯化亚铁 8.氯化镁 9. 硝酸铵10.石蕊 11. 酚酞 Linxier1年前1
Linxier1年前1 -
 雪之女王的吻 共回答了26个问题
雪之女王的吻 共回答了26个问题 |采纳率92.3%H2SO4 + Ca(OH)2====CaSO4 + 2H2O
2 HCl + Ca(OH)2 CaSO4 + Cu(OH)2
FeCl2 +Ca(OH)2====CaCl2 + Fe(OH)2
MgCl2 +Ca(OH)2====Mg(OH)2 + CaCl2
2NH4NO3 + Ca(OH)2 ====Ca(NO3)2 + 2 NH3 +2H2O
.石蕊 变蓝
酚酞 变红1年前查看全部
- 关于物质的量的一道化学题等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液
关于物质的量的一道化学题
等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的 浓度分别为a mol·L—1和b mol·L—1.则a与b的关系为
A.a = b B.a = 2b C. 2a = b D.a = 5b
为什么没有A(HNO3的量很少) 原谅他吧1年前1
原谅他吧1年前1 -
 mandylxl 共回答了23个问题
mandylxl 共回答了23个问题 |采纳率91.3%答案C 没错.但是题干不严谨,应该说溶解于足量的相同体积硝酸中,这样的话就选C了.设等质量为m,据n=m/M这个公式,则CuO和MgO的n之比为其M之比的反比,且变成溶液后铜离子、镁离子的数量都不变且等于粉末中的量,得到a:b=1:2.故选C!希望对你有帮助!呵呵1年前查看全部
- 一道化学题,求解. 下列叙述中正确的是
一道化学题,求解. 下列叙述中正确的是
A.常温下ph=12的烧碱和ph=2的谋算溶液等体积混合,混合后的溶液的ph≤7
B.ph相同的氨水和烧碱溶液稀释相同倍数时氨水ph会下降的少些
C.用相同浓度的盐酸中和ph相同的氨水和烧碱溶液,所需盐酸体积相同
D.用相同ph的盐酸中和相同浓度的氨水和烧碱溶液,所需碱的体积相同
请写一下过程
谢谢 48850651年前3
48850651年前3 -
 gufeng970 共回答了19个问题
gufeng970 共回答了19个问题 |采纳率94.7%选AB.
A.正确,强酸pH=7,弱酸pH1年前查看全部
- 高一一道化学题,在一定温度下,把3.0moLM和2.5moLN混合于2.0L的密闭容器中
高一一道化学题,在一定温度下,把3.0moLM和2.5moLN混合于2.0L的密闭容器中
在一定温度下,把3.0moLM和2.5moLN混合于2.0L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g) XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,已知Q的平均反应速率为0.10 mol•L-1•min-1,下列说法错误的是( )
A.平衡时容器内的压强是原来的0.8倍
B.M的平均反应速率为0.15mol/ L/min
C.x的值为1
D.平衡时p的浓度为0.15mol/L 心如ll海1年前4
心如ll海1年前4 -
 tt0225 共回答了19个问题
tt0225 共回答了19个问题 |采纳率100%3M(g)+N(g) = XP(g)+2Q(g)
3 2.5 0 0
1.5 0.5 0.5X 1
1.5 2 0.5X 1
由Q的平均反应速率和反应时间,容器容积求得Q的物质的量
n(Q)=0.1*2*5=1 mol
由于容器压强变小,则
3+1>X+2
X1年前查看全部
- 一道化学题若实验室需要350ml1.00mol/L的Nacl溶液,能否分别配置100ml和250ml浓度为1.00mol
一道化学题
若实验室需要350ml1.00mol/L的Nacl溶液,能否分别配置100ml和250ml浓度为1.00mol/L的Naci溶液?应该配制多少体积?应该称量多少克Nacl固体? 锈刀草堂1年前4
锈刀草堂1年前4 -
 bian131 共回答了21个问题
bian131 共回答了21个问题 |采纳率85.7%若需要350mL溶液,建议配制500mL.
原因有两个:
一,两次配置误差较大;二,容量瓶是是量入容器.它显示100ml说明它加入的特体体积是100ml,倒出的液体体积必然小于100ml.分别配在100mL和250mL的容量瓶里,所以这两瓶溶液倒出来合在一起是少于350mL的.
配制500mL的话,应该称量29.25克NaCl固体.1年前查看全部
- 一道化学推断+计算的题,不烦的,几个空,好的高价
一道化学推断+计算的题,不烦的,几个空,好的高价
准确称取5g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100ml某硫酸溶液的烧杯中,充分反应后过滤,再向滤液中加入10mol的NaOH溶液,产生沉淀的质量与所加入的氢氧化钠溶液质量的关系如右图所示.试求:
1、写出溶液中所发生的反应方程式
____________________________________________
____________________________________________
____________________________________________
____________________________________________
2、a点之前的NaOH溶液的用途为_________________
3、当NaOH溶液用去35ml时,沉淀为______________
4、(要过程)若a=2.3,则用于沉淀Fe3+,消耗NaOH的体积是_______ml,铝土矿中各组分的质量分数:Al2O3为_______、Fe2O3为_______、SiO2为_______
图
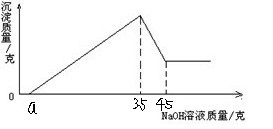
 Jacky光1年前1
Jacky光1年前1 -
 moneyboy2008 共回答了18个问题
moneyboy2008 共回答了18个问题 |采纳率83.3%(1)写出溶液中所发生的反应的方程式.
Al2O3+3H2SO4----->Al2(SO4)3+3H2O
Fe2O3+3H2SO4----->Fe2(SO4)3+3H2O
H2SO4+2NaOH----->Na2SO4+2H2O
Fe2(SO4)3+6NaOH----->2Fe(OH)3+3Na2SO4
Al2(SO4)3+6NaOH----->2Al(OH)3+3Na2SO4 ;Al(OH)3+NaOH----->NaAlO2+2H2O
(2)a点之前的NaOH溶液的用途为_中和过量的硫酸_
(3)当NaOH溶液用去35ml时,沉淀为_Fe(OH)3和Al(OH)3_
(4)应该是6g样品才对.如果为6g样品,计算如下:
若a=2.3mL,用于沉淀Fe3+,消耗NaOH溶液的体积是_0.027mol_mL,铝土矿中组成成分的质量分数:Al2O3__85%_,Fe2O3__12%__Si02__3%___
Al(OH)3沉淀溶解消耗NaOH10ml---------n为10*0.01=0.1mol,
Al(OH)3+NaOH=NaAlO2+2H2O
则Al(OH)3沉淀为0.1mol,生成Al(OH)3沉淀时消耗NaOH0.3mol
Fe(OH)3和Al(OH)3沉淀共消耗NaOH-----32.7ml-------0.0327*10=0.327mol
则Fe(OH)3沉淀消耗NaOH------------0.327mol-0.3mol=0.027mol
Fe3+ +3OH-=Fe(OH)3 Al3+ +3OH-=Al(OH)3
1 3 1 3
0.009mol 0.027mol 0.1mol 0.3mol
Fe2O3~2Fe3+ Al2O3~2Al3+
1 2 1 2
0.0045 0.009 0.05mol 0.1mol
Fe2O3=0.0045*160=0.72g w=0.72/6*100%=12%
Al2O3=0.05*102=5.1g w=5.1/6*100%=85%
Si02=6-5.1-0.72=0.18g w=0.18/6*100%=3%1年前查看全部
- 让我郁闷了N久的几道化学题.1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品
让我郁闷了N久的几道化学题.
1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品溶解于水中,过滤得到不足3 g泥沙和1000 g溶液.取出500 g溶液进行测定,其中含有镁元素1.2 g,钙元素2 g,氯元素42.6 g.则原粗盐中氯化钠的质量分数约为( )
A.83.6% B.86.3% C.88.1% D.91.6%
2.已知t°C时,氯化钾的溶解度为40g.在该温度下,将20g氯化钾固体加入到50g水中,充分溶解,形成的溶液中溶质的质量分数为( )
A.25% B.28.6% C.33.3% D.50%
我知道答案是什么,
请说明为什么. 拓拔路儿1年前1
拓拔路儿1年前1 -
 爱你很痛 共回答了24个问题
爱你很痛 共回答了24个问题 |采纳率79.2%1.A
500 g溶液中:
镁元素1.2 g来自于 MgCl2.
MgCl2中Mg的质量分数:24/(35.5*2+24) 所以MgCl2质量为4.75g
所以MgCl2中Cl的质量:4.75g-1.2 g=3.55g
钙元素2 g来自于CaCl2
CaCl2中Ca的质量分数:40/(40+35.5*2) 所以 CaCl2质量为5.55g
所以CaCl2中Cl的质量:5.55g-2 g=3.55g
氯元素42.6 g来自于MgCl2,CaCl2,NaCl
NaCl中Cl的质量:42.6 g-3.55g-3.55g=35.5g
所以NaCl的质量为58.5g(方法和前面的一样)
500 g溶液中NaCl的质量为58.5g.1000 g溶液中NaCl的质量为117g
溶液一共140g.质量分数:117/140=83.6%
选A
2.B
氯化钾的溶解度为40g :t°时100g水中可以溶解40gKCl
将20g氯化钾固体加入到50g水中,就恰好可以完全溶解
质量分数:20/(50+20)=28.6%
选B1年前查看全部
- 一道化学推断题把铁片和铜片同时放入盛有硝酸银溶液的试管中,充分反应后过滤,在滤纸上留下少量金属,并得到滤液.(1)在滤液
一道化学推断题
把铁片和铜片同时放入盛有硝酸银溶液的试管中,充分反应后过滤,在滤纸上留下少量金属,并得到滤液.
(1)在滤液里滴加盐酸:
①若有白色沉淀产生,则滤纸上一定含有的金属是( ),滤液中一定含有的金属离子是( )
②若无白色沉淀产生,则滤纸上一定含有的金属是( ),可能含有的金属是( );滤液中一定含有的金属离子是( ),可能含有的金属离子是( ).
(2)向从滤纸上得到的金属中滴加稀盐酸:
①若有气体产生,则滤纸上一定含有的金属是( ),滤液中一定含有的金属离子是( ).
②若无气体产生,则滤纸上一定含有的金属是( ),可能含有的金属是( );滤液中一定含有的金属离子是( ),可能含有的金属离子是( ). 天狼Lin1年前2
天狼Lin1年前2 -
 btgxd 共回答了16个问题
btgxd 共回答了16个问题 |采纳率87.5%(1)一定有银,因为有沉淀,所以有银离子,说明铜、铁的量不足以置换出全部的银,所以只有一部分置换出来的银成为了滤渣中一定有的金属!
溶液中一定有银离子,因为有白色沉淀,一定有铁、铜离子因为,铁、铜置换了银.
若无沉淀,说明银离子全部置换出来,一定有银.可能有铜和铁,因为铜和铁可能都过量.也可能恰好完全反应!溶液中一定有铁离子,因为铁的活动性比铜强,所以铁和溶液先反应,如果铁不够用,铜才会开始反应.所以不管怎么说,铁离子一定有.可能有铜离子啦.因为铁可能真的不够用.一定没银离子,因为没沉淀.
(2)一定有铁、铜、银,因为有气体,而铜、银活动性在氢后,所以一定有铁.上一问以说明了铁有剩余,铜一定等于没反应,银全部置换出的原因,所以,也一定有铜和银.
一定有银,因为铜铁可能恰好完全反应,或铜铁不足,可能有铜,因为可能铜过量.一定有的离子是铁,理由同第一问.可能有铜、银两种离子,因为铜银不足时,就会有银离子未被置换出来.1年前查看全部
- 一道化学题 小吴将镁带燃烧后生成白色固体收集起来,发现固体质量比原先镁带质量大,请问这种情况是否符合质量守恒定律?___
一道化学题 小吴将镁带燃烧后生成白色固体收集起来,发现固体质量比原先镁带质量大,请问这种情况是否符合质量守恒定律?_____.为了能够证明他的想法,小吴用同样的方法将此实验重做了一次,可结果却事与愿违,发现第二次实验中固体质量却比原先镁带质量小,请你帮他解释可能的原因._______________________
利用镁带的化学性质在日常生活中可用镁带制作____________________等 一个hh害的人1年前1
一个hh害的人1年前1 -
 bccv888 共回答了20个问题
bccv888 共回答了20个问题 |采纳率90%小吴将镁带燃烧后生成白色固体收集起来,发现固体质量比原先镁带质量大,请问这种情况是否符合质量守恒定律?_符合(白色固体是Mg与氧气反应生成的氧化镁,其质量应等于镁与氧气的质量和,当然比镁的质量大了)____.为了能够证明他的想法,小吴用同样的方法将此实验重做了一次,可结果却事与愿违,发现第二次实验中固体质量却比原先镁带质量小,请你帮他解释可能的原因._有大量的氧化镁以白烟的形式扩散到空气中了_____
利用镁带的化学性质在日常生活中可用镁带制作__照明弹____等1年前查看全部
- 一道化学题,求解再说下这道题有难度么?
 依稀的摸样1年前2
依稀的摸样1年前2 -
 magic9494 共回答了12个问题
magic9494 共回答了12个问题 |采纳率66.7%毫无难度,不,或者说是超级简单
红褐色固体是Fe(OH)3,空气中得到的则H是Fe(OH)2,所以G是FeCl2,D是Fe,J是FeCl3,B是Fe2O3
然後A和Fe2O3高温反应得到C和Fe,明显想到铝热反应,A是Al,C是Al2O3,E是AlCl3,F是NaAlO2,K是Al(OH)
剩下自己做1年前查看全部
- 一道化学题(关于点燃氢气的装置)
一道化学题(关于点燃氢气的装置)
下列点燃氢气的装置中既安全又正确的是哪一项?(从右端尖嘴处点火,液体均为水)
★本题图片传不上来,请大家在百度搜索中复制“从右端尖嘴处点火,液体均为水”这一句,按下回车,
点击“丽水学院附属高中高一化学竞赛选拔试题”
关注第23题,帮忙分析分析,我还是不太清楚这四个选项有什么区别, 发仔啦啦1年前0
发仔啦啦1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 问一道化学题12.有两种卤素单质共1mol,跟氢气在一定条件下完全反应后生成的卤化氢的平均式量为38.5,则该两种卤素单
问一道化学题
12.有两种卤素单质共1mol,跟氢气在一定条件下完全反应后生成的卤化氢的平均式量为38.5,则该两种卤素单质可能是( )
A.F2和Cl2 B.F2和Br2 C.Cl2和Br2 D.Br2和I2 司徒拙1年前7
司徒拙1年前7 -
 可口可乐FLY 共回答了22个问题
可口可乐FLY 共回答了22个问题 |采纳率90.9%BC
HX平均式量为38.5→X平均式量为37.5→X2平均式量为78
F2为38
Cl2为71
Br2为160
I2为254
只有F2和Br2或Cl2和Br2平均才可能得到78的平均式量
所以选BC1年前查看全部
- 一道化学金属活动性顺序题有X Y Z三种金属它们发生如下的反应:X放入Z的溶液中能得到Z,Y放到X的盐溶液中得到X,Y放
一道化学金属活动性顺序题
有X Y Z三种金属它们发生如下的反应:X放入Z的溶液中能得到Z,Y放到X的盐溶液中得到X,Y放入Z的盐溶液中得到Z,三种金属的活动的顺序由强到弱排列为___________ 清清qingqing1年前8
清清qingqing1年前8 -
 实用kk 共回答了21个问题
实用kk 共回答了21个问题 |采纳率85.7%yxz
X放入Z的溶液中能得到Z 可以知道 X比Z的 金属性强 x>z
Y放到X的盐溶液中得到X 可以知道 y比x 金属性强 y>x
所以 y>x>z1年前查看全部
- 一道化学高2的题25℃下, 将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1
一道化学高2的题
25℃下, 将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1比V2等于多少?这种题怎么算,只有用那种公式硬算吗?有什么简单方法没?
 liutoy1年前1
liutoy1年前1 -
 爱笑的小龙女 共回答了22个问题
爱笑的小龙女 共回答了22个问题 |采纳率90.9%pH=13的氢氧化钠溶液 c(OH-)=0.1mol/L
pH=1的稀盐酸 c(H+)=0.1mol/L
最终PH=2 c(H+)=0.01mol/L
最终显酸性,剩余c(H+)=(0.1V2-0.1V1)/(V1+V2)=0.01 V1:V2=9:11
没有什么公式.就先发生酸碱中和反应,用剩余的酸或碱来计算1年前查看全部
- 求解一道化学题,题目如下向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列
求解一道化学题,题目如下
向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列说法正确的是( )
A.一定有锌粉剩余
B.所得溶液中一定有Zn2+和Cu2+
C.一定有银粉生成
D.所得溶液中一定有Cu2+和Ag+
答案选C
解析说可能存在一下几种情况
锌粉刚好把Ag.Cu全部置换出来了
把Ag全部置换出来,但Cu未置换出来
Ag全部置换出来,但Cu只有部分被置换出来
Ag只有部分置换出来,Cu没有置换出来.
我想问为什么锌粉会先跟AgNO3反应,而不是先跟Cu(NO3)2反应或者同时跟两种一起反应?
 bjaya1年前2
bjaya1年前2 -
 jackey512 共回答了15个问题
jackey512 共回答了15个问题 |采纳率93.3%鸡蛋壳的主要成分是(碳酸钙),某同学做了如下的家庭小实验:在一个玻璃杯中放入了大半杯白醋,将一只洗净的鸡蛋放入杯中,观察到鸡蛋慢慢沉到杯底,又慢慢浮起来,马上又下沉……这样反复运动.请通过化学和物理等知识来解释该实验现象.(鸡蛋壳的主要成分为碳酸钙,与盐酸反应产生二氧化碳气体,以气泡形式存在在蛋壳周围,使鸡蛋受到的浮力大于重力而上浮,浮出水面后气泡破裂,鸡蛋受到的浮力小于重力而下沉,如此反复).
打字不易,1年前查看全部
- 求解决一道化学题(知道氧化产物和还原产物有什么用,还有后面根据电子守恒是怎么得出这个式子的)
 蚊子丽1年前1
蚊子丽1年前1 -
 jy3000 共回答了25个问题
jy3000 共回答了25个问题 |采纳率76%碘酸钾是氧化剂,生成的是还原产物碘离子,碘由正五价得六个电子变为负一价,亚硫酸氢根是还原剂,生成的是氧化产物硫酸根,硫由正四价失两个电子变为正六价,所以1mol碘酸钾反应时需要得6mol电子,而1mol的亚硫酸氢根只能失2mol电子,因为反应前后电子守恒,所以反应时1mol的碘酸钾对应3mol的亚硫酸氢根1年前查看全部
- 一道化学推断题:甲乙丙是单质,XYZ是化合物.
一道化学推断题:甲乙丙是单质,XYZ是化合物.
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质.X、Y、Z中只有一种是离子化合物
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状况下是深红棕色液体,Y和Z具有相同阳离子,X和Z具有相同阴离子

 visionarycn1年前1
visionarycn1年前1 -
 hh之心空 共回答了27个问题
hh之心空 共回答了27个问题 |采纳率92.6%1.甲是Mg 乙是氧气,丙是 C x是二氧化碳 y是MgO z 是一氧化碳
2.甲是氯气 乙是铁 丙是溴单质 x是溴化亚铁 Y是氯化铁 Z是溴化铁1年前查看全部
- 一道化学题某无色气体可能含有CO CO2 H2 H2O(水蒸气)中的一种或几种,依次进行如下处理(假设每次处理均完全反映
一道化学题
某无色气体可能含有CO CO2 H2 H2O(水蒸气)中的一种或几种,依次进行如下处理(假设每次处理均完全反映)
(1)通过碱石灰(NaOH和CaO的固体混合物)时,气体体积变小
(2)通过炽热的氧化铜时,粉末变为红色
(3)通过白色硫酸铜粉末,粉末变为蓝色
(4)通过澄清石灰水时,石灰水变浑浊,由此可确定原气体中( )
A 一定含有CO H2,至少含有H2O CO2中的一种
B 一定含有H2O CO,可能含有CO2 H2
C 一定含有CO CO2,可能含有H2O H2
D 一定含有CO2 H2O,可能含有H2 CO
为什么? 高云霞1年前3
高云霞1年前3 -
 阿当75 共回答了19个问题
阿当75 共回答了19个问题 |采纳率89.5%A 一定含有CO H2,至少含有H2O CO2中的一种1年前查看全部
- 关于一道化学的题目 某温度下,向100克水中加入30克硫酸铜粉末,充分溶解后,烧杯底部形成25克晶体(CuSO4.H2O
关于一道化学的题目 某温度下,向100克水中加入30克硫酸铜粉末,充分溶解后,烧杯底部形成25克晶体(CuSO4.H2O),则该温度下CuSO4溶液中溶质含量分数为? 为什么?25克硫酸铜晶体中有硫酸铜16克,结晶水9克.
 天雅海娇1年前1
天雅海娇1年前1 -
 wuwenyi100 共回答了25个问题
wuwenyi100 共回答了25个问题 |采纳率88%25克晶体(CuSO4.5H2O)中硫酸铜16g水9g,
该温度下CuSO4溶液中溶质含量分数为
(30g-16g)/(130g-25g)*100%=13.3%1年前查看全部
- 请教二道化学题(AP)(1)What is a reaction mechanism and how does it d
请教二道化学题(AP)
(1)What is a reaction mechanism and how does it differ from a balanced chemical equation?
(2)Define the following general types of chemical reactions:
a.Addition;
b.Elimination;
b-1.Beta Elimination;
b-2.Alpha Elimination;
b-3.other than alpha- or beta-;
c.Displacement / Substitution;
d.Rearrangement;
e.Oxidation-Reduction. 4257131年前2
4257131年前2 -
 入场22 共回答了18个问题
入场22 共回答了18个问题 |采纳率100%(1)What is a reaction mechanism and how does it differ from a balanced chemical equation?
Ans :
A reaction mechanism provides a detailed step by step description of a reaction.
A balanced equation provides the number of moles of both reactants and products but does not show how the reaction proceeds.
2)Define the following general types of chemical reactions:
a.Addition:
Ans:
Two reactants combine to yield one product.Addition frequently occurs with organic compounds at double ortriple bonds and occasionally at small-sized rings.
b.Elimination:
Ans:
Elimination (Decomposition) is the reverse of addition because two or more atoms or groups are removed from one molecules.
b-1.Beta Elimination:
Ans:
Beta elimination involves removal from adjacent atoms and always leads to an increase in multiple bonding.
b-2.Alpha Elimination:
Ans:
Alpha elimination is the removal from same atom and produces a carbene if this atom is carbon.
b-3.other than alpha- or beta-;
Ans:
If elimination is other than from adjacent atoms or the same atom,a ring results.e.g.Removal from atom once removed (gamma-elimination) affords a three-membered ring.
Decomposition,a kind of elimination,is the energy-catalyzed
breakdown of a molecule into at least two molecule without the
intervention of any other reagent.
c.Displacement / Substitution:
Ans:
This is the replacement of one group by another.When an H is displaced,the reaction is called substitution.
d.Rearrangement:
Ans:
Bonds are scrambled to form an isomer.
e.Oxidation-Reduction.
Ans:
Redox involves transfer to electrons or change in oxidation number.Oxidation of a C is signaled by a decreased in the number of its bonded H's or an increase in its number of bonds to other atoms such as C,O,N,Cl,Br,F,and S.
All these names refer only to the net reaction as given by the cemical equation.For multistep mechanisms,individul steps may be of different types.1年前查看全部
- 求解一道化学题目某硫酸铜溶液100ml,向溶液中侵入50克的铁片,待充分反应后,将铁片取出,洗净并低温下烘干(假设析出的
求解一道化学题目
某硫酸铜溶液100ml,向溶液中侵入50克的铁片,待充分反应后,将铁片取出,洗净并低温下烘干(假设析出的铜全部附在铁片上),称得为50.16克,求:1.)析出铜的质量为多少克? 没有1101年前3
没有1101年前3 -
 1234567mm0 共回答了16个问题
1234567mm0 共回答了16个问题 |采纳率93.8%设析出铜x克
CuSO4+Fe=Cu+FeSO4 △m
64 64-56
x 50.16-50
64÷x=(64-56)÷(50.16-50)
x=1.28(g)
答:析出铜1.28克.1年前查看全部
- 问一道化学题,急!某校化学兴趣小组用下图所示装置测定铜粉样品(含杂质碳)中铜的质量分数。 (1)装置A中发生反应的化
问一道化学题,急!
某校化学兴趣小组用下图所示装置测定铜粉样品(含杂质碳)中铜的质量分数。

(1)装置A中发生反应的化学方程式为 。
(2)装置B的作用是 。
(3) 装置C增重2g,装置D增重4.4g,装置D发生反应的化学方程式为 。
(4)样品中铜的质量分数为 。(结果保留一位小数)
(5)该实验存在一定误差,导致误差的原因有 。(写一条即可)
答案我知道,主要是求(4)的具体过程,应该是91.4%,我算不出来。
 钰泉1年前1
钰泉1年前1 -
 sailormu 共回答了13个问题
sailormu 共回答了13个问题 |采纳率92.3%C + O2 = CO2;D装置增重4.4g,说明含碳1.2g。
2Cu + O2 = 2CuO;C装置增重2g,说明增重氧的质量是:2+1.2=3.2g,
被氧化的铜的质量就是12.8g。
Cu%=12.8/(12.8+1.2)=91.4%1年前查看全部
- 解析一下这道化学题!下列反应可用化学方程式SO2+BR2+2H2O==H2SO4+2HBR表示的有()D1.把SO2气体
解析一下这道化学题!
下列反应可用化学方程式SO2+BR2+2H2O==H2SO4+2HBR表示的有()D1.把SO2气体通入溴水中,2 把液溴加入到SO2的水溶液中 3 把硫酸与NA2SO3反应得到的气体通入溴水中 4 把浓硫酸与溴化氢混合加热得到的红色气体通入水中A 123 B 134 C 123 D 1234
 枫_林_晚1年前2
枫_林_晚1年前2 -
 追水 共回答了19个问题
追水 共回答了19个问题 |采纳率89.5%首先1 3就不用说了
2的话,so2的溶液中应该是h2so3
4中生成的是br2 so2
所以选B1年前查看全部
- 5道化学题1.20°C时,在100g水中溶解11.1gK2SO4恰好达到饱和,此饱和溶液的密度为1.08g/cm³.将3
5道化学题
1.20°C时,在100g水中溶解11.1gK2SO4恰好达到饱和,此饱和溶液的密度为1.08g/cm³.将350mL此温度下的K2SO4饱和溶液用水稀释至500mL.计算稀释后溶液中K2SO4的物质的量的浓度.
2.将一定体积的密度为1.19g/cm³,质量分数为36.5%的浓盐酸稀释至50mL时,溶液中H+的物质的量浓度为1.02mol/L.计算所用浓盐酸的体积.
3.制取500g质量分数为14.6%的盐酸,需要标准状况下HCl气体的体积是多少?
4.在t°C时,ag某化合物饱和溶液的体积为bmL.将其蒸干后得到cg摩尔质量为dg/mol的不含结晶水的固体物质.计算t°C时此化合物的饱和溶液中溶质的物质的量的浓度.
5.将1.721gCaSO4·xH2O加热,使其失去全部结晶水,这时剩余固体物质的质量是1.361g.计算1mol此结晶水合物种所含结晶水的物质的量.
 七七yy1年前1
七七yy1年前1 -
 爱吾爱琴 共回答了18个问题
爱吾爱琴 共回答了18个问题 |采纳率100%1、稀释后溶液中K2SO4的物质的量的浓度
C={1.08*350*[11.1/(100+11.1)]/174}/0.5=0.434 mol/L
2、浓盐酸物质的量浓度=(1000*1.19*36.5%)/36.5=11.9 mol/L
所用浓盐酸的体积=1.02*50/11.9=26.8 mL
3、需要标准状况下HCl气体的体积=[(500*14.6)/36.5]*22.4=44.8 L
4、此化合物的饱和溶液中溶质的物质的量的浓度=1000c/db mol/L
5、x=[(1.721-1.361)/1.361]*(136/18)=21年前查看全部
- 那位天才帮我解决几道化学题下列含有非极性键的共价化合物( )(1)HCI (2)过氧化钠 (3)CH4 (4)C2H2下
那位天才帮我解决几道化学题
下列含有非极性键的共价化合物( )
(1)HCI (2)过氧化钠 (3)CH4 (4)C2H2
下列说法正确的有( )
A.氢的同位素氚和氘可以大量从海里提取
B.1个质子的相对质量和1个中子的相对质量相等
C.共价化合物可能含有离子键
D.某元素的游离态为固态,化合态有可变化合价,若能形成简单阳离子则一定是过渡金属元素 vicentvip1年前3
vicentvip1年前3 -
 鼠标点点 共回答了14个问题
鼠标点点 共回答了14个问题 |采纳率100%方法:两个关键:1非极性键2共价化合物.
答案:(4).(1)(3)极性键共价化合物.(2)离子化合物.
答案:D.A氚和氘可以从海里提取但不是大量,B几乎相等.C共价化合物不可能含有离子键,离子化合物可能含有共价键.1年前查看全部
- 如何巧记这两道化学公式mH2=金属的化合价乘以金属的质量除以金属的相对原子质量m金属的质量=mH2乘以金属的相对原子质量
如何巧记这两道化学公式
mH2=金属的化合价乘以金属的质量除以金属的相对原子质量
m金属的质量=mH2乘以金属的相对原子质量除以金属的化合价 雪舞恋风1年前3
雪舞恋风1年前3 -
 sfz9946 共回答了14个问题
sfz9946 共回答了14个问题 |采纳率85.7%不要总是要求自己记住一些现成的公式,学习化学不同于数学和物理,现成的公式也有,但是物质的变化更多,每一个公式都可能只对应于一种物质,这样,给自己的麻烦就会越来越大.
所以,换个角度,化学的基础是反应,首先,反应方程式的规律要熟悉,能迅速准确的书写.
其次,方程式下的计算格式是固定的,对任何反应都成立.
你的问题是,设金属R化合价+x,原子量R,那么这个金属与酸反应生成H2的方程式可以写成
2R + 2xHCl = 2RClx + xH2
2R---------------------2x
m金属------------------m(H2)
所以,2R/m金属=2x/m(H2)
就得到了你要记的这两个公式1年前查看全部
- 一道化学推断题 将紫黑色固体A加热,得到固体B和C,同时得到无色气体D;把带火星的木条伸入D中,木条重新燃烧;把C加入到
一道化学推断题
将紫黑色固体A加热,得到固体B和C,同时得到无色气体D;把带火星的木条伸入D中,木条重新燃烧;把C加入到另一种白色固体E中,混合加热,又得到D,并同时得到白色固体F.
⒈根据以上叙述,写出A、B、C、D、E、F物质的名称.
⒉写出E~F反应的文字表达式. 流浪的袋鼠1年前6
流浪的袋鼠1年前6 -
 马蹄莲猛鹿 共回答了22个问题
马蹄莲猛鹿 共回答了22个问题 |采纳率86.4%1.A高锰酸钾(KMnO4)
B锰酸钾(K2MnO4)
C二氧化锰(MnO2)
D氧气(O2)
E氯酸钾(KClO3)
F氯化钾(KCl)
2.氯酸钾与二氧化锰混合后加热,生成氧气和氯化钾.
反应式:
MnO2
KClO3-------O2+KCl1年前查看全部
- 几道化学题~~我会加分的1.下列是日常生活中常见的液体,其中属于溶液的是___,其中溶质分别是_、_、_;溶剂都是(填化
几道化学题~~我会加分的
1.下列是日常生活中常见的液体,其中属于溶液的是___,其中溶质分别是_、_、_;溶剂都是(填化学式)_.
①牛奶;②医用酒精;③刷墙用的石灰浆;④白醋;⑤食盐水;⑥油水.
2.实验室中有两瓶液体(标号为A与B),对两瓶液体的描述见下表:
液体A 液体B
颜色状态 无色透明液体 无色透明液体
静置 无沉淀,无分层 无沉淀,无分层
取少量蒸发 留下”白斑 ” 液体完全消失
⑴其中,最有可能是溶液的液体是___(填A或B)
⑵液体B是否有可能是溶液,如有可能,请列举一列____ 棍子大人1年前2
棍子大人1年前2 -
 F双 共回答了24个问题
F双 共回答了24个问题 |采纳率87.5%1、②④⑤;酒精、醋酸、氯化钠;H2O
2、A;酒精1年前查看全部
- 高手帮忙 急求这道化学题怎么做12.4g Na2R 含Na+ 0.4mol,则 Na2R的摩尔质量是_( ),R的相对原
高手帮忙 急求这道化学题怎么做
12.4g Na2R 含Na+ 0.4mol,则 Na2R的摩尔质量是_( ),R的相对原子质量为( ).含R的质量为1.6g的Na2R,其物质的量为( ). renyongyi1年前4
renyongyi1年前4 -
 cnhe6 共回答了22个问题
cnhe6 共回答了22个问题 |采纳率90.9%62 g/mol;16;0.1 mol
n(Na+)=0.4 mol
所以n(Na2R)=0.4/2=0.2 mol
Na2R的摩尔质量=12.4/0.2=62 g/mol
R的相对原子质量=62-23·2=16
m(R)=1.6 g,则n(Na2R)=n(R)=1.6/16=0.1 mol1年前查看全部
- 问一道化学问题求一条化学能转换为电能,一条电能转换为化学能的方程式.
 凤凰12151年前3
凤凰12151年前3 -
 鸲鹆 共回答了18个问题
鸲鹆 共回答了18个问题 |采纳率100%放电时,电极反应为:PbO2 + 4H+ + SO42- + 2e- = PbSO4 + 2H2O
负极反应:Pb + SO42- - 2e- = PbSO4
总反应:PbO2 + Pb + 2H2SO4 === 2PbSO4 + 2H2O (向右反应是放电,向左反应是充电)1年前查看全部
- 一道化学题,帮一帮.x,y,z均为短周期元素.若:x元素原子的最外层电子数为一:y元素原子的M层上有7个电子;z元素的原
一道化学题,帮一帮.
x,y,z均为短周期元素.若:x元素原子的最外层电子数为一:y元素原子的M层上有7个电子;z元素的原子最外层电子数是次外层电子数的3倍.
则由x,y,z组成的化合物的化学式不可能是
A XYZ2 (2为脚标) B XYZ4 (4为脚标) C XYZ D X2YZ4(2,4为脚标)
请讲解,谢谢 绝kou1年前7
绝kou1年前7 -
 hi5y76114 共回答了13个问题
hi5y76114 共回答了13个问题 |采纳率92.3%X可以是H,Li,Na Y必是Cl Z必定是O,
A 可以为HClO2,为亚氯酸,Cl化合价为+3
B可以为HClO4,高氯酸 Cl化合价为+7
C为HClO,也可以NaClO等,化合价为+1
其实就是告诉你 Y最外层电子数为7个,那么Y元素的最高化合价为+7,也就是考Cl的可能的化合价 Cl一般有-1.0.+1,+3.+5 +7 就是没有正6 所以D错1年前查看全部
- 一道化学题 求过程二氧化碳和一氧化碳混合气中碳元素的质量分数为40%,则混合气中一氧化碳的质量分数是多少?要过程
 scsnicole1年前1
scsnicole1年前1 -
 mryangxiao 共回答了16个问题
mryangxiao 共回答了16个问题 |采纳率93.8%设为x
x*12/28+(1-x)*12/44=0.4
x=49/60
近似为百分之811年前查看全部
大家在问
- 1英语翻译究竟要伤多少次,我会绝望?让我再看你一眼…我将要去一个没有悲伤的地方…翻译成英文
- 2世界还能活上多少年?地球的寿命!
- 3旅馆的英文
- 4论语十则中:“孔子认为认识事物的正确态度”的句子是不是“知之为知之,不知为不知.
- 5打火机里面的白色的水是什么?是一种液体嘛?还有打火机的燃烧过程是怎么形成的?.不好意思没分了!
- 6定义新运算:a△b=2a-3b-1.则[5△(-3)]△(-4)=?
- 7已知a2-ab=20,ab-b2=-12,则a2-b2=______,a2-2ab+b2=______.
- 8人们都爱秋天,爱她的天高气爽,爱她的云淡日丽,爱她的香飘四野.仿照上面的句子 续写一个句子 怎么写?
- 9如图是某地等高线地形图,读图回答9--11题.
- 10English is the common interview questions?Such as:"work expe
- 11nice,well,good,fine分别形容什么词?他们的区别.
- 12英语翻译他们为了纪念嫦娥,每当那天就给嫦娥月饼
- 13翻译许多人喜欢吃米线
- 14左边一个快字右边一个图画人像想增加一个爱心是什么成语
- 15正方形ABCD的中心M(3,0),点A,B位于顶点在原点,开口向右的抛物线上,C,D位于一条斜率为1/3的直线l上,试求
