标况下VL氯气与过量消石灰完全反应所得漂白粉中有效成分次氯酸钙的质量为
 梦妍11052022-10-04 11:39:541条回答
梦妍11052022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 海豚湾恋人SM 共回答了23个问题
海豚湾恋人SM 共回答了23个问题 |采纳率73.9%- 2CA(OH)2+2CL2=CACL2+CA(CLO)2+2H2O
44.8L 143
vl x=143*VL/44.8L - 1年前
相关推荐
- 将ag铁粉和bg硫粉混合均匀,在隔绝空气条件下充分加热.然后往反应产物中加入足量稀硫酸,将产生的气体完全燃烧,消耗标况下
将ag铁粉和bg硫粉混合均匀,在隔绝空气条件下充分加热.然后往反应产物中加入足量稀硫酸,将产生的气体完全燃烧,消耗标况下的空气VL,则V的取值范围是.已知O2在空气中的体积分数为0.25
 168cai1年前1
168cai1年前1 -
 gsh000000 共回答了16个问题
gsh000000 共回答了16个问题 |采纳率87.5%将ag铁粉和bg硫粉混合均匀,在隔绝空气条件下充分加热.然后让反应产物中加入兄弟 你也忒小气了这么个问题怎么也要给个十分来着 看懂了记得再加个分数1年前查看全部
- 19克碳酸钠和碳酸氢钠的固体混合物,与300ML的1摩尔每升的盐酸刚好反应完,该混合标况下的体积是多少.
 fengyun_b1年前1
fengyun_b1年前1 -
 werweruiouio123 共回答了18个问题
werweruiouio123 共回答了18个问题 |采纳率94.4%Na2CO3 xmol;NaHCO3 ymol
106x+84y=19
2x+y=0.3
x=y=0.1
V=4.48L1年前查看全部
- 化学中常温常压和室温、标况的区别
 风情阳光1年前3
风情阳光1年前3 -
 哈哈么么 共回答了17个问题
哈哈么么 共回答了17个问题 |采纳率64.7%常温常压是指 25度 1大气压 室温也一般指25度 标况是指0度1大气压1年前查看全部
- SO2与NaOH溶液的反应问题SO2+2NaOH=Na2SO3+H2OSO2+NaOH=NaHSO3若将标况下0.02m
SO2与NaOH溶液的反应问题
SO2+2NaOH=Na2SO3+H2O
SO2+NaOH=NaHSO3
若将标况下0.02moL的SO2通入100mL 0.3mL/L的NaOH 溶液中
则会发生哪些反应?
得到的产物又分别是哪些?并分别求出其物质的量 半夜三点半1年前1
半夜三点半1年前1 -
 sz星罗棋布 共回答了18个问题
sz星罗棋布 共回答了18个问题 |采纳率100%由题可知 2SO2+3NaOH=Na2SO3+H2O+NaHSO3
0.02 0.03
所以得到的产物又分别是Na2SO3,NaHSO3
;0.01molNa2SO3,0.01molNaHSO31年前查看全部
- 在标况下 将盛满氨气的试管倒置在水中,当试管中充满水时,立即取出,此时试管中氨水的物质的量浓度约为
 枫rain1年前1
枫rain1年前1 -
 karenfor 共回答了12个问题
karenfor 共回答了12个问题 |采纳率100%1/22.41年前查看全部
- 在标准状况下,某气体的密度是H2密度的16倍,则64g该气体在标况下的体积是多少?含有的分子数是多少?
 fhwny1年前1
fhwny1年前1 -
 健康逸园 共回答了22个问题
健康逸园 共回答了22个问题 |采纳率95.5%解题思路:根据阿伏伽德罗定律,密度之比就等于摩尔质量之比,在标准状况下:ρ=[m/V]=[n•M/n•22.4L/mol]=[M/22.4]g/L,根据密度关系计算出该气体的摩尔了质量,再计算出64g该气体在标况下的体积及分子数.在标准状况下:ρ=[m/V]=[n•M/n•22.4L/mol]=[M/22.4]g/L,摩尔质量与密度成正比,该气体的密度是H2密度的16倍,该气体的摩尔质量是氢气的摩尔质量的16,即该气体的摩尔质量为:2g/mol×16=32g/mol,则64g该气体在标况下的物质的量为:[64g/32g/mol]=2mol,
标准状况下2mol气体的体积为:22.4mol/L×2mol=44.8L;
2mol该气体的分子数为:2NA,
答:64g该气体在标况下的体积是44.8L,含有的分子数为2NA.点评:
本题考点: 气体摩尔体积.
考点点评: 本题考查了阿伏伽德罗定律,注意相同条件下,气体的密度之比等于摩尔质量之比,本题难度变大.1年前查看全部
- 100ml6mol/L的稀硝酸与1.92g铜反应,铜完全溶解.求1.生成气体在标况下为多少升?2反应后溶液中H+、NO3
100ml6mol/L的稀硝酸与1.92g铜反应,铜完全溶解.求1.生成气体在标况下为多少升?2反应后溶液中H+、NO3-的物质的量浓度?〔设反应前后溶剂体积不变〕要详细步骤啊!
 ii之舟1年前1
ii之舟1年前1 -
 13粉丝22 共回答了17个问题
13粉丝22 共回答了17个问题 |采纳率100%3 Cu + 8 HNO3稀 ==== 3 Cu(NO3)2 + 2NO↑ + 4 H2O
192g 8mol 3mol 44.8L
1.92g x y
得y=0.448L
生成气体在标况下为0.448L
因为1.92g铜只需于与0.08mol稀硝酸反应,所以本题稀硝酸过量
因为1mol稀硝酸中含有1molH+与1molNO3-
未反应稀硝酸的物质的量为:0.1LX6mol/L-0.08mol=0.52mol
反应生成稀硝酸物质的量为:x=0.03mol
H+的物质的量浓度:0.52mol÷0.1L=5.2mol/L
NO3-的物质的量浓度:(0.52mol+0.03mol)÷0.1L=5.5mol/L1年前查看全部
- 电解CuCl2溶液时,如果阴极上有1.6g铜析出,则阳极上产生气体的体积(标况)约为
 也是一个ii1年前1
也是一个ii1年前1 -
 今天不上班 共回答了18个问题
今天不上班 共回答了18个问题 |采纳率94.4%阴极产生的是CL2气体
阳极产生1mol铜,则阴极失去2mol电子,产生1molCl2
所以,阴极产生CL2的体积为
1.6/64*22.4=0.56L1年前查看全部
- 某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,则:
某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,则:
则:(1)该烃的相对分子量为( ) ;
(2)、确定该烃的分子式( );
(3)、如果该烃的一氯取代物有4种,写出该烃的结构简式( ).
(4)、烃A可由另一种烃B通过加成反应而制得,则烃B的可能的是( )(任写一种可能的结构简式) 玉素1年前1
玉素1年前1 -
 一点秋心 共回答了23个问题
一点秋心 共回答了23个问题 |采纳率100%(1)相对分子质量=1mol烃的质量=3.214g/L*22.4L/mol=71.9936≈72
(2)碳氢质量比为5:1.12x+y=72,12x=5y →X=5 Y=12 分子式:C5H12
(3)CH3CHCH2CH3
CH3
(4)CH3CH2CH=CHCH31年前查看全部
- 标况下,将22.4L氯化氢气体溶于635.5ml的水中,所得盐酸的密度为1.12g/cm3,计算所得盐酸的溶物质的量浓度
 lodosswar1年前2
lodosswar1年前2 -
 nonfish 共回答了19个问题
nonfish 共回答了19个问题 |采纳率94.7%22.4L氯化氢气体 的物质的量 为 22.4L / (22.4L/mol)=1mol
22.4L氯化氢气体 的质量 为 1mol x 36.5 g/mol =36.5g
溶解后的溶液总质量为 :36.5+ 635.5 =672 g
其体积为 672g / (1.12g/cm3)= 600 cm3 =600 ml
则所得盐酸的溶物质的量浓度c= 1mol/ 600ml =1.67mol/L1年前查看全部
- 标况下,mg气体A和ng气体B的分子数相等...
标况下,mg气体A和ng气体B的分子数相等...
RT,那么25摄氏度时,1kg气体A和1kg气体B的分子数目比为n:
认为大前提的结论m:n=MA:MB也是标况下推出的,光在25摄氏度时无法使用啊 ohjfgdfjk1年前1
ohjfgdfjk1年前1 -
 gzly001 共回答了19个问题
gzly001 共回答了19个问题 |采纳率89.5%对
n=m/M与温度无关1年前查看全部
- 一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m 3 (标况)某区域空气样品中所含CO的浓
一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m 3 (标况)某区域空气样品中所含CO的浓度进行测定,其方法和实验步骤如下:
①首先将空气样品通过盛有I 2 O 5 固体的加热管,反应生成CO 2 和I 2 (不考虑其他气体的反应);
②用30.0mL 5.00×10 - 5 mol·L - 1 过量的硫代硫酸钠溶液完全吸收反应所产生的碘,发生的反应为:I 2 +2S 2 O 3 2 - =2I - +S 4 O 6 2 -
③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10 -5 mol·L -1 的标准碘溶液进行滴定,滴定至终点,实验记录如下: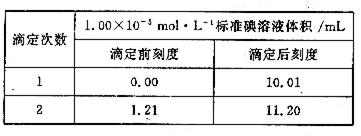
(1) 写出中反应的化学方程式:
(2) 计算该空气样品中CO的浓度,并说明符合几级标准。 cooler_1881年前1
cooler_1881年前1 -
 maginelee 共回答了13个问题
maginelee 共回答了13个问题 |采纳率61.5%⑴5CO + I 2 O 5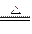 5CO 2 +I 2
5CO 2 +I 2
⑵ 3.85mg/m 3 ,符合一、二级标准
本题是将多步反应计算以“CO的浓度进行测定”为抓手,以氧化还原反应滴定为核心结合起来的试题。 (1)通过化合价升降和原子守恒即可配平。(2)具体计算过程如下:步骤②中过量的S 2 O 3 2 - 物质的量为n(S 2 O 3 2 - )=1.00×10 -5 mol·L -1 ×10 -2 L×2×2=4×10 -7 mol,则n(I 2 )=(1∕2)×(1.5×10 -6 mol-4×10 -7 mol)=5.5×10 -7 mol, n(CO)=5.5×10 -7 mol×5=27.5×10 -7 mol, CO的浓度为(27.5×10 -7 mol×28g∕mol) ∕0.02m 3 =385×10 -5 g∕m 3 即3.85mg/m 3 ,符合一、二级标准.1年前查看全部
- 标况下氢气氯气的混合气体为47.04L完全反应后产生氯化氢气体全溶于水得到20%的盐酸365g求氢气和氯气的质量
标况下氢气氯气的混合气体为47.04L完全反应后产生氯化氢气体全溶于水得到20%的盐酸365g求氢气和氯气的质量
帮帮忙啊 lazybone241年前1
lazybone241年前1 -
 明天会更好888 共回答了20个问题
明天会更好888 共回答了20个问题 |采纳率85%分析:20%的盐酸365克中含有HCl 73克,为2mol,所以根据方程式:
H2+Cl2 2HCl 反应掉的氢气和氯气各 1mol,体积为44.8升,剩余气体2.24升,可能为H2,也可能为Cl2,如果余气是H2,则共有H2 1.1mol,2.2g,如果余气是Cl2,则有H2 1mol,2g.1年前查看全部
- 已知在标况下112ml的某气体的质量为0.32g试计算这种气体的相对分子质量详细dian
 qwrtuioo1年前1
qwrtuioo1年前1 -
 齐鲁一客 共回答了13个问题
齐鲁一客 共回答了13个问题 |采纳率100%已知标况下每摩尔任何气体的体积都是22.4L
0.112/22.4=0.005mol
又知摩尔质量在数值上等于该物质的相对分子质量
所以该气体的相对分子量=0.32/0.005=64
如果对你有用,请点击页面上的好评给俺个支持哈.1年前查看全部
- 标况下,某物质已知的量为Y mol•L -1 .这里的“mol•L -1 ”是指( ) A.物质的量 B.气体的摩尔体
标况下,某物质已知的量为Y mol•L -1 .这里的“mol•L -1 ”是指( ) A.物质的量 B.气体的摩尔体积 C.物质的量浓度 D.物质的摩尔质量  sky-day1年前1
sky-day1年前1 -
 波扳妹 共回答了24个问题
波扳妹 共回答了24个问题 |采纳率100%A、mol是物质的量的单位,故A错误;
B、气体的摩尔体积单位是L/mol,故B错误;
C、物质的量浓度的单位是mol•L -1 ,故C正确;
D、物资的摩尔质量的单位是g/mol,故D错误.
故选C.1年前查看全部
- 高中化学,急(请有分析过程)标况下,下列各组气体等体积混合后得到的混合气体,其平均相对分子质量的48的是()1、氮气和氧
高中化学,急(请有分析过程)
标况下,下列各组气体等体积混合后得到的混合气体,其平均相对分子质量的48的是()
1、氮气和氧气
2、二氧化碳和氧气
3、二氧化硫和二氧化碳
4、碘化氢和氯气
标况下,下列各组气体等体积混合后得到的混合气体,其平均相对分子质量的48的是()
1、氮气和氧气
2、二氧化碳和氧气
3、二氧化硫和二氧化碳
4、碘化氢和氯气
问题补充:C会达到58吗?为什么?
D中会不会反应? jingling10121年前3
jingling10121年前3 -
 wu6871512 共回答了20个问题
wu6871512 共回答了20个问题 |采纳率90%最后一个D
当碘化氢和氯气混合之后会发生反应,生成碘单质和氯化氢,但是还会剩余一半体积的氯气:
2HI+Cl2=I2+2HCl
所以最终的气体组成是HCl:Cl2=2:1,经过简单的计算就可知平均相对分子质量是48左右
C应该不会达到58的吧,应该在54左右1年前查看全部
- 工况变标况 假设工况流量为2100 ,压力为0.18MPa ,温度为26摄氏度。那么标况流量是多少呢,计算公式是什么
 男窝米驮佛1年前1
男窝米驮佛1年前1 -
 ssik 共回答了19个问题
ssik 共回答了19个问题 |采纳率84.2%被测介质是空气吗1年前查看全部
- 有5g含杂质的碳酸氢钠固体(杂质不分解)加热至无气体生成,收集到生成气体标况下的体积为0.56L,
有5g含杂质的碳酸氢钠固体(杂质不分解)加热至无气体生成,收集到生成气体标况下的体积为0.56L,
问该碳酸氢钠固体的纯度为多少? melzy1年前1
melzy1年前1 -
 hhkgg 共回答了17个问题
hhkgg 共回答了17个问题 |采纳率82.4%2NaHCO3=Na2CO3+H2O+CO2
2 22.4
1/20 0.56
M(NaHCO3)=1*20*84=4.2g
碳酸氢钠固体的纯度为4.2/5=0.841年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L,问NO的
将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L,问NO的体积是多少L?NO2的体积为多少L?
 GamBol21年前2
GamBol21年前2 -
 mxl198683 共回答了14个问题
mxl198683 共回答了14个问题 |采纳率92.9%解题思路:n(Cu)=[32.64g/64g/mol]=0.51mol,n(NOx)=[11.2L/22.4L/mol]=0.5mol,铜失电子、氮原子得电子生成氮氧化物,该反应中得失电子守恒,根据转移电子守恒、氮原子守恒列方程式进行计算.n(Cu)=[32.64g/64g/mol]=0.51mol,n(NOx)=[11.2L/22.4L/mol]=0.5mol,设NO的物质的量为x,NO2的物质的量为y,根据氮原子守恒、电子守恒得
x+y=0.5
(5−2)x+(5−4)y=0.51×2
解得
x=0.26
y=0.24
所以V(NO)=0.26mol×22.4L/mol=5.824L,
V(NO2)=0.24mol×22.4L/mol=5.376L,
答:NO的体积是5.824L;NO2的体积为5.376L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学反应方程式的计算,守恒思想思想的运用为解答的关键,注意对应关系,题目难度不大.1年前查看全部
- 取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标况下放出气体体积为V L,则V的取值范
 lg00001年前1
lg00001年前1 -
 qiyueleilei 共回答了18个问题
qiyueleilei 共回答了18个问题 |采纳率88.9%设Na2O2 物质的量为xmol ,Al 物质的量为ymol
2Na2O2 + 2H2O === 4NaOH + O2↑ 2Al+2NaOH+2H2O === 2NaAlO2 + 3H2↑
相同质量的Al比Na2O2 产生的气体要多,所以当Al越多气体越多,但是固体完全溶解,因此当Al与Na2O2产生的NaOH恰好反应时气体最多.此时
78x+27y=a y=2x V=(x/2+3y/2)*22.4
相反,Al越少气体越少,当Al为0时,产生的气体最少,此时
V=22.4*x/2=22.4*a/2*78
需要注意是最大值可以取到,而最小值却不能取到.1年前查看全部
- 0.1molMNO2粉末与50ml的过氧化氢溶液标况下如图(1)实验放出其体体积
0.1molMNO2粉末与50ml的过氧化氢溶液标况下如图(1)实验放出其体体积
mol MnO2粉末加入50mL过氧化氢的溶液里(ρ=1.1g•L-1),在标准状况下,(1)实验时放出气体总体积是___60ml_______.(2)过氧化氢溶液的初始物质的量浓度为__________.第二问这样做哪里错了:C=n/v=m/M/m/密度=密度/M=1.1/34=0.032mol/l 我知道正确答案是0.11mol/l 但不知道我错在哪... 米套天1年前1
米套天1年前1 -
 liruilin 共回答了16个问题
liruilin 共回答了16个问题 |采纳率93.8%这个密度是指过氧化氢和水的平均密度,不是过氧化氢自己的密度,用此密度计算出来的质量是过氧化氢溶液的质量,包汉水,故不能拿来计算初始纯过氧化氢的质量.1年前查看全部
- 标况下,5.60L的甲烷和乙烯的混合气体通过足量的溴水,溴水质量增加了4.20g.试求混合气体中乙烯的质量分数.
 幸福雪儿21年前1
幸福雪儿21年前1 -
 weier50 共回答了22个问题
weier50 共回答了22个问题 |采纳率90.9%溴水吸收乙烯
所以乙烯的质量是4.2g
则乙烯的的物质的量为4.20g/(28g/mol)等于0.15mol
因为混合气体的物质的量为5.60L/22.4L/mol等于0.25mol
所以甲烷的物质的量为0.25mol减去0.15mol等于0.10mol
则甲烷的质量为0.10mol乘以16g/mol等于1.6g
最后乙烯在混合气体中的质量分数为4.20/(4.20+1.60)乘以100%=72.41%1年前查看全部
- 某烷烃的蒸汽密度是3.214g/L(标况),它进行取代反应后得到的一氯代物只有四种,
某烷烃的蒸汽密度是3.214g/L(标况),它进行取代反应后得到的一氯代物只有四种,
则该烷烃的结构简式为?其一氯代物的四种同分异构体为? lythink1年前1
lythink1年前1 -
 猫猫VSmaomao 共回答了18个问题
猫猫VSmaomao 共回答了18个问题 |采纳率77.8%22.4L约有72g所以该烷烃的相对分子质量是72.设分子式为CnH2n 2则12n+2n+2=72所以n=5所以分子式为C5H12又因为其一氯取代物有4种所以是2-甲基丁烷1年前查看全部
- 在标况下,二氧化碳和氧气混合气体500ml,通过灼热的催化层后,体积换算到标况为450ml(so2作为气体计算)
在标况下,二氧化碳和氧气混合气体500ml,通过灼热的催化层后,体积换算到标况为450ml(so2作为气体计算)
将此450ml气体通过氢氧化钠溶液后,溶液质量增加0.985g,计算原混合气体中二氧化硫的质量分数
好吧,是so3.我知道错了. 出道者1年前1
出道者1年前1 -
 cnfoxhu 共回答了17个问题
cnfoxhu 共回答了17个问题 |采纳率88.2%对应方程式 2SO2 +O2===2SO3 体积减少
2 1 3
X=33.3mL 500mL-450mL=50mL
那么溶液增重的就是剩余 SO2的质量
反应掉的SO2 0.033L/22.4L/mol*64g/mol=0.095g
原混合气体中二氧化硫的质量 0.985g+0.095g=1.08g1年前查看全部
- 某混合物是由二价金属和三价金属混合而成,共计7.8克.它与足量盐酸反应后,放出8.96升气体(标况),二价金属的相对原子
某混合物是由二价金属和三价金属混合而成,共计7.8克.它与足量盐酸反应后,放出8.96升气体(标况),二价金属的相对原子质量是三价金属相对原子质量的8/9倍,而且混合物中两种原子个数比为1:2 计算两种金属的相对原子质量
 newdaygary1年前1
newdaygary1年前1 -
 lingling19700101 共回答了16个问题
lingling19700101 共回答了16个问题 |采纳率100%设二价金属M,相对原子质量m,原混合物中物质的量n;三价金属N,相对原子质量9m/8,原混合物中物质的量2n
反应:
①M+2HCl=H2↑+MCl2
②2N+6HCl=3H2↑+2NCl3
氢气物质的量n=V/Vm=8.96/22.4=0.4mol
则:
(一)以原混合物质量为等量可得
m×n+(9m/8)×2n=7.8
(二)以H2物质的量为等量可得
n×1+2n×1.5=0.4
由(二)解得n=0.1,代入(一)解得m=24
因此M相对原子质量24(Mg),N相对原子质量27(Al)1年前查看全部
- 二氧化氮,氨气的混合气体共20ml(标况)在一定条件下充分反应后恢复到标况
二氧化氮,氨气的混合气体共20ml(标况)在一定条件下充分反应后恢复到标况
测得气体为13ml,则原混合气体中二氧化氮,氨气的物质的量之比为多少? redred20091年前1
redred20091年前1 -
 junjizidan 共回答了24个问题
junjizidan 共回答了24个问题 |采纳率91.7%8NH3 + 6NO2 ---> 7N2 + 12H2O
8.6.体积减少7体积
X.Y.20-13=7mL
反应的:NH3 X=8mL;NO2 Y=6mL
所以:(1)NO2:NH3=6:14=3:7(NH3过量);(2)NO2:NH3=12:8=3:2(NO2过量).1年前查看全部
- 由C/H/O元素组成的有机物A,摩尔质量为60,取6g与钠反应,生成标况下1.12升的氢气,有机物的分子式是那三种
 BDZHS1年前3
BDZHS1年前3 -
 zly168 共回答了23个问题
zly168 共回答了23个问题 |采纳率95.7%解析:
能与钠作用生成H2的物质有:羧酸、醇
氢气的物质的量 = 1.12L / 22.4L/mol = 0.05mol
(羟基、羧基)氢原子物质的量 = 0.05mol *2 = 0.1mol
有机物物质的量 = 6g / 60g/mol = 0.1mol
所以0.1mol该有机物含有0.1mol羟基或羧基,说明该物质为一元羧酸或一元醇
可能的结构:
O
||
乙酸(醋酸):CH3-C—OH
1-丙醇:CH3 - CH2 - CH2 -OH
2-丙醇:CH3 - CH - CH3
|
OH1年前查看全部
- 水煤气是一氧化碳和氧气组成 标况下 混合气体密度为1.339克每升 求混合气体中两种物质的体积比
水煤气是一氧化碳和氧气组成 标况下 混合气体密度为1.339克每升 求混合气体中两种物质的体积比
我想要具体步骤 或是解题思路 絮语和风1年前2
絮语和风1年前2 -
 uuID好难申请 共回答了21个问题
uuID好难申请 共回答了21个问题 |采纳率95.2%平均摩尔质量=1.339*22.4=30 g/mol
方法1:设CO为x mol,O2为y mol
30=(28x+32y)/(x+y)
x:y=1:1
方法2:十字交叉法
CO-----28---------------2
平均-----------30
O2------32---------------2
所以,物质的量之比,就是体积之比=2:2=1:1
另外,水煤气应该是CO与H2的混合气体,而不是氧气O21年前查看全部
- 高中化学计算题-摩尔质量在标况下,将VL A气体[摩尔质量为Mg/mol]溶于1L水中,所得溶液密度为dg/mol,则此
高中化学计算题-摩尔质量
在标况下,将VL A气体[摩尔质量为Mg/mol]溶于1L水中,所得溶液密度为dg/mol,则此溶液的物质的量浓度为[mol/L]? 草_禺1年前2
草_禺1年前2 -
 jjbbnn 共回答了24个问题
jjbbnn 共回答了24个问题 |采纳率100%(V/22.4)/((100+(V/22.4)*M)/d) n(A气体)=(V/22.4) M(溶液)=(M水+MA气体)=(100+(V/22.4)*M) 溶液的密度=dg/cm^3 所以V(溶液)=((100+(V/22.4)*M)/d) 所以C=(V/22.4)/((100+(V/22.4)*M)/d)1年前查看全部
- 在标况下,CO和CO2的混合气体共39.2L,质量为61g,则CO2为?mol,CO占总体积的?(百分数)
在标况下,CO和CO2的混合气体共39.2L,质量为61g,则CO2为?mol,CO占总体积的?(百分数)
其中两种气体物质的量之和为(1.75)mol, Shevchenko141年前1
Shevchenko141年前1 -
 一无是处的忧伤 共回答了12个问题
一无是处的忧伤 共回答了12个问题 |采纳率100%两种气体物质的量之和为(1.75)mol——对
原因:39.2L/(22.4L/mol)=1.75mol
设CO、CO2的体积分别为A、B
则A+B=39.2L
28A/22.4 +44B/22.4=61
解得A=22.4L B=16.8L
CO2为:16.8/22.4=0.75mol
CO占总体积的:22.4L /39.2L X100%=57.1%1年前查看全部
- 1mol某烃结构简式是1mol某烃在氧气中充分燃烧,需耗氧气179.2L(标况).它在光照的条件下与氯气反应生成三种不同
1mol某烃结构简式是
1mol某烃在氧气中充分燃烧,需耗氧气179.2L(标况).它在光照的条件下与氯气反应生成三种不同的一氯取代物.改烃的结构简式是 gloryofaa1年前4
gloryofaa1年前4 -
 不喜欢熬夜的狼 共回答了21个问题
不喜欢熬夜的狼 共回答了21个问题 |采纳率85.7%因为1mol该烃在氧气中充分燃烧消耗8mol氧气,所以分子式为C5H12
又它在光照的条件下与氯气反应生成三种不同的一氯取代物
所以结构简式为CH3-CH(CH3)-CH2-CH31年前查看全部
- Mg Al Zn混合物与足量稀硫酸反应,生成标况下H2 2.8升.则原金属混合物物质的量之和最少是多少摩尔
Mg Al Zn混合物与足量稀硫酸反应,生成标况下H2 2.8升.则原金属混合物物质的量之和最少是多少摩尔
详细 Brrda1年前1
Brrda1年前1 -
 lengsongxi 共回答了18个问题
lengsongxi 共回答了18个问题 |采纳率88.9%2.8升 就是 2.8/22.4 mol =0.125mol
1mol的镁生成1mol的氢气
1mol的铝生成1.5mol
1mol锌反应放出1mol氢气
很显然
答案是0.1251年前查看全部
- A、B同周期,B元素是该周期原子半径最大的元素,2.7gA与足量HCL反应放出标况下氢气3.36L
A、B同周期,B元素是该周期原子半径最大的元素,2.7gA与足量HCL反应放出标况下氢气3.36L
(1)A是 B是
(2)A、B最高价氧化物对应水化物相互反应的离子方程式为 想对大家说1年前8
想对大家说1年前8 -
 guanghua520 共回答了22个问题
guanghua520 共回答了22个问题 |采纳率86.4%算氢气是0.15mol 说明2.7gA能失去0.3mol电子,推算可能是Al 那么B原子半径最大的话,应该是Na 所以离子方程式为
Al(OH)3 +OH- ==AlO2- + 2H2O1年前查看全部
- 200ml某浓度的NaOH恰好与5.6l标况下的Cl2完全反应,计算:生成的NaClO的物质的量
200ml某浓度的NaOH恰好与5.6l标况下的Cl2完全反应,计算:生成的NaClO的物质的量
求生成的NaCl的质量。求该溶液中NaCl的物质的量浓度。 窗台上的面包1年前1
窗台上的面包1年前1 -
 小蚁飞 共回答了19个问题
小蚁飞 共回答了19个问题 |采纳率100%Cl2的物质的量:n(Cl2)=5.6/22.4 = 0.25mol
设生成的NaClO的物质的量为x mol,
NaCl的物质的量为Ymol
2NaOH+Cl2==NaClO+NaCl+H2O
-----------1--------1--------1
-----------0.25----X--------Y
则
1/ 0.25 = 1 / X 与 1 / 0.25 = 1 / Y
得
X=0.25mol
Y=0.25mol
所以;
生成的NaClO的物质的量0.25mol
生成的NaCl的质量为:0.25 * 58.5 = 14.625 克
2.
溶液体积=200ml = 0.2 L
所以
该溶液中NaCl的物质的量浓度为:
0.25 / 0.2 L = 1.25 mol/ L1年前查看全部
- PH咋算啊!(1),一块表面有氧化钠的金属钠5.4克,放入1000ml水中,放出1.12L氢气(标况),将此溶液稀释为2
PH咋算啊!
(1),一块表面有氧化钠的金属钠5.4克,放入1000ml水中,放出1.12L氢气(标况),将此溶液稀释为2L,此溶液的PH值( ).(2),PH=2的溶液其H+是PH=4的溶液的多少倍?将PH=2的盐酸和PH=10的氢氧化钠混合制PH=7,盐酸和氢氧化钠溶液的体积比?自学者 Paradise_flower1年前1
Paradise_flower1年前1 -
 younijiujingcai 共回答了12个问题
younijiujingcai 共回答了12个问题 |采纳率100%PH值就是氢离子,或氢氧根离子的浓度的对数,但我的对数学的太烂了,现在都忘的差不多了,
你自己算下吧1年前查看全部
- Cl2能将100ml0.1mol/l Na2SO3氧化成Na2SO4 求标况下Cl2的体积
 紫凝曦_amigo1年前1
紫凝曦_amigo1年前1 -
 独自感受 共回答了23个问题
独自感受 共回答了23个问题 |采纳率100%Cl2+Na2SO3+H2O=Na2SO4+2HCl
x 0.1mol
这两种物质以1比1的物质的量反应,所以x=0.1mol
Vcl2=22.4L/mol*0.1mol=2.24L1年前查看全部
- 11.9克铝,铁,铜,混合物,与足量的稀硝酸反应生成标况下一氧化氮,6.72升再加入足量氢氧化钠溶液是金属离子完全变成沉
11.9克铝,铁,铜,混合物,与足量的稀硝酸反应生成标况下一氧化氮,6.72升再加入足量氢氧化钠溶液是金属离子完全变成沉淀,问生成沉淀的值是,
 fjljxc1年前3
fjljxc1年前3 -
 guoxue 共回答了18个问题
guoxue 共回答了18个问题 |采纳率83.3%设铝,铁,铜的物质的量分别为,X,Y,Z mol,设生成的沉淀质量为 M 克
因为 铝,铁,铜,混合物 质量为 11.9克
所以
27X + 56Y + 64Z = 11.9 -----------------(1)
生成一氧化氮的物质的量为:6.72 / 22.4 = 0.3 mol
2Al + 8HNO3 (稀)== 2Al(NO3)3 + 2NO↑ + 4H2O
2------------------------------------------2
Xmol-------------------------------------Xmol
所以铝生成 Xmol NO
Fe + 4HNO3 == Fe(NO3)3 + NO↑ + 2H2O
1-------------------------------------1
Y mol--------------------------------Y mol
所以Fe生成 Ymol NO
3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑+ 4H2O
3---------------------------------------------2
Z mol---------------------------------------(2/3) Z mol
所以Cu生成(2/3) Z molNO
所以 X + Y + (2/3) Z = 0.3 -------------(2)
生成沉淀的物质为:Al(OH),Fe(OH)3,Cu(OH)2
所以
沉淀的质量为:
78X + 107Y + 98Z = M ----------------(3)
所以只有结合三个方程式 求出M 即可
(3)式 - (1)式 得
51X + 51 Y + 34Z = (M - 11.9 ) ----------(4)
将(4)式两边同时除以51得
X + Y + (2/3) Z = (M - 11.9 ) / 51 -------------(4)
这时不妨看看(2)式 就可以得到
(M - 11.9 ) / 51 = 0.3
得
M=27.2 克
所以沉淀的质量是 27.2 克1年前查看全部
- 8.足量的锌与下列溶液反应,在标况下产生H2体积最大的是( ).A.500 mL 0.2 mol/L的盐酸 B.100
8.足量的锌与下列溶液反应,在标况下产生H2体积最大的是( ).A.500 mL 0.2 mol/L的盐酸 B.100 mL 3 mol/C
8.足量的锌与下列溶液反应,在标况下产生H2体积最大的是( A.500 mL 0.2 mol/L的盐酸 B.100 mL 3 mol/C.200 mL 18.4 mol/L的硫酸 D.300 mL 1 mol/L的硫酸
请说出具体解法
为什么C答案不能制得H2?怎么算? 刺耳的阳光1年前4
刺耳的阳光1年前4 -
 爱就一个人 共回答了23个问题
爱就一个人 共回答了23个问题 |采纳率91.3%选D,比较氢离子物质的量.A是0.1mol,B是0.3mol,C氧化产生SO2而不产生氢气,B是0.6mol.1年前查看全部
- 实验室需要标况下11.2L的CO2,现用CaCO3与250ml足量稀盐酸反应怎么以物质的量来求
 怕输才不怪1年前3
怕输才不怪1年前3 -
 紧张的可怜人 共回答了20个问题
紧张的可怜人 共回答了20个问题 |采纳率90%CaCO3 + 2HCl = CaCl2 + H2O + CO2
2mol 1mol
M×250/1000 11.2/22.4
计算M就是要用的HCl的摩尔浓度.1年前查看全部
- 四种气体密度比较在标况下的四种气体:一,6.72LCH4 二,0.5NA个HCl分子 三,13.6gH2S 四,0.2m
四种气体密度比较
在标况下的四种气体:一,6.72LCH4 二,0.5NA个HCl分子 三,13.6gH2S 四,0.2molNH4,它们的密度从大到小排序 321456987yun1年前2
321456987yun1年前2 -
 大脸毛a 共回答了10个问题
大脸毛a 共回答了10个问题 |采纳率100%CH4的密度约为0.71g/L;HCl的密度约为1.63g/L;H2S的密度约为1.52g/L;NH4的密度约为0.76g/L.所以:HCl>H2S>NH3>CH4.(氨气你写错了)
1楼说的是在物质的量相等的情况下分子量大的密度大.1年前查看全部
- 两种有机物以任意比例混合,一定条件下aL(标况)足量O2中充分燃烧,再将剩余的氧气和全部的生成物通过足量的过氧化钠,得到
两种有机物以任意比例混合,一定条件下aL(标况)足量O2中充分燃烧,再将剩余的氧气和全部的生成物通过足量的过氧化钠,得到气体的体积大于aL(标况),下列组合中符合此条件的是
A、CH4 C2H4
B、CH3OH CH3COOH
C、C6H6 HCOOCH3
D、HCOOH HOCH2CH2COOH 一棹春风1年前1
一棹春风1年前1 -
 低音提琴 共回答了29个问题
低音提琴 共回答了29个问题 |采纳率93.1%答案:D
答案解析:试题分析:根据题意可知,反应前后氧气的体积是不变的,这说明反应的实质相当于是CO+Na2O2=Na2CO3、H2+Na2O2=2NaOH.所以要满足条件,则物质的组成必须满足(CO)n(H2)m,因此根据物质的化学式可知,选项AC不可能,B中以任意比例混合均可以.D中二者按照1:1混合即可,所以答案选D.1年前查看全部
- 为什么标况下M=dg/cm3×103·22.4L/mol
 xpdog1年前1
xpdog1年前1 -
 fense123 共回答了18个问题
fense123 共回答了18个问题 |采纳率100%M=m/n
n=V/22.4L/mol(V的单位是L)
M=m/(V/22.4L/mol)=m/V X 22.4L/mol = m/(1000V') X 22.4L/mol(V'单位为mL)1年前查看全部
- 标况下,将20L,CO2和CO的混合气体通过足量的NA2O2粉末,充分反应后,在相同情况下气体体积减少至16L,原混合其
标况下,将20L,CO2和CO的混合气体通过足量的NA2O2粉末,充分反应后,在相同情况下气体体积减少至16L,原混合其中CO的体积是?
答案是12L.可是, 水木白1年前2
水木白1年前2 -
 错了就过了 共回答了21个问题
错了就过了 共回答了21个问题 |采纳率90.5%设二氧化碳体积x L
2 CO2+2 Na2O2=2 Na2CO3+O2
2 1
x x/2
减少的体积是x/2 L =16
x=81年前查看全部
- 标况下22.4升氧气和臭氧组成的混合物中总原子数为什么是2Na至3Na?怎么算?要详解
 人淡如菊_CC1年前1
人淡如菊_CC1年前1 -
 永远娜娜 共回答了18个问题
永远娜娜 共回答了18个问题 |采纳率94.4%用极值法,当22.4升全是O2时是2Na,当22.4升全是臭氧时是3Na,因为是混合物所以是在2Na至3Na1年前查看全部
- 有关NA的计算Na与Na2O混合物10.8g将它投入100g水中反应完全后收集到标况下氢气224ml求(1)未被氧化的金
有关NA的计算
Na与Na2O混合物10.8g将它投入100g水中反应完全后收集到标况下氢气224ml求(1)未被氧化的金属的质量(2)被氧化成Na2O的金属的质量(3)反应后溶液中溶质的质量分数和物质的量浓度(反应后溶液密度为dg/cm^3) 善上若水1年前1
善上若水1年前1 -
 不是一天两天的事 共回答了20个问题
不是一天两天的事 共回答了20个问题 |采纳率85%都不想说了,这么简单
给你个思路
把H2转成Mol
2Na----H21年前查看全部
- 有关Na的计算题由钠、镁、铝三种金属中的两种组成的混合物共10克,跟足量的盐酸反应,生成0.5克标况下的氢气,则此混合物
有关Na的计算题
由钠、镁、铝三种金属中的两种组成的混合物共10克,跟足量的盐酸反应,生成0.5克标况下的氢气,则此混合物中必定含有( )
A.AL
B.MA
C.NA
D.都不可能含有 fengyun_haha1年前3
fengyun_haha1年前3 -
 sky5217 共回答了18个问题
sky5217 共回答了18个问题 |采纳率77.8%选C
列方程式``
2Al+6HCl=2AlCl3+3H2↑
Mg+2HCl=MgCl2+H2↑
2Na+2HCl=2NaCl+H2↑
分三步``假设这个物质全为一种金属`
根据第一个方程``把氢质量为0.5g带进去算``
算出来Al质量为4.5g
根据第二个``算出来Mg质量为6g``
第三个``算出来Na质量为11.5g``
那就想``这混合物得有10克啊``你要是Al和Mg``怎么平均也不能为10克啊```所以必须得有Na在里面啊```
所以选C``
回答完毕``谢谢``
如有不懂就继续问哈```^-^``1年前查看全部
- 2mol/L盐酸50克和足量Zn反应,在标况下得到H2多少L
 yongzhougirl1年前1
yongzhougirl1年前1 -
 喜欢黑夜静 共回答了22个问题
喜欢黑夜静 共回答了22个问题 |采纳率90.9%0.5
2hcl+zn=zncl2+h2
2 1
2mol x1年前查看全部
- 1.06克某有机化合物A完全燃烧后,得到1.79LCO2气体(标况)和0.90克H2O,该有机物对空气相对密度是3.66
1.06克某有机化合物A完全燃烧后,得到1.79LCO2气体(标况)和0.90克H2O,该有机物对空气相对密度是3.66
求分子式 正米小雪1年前2
正米小雪1年前2 -
 mmenghuang2000 共回答了16个问题
mmenghuang2000 共回答了16个问题 |采纳率93.8%分子式是C8H10.
CO2的物质的量是n=V/Vm=1.79/22.4=0.08mol
H2O的物质的量是n=m/M=0.9/18=0.05mol
1个CO2含有1个C原子,所以C原子的物质的量是0.08mol,质量是0.08*12=0.96g
1个H2O含有2个H原子,所以H原子的物质的量是0.1mol,质量是0.1*1=0.1g
C和H元素的质量和是0.96+0.1=1.06g,所以该物质只含有C、H元素,没有O元素,最简式是C8H10.
相对密度比等于相对分子质量之比,空气的平均相对分子质量为29,有机物的相对分子质量为3.66*29=106,(8*12+10)x=106,x=1,所以化学式是C8H10.1年前查看全部
- 在标况下,2.8L某气体的质量是3.5g,已知该气体是由碳和氢两种元素组成的化合物,且化合物中碳元素的质量分数为85.7
在标况下,2.8L某气体的质量是3.5g,已知该气体是由碳和氢两种元素组成的化合物,且化合物中碳元素的质量分数为85.7%,氢元素的质量分数为14.3%,求该气体的分子式?
 sneozt1年前1
sneozt1年前1 -
 出神入化者 共回答了13个问题
出神入化者 共回答了13个问题 |采纳率100%该气体物质的量为0.125mol,所以其分子量应该为28,只含有碳氢元素.所以为气态烃,碳元素的质量分数:氢元素的质量分数=85.7%:14.3%=6:1,即C:H=6:1,设有x个C,y个H则有
6:1=12x:y,且有12x+y=28解得 x=2 y=4
所以为C2H4.1年前查看全部
大家在问
- 1三分之一除以二分之一的意义是什么
- 2如图,已知圆o的直径为10,点p是圆O内一点,且op为3,则过点p且长度为整数的玄的条数
- 3二分之一除以三分之一表示什么意思
- 4新制氯水中,铁三离子,硝酸根.氯离子.铝离子共存.可是新制氯水中的次氯酸根即有氧化性也有还原性,而且
- 5学术英语翻译 见图3-5
- 6这是一封用蓝墨水写的信 用英语翻译
- 7几个导体并联起来,总电阻比任何一个导体的电阻都 (填大或小),因为这相当与增加了导体的 .
- 8若3能整除x,x又能整除12,求x的值.
- 9厨房这个词的英文怎样写讨回公道让他
- 10Aa和aa杂交是不是相对性状的杂交?
- 11盐酸与什么物质生成黄色溶液
- 12根据方程X/5=X、6+1自编一道应用题
- 13纯粹近义词
- 14硫化镁是多种颜色吗镁与二氧化硫反应生成硫化镁
- 15英语翻译1.我不喜欢卡通电影.(翻译成英文)2.2.你喜欢体育新闻吗?(翻译成英文)
