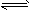500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ
 sandy7811032022-10-04 11:39:541条回答
sandy7811032022-10-04 11:39:541条回答500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热38.6kJ,其热化学方程式为: △H=-38.6kJ/mol 问为什么错?
/>

已提交,审核后显示!提交回复
共1条回复
 兰特80 共回答了22个问题
兰特80 共回答了22个问题 |采纳率77.3%- 反应是可逆反应,反应物没有完全参与反应,所以放出的热量不是反应热
- 1年前
相关推荐
- (1)3FeCl2+4H2O(g)=500℃Fe3O4+6HCl+H2 (2) 2Fe3O4+3Cl2+12HCl=10
(1)3FeCl2+4H2O(g)=500℃Fe3O4+6HCl+H2 (2) 2Fe3O4+3Cl2+12HCl=100℃6FeCl3+6H2O+O2 (3)2FeCl3=300℃2FeCl2+Cl2↑ 合并成一个总反应式 并且指出是放热还是吸热
 tinalili-rose1年前1
tinalili-rose1年前1 -
 as1481 共回答了17个问题
as1481 共回答了17个问题 |采纳率100%(1)乘以2加(2)加(3)乘以3即可得总方程式为2H2O=2H2+O2,由于氢气在氧气中燃烧放热,所以该总反应一定是吸热反应.该反应即为了得到氢气而设计的1年前查看全部
- 温度为500℃时,反应4NH3+5O2⇌4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol
温度为500℃时,反应4NH3+5O2⇌4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
A. v(NO)=0.08mol/(L•s)
B. v(O2)=0.01mol/(L•s)
C. v(NH3)=0.002mol/(L•s)
D. v(H2O)=0.004mol/(L•s) stec_whq1年前5
stec_whq1年前5 -
 Anglesmile 共回答了16个问题
Anglesmile 共回答了16个问题 |采纳率93.8%解题思路:在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则v(NO)=
=0.002mol/(L•s),结合反应速率之比等于化学计量数之比来解答.0.3mol 5L 30s 在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则v(NO)=
0.3mol
5L
30s=0.002mol/(L•s),
A.v(NO)=0.002mol/(L•s),故A错误;
B.v(O2)=0.002mol/(L•s)×[5/4]=0.0025mol/(L•s),故B错误;
C.v(NO)=v(NH3)=0.002mol/(L•s),故C正确;
D.v(H2O)=0.002mol/(L•s)×[6/4]=0.006mol/(L•s),故D错误;
故选C.点评:
本题考点: 化学反应速率和化学计量数的关系.
考点点评: 本题考查化学反应速率与化学计量数的关系,为高频考点,把握反应速率的计算及数量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.1年前查看全部
- 在500℃.1.01*10^5 pa条件下,将SO2 与O2按体积2:1充入一密闭容器中,达到平衡后,SO3 的体积百分
在500℃.1.01*10^5 pa条件下,将SO2 与O2按体积2:1充入一密闭容器中,达到平衡后,SO3 的体积百分含量为91%,
求平衡时SO2和O2的体积百分含量 绿豌豆1年前1
绿豌豆1年前1 -
 筷子鱼 共回答了23个问题
筷子鱼 共回答了23个问题 |采纳率82.6%算法一:标准算法
2SO2 + O2 =可逆= 2SO3
起始 2 1 0
反应 2n n 2n
平衡 2-2n 1-n 2n
达到平衡后,SO3 的体积百分含量=2n/(2-2n+1-n+2n)=2n/(3-n)=91%
解得n=0.938
O2的体积百分含量=(1-n)/(3-n)=3%
SO2=6%
算法2:V(O2)+V(SO2)=1-V(SO3)=1-91%=9%
V(SO2)=2V(O2),所以V(SO2)=6%,V(O2)=3%1年前查看全部
- 500℃时,在钒触媒的作用下,某密闭容器中反应 达到化学平衡状态时的标志,错误的是 [
500℃时,在钒触媒的作用下,某密闭容器中反应 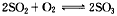 达到化学平衡状态时的标志,错误的是[ ]
达到化学平衡状态时的标志,错误的是[ ]A.SO 2 的消耗速率等于SO 3 的生成速率
B.SO 3 的生成速率等于O 2 生成速率的2倍
C.容器中气体总物质的量不随时间发生改变
D.容器中的压强不随时间发生改变 sdlyt11年前1
sdlyt11年前1 -
 guosong33 共回答了18个问题
guosong33 共回答了18个问题 |采纳率94.4%A1年前查看全部
- 在常压和500℃时把O2和SO2按1:2体积比混合,如果混合前O2为10mol,平衡混合气体中SO3占总体积的91%.求
在常压和500℃时把O2和SO2按1:2体积比混合,如果混合前O2为10mol,平衡混合气体中SO3占总体积的91%.求:
(1)平衡时有多少摩尔O2转化?
(2)混合气体中SO2的体积分数是多少?
(3)SO2的转化率是多少? yy052620731年前1
yy052620731年前1 -
 擎天小猫 共回答了23个问题
擎天小猫 共回答了23个问题 |采纳率95.7%解题思路:令参加反应的氧气的物质的量为nmol,根据三段式解题法,用n表示求出混合气体各组分物质的量的变化量、平衡时各组分的物质的量.根据平衡时SO3占总体积的91%,列方程计算n值.
(1)根据平衡时SO3占总体积的91%,列方程计算n值;
(2)根据体积分数的定义计算;
(3)根据转化率的定义计算.令参加反应的氧气的物质的量为nmol,则
2SO2(g)+O2(g)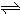 2SO3(g).
2SO3(g).
开始(mol):20 100
变化(mol):2n n 2n
平衡(mol):20-2n10-n 2n
(1)平衡时SO3占总体积的91%,所以[2n/20−2n+10−n+2n]×100%=91%,
解得n=9.38
答:平衡时有9.38molO2转化;
(2)混合气中SO2的体积分数为[20−2×9.38/30−9.38]×100%=6%,答:混合气中SO2的体积分数为6%;
(3)SO2的转化率为[2×9.38/20]×100%=93.8%,答:SO2的转化率为93.8%.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡计算、等效平衡等,难度不大,注意基础知识的掌握与三段式解题法运用.1年前查看全部
- 下列热化学方程式书写正确的是( ) A.2SO 2 +O 2 500℃ V 2 O 5 2SO 3 △H=-196.6
下列热化学方程式书写正确的是( ) A.2SO 2 +O 2
2SO 3 △H=-196.6 kJ/mol500℃ V 2 O 5 B.C(s)+O 2 (g)═CO 2 (g)△H=+393.5 kJ/mol C.2H 2 (g)+O 2 (g)═2H 2 O(l)△H=-571.6 kJ D.H 2 (g)+
O 2 (g)═H 2 O(l)△H=-285.8 kJ/mol1 2  大王宝宝1年前1
大王宝宝1年前1 -
 huangzhanglei758 共回答了16个问题
huangzhanglei758 共回答了16个问题 |采纳率93.8%A、反应的热化学方程式为:2SO 2 (g)+O 2 (g)
500℃
V 2 O 5 2SO 3 (g)△H=-196.6 kJ/mol,故A错误;
B、反应的热化学方程式为:C(s)+O 2 (g)═CO 2 (g)△H=-393.5 kJ/mol,故B错误;
C、反应的热化学方程式为:2H 2 (g)+O 2 (g)═2H 2 O(l)△H=-571.6 kJ/mol,故C错误;
D、反应的热化学方程式为:H 2 (g)+
1
2 O 2 (g)═H 2 O(l)△H=-285.8 kJ/mol,故D正确;
故选D.1年前查看全部
- 电灯泡内充有氦氩混合气体,如果要使电灯泡内的混合气体在500℃时的压强不超过一个大气压,则在20℃的室温下充气,电灯泡内
电灯泡内充有氦氩混合气体,如果要使电灯泡内的混合气体在500℃时的压强不超过一个大气压,则在20℃的室温下充气,电灯泡内气体压强至多能充到多少个大气压?
 wyz95271年前1
wyz95271年前1 -
 bvks 共回答了22个问题
bvks 共回答了22个问题 |采纳率68.2%解题思路:电灯泡内气体经历等容过程,根据查理定律列式求解即可.气体经历等容过程,根据查理定律,有:
P0
T1=
P
T2
解得:
P
P0=
T2
T1=
20+273
500+273=0.38
答:在20℃的室温下充气,电灯泡内气体压强至多能充到0.38个大气压.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题关键是明确封闭气体的变化特点,然后选择恰当的气体实验定律列式求解,基础题目.1年前查看全部
- 已知2SO2(g)+O2(g )⇌2SO3(g)(正反应放热),若在500℃和催化剂的作用下,该反应在容积固定
已知2SO2(g)+O2(g )⇌2SO3(g)(正反应放热),若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
A. 若降低温度,可以加快反应速率
B. 使用催化剂是为了加快反应速率
C. 在上述条件下,SO2能完全转化为SO3
D. 达到平衡时,SO2和SO3的浓度一定相等 帮主的最爱1年前1
帮主的最爱1年前1 -
 八格丫鲁冰花 共回答了17个问题
八格丫鲁冰花 共回答了17个问题 |采纳率70.6%解题思路:A、根据降低温度,反应速率减慢;
B、根据催化剂可以加快反应速率;
C、根据可逆反应不可能完全进行到底;
D、根据平衡状态时的标志来判断;A、因降低温度,反应速率减慢,故A错误;
B、因催化剂可以加快反应速率,故B正确;
C、因可逆反应不可能完全进行到底,所以SO2不能完全转化为SO3,故C错误;
D、因平衡状态时SO2和SO3的浓度不变,而不是相等,故D错误;
故选:B.点评:
本题考点: 化学反应速率的影响因素;化学反应的可逆性;化学平衡状态的判断.
考点点评: 本题主要考查了影响化学反应速率的因素以及化学平衡的判断,难度不大.1年前查看全部
- 坩埚需不需要预热,直接放入500℃的马弗炉中,行不行?会不会裂掉.
 Noughts1年前3
Noughts1年前3 -
 xajh6666 共回答了16个问题
xajh6666 共回答了16个问题 |采纳率93.8%不需要,以前做试验,空坩埚都要先衡重.坩埚在马弗炉中高温灼烧,冷却后称重,再烧,冷却,称重,再烧……直至两次称重一致(误差范围内).1年前查看全部
- 在常压和500℃条件下,等物质的量AgO2,Fe(OH)3,NH4HCO3,NaHCO3完全分解,所得气体体积依次是V1
在常压和500℃条件下,等物质的量AgO2,Fe(OH)3,NH4HCO3,NaHCO3完全分解,所得气体体积依次是V1,V2,V3,V4.体积大小顺序正确的是?
 股灵通1年前1
股灵通1年前1 -
 徽州白开水 共回答了15个问题
徽州白开水 共回答了15个问题 |采纳率73.3%32411年前查看全部
- 一根烧红的铁钉,温度是500℃,出多少热量?[已知铁的比热容C铁=0.46×10 3J/(㎏.℃
一根烧红的铁钉,温度是500℃,出多少热量?[已知铁的比热容C铁=0.46×10 3J/(㎏.℃
一根烧红的铁钉,温度是500℃,出多少热量?[已知铁的比热容C铁=0.46×10 3J/(㎏.℃)] xzm09711年前0
xzm09711年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知酒精灯火焰的温度约为500℃。利用下图装置,验证达到可燃物着火点是燃烧的条件之一,
已知酒精灯火焰的温度约为500℃。利用下图装置,验证达到可燃物着火点是燃烧的条件之一,
我认为应该设计对照实验,一个着火点大于500,另一个小于500,可是答案为什么是MN
 ernst1年前1
ernst1年前1 -
 sam1127 共回答了21个问题
sam1127 共回答了21个问题 |采纳率81%你没理解题意,这个实验中共试验了4种材料,2种无法燃烧,2种可然。
问题问的是其中的两种可燃物是什么。
不是问为了设计这个实验,要选择哪两种材料。1年前查看全部
- 可逆反应 N2(g)+3H2(g)⇌2NH3(g),在500℃时,将2molN2 和2molH2冲入
可逆反应 N2(g)+3H2(g)⇌2NH3(g),在500℃时,将2molN2 和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
A. 0.01mol•L-1
B. 0.02mol•L-1
C. 0.05mol•L-1
D. 0.15mol•L-1 呀囡峰峰1年前2
呀囡峰峰1年前2 -
 8z86byz 共回答了21个问题
8z86byz 共回答了21个问题 |采纳率95.2%解题思路:可逆反应不能进行到底,利用极限转化法计算出氨气的最大浓度即可解答.该反应为可逆反应,可逆反应不能进行到底.假设反应完全进行,由化学方程式 N2(g)+3H2(g)⇌2NH3(g),知2molN2 过量,因而2molH2 完全反应生成[4/3]mol NH3,故NH3的浓度肯定小于
4
3mol
10L=0.013mol/L,不可能达到0.15mol•L-1,故选D.点评:
本题考点: 化学反应的可逆性.
考点点评: 本题考查可逆反应的特点,难度不大,掌握化学方程式相关的计算是解题的关键.1年前查看全部
- (2010•天津一模)在500℃时,向甲容器中充入1mol SO3,向相同容积的乙容器中充入1mol
(2010•天津一模)在500℃时,向甲容器中充入1mol SO3,向相同容积的乙容器中充入1mol SO2和0.5mol O2.若甲容器保持容积不变,乙容器保持压强不变,分别达到平衡,下列说法正确的是( )
A.平衡时容器内的压强:甲>乙
B.平衡时容器内的压强:乙>甲
C.平衡时容器内O2的体积分数:乙>甲
D.平衡时容器内SO3的体积分数:甲>乙 fyyffyyf1年前0
fyyffyyf1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知2A(g)+B(g)⇌2C(g),向容积为1L的密闭容器中加入0.050molA和0.025molB,在500℃时充
已知2A(g)+B(g)⇌2C(g),向容积为1L的密闭容器中加入0.050molA和0.025molB,在500℃时充分反应,达平衡后测得c(C)=0.040mol.L -1 ,放出热量Q 1 kJ.
(1)能说明上述反应已经达到化学平衡状态的是______(填字母编号)
a.v(C)=2v(B)
b.单位时间内生成2molA的同时消耗1molB
c.容器内压强保持不变d.容器内气体的密度保持不变
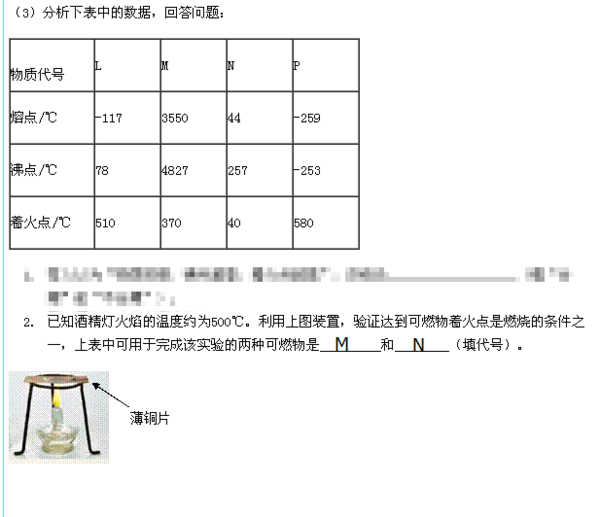
(2)若在相同的容器中只加入0.050molC,500℃时充分反应达平衡后,吸收热量Q 2 kJ,则Q 1 与Q 2 之间的关系式可表示为______(用含Q 1 、Q 2 的代数式表示).
(3)500℃时,上述反应的化学平衡常数K=______.
(4)已知K(300℃)>K(350℃),该反应是______(填“放”或“吸”)热反应;若反应温度升高,A的转化率______(填“增大”、“减小”或“不变”).
(5)某温度下,A的平衡转化率(a))与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______K(B)(填“>”、“<”或“=”.)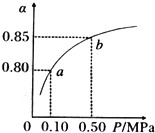
 白杨森林211年前1
白杨森林211年前1 -
 Hunter_InAus 共回答了18个问题
Hunter_InAus 共回答了18个问题 |采纳率94.4%(1)a.v(C)=2v(B),不能判断正反应速率和逆反应速率的关系,所以不能说明已经达到平衡状态,故错误;
b.单位时间内生成2mol A为逆速率,消耗1molB为正速率,而且正逆速率之比等于化学计量数之比,所以是平衡状态,故正确;
c.反应后气体的物质的量减小,所以容器内的压强减小,所以容器内压强保持不变,即是平衡状态,故正确;
d.反应后气体的体积不变,气体的质量也不变,所以容器内气体的密度始终保持不变,不能判断平衡状态,故错误;
故答案为:bc;
(2)2A(g)+B(g)⇌2C(g)
起始的量:0.050mol 0.025mol 0
转化的量:x 0.5x x
平衡的量:0.050-x 0.025-0.5x x
已知达平衡后测得c(C)=0.040mol.L -1 ,所以0.040mol.L -1 ×1L=x,即x=0.04mol;
若在相同的容器中只加入0.050mol C,把C全部转化为AB时,则生成0.050mol A和0.025mol B,与第一次相等,所以两次的平衡为等效平衡,所以平衡时各物质的量相同;
2C(g)⇌2A(g)+B(g)
起始的量:0.050mol 00
转化的量:y y 0.5y
平衡的量:0.050-y y 0.5y
所以0.04=0.050-y,即y=0.01mol,则
0.04mol
Q 1 =
0.01mol
Q 2 ,所以Q 1 =4Q 2 ,故答案为:Q 1 =4Q 2 ;
(3)平衡时c(A)=
0.050-0.04
1 mol/l=0.01mol/L,c(B)=
0.025-0.5×0.040
1 mol/L=0.005mol/L,c(C)=0.040mol/L,
所以K=
c 2 (C)
c 2 (A)×c(B) =3200L•mol -1 ;故答案为:3200L•mol -1 ;
(4)已知K(300℃)>K(350℃),所以温度越高K越小,说明升高温度平衡逆移,所以正反应为放热反应;反应温度升高,平衡逆移,所以A的转化率减小,故答案为:放;减小;
(5)平衡常数只与温度有关,所以平衡状态由a变到b时压强增大,但温度不变,所以K不变,即K(A)=K(B),故答案为:=.1年前查看全部
- 500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g)⇌N2O4(g),平衡后,向容器内再充入1
500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g)⇌N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的( )
A.平衡向正反应方向移动
B.平衡常数K增大
C.NO2的转化率变小
D.容器内气体颜色先变深后变浅,最后比原来还要浅 失落员1年前1
失落员1年前1 -
 变色感情 共回答了24个问题
变色感情 共回答了24个问题 |采纳率91.7%解题思路:在恒容密闭容器中,可逆反应达到平衡后,向容器内再充入1molNO2,容器中气体的物质的量增大则压强增大,平衡向气体体积减小的方向移动.A.向容器内再充入1molNO2,容器内压强增大,平衡向气体体积减小的正反应方向移动,故A正确;
B.温度不变,化学平衡常数不变,故B错误;
C.增大压强有利于平衡向正反应方向移动,所以二氧化氮的转化率增大,故C错误;
D.增大反应物浓度平衡向正反应方向移动,再次达到平衡后容器内二氧化氮浓度比第一次平衡时浓度大,所以容器内气体颜色先变深后变浅,最后比原来还要深,故D错误;
故选A.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了压强对化学平衡的影响,根据压强的改变确定平衡移动方向,易错选项是A,虽然二氧化氮转化率增大,但平衡时二氧化氮浓度要大于第一次平衡,所以最终颜色要比原来深,为易错点.1年前查看全部
- 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g).Z的含量(Z%)随时间t的变化如下图所示.已知在t 3 时刻改变了某一实验条件.相关判断正确的是( ) A.曲线a是500℃时的图象 B.正反应是吸热反应 C.t 3 时刻可能是升高了温度 D.t 3 时刻可能是减小了压强 
 开心就好灭1年前1
开心就好灭1年前1 -
 曾经拥有的 共回答了14个问题
曾经拥有的 共回答了14个问题 |采纳率100%A、图象判断,b曲线先到达平衡,反应速率大,说明b曲线的反应温度高,应是500℃时的图象,故A错误;
B、温度升高,Z%的数值减小,说明升高温度平衡向逆向移动,正反应是放热反应,故B错误;
C、t 3 时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是放热反应,可能为降低温度,不可能是升高温度,故C错误;
D、t 3 时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是气体体积增大的反应,减小压强,平衡向正反应移动,故可能是减小了压强,故D正确;
故选D.1年前查看全部
- 下列关于热化学反应的描述中正确的是( ) A.500℃、30MPa下,将0.5mol N 2 和1.5mol
下列关于热化学反应的描述中正确的是( ) A.500℃、30MPa下,将0.5mol N 2 和1.5molH 2 置于密闭的容器中充分反应生成NH 3 (g),放热19.3kJ,其热化学方程式为:
N 2 (g)+3H 2 (g)⇌2NH 3 (g)△H=-38.6kJ•mol -1B.HCl和NaOH反应的中和热△H=-57.3 kJ•mol -1 ,则H 2 SO 4 和Ca(OH) 2 反应的中和热△H=2×(-57.3)kJ•mol -1 C.CO(g)的燃烧热是283.0 kJ•mol -1 ,则2CO 2 (g)=2CO(g)+O 2 (g)反应的△H=+2×283.0 kJ•mol -1 D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热  jericho03151年前1
jericho03151年前1 -
 cjplly 共回答了18个问题
cjplly 共回答了18个问题 |采纳率94.4%A、N 2 (g)+3H 2 (g)⇌2NH 3 (g),该反应是可逆反应,所以△H=>38.6kJ•mol -1 ,故A错误;
B、HCl和NaOH反应的中和热△H=-57.3 kJ•mol -1 ,则稀H 2 SO 4 和Ca(OH) 2 反应的中和热是△H>-57.3 kJ•mol -1 ,因为氢氧化钙是微溶,其中的氢氧根不能完全电离,故B错误;
C、CO(g)的燃烧热是283.0 kJ•mol -1 ,所以2CO(g)+O 2 (g)=2CO 2 (g)△H=-2×283.0 kJ•mol -1 ,则2CO 2 (g)=2CO(g)+O 2 (g)反应的△H=+2×283.0 kJ•mol -1 ,故C正确;
D、1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷的燃烧热,故D错误.
故选C.1年前查看全部
- 白磷的着火点40℃、红磷的着火点240℃,酒精灯火焰可达到的最高温度约500℃,试判断下列两个实验中的现象(先燃烧,后燃
白磷的着火点40℃、红磷的着火点240℃,酒精灯火焰可达到的最高温度约500℃,试判断下列两个实验中的现象(先燃烧,后燃烧、不燃烧)并将结论填在各有关物质后的横线上:
____________. 习楚1年前1
习楚1年前1 -
 爱猪头妹妹 共回答了18个问题
爱猪头妹妹 共回答了18个问题 |采纳率94.4%解题思路:可燃物燃烧的条件是:与氧气接触,温度达到可燃物的着火点.(1)红磷和白磷都与氧气接触,温度达到了红磷和白磷的着火点,白磷的着火点低.
故填:白磷先燃烧,红磷后燃烧.
(2)温度达到了白磷的着火点,并且白磷与氧气接触,白磷能燃烧.红磷与氧气隔绝,并且温度不能达到红磷的着火点.
故填:红磷不燃烧,白磷先燃烧.点评:
本题考点: 燃烧与燃烧的条件.
考点点评: 本题主要考查了物质的燃烧条件方面的知识.1年前查看全部
- 一质量为2千克的金属块,被加热到500℃后放入1千克20℃的冷水中,不计热量损失,到平衡后,水和金属块的温度均为80℃,
一质量为2千克的金属块,被加热到500℃后放入1千克20℃的冷水中,不计热量损失,到平衡后,水和金属块的温度均为80℃,求:
(1)水吸收的热量;
(2)金属块的比热是多少?【c水=4.2×103J/(kg•℃)】 童话结束1年前1
童话结束1年前1 -
 cwpdmqpwdg 共回答了11个问题
cwpdmqpwdg 共回答了11个问题 |采纳率90.9%解题思路:(1)利用热量的计算公式计算即可,(2)水吸收的热量就是金属块放出的热量,再一次利用热量的就是公式计算,(1)Q=c水m(t-t0)=4.2×103J/(kg•℃)×1kg×(80℃-20℃)=2.52×105J;
(2)Q放=Q吸,所以由Q=cm(t1-t2)得c=[Q/m△t]=
2.52×105J
2kg×(500℃−80℃)=0.3×103J/(kg•℃).
答:(1)水吸收的热量是2.52×105J,(2)金属块的比热是0.3×103J/(kg•℃).点评:
本题考点: 热量的计算;比热容的概念.
考点点评: 计算本题的关键是金属块放出的热量等于水吸收的热量;二者具有相同的末温.1年前查看全部
- 根据图示回答:白磷的着火点约40℃,红磷的着火点约为240℃,酒精灯的火焰约为500℃.在铜片上将白磷(烧杯中B点、C点
 根据图示回答:白磷的着火点约40℃,红磷的着火点约为240℃,酒精灯的火焰约为500℃.在铜片上将白磷(烧杯中B点、C点),红磷(A点)摆放好,再点燃酒精灯加热,片刻,先发生燃烧现象的是______点,后发生燃烧现象的是______点,不会发生燃烧现象的是______点.综合所述,燃烧时需要(1)______;(2)______;(3)______三个条件.
根据图示回答:白磷的着火点约40℃,红磷的着火点约为240℃,酒精灯的火焰约为500℃.在铜片上将白磷(烧杯中B点、C点),红磷(A点)摆放好,再点燃酒精灯加热,片刻,先发生燃烧现象的是______点,后发生燃烧现象的是______点,不会发生燃烧现象的是______点.综合所述,燃烧时需要(1)______;(2)______;(3)______三个条件.  快点来看妖怪三儿1年前1
快点来看妖怪三儿1年前1 -
 明兄 共回答了20个问题
明兄 共回答了20个问题 |采纳率75%解题思路:本题中红磷和白磷都具有可燃性,AC两点的红磷及白磷能够燃烧,而水中的白磷没有与氧气接触,不会燃烧据此分析解答.AC两点的红磷及白磷能够燃烧,而水中的白磷没有与氧气接触,不会燃烧,由于白磷的着火点约为40℃,红磷的着火点约为240℃,所以C点的白磷会先达到着火点而燃烧,A后燃烧.可推知燃烧的条件:①物质具有可燃性;②可燃物与氧气接触;③使可燃物达到着火点;三个条件缺一不可.
故答案为:C;A;B;(1)物质具有可燃性;(2)可燃物与氧气接触;(3)使可燃物达到着火点.点评:
本题考点: 燃烧与燃烧的条件.
考点点评: 本题通过对比试验考查了物质燃烧的条件,从而加深学生对燃烧条件的认识.1年前查看全部
- (2012•黄石)一根烧红的铁钉,温度是500℃,质量是1.5g,它的温度降低到20℃,要放出多少热量?已知铁的比热容C
(2012•黄石)一根烧红的铁钉,温度是500℃,质量是1.5g,它的温度降低到20℃,要放出多少热量?已知铁的比热容C铁=0.46×103J/(kg•℃).
 活丑啊1年前1
活丑啊1年前1 -
 lihueijun520 共回答了26个问题
lihueijun520 共回答了26个问题 |采纳率92.3%解题思路:知道铁钉的质量、铁钉的初温和末温、铁的比热容,利用放热公式Q放=cm△t求铁钉放出的热量.铁钉放出的热量:
Q放=cm△t
=0.46×103J/(kg•℃)×1.5×10-3kg×(500℃-20℃)
=331.2J.
答:铁钉要放出的热量为331.2J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,计算时注意统一单位:Q-J、c-J/(kg•℃)、m-kg、t-℃.1年前查看全部
- 在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)
在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小28.5%.下列说法正确的是( )
A.前2min SO2的平均反应速率0.01425mol(L•s)
B.平衡时,SO2的浓度为0.01425mol/L
C.平衡时,SO2的转化率为95%
D.平衡时,SO2的转化率为71.5% xiaoyaya1191年前1
xiaoyaya1191年前1 -
 magistar 共回答了23个问题
magistar 共回答了23个问题 |采纳率91.3%解题思路:依据化学平衡三段式列式计算,设二氧化硫转化物质的量为x,则
2SO2+O2 =2SO3
起始量(mol) 0.3 0.2 0
变化量(mol) x 0.5xx
平衡量(mol)0.3-x 0.2-0.5x x
气体物质的量之比和气体压强之比分析判断计算;在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小28.5%,设二氧化硫转化物质的量为x,则
2SO2+O2 =2SO3
起始量(mol) 0.3 0.2 0
变化量(mol)x0.5x x
平衡量(mol)0.3-x 0.2-0.5x x
容器内的压强不再变化,此时容器内压强减小28.5%,即气体物质的量减少28.5%,得到(0.3+0.2)×(1-28.5%)=0.3-x+0.2-0.5x+x
x=0.285mol
A、前2min SO2的平均反应速率=
0.285mol
10L
2min=0.01425mol(L•min),故A错误;
B、平衡时,SO2的浓度为=[0.285mol/10L]=0.0285mol/L,故B错误;
C、平衡时,SO2的转化率=[0.285mol/0.3mol]×100%=95%,故C正确;
D、平衡时,SO2的转化率=[0.285mol/0.3mol]×100%=95%,故D错误;
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡三段式计算应用,反应速率、转化率、平衡浓度计算分析应用是解题关键,题目难度中等.1年前查看全部
- 已知2SO2(g)+O2(g )⇌2SO3(g)(正反应放热),若在500℃和催化剂的作用下,该反应在容积固定
已知2SO2(g)+O2(g )⇌2SO3(g)(正反应放热),若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
A.若降低温度,可以加快反应速率
B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2能完全转化为SO3
D.达到平衡时,SO2和SO3的浓度一定相等 花儿4321年前1
花儿4321年前1 -
 oh41589 共回答了17个问题
oh41589 共回答了17个问题 |采纳率88.2%解题思路:A、根据降低温度,反应速率减慢;
B、根据催化剂可以加快反应速率;
C、根据可逆反应不可能完全进行到底;
D、根据平衡状态时的标志来判断;A、因降低温度,反应速率减慢,故A错误;
B、因催化剂可以加快反应速率,故B正确;
C、因可逆反应不可能完全进行到底,所以SO2不能完全转化为SO3,故C错误;
D、因平衡状态时SO2和SO3的浓度不变,而不是相等,故D错误;
故选:B.点评:
本题考点: 化学反应速率的影响因素;化学反应的可逆性;化学平衡状态的判断.
考点点评: 本题主要考查了影响化学反应速率的因素以及化学平衡的判断,难度不大.1年前查看全部
- (2013•潍坊模拟)在常压和500℃条件下,等物质的量的Ag 2 O、Fe(OH) 3 、NH 4 HCO 3 、Na
(2013•潍坊模拟)在常压和500℃条件下,等物质的量的Ag 2 O、Fe(OH) 3 、NH 4 HCO 3 、NaHCO 3 完全分解,所得气体体积依次为V 1 、V 2 、V 3 、V 4 ,体积大小顺序正确的是( )
A.V 3 >V 2 >V 4 >V 1 B.V 3 >V 4 >V 2 >V 1 C.V 3 >V 2 >V 1 >V 4 D.V 2 >V 3 >V 1 >V 4  zexi_chen1年前0
zexi_chen1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一根烧红的铁钉,温度是500℃,质量是1.5g,它的温度降低20℃,放出多少热量?(铁的比热容为0.46×103J/(k
一根烧红的铁钉,温度是500℃,质量是1.5g,它的温度降低20℃,放出多少热量?(铁的比热容为0.46×103J/(kg▪℃)
 hfgenius1年前2
hfgenius1年前2 -
 5i24x21 共回答了23个问题
5i24x21 共回答了23个问题 |采纳率95.7%解题思路:知道铁钉的质量、比热容、温度变化,可利用公式Q放=cm△t计算出铁钉放出的热量.铁钉放出的热量:
Q放=cm△t
=0.46×103J/(kg•℃)×1.5×10-3kg×20℃
=13.8J.
答:铁钉放出的热量为13.8J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,计算时注意温度降低(△t)与降低到(末温)的区别,易错点!1年前查看全部
- 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质
 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )
A.该反应的△H>0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t1min内CH3OH的平均生成速率为
mol•L-1 min-1n1 2t1
D.A点的反应体系从300℃升高到500℃,达到平衡时
减小n(H2) n(CH3OH)  zmm11201年前1
zmm11201年前1 -
 新凤凰 共回答了9个问题
新凤凰 共回答了9个问题 |采纳率77.8%解题思路:A、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,故升高温度平衡向逆反应移动,据此判断;
B、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小;
C、平衡时甲醇的物质的量为n1mol,根据v=
,计算v(CH3OH);△n V △t
D、A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,据此判断.A、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,故升高温度平衡向逆反应移动,该反应正反应是放热反应,即△H<0,故A错误;
B、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小,故B错误;
C、平衡时甲醇的物质的量为n1mol,v(CH3OH)=
n1mol
2L
t1min=
n1
2t1mol•L-1•min -1,故C正确;
D、A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,故达到平衡时
n(H2)
n(CH3OH)增大,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大,注意掌握平衡移动原理,根据图象判断温度对平衡移动的影响.1年前查看全部
- 丙烯(CH2=CH-CH3)在500℃时能转化为A,A与溴的四氯化碳溶液继续反应转化为农药B(C3H5Br2Cl).已知
丙烯(CH2=CH-CH3)在500℃时能转化为A,A与溴的四氯化碳溶液继续反应转化为农药B(C3H5Br2Cl).已知B分子中,每个碳原子上有一个卤素原子.
(1)A中的官能团名称是______;
(2)丙烯转化为A的化学方程式是______;
(3)A转化为B的化学方程式是______;反应类型是______. awen82061年前1
awen82061年前1 -
 歪了道东 共回答了20个问题
歪了道东 共回答了20个问题 |采纳率100%解题思路:对比丙烯和B的分子组成可知A的分子式应为C3H5Cl,B的分子式为C3H5Br2Cl,且B分子中,每个碳原子上有一个卤素原子,应为CH2BrCHBrCH2Cl,则A为CH2=CH-CH2Cl,以此解答该题.对比丙烯和B的分子组成可知A的分子式应为C3H5Cl,B的分子式为C3H5Br2Cl,且B分子中,每个碳原子上有一个卤素原子,应为CH2BrCHBrCH2Cl,A为CH2=CH-CH2Cl,
(1)A为CH2=CH-CH2Cl,含有的官能团有碳碳双键、氯原子,故答案为:碳碳双键、氯原子;
(2)丙烯转化为A的反应为取代反应,方程式为CH2=CH-CH3+Cl2→CH2=CH-CH2Cl+HCl,故答案为:CH2=CH-CH3+Cl2→CH2=CH-CH2Cl+HCl;
(3)A转化为B的反应为加成反应,化学方程式为CH2=CH-CH2Cl+Br2→CH2BrCHBrCH2Cl,故答案为:CH2=CH-CH2Cl+Br2→CH2BrCHBrCH2Cl;加成反应.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,题目难度不大,注意把握有机物的分子式和结构特点,为推断该题的关键.1年前查看全部
- 在500℃,20MPa时,将N2,H2置于一个容积为2L的密闭容器中发生反应.反应过程中各
在500℃,20MPa时,将N2,H2置于一个容积为2L的密闭容器中发生反应.反应过程中各
在500℃,20MPa时,将N2,H2置于一个容积为2L的密闭容器中发生反应.反应过程中各物质的物质的量变化如图所示,
请回答下列问题
(2)在10~20min内:NH3浓度变化的原因可能是( )
A.降低温度 B.缩小容器体积
C.加了催化剂 D.补充NH3
(4)在反应进行至25min时,
①曲线发生变化的原因( ).
②第二次达到平衡时,反应N2+3H2===2NH3的平衡常数K2与K1的关系是( )
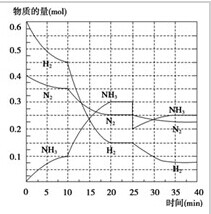
 pumba1年前1
pumba1年前1 -
 chailinyang 共回答了19个问题
chailinyang 共回答了19个问题 |采纳率89.5%10~20min斜率大了,浓度变化快了,速率快了.所以选BC
加NH3的话N2和H2会变多.
移除了部分NH3 (图上NH3由0.3变为了0.2)
K1=K2 温度没变1年前查看全部
- 工程热力学中某热机预定从温度为500℃的热源吸热500 ,并向30℃的冷源放热100 .此热机能制造成功吗?
 1758590141年前1
1758590141年前1 -
 Thorn_Birds 共回答了12个问题
Thorn_Birds 共回答了12个问题 |采纳率91.7%热机的热效率以卡诺循环时为最高,超过卡诺循环允许的热效率是不可能达到的.卡诺循环的热效率为ηc=1-T2/T1=1-(30+273)/(500+273)=0.608>100/500=0.2,所以是可以制造成功的.1年前查看全部
- 在500℃,300MPa下,N2(g)+3H2(g)﹦2NH3(g)达到平衡,下列能提高H2的转换率的有①③ ①加入N2
在500℃,300MPa下,N2(g)+3H2(g)﹦2NH3(g)达到平衡,下列能提高H2的转换率的有①③ ①加入N2②加入H2
③移走NH3④加入催化剂
请把每条选或不选说明一下原因。 偶是蚂蚁1年前1
偶是蚂蚁1年前1 -
 糸糸 共回答了15个问题
糸糸 共回答了15个问题 |采纳率86.7%选1,3
加入N2,反应向着正反应方向进行,H2转化率升高(H2总量不变,转化的更多了)
加入H2,反应虽然向着正反应方向进行,但这也只是反应平衡向着减弱这种改变的方向进行,而不是抵消这种改变,所以新加入的H2中,只有一小部分转化,这样就降低了H2的转化率(H2总量增加的更多了)
移走NH3,反应向着正反应方向进行,H2转化率升高(H2总量不变,转化的更多了)
加入催化剂,化学反应平衡不改变,H2转化率不变1年前查看全部
- 在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=
在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mo/L,求CO的平衡转化率平衡常数k=9 CO(g)+H2O(g)=H2(g)+CO2(g)
 啼血鸳鸯1年前1
啼血鸳鸯1年前1 -
 lovesrcok 共回答了14个问题
lovesrcok 共回答了14个问题 |采纳率85.7%25%1年前查看全部
- 化学平衡简单题目在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g); (1)500℃时,将a mol SO2
化学平衡简单题目
在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g);
(1)500℃时,将a mol SO2与b mol O2以3:2通入固定容积为5L的密闭容器中.
①反应进行至10min时,测得n(SO2)=8mol,n(SO3)=4mol,则b=___________mol.
②反应进行至10min时,测得反应放热392kJ,则上述热化学方程式中的
ΔH=____________________________________________.
③10min内平均速率v(SO2)=___________________________________________.
④反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时
c(SO3)=___________________,SO2的转化率α1(SO2)=________________.
(2)当反应温度、起始SO2与O2物质的量均与(1)相同时,将其混合气通入一恒压反应容器中,达平衡时SO2的转化率 与(1)中转化率 的关系是 ___________ (填=、>或<)
仅求3.4问,第一问是8mol
顺便说下过程吧,谢谢了 营生虫1年前1
营生虫1年前1 -
 木兰在线 共回答了16个问题
木兰在线 共回答了16个问题 |采纳率100%=8 mol,a= (3/2)*8 =12 mol
③10min内平均速率v(SO2)=[(8-12)/5]/10 = -0.08 mol.L-1.min-1
④反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,
pV = nRT,V,T,R不变,p/p0 = 0.715;
p/p0 = n/n0 = n/(a+b) = n/(12+8) = n/20
n/20 =0.715
n= 14.3 mol
设平衡时n(SO3)= x mol,则消耗的SO2 的量为 x mol,消耗的O2 的量为 x/2 mol; 平衡时SO2 的量为 (12-x) mol,O2的量为(8-x/2) mol.
则:x + (12-x) + (8-x/2) = 14.3
x= 11.4 mol
则平衡时c(SO3)= 11.4/5 = 2.28 mol/L
SO2的转化率α1(SO2)= 100%*11.4/12 = 95%1年前查看全部
- 16.8g NaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃.最后容
16.8g NaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃.最后容器内的物质是( )
A. Na2CO3、Na2O2、O2
B. NaHCO3、Na2CO3、O2
C. Na2CO3、NaOH、CO2、O2
D. Na2CO3、O2、H2O(g) 番外8921年前1
番外8921年前1 -
 lbaggiocn 共回答了19个问题
lbaggiocn 共回答了19个问题 |采纳率100%解题思路:在密闭容器中充分加热,2NaHCO3
Na2CO3+CO2↑+H2O,计所产生的气体CO2和H2O与Na2O2的反应为:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,最终可以看作生成的二氧化碳先与过氧化钠反应,然后水再与过氧化钠反应.计算16.8gNaHCO3分解生成的二氧化碳、水的质量,再根据二氧化碳与过氧化钠的反应进行过量计算判断是否有过氧化钠剩余,若过氧化钠剩余,则与水反应生成氢氧化钠,再根据剩余过氧化钠与水的量进行判断,据此解答.△ .2NaHCO3
△
.
Na2CO3+CO2↑+H2O
168 44 18
16.8 g 4.4g 1.8 g
2CO2+2Na2O2=2Na2CO3+O2,
88 156
4.4g 7.8g
7.8g Na2O2恰好与NaHCO3分解产生的4.4gCO2完全反应生成Na2CO3和O2.所以最后容器内的物质是Na2CO3、O2、H2O(g),
故选D.点评:
本题考点: 钠的重要化合物.
考点点评: 本题考查钠重要化合物性质、混合物的有关计算,难度中等,注意过氧化钠与水、二氧化碳反应的性质,注意转化为二氧化碳、水与过氧化钠反应的先后问题进行的解答.1年前查看全部
- 可逆反应A(g)+B(g)⇌C(g)在两个容积相等的甲、乙容器中分别加入A、B各1mol,甲容器在500℃时达到平衡,压
可逆反应A(g)+B(g)⇌C(g)在两个容积相等的甲、乙容器中分别加入A、B各1mol,甲容器在500℃时达到平衡,压强为原来的75%,乙容器在700℃时达到平衡,B的转化率为30%.
(1)计算甲容器中A的转化率.
(2)判断该反应的正方向是放热反应还是吸热反应. 不会游泳的鱼笨笨1年前1
不会游泳的鱼笨笨1年前1 -
 猪佬一号 共回答了15个问题
猪佬一号 共回答了15个问题 |采纳率100%解题思路:(1)依据化学平衡三段式列式计算,其他压强之比等于物质的量之比,转化率=[消耗量/初始量]×100%,
(2)根据反应在700℃时B的转化率以及在500℃时B的转化率来判断平衡的移动方向,确定反应热的变化.(1)设甲容器A的变化量是x,
A(g)+B(g)⇌C(g)
初始量:1 1 0
变化量:x xx
平衡量:1-x 1-x x
甲容器在500℃时达到平衡,压强为原来的75%,则[1−x+1−x+x/2]=[75/100],解得x=0.5,所以甲容器中A的转化率=[0.5/1]×100%=50%,
答:甲容器中A的转化率是50%;
(2)甲容器在500℃时达到平衡,B的转化率是50%,乙容器在700℃时达到平衡,B的转化率为30%,说明升高温度,平衡逆向进行,所以反应是放热反应,
答:该反应的正方向是放热反应.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算分析,转化率、平衡常数概念的计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 已知2SO2(g)+O2(g )⇌2SO3(g)(正反应放热),若在500℃和催化剂的作用下,该反应在容积固定
已知2SO2(g)+O2(g )⇌2SO3(g)(正反应放热),若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
A. 若降低温度,可以加快反应速率
B. 使用催化剂是为了加快反应速率
C. 在上述条件下,SO2能完全转化为SO3
D. 达到平衡时,SO2和SO3的浓度一定相等 al661年前1
al661年前1 -
 无风的云 共回答了17个问题
无风的云 共回答了17个问题 |采纳率94.1%解题思路:A、根据降低温度,反应速率减慢;
B、根据催化剂可以加快反应速率;
C、根据可逆反应不可能完全进行到底;
D、根据平衡状态时的标志来判断;A、因降低温度,反应速率减慢,故A错误;
B、因催化剂可以加快反应速率,故B正确;
C、因可逆反应不可能完全进行到底,所以SO2不能完全转化为SO3,故C错误;
D、因平衡状态时SO2和SO3的浓度不变,而不是相等,故D错误;
故选:B.点评:
本题考点: 化学反应速率的影响因素;化学反应的可逆性;化学平衡状态的判断.
考点点评: 本题主要考查了影响化学反应速率的因素以及化学平衡的判断,难度不大.1年前查看全部
- 将10 mL N 2 和H 2 的混合气体在催化剂作用下,500℃左右发生下列可逆反应:N 2 (g)+3H 2 (g)
将10 mL N 2 和H 2 的混合气体在催化剂作用下,500℃左右发生下列可逆反应:N 2 (g)+3H 2 (g) 
2NH 3 (g), 已知反应达平衡后在相同条件下混合气体体积变为6 mL。则在原混合气中,N 2 和H 2 的物质的量之比可能是[ ]
A.2∶3
B.1∶3
C.1∶4
D.1∶7 终于大悟1年前1
终于大悟1年前1 -
 iamfeihong 共回答了21个问题
iamfeihong 共回答了21个问题 |采纳率90.5%B1年前查看全部
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响. (1) 500℃、50MPa时,在容
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响. (1) 500℃、50MPa时,在容
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________.
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 .
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率.某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g•L-1,从合成塔出来的混合气体在相同条件下密度为0.693g•L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________.
(4)的理由
 sonic11221年前1
sonic11221年前1 -
 百色mm网 共回答了24个问题
百色mm网 共回答了24个问题 |采纳率91.7%(1) N2 + 3H2 = 2NH3
起始: 0.8 1.6 0
转化: 0.2 0.6 0.4
平衡: 0.6 1.0 0.4
K=c(NH3)^2 / [c(N2)·c(H2)^3]=(0.4)^2÷[0.6×(1.0)^3]=4/15.
(2)C、D.
(3)阳极反应:3H2 - 6e- = 6H+;阴极反应:N2 + 6e- + 6H+ = 2NH3.
(4)因为气体密度均为标准状况下测得,设原反应混合气中N2的物质的量为amol,H2的物质的量为bmol:气体总质量为28a+2b=(a+b)×22.4×0.554,解得:a/b=2/3.
又根据质量守恒定律,反应前后气体总质量不变.
在同温同压同质量情况下,气体密度之比就等于其体积比的倒数,同时等于气体物质的量之比的倒数.
N2 + 3H2 = 2NH3
起始: a b 0
转化: n 3n 2n
平衡: a-n b-3n 2n
(a+b) / [(a-n)+(b-3n)+2n)=0.693 / 0.554,且a/b=2/3.解得转化率:n/a×100%=25%.1年前查看全部
- 在500℃、101KPa条件下,发生如下反应:N2(g)+3H2(g)=2NH3(g);△H=-Qkj/m
在500℃、101KPa条件下,发生如下反应:N2(g)+3H2(g)=2NH3(g);△H=-Qkj/m
在500℃、101KPa条件下,发生如下反应:N2(g)+3H2(g)=2NH3(g);△H=-Qkj/mol(Q>0).将amolN2与bmolH2充入一容积可变的密闭容器中,达到平衡时NH3的体积分数为40%
(1)若温度和压强保持不变,平衡时密闭容器的体积与起始体积之比为---------------
(2)平衡时放出的热量为-----------------kj 利矛1年前1
利矛1年前1 -
 旋转的雪花 共回答了13个问题
旋转的雪花 共回答了13个问题 |采纳率100%N2(g)+3H2(g)=2NH3(g)
a b 0
x 3x 2x
a-x b-3x 2x
2x:(a-x+b-3x)=40%推出a+b=7x
(1)平衡体积与起始体积之比:(a-x+b-3x+2x):(a+b) =5x:7x=5:7
(2)生成2molNH3的热效应是Q,现在生成了2xmol,即2(a+b)/7mol,所以平衡时放出的热量为(a+b)Q/71年前查看全部
- ⑵500℃,上述反应达到平衡时NO的浓度为 ⑶300℃时,反应达到平衡,N2的浓度为_______
⑵500℃,上述反应达到平衡时NO的浓度为 ⑶300℃时,反应达到平衡,N2的浓度为_______
⑵500℃,上述反应达到平衡时NO的浓度为
⑶300℃时,反应达到平衡,N2的浓度为________,NO的转化率为
⑷在其他条件不变的情况下,将处于E点的体积压缩到原来的一半,
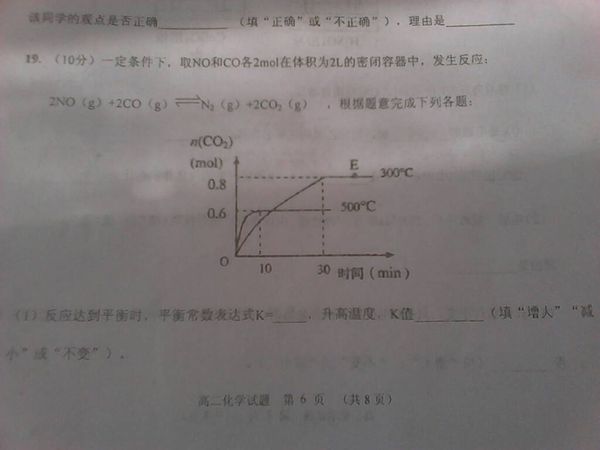
 668489371年前0
668489371年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于饱和蒸汽压与沸点的问题,在一个密闭容器中,存有一定量的75%乙醇溶液,现在给这个密闭容器加热(从室温加热到500℃)
关于饱和蒸汽压与沸点的问题,
在一个密闭容器中,存有一定量的75%乙醇溶液,现在给这个密闭容器加热(从室温加热到500℃),请帮忙详细分析一下温度升高对应的乙醇溶液饱和蒸汽压与沸点的变化情况.
回答精彩的有追加分
请再回答的详细一点, asia_king1年前1
asia_king1年前1 -
 锁丢了 共回答了22个问题
锁丢了 共回答了22个问题 |采纳率95.5%当乙醇温度升高时,就会产生乙醇蒸汽,随着温度的升高,乙醇蒸汽会越来越多,密闭容器中的压力P1也越来越大,乙醇溶液的饱和蒸汽压P2也随温度的上升而加大.加热刚开始时,P1等于大气压力,温度为室温,不足78度,P1>P2,乙醇溶液不沸腾;之后,P1上升比P2慢,在P11年前查看全部
- 在相同的条件下(500℃),有相同体积的甲、乙两容器,甲容器充入1g O2和1g SO2,乙容器充入2g O2和2g
在相同的条件下(500℃),有相同体积的甲、乙两容器,甲容器充入1g O2和1g SO2,乙容器充入2g O2和2g SO2.下列叙述中错误的是( )
A. 化学反应速率:乙>甲
B. 平衡时O2的浓度:乙>甲
C. 平衡时SO2的转化率:乙>甲
D. 平衡时SO2的体积分数:乙>甲 上海小玲1年前2
上海小玲1年前2 -
 dimple_ll 共回答了26个问题
dimple_ll 共回答了26个问题 |采纳率92.3%解题思路:A、浓度越大反应速率越快;
B、由于乙中的量是甲中的2倍,所以反应后乙中剩余的氧气多;
C、由于乙中的量是甲中的2倍,气体物质的量越大,压强越大,所以乙中相当于增大了压强,平衡正移,二氧化硫的转化率增大;
D、由C选项可知,乙中二氧化硫的转化率大,所以二氧化硫的体积分数小.A、浓度越大反应速率越快,所以开始时化学反应速率:乙>甲,故A正确;
B、由于乙中的量是甲中的2倍,所以反应后乙中剩余的氧气多,所以平衡后O2的浓度:乙>甲,故B正确;
C、由于乙中的量是甲中的2倍,气体物质的量越大,压强越大,所以乙中相当于增大了压强,平衡正移,二氧化硫的转化率增大,所以平衡后SO2的转化率:乙>甲,故C正确;
D、由C选项可知,乙中二氧化硫的转化率大,所以乙中二氧化硫的体积分数小与甲中,故D错误;
故选D.点评:
本题考点: 化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查了压强对平衡移动的影响,题目难度中等,注意转化率与体积分数的关系.1年前查看全部
- 一根烧红的铁钉,温度是500℃,质量是1.5g,它的温度降低到20℃,要放出多少热量?已知铁的比热容C铁=0.46×10
一根烧红的铁钉,温度是500℃,质量是1.5g,它的温度降低到20℃,要放出多少热量?已知铁的比热容C铁=0.46×103J/(kg•℃).
 zjnihao1111年前1
zjnihao1111年前1 -
 悄悄的我来过 共回答了23个问题
悄悄的我来过 共回答了23个问题 |采纳率69.6%解题思路:知道铁钉的质量、铁钉的初温和末温、铁的比热容,利用放热公式Q放=cm△t求铁钉放出的热量.铁钉放出的热量:
Q放=cm△t
=0.46×103J/(kg•℃)×1.5×10-3kg×(500℃-20℃)
=331.2J.
答:铁钉要放出的热量为331.2J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,计算时注意统一单位:Q-J、c-J/(kg•℃)、m-kg、t-℃.1年前查看全部
- 空气在500℃下膨胀多少倍
 addison_shi1年前1
addison_shi1年前1 -
 shannuo2000 共回答了18个问题
shannuo2000 共回答了18个问题 |采纳率88.9%大约是原来体积的3倍1年前查看全部
- 温度为500℃时,反应4NH3+5O2⇌4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol
温度为500℃时,反应4NH3+5O2⇌4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率
(x)为( ).v
A.
(O2)=0.01mol/(L•s).v
B.
(NO)=0.08mol/(L•s).v
C.
(H2O)=0.003mol/(L•s).v
D.
(NH3)=0.02mol/(L•s).v  sisdalong1年前2
sisdalong1年前2 -
 千江明珠 共回答了21个问题
千江明珠 共回答了21个问题 |采纳率85.7%解题思路:根据v=[△c/△t]计算v(NO),在根据速率之比等于化学计量数之比计算用其它物质表示的反应速率.半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=
0.3mol
5L
30s=0.002mol/(L•s).
A、根据速率之比等于化学计量数之比,所以v(O2)=[5/4]v(NO)=[5/4]×0.002mol/(L•s)=0.0025mol/(L•s),故A错误;
B、半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=
0.3mol
5L
30s=0.002mol/(L•s),故B错误;
C、根据速率之比等于化学计量数之比,所以v(H2O)=1.5v(NO)=1.5×0.002mol/(L•s)=0.003mol/(L•s),故C正确;
D、根据速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L•s),故D错误.
故选:C.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 考查化学反应速率,难度不大,注意反应速率计算常用两种方法定义法与化学计量数法,根据情况选择使用.1年前查看全部
- 已知2SO2(g)+O2(g)⇌2SO3(g);△H=-197kJ•mol-1.若在500℃和催化剂的作用下,该反应在容
已知2SO2(g)+O2(g)⇌2SO3(g);△H=-197kJ•mol-1.若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
A.若降低温度,可以加快反应速率
B.在上述条件下,2mol SO2和1mol O2混合反应,放出197kJ的热量
C.反应达平衡时,SO2和SO3的浓度一定相等
D.增大O2的浓度可提高SO2的利用率 gyf82101年前1
gyf82101年前1 -
 就你好 共回答了13个问题
就你好 共回答了13个问题 |采纳率100%解题思路:A.降低温度,反应速率减小;
B.为可逆反应,不能完全转化;
C.转化率和起始浓度未知;
D.增大O2的浓度,平衡正向移动.A.降低温度,反应速率减小,与反应热无关,故A错误;
B.为可逆反应,不能完全转化,则在上述条件下,2mol SO2和1mol O2混合反应,放出的热量小于197kJ,故B错误;
C.转化率和起始浓度未知,则反应达平衡时,SO2和SO3的浓度关系不确定,故C错误;
D.增大O2的浓度,平衡正向移动,促进二氧化硫的转化,则提高SO2的利用率,故D正确;
故选D.点评:
本题考点: 化学平衡的影响因素;化学反应速率的影响因素;化学平衡状态的判断.
考点点评: 本题考查影响化学平衡的因素,注意温度、浓度对反应速率及平衡的影响,选项C为解答的难度,题目难度中等.1年前查看全部
- (1)在体积为10升的密闭容器中,500℃、有催化剂存在的条件下,某反应过程中各物质物质的量
(1)在体积为10升的密闭容器中,500℃、有催化剂存在的条件下,某反应过程中各物质物质的量
n(mol)随时间t(min)的变化曲线如下图。根据图示回答下列问题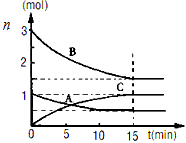
①在0~15min内的平均反应速率:v(B)=______mol/(L·min)
②该反应过程的化学方程式为:_______________________________________。
(2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。若该反应的正反应速率与时间的关系如图所示。
2C(g)+Q(Q>0)。若该反应的正反应速率与时间的关系如图所示。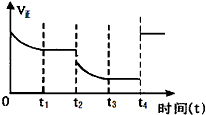
在其它条件不变的情况下,请填空:
①写出t 2 时改变的条件可能是:___________ (用文字表达);
②t 4 时改变的条件可能是___________(用编号表示,多选扣分)。
A.增大压强 B.减小压强 C.使用催化剂 D.升高温度 E.增大A的浓度 椰子树下茶楼1年前1
椰子树下茶楼1年前1 -
 WCGSK 共回答了15个问题
WCGSK 共回答了15个问题 |采纳率93.3%1年前查看全部
- 以质量为2kg的金属块,被加热到500℃后放入1kg、20℃的冷水中,不计热损失,达到平衡后,水和金属块的温度均为80℃
以质量为2kg的金属块,被加热到500℃后放入1kg、20℃的冷水中,不计热损失,达到平衡后,水和金属块的温度均为80℃,求水吸收的热量和金属块的比热容各是多少?
 g1bt781年前5
g1bt781年前5 -
 hhVShh 共回答了22个问题
hhVShh 共回答了22个问题 |采纳率72.7%Q吸=c水m水△t水=4.2×10^3J/kg℃×1kg×(80℃-20℃)=2.52×10^5J
Q吸=Q放
Q放=c金m金△t金
2.52×10^5J=c金×2kg×(500℃-80℃)
c金=0.3×10^3J/kg℃
水吸收的热量是2.52×10^5J
金属块的比热容是0.3×10^3J/kg℃1年前查看全部
- (2007•海南)工业生产硫酸的重要反应之一为2SO2+O2V2O5.500℃2X,该反应属于______(填基本反应类
(2007•海南)工业生产硫酸的重要反应之一为2SO2+O2
2X,该反应属于______(填基本反应类型),X化学式为______,V2O5中V的化合价为______,V2O5在反应中作______.V2O5 .500℃  setgewqfweqt1年前1
setgewqfweqt1年前1 -
 dangwoyu32 共回答了16个问题
dangwoyu32 共回答了16个问题 |采纳率87.5%解题思路:可以根据化合反应的概念、质量守恒定律、化合物中元素化合价代数和为零、催化剂等方面的内容进行分析、解答.此反应为两种物质反应生成一种物质,属于化合反应.根据质量守恒定律,化学反应前后各元素的原子个数不变,反应前有2个S原子,6个O原子,故可知X的化学式为SO3,氧元素的化合价是-2,设V的化合价为x,则有2x+(-2)×5=0,可以求出矾元素的化合价为:x=+5,V2O5在反应中作催化剂,故填:化合反应;SO3;+5;催化剂.
点评:
本题考点: 化合反应及其应用;催化剂的特点与催化作用;有关元素化合价的计算;质量守恒定律及其应用.
考点点评: 本题主要考查了反应类型、质量守恒定律、化合价、催化剂等方面的问题,可以依据已有的知识进行.1年前查看全部
大家在问
- 1星期四和星期六用英语怎么写?
- 2英语难题Today is __________ ________,our National Day.My family
- 3抛一枚硬币连续100次都是正面朝上,第101次抛出是反面的可能性是多少?(五年级数学第五单元卷上的)
- 4如图所示,在相互垂直的匀强电场和匀强磁场中,有一倾角为θ,足够长的光滑绝缘斜面,磁感强度为B,方向
- 5小江玩投掷飞镖的游戏,他设计了一个如图所示的靶子,点E、F分别是矩形ABCD的两边AD、BC上的点,EF∥AB,点M、N
- 61.两直线的三组同面投影互相平行,则这两直线在空间 ( ) A.一定平行 B.一定交叉 C.可能相交 D.可能
- 7在△ABC中,已知a比b长2,b比c长2,且最大角的正弦值是32,则△ABC的面积是( )
- 8在温度不变下,在恒压容器a与恒容容器b中,分别充入体积比为1:3的N2和H2.若开始时两容器的体积相等,且在相同条件下达
- 98.2×9.5的积一定是两位小数.______. (判断对错)
- 10在线高分询问:外径140的不锈钢304管,承受300公斤气压,壁厚需要多厚?
- 11德语句中...-auf Eis zu legen.理解为冷处理?求为什么在Eis 前要有auf
- 12已知方程ax+by=25的曲线经过点A(0,三分之五)和点B(1,1),求a,b的值.
- 13要把1到49分成3个一组数字不重复。
- 14Alice began to learn Chinese at the age of six.改为复合句
- 15lim(1/n^2+2/n^2+……+n-1/n^2)的极限 这道题为什么不能打开 然后相加等于0?