Na2Cr2O7+Na2S+H2O-Na2S2O3+NaOH+Cr(OH0)3配平
 gmg2514372022-10-04 11:39:541条回答
gmg2514372022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 c94070 共回答了13个问题
c94070 共回答了13个问题 |采纳率100%- 4Na2Cr2O7+6Na2S+19H2O-3Na2S2O3+14NaOH+8Cr(OH)3
转移电子为24个 - 1年前
相关推荐
- na2cr2o7与ki在酸性条件下反应
 korla40j1年前2
korla40j1年前2 -
 光辉岁月110 共回答了19个问题
光辉岁月110 共回答了19个问题 |采纳率73.7%Na2Cr2O7+KI+HCl——CrCl3+NaCl+KCl+H2O1年前查看全部
- 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气
 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2高温 ..
②2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O
(1)反应①是在回转窑中进行,反应时需不断搅拌,其目的是______.
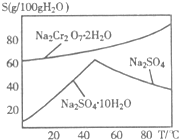
(2)右图是红矾钠(Na2Cr2O7•2H2O)和Na2SO4的溶解度曲线.从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤.趁热过滤的目的是______;然后将滤液______,从而析出红矾钠.
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶解度见右表):______.
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:温度 0℃ 100℃ 溶解度 物质 K2Cr2O7 4.6g 94.1g KCl 28g 55g NaCl 35g 39g
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol•L.重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式______.
②如省去步骤③,则所测定的铁的含量______(填“偏高”、“偏低”或“无影响”).
③步骤5使用的玻璃仪器有______. garmin1年前1
garmin1年前1 -
 hfhczs 共回答了19个问题
hfhczs 共回答了19个问题 |采纳率100%解题思路:(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;
滤液的温度较高,从溶液中获得晶体需要冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl混合,再冷却结晶,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液.(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
故答案为:使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;滤液的温度较高,从溶液中获得晶体需要冷却结晶,
故答案为:有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7,
故答案为:较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+,反应离子方程式为:2Fe3++Sn2+=Sn4++2Fe2+,
故答案为:2Fe3++Sn2+=Sn4++2Fe2+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高,所测定的铁的含量偏高,
故答案为:偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液,
故答案为:酸式滴定管、锥形瓶.点评:
本题考点: 化学平衡的调控作用;探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对数据及图象的分析、常用化学用语、氧化还原反应滴定等,难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与运用知识分析解决问题的能力.1年前查看全部
- (2013•厦门一模)某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,
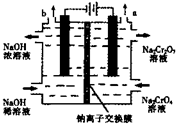 (2013•厦门一模)某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )
(2013•厦门一模)某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )
A.阳极区的PH会不断下降
B.溶液中Na+从负极移向正极
C.该电解池的两电极材料只能用石墨不能用铁
D.阳极区发生的反应是:2H2O-4e-=O2↑+4H+2CrO
+2H+=Cr2O2−4
+H2O2−7 艳_dd1年前1
艳_dd1年前1 -
 business47 共回答了16个问题
business47 共回答了16个问题 |采纳率93.8%解题思路:A、通过电解提高阳极区溶液的酸性,实现Na2CrO4转化为Na2Cr2O7;
B、电解池中钠离子从阳极移向阴极;
C、电解池中阴极被保护不参与反应;
D、通过电解提高阳极区溶液的酸性,说明在阳极区生成H+,电极反应式为2H2O-4e-=O2+4H+,2CrO42-+2H+=Cr2O72-+H2O.A、通过电解提高阳极区溶液的酸性,说明在阳极区生成H+,电极反应式为2H2O-4e-=O2+4H+,2CrO42-+2H+=Cr2O72-+H2O;溶液PH不会不断下降,故A错误;
B、电解池中阳离子移向阴极,钠离子从阳极移向阴极,故B错误;
C、电解池中阴极被保护不参与反应,可以用铁做阴极,故C错误;
D、通过电解提高阳极区溶液的酸性,说明在阳极区生成H+,电极反应式为2H2O-4e-=O2+4H+,2CrO42-+2H+=Cr2O72-+H2O,故D正确;
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解池原理的分析应用,电极判断,电极反应是解题关键,题目难中等.1年前查看全部
- 丙醇 怎么氧化?丙醇 和na2cr2o7 h2so4怎么反应
 串串11111年前1
串串11111年前1 -
 kokocj 共回答了14个问题
kokocj 共回答了14个问题 |采纳率78.6%换成乙醇的话就是酒后驾驶的测试原理,丙醇完全同理.就是醇类被重铬酸根氧化成醛类,而橙色的重铬酸根被还原为三价的绿色铬离子.这里硫酸起提供氢离子的作用,而非脱水.
注意是被氧化为醛.1年前查看全部
- 配平:Na2Cr2O7+Na2S+H2O---Na2SO3+NaOH+Cr(OH)3
 sunny248211年前1
sunny248211年前1 -
 冬虫夏草01 共回答了20个问题
冬虫夏草01 共回答了20个问题 |采纳率100%很明显这是一个碱性介质,在碱性介质中,重铬酸根离子不能氧化硫离子,而且六价铬只能以铬酸根离子形式存在.1年前查看全部
- 丙醇 和na2cr2o7 h2so4怎么反应?
 火星de公主1年前2
火星de公主1年前2 -
 wer321d 共回答了15个问题
wer321d 共回答了15个问题 |采纳率80%酸性Na2Cr2O7强氧化性,直接把CH3CH2CH2OH氧化成CH3CH2COOH1年前查看全部
- 配平Na2Cr2O7+Na2S+H2O---Na2S2O3+NaOH+Cr(OH)3
 ybbyid1年前1
ybbyid1年前1 -
 vbnm981733 共回答了17个问题
vbnm981733 共回答了17个问题 |采纳率94.1%4Na2Cr2O7+6Na2S+19H2O=3Na2S2O3+14NaOH+8Cr(OH)31年前查看全部
- Na2SO3被Na2Cr2O7氧化为Na2SO4则Cr在还原产物的化合价是多少
 tt雄风1年前3
tt雄风1年前3 -
 我心涟漪 共回答了9个问题
我心涟漪 共回答了9个问题 |采纳率88.9%一般在酸性条件下,Cr被还原为Cr3+,是+3价.
方程式:3Na2SO3 + 2Na2CrO4 + 5H2SO4 == 5Na2SO4 + Cr2(SO4)3 + 5H2O1年前查看全部
- 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2□+8CO2高温 .
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①中的氧化剂是O2,还原剂是FeO•Cr2O3
C.□内的物质是Fe3O4
D.生成1 mol Na2Cr2O7,时共转移6 mol电子 亲爱的ミ1年前1
亲爱的ミ1年前1 -
 yyuu852 共回答了11个问题
yyuu852 共回答了11个问题 |采纳率72.7%解题思路:A.有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的升降;
B.得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
C.根据元素守恒及原子守恒判断;
D.根据Na2Cr2O7和转移电子之间的关系式计算.A.在反应前后,②中各元素的化合价都不变化,所以不是氧化还原反应,故A错误;
B.反应①氧气得电子化合价降低,所以氧气是氧化剂,FeO•Cr2O3中铁和铬元素化合价都升高,所以FeO•Cr2O3是还原剂,故B正确;
C.根据原子守恒知,□内的物质是Fe2O3,故C错误;
D.反应②中生成1molNa2Cr2O7需要2molNa2CrO4,由反应①可知,参加反应FeO•Cr2O3为1mol,反应中Fe元素化合价由+2价升高为+3价,Cr由+3升高为+6,故生成1molNa2Cr2O7共转移电子的物质的量为1mol×[1+(6-3)]=7mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应基本概念与计算等,难度中等,注意根据化合价理解氧化还原反应.1年前查看全部
大家在问
- 1表现爱国精神的四字词语?
- 2读我国东部地区4城市日照时数和降水量的年变化图,完成1—2题。
- 3We go to school (by bike) every day提问括号内
- 4用1.2.3.4.5.6分别除以7看看有什莫规律.
- 5为什么植物生长调节剂的作用效果比植物激素更稳定?
- 66x的平方减x减1大于等于0的解
- 7550克的水和500ml的水哪个重量会重一些
- 8类似怎么判断是定语从句还是表语或状语这些.从句前面的what.why.while…… 或者是prep.+while中介词
- 9Al1 I want to do is live with you.
- 10帮我看看这个表格是什么意思了我买了个小本,上面有几个英语单词,有的能认识,有的不知道该咋翻译today pointto
- 11It's Jackie Chan.
- 125073 million 日元等于多少人民币
- 13算算2次函数...A(-1,0) B(3,0) C(2,3) 再算算顶点...谢谢.速度.....快啊...
- 14We didn;t eat here last week,.we?A.didn't B.haven't C.do D.d
- 15如图所示,在一端开口的玻璃管内装有一半的酒精,再沿管壁慢慢地注入带颜色的水,这时可以清楚地看见水和酒精的分界面,然后堵住
