在恒温恒压下,向密闭容器中充人4 mol A和2 mol B,发生如下反应:2A(g)+B(g) 2C(g);△H
 q1987080252022-10-04 11:39:541条回答
q1987080252022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 19号凌晨不睡觉 共回答了23个问题
19号凌晨不睡觉 共回答了23个问题 |采纳率100%- 我觉得A B对,知道答案告诉我!Please!
- 1年前
相关推荐
- 急求!恒温恒压下,气体反应中加入惰性气体对反应速率影响
急求!恒温恒压下,气体反应中加入惰性气体对反应速率影响
恒温恒压下,气体反应中加入惰性气体,虽说反应物浓度不变,但从微观角度讲,无关分子的加入应会对反应物分子的有效碰撞产生干扰,故反应速率会减慢.但本人从课堂得到的结论是不变!急求解释呀,老感觉书上的结论有些许不可靠.还有谁能详细解释总压与分压的定义及对反应的影响.
小灰急求 爱赫爱E1年前1
爱赫爱E1年前1 -
 hust_jy88 共回答了24个问题
hust_jy88 共回答了24个问题 |采纳率91.7%但从微观角度讲,无关分子的加入应会对反应物分子的有效碰撞产生干扰,故反应速率会减慢.这句话肯定是错误的啦,无关分子碰撞怎么会减慢反应速度啊?你吧他们看做是对器壁的碰撞.也就是在反应室内对放了一个器壁不会影响反应速率的.但愿你能理解1年前查看全部
- 恒温恒容和恒温恒压时通稀有气体对反应有什么影响?(反应速率和平衡移动方向)
 风雨无助1年前2
风雨无助1年前2 -
 huinc 共回答了22个问题
huinc 共回答了22个问题 |采纳率86.4%恒温恒容,通稀有气体,所有的反应物和生成物的浓度不变(注意体积不变的哦 ),因此反应速率不变,
既然速率都不变了,平衡也就不移动.
恒温恒压,通稀有气体,(注意体积肯定变大的) ,所有的反应物和生成物的浓度都减小,反应速率降低,但是不要用浓度来判断平衡移动方向,浓度都按照倍数减小,就相当于减压.减压 ,平衡向 气体分子数 增加的方向移动.1年前查看全部
- 在恒温恒压下,将3mol A和1mol B放入一密闭容器中发生反应:2A(g)+B(g)⇌2C(g)
在恒温恒压下,将3mol A和1mol B放入一密闭容器中发生反应:2A(g)+B(g)⇌2C(g),达到化学平衡Ⅰ.在同样条件下,3mol A和2mol B发生同样的反应,达到化学平衡Ⅱ.现将平衡Ⅱ的混合气体全部压入平衡Ⅰ的容器中,在同样条件下达到化学平衡Ⅲ.下列关于平衡Ⅰ、Ⅱ、Ⅲ的说法错误的是( )
A. 平衡Ⅲ中A的转化率等于B的转化率
B. 平衡Ⅰ中A的转化率小于B的转化率
C. n(C)/n(A)的值,平衡Ⅲ的比平衡Ⅰ的小
D. n(A)/n(B)的值,平衡Ⅲ的比平衡Ⅱ的大 梦之倩影1年前2
梦之倩影1年前2 -
 老海校 共回答了20个问题
老海校 共回答了20个问题 |采纳率90%解题思路:平衡Ⅰ、Ⅱ、Ⅲ的起始状态可以认为是:
2 A+B⇌2C
Ⅰ(mol):3 1 0
Ⅱ(mol):3 2 0
Ⅲ(mol):6 3 0
A、在平衡Ⅲ中,n(A):n(B)=2:1,与化学计量数之比相等,A、B转化率相等;
B、平衡Ⅰ中n(A):n(B)=3:1,大于化学平衡常数之比,相当于在Ⅲ的基础上又单独加入了A;
C、保持恒温恒压,Ⅲ相当于在Ⅰ的基础上又单独加入了B;
D、保持恒温恒压,Ⅲ也相当于在Ⅱ的基础上,单独减少了B.平衡Ⅰ、Ⅱ、Ⅲ的起始状态可以认为是:
2 A+B⇌2C
Ⅰ(mol):3 1 0
Ⅱ(mol):3 2 0
Ⅲ(mol):6 3 0
A、在平衡Ⅲ中,n(A):n(B)=2:1,与化学计量数之比相等,所以α(A)=α(B),故A正确;
B、平衡Ⅰ中n(A):n(B)=3:1,大于化学平衡常数之比,相当于在Ⅲ的基础上又单独加入了A,A的转化率减小,B的转化率增大,所以α(A)<α(B),故B正确;
C、保持恒温恒压,Ⅲ相当于在Ⅰ的基础上又单独加入了B,平衡向右移动,n(C)增大、n(A)减小,会使n(C)/n(A)变大,故C错误;
D、保持恒温恒压,Ⅲ也相当于在Ⅱ的基础上,单独减少了B,会使n(A)/n(B)变大,故D正确;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 考查化学平衡的影响元素、化学计算等,难度中等,设计平衡建立的途径是解题的关键,注意等效思想的利用.1年前查看全部
- 在恒温恒压下,向容积可变的密闭容器中充入3LA和2LB发生如下反应:3A(g)+2B(g)⇌xC(g)+yD(g)达到平
在恒温恒压下,向容积可变的密闭容器中充入3LA和2LB发生如下反应:3A(g)+2B(g)⇌xC(g)+yD(g)达到平衡时,混合气体中D的体积分数为W%,若维持温度、压强不变,将1.2LA,0.8LB,3LC,0.6LD作为起始物质充入密闭容器中,达到平衡时混合气体中D的体积分数仍为W%,则x,y的值分别为( ) A.x=3,y=1 B.x=2,y=3 C.x=4,y=1 D.x=5,y=1  ghost4351年前1
ghost4351年前1 -
 爱在太平洋 共回答了21个问题
爱在太平洋 共回答了21个问题 |采纳率85.7%由题意可知恒温恒压下,向容积可变的密闭容器中,
状态Ⅰ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始量3 2
状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 1.2 0.8 3 0.6
两种状态下到平衡时混合气体中D的体积分数均为W%,
则二者为等效平衡状态,利用极限转化为起始量时,A、B的物质的量之比为3:2,
所以状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 1.2+
9
x 0.8+
1.2
y
(1.2+
9
x ):(0.8+
1.2
y )=3:2,解得x:y=5:1,
显然只有D中x=5、y=1符合,故选D.1年前查看全部
- 在恒温恒压容器充入一定量N 2 和H 2 进行反应:N 2 (g) + 3H 2 (g) 2NH 3 (g)
在恒温恒压容器充入一定量N 2 和H 2 进行反应:N 2 (g) + 3H 2 (g)
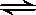 2NH 3 (g),若反应过程中 n (H 2 )和 n (NH 3 )随时间变化的关系如图所示,则下列有关叙述中正确的是
2NH 3 (g),若反应过程中 n (H 2 )和 n (NH 3 )随时间变化的关系如图所示,则下列有关叙述中正确的是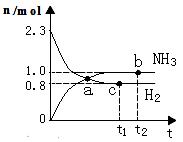
A.a点表示NH 3 生成速率与NH 3 分解速率相等 B.b点H 2 的转化率大于c点 C.若在t 1 时刻再充入一定量稀有气体,达到新平衡时 n (H 2 )大于0.8mol D.若在t 2 时刻再充入一定量NH 3 (g),达到新平衡时NH 3 体积分数减少  xppr934on57f01年前1
xppr934on57f01年前1 -
 ericmagang 共回答了19个问题
ericmagang 共回答了19个问题 |采纳率89.5%C
1年前查看全部
- 恒温恒溶密闭容器中,发生如下可逆反应:N2+3H2可逆号2NH3 下列叙述中能证明该反应已经达到化学平衡状态的是( )A
恒温恒溶密闭容器中,发生如下可逆反应:N2+3H2可逆号2NH3 下列叙述中能证明该反应已经达到化学平衡状态的是( )A反应物和生成物浓度不再发生变化 B反应物和生成物的浓度相等
C、容器内气体原子总数不再发生变化——C:根据质量守恒,容器内的气体原子总数一直变化,(注意:全为气体)这样解释对吗,为什么是恒温恒容得密闭容器中容器内的气体原子总数一直变化?
D.N2和H2不再化合成NH3
请解释每个选项谢谢!~~~! ChrisNET1年前1
ChrisNET1年前1 -
 cicely905 共回答了24个问题
cicely905 共回答了24个问题 |采纳率87.5%A:因为浓度是单位体积内物质的量 浓度不变 容器内此物质的物质的量不变 也就是 正反应速率等于你反应速率 达到平衡 如果正反应速率不等于你反应速率 浓度会改变;
B:这个和平衡没有关系 你要是一开始就放的相等 此时不一定平衡;
C每个物质都是由原子组成 根据原子守恒 原子个数不变 所以 原子个数 平不平衡都是不变的 且等于初始;
D:这句话本身就是错的 可逆反应不可能 平衡时候 正反应速率等于你反应速率.
可追问1年前查看全部
- (2009•辽宁模拟)在恒温恒压下,向容积可变的密闭容器中充入3LA和2LB发生如下反应:3A(g)+2B(g)⇌xC(
(2009•辽宁模拟)在恒温恒压下,向容积可变的密闭容器中充入3LA和2LB发生如下反应:3A(g)+2B(g)⇌xC(g)+yD(g)达到平衡时,混合气体中D的体积分数为W%,若维持温度、压强不变,将1.2LA,0.8LB,3LC,0.6LD作为起始物质充入密闭容器中,达到平衡时混合气体中D的体积分数仍为W%,则x,y的值分别为( )
A.x=3,y=1
B.x=2,y=3
C.x=4,y=1
D.x=5,y=1 西林碧1年前1
西林碧1年前1 -
 寂静的星空下 共回答了20个问题
寂静的星空下 共回答了20个问题 |采纳率90%解题思路:恒温恒压下,向容积可变的密闭容器中,
状态Ⅰ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始量3 2
状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 1.2 0.8 3 0.6
两种状态下到平衡时混合气体中D的体积分数均为W%,
则二者为等效平衡状态,利用极限转化为起始量时,A、B的物质的量之比为3:2,以此来解答.由题意可知恒温恒压下,向容积可变的密闭容器中,
状态Ⅰ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始量3 2
状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 1.2 0.8 3 0.6
两种状态下到平衡时混合气体中D的体积分数均为W%,
则二者为等效平衡状态,利用极限转化为起始量时,A、B的物质的量之比为3:2,
所以状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 1.2+[9/x]0.8+[1.2/y]
(1.2+[9/x]):(0.8+[1.2/y])=3:2,解得x:y=5:1,
显然只有D中x=5、y=1符合,故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算及等效平衡,明确两种状态达到平衡时混合气体中D的体积分数均为W%,将第二种状态利用极限转化为起始量成正比即可解答,题目难度中等.1年前查看全部
- 化学等效平衡恒温恒压的问题对于恒温恒压下的可逆反应,只要加入的量和原比例相同就可以了(回归定比)这句话为什么对.可以给我
化学等效平衡恒温恒压的问题
对于恒温恒压下的可逆反应,只要加入的量和原比例相同就可以了(回归定比)
这句话为什么对.可以给我举出一个例子并且说明吗? 鱼儿泪0001年前1
鱼儿泪0001年前1 -
 gohome 共回答了17个问题
gohome 共回答了17个问题 |采纳率100%对于恒温恒压下的可逆反应:当加入的量和原来的比例相同时,容器体积会随之变化,最后形成平衡为等效平衡(例如第二次是第一次的2倍,那么体积就是2倍,各物质质量分数和原来一样).1年前查看全部
- 在恒温恒压下,向密闭容器中充入4mol SO 2 和2mol O 2 ,发生如下反应:2SO 2 +O 2 ⇌2SO 3
在恒温恒压下,向密闭容器中充入4mol SO 2 和2mol O 2 ,发生如下反应:2SO 2 +O 2 ⇌2SO 3 △H<0.2min后,反应达到平衡,生成SO 3 为1.4mol,同时放出热量QkJ.则下列分析正确的是( ) A.在该条件下,反应前后的压强之比为6:5.3 B.若反应开始时容器体积为2L,则v(SO 3 )=0.35mol/(L•min) C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO 3 )<1.4mol D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于QkJ  这样如何是好1年前1
这样如何是好1年前1 -
 白沙河 共回答了17个问题
白沙河 共回答了17个问题 |采纳率94.1%A、反应在恒温恒压条件下进行,应前后的压强之比为1;1,故A错误;
B、若容器体积不变,条件,v(SO 3 )=0.35mol/(L•min),但反应是在恒温恒压条件进行,混合气体平衡后的条件分数改变,v(SO 3 )>0.35mol/(L•min),故B错误;
C、若把“恒温恒压下”改为“恒压绝热条件下”反应,反应是放热反应,绝热温度升高,平衡逆向进行,平衡后n(SO 3 )<1.4mol,故C正确;
D、若把“恒温恒压下”改为“恒温恒容下”反应,反应过程中压强减小,平衡逆向进行,达平衡时放出热量小于Q kJ,故D错误;
故选:C.1年前查看全部
- 为什么可逆反应恒温恒压通入惰性气体相当于减小压强
为什么可逆反应恒温恒压通入惰性气体相当于减小压强
没懂- -你第一句说的充入惰性气体是恒压状态的嘛? qqquuu11年前1
qqquuu11年前1 -
 hnyyclx 共回答了21个问题
hnyyclx 共回答了21个问题 |采纳率85.7%恒压状态要求整个容器内压强是不变的,当你冲入气体后这个体积就不在合适了需要增大体积但是反应气体本身的量并没有增加啊,原来的反应量比上现在增大的体积,反应气体单位体积内的量就减少了,所以相当于减压下了1年前查看全部
- 惰性气体对化学平衡的影响我在看书时,说恒温恒压下,冲入惰性气体,会向体积增大的反应.为什么啊
 tracyhe20071年前1
tracyhe20071年前1 -
 zhangyang1982 共回答了15个问题
zhangyang1982 共回答了15个问题 |采纳率86.7%因为前提是“恒温恒压下”,在这个前提下冲入惰性气体,相当于将平衡系统种的所有气体稀释,那么体积大的方向体积降低的幅度,大于体积小的方向体积降低的幅度,为维持系统的平衡必然反应向原来体积较大的方向移动.1年前查看全部
- 有关恒温恒容和恒温恒压的化学问题
有关恒温恒容和恒温恒压的化学问题
有两个容器A 和 B A保持恒温恒压 B容器保持恒温恒容 起始时分别充入等量的体积比为2:1的SO2和O2 并使A,B的容积相等 其反应方程式2SO2+O2=2SO3 达平衡时所需的时间A比B短,A中SO2的转化率和B中SO2转化率哪个更大?达上述平衡后,若向两容器通入等量的原反映气体 再次平衡 A中SO3的百分含量会怎么变化 B中的百分含量又会怎么变化? 听你说谎1年前3
听你说谎1年前3 -
 爱上老母猪 共回答了20个问题
爱上老母猪 共回答了20个问题 |采纳率85%第一问:从反应方程看,其正反应是体积变小的,即3体积气体生成2体积气体;所以恒压有利于反应向正方向进行;当是恒容条件时,随着反应的进行,气体的体积数变小,容器内的压力就会变小,反应速率相对就会减慢;所以比较而言,A中的反应速率比B的大,达到平衡需要时间短;A的转化率比B大.第二问:有点复杂,我们把通入的气体考虑为达到平衡之后的状态,这样就比较好去解答了;恒压情况:当加入气体,体积会增大,但是压力不变,所以反应平衡不会被打破,所以SO3的百分含量不变;恒容情况:当加入气体,容器体积不变,则容器内压强增大,所以反应会向正反应方向进行,所以SO3的百分含量会增加1年前查看全部
- 比如N2+3H2=2NH3在恒温恒容一开始投料2molN2 6molH2反应平衡后再恒温恒压下再投一样的料平衡移动不移动
比如N2+3H2=2NH3在恒温恒容一开始投料2molN2 6molH2反应平衡后再恒温恒压下再投一样的料平衡移动不移动
答案给的不移动,我一直觉得是正向移动,恒温恒压下虽然压强不变通入反应气体不影响移动但是反应物物质的量浓度增大了,我总觉得应该是正想移动吧 拿铁的鬼魂1年前3
拿铁的鬼魂1年前3 -
 胭脂马 共回答了13个问题
胭脂马 共回答了13个问题 |采纳率76.9%不移动,反应物得浓度不会增大,再次投料时,容器体积会增大,因为要保持恒压,也就说容器体积会增大一倍,因此浓度不变.相当于在另个等同的容器中分别加入2 mol N2和6molH2,待反应平衡时,将两个容器合并到一起.二者互不影响.因此反应平衡不移动,如果将已知条件改成恒温恒容,则平衡正向移动.1年前查看全部
- 恒温恒溶密闭容器中,发生如下可逆反应:N2+3H2可逆号2NH3 下列叙述中能证明该反应已经达到化学平衡状态的是( )
恒温恒溶密闭容器中,发生如下可逆反应:N2+3H2可逆号2NH3 下列叙述中能证明该反应已经达到化学平衡状态的是( )
A、容器内压强不再变化 B、容器内密度不再变化
C、容器内气体原子总数不再发生变化
D、相同时间内消耗n摩尔N2同时消耗3n摩尔H2
(请分别解释为什么) 忆苦的薄荷1年前3
忆苦的薄荷1年前3 -
 wandoudoll 共回答了15个问题
wandoudoll 共回答了15个问题 |采纳率86.7%A正确,恒温恒溶密闭容器中,只要未达到平衡状态,压强一直在变,P不变就说明平衡了.
B:不正确,根据ρ=m/v,气体的质量没有变,容器的体积也不变,密度ρ在整个过程中一直不变.
C:根据质量守恒,容器内的气体原子总数一直变化,(注意:全为气体)
D:消耗n摩尔N2代表正方向,同时消耗3n摩尔H2也代表正方向,看不出V(正)与V(逆)是否相等,所以不能确定是否平衡.1年前查看全部
- 在恒温恒压下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的是
在恒温恒压下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的是
A.A(g)+B(g)=C(g)
B.A(g)+2B(g)=3C(g)
C.A(g)+B(g)=C(g)+D(g) hnjf200711年前1
hnjf200711年前1 -
 ll孟回 共回答了8个问题
ll孟回 共回答了8个问题 |采纳率100%A
这题很明显选a了,因为b与c从一开始压强就不会变化,因为气体系数之和左右两边相等1年前查看全部
- 在恒温恒压容器中N2与H2反应时加入N2,平衡会如何移动?是因为浓度还是因为压强?
在恒温恒压容器中N2与H2反应时加入N2,平衡会如何移动?是因为浓度还是因为压强?
如果在恒温恒容的容器中N2与H2反应时加入N2,平衡会如何移动?是因为浓度还是因为压强 L随缘1年前1
L随缘1年前1 -
 venus妞妞 共回答了17个问题
venus妞妞 共回答了17个问题 |采纳率88.2%容器是恒温恒压的,所以与压强无关.因为N2的浓度增加,平衡向右移动.根据勒夏特列原理也可以解释,平衡会向减弱这个方向进行~1年前查看全部
- 在恒温恒压的容器中,有一个可逆反应平衡,通入惰性气体后在不同情况下会发生的情况.
在恒温恒压的容器中,有一个可逆反应平衡,通入惰性气体后在不同情况下会发生的情况.
就是系数不同时会分别发生什么,当然反应中反应物均为气体 栗子梅1年前3
栗子梅1年前3 -
 耿军让 共回答了19个问题
耿军让 共回答了19个问题 |采纳率73.7%恒压状态要求整个容器内压强是不变的,当你冲入气体后这个体积就不在合适了需要增大体积但是反应气体本身的量并没有增加,原来的反应量比上现在增大的体积,反应气体单位体积内的量就减少了,所以相当于可逆反应恒温恒压通入惰性气体相当于减小压强.那么接下来您就按照减少压强来做就可以了 那么就像化学计量数之和多的方向移动了1年前查看全部
- 化学等效平衡 恒温恒压时 对于2SO2+O2=2SO3
化学等效平衡 恒温恒压时 对于2SO2+O2=2SO3
如果起始投入SO2和O2分别为5mol和1mol 那么 相同条件下 投入分别为15mol和3mol 转化率和质量分数相同么? 6og91年前1
6og91年前1 -
 jungang2000 共回答了15个问题
jungang2000 共回答了15个问题 |采纳率80%既然是恒温恒压,只要投料成比例,即是等效平衡,转化率和质量分数相同的1年前查看全部
- (2014•岳阳一模)在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2+O2⇌2S
(2014•岳阳一模)在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2+O2⇌2SO3△H<0.2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ.则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6:5.3
B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L•min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ 小小鼻涕泡1年前1
小小鼻涕泡1年前1 -
 银雪灵龙 共回答了14个问题
银雪灵龙 共回答了14个问题 |采纳率85.7%解题思路:A、依据反应在恒温恒压条件下进行分析;
B、依据化学反应速率的概念分析计算;
C、绝热条件温度升高平衡逆向进行;
D、恒温恒容条件反应过程中,压强减小.A、反应在恒温恒压条件下进行,应前后的压强之比为1;1,故A错误;
B、若容器体积不变,条件,v(SO3)=0.35mol/(L•min),但反应是在恒温恒压条件进行,混合气体平衡后的条件分数改变,v(SO3)>0.35mol/(L•min),故B错误;
C、若把“恒温恒压下”改为“恒压绝热条件下”反应,反应是放热反应,绝热温度升高,平衡逆向进行,平衡后n(SO3)<1.4mol,故C正确;
D、若把“恒温恒压下”改为“恒温恒容下”反应,反应过程中压强减小,平衡逆向进行,达平衡时放出热量小于Q kJ,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素;化学平衡的调控作用.
考点点评: 本题考查了化学平衡的影响因素分析判断,注意恒温恒容、恒温恒压条件下分析的角度不同,结果不同,注意掌握平衡移动原理的实质应用,题目难度中等.1年前查看全部
- 关于恒温恒压下,在反应前就开始恒温恒压,对于反应后气体体积减少或增大的反应来说,这个反应有可能平衡吗?有可能的话请下为何
关于恒温恒压下,
在反应前就开始恒温恒压,对于反应后气体体积减少或增大的反应来说,这个反应有可能平衡吗?有可能的话请下为何
我的问题在反应前就开始恒温恒压,对于反应后气体体积减少或增大的反应来说,那气体体积变化压强就变化,那那要恒压一定要改变容器体积,那反应一直下去,体积一直在改变,这个反应有可能平衡吗 oo的世界1年前3
oo的世界1年前3 -
 yaogang737 共回答了11个问题
yaogang737 共回答了11个问题 |采纳率90.9%有可能 以氮气和氢气合成氨气为例,开始时反应容器中充入氮气和氢气,恒温下反应,一旦反应开始因为气体分子数减小,为了保持恒压,势必容器体积得不断减小才行.当进行到一定程度,即氮气和氢气生产氨气的速度和氨气分解的速度相等时即达到化学平衡.1年前查看全部
- (2013•成都一模)在恒温恒压下,向密闭容器中充入4mol A和2mol B,发生如下反应:2A(
(2013•成都一模)在恒温恒压下,向密闭容器中充入4mol A和2mol B,发生如下反应:2A(g)+B(g)⇌2C(g)△H<0.2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
A.若反应开始时容器体积为2L,则v(C)=0.4mol/(L•min)
B.若在恒压绝热条件下反应,平衡后n(C)<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加 hiyihqe4ee1年前1
hiyihqe4ee1年前1 -
 长啸长哭 共回答了26个问题
长啸长哭 共回答了26个问题 |采纳率84.6%解题思路:A、依据化学反应速率概念计算分析判断;
B、在恒压绝热条件下反应,反应放热,平衡逆向进行,平衡后n(C)<1.6mol;
C、若2min后,向容器中再投入等物质的量A、C,平衡正向进行;
D、恒温恒容条件反应过程中,压强减小.A、由化学平衡三段式可知,
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.6 0.8 1.6
平衡量(mol) 2.4 1.2 1.6
若反应开始时容器体积为2L,平衡后容器体积小于2L,则v(C)>0.4mol/(L•min),故A错误;
B、依据平衡计算,在恒压绝热条件下反应,反应是放热反应,温度升高平衡逆向进行,平衡后n(C)<1.6mol,故B正确;
C、若2min后,向容器中再投入等物质的量A、C,平衡正向进行,B的转化率增大,故C错误;
D、恒温恒容条件反应过程中,压强减小,平衡逆向进行放出的热量减小,故D错误;
故选B.点评:
本题考点: 化学平衡的影响因素;化学平衡的调控作用.
考点点评: 本题考查了化学平衡的影响因素分析判断,注意恒温恒容、恒温恒压条件下分析的角度不同,结果不同,注意掌握平衡移动原理的实质应用,题目难度中等.1年前查看全部
- 在恒温恒压下,将3mol A和1mol B放入一密闭容器中发生反应:2A(g)+B(g)⇌2C(g)
在恒温恒压下,将3mol A和1mol B放入一密闭容器中发生反应:2A(g)+B(g)⇌2C(g),达到化学平衡Ⅰ.在同样条件下,3mol A和2mol B发生同样的反应,达到化学平衡Ⅱ.现将平衡Ⅱ的混合气体全部压入平衡Ⅰ的容器中,在同样条件下达到化学平衡Ⅲ.下列关于平衡Ⅰ、Ⅱ、Ⅲ的说法错误的是( ) A.平衡Ⅲ中A的转化率等于B的转化率 B.平衡Ⅰ中A的转化率小于B的转化率 C.n(C)/n(A)的值,平衡Ⅲ的比平衡Ⅰ的小 D.n(A)/n(B)的值,平衡Ⅲ的比平衡Ⅱ的大  lucifer951年前1
lucifer951年前1 -
 王日比1219 共回答了20个问题
王日比1219 共回答了20个问题 |采纳率95%平衡Ⅰ、Ⅱ、Ⅲ的起始状态可以认为是:
2 A+B⇌2C
Ⅰ(mol):3 1 0
Ⅱ(mol):3 2 0
Ⅲ(mol):6 3 0
A、在平衡Ⅲ中,n(A):n(B)=2:1,与化学计量数之比相等,所以α(A)=α(B),故A正确;
B、平衡Ⅰ中n(A):n(B)=3:1,大于化学平衡常数之比,相当于在Ⅲ的基础上又单独加入了A,A的转化率减小,B的转化率增大,所以α(A)<α(B),故B正确;
C、保持恒温恒压,Ⅲ相当于在Ⅰ的基础上又单独加入了B,平衡向右移动,n(C)增大、n(A)减小,会使n(C)/n(A)变大,故C错误;
D、保持恒温恒压,Ⅲ也相当于在Ⅱ的基础上,单独减少了B,会使n(A)/n(B)变大,故D正确;
故选C.1年前查看全部
- 在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应2A(g)+B(g) 2C(g) △H
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应2A(g)+B(g)
 2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ()
2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ()
A.若反应开始时容器体积为2 L,则υ C =0.4mol/L·min
B.若在恒压绝热条件下反应,平衡后n C <1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加 提线人偶-娃娃1年前1
提线人偶-娃娃1年前1 -
 深蓝色的海底 共回答了19个问题
深蓝色的海底 共回答了19个问题 |采纳率94.7%B
1年前查看全部
- 1.A(S)+2B(g)=4C(g)+D(g)在恒温恒压的容器中,在一定温度压强下达到平衡,若再加入B,则再次达到平衡时
1.A(S)+2B(g)=4C(g)+D(g)在恒温恒压的容器中,在一定温度压强下达到平衡,若再加入B,则再次达到平衡时,正逆反应的速率均增大,为什么是错的.答案说速率不变 、
2.此反应的物质的量与时间的图像,达到平衡后,若升高温度,曲线是突增还是从原点缓慢的渐变上去,不管这个反应放热吸热无关,物质的量都会比原先多吗?比如浓度时间图像,它要是升温,不就是产物和反应物都缓慢的升高,那物质的量与时间图呢?
第二个问题的图像,就是把我穿的那个图的图像C改成N, 要是升高温度,它物质的量时突然升高,还是在原来的基础上慢慢升高
 地中海星光1年前6
地中海星光1年前6 -
 TOTO128 共回答了18个问题
TOTO128 共回答了18个问题 |采纳率94.4%1首先容器是恒温恒容,加B并不改变压强(即不改变浓度),故保持平衡状态.
2曲线是缓慢变化,达到平衡后呈直线,化学平衡的建立需要一个过程,升高温度能缩短建立平衡时间,物质的量增减要看平衡朝那个方向移动,若朝左移动,这物质的量减少,朝右则物质的量增加,这就要看该反应式放热还是吸热反应.1年前查看全部
- 2体积二氧化硫与一体积氧气反映达到平衡,恒温恒压通入一体积氧气,三氧化硫浓度怎么变?
 pechel1年前1
pechel1年前1 -
 长乐猫王 共回答了15个问题
长乐猫王 共回答了15个问题 |采纳率100%不变1年前查看全部
- 在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X
在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)⇌2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L.则该反应方程式中的n值是( )
A. 8
B. 6
C. 5
D. 3 gmtlx1年前1
gmtlx1年前1 -
 hzh118 共回答了15个问题
hzh118 共回答了15个问题 |采纳率100%解题思路:依据化学平衡的三段式列式计算,利用转化率计算消耗X的量,三段式计算出平衡量结合混合气体最后为6,5L计算n值;或差量法计算;在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)⇌2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L.依据平衡的三段式计算列式计算得到:
4X(g)+3Y(g)⇌2Q(g)+nR(g)
起始量(L) 4 3 00
变化量(L) 4×25%=1 [3/4] [1/2][1/4]n
平衡量(L) 3 [9/4] [1/2] [1/4]n
则得到:3+[9/4]+[1/2]+[n/4]=6.5
n=3
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的三段式计算,依据条件列出三段的量容易计算得到,题目较简单.1年前查看全部
- 对于aA+bB=cC+dD的反应,只增加其中一种反应物的浓度,(两种反应物都增加呢?)在恒温恒容和恒温恒压下平衡分别向那
对于aA+bB=cC+dD的反应,只增加其中一种反应物的浓度,(两种反应物都增加呢?)在恒温恒容和恒温恒压下平衡分别向那方移动?依据是什么?这两种条件(恒温恒容和恒温恒压)有什么区别?
 风儿fe1年前1
风儿fe1年前1 -
 他的珍妮 共回答了24个问题
他的珍妮 共回答了24个问题 |采纳率91.7%如果都是气体 且 a+b=c+d
恒温恒容 增加其中一种反应物的浓度 反应向逆方向移动
恒温恒压 增加其中一种反应物的浓度 反应向逆方向移动
如果都是气体 且 a+b>c+d
恒温恒容 增加其中一种反应物的浓度 反应向逆方向移动
恒温恒压 增加其中一种反应物的浓度 反应向逆方向移动
如果都是气体 且 a+b<c+d
恒温恒容 增加其中一种反应物的浓度 反应向逆方向移动
恒温恒压 增加其中一种反应物的浓度 反应向逆方向移动
至于 恒容 恒压 的区别只在于 恒容增大体积方应向体积减小的方向移动(就是系数相加较小的方向)
恒压增大体积方应不移动
这是根据夏列特勒原理 推倒的1年前查看全部
- 在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X
在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)⇌2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L.则该反应方程式中的n值是( )
A. 8
B. 6
C. 5
D. 3 宗康1年前2
宗康1年前2 -
 当蚊子爱上青蛙 共回答了19个问题
当蚊子爱上青蛙 共回答了19个问题 |采纳率84.2%解题思路:依据化学平衡的三段式列式计算,利用转化率计算消耗X的量,三段式计算出平衡量结合混合气体最后为6,5L计算n值;或差量法计算;在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)⇌2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L.依据平衡的三段式计算列式计算得到:
4X(g)+3Y(g)⇌2Q(g)+nR(g)
起始量(L) 4 3 00
变化量(L) 4×25%=1 [3/4] [1/2][1/4]n
平衡量(L) 3 [9/4] [1/2] [1/4]n
则得到:3+[9/4]+[1/2]+[n/4]=6.5
n=3
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的三段式计算,依据条件列出三段的量容易计算得到,题目较简单.1年前查看全部
- 为什么只有恒温恒压时,反应热等于焓变?
为什么只有恒温恒压时,反应热等于焓变?
一个反应肯定要吸放热还怎么可能恒温?
难道一个在封闭容器中进行的反应,反应热≠焓变? wyt5121年前4
wyt5121年前4 -
 bbc966 共回答了22个问题
bbc966 共回答了22个问题 |采纳率100%这是个数学演绎过程:由定义:H=U-TS
由热力学第一方程式:U=δQ-pΔV
又熵的定义:dS=δQ/T
三式联立求微分:dH=TdS+Vdp
如果dp=0,则dH=TdS=δQ
若等温下(不是恒温)H=Qv
等温是指系统和环境温度相同,不是恒定温度.
封闭系统认为是刚性的,若压强dp≠0,则dH≠δQ.1年前查看全部
- 化学平衡移动,改变浓度 以N2+3H2可逆反应2NH3为例 恒温恒容下
化学平衡移动,改变浓度 以N2+3H2可逆反应2NH3为例 恒温恒容下
原来N2 aMOL/L H2b mol/L,NH3 cmol/L 充入a mol/L N2,平衡移动后N2为xmol/L,H2为b mol/L,NH3 d mol/L
写出 x y d 的范围 N2转化率下降,H2转化率上升,为什么?
并说明原因
平衡后 H2 为y mol/L 打错字了,sorry,
假如要是 充入NH3 使浓度变为2c mol/L 则 x y d 怎么变?(要求,x的范围只能用带字母a的表示;y 只能用带字母b的表示;d只能用带字母c的表示) reagent1年前3
reagent1年前3 -
 gtgrwcbb 共回答了25个问题
gtgrwcbb 共回答了25个问题 |采纳率84%x在a--2amol/L之间 y在b-3a--bmol/L之间 d在c--c+2amol/L之间
加入a mol/L N2,反应平衡右移,氢气的量减少,氨气和氮气的量增加.
因为加入a mol/L N2,所以氮气的量最多不超过2a,因为氮气加入后不可能全部反应,所以氢气的减少量小于3a,氨气的增加量小于2a,所以氢气的浓度至少b-3a,氨气浓度至多c+2a.
N2转化率下降是因为加入了N2,增大了基数,反应又不能完全进行,所以导致果不抵因;H2转化率上升是因为反应平衡右移,基数不变的前提下参与反应的量多了.1年前查看全部
- 化学平衡时恒温恒容和恒温恒压的解题方法
 天雷教的oo1年前1
天雷教的oo1年前1 -
 冰蛋糕 共回答了22个问题
冰蛋糕 共回答了22个问题 |采纳率86.4%所以等效平衡也是一种思维分析方式和解题方法.这种方法往往用在相似平衡的计算在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学方程式系数比换算1年前查看全部
- 在恒温恒压下向N2O4 =2NO2平衡混合气体中正在冲入一定量的N2O4,则
在恒温恒压下向N2O4 =2NO2平衡混合气体中正在冲入一定量的N2O4,则
A:N2O4的转化率增加
B:混合气体的平均相对分子质量增大
C:混合气体的颜色增加
D:以上说法均不正确 小珍珍妹1年前1
小珍珍妹1年前1 -
 wjl415 共回答了21个问题
wjl415 共回答了21个问题 |采纳率81%选D
在恒温恒压下,等比即等效.
此反应只有一种反应,始终是成比例的,所以是等效平衡.1年前查看全部
- 恒温恒容容器,各气体物质物质的量和什么因素相关联 恒温恒压容器,各气体物质物质的量和什么因素相关联
 ilel20041年前1
ilel20041年前1 -
 彭澎 共回答了21个问题
彭澎 共回答了21个问题 |采纳率90.5%pV=nRT1年前查看全部
- 在恒温恒压的密闭容器中,充入密闭容器中,充入4LX和3LY的混合气体
在恒温恒压的密闭容器中,充入密闭容器中,充入4LX和3LY的混合气体
在恒温恒压的密闭容器中,充入4LX和3LY的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g) 2Q(g)+nR(g).达到平衡时测得X的转化率为25%,此时混合气体的体积为6.5L,则该反应方程式中的n值是( )
A.8 B.6 C.5 D.3
n=3
4X+3Y=2Q+nR
原来 4 3 0 0
反应 4X 3X 2X nX
平衡 4-4x 3-3X 2X nX
因为转化率为25% 所以4X/4=0.25 所以X=0.25
混合后体积为4-4X+3-3X+2X+nX=6.5 把X=0.25代入得n=3
这个为什么要设成4x和3x?2x和nx怎么来的 梦里想看海1年前1
梦里想看海1年前1 -
 lcv7 共回答了14个问题
lcv7 共回答了14个问题 |采纳率85.7%因为反应方程式中各物质的比例系数=4:3:2:n
所以设4X X物质、3X Y物质反应生成2X Q物质和nX R物质,是为了没有分数,计算简便.1年前查看全部
- 化学平衡移动,改变浓度 以N2+3H2可逆反应2NH3为例 恒温恒容下
化学平衡移动,改变浓度 以N2+3H2可逆反应2NH3为例 恒温恒容下
原来N2 aMOL/L H2b mol/L,NH3 cmol/L 充入a mol/L N2,平衡移动后N2为xmol/L,H2为b mol/L,NH3 d mol/L
写出 x y d 的范围 N2转化率下降,H2转化率上升,为什么?
并说明原因 好人一生平安否1年前2
好人一生平安否1年前2 -
 雪骥 共回答了22个问题
雪骥 共回答了22个问题 |采纳率90.9%a<x<2a;0<y<b;d>c.
这是因为只是加入了氮气.
从平衡移动上说,平衡肯定是向右移动的,所以氢气的转化率肯定是上升的.但是平衡移动的程度是很小的,所以相对来说,氮气的综合转化率是降低的.1年前查看全部
- 化学平衡恒压充惰性气体如 2SO2+O2==2SO3在恒温恒压的容器内冲入少量氩气,平衡向什么方向移动?
 古老鼠1年前0
古老鼠1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 反应CO(g) + 2H2(g)CH3OH(g)在恒温恒压下进行,当加入某种催化剂,该反应速率明显加快.不存在催化剂时,
反应CO(g) + 2H2(g)CH3OH(g)在恒温恒压下进行,当加入某种催化剂,该反应速率明显加快.不存在催化剂时,反应的平衡常数为K,活化能为Ea,存在催化剂时为K和Ea,则
A. K=K,EaEa B. KK,EaEa
C. K=K,EaEa D. KK,EaEa gfl5351年前2
gfl5351年前2 -
 尘子刘 共回答了19个问题
尘子刘 共回答了19个问题 |采纳率84.2%是否有催化剂不影响化学反应平衡,所以K不变,而催化剂的本质就是改变活化能,所以Ea减小1年前查看全部
大家在问
- 1用1.2.3.和小数点组成6个小数部分的小数,并将它们从小到大排列
- 2若数列An的极限存在,且(An-3)/(2+An)的极限是四分之九,那么An的极限是多少,
- 3请问这两个题选哪一个,为什么?1.I like playing ___paseball,but I don"t like
- 4keep secrets to sb
- 5以无奈的母爱做题目写一篇作文
- 6一个圆内最大的直角三角形的面积是40平方米,那么圆的面积是多少
- 7一个长方体水箱,从里面量,长50厘米,宽40厘米,深40厘米,水箱中的水面高14厘米,放入一个棱长为20厘米
- 8大一解析几何 向量的外积
- 9比较好写的的四字成语至少也要30个吧!我只采纳最多的哦 如果100个以上的话就能增加悬赏20哦
- 10日全食多少年一次?解释下什么是日全食
- 11突触和突触小体的区别
- 12每种气体的物质的量之比为什么等于其分子个数之比
- 13把一根长2米的圆柱体木棒垂直于高截成两段,表面积增加了32平方分米.原来这根木棒的体积是多少?
- 14He is the very man in___pocket I found my lost money
- 15制备单克隆抗体的2个原理
