ch3och3中碳的化合价是多少
 y51272022-10-04 11:39:541条回答
y51272022-10-04 11:39:541条回答二甲醚

已提交,审核后显示!提交回复
共1条回复
 只爱BOBO 共回答了17个问题
只爱BOBO 共回答了17个问题 |采纳率94.1%- 有机物一般不讨论碳元素的化合价,如果非要知道,可以认为是 -2 价.
- 1年前
相关推荐
- 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为______.
A.加入某物质作催化剂B.加入一定量COC.反应温度降低D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为______;若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=______mol/L.
(3)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______.
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如上图所示.b电极是______极,写出a电极上发生的电极反应式______. falcon20061年前1
falcon20061年前1 -
 coco酸酸乳 共回答了20个问题
coco酸酸乳 共回答了20个问题 |采纳率85%解题思路:(1)已知反应①是体积减小的放热反应,根据外界条件对平衡的影响分析;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,根据v(CO)=[△c/△t]计算v(CO);
计算该温度下的平衡常数,根据平衡常数计算平衡时氢气的浓度,根据甲醇的平衡浓度计算氢气浓度的变化量,进而计算a的值;
(3)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
(4)依据图示分析通入氧气的一端为正极,通入二甲醚的一端为负极,电解质溶液为酸性环境,二甲醚失电子生成二氧化碳,根据电子守恒写出电极反应.(1)已知反应①是体积减小的放热反应,若要增大反应①中H2的转化率,则需要使平衡正移,所以改变的条件为加入一定量CO或反应温度降低;
故答案为:BC;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,所以v(CO)=[0.5mol/L/5min]=0.1mol/(L•min);
该温度到达平衡时,c(CO)=0.5mol/L,c(H2)=2.4mol/L-2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以该温度下,平衡常数k=[0.5
0.5×1.42=
25/49],若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L-2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以[2
2×y2=
25/49];
解得y=1.4,故a=2mol/L×2+1.4mol/L=5.4mol/L.
故答案为:0.1mol/(L•min);5.4.
(3)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产,采用300℃的反应温度,目的提高化学反应速率.
故答案为:-246.1kJ/mol;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+;
故答案为:CH3OCH3+3H2O-12e-═2CO2+12H+.点评:
本题考点: 化学平衡的影响因素;热化学方程式;常见化学电源的种类及其工作原理;化学平衡的计算.
考点点评: 本题考查热化学方程式书写,燃烧热概念,平衡移动,图象分析应用,原电池电极反应的书写方法,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的工艺
 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的工艺主要发生三个反应:
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的工艺主要发生三个反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-91kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41kJ•mol-1
回答下列问题:
(1)该工艺总反应的热化学方程式为:______,平衡常数表达式K=c(CH3OCH3)•c(CO2) c3(CO)•c3(H2) .c(CH3OCH3)•c(CO2) c3(CO)•c3(H2)
(2)增大压强,CH3OCH3的产率______(填“增大”、“减小”或“不变”).
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、
反应时间等因素不变,试验结果如图.该条件下,温度为______时最合适.低于此温度CO转化率不高的原因是______. nmfdgjn1年前1
nmfdgjn1年前1 -
 lcythink 共回答了15个问题
lcythink 共回答了15个问题 |采纳率86.7%解题思路:(1)运用盖斯定律的原理,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得;根据化学平衡常数进行解答,平衡时生成物浓度幂之积比反应物浓度幂之积;
(2)根据压强对平衡移动的影响来回答;
(3)由图表可知,在较低温时,反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,反应体系均已达到平衡,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.(1)已知①CO(g)+2H2(g)⇌CH3OH(g)△H1=-91kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41kJ•mol-1
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,平衡常数K=
c(CH3OCH3)•c(CO2)
c3(CO)•c3(H2);
故答案为:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1;
c(CH3OCH3)•c(CO2)
c3(CO)•c3(H2);
(2)增大压强,化学平衡正向移动,所以CH3OCH3的产率增大,故答案为:增大;
(3)由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.
故答案为:240℃;在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大.点评:
本题考点: 热化学方程式;化学平衡的影响因素.
考点点评: 本题考查反应热的计算、平衡移动、化学平衡常数等,难度中等,难点在于读图明白温度为240℃时反应体系均已达到平衡.1年前查看全部
- 日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3
 日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )
日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1mol二甲醚被还原时有12mol电子转移 uu自卑1年前1
uu自卑1年前1 -
 pengkevv 共回答了20个问题
pengkevv 共回答了20个问题 |采纳率85%解题思路:该装置是原电池,通过甲醚的电极是负极,负极上甲醚失电子发生还原反应,通入氧气的电极是正极,正极上氧气得电子发生还原反应,电流从正极沿导线流向负极,根据甲醚和转移电子之间的关系计算转移电子数.A、燃料电池中,通入燃料甲醚的电极a是负极,故A正确;
B、电池工作时电流由正极b沿导线到负极a,故B正确;
C、燃料电池中,通入氧气的电极是正极,在酸性环境下的电极反应为:4H++O2+4e-=2H2O,故C正确;
D.根据电池反应CH3OCH3+3O2=2CO2+3H2O可知,甲醚作还原剂被氧化,1mol甲醚被氧化时就有12mol电子转移,故D错误.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池,会根据电池反应式判断正负极上的原料、明确原电池原理即可解答,难度中等.1年前查看全部
- 二甲醚(CH3OCH3)是一种比较惰性的非腐蚀性有机物,不致癌,对大气臭氧层无破坏作用,在对流层中易于降解,是一种优良的
二甲醚(CH3OCH3)是一种比较惰性的非腐蚀性有机物,不致癌,对大气臭氧层无破坏作用,在对流层中易于降解,是一种优良的绿色化工产品。下列关于二甲醚的叙述错误的是
①二甲醚由三种元素组成
②二甲醚分子由2个碳原子、6个氢原子和1个氧原子构成
③二甲醚的相对分子质量为46
④二甲醚中碳、氢元素的质量比为1:3A.③④ B.①② C.②④ D.②③④  200510271年前1
200510271年前1 -
 financialacc 共回答了29个问题
financialacc 共回答了29个问题 |采纳率100%C
1年前查看全部
- 下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( )
下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( )
A.李比希燃烧法
B.铜丝燃烧法
C.红外光谱法
D.元素分析仪 O买噶1年前1
O买噶1年前1 -
 化石玉米 共回答了17个问题
化石玉米 共回答了17个问题 |采纳率100%A.李比希燃烧法能够测定元素的含量,而二甲醚和乙醇为同分异构体,二者元素的含量相同,无法用李比希燃烧法鉴别,故A错误;
B.铜丝燃烧法可定性确定有机物中是否存在卤素,而二甲醚和乙醇中都不含卤素,无法鉴别二者,故B错误;
C.红外光谱法确定有机物中的官能团,二甲醚与乙醇中的官能团不同,可鉴别,故C正确;
D.二甲醚(CH3OCH3)和乙醇的组成元素均为C、H、O,不能利用元素分析仪鉴别,故D错误;
故选C.1年前查看全部
- (2014?浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴
(2014?浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴
 (2014?浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
(2014?浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-91KJ?mol-1
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-24KJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41KJ?mol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______,平衡常数表达式K=______.
(2)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是______(填字母代号).
a.低温高压b.加入催化剂c.减少CO2的浓度d.增加CO的浓度
(3)在某温度下,2L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2mol和6mol,3min后达到平衡,测得CO的转化率为60%,则3min内CO的平均反应速率为______.若同样条件下起始时CO的物质的量为4mol,达到平衡后CH3OH为2.4mol,则起始时H2的物质的量为:______.
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
则此反应在该温度下的平衡常数为______,若再向容器分别加入甲醇0.02mol、CH3OCH3 1.0mol,此时该反应v正反应______v逆反应(填“>”、“<”或“=”).反应时间/min 0 1 2 3 4 c(CH3OH)/mol?L-1 0.51 0.2 0.1 0.01 0.01
(5)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图试解释原因是:______.
 ELLA12261年前1
ELLA12261年前1 -
 天地庐 共回答了17个问题
天地庐 共回答了17个问题 |采纳率94.1%(1)已知①CO( g)+2H2(g)?CH3OH( g)△H1=-91kJ?mol-1,②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-24kJ?mol-1,③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ?mol-1,根据盖斯定律,①×2+②+③...1年前查看全部
- (2014•葫芦岛一模)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能
 (2014•葫芦岛一模)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.
(2014•葫芦岛一模)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.
(1 )CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g)+3H2(g)=CH3OH(g)+H20(g)△H=-49.0kJ•mol-1
2CH3OH(g)=CH30CH3(g)+H20(g)△H=-23.5kJ•mol-1
则CO2与H2反应合成二甲醚的热化学方程式为______.
(2 )若反应2CH3OH(g)⇌CH3OCH3(g)+H20(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加人一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
①比较该时刻正、逆反应速率的大小:v(正)______v(逆)(填“>”“<”或“=”)
物质______ CH3OCH3(g) H20(g) 浓度(mol•L-1) ______ 0.60 0.60
②若加入甲醇后经10min反应达到平横,则平衡后c(CH3OH)=______,该时间内反应速率v(CH3OCH3)=______.
(3 )工业上合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ•mol-1若在温度相同、容积均2L的3个容器中,按不同方式投人反应物,保持恒温、恒容,测得反应达到平衡时如下:
下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是______;容器 甲2 乙 丙 反应物投入量 1molCO、2molH2 1molCH3OH 2molCO、4molH2 CH3OH c1=0.25 c2 c3 反应的能量变化 放出Q1kJ 吸收Q2kJ 放出Q3kJ 平衡常数 K1 K2 K3 反应物转化率 a1 a2 a3
A.v正(H2)=2v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
E.容器的压强不变
②下列说法正确的是______.
A、c1=c2B、Q1=Q2C、K1=K2D、a2+a3<100%
③如图表示该反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
K4、K5、K6、K7之间的关系为______(用“>”、“<”或“=”连接).反应物的转化率最大的一段时间是______.t1-t2 t4-t5 t5-t6 t7-t8 K4 K5 K6 K7  子曰啥了1年前1
子曰啥了1年前1 -
 hhhhhh1 共回答了13个问题
hhhhhh1 共回答了13个问题 |采纳率100%解题思路:(1)根据盖斯定律及题中热化学方程式写出CO2与H2反应合成二甲醚的热化学方程式;
(2)①根据各组分的浓度商与平衡常数的大小进行判断反应方向及正逆反应速率大小;
②设达到平衡时又消耗了xmol甲醇,利用三段式及平衡常数列出方程式进行计算平衡时甲醇浓度及二甲醚的反应速率;
(3)①可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
②在恒温恒容条件下,甲加入1molCO、2molH2与乙中1molCH3OH为等效平衡,而丙中加入2molCO、4molH2,与甲相比,丙增大了压强,平衡向着正向移动,据此进行解答;
③温度不变,化学平衡常数不变,t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应该为升高了温度;t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动,据此进行解答.(1)(g)+3H2(g)=CH3OH(g)+H20(g)△H=-49.0kJ•mol-1 ①
2CH3OH(g)=CH30CH3(g)+H20(g)△H=-23.5kJ•mol-1②
根据盖斯定律,将①×2+②可得:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-121.5kJ•mol-1,
故答案为:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-121.5kJ•mol-1;
(2)①此时的浓度商为:Qc=[0.6×0.6
0.442=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②设达到平衡时据此又消耗了xmol,则
2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol•L-1):0.44 0.6 0.6
转化浓度(mol•L-1):2x x x
平衡浓度(mol•L-1):0.44-2x 0.6+x 0.6+x
K=
(0.6+x)2
(0.44−2x)2=400,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,
则10min生成二甲醚的浓度为:0.6moL/L+0.2moL/L=0.8mol/L,
所以甲醇的反应速率为v(CH3OH)=
0.8mol/L/10min]=0.08 mol/(L•min),
故答案为:0.040 mol•L-1;0.08 mol•L-1•min-1;
(3)①A.v正(H2)=2v逆(CH3OH),表示的是正逆反应速率,且满足二者计算量关系,说明反应达到平衡状态,故A错误;
B.n(CO):n(H2):n(CH3OH)=1:2:1,物质的量之比,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故B正确;
C.混合气体的密度不变,反应前后都是气体,容器的容积不变,所以气体的密度始终不变,密度不能作为判断平衡状态的依据,故C正确;
D.该反应是气体体积缩小的反应,反应过程中气体的物质的量发生变化,混合气体的平均分子量发生变化,若混合气体的平均相对分子质量不变,说明达到了平衡状态,故D错误;
E.该反应是体积缩小的反应,气体的物质的在反应中发生变化,若容器的压强不变,说明正逆反应速率相等,达到了平衡状态,故E错误;
故答案为:BC;
②A、恒温恒容条件下,甲加入1molCO、2molH2与乙中1molCH3OH为等效平衡,则达到平衡时各组分的浓度都相等,所以c1=c2,故A正确;
B、由于甲和乙是从不同方向进行的反应,则甲放出的热量与乙吸收的热量不一定相等,故B错误;
C、由于甲和乙为从不同的方向进行的可逆反应,两个反应中温度相同,则平衡常数不变,所以K1=K2,故C正确;
D、甲和乙为等效平衡,反应的方向完全不同,所以a1=a2,用于丙中浓度为甲的2倍,相当于增大了压强,丙中反应物转化率大于甲,即a3>a1,所以a2+a3>100%,故D错误;
故答案为:AC;
③t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应为升高温度,所以K4>K5;
t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动;应为降低压强,所以K6=K7;
t5~t6正逆速率都增大,平衡不移动,应是使用催化剂,K不变,所以K5=K6,所以K4>K5=K6=K7,
根据t3时刻升高了温度,平衡向着逆向移动,反应物转化率减小;t4-t5时使用催化剂,转化率不变;t6时减小了压强,平衡向着逆向移动,反应物转化率减小,所以t2~t3段A的转化率最高,
故答案为:K4>K5=K6=K7; t2~t3.点评:
本题考点: 等效平衡;热化学方程式;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查较为综合,题目难度中等,试题题量过大,难度较大,注意“始、转、平”是解决有关化学平衡的“三段论”解题法,当三组量一旦确定,可以解答有关平衡的平衡常数计算、转化率、反应速率、平衡时成分的体积分数等的关键.1年前查看全部
- (2013•市中区一模)二甲醚(CH3OCH3)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.请回答下列问题
(2013•市中区一模)二甲醚(CH3OCH3)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.请回答下列问题:
(1)二甲醚属于______(填“酸”、“碱”、“盐”、“氧化物”或“有机物”中一种).
(2)二甲醚的一个分子中,C、H、O三种原子的个数之比为______(填最简整数比).
(3)二甲醚中,C、O两元素的质量之比为______(填最简整数比).
(4)二甲醚可由合成气(CO和H2)在一定条件下制得.用合成气制二甲醚时,还产生了一种可参与大气循环的常温下为液体的氧化物,该反应的化学方程式是:2CO+4H2
CH3OCH3+H2O一定条件 .2CO+4H2.
CH3OCH3+H2O一定条件 . yk_tianxie1年前1
yk_tianxie1年前1 -
 漂在mm的蓝领 共回答了14个问题
漂在mm的蓝领 共回答了14个问题 |采纳率85.7%解题思路:(1)含有碳元素的化合物叫有机化合物,简称有机物.
(2)根据二甲醚化学式的含义进行分析判断.
(3)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(4)根据题中信息结合化学方程式的书写进行分析.(1)二甲醚(CH3OCH3)是含碳元素的化合物,属于有机物;
(2)一个二甲醚分子是由2个碳原子、6个氢原子和1个氧原子构成的,因此二甲醚的一个分子中,C、H、O三种原子的个数之比为2:6:1;
(3)二甲醚中碳、氧元素的质量比为(12×2):16=3:2;
(4)根据题中信息可知反应物是一氧化碳和氢气,生成物是二甲醚和水,反应条件是一定条件,反应的化学方程式是2CO+4H2
一定条件
.
CH3OCH3+H2O;
故答案为:(1)有机物;(2)2:6:1;(3)3:2;(4)2CO+4H2
一定条件
.
CH3OCH3+H2O.点评:
本题考点: 常见的氧化物、酸、碱和盐的判别;元素质量比的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 二甲醚(CH3OCH3)是一种新型能源,它清洁、高效.工业合成氨时可联产二甲醚,一定条件下,在容积固定的密闭设备中发生反
二甲醚(CH3OCH3)是一种新型能源,它清洁、高效.工业合成氨时可联产二甲醚,一定条件下,在容积固定的密闭设备中发生反应:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g);△H<0.
CH3OCH3(g)+3H2O(g);△H<0.
(1)若其它条件不变,升高反应设备的温度,H2的转化率______(填“增大”、“减少”、“不变”);若不改变反应设备的温度、不增大设备的压强,能提高二甲醚产率的措施有(写一条)______;
(2)相同温度下,在两个设备中进行上述反应,某时刻设备中各气态物质的浓度及正逆反应速率关系如下表所示.
①判断设备 I中的反应是否达到平衡状态______(填“是”或“否”),该温度下的平衡常数K=______;
②推测表中空格处v(正)与v(逆)的关系,并写出推测过程)______;
(3)若起始时CO2和H2的物质的量比为1:3,某一时刻从上述正在进行的反应设备中分离走H2和H2O,得到CO2(g)和CH3OCH3(g)的混合物.测算出该混合物中C、O两原子的物质的量比n(C):n(O)=1:x,画出以x为横坐标、上述反应中H2(g)的转化率为纵坐标的
的图象(直线). 王道火把1年前1
王道火把1年前1 -
 中青队 共回答了18个问题
中青队 共回答了18个问题 |采纳率88.9%解题思路:(1)升高温度化学平衡向着吸热方向进行,根据平衡移动原理来判断提高二甲醚产率的措施;
(2)①平衡状态的标志是:正逆反应速率相等,根据平衡常数表达式来计算平衡常数;
②根据任意态的浓度熵和平衡常数的关系来判断是否是平衡状态以及反应的移动方向;
(3)根据物质的分子构成以及物质成分结合化学平衡移动来画图.(1)若其它条件不变,升高反应设备的温度,平衡逆向移动,所以氢气的转化率减小减少,若不改变反应设备的温度、不增大设备的压强,提高二甲醚产率即平衡正向移动的方法是减少生成物的浓度,即,及时分离出二甲醚或水,故答案为:减少;及时分离出二甲醚或水;
(2)①设备I中正逆反应速率相等的状态是平衡状态,根据平衡常数K=
[CH3OCH3]•[H2O]3
[CO2]2•[H2]6=
(1×10−4)4
(1×10−2)8=1,故答案为:是;K=1;
②因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)•c3(H2O)/c2(CO2)•c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆),故答案为:因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)•c3(H2O)/c2(CO2)•c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆);
(3)根据二氧化碳和乙醚的分子式中碳原子和氧原子的分子构成:二氧化碳中n(C):n(O)=1:2,乙醚中n(C):n(O)=2:1,当x=0.5时,则n(C):n(O)=2:1,此时物质的组成只有乙醚,所以二氧化碳消耗完毕,此时氢气的转化率是100%,当x=2是,则物质的组成是二氧化碳,反应刚开始,所以氢气的转化率为0,即 ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡的影响因素;化学平衡常数的含义;化学平衡状态的判断.
考点点评: 本题综合性较强,难度很大,要求学生具有分析和解决问题的能力.1年前查看全部
- (2012•开封模拟)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和 H2O
(2012•开封模拟)二甲醚(ch3och3)和甲醇(ch3oh)被称为21世纪的新型燃料.以ch4和 h2o为原料制备二甲醚和甲醇的工业流程如图1.请填空:
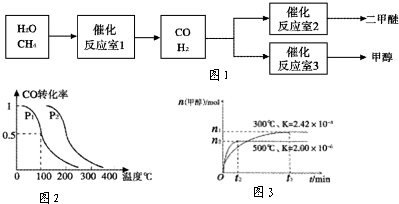
(1)在一定条件下,反应室1中发生反应:
ch4(g)+h2o(g)⇌co(g)+3h2(g)△h>0.
在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).将1.0mol ch4和2.0mol h2o通入反应室1(假设容积为10l),1min末有 0.1molco生成,则1min内反应的平均速率v(h2)=______mol/(l•min).
(2)已知:co的燃烧热为283kj/mol;
ch3och3(g)+3o2(g)═2co2(g)+3h2o(g)△h=-1323kj/mol
2h2(g)+o2(g)═2h2o(g)△h=-484kj/mol
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为______.(本题涉及的条件均在同一条件下)
(3)反应室3中在催化剂作用下发生如下反应:co(g)+2h2(g)⇌ch3oh(g).
对此反应进行如下研究:
①在压强为0.1mpa条件下,容积为2l时,充入0.2mol co与0.4mol h2在催化剂作用下反应生成甲醇.co的平衡转化率与温度、压强的关系如图2所示.则p1______p2 (填“<”、“>”或“=”);在p1压强下,100℃时,若温度不变,反应co(g)+2h2(g)⇌ch3oh(g)的平衡常数k的值为______,再加入1.0 mol co后重新达到平衡,则co的转化率______(填“增大”、“不变”或“减小”),ch3oh的体积分数______ (填“增大”、“不变”或“减小”).
②在容积为1l的密闭容器中分别充入1mol co和 2mol h2,实验测得甲醇的物质的量和温度、时间的关系曲线如图3所示.则该正反应的△h______0(填“<”、“>”或“=”),判断的理由是______.
(4)***某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:ch3och3-12e-+16oh-═2co
+11h2o.2−3
有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含so2的废气通入电解饱和食盐水所得溶液中,得nahso3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入nahso3溶液中得so2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下vl的废气,计算消耗二甲醚的质量.[23v/134.4]g[23v/134.4]g. 叶子与风的纠缠1年前1
叶子与风的纠缠1年前1 -
 myj741008 共回答了10个问题
myj741008 共回答了10个问题 |采纳率90%解题思路:(1)降低温度正、逆反应速率都降低;根据方程式计算生成的氢气的物质的量,进而计算氢气的浓度变化,根据v=[△c/△t]计算v(H2);
(2)反应室2的可逆反应除生成二甲醚外还生成了气态水,根据盖斯定律计算;
(3)依据图象分析,随温度升高,一氧化碳转化率减小,平衡逆向进行,逆向是吸热反应,正向是放热反应;依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(4)依据化学反应转化关系,热量电池电极饱和氯化钠溶液生成的氢氧化钠吸收二氧化硫,结合电子守恒进行计算.(1)降低温度逆反应速率减小;
1min末有0.1mol CO生成,根据方程式CH4(g)+H2O(g)⇌CO(g)+3H2(g)可知,生成的氢气为0.1mol×3=0.3mol,容器的体积为10L,
则1min内用氢气表示的平均速率v(H2)=
0.3mol
10L
1min=0.03mol/(L•min);
故答案为:减小;0.03;
(2)已知:①CO的燃烧热为283kJ/mol,则CO(g)+[1/2]O2(g)═CO2(g)△H=-283kJ/mol;
②CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1323kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
利用盖斯定理将①×2+③×2-②可得:
2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-2×(-283kJ/mol)+2×(-484kJ/mol)-(-1323kJ/mol)=-211kJ/mol,
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-211kJ/mol;
(3)①由图可知温度相同时,到达平衡时,压强为p2的CO转化率高,平衡向正反应方向移动,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动,即p1<p2;
CO的起始浓度为[0.2mol/2L]=0.1mol/L,H2的起始浓度为[0.4mol/2L]=0.2mol/L,由图2可知,在p1压强下,100℃时,CO的转化率为0.5,CO的浓度变化量为0.1mol/L×0.5=0.05mol/L,则:
CO(g)+2H2(g)⇌CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.10.05
所以平衡常数k=[0.05
0.05×0.12=100,
若温度不变,再加入1.0 mol CO后重新达到平衡,虽然平衡向正方向移动,但转化的比加入的少,则转化率减小;CH3OH的体积分数减小;
故答案为:<;100;减小;减小;
②从图象可以看出,升高温度,甲醇的物质的量减少,说明正反应是放热反应,则△H<0,
故答案为:<,升高温度甲醇的物质的量减少,反应向吸热方向进行;
(4)CH3OCH3-12e-+16OH-═2CO2-3+11H2O,2H++2e-═H2↑,2NaCl+2H2O
通电
./ ]2NaOH+H2↑+Cl2↑,SO2+NaOH═NaHSO3,得到CH3OCH3~12SO2,依据条件计算,设二甲醚质量为X;
CH3OCH3~12SO2
46 12mol
x [V/22.4]
x=[23V/134.4]g;
故答案为:[23V/134.4]g.点评:
本题考点: 化学平衡的计算;用盖斯定律进行有关反应热的计算;化学电源新型电池;反应速率的定量表示方法;化学反应速率的影响因素;转化率随温度、压强的变化曲线.
考点点评: 本题考查了热化学方程式的书写方法,化学平衡的分析判断,平衡常数计算应用,原电池、电解池原理中的电子守恒计算,综合考查学生的分析能力和计算能力,较为综合,题目难度中等.1年前查看全部
- (2013•绥化)二甲醚(CH3OCH3)可由H2和物质X在一定条件下反应制得.反应的化学方程式为2X+4H2
(2013•绥化)二甲醚(CH3OCH3)可由H2和物质X在一定条件下反应制得.反应的化学方程式为2X+4H2
CH3OCH3+H2O,则X的化学式是( )一定条件 .
A.C2H5OH
B.H2O2
C.C2H4
D.CO 李mm来也1年前1
李mm来也1年前1 -
 xzy323 共回答了18个问题
xzy323 共回答了18个问题 |采纳率83.3%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.根据反应的化学方程式2X+4H2
一定条件
.
CH3OCH3+H2O,反应物中氢原子个数为8,反应后的生成物中碳、氢、氧原子个数分别为2、8、2,根据反应前后原子种类、数目不变,则2X中含有2个碳原子和2个O原子,则每个X分子由1个碳原子和1个氧原子构成,则物质X的化学式为CO.
故选D.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- (2014•南海区三模)二甲醚(CH3OCH3)可由一氧化碳和物质X在一定的条件下制得.反应的化学方程式为2CO+4X═
(2014•南海区三模)二甲醚(CH3OCH3)可由一氧化碳和物质X在一定的条件下制得.反应的化学方程式为2CO+4X═CH3OCH3+H2O,则X的化学式为( )
A.H2
B.H2O2
C.C2H4
D.C2H5OH jonyfan2131年前1
jonyfan2131年前1 -
 hy2959 共回答了17个问题
hy2959 共回答了17个问题 |采纳率94.1%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.根据反应的化学方程式2CO+4X═CH3OCH3+H2O,反应物中碳、氧原子个数分别为2、2,反应后的生成物中碳、氢、氧原子个数分别为2、8、2,根据反应前后原子种类、数目不变,则4X中含有8个氢原子,则每个X分子由2个氢原子构成,则物质X的化学式为H2.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
①2H2(g)+CO(g)⇌CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
(1)总合成反应的热化学方程式为______.
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是______(填字母代号).
A.高温高压B.加入催化剂C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)已知反应②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表格:
此时,v(正)______ v(逆)(填“>”、“<”或“=”);达到平衡后,CH3OCH3的物质的量浓度是______.物质 CH3OH CH3OCH3 H2O c/mol•L-1 0.44 0.60 0.60  lijie12141年前1
lijie12141年前1 -
 n33960 共回答了16个问题
n33960 共回答了16个问题 |采纳率87.5%解题思路:(1)依据盖斯定律解答,从待求反应出发,分析已知反应的反应物和生成物,通过相互加减得到待求反应;
(2)提高转化率,需使平衡向正向移动,利用勒夏特列原理分析;
(3)利用K与Qc的相对大小解决第一问;用三段式法求得第二问.(1)已知
①2H2(g)+CO(g)⇌CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
据盖斯定律,①×2+②+③得:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-246.4 kJ•mol-1
故答案为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-246.4 kJ•mol;
(2)A、因△H<0,升温时平衡逆向移动,CO的转化率降低,故A错误;
B、加入催化剂能同等程度地加快正逆反应速率,平衡不发生移动,故B错误;
C、减少生成物的浓度,平衡正向移动,能增大CO的转化率,故C正确;
D、增大CO的浓度,平衡虽然正向移动,但CO的转化率降低,故D错误;
E、减少生成物的浓度,平衡正向移动,能增大CO的转化率,故E正确.
故答案为:CE;
(3)此时的Qc=
c(CO2)×c(CH3OCH3)
c2(CH3OH)=
0.6×0.6
0.442=1.86<K=400,故未达到平衡,反应向正向进行,v(正)>v(逆);
将上表中的浓度可知,CH3OH的起始浓度为0.44+0.6×2=1.64,设CH3OCH3的浓度增大了x,则有
2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
起始(mol/L) 1.64 0 0
转化(mol/L) 2x x x
平衡(mol/L)1.64-2x x x
K=
c(CO2)×c(CH3OCH3)
c2(CH3OH)=
x2
(1.64−2x)2=400
x=0.80mol/L,
故答案为:>;0.80mol/L.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的影响因素.
考点点评: 本题考查了盖斯定律的计算应用,化学平衡的影响因素分析判断,平衡常数的计算应用,注意平衡常数随温度变化,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上
CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)⇌CH3OH(g)+91kJ
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)+24kJ
③CO(g)+H2O(g)⇌CO2(g)+H2(g)+41kJ
新工艺的总反应为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)+Q.
 为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是______,其原因是______.
为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是______,其原因是______.  zhy11001年前1
zhy11001年前1 -
 qoing 共回答了19个问题
qoing 共回答了19个问题 |采纳率84.2%解题思路:由图象可知,温度低于240℃时,CO的转化率随温度升高而增大,但温度高于240℃时,温度越高,CO的转化率越低,可说明240℃时达到平衡状态,且正反应为放热反应,以此解答.由图象可知,CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,可能原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小,
故答案为:温度低于240℃时,CO的转化率随着温度的升高而增大,而温度高于240℃时,CO的转化率随着温度的升高而减小;在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大,而在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.点评:
本题考点: 转化率随温度、压强的变化曲线.
考点点评: 本题考查化学平衡的影响,侧重于学生的分析能力的考查,为高频考点,注意把握图象的曲线变化趋势,结合温度的变化对平衡移动的影响思考,难度不大.1年前查看全部
- 上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行.二甲醚(CH3OCH3)被称为21世纪的新型燃料,清
上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行.二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.有关说法不正确的是( )
A.该燃料电池中通入二甲醚的一极为负极
B.在燃料电池中二甲醚最终转化为CO2和H2O
C.二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染
D.消耗0.5 mol二甲醚可以向外电路提供6mole- 海州0011年前1
海州0011年前1 -
 whml0540 共回答了17个问题
whml0540 共回答了17个问题 |采纳率100%解题思路:该电池属于燃料电池,负极上燃料二甲醚失电子发生氧化反应,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,正极上氧气得电子发生还原反应,电极反应式为3O2+12e-+6H2O=12OH-,结合物质间的关系式解答.A.该燃料电池中,二甲醚失电子发生氧化反应,所以通入二甲醚的电极是负极,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,故A正确;
B.碱性电池中,二氧化碳能和氢氧根离子反应生成碳酸根离子,所以二甲醚最终转化为碳酸根离子和水,故B错误;
C.二甲醚属于有机物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故C正确;
D.消耗0.5 mol二甲醚可以向外电路提供电子的物质的量=0.5mol×2×(4+2)=6mol,故D正确;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,明确正负极上发生的电极反应式是解本题关键,注意电极反应式的书写要结合电解质溶液的酸碱性,题目难度不大.1年前查看全部
- 二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ、合成二甲醚反应一:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-247kJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压B、加催化剂C、体积不变充入N2 D、增加CO浓度E、分离出二甲醚
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
(1)该电池正极的电极反应式为______. 电池在放电过程中,b对应的电极周围溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.
①X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式:2Cl-+2H2O
2OH-+H2↑+Cl2↑电解 .2Cl-+2H2O.
2OH-+H2↑+Cl2↑电解 .
②X、Y分别为铜、银,a为1L 0.2mol/L AgNO3溶液,写出Y电极反应式:______.
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图三计算,上述电解过程中消耗二甲醚的质量为______.
②若图三的B点pH=7,则滴定终点在______区间(填“AB”、“BC”或“CD”).
③C点溶液中各离子浓度大小关系是______. 高职高专1年前1
高职高专1年前1 -
 若宣 共回答了20个问题
若宣 共回答了20个问题 |采纳率75%解题思路:I.要提高CO的转化率,改变条件使反应向正反应方向移动,可以通过改变温度、压强、浓度使平衡向正反应方向移动;
II.(1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水;
电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,导致氢离子浓度增大;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算二甲醚的质量;
②滴定终点二者恰好反应生成CH3COOK;
③C点溶液中的溶质是CH3COOK和CH3COOH,溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度.I.要提高CO的转化率,改变条件使反应向正反应方向移动,可以通过改变温度、压强、浓度使平衡向正反应方向移动,A、低温高压平衡向正反应方向移动,所以能提高CO的转化率,故正确;B、加催...
点评:
本题考点: 化学电源新型电池;化学平衡的影响因素;电解原理.
考点点评: 本题考查了原电池和电解池原理、酸碱中和滴定等知识点,这些知识点都是考试热点,知道原电池和电解池中各个电极上发生的电极反应式,近几年中化学电源新型电池及燃料电池考查较多,离子浓度大小比较常常与盐类水解和弱电解质电离联合考查,为学习难点,要熟练掌握基本知识,灵活运用基础知识解答问题,题目难度中等.1年前查看全部
- (2011•如皋市模拟)二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能.
(2011•如皋市模拟)二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能.
Ⅰ.工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
(1)甲烷氧化可制合成气:CH4(g)+[1/2]O2(g)⇌CO(g)+2H2(g)△H=-35.6kJ/mol,该反应是______反应(填“自发”或“非自发”).
(2)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______.830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”)
(3)上述流程中,可循环使用的物质有______.
Ⅱ.如图为绿色电源“直接二甲醚燃料电池”的工作原理示意图.
(1)b电极是______极.
(2)a电极的反应式为______. 自然咖啡1年前1
自然咖啡1年前1 -
 不为爱而生 共回答了21个问题
不为爱而生 共回答了21个问题 |采纳率95.2%解题思路:Ⅰ、(1)依据自发进行的判断依据为△H-T△S<0,是自发进行的反应;△H-T△S>0,是非自发进行的反应;
(2)依据热化学方程式和盖斯定律计算得到热化学方程式进行计算应用;催化反应室内的反应条件是压力2.0~10.0Mpa,温度230~280℃;结合化学平衡影响因素分析判断;
(3)依据反应过程中的中间产物是可以循环利用的物质;
Ⅱ、反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,b为正极,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子.I.(1)甲烷氧化可制合成气:CH4(g)+[1/2]O2(g)⇌CO(g)+2H2(g)△H=-35.6kJ/mol,△S>0,△H<0,;△H-T△S<0,反应能自发进行,故答案为:自发;
(2)催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应.
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
依据盖斯定律①×2+②+③得到:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol;
830℃时反应③的K=1.0,则在催化反应室中,压力2.0~10.0Mpa,温度230~280℃,温度降低.平衡正向进行,反应③的K增大;
故答案为:-246.1kJ/mol;>;
(3)依据催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应.
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
CO、甲醇和水,是中间产物,H2也可以部分循环,故答案为:CO、H2、甲醇和水;
II.反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,b为正极,氧气得到电子发生还原反应,故答案为:正;CH3OCH3+3H2O-12e-=2CO2+12H+.点评:
本题考点: 焓变和熵变;化学电源新型电池;化学平衡常数的含义.
考点点评: 本题考查了反应自发进行的判断依据,盖斯定律的计算应用,平衡影响因素的分析判断,原电池的电极判断,电极反应书写应用,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚.下列叙述正确的是( )
A.二甲醚分子中只含有极性键
B.二甲醚为不可再生能源
C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式为:CH3OCH3-12e-+12OH-=2CO2+8H2O
D.二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g);△H=-1455kJ/mol 我是熊熊熊熊熊1年前1
我是熊熊熊熊熊1年前1 -
 天堂小笨鱼 共回答了16个问题
天堂小笨鱼 共回答了16个问题 |采纳率93.8%解题思路:A、同种非金属元素之间能形成非极性键,不同非金属元素之间形成极性键.
B、通过天然作用或人工活动能再生更新,而为人类反复利用的自然资源叫可再生资源,据此判断.
C、燃料电池中,负极上失电子发生氧化反应,要根据电解质溶液的酸碱性判断生成物.
D、燃烧热方程式中产物必须是稳定的氧化物.A、二甲醚分子中,碳原子和氢原子之间存在极性键,碳原子和氧原子之间存在极性键,故A正确.
B、工业上用合成气(CO、H2)直接或间接制取二甲醚,二甲醚为可再生资源,故B错误.
C、二甲醚生成的二氧化碳会和氢氧根离子反应生成碳酸根离子,所以该电池中负极上的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O,故C错误.
D、该反应方程式中水蒸气不是氢元素的稳定氧化物,应改为液态水,故D错误.
故选A.点评:
本题考点: 极性键和非极性键;热化学方程式;化学电源新型电池.
考点点评: 本题考查了化学键的判断、电极反应式和燃烧热方程式等知识点,难点是书写电极反应式,注意书写电极反应式时要结合电解质溶液的酸碱性判断生成物.1年前查看全部
- (2012•黄浦区一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上
(2012•黄浦区一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上
CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)⇌CH3OH(g)+91kJ
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)+24kJ
③CO(g)+H2O(g)⇌CO2(g)+H2(g)+41kJ
新工艺的总反应为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)+Q.
31.该反应Q=.
32.增大压强,CH3OCH3的产率(选填“增大”、“减小”或“不变”).
33.原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是. 34.为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是______,其原因是______.
34.为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是______,其原因是______.  day236165761年前1
day236165761年前1 -
 哭泣猫 共回答了15个问题
哭泣猫 共回答了15个问题 |采纳率80%解题思路:由图象可知,温度低于240℃时,CO的转化率随温度升高而增大,但温度高于240℃时,温度越高,CO的转化率越低,可说明240℃时达到平衡状态,且正反应为放热反应,以此解答.由图象可知,CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,可能原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小,
故答案为:温度低于240℃时,CO的转化率随着温度的升高而增大,而温度高于240℃时,CO的转化率随着温度的升高而减小;在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大,而在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.点评:
本题考点: 转化率随温度、压强的变化曲线.
考点点评: 本题考查化学平衡的影响,侧重于学生的分析能力的考查,为高频考点,注意把握图象的曲线变化趋势,结合温度的变化对平衡移动的影响思考,难度不大.1年前查看全部
- 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上
CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)⇌CH3OH(g)+91kJ
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)+24kJ
③CO(g)+H2O(g)⇌CO2(g)+H2(g)+41kJ
新工艺的总反应为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)+Q.
该反应Q=______. 绿罗公主1年前1
绿罗公主1年前1 -
 zmh258 共回答了14个问题
zmh258 共回答了14个问题 |采纳率100%解题思路:运用盖斯定律的原理,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.已知①CO(g)+2H2(g)⇌CH3OH(g)+91kJ
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)+24kJ
③CO(g)+H2O(g)⇌CO2(g)+H2(g)+41kJ
据盖斯定律,①×2+②+③得:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)+(91KJ×2+24KJ+41KJ)为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)+247KJ
故答案为:247KJ.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:
1、所求反应中的反应物在已知反应的哪个反应了?是反应物还是生成物?
2、已知反应中哪些物质是所求反应中没有的?
3、如何才能去掉无用的?然后,通过相互加减,去掉无关物质.
将所对应的△H代入上述化学方程式的加减中就可以了.1年前查看全部
- (2014•淄博三模)己知:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1.某温度下
(2014•淄博三模)己知:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1.某温度下的平衡常数为400.此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是( )
物质 CH3OH CH3OCH3 H2O c/(mol•L-1) 0.08 1.6 1.6
A.此时刻反应达到平衡状态
B.容器内压强不变时,说明反应达平衡状态
C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D.平衡时,反应混合物的总能量降低40kJ 我不做aa好多天1年前1
我不做aa好多天1年前1 -
 xiaoyu821111 共回答了13个问题
xiaoyu821111 共回答了13个问题 |采纳率76.9%解题思路:A.首先根据公式计算出浓度商Q,然后根据Q与K的大小关系,判断反应是否达到平衡状态;
B.该反应在恒容时压强始终不变,故不能说明反应达平衡状态;
C.平衡时再加入与起始等量的CH3OH,两次平衡为等效平衡,CH3OH转化率不变;
D.反应混合物的总能量减少等于反应放出的热量,根据B计算中可知生成的n(CH3OCH3),结合热化学方程式计算放出的热量.A.已知2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则浓度商Q=
c(CH3OCH3)c(H2O)
c2(CH3OH)=
1.6×1.6
0.082=400,Q=K,说明反应达到平衡状态,故A正确;
B.该反应前后气体物质的量不变,在恒容时压强始终不变,故不能说明反应达平衡状态,故B错误;
C.平衡时再加入与起始等量的CH3OH,两次平衡为等效平衡,所以达新平衡后,CH3OH转化率不变,故C正确;
D.反应混合物的总能量减少等于反应放出的热量,由B中可知,平衡时后c(CH3OCH3)=1.6mol/L,所以平衡时n(CH3OCH3)=1.6mol/L×1L=1.6mol,由热化学方程式可知反应放出的热量为25kJ/mol×1.6mol=40kJ,故平衡时,反应混合物的总能量减少40kJ,故D正确;
故选B.点评:
本题考点: 化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数的有关计算与影响因素、化学平衡移动、化学反应中能量变化等,难度中等,根据化学平衡常数进行计算、判断反应进行方向是考查的趋势.1年前查看全部
- (2011•福州)二甲醚(CH3OCH3)可由一氧化碳和物质X在一定的条件下制得.反应的化学方程式为2CO+4X
(2011•福州)二甲醚(CH3OCH3)可由一氧化碳和物质X在一定的条件下制得.反应的化学方程式为2CO+4X
CH3OCH3+H2O,则X的化学式为( )一定条件 .
A.C2H5OH
B.H2O2
C.C2H4
D.H2 爱情小乖乖1年前1
爱情小乖乖1年前1 -
 jianghonghong775 共回答了19个问题
jianghonghong775 共回答了19个问题 |采纳率89.5%解题思路:根据质量守恒定律,化学反应前后元素种类及原子个数不变,分别统计出反应前后原子种类及个数,比较分析可得所求物质的化学式.解;根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为C:2个、O:2个;已知生成物中含有的原子种类及原子个数为C:2个、O,2个、H:8个;比较分析可知X中含有H元素,其原子个数分别为2,故X的化学式为H2.
故选D点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.
考点点评: 此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御,正确解答.1年前查看全部
- 某温度下,反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中
某温度下,反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
下列说法不正确的是( )物质 CH3OH CH3OCH3 H2O 浓度/(mol•L-1) 0.44 0.6 0.6
A.CH3OH的起始浓度为1.64 mol/L
B.此时逆反应速率小于正反应速率
C.平衡时,CH3OH的浓度为0.04 mol/L
D.平衡时,CH3OH的转化率小于90% stonaliao1年前1
stonaliao1年前1 -
 Junixs 共回答了26个问题
Junixs 共回答了26个问题 |采纳率96.2%解题思路:A、甲醇起始量浓度等于变化浓度和剩余浓度的和;
B、依据浓度商和平衡常数比较分析反应进行的方向;
C、依据平衡常数和化学平衡三段式列式计算得到;
D、依据计算得到甲醇的变化浓度,进而计算甲醇的转化率.A、根据反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g),当甲醚和水的浓度是0.6mol/L,所以消耗的甲醇是1.2mol/L,即甲醇起始量浓度为0.44+1.2=1.64mol/L,故A正确;
B、表中数据分析计算Q=[0.6×0.6
0.442=1.86<400,说明反应正向进行,v正>v逆,故B正确;
C、设转化的甲醇浓度为x
2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
起始量( mol/L)1.64 0 0
变化量(mol/L) x 0.5x 0.5x
平衡量(mol/L) 1.64-x 0.5x 0.5x
则
(0.5x)2
(1.64−x)2=400,解得x=1.6mol/L,所以平衡时,CH3OH的浓度为1.64mol/L-1.6mol/L=0.04mol/L,故C正确;
D、达到平衡时,甲醇的转化率=
1.6mol/L/1.64mol/L]≈98%,故D错误.
故选D.点评:
本题考点: 化学平衡的计算;化学平衡建立的过程.
考点点评: 本题考查了化学平衡常数的计算应用,平衡常数随温度变化,化学平衡三段式计算方法的应用,题目难度中等.1年前查看全部
- CH3CH2OH和CH3OCH3互为同分异构体吗?
 greycollar1年前1
greycollar1年前1 -
 aoliaoaoliao 共回答了19个问题
aoliaoaoliao 共回答了19个问题 |采纳率94.7%两者的分子式都为C2H6O,而一个是醇一个是醚,因此属于同分异构体.1年前查看全部
- 下列说法不正确的是( )A.CH4和C2H6互为同系物B.H2和D2互为同位素C.C2H5OH和CH3OCH3互为同分
下列说法不正确的是( )
A.CH4和C2H6互为同系物
B.H2和D2互为同位素
C.C2H5OH和CH3OCH3互为同分异构体
D.O2和O3互为同素异形体 kk珠1年前1
kk珠1年前1 -
 白眼豆 共回答了23个问题
白眼豆 共回答了23个问题 |采纳率87%解题思路:A、同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
B、质子数相同质量数(或中子数)不同的原子互称同位素;
C、具有相同分子式而结构不同的化合物互为同分异构体;
D、同种元素形成的不同单质互为同素异形体.A、CH4和C2H6互分子通式相同,都为烷烃,相差1个CH2原子团,互为同系物,故A正确;
B、同位素使用范是原子,H2和D2互是氢元素形成的单质,结构相同,为同一物质,故B错误;
C、C2H5OH和CH3OCH3分子式相同,结构不同,C2H5OH属于醇,CH3OCH3属于醚,为种类异构,故C正确;
D、O2与O3是氧元素形成的不同单质,互为同素异形体,故D正确.
故选B.点评:
本题考点: 芳香烃、烃基和同系物;同位素及其应用;同素异形体;同分异构现象和同分异构体.
考点点评: 本题考查“五同”的概念分析、比较,难度不大,以加深对五个概念的认识与理解,“五同”是指同位素、同素异形体、同系物、同分异构体、同种物质,注意从相同的内容、不同的内容、使用范围等方面掌握判断的方法和技巧.1年前查看全部
- 甲醚(CH3OCH3)是一种新型的合成“柴油”,它可由天然气(体积分数:CO2为5%,CH4为95%)合成.
甲醚(CH3OCH3)是一种新型的合成“柴油”,它可由天然气(体积分数:CO2为5%,CH4为95%)合成.
过程如下(气体体积均在同温同压下测定;氧气由空气提供,其中N2和O2的体积比为4:1;不考虑CO与水的反应;各步反应转化率均为100%):
造气:CH4+H2O==3H2+CO
CH4+CO2==2H2+2CO
2CH4+O2==4H2+2CO
1)若造气得到的气体只含CO和H2,该混合气体中,碳元素的质量分数为a%,则氢元素的质量分数为 %(用含a的式子表示).
2)造气时每使用100m3天然气,应同时通入水蒸气________m3、空气_________m3,才能保证合成时CO与H2的体积比为1:2;合成甲醚后,有________m3的水蒸气可参加循环生产. AYYZG1231年前1
AYYZG1231年前1 -
 玩世不恭小无赖 共回答了13个问题
玩世不恭小无赖 共回答了13个问题 |采纳率100%忘记怎么写正规格式了 我写下算法格式你自己弄吧!
碳元素的质量分数为a% 得到气体只含CO和H2 所以每含有一个碳原子就含有一个氧原子C:O=12:16 算的氧元素的质量分数为4a/3% 氢元素的质量分数=1-a%-4a/3%=整理后的数字
保证CO和H2的体积比为1:2配成生成物中CO和H2比为1:2
2CH4+2H2O=6H2+2CO
CH4+CO2=2H2+2CO
16CH4+8O2=32H2+16CO 把三个方程式相加得
19CH4+2H2O+CO2+8O2=40H2+20CO
95 10 5 40 200 100
所以每使用100m3天然气应同时通入水蒸气10m3、200空气m3(氧气占空气20%)
每100m3天然气可制得100m3一氧化碳
2CO+4H2=C2H6O+H2O
100 200 50 50
所以有20m3的水蒸气可参加循环生产.
不知道对不对从高中毕业就没在碰过化学在加上上班这么多年都快还给老师了.1年前查看全部
- 已知:2CH3OH(g) CH3OCH3(g) + H2O(g),ΔH=-25 kJ/mol
已知:2CH3OH(g) CH3OCH3(g) + H2O(g),ΔH=-25 kJ/mol
此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 CH3OH CH3OCH3 H2O
c/(mol·L-1) 0.8 1.24 1.24
1 .平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率该如何变化
2.平衡时,反应混合物的总能量该如何变化
请您帮我尽量详细分析 chishanjing11年前1
chishanjing11年前1 -
 mmdd人 共回答了20个问题
mmdd人 共回答了20个问题 |采纳率90%1.再加入与起始量等的CH3OH,先假设这些CH3OH是放入旁边容器中,那麼此时新平衡和原平衡是等效的.然後把中间隔板拿走,混合之後平衡不移动.最後把体积压缩回原来大小.由於压缩体积平衡不移动,因此最终还是等效平衡,所以转化率不变.
2.因为是放热反应,所以能量要降低.1年前查看全部
- 二甲醛(CH3OCH3)被称为21世纪的新型燃料,如图为“二甲醛燃料电池”的工作原理示意图.下列说法正确的是( )
 二甲醛(CH3OCH3)被称为21世纪的新型燃料,如图为“二甲醛燃料电池”的工作原理示意图.下列说法正确的是( )
二甲醛(CH3OCH3)被称为21世纪的新型燃料,如图为“二甲醛燃料电池”的工作原理示意图.下列说法正确的是( )
A.a电极的电极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+
B.该装置中电子从负极沿导线到正极,再从电解质中到负极,形成闭合回路
C.用此电池精炼Cu,应将b电极接纯铜
D.消耗标准状况下22.4L O2时,b电极转移电子2mol 人争非之1年前1
人争非之1年前1 -
 fox1111 共回答了24个问题
fox1111 共回答了24个问题 |采纳率95.8%解题思路:该燃料电池中,通入二甲醚的电极为负极,电解质溶液中存在自由移动的氢离子,所以电解质溶液呈酸性,负极电极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+,正极上电极反应式为O2+4e-+4H+=2H2O,电子从负极沿导线流向正极,再根据氧气和转移电子之间的关系计算.A.该装置为燃料电池,通入二甲醚的电极为负极,根据图中离子移动方向知,电解质溶液呈酸性,负极电极反应为CH3OCH3+3H2O-12e-═2CO2+12H+,故A正确;
B.电子不能进入电解质溶液,电解质溶液是通过离子定向移动形成电流,故B错误;
C.用此电池精炼Cu,应将b电极接粗铜,故C错误;
D.消耗标准状况下22.4L O2时,b电极转移电子的物质的量=
22.4L
22.4L/mol×4=4mol,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据得失电子确定正负极,会正确书写电极反应式,易错选项是B,注意电子不通过电解质溶液,知道电解质溶液形成电流原理,为易错点.1年前查看全部
- (2013•常州一模)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料.以CH4和H2O为原料制备二
(2013•常州一模)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

(1)写出催化反应室1中在一定条件下进行的化学反应方程式:CH4+H2O
CO+3H2一定条件 .CH4+H2O.
CO+3H2一定条件 .
(2)在压强为0.1MPa条件下,反应室3(容积为V L)中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度、压强的关系如图1所示,则
①p1______(填“<”“>”或“=”)p2.
②在其他条件不变的情况下,反应室3再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率______(填“增大”“减小”或“不变”).
③在p1压强下,100℃时,反应:CH3OH(g)⇌CO(g)+2H2(g)的平衡常数为a2 V2 .(用含a、V的代数式表示)a2 V2 
(3)图2为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为______.
(4)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)⇌CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g);△H=-41.3kJ•mol-1
则反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=______. 颖彬1年前1
颖彬1年前1 -
 猪头249 共回答了18个问题
猪头249 共回答了18个问题 |采纳率88.9%解题思路:(1)由工艺流程图可知,催化反应室1中发生的反应是甲烷与水在一定条件下生成一氧化碳与氢气;
(2)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)⇌CH3OH(g)可知压强越大,越有利于平衡向正反应进行;
②在其它条件不变的情况下,反应室3再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大;
③由图1可知,在P1压强下,100℃时,CO的转化率为0.5,据此计算CO的浓度变化量,根据三段式计算平衡时各组分的平衡浓度,计算合成甲醇的化学平衡常数,再利用相同温度下,对同一反应的正逆反应平衡常数互为倒数计算甲醇分解的化学平衡常数;
(3)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,由图可知,a极为负极,二甲醚放电生成二氧化碳,由离子交换膜可知还生成氢离子;
(4)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.(1)由工艺流程图可知,催化反应室1中发生的反应是甲烷与水在一定条件下生成一氧化碳与氢气,反应方程式为:CH4+H2O
一定条件
.
CO+3H2,
故答案为:CH4+H2O
一定条件
.
CO+3H2;
(2))①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)⇌CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强P1<P2,
故答案为:<;
②在其它条件不变的情况下,反应室3再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大,故答案为:增大;
③CO的起始浓度为[a/V]mol/L,H2的起始浓度为[2a/V]mol/L,由图1可知,在P1压强下,100℃时,CO的转化率为0.5,CO的浓度变化量为[a/V]mol/L×0.5=[a/2V]mol/L,则:
CO(g)+2H2(g)⇌CH3OH(g)
开始(mol/L):[a/V] [2a/V] 0
变化(mol/L):[a/2V] [a/V] [a/2V]
平衡(mol/L):[a/2V] [a/V] [a/2V]
所以平衡常数k=
a
2V
a
2V×(
a
V)2=
V2
a2
故相同温度下,CH3OH(g)⇌CO(g)+2H2(g)的平衡常数为
1
V2
a2=
a点评:
本题考点: 化学平衡的影响因素;用盖斯定律进行有关反应热的计算;化学电源新型电池;化学平衡常数的含义.
考点点评: 本题考查影响平衡的因素、化学平衡常数、化学平衡图象、反应热的计算等,难度中等,(3)中注意根据离子交换膜判断有氢离子生成是关键,可以利用总反应式减去正极反应式进行书写.1年前查看全部
- (2014•昭通模拟)二甲醚(CH3OCH3)和甲醇(CH3OH)都是高效清洁能源.工业上利用煤的气化产物(水煤气)合成
(2014•昭通模拟)二甲醚(CH3OCH3)和甲醇(CH3OH)都是高效清洁能源.工业上利用煤的气化产物(水煤气)合成甲醇和二甲醚.回答下列问题:
(1)制备二甲醚最后一步反应由Al2O3催化甲醇脱水合成,反应方程式为2CH3OH
CH3OCH3+H2O氧化铝 2CH3OH.
CH3OCH3+H2O氧化铝
(2)已知:CO(g)+2H2(g)═CH3OH (g)△H=-90.1kJ•mol-1
CO(g)的燃烧热是282.8kJ•mol-1;H2的燃烧热是285.8kJ•mol-1
写出表示CH3OH (g) 燃烧热的热化学反应方程式CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-764.4 kJ•mol-1CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-764.4 kJ•mol-1.
(3)二甲醚直接燃料电池比甲醇直接燃料电池更高效,等质量的二甲醚和甲醇完全放电转移电子的物质的量之比是______.用二甲醚直接燃料电池电解足量饱和食盐水,当消耗9.2g二甲醚时理论上阴极产生的气体的体积为______L.(标况下)
(4)在合成中伴有水煤气交换反应:CO(g)+H2O(g)═CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表.
①请解释CO转化率随温度变化的关系______.温度 260℃ 280℃ 295℃ 310℃ CO转化率 89% 80% 75% 60%
②列式计算280℃时平衡常数______.
③若平衡体系中,测得H2的压强占总压的30%,要使体系中CO转化率达到70%,应该使温度______(填“升高”、“降低”、“不变”) tatatatatata1年前1
tatatatatata1年前1 -
 大海广阔 共回答了21个问题
大海广阔 共回答了21个问题 |采纳率95.2%解题思路:(1)甲醇在氧化铝催化剂作用下发生分子间脱水生成二甲醚;
(2)分别写出CO、H2的燃烧热的热化学方程式,利用盖斯定律可求出CH3OH燃烧热的热化学方程式;
(3)根据二甲醚和甲醇燃烧的方程式解答;求出9.2g二甲醚转移电子数,串联电路每个电极转移电子守恒,依据电解饱和食盐水时阴极电极反应式求出产生气体的体积;
(4)①依据温度对平衡移动的影响解答;
②列三段求出平衡时各物质浓度带入平衡常数表达式求解;
③列三段求出H2的压强占总压的30%时,CO的转化率,依据温度对平衡移动的影响解答.(1)甲醇在氧化铝催化剂作用下发生分子间脱水生成二甲醚和水方程式为:2CH3OH
氧化铝
CH3OCH3+H2O;
故答案为:2CH3OH
氧化铝
CH3OCH3+H2O;
(2)CO燃烧的热化学方程式:CO(g)+[1/2]O2(g)═CO2(g)△H=-282.8 kJ•mol-1 ①
H2燃烧的热化学方程式:H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8 kJ•mol-1 ②
CO(g)+2H2(g)═CH3OH (g)△H=-90.1kJ•mol-1③
根据盖斯定律:①+②×2-③得甲醇燃烧的热化学方程式:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-764.4 kJ•mol-1 ,
故答案为:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-764.4 kJ•mol-1 ;
(3)取mg二甲醚和甲醇则转移电子数关系
CH3OCH3+3O2
点燃
2CO2+3H20,转移电子数
4612mol
m [12m/46]
2CH3OH+3O2
燃烧
2CO2+4H2O 转移电子数
64 12mol
m [12m/64]
等质量的二甲醚和甲醇完全放电转移电子的物质的量之比=[12m/46]:
12m
64点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡建立的过程.
考点点评: 本题考查了反应热的计算,热化学方程式的书写,燃料电池原理,化学平衡常数的计算和应用,影响化学平衡移动的因素,题目综合性强,涉及考点均为高考的热点,需要对相应知识有很好的把握,难度较大,是个好题.1年前查看全部
- 初三化学题,谢谢,高手请进经测定,有甲醛(CH2O)、醋酸(CH3COOH)和丙酮(CH3OCH3)组成的混合物中,氢元
初三化学题,谢谢,高手请进
经测定,有甲醛(CH2O)、醋酸(CH3COOH)和丙酮(CH3OCH3)组成的混合物中,氢元素的质量分数为x%,则其混合物中氧元素的质量分数是( D ).
A 0.5x%
B 1-1.5x%
C 2x%
D 1-7x%
请讲的详细点谢谢了.
 ifeeling6261年前1
ifeeling6261年前1 -
 蝶戏猫 共回答了27个问题
蝶戏猫 共回答了27个问题 |采纳率92.6%甲醛 CH2O
醋酸 C2H4O2
丙酮 C3H6O,
观察发现,每个组分C:H=1:2,H的质量分数是x%,所以CH2的质量分数是7x%,剩余就是氧,所以就是1-7x%1年前查看全部
- 下列叙述错误的是( )A.乙醇(CH3CH2OH)和二甲醚(CH3OCH3)互为同分异构体B.CH2=CH-CH2-C
下列叙述错误的是( )
A.乙醇(CH3CH2OH)和二甲醚(CH3OCH3)互为同分异构体
B.CH2=CH-CH2-CH3和CH2=CH-CH=CH-CH2-CH3属于同系物
C.石墨与C60是同素异形体
D.1H、2H、3H是氢的三种同位素 SOPHIA8110221年前1
SOPHIA8110221年前1 -
 dmpagr 共回答了19个问题
dmpagr 共回答了19个问题 |采纳率89.5%解题思路:A.具有相同分子式而结构不同的化合物互为同分异构体;
B.同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
C.同种元素形成的不同单质互为同素异形体;
D.质子数相同,中子数不同的原子互称同位素.A.乙醇(CH3CH2OH)和二甲醚(CH3OCH3)分子式相同,结构不同,互为同分异构体,故A正确;
B.CH2=CH-CH2-CH3和CH2=CH-CH=CH-CH2-CH3中官能团数目不等,结构不相似,不是同系物,故B错误;
C.石墨与C60是碳元素形成的不同单质,互为同素异形体,故C正确;
D.1H、2H、3H的质子数相同,中子数不同,互称同位素,故D正确;
故选B.点评:
本题考点: 同分异构现象和同分异构体;同位素及其应用;同素异形体;芳香烃、烃基和同系物.
考点点评: 本题考查“五同”比较,难度不大,侧重考查学生的辨别能力.1年前查看全部
- (2011•肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
 (2011•肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
(2011•肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
(1)合成二甲醚反应一:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)△H=-247kJ/mol一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A.低温高压B.加催化剂C.体积不变充入N2D.增加CO浓度E.分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)═CH3OCH3(g)+H2O(g).在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
①该温度的平衡常数为______.物质 CH3OH CH3OCH3 H2O 浓度/mol•L-1 0.01 0.2 0.2
②10min内平均反应速率v(CH3OH)=______;
(3)如图为绿色电源“二甲醚燃料电池”的工作原理示意图.该反应的还原剂是______(写名称);
若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:______. killhbr1年前1
killhbr1年前1 -
 thy8112 共回答了19个问题
thy8112 共回答了19个问题 |采纳率78.9%解题思路:(1)要提高CO的转化率,应使平衡向正反应分析移动;
(2)2CH3OH(g)═CH3OCH3(g)+H2O(g)
①K=生成物浓度幂之积与反应物浓度幂之积的比;
②计算二甲醚的反应速率,结合反应速率之比等于化学计量数之比计算v(CH3OH);
(3)燃料电池中,负极上是燃料发生失电子的氧化反应.(1)A正反应放热,则降低温度可使平衡向正方向移动,增大压强平衡向正方向移动,故A正确;
B.加入催化剂平衡不移动,故B错误;
C.体积不变充入N2,平衡不移动,故C错误;
D.增加CO浓度,CO的转化率降低,故D错误;
E.分离出二甲醚,可使平衡向正方向移动,
故答案为:AE;
(2)①由表格中的数据及K的定义可知,K=[0.2×0.2
(0.01)2=400,故答案为:400;
②由表格中的数据可知,v(CH3OCH3)=
0.2mol/L/10min]=0.02 mol•L-1•min-1,又反应速率之比等于化学计量数之比,
v(CH3OH)=2×0.02 mol•L-1•min-1=0.04 mol•L-1•min-1,故答案为:0.04 mol•L-1•min-1;
(3)由“二甲醚燃料电池”的工作原理示意图可知,二甲醚失去电子,作还原剂,a为负极,负极反应为(CH3)2O-12e-+3H2O=2CO2+12H+或 C2H6O-12e-+3H2O=2CO2+12H+,故答案为:二甲醚;(CH3)2O-12e-+3H2O=2CO2+12H+或 C2H6O-12e-+3H2O=2CO2+12H+.点评:
本题考点: 化学平衡的计算;常见化学电源的种类及其工作原理;化学平衡常数的含义;化学平衡的影响因素;化学反应速率和化学计量数的关系.
考点点评: 本题考查较为综合,涉及化学平衡的移动,原电池及反应速率、平衡常数的计算,题目难度中等,注意把握电极方程式的书写以及平衡常数的意义.1年前查看全部
- 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)═CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为______.
A.加入某物质作催化剂
B.加入一定量CO
C.反应温度降低
D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为______;若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=______mol/L.
(3)催化反应室中总反应3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)的△H=______;830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”).
(4)二甲醚的燃烧热为1455kJ•mol-1,则二甲醚燃烧的热化学方程式为______.
(5)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示.写出a电极上发生的电极反应式______. bearhyh1年前1
bearhyh1年前1 -
 爱老虎尤 共回答了17个问题
爱老虎尤 共回答了17个问题 |采纳率88.2%解题思路:(1)已知反应①是体积减小的放热反应,根据外界条件对平衡的影响分析;(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,根据v(CO)=△c△t计算v(CO);计算该温度下的平衡常数,根据平衡常数计算平衡时氢气的浓度,根据甲醇的平衡浓度计算氢气浓度的变化量,进而计算a的值;(3)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;(4)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式;(5)依据图示分析通入氧气的一端为正极,通入二甲醚的一端为负极,电解质溶液为酸性环境,二甲醚失电子生成二氧化碳,根据电子守恒写出电极反应.(1)已知反应①是体积减小的放热反应,若要增大反应①中H2的转化率,则需要使平衡正移,所以改变的条件为加入一定量CO或反应温度降低;
故答案为:BC;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,所以v(CO)=[0.5mol/L/5min]=0.1mol/(L•min);
该温度到达平衡时,c(CO)=0.5mol/L,c(H2)=2.4mol/L-2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以该温度下,平衡常数k=[0.5
0.5×1.42=
25/49],若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L-2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以[2
2×y2=
25/49]
解得y=1.4,故a=2mol/L×2+1.4mol/L=5.4mol/L.
故答案为:0.1mol/(L•min);5.4.
(3)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产,采用300℃的反应温度,目的提高化学反应速率.
故答案为:-246.1kJ/mol;
(4)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
(5)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+;
故答案为:CH3OCH3+3H2O-12e-═2CO2+12H+.点评:
本题考点: 化学平衡的调控作用;化学电源新型电池;化学平衡建立的过程.
考点点评: 本题考查热化学方程式书写,燃烧热概念,平衡移动,图象分析应用,原电池电极反应的书写方法,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
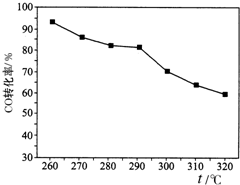 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
反应①2H2(g)+CO(g)⇌CH3OH(g)△H1=-90kJ•mol-1
反应②2CH3OH (g)⇌CH3OCH3 (g)+H2O(g)△H2=-24kJ•mol-1
反应③CO(g)+H2O (g)⇌CO2(g)+H2(g)△H3=-41kJ•mol-1
(1)反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g) 的△H=______.(用△H1、△H2、和△H3表示).
(2)写出由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为______.
(3)有研究者在催化剂、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示.其中CO转化率随温度升高而降低的原因是______.
(4)已知某温度下反应②平衡常数K=400.此温度下向恒容密闭容器中充入CH3OH,10min后反应②达到平衡,c平衡(CH3OH)=0.04mol•L-1,计算CH3OH转化率(写出计算过程,结果保留两位有效数字).计算10min内CH3OH的平均反应速率v(CH3OH)=______. guanp12201年前1
guanp12201年前1 -
 q1234qwer1 共回答了18个问题
q1234qwer1 共回答了18个问题 |采纳率83.3%解题思路:(1)由盖斯定律可知,通过①×2+②+③可得3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g);
(2)依据盖斯定律①×2+②得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g);
(3)H2和CO直接制备二甲醚的反应是放热反应,升高温度,平衡向左移动,CO转化率降低;
(4)到平衡时CH3OCH3的浓度为x mol•L-1,依据化学平衡三段式表示出平衡浓度,带入K计算x,带入相应公式计算.(1)①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=2△H1+△H2+△H3,
故答案为:2△H1+△H2+△H3;
(2)①CO(g)+2H2(g)═CH3OH(g)△H1=-90kJ•mol-1,
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24kJ•mol-1,
依据盖斯定律①×2+②得到:2CO(g)+4H2(g)⇌CH3OCH3+H2O(g)△H=-204kJ•mol-1,
故答案为:2CO(g)+4H2(g)⇌CH3OCH3+H2O(g)△H=-204kJ•mol-1;
(3)2CO(g)+4H2(g)⇌CH3OCH3+H2O(g)是一个可逆反应,反应是放热反应,升高温度,平衡向左移动,CO转化率降低,
故答案为:H2和CO直接制备二甲醚的反应是放热反应,升高温度,平衡向左移动,CO转化率降低;
(4)设达到平衡时CH3OCH3的浓度为x mol•L-1
2CH3OH (g) CH3OCH3 (g)+H2O(g)
CH3OCH3 (g)+H2O(g)
c开始(mol•L-1)0.04+2x 00
变化(mol•L-1) 2xx x
c平衡(mol•L-1)0.04xx
K=
x2
0.042=400,x=0.8mol•L-1,
CH3OH转化率=[2×0.8/0.04+2×0.8]×100%=97.56%,
v(CH3OH)=[2×0.8mol/L/10min]=0.16 mol•L-1min-1,
故答案为:0.16 mol•L-1min-1.点评:
本题考点: 用盖斯定律进行有关反应热的计算;热化学方程式;化学平衡的计算.
考点点评: 本题考查较为综合,涉及化学平衡的移动、反应速率、平衡常数的计算,为高频考点,题目难度中等,注意把握平衡常数的意义.1年前查看全部
- 同分异构体的分类.CH2=C(CH3)2和CH3CH=CHCH3 ,CH3CH2OH和CH3OCH3 这两组分别属于什么
同分异构体的分类.
CH2=C(CH3)2和CH3CH=CHCH3 ,CH3CH2OH和CH3OCH3 这两组分别属于什么类型的异构? 碳链或者官能团、?
碳链异构 官能团位置异构 这两者该怎么区分? mshiys1年前4
mshiys1年前4 -
 我有勇敢的心 共回答了24个问题
我有勇敢的心 共回答了24个问题 |采纳率95.8%前者是碳链异构,后者是官能团互变异构.
碳链相同,只是官能团的位置不同.如C—C—C—C,而碳碳双键的位置不同,这属于官能团的位置异构,1-丁烯,2-丁烯就是同属前述碳链.
如C—C—C—C和C—C(C)—C则属于碳链不同,是碳链异构.1年前查看全部
- 二甲醚(CH3OCH3,沸点为-24.9℃)被称为21世纪的新型能源.科学家利用太阳能分解水生成的氢气与从烟道气中分离出
二甲醚(CH3OCH3,沸点为-24.9℃)被称为21世纪的新型能源.科学家利用太阳能分解水生成的氢气与从烟道气中分离出的CO2在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池.其合成流程如下:

(1)已知:CH3OCH3(g)、H2(g)的标准燃烧热分别为:△H=-1455.0kJ•mol-1、△H=-285.8kJ•mol-1.写出以CO2、H2合成CH3OCH3的热化学方程式:______.
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.写出吸收CO2反应的化学方程式______.
(3)一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL•min-1时,则生成0.3mol二甲醚需要通入CO2的物质的量为______.
(4)图2为二甲醚燃料电池示意图.
①b电极为______,a电极的电极反应式为______.
该燃料电池的最大障碍是氧化反应不完全而产生______(填物质名称)而导致通入电极的气体通道堵塞.
②若以1.12L•min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol•L-1 CuSO4溶液,通电0.50min后,计算理论上可析出金属铜的质量(写出解题过程). 3648064081年前1
3648064081年前1 -
 hjvkly 共回答了23个问题
hjvkly 共回答了23个问题 |采纳率100%解题思路:(1)依据燃烧热写出热化学方程式,结合盖斯定律计算得到合成甲醚的热化学方程式;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)先根据二甲醚的选择性求出理论上生成的二甲醚,然后根据物质的量之比等于化学计量数之比求出反应的CO2的物质的量,最后根据CO2的转化率求出实际通入的CO2;
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子;该燃料电池的最大障碍是氧化反应不完全而产生碳堵塞通入电极的气体通道;
②依据二甲醚通入的量计算物质的量,结合电子守恒计算析出铜的质量;(1)已知:CH30CH3(g)、H2(g)的标准燃烧热分别为:△H=-1455.OkJ•mol-1、△H=-285.8kJ•mol-1,
①CH30CH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1455.0kJ•mol-1;
②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1,
依据盖斯定律②×6-①得到:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol
写出以CO2、H2合成CH3OCH3的热化学方程式为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol,
故答案为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol;
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作C02吸收剂,乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,结合二氧化碳生成碳酸盐,反应的化学方程式为:2HOCH2CH2NH2+H2O+CO2⇌(HOCH2CH2NH3)2CO3;
故答案为:2HOCH2CH2NH2+H2O+CO2⇌(HOCH2CH2NH3)2CO3;
(3)生产0.3mol二甲醚,理论上应生成二甲醚物质的量[0.3mol/5%]=6mol,反应的反应的CO2的物质的量为12mol,实际通入的CO2的物质的量为[12mol/60%]=20mol,
故答案为:20mol;
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+;该燃料电池的最大障碍是氧化反应不完全而产生碳堵塞通入电极的气体通道;
故答案为:正;CH3OCH3+3H2O-12e-═2CO2+12H+;炭;
②若以1.12L•min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol•L-1 CuS04溶液,通电0.50min后,通入二甲醚物质的量=[1.12L/min×0.50min/22.4L/mol]=0.025mol;依据电极反应电子守恒,CH3OCH3--12e---6Cu2+
n(Cu2+)=0.025mol×6=0.15mol
m(Cu)=0.15mol×64g/mol=9.6g
答:理论上可析出金属铜的质量9.6g;点评:
本题考点: 热化学方程式;化学电源新型电池.
考点点评: 本题考查热化学方程式书写,燃烧热概念,流程分析,图象分析应用,原电池电极反应的书写方法,电子守恒的计算应用,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)被称为本世纪的新型燃料,它清洁、高效,具有优良的环保性能.以CH4和H2O为原料制备二甲醚的工业
二甲醚(CH3OCH3)被称为本世纪的新型燃料,它清洁、高效,具有优良的环保性能.以CH4和H2O为原料制备二甲醚的工业流程如图.请回答下列问题:

(1)新型燃料二甲醚(CH3OCH3)中碳元素的化合价为______.
(2)一定条件下,反应室1中发生的化学反应为CH4+H20
CO+3H2,在其它条件不变的情况下升高温度,该反应的反应速率将______(填“增大”、“减小”、或“不变”).催化剂 .△
(3)在催化剂、加热条件下,反应室2中生成了二甲醚(CH3OCH3)和水,则该反应的化学方程式为2CO+4H2
CH3OCH3+H2O△ .催化剂 2CO+4H2.
CH3OCH3+H2O△ .催化剂  请告诉我怎1年前1
请告诉我怎1年前1 -
 红木剑 共回答了16个问题
红木剑 共回答了16个问题 |采纳率87.5%解题思路:(1)根据化合物中正负化合价代数和为零计算;(2)根据温度与分子运动速度的关系考虑;(3)根据方程式的书写方法考虑.(1)在CH3OCH3中设碳元素的化合价为X则:X+(+1)×3+(-2)+X+(+1)×3=0解得X=-2价;
(2)升高温度分子运动速度快,反应物接触的几率大,反应速度就快;
(3)反应物是一氧化碳和氢气,生成物是二甲醚和水,用观察法配平即可,反应条件是在催化剂作用下加热,所以方程式是:2CO+4H2
△
.
催化剂 CH3OCH3+H2O.
故答案为:(1)-2;(2)增大;(3)2CO+4H2
△
.
催化剂 CH3OCH3+H2O.点评:
本题考点: 物质的相互转化和制备.
考点点评: 解答本题关键是要知道化合价的求法,反应速度的影响因素,知道方程式书写时的注意事项.1年前查看全部
- 新工艺的总反应为:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) △H<0
新工艺的总反应为:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) △H<0
为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是( )其原因是( )

温度高于240°好说,就是低于240°那一段怎么理解?
答案说是反应未平衡,转化率主要受反应速率影响.可我觉得这个实验过程并不是连续的,而是如题所言“研究者进行了一系列试验”,也就是在不同温度下进行试验,并记录下不同温度下达到平衡状态的转化率.所以不涉及未达到平衡状态的原因. 东方卢荟1年前1
东方卢荟1年前1 -
 linxlee 共回答了21个问题
linxlee 共回答了21个问题 |采纳率95.2%这个反应需要注意两个问题.第一,这个反应,应该是吉布斯自由能大于零的反应,即该反应不能自发进行.也就是说这个反应的进行,需要克服一个反应能垒,那么随着温度的升高,所占比例越来越多的分子能够快速克服能垒,参与反...1年前查看全部
- 已知2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-QkJ/mol(Q>0),若某温度下K=400,在1L
已知2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-QkJ/mol(Q>0),若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如表,判断下列说法正确的是( )
物质 CH3OH CH3OCH3 H2O 浓度/mol•L-1 0.6 1.2 1.2
A.此时反应v正<v逆
B.平衡后升高温度,K>400
C.达平衡后再通入H2O(g),甲醇的体积分数一定减小
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率增大 删就一个字1年前1
删就一个字1年前1 -
 博文的uu 共回答了22个问题
博文的uu 共回答了22个问题 |采纳率95.5%解题思路:A、计算浓度商和平衡常数比较分析判断反应进行方向;
B、该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低;
C、依据平衡常数含义分析判断;
D、该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低;A、浓度商Q=
1.2×1.2
0.62=4<K=400,反应正向进行,此时反应v正>v逆,故A错误;
B、该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低,故平衡后升高温度,平衡常数<400,故B错误;
C、2CH3OH(g)⇌CH3OCH3(g)+H2O(g)平衡常数=
c(H2O)c(CH3OCH3)
c(CH3OH),达平衡后再通入H2O(g),平衡常数不变,所以甲醇的体积分数一定减小,故C正确;
D、平衡时,再加入与起始等量的CH3OH,等效为增大压强,反应前后气体的物质的量不变,与原平衡等效,平衡后CH3OH转化率不变,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡影响因素分析,平衡常数的计算应用,掌握基础是关键,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10
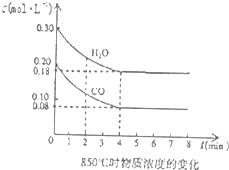 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1,
(1)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______.
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强保持不变;b.混合气体中c(CO)不变;c.v正(CO)=v逆(H2);d.c(CH3OH)=c(CO)
(3)在2L的容器中加入amolCH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH的转化率______(填“增大”、“减小”或“不变”).
(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示.
①0~4min的平均反应速率υ(CO)=______.
②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),起始时D正______V逆(填“<”、“>”或“=”),请结合必要的计算说明理由Qc=[0.3,mol/L×0,3mol/L/0.4mol/L×0.2mol/L]=[9/8],K=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1,因为Qc>K,平衡左移,V正<V逆Qc=[0.3,mol/L×0,3mol/L/0.4mol/L×0.2mol/L]=[9/8],K=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1,因为Qc>K,平衡左移,V正<V逆. 宁波dd1年前1
宁波dd1年前1 -
 毛毛青子 共回答了23个问题
毛毛青子 共回答了23个问题 |采纳率82.6%解题思路:(1)依据盖斯定律结合热化学方程式计算得到;
(2)化学平衡的标志是正逆反应速率相同,各组分浓度不变,据此分析选项判断;
(3)②反应前后气体体积不变,增大压强平衡不变;
(4)①依据化学反应速率概念结合图象分析计算;
②依据图象分析计算平衡常数,结合浓度商和平衡常数比较分析判断平衡移动方向.(1)①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1,
依据盖斯定律①×2+②+③:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
故答案为:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
(2)CO(g)+2H2(g)⇌CH3OH(g),反应是气体体积减小的放热反应;
a.反应前后气体体积变化,容器中压强保持不变,证明反应达到平衡,故a正确;
b.平衡状态的标志是物质浓度 保持不变,混合气体中c(CO)不变说明反应达到平衡,故b正确;
c.依据化学方程式反应达到平衡时2v正(CO)=v逆(H2)证明反应达到平衡,故C错误;
d.反应过程中c(CH3OH)=c(CO)说明剩余一氧化碳和生成甲醇浓度相同,但不能证明正逆反应速率相同,故d错误;
故答案为:ab;
(3)在2L的容器中加入amolCH3OH(g)发生反应②,反应前后气体体积不变,达到平衡后若再加入amolCH3OH(g)相当于增大压强,平衡不变,CH3OH的转化率不变
故答案为:不变;
(4)①图象分析平衡后一氧化碳浓度变化为0.2mol/L-0.08mol/L=0.12mol/L;V(CO)=[0.12mol/L/4min]=0.03mol/L•min;
故答案为:0.03mol/L•min;
②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),Qc=[0.3,mol/L×0,3mol/L/0.4mol/L×0.2mol/L]=[9/8],K=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1
因为Qc>K,平衡左移,V正<V逆
故答案为:<;因为Qc>K,平衡左移,所以V正<V逆.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素的分析判断,平衡常数的计算应用,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)被称为本世纪的新型燃料,它清洁、高效,具有优良的环保性能.以CH4和H2O为原料制备二甲醚的工业
二甲醚(CH3OCH3)被称为本世纪的新型燃料,它清洁、高效,具有优良的环保性能.以CH4和H2O为原料制备二甲醚的工业流程如图:
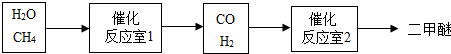
请回答下列问题:
(1)新型燃料二甲醚(CH3OCH3)中碳元素的化合价为______.
(2)一定条件下,反应室1中发生的反应为CH4+H2O
CO+3H2,在其它条件不变的情况下升高温度,则该反应将______ (填“加快”、“减慢”或“不变”).催化剂 .△
(3)在催化剂、加热的条件下,反应室2中生成了二甲醚(CH3OCH3) 和水,则该反应的化学方程式是2CO+4H2
CH3OCH3+H2OMnO2 .△ 2CO+4H2.
CH3OCH3+H2OMnO2 .△  175797899q1年前1
175797899q1年前1 -
 康撒A不MUSIC 共回答了23个问题
康撒A不MUSIC 共回答了23个问题 |采纳率82.6%解题思路:(1)根据化合物中正负化合价代数和为零进行分析;
(2)根据温度与分子运动速度的关系进行分析;
(3)根据一氧化碳和氢气在催化剂、加热的条件下生成二甲醚和水进行分析.(1)在CH3OCH3中,
设碳元素的化合价为x则:
x+(+1)×3+(-2)+x+(+1)×3=0
解得x=-2;
(2)升高温度分子运动速度快,反应物接触的几率大,反应速度就快;
(3)一氧化碳和氢气在催化剂、加热的条件下生成二甲醚和水,化学方程式为:2CO+4H2
MnO2
.
△CH3OCH3+H2O.
故答案为:(1)-2;
(2)加快;
(3)2CO+4H2
催化剂
.
△CH3OCH3+H2O.点评:
本题考点: 物质的相互转化和制备;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要知道化合价的求法,反应速度的影响因素,知道方程式书写时的注意事项.1年前查看全部
- 在273K和1.01×105 Pa下,将1.0 dm3洁净干燥的空气缓慢通过CH3OCH3液体,在此过程中,液体损失0.
在273K和1.01×105 Pa下,将1.0 dm3洁净干燥的空气缓慢通过CH3OCH3液体,在此过程中,液体损失0.0335 g
求此液体273 K时的饱和蒸气压 A_BoLo1年前1
A_BoLo1年前1 -
 denghailong16 共回答了25个问题
denghailong16 共回答了25个问题 |采纳率88%n(醇) = m(醇) / M(醇) = 0.0335g / 46g/mol = 7.28×10^-4 mol
V(醇) = n(醇)RT / P(总)
= 7.28×10^-4 mol × 8314.3 Pa·dm3·mol-1·K-1 × 273K / 1.01×10^5 Pa = 0.016dm3
V(总) = 1.0 dm3 + 0.016dm3 = 1.016dm3
P(醇) = n(醇)RT / P(总)
= 7.28×10^-4 mol × 8314.3 Pa·dm3·mol-1·K-1 × 273K / 1.016dm3 = 1.63×10^3 Pa1年前查看全部
- 二甲醚(CH3OCH3)燃料电池正极的电极反应为:
 从不言妥协1年前1
从不言妥协1年前1 -
 bushtod 共回答了18个问题
bushtod 共回答了18个问题 |采纳率88.9%负极:CH3OCH3+3H2O→2CO2+12e-+12H+正极:3O2+12e-+12H+→6H2O
总反应式为 CH3OCH3+3O2→2CO2+3H2O
好像是这样的吧,记不太清了1年前查看全部
- 无水乙醇与金属钠反应制取氢气的方法,由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3.理由是
 云丝1年前1
云丝1年前1 -
 青湖夜雨 共回答了15个问题
青湖夜雨 共回答了15个问题 |采纳率93.3%和纳反应生成氢气的说到底是羟基(-OH)上电离出的H+
有羟基才会电离,没有自然就不会
所以乙醇结构式CH3CH2OH1年前查看全部
- 下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( )
下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( )
A.李比希燃烧法
B.铜丝燃烧法
C.红外光谱法
D.元素分析仪 经典黄飞鸿1年前1
经典黄飞鸿1年前1 -
 也想飞 共回答了17个问题
也想飞 共回答了17个问题 |采纳率94.1%解题思路:A.李比希燃烧法可定量测定元素含量,而乙醇和二甲醚中元素的含量相同;
B.铜丝燃烧法可定性确定有机物中是否存在卤素
C.红外光谱法确定有机物中的化学键和官能团;
D.二者组成元素相同,均为C、H、O.A.李比希燃烧法能够测定元素的含量,而二甲醚和乙醇为同分异构体,二者元素的含量相同,无法用李比希燃烧法鉴别,故A错误;
B.铜丝燃烧法可定性确定有机物中是否存在卤素,而二甲醚和乙醇中都不含卤素,无法鉴别二者,故B错误;
C.红外光谱法确定有机物中的官能团,二甲醚与乙醇中的官能团不同,可鉴别,故C正确;
D.二甲醚(CH3OCH3)和乙醇的组成元素均为C、H、O,不能利用元素分析仪鉴别,故D错误;
故选C.点评:
本题考点: 有机物结构式的确定.
考点点评: 本题考查有机物的鉴别,为高频考点,把握二者结构的差异、性质的差异为解答的关键,注意红外光谱法、核磁共振氢谱均为确定有机物结构常用的方法,题目难度不大.1年前查看全部
- (2012•西安模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料.工业上制备二甲醚在催化反应室中(压强2.0-10
(2012•西安模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料.工业上制备二甲醚在催化反应室中(压强2.0-10.0MPa,温度230-280℃)进行下列反应
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)对于反应②,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______(填序号字母)
a.n(CH3OH)=n(CH3OCH3)=n(H2O)b.容器内压强保持不变
c.H2O(g)的浓度保持不变d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
(2)对于反应③,若要提高CO的转化率,在其它条件不变的情况下可以采取的措施为______(填写序号字母)
a.加入一定量的H2O(g)b.降低反应温度
c.加入催化剂 d.缩小容器体积
(3)在某温度下,若反应①各物质起始浓度分别为:c(CO)=1.0mol•L-1,c(H2)=2.4mol•L-1,5min后达到平衡,CO的转化率为50%,则5min内H2的平均反应速率为;______在相同温度下,若反应物的起始浓度分别为c(CO)=4.0mol•L-1,c(H2)=amol•L-1,达到平衡后,c(CH3OH)=2.0mol•L-1,则a=______.
(4)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______;已知830℃时反应③的平衡常数K=1.0,则在催化室中反应③的平衡常数K______1.0 (填>或<或=)
(5)9.2g二甲醚完全燃烧生成液态水和CO2时放出291.0kJ热量,则二甲醚燃烧的热化学方程式为______,二甲醚的燃烧热为______. 1vuer1年前1
1vuer1年前1 -
 chong711 共回答了17个问题
chong711 共回答了17个问题 |采纳率88.2%解题思路:(1)可逆反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1若达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断是否达到平衡状态;
(2)根据反应③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1的特点及影响化学平衡的因素进行分析;
(3)根据一氧化碳的转化率计算出氢气的浓度变化,5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,根据v(CO)=[1/2]v(H2)=[△c/△t]计算v(H2);计算该温度下的平衡常数,根据平衡常数计算平衡时氢气的浓度,根据甲醇的平衡浓度计算氢气浓度的变化量,进而计算a的值;
(4)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;根据温度对化学平衡的影响判断化学平衡常数大小;
(5)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式.(1)a.n(CH3OH)=n(CH3OCH3)=n(H2O),不能判断各组分的浓度是否不再变化,无法判断是否达到平衡状态,故a错误;
b.该反应是体积不变的反应,反应过程中容器内压强始终不变,所以容器内压强保持不变,无法判断是否达到平衡状态,故b错误;
c.H2O(g)的浓度保持不变,表明正逆反应速率相等,达到了平衡状态,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,表示的是正逆反应,且满足化学计量关系,说明达到了平衡状态,故d正确;
故选cd;
(2)反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1,若要提高CO的转化率,必须使化学平衡向着正向移动,
a.加入一定量的H2O(g),水蒸气的浓度增大,化学平衡向着正向移动,一氧化碳的转化率增大,故a正确;
b.该反应为放热反应,通过降低温度,平衡向着正向移动,可以提高一氧化碳的转化率,故b正确;
c.加入催化剂,催化剂不影响化学平衡的移动,不会影响一氧化碳的转化率,故c错误;
d.缩小容器体积,增大了压强,由于该反应是体积不变的反应,压强不影响化学平衡,故d错误;
故选ab;
(3)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,一氧化碳和氢气的化学计量数之比为1:2,所以v(H2)=2v(CO)=2×[0.5mol/L/5min]=0.2mol/(L•min);
该温度到达平衡时,c(CO)=0.5mol/L,c(H2)=2.4mol/L-2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以该温度下,平衡常数k=
0.55
0.5×1.42=[25/49],若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c(CO)=4mol/L-2mol/L=2mol/L,设平衡时氢气的浓度为ymol/L,所以[2
2×y2=
25/49],解得y=1.4,故a=2mol/L×2+1.4mol/L=5.4mol/L,
故答案为:0.2mol/(L•min);5.4.
(4)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
催化室中的温度230-280℃,已知830℃时反应③的平衡常数K=1.0,由于该反应为放热反应,温度降低,平衡向着正向移动,化学平衡常数增大,所以>1.0,
故答案为:-246.1kJ/mol;>;
(5)9.2g二甲醚的物质的量为:n=[9.2g/46g/mol]=0.02mol,0.2mol二甲醚完全燃烧生成液态水和CO2时放出291.0kJ热量,所以二甲醚的燃烧热为:[291.2kJ/0.2mol]=1455kJ/mol,则二甲醚燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;1455kJ/mol.点评:
本题考点: 化学平衡状态的判断;热化学方程式;化学平衡常数的含义;化学平衡的调控作用.
考点点评: 本题考查了化学平衡状态的判断、化学平衡常数的计算等知识,题目综合性较大,涉及盖斯定律、热化学方程式书写、化学反应速率、化学平衡计算、平衡常数,题目难度中等,注意平衡常数的有关计算,成为近几年高考的热点,注意盖斯定律在求算反应热中应用.1年前查看全部
- (2013•芜湖模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢
(2013•芜湖模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.有关说法不正确的是( )
A.该燃料电池中通入二甲醚的一极为负极
B.二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染
C.在燃料电池中二甲醚最终转化为CO2和H2O
D.消耗0.5 mol二甲醚可以向外电路提供6mol e- tikki1年前1
tikki1年前1 -
 我塞 共回答了19个问题
我塞 共回答了19个问题 |采纳率84.2%解题思路:该电池属于燃料电池,负极上燃料二甲醚失电子发生氧化反应,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,正极上氧气得电子发生还原反应,电极反应式为3O2+12e-+6H2O=12OH-,结合物质间的关系式解答.A.该燃料电池中,二甲醚失电子发生氧化反应,所以通入二甲醚的电极是负极,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,故A正确;
B.二甲醚属于有机物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故B正确;
C.碱性电池中,二氧化碳能和氢氧根离子反应生成碳酸根离子,所以二甲醚最终转化为碳酸根离子和水,故C错误;
D.消耗0.5 mol二甲醚可以向外电路提供电子的物质的量=0.5mol×2×(4+2)=6mol,故D正确;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理,明确正负极上发生的电极反应式是解本题关键,注意电极反应式的书写要结合电解质溶液的酸碱性,为易错点.1年前查看全部
- (2014•浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化
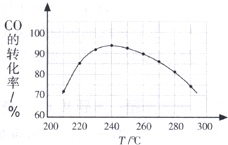 (2014•浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
(2014•浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-91KJ•mol-1
②2CH30H(g)⇌CH30CH3(g)+H20(g)△H2=-24KJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41KJ•mol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______,平衡常数表达式K=c(CH3OCH3)c(CO2) c3(CO)c3(H2) .c(CH3OCH3)c(CO2) c3(CO)c3(H2)
(2)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是______(填字母代号).
a.低温高压b.加入催化剂c.减少CO2的浓度d.增加CO的浓度
(3)在某温度下,2L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2mol和6mol,3min后达到平衡,测得CO的转化率为60%,则3min内CO的平均反应速率为______.若同样条件下起始时CO的物质的量为4mol,达到平衡后CH3OH为2.4mol,则起始时H2的物质的量为:______.
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
则此反应在该温度下的平衡常数为______,若再向容器分别加入甲醇0.02mol、CH3OCH3 1.0mol,此时该反应v正反应______v逆反应(填“>”、“<”或“=”).反应时间/min 0 1 2 3 4 c(CH3OH)/mol•L-1 0.51 0.2 0.1 0.01 0.01
(5)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图试解释原因是:______. cnlamar1年前1
cnlamar1年前1 -
 xddhh 共回答了7个问题
xddhh 共回答了7个问题 |采纳率85.7%解题思路:(1)根据盖斯定律计算△H;平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)要提高CO的转化率,应该不条件平衡正向进行方向判断;
(3)依据化学平衡三段式列式计算,结合平衡常数计算 氢气起始量;
(4)根据表中数据,3分钟后达到平衡状态,计算出该反应的平衡常数;向容器分别加入甲醇0.02mol、CH3OCH31.0mol,重新计算出浓度商,与化学平衡常数对比,判断平衡移动方向;
(5)由图表可知,在较低温时,反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,反应体系均已达到平衡,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.(1)已知①CO( g)+2H2(g)⇌CH3OH( g)△H1=-91kJ•mol-1,
②2CH30H(g)⇌CH30CH3(g)+H20(g)△H2=-24kJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41kJ•mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,
平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以K=
c(CH3OCH3)c(CO2)
c3(CO)c3(H2);
故答案为:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247KJ•mol-1,
c(CH3OCH3)c(CO2)
c3(CO)c3(H2);
(2)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施应使平衡正向进行,3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247KJ•mol-1;
a.反应是气体体积减小的放热反应,低温高压平衡正向进行,一氧化碳转化率增大,故a正确;
b.加入催化剂 改变反应速率不改变化学平衡,一氧化碳转化率不变,故b错误;
c.减少CO2的浓度,平衡正向进行,一氧化碳转化率增大,故c正确;
d.增加CO的浓度,平衡正向进行,一氧化碳转化率减小,故d错误;
故答案为:ac;
(3)在某温度下,2L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2mol和6mol,3min后达到平衡,测得CO的转化率为60%,依据化学平衡三段式列式计算:
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.6 0.6 0.2
平衡量(mol/L) 0.4 2.4 0.2
则3min内CO的平均反应速率=[0.6mol/L/3min]=0.2mol/L•min;
若同样条件下起始时CO的物质的量为4mol,达到平衡后CH3OH为2.4mol,设氢气起始量ymol/L
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L)2y 0
变化量(mol/L)1.2 2.4 1.2
平衡量(mol/L) 0.8 y-2.41.2
依据化学平衡常数不变计算得到
1.2
0.8×(y−2.4)2=
0.2
0.4×2.42
y=4.2mol/L;
氢气物质的量为8.4mol
故答案为:0.2 mol•L-1•min-1,8.4 mol;
(4)根据反应方程式:2CH3OH(g)⇌CH3OCH3(g)+H2O(g),
反应前c(CH3OH)/mol•L-1:0.51 0 0
3分钟后达到平衡状态浓度:0.01 0.25 0.25
平衡常数为:
0.25×0.25
0.012=625,
再向容器分别加入甲醇0.02mol、CH3OCH31.0mol反应的浓度商为:
(1.0+0.25)×0.25
0.032≈347.2<625,平衡向着正向移动,正反应速率大于逆反应速率,
故答案为:625;>;
(5)由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应点评:
本题考点: 化学平衡的计算;热化学方程式;化学平衡的影响因素;化学平衡的调控作用.
考点点评: 本题考查反应热的计算、平衡移动、化学平衡常数等,难度中等,难点在于读图明白温度为240℃时反应体系均已达到平衡.1年前查看全部
大家在问
- 1(文科)设向量a=(cos23°,cos67°),b=(cos68°,cos22°),u=a+tb(t∈R),则|u|的
- 2急求一篇英语作文?如你是李华,在你生日收到你一位美国朋友Mike的一封信和生日礼物英语词典,为此回信给他,表示谢意的英语
- 3因为'X分之X的平方'=X,而X取任意实数都有意义,所以使分式'X分之X的平方'有意义的条件是X为任意实数.你认为这种说
- 4把句子补充完整.小汽车像什么?
- 5函数f(X)=1/3x3-1/2ax2+2/3a,其中a>o,若当x>=0,有 f(x)>0 恒成立,求a的取值范围
- 6英语翻译My DearHow is your life over there?I hope all is well wi
- 7在△АВС中,sinА+sinВ+sinС=0,cosA+cosB+cosC=0.求证:cos²A+cos&s
- 8(2011•阳谷县)体积相等,底面积相等的圆柱和圆锥,它们的高的比是______:______.
- 9苏教版一到六年级的所有课文古诗
- 10真空两长直螺线管,长度相等单层密绕匝数相同,直径之比为1/4.当它们通以相同电流,求贮存的磁能之比.
- 11火箭发射时,火箭尾部向下喷射出炽热的气体,这时是什么推动火箭向上飞行
- 12英语翻译翻译的:1.At her gentlest touch he will preenm stretch,and o
- 13一次函数y=mx+n的图象如图所示,则代数式|m+n|-|m-n|化简后的结果为______.
- 14在桥式整流电路中 ,若有一只整流二极管变成了断路 、 短路 、 反接 ,那 么输出电压将出现什么现象
- 15催化剂的问题对于一个多步骤的循环反应,一个物质在反应中改变了别的物质,但最后循环的最后一步变成原始物质,请问这样的物质可
