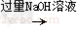铝镁合金LD31是什么
 200342072022-10-04 11:39:541条回答
200342072022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 op510 共回答了21个问题
op510 共回答了21个问题 |采纳率95.2%- 铝矽镁合金挂件材质为LD31-RCS,大家知道铝合金的种类很多,约有170多个系列.铝矽镁合金的材料,现广泛用于航空制造业、汽车制造业、火车制造业、船舶制造业等,在建筑业以及装饰材料行业的应用也是非常广泛的.铝矽镁石材幕墙挂件系列,集中了抗老化、耐高温、耐腐蚀、强度高、拆装方便等特点,提高了产品的技术性能,通过实践证明,在石材装饰板材的施工安装过程中板与板之间相互不传力.所以,给以后维修与养护会带来极大的方便,铝矽镁石材挂件属于更经济、更安全、更快速的产品.
LD31铝镁合金 的参考化学成分:Cu Mg Mn Fe Si Zn Cr Ti 其他 Ai 单个 合计 0.1 0.45-0.9 0.1 0.35 0.2-0.6 0.1 0.1 0.1 0.05 0.15 余量 型材中各化学成分的含量对型材的机械性能有很大影响,如镁含量过低,型材的强度不够,镁含量过高,型材会发脆;硅含量过高会降低型材的挤压性能和电解着色性能,硅含量过低,会降低型材的机械性能. - 1年前
相关推荐
- 探究"测定铝镁合金中铝的质量分数",取8.0g碾碎后的铝镁合金样品,设计了3种实验方案如下:
探究"测定铝镁合金中铝的质量分数",取8.0g碾碎后的铝镁合金样品,设计了3种实验方案如下:
甲方案:铝镁合金 + 盐酸 → 测得生成气体的体积为 V mL(标准状况)
乙方案:铝镁合金 + 过量 NaOH 溶液 → 测得剩余固体的质量 2.4 g
丙方案:铝镁合金 + 过量盐酸 → 溶液 + 过量 NaOH 溶液 → 测得沉淀的质量为 a g
(1)甲方案能否测定出铝的质量分数 并说明理由 .
(2)乙方案中反映的离子方程式 .测得的铝的质量分数为多少?
(3)丙方案中加过量的 NaOH 溶液充分反应后 ,过滤、洗涤、烘干沉淀 若烘干时的温度偏高,沉淀有一部分分解,测得的铝的质量分数将偏大、偏小还是无影响 zhchoo1年前1
zhchoo1年前1 -
 小虫它mm 共回答了14个问题
小虫它mm 共回答了14个问题 |采纳率85.7%(1)能.因相同质量的镁、铝与盐酸反应产生H2的体积不同.
可以这样算:设合金中Mg的物质的量为xmol,Al的物质的量为ymol
2Al + 6H+ = 2Al3+ + 3H2↑,Mg + 2H+ = Mg2+ + H2↑
24x + 27y = 8.0,22.4( 3x/2 + y ) = V/1000,通过解方程求出结果.
(2)2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑ .镁不与氢氧化钠反应.
剩余固体为Mg,合金中铝的质量分数为:(8.0-2.4)/8.0×100%=70%.
(3)2Al + 6H+ = 2Al3+ + 3H2↑,Mg + 2H+ = Mg2+ + H2↑,
Mg2+ + 2OH- =Mg(OH)2↓,Al3+ + 4OH- = AlO2- + 2H2O.
加入过量氢氧化钠溶液,最后剩余沉淀为Mg(OH)2.若烘干时温度过高,氢氧化镁有一部分分解,称量时质量就会减轻,则算出的铝的质量分数就会偏大.1年前查看全部
- 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
[探究一]
实验方案:铝镁合金
测定剩余固体质量NaOH溶液
实验中发生反应的化学方程式是______
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol•L-1NaOH溶液中,充分反应.NaOH溶液的体积V≥______
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
______(填“偏高”或“偏低”).
[探究二]
实验方案:铝镁合金
测定生成气体的体积实验装置:盐酸 
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置.你的意见是:______(填“需要”或“不需要”).
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):①______②______
[探究三]
实验方案:称量x g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧. 问题讨论:
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是______
(2)若用空气代替O2进行实验,对测定结果何影响?______(填“偏高”或“偏低”或“无影响”). i_踏雪无痕1年前1
i_踏雪无痕1年前1 -
 摘地区 共回答了20个问题
摘地区 共回答了20个问题 |采纳率75%解题思路:探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
探究二:(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(2)装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
探究三:(1)Mg、Al都能够与氧气化学反应生成氧化物;
(2)用空气代替O2进行实验,发生反应:3Mg+N2
Mg3N2,2Mg+CO2点燃 .
2MgO+C,测定生成固体的质量变大.点燃 .探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为零时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g2mol
5.4g V×10-3L×2.0mol/L
所以54g:5.4g=2mol:(V×10-3L×2.0mol/L),
解得:V=100mL,故V(NaOH溶液)≥100mL;
故答案为:100mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
探究二:(1)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,故答案为:不需要;
(2)反应中装置的气密性、合金是否完全溶解都会影响测定结果,
故答案为:检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案);
【探究三】
(1)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,故答案为:灼烧后固体的质量;
若用空气代替O2进行实验,发生反应:3Mg+N2
点燃
.
Mg3N2,2Mg+CO2
点燃
.
2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:偏高.点评:
本题考点: 探究物质的组成或测量物质的含量;镁的化学性质;铝的化学性质.
考点点评: 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.1年前查看全部
- 现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaO
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是( ) A.恰好溶解后溶液中的NO 3 - 离子的物质的量为
molbv 1000 B.反应过程中转移的电子数为
moln-m 17 C.生成NO气体的体积为
L22.4(n-m) 51 D.与合金反应反应的硝酸的物质的量为(
+n-m 51
)molbv 1000  欢喜顶帖英雄1年前1
欢喜顶帖英雄1年前1 -
 吴弛 共回答了17个问题
吴弛 共回答了17个问题 |采纳率94.1%A、当沉淀量最大时,溶液中的溶质只有硝酸钠(NaNO 3 ),硝酸根离子与钠离子的物质的量相等,n(NO 3 - )=n(Na + )=n(NaOH)=
bv
1000 mol,故A正确;
B、至沉淀量最大,生成的n克沉淀为氢氧化铝和氢氧化镁.根据质量守恒定律,其中镁、铝元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg 2+ 、Al 3+ 所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e - )=n(OH - )=
n-m
17 mol,故B正确;
C、根据电子守恒原理,生成NO时是HNO 3 中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即
n-m
17 ×
1
3 =
n-m
51 mol,其体积在标准状况下为为
22.4(n-m)
51 L,但是选项中没有说明状态,则此时的体积不能确定,故C错误;
D、参加反应的硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
bv
1000 mol,作氧化剂的硝酸的物质的量等于NO的物质的量,即
n-m
51 mol,所以与合金反应的硝酸的物质的量为(
n-m
51 +
bv
1000 )mol,故D正确.
故选C.1年前查看全部
- 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%—5%的铝镁合金(不含其他元
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%—5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
[探究一]
实验方案:铝镁合金测定剩余固体:(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol·L-1NaOH溶液中,充分反应.NaOH溶液的体积V≥_________.
为什么是97ml,不是应该按铝最少时算吗不是5.4x95%吗? 林度爱情1年前1
林度爱情1年前1 -
 aduo520 共回答了18个问题
aduo520 共回答了18个问题 |采纳率94.4%亲,这里不能用最少而应该用最大的量计算.
因为如果按最少的量计算的话,那么有可能合金中铝的含量是97%的话,那么Al就不能完全反应,最后就会影响最后的计算.1年前查看全部
- (2011•四川二模)室温下,取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合
(2011•四川二模)室温下,取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为[bV/1000]mol
③反应过程中转移的电子数为[n−m/17]mol
④生成NO气体的体积为
L22.4(n−m) 51
⑤发生反应的硝酸的物质的量为([n−m/51+bV 1000])mol.
A.2项
B.3项
C.4项
D.5项赞
一朵涟漪 幼苗
共回答了16个问题采纳率:87.5% 举报
解题思路:mg铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,沉淀质量最大为氢氧化铝和氢氧化镁质量之和,此时溶液为硝酸钠溶液.
①沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和.
②恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,即n(NO3-)=n(Na+)=n(NaOH),据此进行计算.
③根据电荷守恒,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子来进行计算.
④根据气体没有明确所处状态是否标准状态来判断.
⑤根据质量守恒,硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,作氧化剂的硝酸的物质的量等于NO的物质的量进行计算.①沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和,所以沉淀中氢氧根的质量为(n-m)克,故①正确;
②、恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,当沉淀量最大时,溶液中的溶质只有硝酸钠(NaNO3),硝酸根离子与钠离子的物质的量相等,n(NO3-)=n(Na+)=n(NaOH)=[bV/1000]mol,故②正确;
③、至沉淀量最大,生成的n克沉淀为氢氧化铝和氢氧化镁.根据质量守恒定律,其中镁、铝元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e-)=n(OH-)=[n−m/17]mol,故③正确;
④、根据电子守恒原理,生成NO时,HNO3中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即[n−m/17]mol×[1/3]=[n−m/51]mol,其体积在标准状况下为
22.4(n−m)
51L,但是选项中没有说明所处状态,则此时的体积不能确定,故④错误;
⑤、参加反应的硝酸有两种作用,起酸和氧化剂作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量为[bV/1000]mol,作氧化剂的硝酸的物质的量等于NO的物质的量为[n−m/51]mol,所以与合金反应的硝酸的物质的量为([n−m/51]+[bV/1000])mol,故⑤正确.
故①②③⑤正确.
故选:C.点评:
本题考点: 有关混合物反应的计算;镁、铝的重要化合物.
考点点评: 本题结合铝镁与硝酸反应及生成的盐与氢氧化钠反应的特点,对电子守恒、溶液电中性原理、质量守恒进行综合考查,难度中等,题目以多项形式呈现,考查了学生的综合运用知识能力和解决复杂问题的能力,是一道考查能力的好题.1年前
9可能相似的问题你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.029 s. - webmaster@yulucn.com guozili841年前1
guozili841年前1 -
 一朵涟漪 共回答了16个问题
一朵涟漪 共回答了16个问题 |采纳率87.5%解题思路:mg铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,沉淀质量最大为氢氧化铝和氢氧化镁质量之和,此时溶液为硝酸钠溶液.
①沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和.
②恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,即n(NO3-)=n(Na+)=n(NaOH),据此进行计算.
③根据电荷守恒,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子来进行计算.
④根据气体没有明确所处状态是否标准状态来判断.
⑤根据质量守恒,硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,作氧化剂的硝酸的物质的量等于NO的物质的量进行计算.①沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和,所以沉淀中氢氧根的质量为(n-m)克,故①正确;
②、恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,当沉淀量最大时,溶液中的溶质只有硝酸钠(NaNO3),硝酸根离子与钠离子的物质的量相等,n(NO3-)=n(Na+)=n(NaOH)=[bV/1000]mol,故②正确;
③、至沉淀量最大,生成的n克沉淀为氢氧化铝和氢氧化镁.根据质量守恒定律,其中镁、铝元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e-)=n(OH-)=[n−m/17]mol,故③正确;
④、根据电子守恒原理,生成NO时,HNO3中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即[n−m/17]mol×[1/3]=[n−m/51]mol,其体积在标准状况下为
22.4(n−m)
51L,但是选项中没有说明所处状态,则此时的体积不能确定,故④错误;
⑤、参加反应的硝酸有两种作用,起酸和氧化剂作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量为[bV/1000]mol,作氧化剂的硝酸的物质的量等于NO的物质的量为[n−m/51]mol,所以与合金反应的硝酸的物质的量为([n−m/51]+[bV/1000])mol,故⑤正确.
故①②③⑤正确.
故选:C.点评:
本题考点: 有关混合物反应的计算;镁、铝的重要化合物.
考点点评: 本题结合铝镁与硝酸反应及生成的盐与氢氧化钠反应的特点,对电子守恒、溶液电中性原理、质量守恒进行综合考查,难度中等,题目以多项形式呈现,考查了学生的综合运用知识能力和解决复杂问题的能力,是一道考查能力的好题.1年前查看全部
- (2010•朝阳区二模)某兴趣小组为探究铝镁合金的组成,取16g铝镁合金样品,将60g氢氧化钠溶液平均分成三份依次加入样
(2010•朝阳区二模)某兴趣小组为探究铝镁合金的组成,取16g铝镁合金样品,将60g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
计算:(1)该合金中,铝元素与镁元素的质量比为______.所加氢氧化钠溶液的次数 第一次 第二次 第三次 剩余固体的质量/g 10.6 5.2 4.0
(2)所用氢氧化钠溶液中溶质的质量分数. wskpa1年前1
wskpa1年前1 -
 wangch002 共回答了15个问题
wangch002 共回答了15个问题 |采纳率93.3%解题思路:(1)根据第一次加入氢氧化钠溶液所得的数据可知,每加入20g氢氧化钠溶液将会消耗铝16g-10.6g=5.4g;而第三次加入20g氢氧化钠溶液,金属的质量减少5.2g-4.0g=1.2g<5.4g,说明金属铝已完全反应,剩余固体为镁;
(2)根据第一次或第二次所加入氢氧化钠溶液的实验数据,通过反应消耗铝的质量,根据反应的化学方程式,计算所加氢氧化钠溶液中的氢氧化钠的质量,而得出所用氢氧化钠溶液中溶质的质量分数.(1)由前两次实验数据可得:每加入20g氢氧化钠溶液将会消耗铝16g-10.6g=5.4g,第三次加入20g氢氧化钠溶液,样品质量减少5.2g-4.0g=1.2g<5.4g,则所剩余固体4.0g为金属镁的质量,则该合金中,铝元素与镁元素的质量比=(16g-4g):4g=12:4=3:1
故答案为:3:1;
(2)第一次所加20g氢氧化钠溶液能反应的铝的质量为:16g-10.6g=5.4g
设20g氢氧化钠溶液中溶质的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54 80
5.4g x
[54/80]=[5.4g/x] x=8g
所用氢氧化钠溶液中溶质的质量分数=[8g/20g]×100%=40%
答:所用氢氧化钠溶液中溶质的质量分数为40%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据每次加入氢氧化钠溶液充分反应后合金样品质量减少的规律,判断反应进行的程度,从而得出剩余固体为不参加反应的金属的质量.1年前查看全部
- 3g铝镁合金与100ml稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4g则原硫酸的物质的量浓度为?
 eiak1年前1
eiak1年前1 -
 weimin7678 共回答了17个问题
weimin7678 共回答了17个问题 |采纳率100%17.4-3=14.4g就是硫酸根的质量.硫酸根的物质的量为14.4/96=0.15mol
原硫酸的物质的量浓度为1.5mol/L1年前查看全部
- 兴趣小组为探究铝镁合金的组成兴趣小组为探究铝镁合金的组成,取16克铝镁合金样品?
兴趣小组为探究铝镁合金的组成兴趣小组为探究铝镁合金的组成,取16克铝镁合金样品?
35.某兴趣小组为探究铝镁合金的组成,取16克铝镁合金样品,将60克氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应化学方程式为:
2Al+2NaOH+2H2O===2NaAlO2+3H2↑),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所加氢氧化钠溶液的次数x05第一次x05第二次x05第三次
剩余固体的质量/克 x0510.6x05 5.2x05 4.0
计算:(1)从表中数据可知第一次结束后,参加反应的金属铝的质量为 克;
(2)该合金中金属镁的质量分数;
(3)所用氢氧化钠溶液溶质的质量分数.
请写出每一小题的解题过程. nicole_lau1年前1
nicole_lau1年前1 -
 sugarfairy 共回答了13个问题
sugarfairy 共回答了13个问题 |采纳率92.3%j1.参加反应的金属铝的质量为 16g-10.6g=5.4g
2合金中金属镁的质量分数4g/16g*100%=25%
3设所用氢氧化钠溶液溶质的质量分数为x
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
54 80
16g-10.6g 20x
54/80=16g-10.6g /20x
解得x=40%1年前查看全部
- 某兴趣小组为探究铝镁合金的组成,取16g铝镁合金样品,将60g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不
某兴趣小组为探究铝镁合金的组成,取16g铝镁合金样品,将60g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所有氢氧化钠溶液的次数 第一次 第二次 第三次
剩余固体的质量/ g 10.6 5.2 4.0
第二次反应时生成的H2在标况下的体积是 ziwei2171年前2
ziwei2171年前2 -
 shuipa 共回答了23个问题
shuipa 共回答了23个问题 |采纳率95.7%第二次参与反应的铝为10.6-5.2=5.4g,产生的氢气为0.6g,则氢气的体积为0.3*22.4L=6.72L1年前查看全部
- m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO)向反应后的混合溶液中滴加a mol/L NaO
m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO)向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有()
①沉淀中氢氧根的质量为(n—m)g
②恰好溶解后溶液中的NO 3 - 离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为
④生成NO气体的体积室温下为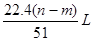
⑤与合金反应的硝酸的物质的量为
A.2项 B.3项 C.4项 D.5项  wandq721年前1
wandq721年前1 -
 duducatmlj 共回答了22个问题
duducatmlj 共回答了22个问题 |采纳率90.9%B
反应中涉及的电子转移及生成沉淀的反应为:
Mg-2e - =Mg 2 + Mg 2 + +2OH - =Mg(OH) 2
Al-3e - =Al 3 + Al 3 + +3OH - =Al(OH) 3
从上式可看出,反应中电子转移数目与沉淀过程中OH - 的个数相等;
合金最终生成沉淀,两者质量的差值应该为沉淀中氢氧根的质量,即(n—m)g,物质的量为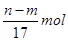 ,也就是说反应过程中转移的电子的物质的量也是
,也就是说反应过程中转移的电子的物质的量也是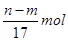 ;
;
由3e — →NO↑,可得NO的物质的量为 mol,标准状况下的体积为
mol,标准状况下的体积为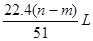 ,而室温下无法确定
,而室温下无法确定
离子全部沉淀达到最大值时,溶液为NaNO 3 溶液,由钠的守恒可知,NaNO 3 的物质的量与NaOH的物质的量相同,即 mol;也就是合金恰好溶解后溶液中的NO 3 - 离子的物质的量
mol;也就是合金恰好溶解后溶液中的NO 3 - 离子的物质的量 mol;
mol;
由氮的守恒可知,原硝酸溶液中硝酸的物质的量为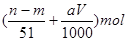
故题目中的①③⑤说法正确,故答案为B1年前查看全部
- (2013•河南一模)为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设
 (2013•河南一模)为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.
(2013•河南一模)为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.
【探究一】实验方案:铝镁合金
测定剩余固体质量实验中发生反应的离子反应方程式______.NaOH
实验步骤:
(1)称取8.1g 铝镁合金粉末样品,投入VmL 2.0mol・L-1 NaOH溶液中,充分反应.NaOH溶液的体积V“≥”______.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得铝的质量分数将______(填“偏高”或“偏低”).
【探究二】实验方案:铝镁合金溶于盐酸溶液中测定生成气体的体积实验装置(如图1):
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置.你的意见是:______(填“需要”或“不需要”).
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______
②______
【探究三】实验方案:称量x g铝镁合金粉末.放在如图2所示装置的惰性电热板上,通电使其充分灼烧.
问题讨论:
(1)欲计算铝的质量分数,该实验中还需测定的数据是______.
(2)若用空气代替O2进行实验,对测定结果是否有影响?______(填“是”或“否”).
【实验拓展】
参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数.______. 欢欢QQ1年前1
欢欢QQ1年前1 -
 龙城鬼客 共回答了24个问题
龙城鬼客 共回答了24个问题 |采纳率95.8%解题思路:【探究一】铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
【探究二】(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(2)调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等会影响测定结果;
【探究三】(1)Mg、Al都能够与氧气化学反应生成氧化物;
(2)用空气代替O2进行实验,发生反应:3Mg+N2
Mg3N2,2Mg+CO2点燃 .
2MgO+C,测定生成固体的质量变大;点燃 .
【实验拓展】
根据探究一,可测定铝和氢氧化钠反应产生氢气的体积来计算铝的质量分数.【探究一】铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(1)含镁为零时,金属铝的含量最高,8.1g合金中铝的质量为,8.1g×97%=7.857g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g2mol
7.857g V×10-3L×2.0mol/L
所以54g:7.857g=2mol:(V×10-3L×2.0mol/L),
解得:V=145.5mL,故V(NaOH溶液)≥145.5mL;
故答案为:145.5mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,则铝的质量分数偏低;故答案为:偏低;
【探究二】(1)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,故答案为:不需要;
(2)调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等会影响测定结果;
故答案为:调整量气管C的高度,使C中液面与B液面相平;待冷却至室温再读体积等合理答案;
【探究三】
(1)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,故答案为:充分灼烧后固体的质量;
(2)若用空气代替O2进行实验,发生反应:3Mg+N2
点燃
.
Mg3N2,2Mg+CO2
点燃
.
2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:是;
【实验拓展】
根据探究一,可测定铝和氢氧化钠反应产生氢气的体积来计算铝的质量分数,故答案为:称取一定量的镁铝合金,加入足量的氢氧化钠溶液,测定生成气体的体积.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.1年前查看全部
- (就是08年重庆高考题)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.A中为NaOH溶液.
(就是08年重庆高考题)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.A中为NaOH溶液.
(1)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①调节量气管两侧液面相平,并记录C的起始液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂.
上述操作的顺序是 ①、④、③、②(填序号).
(2)记录C的液面位置时,除视线平视外,还应调节量气管两侧液面相平,其原因是
我要问的是,进行类似实验时我调节量气管两侧液面相平,但没发现液面高度有什么明显变化,如果细看的话,向下移D管,好像是C管液面略下降,D管液面略上升(相对于管上刻度而言),请问我观察到的现象是否准确,求对应分析。还有为什么要调节量气管两侧液面相平啊,
 音律1年前2
音律1年前2 -
 crystallh_8 共回答了25个问题
crystallh_8 共回答了25个问题 |采纳率92%正确.没有外加压力左右液面高度是一致的.如果你不调节平衡会有压差,导致结果不准确.1年前查看全部
- 铝镁合金0.2g完全溶于盐酸中,加入过量的氢氧化钠溶液,得到白色沉淀,将此沉淀洗净后,溶于25mL 0.2mol/L的盐
铝镁合金0.2g完全溶于盐酸中,加入过量的氢氧化钠溶液,得到白色沉淀,将此沉淀洗净后,溶于25mL 0.2mol/L的盐酸中.再用0.05mol/L的氢氧化钠溶液中和过量的酸时,共用去18mL碱液.求合金中镁的质量分数.
 十灰1年前1
十灰1年前1 -
 敢爱敢干 共回答了19个问题
敢爱敢干 共回答了19个问题 |采纳率94.7%解题思路:镁、铝合金加入盐酸,使之完全溶解 (酸过量),所得溶液含有氯化镁、氯化铝、剩余的盐酸,再加入过量的未知浓度的氢氧化钠,得到沉淀为Mg(OH)2,铝形成偏铝酸钠,在滤液中,向沉淀中加入0.2mol/L盐酸25mL,沉淀完全溶解,剩余盐酸用氢氧化钠中和,根据氢氧化钠的量可计算出剩余盐酸的量,进而计算出氢氧化镁的量,根据原子守恒计算出镁的量,进而计算镁和铝的质量,利用质量分数定义计算.镁、铝合金加入盐酸,使之完全溶解 (酸过量),所得溶液含有氯化镁、氯化铝、剩余的盐酸,再加入过量的未知浓度的氢氧化钠,得到沉淀为Mg(OH)2.
中和过量盐酸的氢氧化钠的物质的量为:0.05mol/L×0.018L=0.0009mol,则与氢氧化镁反应的盐酸为:0.2mol/L×0.025L-0.0009mol=0.0041mol;
根据反应:Mg(OH)2+2HCl=MgCl2+H2O可知氢氧化镁的物质的量=[0.0041mol/2]=0.00205mol,根据Mg元素守恒可知,m(Mg)=0.00205mol×24g/mol=0.0492g,
故混合物中Mg的质量分数为[0.0492g/0.2g]×100%=24.6%,
答:原来混合物中镁的质量分数分别为24.6%.点评:
本题考点: 有关混合物反应的计算.
考点点评: 考查混合物的有关计算,难度中等,清楚反应过程是解题的关键,注意守恒思想的运用,简化计算过程.1年前查看全部
- 铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol·L -1 NaOH溶液中,充分反应。NaOH溶液的体积V≥______。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”或“偏低”)。
【探究二】实验方案:铝镁合金 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
问题讨论: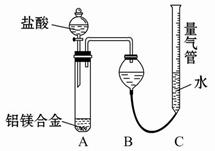
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是:_____(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________。
②______________________________。
【探究三】
实验方案:称量x g铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。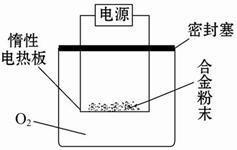
问题讨论:
(1)欲计算镁的质量分数,该实验中还需测定的数据是______。
(2)若用空气(不考虑CO 2 )代替O 2 进行实验,对测定结果有何影响? _____(填“偏高”、“偏低”或“无影响”)。 askalin1年前1
askalin1年前1 -
 ambitious 共回答了19个问题
ambitious 共回答了19个问题 |采纳率89.5%【探究一】2Al+2NaOH+2H 2 O=2NaAlO 2 +3H 2 ↑
(1)100 (2)偏高
【探究二】(1)不需要
(2)检查装置的气密性合金完全溶解(或加入足量盐酸)调整量气管C的高度,使C中液面与B液面相平待冷却至室温再读数等(写出两点,答案合理即可)
【探究三】(1)灼烧后固体的质量 (2)偏高
【探究一】镁铝合金中只有铝与氢氧化钠反应2Al+2NaOH+2H 2 O=2NaAlO 2 +3H 2 ↑,用极值法,假定5.4 g合金完全是铝时,根据方程式求出消耗氢氧化钠的体积为100 mL,故V≥100,若未洗涤固体,镁的表面附着其他杂质,质量偏大,测得镁的质量分数将偏高。
【探究二】(1)因为是排水量气,故不需要在A、B之间添加一个干燥、除酸雾的装置;(2)为使结果准确,应从以下几个方面考虑:检查装置的气密性;合金完全溶解(或加入足量盐酸);调整量气管C的高度,使C中液面与B中液面相平;待冷却至室温再读数等。
【探究三】称量x g铝镁合金粉末,要求镁的质量分数,还需要知道灼烧后固体的质量;若用空气代替O 2 进行实验,部分镁与氮气反应生成氮化镁,燃烧产物的质量减少,通过计算所得镁的质量偏高,测定结果偏高。1年前查看全部
- 铝镁合金5.1g,加入100mL盐酸恰好完全反应,产生标准情况下的气体体积为5.6L,试计算:(1)铝镁合金中镁铝各多少
铝镁合金5.1g,加入100mL盐酸恰好完全反应,产生标准情况下的气体体积为5.6L,试计算:(1)铝镁合金中镁铝各多少克(2)盐酸的物质的量浓度是多少
 夜半鼠鸣1年前1
夜半鼠鸣1年前1 -
 海东311 共回答了18个问题
海东311 共回答了18个问题 |采纳率94.4%现在木有计算器,结果自己算即可.
设铝的物质的量为n1,镁的物质的量为n2,则列出下列方程:
27n1+24n2=5.1g
n1*1.5+n2=5.6/22.4(mol)
即可算出镁铝含量.
盐酸的浓度为(3n1+2n2)/0.1=c(HCl)1年前查看全部
- 现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaO
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n 克,则下列有关该实验的说法中正确的有: [ ]①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO 3 - 离子的物质的量为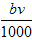 mol
mol
③反应过程中转移的电子数为 mol
mol
④生成NO气体的体积为 L
L
⑤与合金反应反应的硝酸的物质的量为 mol
mol
A.2项
B.3项
C.4项
D.5项 酒是这么喝的1年前1
酒是这么喝的1年前1 -
 h1268 共回答了19个问题
h1268 共回答了19个问题 |采纳率94.7%C1年前查看全部
- 铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等.下列与这些用途无关
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等.下列与这些用途无关的性质是( )
A.不易生锈
B.导电性好
C.密度小
D.强度高 谁e宠物1年前1
谁e宠物1年前1 -
 创三小卡 共回答了19个问题
创三小卡 共回答了19个问题 |采纳率100%解题思路:根据镁铝合金的性质判断正误.根据镁铝合金的性质是坚硬、轻巧、美观、洁净、易于加工,所以主要用于制作窗框、卷帘门、防护栏等;A、C、D都符合这些特点,只有B不符合.
故选:B点评:
本题考点: 金属与合金在性能上的主要差异;合金的概念及其重要应用.
考点点评: 本题考查的是合金的性质及应用,性质决定用途,用途体现性质,根据镁铝合金的性质判断即可.1年前查看全部
- 铝镁合金的密度为什麽小比铝镁都小
 钉子之本1年前3
钉子之本1年前3 -
 fanshenglan 共回答了17个问题
fanshenglan 共回答了17个问题 |采纳率100%lamoncat说错了,不会介于两金属之间.跟元素的原子结构有关
一般来说,合金的物理性质(包括你所提到的密度以及硬度等)、化学性质(熔点等)都与它的组成元素不同.例如,硬度比它的各成分金属大,多数合金的熔点一般也比它的各成分金属低.这与合金的特性有关.
镁铝合金中含有10%~30%的镁,主要性质是强度和硬度都比纯铝和纯镁大,主要用于火箭,飞机,轮船等制造业.1年前查看全部
- (2009•绍兴)铝镁合金是新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等.下列性质与这些用途无关的是( )
(2009•绍兴)铝镁合金是新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等.下列性质与这些用途无关的是( )
A.不易生锈
B.导电性好
C.密度小
D.强度高 onlyyyou1年前1
onlyyyou1年前1 -
 healthl330 共回答了19个问题
healthl330 共回答了19个问题 |采纳率100%解题思路:本题考查了对物质物理性质的应用知识.A、不易生锈,用作建筑装潢材料,美观;
B、导电性好,与装潢无关;
C、密度小,用作建筑装潢材料,轻;
D、强度高,用作建筑装潢材料,坚固耐用.
故选B.点评:
本题考点: 物质的物理特征.
考点点评: 对物质物理性质的应用,一定要联系实际.1年前查看全部
- Ⅰ从某铝镁合金片上剪下一小块(质量为2.0g),立即投入到盛有20mL 5mol•L-1 NaOH溶液的小烧杯中.
Ⅰ从某铝镁合金片上剪下一小块(质量为2.0g),立即投入到盛有20mL 5mol•L-1 NaOH溶液的小烧杯中.
(1)开始时产生气泡的速率较慢其原因是______,一段时间后反应速率相当快原因是______
(2)写出合金片与溶液反应时可能形成的原电池的负极材料是______,正极电极反应方程式为______.
Ⅱ某同学设计了一种电解法制取Fe(OH)2的实验装置(如右图).玻璃管内的电解液为NaCl溶液,通电后,溶液中产生白色沉淀,且较长时间不变色.回答下列问题:
(1)写出A电极的电极反应式______B电极的电极反应式______
(2)若电解改用NaOH溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用NaCl溶液作电解液时白色沉淀能保持较长时间的原因______. 舒笑笑1年前1
舒笑笑1年前1 -
 sun420 共回答了17个问题
sun420 共回答了17个问题 |采纳率88.2%解题思路:I(1)氧化铝和氢氧化钠溶液反应生成偏铝酸钠;镁、铝和电解质溶液能构成原电池,温度越高反应速率越快;
(2)易水的金属作负极,正极上水得电子发生还原反应;
II(1)铁作阳极,阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应;
(2)氢氧化亚铁不稳定,易被氧化生成氢氧化铁,根据氢氧化亚铁产生的位置分析.Ⅰ(1)合金表面有氧化膜氧化铝阻止铝与氢氧化钠溶液反应,氧化铝和氢氧化钠溶液反应生成偏铝酸钠,导致开始时产生气泡的速率较慢;
镁、铝和氢氧化钠溶液构成原电池加速铝被腐蚀,铝和氢氧化钠溶液的反应放出热量导致温度升高,加快反应,氧化膜溶解后铝和氢氧化钠溶液反应导致反应速率加快,
故答案为:合金片表面有氧化膜;形成原电池反应、反应放热、氧化膜溶解;
(2)该原电池中,铝易失电子而作负极,镁作正极,正极上水得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,故答案为:Al;2H2O+2e-=H2↑+2OH-;
Ⅱ(1)铁作阳极,阳极上电极反应式为Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑),
故答案为:Fe-2e-=Fe2+;2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑);
(2)如果改用氢氧化钠溶液,亚铁离子和氢氧根离子在阳极附近生成氢氧化亚铁程度,易被空气氧化,如果电解氯化钠溶液,亚铁离子和氢氧根离子在阴极附近生成氢氧化亚铁,溶液能隔绝空气,所以不易被氧化,故答案为:在溶液的中下部产生沉淀有利于和空气隔绝.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,根据各个电极上发生的电极反应来分析解答,注意不能根据金属的活泼性判断原电池正负极,要根据失电子的难易程度确定原电池负极,为易错点.1年前查看全部
- 铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料.下列性质与这些用途无关的是
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料.下列性质与这些用途无关的是( )
A.导电、导热性好
B.不易生锈
C.密度小
D.强度高 秋之花絮1年前1
秋之花絮1年前1 -
 吴梭位 共回答了19个问题
吴梭位 共回答了19个问题 |采纳率89.5%解题思路:铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点.铝镁合金用于制作门窗、防护栏等时主要是利用了铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点,与导电性是否良好无关.
故选:A.点评:
本题考点: 金属与合金在性能上的主要差异.
考点点评: 解答本题要掌握物质的性质方面的特点,只有这样才能对相关方面的问题做出正确的判断,1年前查看全部
- 铝镁合金是新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等.下列性质与这些用途无关的是( )
铝镁合金是新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等.下列性质与这些用途无关的是( )
A. 不易生锈
B. 导电性好
C. 密度小
D. 强度高 hycbat1年前1
hycbat1年前1 -
 价值69 共回答了19个问题
价值69 共回答了19个问题 |采纳率84.2%解题思路:本题考查了对物质物理性质的应用知识.A、不易生锈,用作建筑装潢材料,美观;
B、导电性好,与装潢无关;
C、密度小,用作建筑装潢材料,轻;
D、强度高,用作建筑装潢材料,坚固耐用.
故选B.点评:
本题考点: 物质的物理特征.
考点点评: 对物质物理性质的应用,一定要联系实际.1年前查看全部
- 含镁3%-5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量的铝镁合金,欲测定其中镁的质量
含镁3%-5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
方案1:向铝镁合金中加盐酸,测定生成气体在标准状况下的体积
方案2:向铝镁合金中加氢氧化钠,充分反应后测定剩余固体的质量
方案3:向铝镁合金中加盐酸,形成溶夜,再加过量氢氧化钠,过滤,侧定沉淀的质量
为什么三个方案都能测出镁的质量分数?
不用解释第二个方案,只求详细解释第一个和第三个方案,第三个为什么沉淀是Mg(OH)2不可以是AL(OH)3么,第一个怎么测定 zjxyyp6591年前1
zjxyyp6591年前1 -
 13816429995 共回答了25个问题
13816429995 共回答了25个问题 |采纳率76%1,盐酸与铝和镁均反应生成氢气.
3,过量的氢氧化钠与铝离子反应生成偏铝酸根(铝具有两性,可与酸或强碱反应),镁经HCL反应后为Mg离子,之后与NaoH反应生成Mg(OH)2沉淀1年前查看全部
- (每空2分,共16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝
(每空2分,共16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
 [方案一]
[方案一] 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是 。
实验中发生反应的化学方程式是 。 〖实验步骤〗
〖实验步骤〗 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将  (填“偏高”、“偏低”或“无影响”)。
(填“偏高”、“偏低”或“无影响”)。 [方案二
[方案二
 ]
]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 10 5 Pa)的体积。
10 5 Pa)的体积。 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:





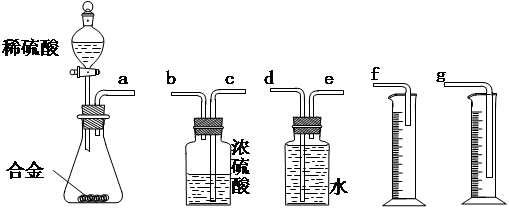

 ①你认为最简易的装置其连接顺序是:a接()()接()()接()(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接()()接()()接()(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
A.等待实验装置冷却 
B.上下移动量筒f,使其中液面与广口瓶中液面相平 
C.上下移动量筒g,使其中液面与广口瓶中液面相平 
D.视线与凹液面的最低点水平读取量筒中水的体积  (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
 ①装置中导管a的作用是 。
①装置中导管a的作用是 。 ②实验前后碱式滴定管中液面读数分别为V 1 mL、V 2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V 1 mL、V 2 mL。则产生氢气的体积为_________mL。



 ldp673831591年前1
ldp673831591年前1 -
 深水涧 共回答了24个问题
深水涧 共回答了24个问题 |采纳率100%1年前查看全部
- (2013•莒南县一模)铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装饰材料,主要用于制作窗框、卷帘门、防护
(2013•莒南县一模)铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装饰材料,主要用于制作窗框、卷帘门、防护栏等.下列与这些用途无关的性质是( )
A.导电性好
B.密度小
C.不易生锈
D.强度高 受伤的脚趾1年前1
受伤的脚趾1年前1 -
 外天 共回答了18个问题
外天 共回答了18个问题 |采纳率94.4%解题思路:根据物质的性质决定物质的用途,物质的用途反映物质的性质.根据镁铝合金的性质是坚硬、轻巧、美观、洁净、易于加工,所以主要用于制作窗框、卷帘门、防护栏等;B、C、D都符合这些特点,只有A不符合.
故选:A点评:
本题考点: 合金与合金的性质.
考点点评: 本题考查的是合金的性质及应用,性质决定用途,用途体现性质,根据镁铝合金的性质判断即可.1年前查看全部
- 某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
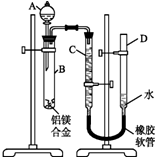 某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(1)A中试剂为______.
(2)B中发生反应的化学方程式为______.
(3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为33600(a−c) b .33600(a−c) b  nrmini1年前1
nrmini1年前1 -
 peakie83 共回答了15个问题
peakie83 共回答了15个问题 |采纳率80%解题思路:Mg与NaOH不反应,而Al与Na反应,由实验可知,A中为NaOH溶液,B中发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,C、D为量气装置,利用氢气的体积可计算铝的质量分数和铝的相对原子质量.Mg与NaOH不反应,而Al与Na反应,由实验可知,A中为NaOH溶液,B中发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,C、D为量气装置,
(1)由上述分析可知,A为NaOH溶液,故答案为:NaOH溶液;
(2)B中发生反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)B中剩余固体的质量为c g,为Mg的质量,则Al的质量为(a-c)g,测得氢气体积为b mL,其物质的量为
b×10−3L
22.4L/mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,Al的物质的量为
b×10−3L
22.4L/mol×[2/3]=[b/33600]mol,则Al的摩尔质量为
(a−c)g
b
33600mol=
33600(a−c)
bg/mol,所以铝的相对原子质量为
33600(a−c)
b,
故答案为:
33600(a−c)
b.点评:
本题考点: 探究物质的组成或测量物质的含量;镁的化学性质;铝的化学性质.
考点点评: 本题考查物质含量的测定,涉及Al的化学性质、化学反应方程式的计算等,综合性较强,注重高频考点的考查,题目难度中等,侧重分析、实验与计算能力的考查.1年前查看全部
- 急..一道化学金属化合物的题铝镁合金3g与100ml 5mol/L盐酸完全反应,生成氢气3.36L(标况),计算在反应后
急..一道化学金属化合物的题
铝镁合金3g与100ml 5mol/L盐酸完全反应,生成氢气3.36L(标况),计算在反应后的溶液中应加入多少毫升的5mol/L的NaOH容易才能得到纯净的Mg(OH)2沉淀? lbnhk1年前2
lbnhk1年前2 -
 hlwcxphlw 共回答了15个问题
hlwcxphlw 共回答了15个问题 |采纳率80%设有铝xmol,镁ymol,
27x+24y=3
1.5x+y=3.36/22.4
解得x=1/15,y=0.05
计算消耗盐酸的量1/15*3+0.05*2=0.3mol盐酸过量0.2mol
要想达到最终目的需要中和过量盐酸,消耗铝离子的4倍让铝离子转化为偏铝酸根,消耗镁离子两倍使其沉淀,共计0.2+4/15+0.11年前查看全部
- 铝硅合金的燃点?请问铝硅合金,铝镁合金的燃点是否一样?是多少?
 暗香沾衣1年前1
暗香沾衣1年前1 -
 kev97in 共回答了23个问题
kev97in 共回答了23个问题 |采纳率82.6%一般说铝只会说熔点,纯铝的熔点为660.24度,沸点为2467度.
首先铝硅合金和铝镁合金的熔炼肯定是不一样的,因为成分不同.
铝硅合金其含硅量一般在4%-22%,而硅的熔炼为1350度,所以铝硅合金的熔点一定会比纯铝高,具体温度也要看硅及其他成分含量.
铝镁合金其含镁量一般在4%-11%,而镁的熔炼为549度,所以铝镁合金的熔点一定会比纯铝低,具体温度也要看成分.1年前查看全部
- 关于化学铝镁合金的计算将3.9克铝镁合金投入到500毫升2mol每升的盐酸中,金属完全溶解,再加入4mol每升的氢氧化钠
关于化学铝镁合金的计算
将3.9克铝镁合金投入到500毫升2mol每升的盐酸中,金属完全溶解,再加入4mol每升的氢氧化钠溶液,若要生成的沉淀最多,加入的这种氢氧化钠溶液的体积是
A,125ml B.200ml C.250ml D.560ml 问牛知马大1年前2
问牛知马大1年前2 -
 ox819 共回答了16个问题
ox819 共回答了16个问题 |采纳率81.3%这道题要用“守恒法”做,因为根据题目信息铝镁合金中铝、镁的量是求不出来的
铝镁合金投入到500ml,2mol/L的盐酸中,金属完全溶解
这时溶液中一定有Mg2+、Al3+、Cl-可能有H+
再加入氢氧化钠溶液,OH-会与H+中和,使Mg2+、Al3+沉淀
但若氢氧化钠溶液过量,Al(OH)3会溶解,生成AlO2-(偏铝酸根)
因此生成的沉淀最多时,Mg2+、Al3+恰好全部沉淀,溶液中只有Na+、Cl-
显然有n(Na+)=n(Cl-)=c(HCl)V(HCl)=1mol
∴V(NaOH)=n(Na+)/c(NaOH)=0.25L=250ml1年前查看全部
- 铝镁合金的优点
 紫玉未成烟1年前1
紫玉未成烟1年前1 -
 寻找净土 共回答了17个问题
寻找净土 共回答了17个问题 |采纳率88.2%铝镁合金主要特点是轻,而且是2系铝合金吧,强度和耐腐蚀都很好,你直接查查含镁的是几系铝合金就行了,1年前查看全部
- 一种铝镁合金比是3比2,现在加入2克铝后的重量是32千克,加铝后铝和镁的比是
 awazaza1年前2
awazaza1年前2 -
 GreeN_枫 共回答了22个问题
GreeN_枫 共回答了22个问题 |采纳率95.5%3:2一共是5 份.重32000-2=31998克.每份重31998/5=6399.6克.加入2克铝后铝的重量是
3X6399.6+2=19200.8 镁的重量是2X6399.6=12799.2 铝镁的比是19200.8:12799.2化简后变化不等于3.0003125195324707794237139821239比2 约等于3比2 因为加的比例太少了.1年前查看全部
- 铝镁合金与100ml稀硫酸恰好完全反应,将反应后所得溶液加热蒸干,得到无水硫酸盐17.4g,则原硫酸溶液的物质
铝镁合金与100ml稀硫酸恰好完全反应,将反应后所得溶液加热蒸干,得到无水硫酸盐17.4g,则原硫酸溶液的物质
的量浓度可能是
A.1mol/L
B.1.5mol/L
C.2 mol/L
D.2.5 mol/L lfzheng1年前1
lfzheng1年前1 -
 长尾cc 共回答了23个问题
长尾cc 共回答了23个问题 |采纳率87%这道题条件较少,用极限法比较快,设硫酸溶液中含H2SO4物质的量为x,假设与硫酸反应的金属全部为AL,则反应后的硫酸盐为Al2(SO4)3,反应前硫酸的量即为硫酸铝中硫酸根的量:x=3*17.4/342=0.153mol,则硫酸的浓度为1.53mol/L
同理可得若金属全为Mg,反应后的硫酸盐全部为MgSO4,则硫酸的量x=17.4/120=0.145,硫酸溶液的物质量浓度为1.45mol/L
既然反应金属是合金,就说明硫酸的量应在0.145和0.153之间,所以选择1.45mo/L和1.53mol/L之间的答案,即B选项正确1年前查看全部
- amol 98%的浓硫酸,与bg铝镁合金反应.生成0.75mol气体.求反应镁的质量.
amol 98%的浓硫酸,与bg铝镁合金反应.生成0.75mol气体.求反应镁的质量.
原题忘了,如果给的条件不够.做不出来.那就说一说浓硫酸与铝镁金属反应解题思路吧.(我知道浓硫酸会变稀这一点) gub87gqweaw1年前3
gub87gqweaw1年前3 -
 七夜哥哥 共回答了25个问题
七夜哥哥 共回答了25个问题 |采纳率96%估计是求不出来!条件不够!
你只要抓住Al不会生成气体,因为会与98%的硫酸发生钝化!
产生的气体都是Mg产生的
刚开始时浓硫酸】
2H2SO4+Mg===MgSO4+SO2+2H2O
接下来如果Mg的量够久硫酸变稀释
H2SO4+Mg===MgSO4+H2
因为Mg最终都是生成Mg2+,所以计算过程可以根据Mg的电子守恒来计算
希望有帮助!
有帮助就给个采纳!1年前查看全部
- 1.现在出现了质量轻.结实耐用.不生锈的自行车,制造自行车的材料也很多,如碳素纤维,铝镁合金,钛合金等,请选择其中一种材
1.现在出现了质量轻.结实耐用.不生锈的自行车,制造自行车的材料也很多,如碳素纤维,铝镁合金,钛合金等,请选择其中一种材料,说出优点.
2.食品包装里常有一袋粉末物质,打开有发现有板结的铁锈,这物质是什么,作用原理是什么
3.考古挖掘的铜器里面往往有铜绿CU2(OH)2CO3,分析形成原因
4.为什么高档电器的铜质插空,插头表面要镀上比铜贵且导电性又不如铜的金呢? 9987551年前2
9987551年前2 -
 千古一爱 共回答了20个问题
千古一爱 共回答了20个问题 |采纳率85%1、碳纤维 质量轻 耐腐蚀 一般不发生化学反应 机械强度好 耐高温 F1方程式赛车的刹车片就是碳纤维的 还有飞机的刹车片
2、 就是在潮湿和有二氧化碳的环境下形成的
2Cu+O2+CO2+H2O=Cu2(OH)2CO3
3、氧化铁有吸水能力(因为铁锈的分子式是Fe2O3.nH2O) 跟硫酸铜类似 有很强的吸水能力 不过硫酸铜有毒
4、为什么不用铜 因为空调等大功率电器 在拔下插头的时候由于功率大 插头和插座在分开的一瞬间会产生电弧(俗称电火花) 而电弧具有很高的能量 瞬间释放大量的热 温度很高 插头和插座容易氧化 所以不用铜 而金熔点高 抗氧化性好 所以采用镀金
2、 就是在潮湿和有二氧化碳的环境下形成的
2Cu+O2+CO2+H2O=Cu2(OH)2CO3
3、氧化铁有吸水能力(因为铁锈的分子式是Fe2O3.nH2O) 跟硫酸铜类似 有很强的吸水能力 不过硫酸铜有毒1年前查看全部
- 适合于铝及铝镁合金厂化验室分析的进口直读光谱仪有哪些?价格都是多少呢?
适合于铝及铝镁合金厂化验室分析的进口直读光谱仪有哪些?价格都是多少呢?
1、要进口的不要国产的.
2、小一点的能做铝分析的又哪些,什么价位.
3、大的可以做磷生铁又可以做铝的是什么价位,都有什么牌子.
4、做电解质的光谱仪有哪些,什么价位.
作的比较多,要三四十万或是七八十万的,不要手持的 wangdou1年前1
wangdou1年前1 -
 烟雨之缘 共回答了18个问题
烟雨之缘 共回答了18个问题 |采纳率88.9%要好的就买当前公认的牌子:ARL OBLF SPECTRO,国产买DF好了1年前查看全部
- (2008•重庆)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
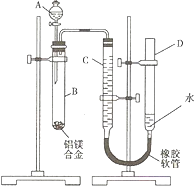 (2008•重庆)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(2008•重庆)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(1)A中试剂为______.
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是______.
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性.上述操作的顺序是______(填序号);记录C的液面位置时,除视线平视外,还应______.
(4)B中发生反应的化学方程式为______.
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为33600(a−c) b .33600(a−c) b
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将______(填“偏大”、“偏小”、“不受影响”). 范遥1年前1
范遥1年前1 -
 傲剑纷飞 共回答了29个问题
傲剑纷飞 共回答了29个问题 |采纳率86.2%解题思路:(1)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而不和Mg反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量;
(2)由于Al表面容易生成氧化膜,因而要用酸处理;
(3)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录C中的液面,两者相减即为产生H2的量;最后称得的固体即为Mg的质量.在读数时要注意D、C液面相平,否则气体将受压,造成读数不准;
(4)B中发生的是Al与碱的反应;
(5)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量,而n(Al)可以由产生的H2获得;
(6)未洗涤,则造成(a-c)变小,则由(5)的结果可进行判断.(1)根据铝镁的化学性质,铝镁都能与酸反应放出氢气,但铝还能与碱(如NaOH溶液)反应放出氢气,而镁不能,要测定铝镁合金中铝的质量分数,应选择NaOH溶液,
故答案为:NaOH溶液;
(2)铝镁的表面都容易形成一层氧化膜,在实验前必须除去,故答案为:除去铝镁合金表面的氧化膜;
(3)实验时首先要检查气密性,记下量气管中C的液面位置,再加入NaOH溶液开始反应,待反应完毕并冷却至室温后,记录量气管中C的液面位置,最后将B中剩余固体过滤,洗涤,干燥,称重;量气管读数时为使里面气体压强与外界大气压相等,必须使D和C两管中液面相平,
故答案为:⑤①④③②;使D和C的液面相平;
(4)B管中发生铝与NaOH溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a-c)g bml
解之得:M=
33600(a−c)
b,故答案为:
33600(a−c)
b;
(6)铝的质量分数为:
(a−c)
a×100%,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,
故答案为:偏小.点评:
本题考点: 铝的化学性质;镁的化学性质;探究物质的组成或测量物质的含量.
考点点评: 本题考查混合物的计算和测定,题目难度中等,建议加强元素化合物的学习,学会分析实验中的每一个关键点.1年前查看全部
- 下列物质中不属于合金的是A钢 B水银 C18K金 D铝镁合金
 加勒比之光1年前1
加勒比之光1年前1 -
 我爱鱼羊 共回答了16个问题
我爱鱼羊 共回答了16个问题 |采纳率93.8%答案:B水银(汞)
A是铁和多种矿物的合金
C是金和多种矿物的合金
D是铝和镁合金1年前查看全部
- 304不锈钢和铝镁合金哪个强度高?不易折断!
304不锈钢和铝镁合金哪个强度高?不易折断!
不考虑重量问题 816751年前1
816751年前1 -
 syrengyue 共回答了30个问题
syrengyue 共回答了30个问题 |采纳率86.7%不考虑重量问题,304不锈钢比铝镁合金强度高,不易折断,
原因:304不锈钢抗拉强度520MPa; 最好的铝镁合金6061强度290MPa1年前查看全部
- 铝镁合金制品 英文 用于XX铝镁合金制品 有限公司
铝镁合金制品 英文 用于XX铝镁合金制品 有限公司
谢谢, GZ突然的自我1年前1
GZ突然的自我1年前1 -
 yw33441314 共回答了18个问题
yw33441314 共回答了18个问题 |采纳率88.9%magaluma
aluminum magnesium alloy1年前查看全部
- (2007•黄埔区一模)铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑材料,主要用于制作窗框、卷帘门、防护栏等
(2007•黄埔区一模)铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑材料,主要用于制作窗框、卷帘门、防护栏等.下列与这些用途无关的性质是( )
A.不易生锈
B.导电性好
C.密度小
D.强度高 美妹mm1年前1
美妹mm1年前1 -
 西就她没 共回答了14个问题
西就她没 共回答了14个问题 |采纳率85.7%解题思路:A、根据防护栏、门窗需要防锈进行分析,
B、根据制作窗框、卷帘门、防护栏不需要考虑导电性进行分析,
C、根据制作窗框、卷帘门的质量不能太重进行分析,
D、根据卷帘门需要具有一定的强度进行分析.A、门窗常暴露与空气中,需要防止锈蚀,故A错误,
B、制作的这些产品不用考虑导电性,故B正确,
C、卷帘门在操作时的质量不能太重,所以密度不能太大,故C错误,
D、卷帘门需要有一定的抗撞击能力,强度必须较高,故D错误,
故选B.点评:
本题考点: 合金与合金的性质.
考点点评: 在解此类题时,首先分析各种物质或产品需要具有的性能,然后结合题中的信息解答.1年前查看全部
- 铝镁合金,铅铝合金的密度.
 落落月落1年前1
落落月落1年前1 -
 黑莲蓉 共回答了25个问题
黑莲蓉 共回答了25个问题 |采纳率72%铝镁合金密度小(大约为铝的2/3,钢的1/4,钛的1/3),1年前查看全部
- 3.9克铝镁合金加入盐酸后再加入过量的氢氧化钠溶液,测得的沉淀质量为2.9克,加过量的氢氧化钠溶液充分反应后,用什么分离
3.9克铝镁合金加入盐酸后再加入过量的氢氧化钠溶液,测得的沉淀质量为2.9克,加过量的氢氧化钠溶液充分反应后,用什么分离方法,洗涤烘干沉淀,镁的质量分数为多少,如果不洗涤沉淀,测得的镁的质量分数将偏大?偏小?无变化?求具体思路
 50450411年前0
50450411年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 实验:1、铝镁合金和盐酸反应2、铝镁合金和氢氧化钠反应3、铝镁合金先和盐酸反应后和过量氢氧化钠
实验:1、铝镁合金和盐酸反应2、铝镁合金和氢氧化钠反应3、铝镁合金先和盐酸反应后和过量氢氧化钠
1、反应方程式2、这体现了铝、镁单质的哪些性质?3、该实验能测出合金中镁的质量分数吗?(镁质量已知)
上述三个实验分别都能测出合金中镁的质量分数吗? 窝在圈里的猪猪1年前1
窝在圈里的猪猪1年前1 -
 漫步云端6262 共回答了21个问题
漫步云端6262 共回答了21个问题 |采纳率90.5%1、2Al+6HCl=2AlCl3+3H2;Mg+2HCl=MgCl2+H2
2、2Al+2NaOH+2H2O=2NaAlO2+3H2
3、2Al+6HCl=2AlCl3+3H2;Mg+2HCl=MgCl2+H2;
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O;MgCl2+2NaOH=Mg(OH)2+2NaCl
金属性
可以1年前查看全部
- 某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数.
某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数.
【查阅资料】
(1)氢氧化镁和氢氧化铝据难溶于水.难溶碱受热后能分解生成水和相应的金属氧化物.
(2)镁和氢氧化镁均不能与氢氧化钠溶液反应,但铝和氢氧化铝均能能与氢氧化钠溶液发生如下反应:2Al+2NaOH+2H 2 O==2NaAlO 2 +3H 2 ↑、Al(OH) 3 +NaOH==NaAlO 2 +2H 2 O
【方案设计】他们利用实验室提供的盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金 测定生成气体的体积
测定生成气体的体积
方案二:铝镁合金 测定生成气体的体积
测定生成气体的体积
方案三:铝镁合金 溶液
溶液 称量灼烧产物
称量灼烧产物
【方案评价】(1)三个方案是否均可行,如有不可行的请说明理由. _________ .
(2)如果你是小组成员,你愿意采用何种方案? _________ (填“方案一”、“方案二”或“方案三”).理由是 _________ .
【实验设计】实验小组根据方案二设计了如下图所示(图中的铁架台已省略)的两个实验装置.
你认为选择 _________ 装置进行实验更合理,误差更小.
【交流讨论】(3)小组成员实验后,通过交流讨论普遍认为上述三个实验方案均存在操作不够简便或容易产生测量误差的问题.于是按照上述形式重新设计了方案,请你帮助他们完成新方案的设计(在→上方填写相应的试剂和操作):_________
小组成员按照新的测定方案,取20g铝镁合金,研成金属粉末后,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:加NaOH溶液的次数第一次第二次第三次…/g16.5n9.5…
(4)小组成员将铝镁合金研成金属粉末的目的是 _________ .
(5)分析以上数据可知,上表中n的值为 _________ ;
(6)该金属粉末中Al的质量分数为 _________ %
(7)列式计算:所用氢氧化钠溶液的溶质质量分数为多少?计算过程: _________ _________ . ttimefighter1年前1
ttimefighter1年前1 -
 水色冰月 共回答了16个问题
水色冰月 共回答了16个问题 |采纳率87.5%1年前查看全部
- 某兴趣小组为探究铝镁合金的组成,取16g铝镁合金样品,将60g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不
某兴趣小组为探究铝镁合金的组成,取16g铝镁合金样品,将60g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H 2 O═2NaAlO 2 +3H 2 ↑),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
计算:(1)该合金中,铝元素与镁元素的质量比为______.所加氢氧化钠溶液的次数 第一次 第二次 第三次 剩余固体的质量/g 10.6 5.2 4.0
(2)所用氢氧化钠溶液中溶质的质量分数. yyjysyx1年前1
yyjysyx1年前1 -
 13755765359 共回答了17个问题
13755765359 共回答了17个问题 |采纳率88.2%(1)由前两次实验数据可得:每加入20g氢氧化钠溶液将会消耗铝16g-10.6g=5.4g,第三次加入20g氢氧化钠溶液,样品质量减少5.2g-4.0g=1.2g<5.4g,则所剩余固体4.0g为金属镁的质量,则该合金中,铝元素与镁元素的质量比=(16g-4g):4g=12:4=3:1
故答案为:3:1;
(2)第一次所加20g氢氧化钠溶液能反应的铝的质量为:16g-10.6g=5.4g
设20g氢氧化钠溶液中溶质的质量为x
2Al+2NaOH+2H 2 O═2NaAlO 2 +3H 2 ↑
54 80
5.4g x
54
80 =
5.4g
x x=8g
所用氢氧化钠溶液中溶质的质量分数=
8g
20g ×100%=40%
答:所用氢氧化钠溶液中溶质的质量分数为40%.1年前查看全部
- 从某铝镁合金片上剪下一小块,立即投入到盛有10ml 10mol/l氢氧化钠溶液中
从某铝镁合金片上剪下一小块,立即投入到盛有10ml 10mol/l氢氧化钠溶液中
一开始反应慢,后来又非常快,为什么?
想要测定合金铝的含量,还要测定哪些数据? 健身ww1年前1
健身ww1年前1 -
 addnext 共回答了16个问题
addnext 共回答了16个问题 |采纳率93.8%一开始是化学反应2Al+2NaOH+2H2O=2NaAlO2+3H2
后来是原电池
正极(Mg):6H2O+6e=3H2+6OH- 负极(Al):2Al+4OH—6e=2AlO2- +2H2O
要剩余的Mg质量和生成的H2质量(或者标况下体积)
常州一中的?1年前查看全部
- 铝镁合金--NaOH-->测定生成气体的体积
 宝的圣诞梅花鹿1年前1
宝的圣诞梅花鹿1年前1 -
 bubble7724 共回答了18个问题
bubble7724 共回答了18个问题 |采纳率88.9%呃,没明白lz的问题…是问这种方法是干嘛的么?是为了测合金中Al的含量的,因为Al会和氢氧化钠反应但是Mg不会,所以加入过量的氢氧化钠后测量产生的氢气体积就可以算出Al的摩尔数,从而算出合金中Al的含量1年前查看全部
- 将3.9克铝镁合金投入到500毫升2mol每升的盐酸中,金属完全溶解,再加入4mol每升的氢氧化钠溶
 luoji30001年前1
luoji30001年前1 -
 坏兮兮 共回答了11个问题
坏兮兮 共回答了11个问题 |采纳率90.9%题目补充完整些?1年前查看全部
- 5.1克铝镁合金,投入500毫升2摩尔每升的盐酸中,加入4摩尔每升的氢氧化钠多少毫升?
5.1克铝镁合金,投入500毫升2摩尔每升的盐酸中,加入4摩尔每升的氢氧化钠多少毫升?
是得到沉淀质量最多时需要的氢氧化钠 边城Roy1年前1
边城Roy1年前1 -
 yabgwei328 共回答了22个问题
yabgwei328 共回答了22个问题 |采纳率86.4%镁铝加入盐酸(是否过量未知)反应后溶液中为氯化镁、氯化铝、(盐酸)【可能】.再加入氢氧化钠,完全沉淀(镁铝离子全部出去)溶液中只剩下氯化钠.溶液中的Cl-与Na+以一比一的比例存在,所以,总Cl-与Na+的数量相同,所以氢氧化钠的物质的量等于盐酸的物质的量=1mol,所以VNaOH=250ml.1年前查看全部
大家在问
- 119世纪末,康有为、梁启超掀起维新变法的目的是( )
- 22012年专四,除了dictation和作文能打38分,请问能过吗?大作文没语法错误一般给几分,没跑题,小作文几分
- 3已知集合A={x|x=cos2(2n−1)πm,n∈Z},当m为4022时,集合A的元素个数为______.
- 4水压与管径的关系我平时理解水压与管径是无关的,但从流量角度上看就很矛盾了.比如在大管后接小管,或者在小管后接大管,从流量
- 5一只失去雏鸟的美国红雀,把养鱼池边浮到水面张口求食的金鱼当作自己的雏鸟来喂养,一连喂了好几个星期.美国红雀的这种行为(
- 6有人向一位老师:“您所教的班级有多少名学生?”老师说:“一半学生在学数学,四分之一的学生在学音乐,七分之一的学生在学外语
- 7文中哪些地方表现了祖父对小孙女的喜爱?
- 8英语翻译心理压力即精神压力,现代生活中每个人都有所体验,心理压力总的来说有社会、生活和竞争三个压力源.压力过大、过多会损
- 9夏天度假怎么穿
- 10南方居民的主食是( )A.面食B.大米C.小米D.杂粮饼
- 11look at the insect,it's very samll, and it's( )
- 12资本主义制度经历了建立发展、调整完善的过程,并由大西洋沿岸逐步扩展到世界范围.阅读下列材料,回答问题.(8分)
- 13求历年来关于奥英一些竞赛的试题?
- 14wash the clothes 作文
- 15一个陀螺顶部分为红黄蓝三种颜色,旋转时,请问是什么颜色?