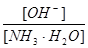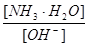问欲将0.1摩草酸钙完全溶解于1升盐酸中,盐酸浓度最低多少
 天天33272022-10-04 11:39:541条回答
天天33272022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 juliechen520 共回答了19个问题
juliechen520 共回答了19个问题 |采纳率84.2%- 这个需要你给出草酸钙的溶度积常数和草酸的电离常数.
- 1年前
相关推荐
- 问:用水稀释0.1摩/升氨水时OH-浓度变化(增大还是减小)?给出合理理由
问:用水稀释0.1摩/升氨水时OH-浓度变化(增大还是减小)?给出合理理由
物质的量增大了,但体积又变大了,要如何判断? 长理大飞1年前1
长理大飞1年前1 -
 li521le 共回答了19个问题
li521le 共回答了19个问题 |采纳率89.5%你只需要记住平衡移动总是远弱于稀释的作用就可以了.
因此稀释后,虽然电离度上升了,但是总体而言OH-的浓度是下降的.1年前查看全部
- 1.中和10%的硫酸溶液49克,需要氢氧化钠多少摩?反应后盐溶液的质量百分比浓度是多少?(已算出需要氢氧化钠0.1摩,请
1.中和10%的硫酸溶液49克,需要氢氧化钠多少摩?反应后盐溶液的质量百分比浓度是多少?(已算出需要氢氧化钠0.1摩,请帮我算出第二个问题.)
2.将6.6克二氧化碳通入含7.4克氢氧化钙的澄清石灰水中,可生成沉淀多少摩?
以上都需要按照解答题格式来做,如果解题过程详细且条理清晰会有加分. idachen04241年前1
idachen04241年前1 -
 do1tn0w 共回答了17个问题
do1tn0w 共回答了17个问题 |采纳率82.4%第一题:
已知10%的硫酸溶液49克中含有硫酸为49*10%=4.9g
根据方程式:
H2SO4+2NaOH---Na2SO4+H2O
98 80 142
4.9g 4g 7.1g
根据质量守恒定律,可知反应后盐溶液的质量百分比浓度为:
p=7.1/ 4.9+4 =79.77%
第二题:
其化学方程式为:
CO2+ Ca(OH)2--- CaCO3(沉淀)+H2O
已知二氧化碳为6.6g,则根据n=m/M,可知其物质的量为:
n1=m1/M1=6.6g/ 44g/mol =0.15 mol
已知二氧化碳为7.4g,则根据n=m/M,可知其物质的量为:
n2=m2/M2= 7.4g/ 74g/mol=0.1mol
由此可知,氢氧化钙过量.
根据题意,列出化学方程式 :
CO2+ Ca(OH)2--- CaCO3(沉淀)+H2O
1 1 1
0.15mol 0.15 mol x mol
根据化学方程式,可得
x=0.15mol
所以可生成沉淀0.15mol1年前查看全部
- 0.1摩下列金属分别投入0.1摩/升的100毫升盐酸标准状况下产生气体体积最大的
0.1摩下列金属分别投入0.1摩/升的100毫升盐酸标准状况下产生气体体积最大的
v升 Al2(so4)3溶液中含有AL^3+ m克,则溶液中so4^2-的浓度
A Mg B AL C Na D Zn loveme199991年前2
loveme199991年前2 -
 benbenzhong 共回答了19个问题
benbenzhong 共回答了19个问题 |采纳率89.5%当然是钠.因为这四种金属与酸反应,酸都是不足量的,而钠虽然酸也不足量,但是还可以和水继续反应,生成更多的氢气.其余三种生成0.005摩氢气,钠生成0.05摩.
m/18v1年前查看全部
- 用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是 A. B. C.[H + ]和[OH - ]的乘积 D.OH
用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A. 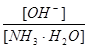
B. 
C.[H + ]和[OH - ]的乘积 D.OH - 的物质的量  月光之神1年前1
月光之神1年前1 -
 huyuqian0720 共回答了17个问题
huyuqian0720 共回答了17个问题 |采纳率88.2%1年前查看全部
- 6.4g铜与过量硝酸amol/L,30mL充分反应,硝酸还原产物有N0、NO2.反应后溶液中含H+ 0.1摩
6.4g铜与过量硝酸amol/L,30mL充分反应,硝酸还原产物有N0、NO2.反应后溶液中含H+ 0.1摩
(1)溶液中NO3-有几mol?
(2)NO2 NO物质的量 用a表示 承璐1年前1
承璐1年前1 -
 lin7672 共回答了17个问题
lin7672 共回答了17个问题 |采纳率82.4%我没太多时间,只能大概说说
(1).6.4gCu充分反应,变成Cu(NO3)2,所以NO3-就有0.2mol了
H+过量所剩余的0.1mol,是以HNO3形式存在,所以还有0.1molNO3-
所以总共是0.3molNO3-
(2).NO2 NO物质的量 应该是
amol/L*30ml-0.1mol
第二问我不太确定1年前查看全部
- 用10ml的0.1摩/升氯化钡溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则
用10ml的0.1摩/升氯化钡溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液中的物质的量浓度比为多少?
1:3:3
为什么? 干净更利落1年前1
干净更利落1年前1 -
 九雪 共回答了19个问题
九雪 共回答了19个问题 |采纳率84.2%3BaCl2~Fe2(SO4)3
3^^^^^^^^^^^^^^1
0.1^^^^^^^^^^^^0.1/3
BaCl2~ZnSO4
1^^^^^^^^^^^^1
0.1^^^^^^^^^^0.1
BaCl2~K2SO4
1^^^^^^^^^^^^1
0.1^^^^^^^^^^0.1
0.1/3:0.1:0.11年前查看全部
- 0.1摩l每升碳酸铵溶液与0.1摩每升碳酸钠溶液ph大小
 kk-v1年前2
kk-v1年前2 -
 chenruoguaa 共回答了14个问题
chenruoguaa 共回答了14个问题 |采纳率100%碳酸钠>碳酸铵1年前查看全部
- 将100毫升0.1摩/升的bacl2溶液加入到100毫升0.2摩/升的H2SO4中,则溶液中存在离子浓度关系
 qiuguodong1年前2
qiuguodong1年前2 -
 成都酒鬼 共回答了17个问题
成都酒鬼 共回答了17个问题 |采纳率88.2%100毫升0.1摩/升的bacl2溶液中氯化钡物质的量为0.01mol
100毫升0.2摩/升的H2SO4中硫酸物质的量为0.02mol
发生反应:H2SO4+BaCl2=BaSO4↓+2HCl
0.01mol氯化钡和0.01molH2SO4完全反应,此时生成0.02molHCl剩余0.01molH2SO4
所以此时溶液中存在的离子有H+ SO42- Cl-
n(H+)=0.02+0.01×2=0.04mol
n(SO42-)=0.01mol
n(Cl-)=0.02mol
所以 n(H+)>n(Cl-)>n(SO42-)1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 edczxcvbnm1年前1
edczxcvbnm1年前1 -
 含思怡笑 共回答了24个问题
含思怡笑 共回答了24个问题 |采纳率87.5%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 用98%(密度为1.84g/cm3)的浓硫酸配置0.1摩/升硫酸100ml时,需要浓硫酸___毫升?
用98%(密度为1.84g/cm3)的浓硫酸配置0.1摩/升硫酸100ml时,需要浓硫酸___毫升?
说明原因。 天水一鸣1年前2
天水一鸣1年前2 -
 pinker 共回答了20个问题
pinker 共回答了20个问题 |采纳率100%m(H2SO4)=0.1*0.1*98=0.98g
V=0.98/(1.84*98%)=0.54mL1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 liuyunfei1231年前1
liuyunfei1231年前1 -
 海角ee一粟 共回答了18个问题
海角ee一粟 共回答了18个问题 |采纳率94.4%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 某元素单质0.1摩与氯气充分反映后,生成物的质量比原单质的质量增加了10.5克,求这种元素
 心烦恼意乱的xx1年前4
心烦恼意乱的xx1年前4 -
 有个玩具屋 共回答了21个问题
有个玩具屋 共回答了21个问题 |采纳率90.5%增加的质量就是氯气的质量.,
那么得到氯气的物质的量是10.5/35=0.3
那么得到化学式应该是ACl3
那么元素是正三价的元素,
答案应该是AL(铝),Fe(铁)
感觉你条件好像少,要不然有2种可能啊!1年前查看全部
- 某液态有机物0.1摩与0.3摩氧气混合于密闭容器中用电火花点火,燃烧完毕,将燃烧产物通入过量澄清石灰水,可生成白色沉淀2
某液态有机物0.1摩与0.3摩氧气混合于密闭容器中用电火花点火,燃烧完毕,将燃烧产物通入过量澄清石灰水,可生成白色沉淀20克,溶液质量减少5.8克,剩余气体继续通过灼热的氧化铜,可使氧化铜质量减少1.6克.又知该有机物能与金属钠发生反应生成H2,还能发生银镜反应,通过计算写出该有机物的分子式,判断该有机物的结构简式
 oo88oo1年前1
oo88oo1年前1 -
 10202shi 共回答了24个问题
10202shi 共回答了24个问题 |采纳率91.7%CO2 + Ca(OH)2 = CaCO3 + H2O
44--------74-------100--------18
白色沉淀为碳酸钙
参加反应的CO2为:20g/100 = 0.2mol
溶液质量减少的理论值为氢氧化钙减去生成的水:20g/100×(74-18) = 11.2g
而溶液实际减少了5.8g,则与上式的差值为H2O的质量:11.2g-5.8g = 5.4g
5.4g/18g/mol = 0.3mol
由于剩余气体可能含有CO,所以可以还原氧化铜
CO + CuO = CO2 + Cu
减少的就是O的质量,为1.6克,即0.1mol
所以CO为0.1mol
总结一下上面的过程
0.1mol有机物与0.3mol氧气点燃,生成二氧化碳0.2mol、一氧化碳0.1mol,水0.3mol
所以,该有机物中,碳氢个数分别为3和6
由于可以与金属钠反应生成氢气,且能发生银镜反应,说明有羟基和醛基
所以,该有机物为C3H6O2.
结构简式:HOCH2CH2CHO、CH3CH(OH)CHO1年前查看全部
- 在某100毫升混合溶液中,硝酸和硫酸的物质的量浓度分别是0.4摩每升和0.1摩每升,向该混合溶液中加入1.92克
在某100毫升混合溶液中,硝酸和硫酸的物质的量浓度分别是0.4摩每升和0.1摩每升,向该混合溶液中加入1.92克
在某100毫升混合溶液中,硝酸和硫酸的物质的量浓度分别是0.4摩每升和0.1摩每升,向该混合溶液中加入1.92克铜粉,加热,待充分反应后,所得溶液中的铜离子的物质的量浓度是多少 8111261年前1
8111261年前1 -
 动力调频 共回答了20个问题
动力调频 共回答了20个问题 |采纳率95%加入铜单质?
用稀硝酸和铜的离子方程式求解.硫酸就是提供氢离子给硝酸用的.
铜:0.03mlo,氢离子:0.06mol,硝酸根:0.04mol
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO + 4H2O(氢离子不足,计算以氢离子量为准)
0.03 0.06 0.04 0.0225
0.0225/0.1=0.225mlo/L1年前查看全部
- 高中化学 关于混合物的问题1,20度,一标准大气压下,2.8gC2H4 和CO混合气体中,含气体分子数-----0.1摩
高中化学 关于混合物的问题
1,20度,一标准大气压下,2.8gC2H4 和CO混合气体中,含气体分子数-----0.1摩(填>,<,=)
2,46gNO2 N2O4 混合气体中分子数为--------摩
3,相同条件下,N2 O3的混合气体与等V的N2,所含原子数--------(填>,<,=)
4,CO2 O2组成的混合物中有-----摩分子,其中的氧原子数为------摩
5,标况下,分子数为1摩的CO C2H4混合气体体积约为------L,质量为-------
恳请帮忙解释一下,谢谢。明天就考试了,还有不会的,希望能尽快解决问题。 paopaozhu198141年前10
paopaozhu198141年前10 -
 部级科员 共回答了21个问题
部级科员 共回答了21个问题 |采纳率95.2%1.是= (因为C2H4 和CO的分子质量都是28)
2.是属于0.5和1之间 两者之间存在平衡移动 所以1和0.5
3.> 等V说明他们的分子数相同 但是O3 比N2多一个原子
4.缺少条件呐
5.只要是标况,物质是气体且总共有1摩,那么即使有一万种气体,它就是22.4L
由于俩分子的分子质量都是28 所以根据m=n*M1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 gyaq1年前2
gyaq1年前2 -
 shuqing1999 共回答了26个问题
shuqing1999 共回答了26个问题 |采纳率88.5%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 0.1摩每升的磷酸一氢钠溶液ph计算!要详细步骤
 xmj0651年前1
xmj0651年前1 -
 狂舞的蝴蝶 共回答了11个问题
狂舞的蝴蝶 共回答了11个问题 |采纳率81.8%任何浓度的HPO42-水溶液
pH=0.5(pKa2 + pKa3)= 9.671年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 flowerfl1231年前4
flowerfl1231年前4 -
 yinyucoo 共回答了19个问题
yinyucoo 共回答了19个问题 |采纳率84.2%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 0.1摩H2SO4约含( )个H原子,溶于水后电离出( )mol硫酸根离子.
0.1摩H2SO4约含( )个H原子,溶于水后电离出( )mol硫酸根离子.
36克水与( )克CO2具有相同的氧原子数.
71克NA2SO4中所含钠离子的物质的量为( )mol
在9.5克某二价金属的氯化物中含0.2mol氯离子,此氯化物的摩尔质量为( ),该元素的相对分子质量为( )
有公式的请把公式也写上, liwinshine1年前2
liwinshine1年前2 -
 信誉时尚 共回答了17个问题
信誉时尚 共回答了17个问题 |采纳率94.1%0.1摩H2SO4约含(0.2*6.02*10^23)个H原子,溶于水后电离出(0.2)mol硫酸根离子.
36克水与(44)克CO2具有相同的氧原子数.
71克NA2SO4中所含钠离子的物质的量为(1)mol
在9.5克某二价金属的氯化物中含0.2mol氯离子,此氯化物的摩尔质量为(95g/mol),该元素的相对分子质量为(24)1年前查看全部
- 分子式为CnH2nO2的一元羧酸0.569g,恰好中和0.1摩/升的苛性钠溶液20m毫升,求n的值
 pantaimao1年前1
pantaimao1年前1 -
 sunshine_6396 共回答了19个问题
sunshine_6396 共回答了19个问题 |采纳率89.5%n(NaOH)=0.002mol=n(acid)
MW(acid)=0.569/0.002=284.5(g/mol)
14n+32=284.5 n=181年前查看全部
- 将0.2摩/升的氢氧化钠和0.1摩/升的醋酸等体积混合,有关溶液中离子浓度的判断正确的是( )
将0.2摩/升的氢氧化钠和0.1摩/升的醋酸等体积混合,有关溶液中离子浓度的判断正确的是( )
A.c(Na+)>c (H+)>c (CH3COO-)>c (OH-)
B.c (Na+)>c (CH3COO-)>c (OH-)>c (H+)
C.c (Na+)+c (H+)=c (OH-)+c (CH3COO-)
D.c (Na+)=c (OH-)>c (CH3COO-)=c (H+) luowei2121年前1
luowei2121年前1 -
 e32er 共回答了14个问题
e32er 共回答了14个问题 |采纳率92.9%解题思路:将0.2摩/升的氢氧化钠和0.1摩/升的醋酸等体积混合,NaOH+CH3COOH=CH3COONa+H2O,反应完全后溶液中溶质为等浓度的CH3COONa和NaOH,据此分析判断离子浓度大小,溶液中存在电荷守恒c (Na+)+c (H+)=c (OH-)+c (CH3COO-);将0.2摩/升的氢氧化钠和0.1摩/升的醋酸等体积混合,NaOH+CH3COOH=CH3COONa+H2O,反应完全后溶液中溶质为等浓度的CH3COONa和NaOH,据此分析判断离子浓度大小,c (Na+)>c (OH-)>c (CH3COO-)>c (H+),溶液中存在电荷守恒c (Na+)+c (H+)=c (OH-)+c (CH3COO-);
所以选项中C正确,
故选C.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了电解质溶液中离子浓度大小和电荷守恒的分析判断,主要是化学反应定量分析溶液中溶质,掌握基础是关键,题目难度中等.1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A.3:2:2
B.1:2:3
C.1:3:3
D.3:1:1 jnjingsarry1年前1
jnjingsarry1年前1 -
 woshihaoren44 共回答了16个问题
woshihaoren44 共回答了16个问题 |采纳率81.3%由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~
1
3Fe2(SO4)3~ZnSO4~K2SO4,
1
1
3 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为
1
3:1:1=1:3:3,
故选C.1年前查看全部
- 在一定温度下,一定体积的密闭容器中有如下平衡:H2+I2=2HI已知H2和I2的起始浓度均为0.1摩耳每升,达平...
在一定温度下,一定体积的密闭容器中有如下平衡:H2+I2=2HI已知H2和I2的起始浓度均为0.1摩耳每升,达平...
在一定温度下,一定体积的密闭容器中有如下平衡:H2+I2=2HI已知H2和I2的起始浓度均为0.1摩耳每升,达平衡时HI的浓度为0.16摩耳每升,若H2和I2的起始浓度均变为0.2摩耳每升,则平衡时氢气的浓度是?A:0.16;B:0.08;C:0.04;D:0.02 kiko90241年前3
kiko90241年前3 -
 青壮年痴呆症 共回答了16个问题
青壮年痴呆症 共回答了16个问题 |采纳率87.5%对平衡一,平衡时HI的浓度为0.16mol/L,反应的c(H2)=0.16/2=0.08mol/L,平衡时c(H2)=0.1-0.08=0.02mol/L
因为反应前后气体体积不变,所以起始将H2和I2浓度增大为原来2倍时,平衡时的H2浓度也增大为原来的2倍,选C1年前查看全部
- 100毫升0.1摩/升醋酸与50毫升0.2摩/升氢氧化钠溶液混和,在所得溶液中( )
100毫升0.1摩/升醋酸与50毫升0.2摩/升氢氧化钠溶液混和,在所得溶液中( )
A.[Na+]>[CH3COO-]>[OH-]>[H+]
B.[Na+]>[CH3COO-]>[H+]>[OH-]
C.[Na+]>[CH3COO-]>[H+]=[OH-]
D.[Na+]=[CH3COO-]>[OH-]>[H+] 笑风清1年前1
笑风清1年前1 -
 linwengeng 共回答了16个问题
linwengeng 共回答了16个问题 |采纳率100%解题思路:100毫升0.1摩/升醋酸与50毫升0.2摩/升氢氧化钠溶液混和反应后溶液中的溶质只有醋酸钠,由醋酸钠的化学式为CH3COONa,
由醋酸根离子水解,则[Na+]>[CH3COO-],水解后溶液显碱性,则[OH-]>[H+],又水解的程度很弱,则[CH3COO-]>[OH-],然后分析选项即可解答.醋酸的物质的量为0.1L×0.1mol/L=0.01mol,氢氧化钠的物质的量为0.05L×0.2mol/L=0.01mol,
则混合后二者恰好完全反应,溶液中的溶质只有CH3COONa,
A、醋酸根离子水解,则[Na+]>[CH3COO-],水解后溶液显碱性,则[OH-]>[H+],又水解的程度很弱,则[CH3COO-]>[OH-],即
溶液中离子的浓度大小为[Na+]>[CH3COO-]>[OH-]>[H+],故A正确;
B、因醋酸钠溶液中醋酸根离子水解后溶液显碱性,则[OH-]>[H+],故B错误;
C、因醋酸钠溶液中醋酸根离子水解后溶液显碱性,则[OH-]>[H+],故C错误;
D、由醋酸钠的化学式为CH3COONa,CH3COO-与Na+的物质的量之比为1:1,但由于醋酸根离子水解,则[Na+]>[CH3COO-],故D错误;
故选A.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查盐类水解的应用,明确酸碱混合后的溶液中的溶质是解答的关键,然后利用“有弱才水解、谁强显谁性”的水解规律即可解答.1年前查看全部
- 0.2摩醋酸和0.1摩NaOH溶液等体积混,则2c(氢离子)-2c(氢氧根离子)=c(醋酸根离子)-c(醋酸)对不对,
 米西米西3111年前4
米西米西3111年前4 -
 孤独的竹 共回答了20个问题
孤独的竹 共回答了20个问题 |采纳率85%电荷守恒:H+ +Na+=OH- +CH3COO-
物料守恒:Na+ =1/2(CH3COOH+CH3COO-)
两式各乘2,合并,则该等式成立1年前查看全部
- 480毫升0.1摩升的硫酸铜溶液 是什么意思
 蓬头垢面劫机1年前4
蓬头垢面劫机1年前4 -
 仙知 共回答了29个问题
仙知 共回答了29个问题 |采纳率96.6%0.1摩升即物质的量浓度为0.1mol/L
480毫升0.1摩升的硫酸铜溶液
意思是有物质的量浓度为0.1mol/L的硫酸铜溶液480毫升1年前查看全部
- 用0.1摩/升的Na 2 SO 3 溶液30毫升,恰好将2×10 -3 摩XO 4 - 离子还原,则元素X在还原产物中的
用0.1摩/升的Na 2 SO 3 溶液30毫升,恰好将2×10 -3 摩XO 4 - 离子还原,则元素X在还原产物中的化合价是 [ ]
A.+1
B.+2
C.+3
D.+4 Emily0104261年前1
Emily0104261年前1 -
 酸奶卡拉 共回答了21个问题
酸奶卡拉 共回答了21个问题 |采纳率95.2%D1年前查看全部
- 已知阿伏加德罗常数近似为6.02×10 23 mol -1 ,下列有关叙述不正确的是( ) A.0.1摩H 2 O和D
已知阿伏加德罗常数近似为6.02×10 23 mol -1 ,下列有关叙述不正确的是( ) A.0.1摩H 2 O和D 2 O组成的混合物中含有的中子数为6.02×10 23 B.0.5 摩1,3-丁二烯分子中含有C=C双键数为6.02×10 23 C.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为
×6.02×10 237 22.4 D.1摩碳正离子(CH 3 + )所含的电子总数为8×6.02×10 23  电影dy558net1年前1
电影dy558net1年前1 -
 蝶影魅舞 共回答了6个问题
蝶影魅舞 共回答了6个问题 |采纳率83.3%A、H 2 O中含有中子数为8×6.02×10 23 ;D 2 O中子数为10×6.02×10 23 ;0.1摩H 2 O和D 2 O组成的混合物中含有的中子数不是6.02×10 23 ,故A错误;
B、1,3-丁二烯分子中含有2个C=C双键,0.5 摩1,3-丁二烯分子中含有C=C双键数为6.02×10 23 ,故B正确;
C、标准状况,庚烷不是气体;1L庚烷物质的量不是
1
22.4 mol,故C错误;
D、1摩碳正离子(CH 3 + )所含的电子总数为8mol,电子数为8×6.02×10 23 ,故D正确;
故选AC.1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 zhb19801年前4
zhb19801年前4 -
 柳散 共回答了24个问题
柳散 共回答了24个问题 |采纳率87.5%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 ase20011年前1
ase20011年前1 -
 傻瓜的傻 共回答了13个问题
傻瓜的傻 共回答了13个问题 |采纳率92.3%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 0.1摩元素X的单质(固体)与氧气完全反应生成氧化物后,质量增加了4克,该氧化物的组成是
0.1摩元素X的单质(固体)与氧气完全反应生成氧化物后,质量增加了4克,该氧化物的组成是
如题 BMW07081年前1
BMW07081年前1 -
 anlin365 共回答了23个问题
anlin365 共回答了23个问题 |采纳率78.3%4克的氧原子有4/16=0.25mol,所以生成了X2O5,所以X应该是P白磷,生成了P2O5(准确的说是P4O10)1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 annzeng0411291年前1
annzeng0411291年前1 -
 gx21986150 共回答了18个问题
gx21986150 共回答了18个问题 |采纳率77.8%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 哈利路亚9981年前3
哈利路亚9981年前3 -
 LVGUANGPIN 共回答了21个问题
LVGUANGPIN 共回答了21个问题 |采纳率81%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 将0.1摩两种气态烃组成的混合气体完全燃烧后得3.36L二氧化碳和3.6g水
将0.1摩两种气态烃组成的混合气体完全燃烧后得3.36L二氧化碳和3.6g水
则 A一定有乙烯、B甲烷、
C一定没有甲烷D乙烷
选什么 5410001年前1
5410001年前1 -
 聽嗨Dě聲 共回答了18个问题
聽嗨Dě聲 共回答了18个问题 |采纳率100%B 0.1摩气体生成0.15摩二氧化碳平均碳原子数为一点五,则混合物中一定有碳原子数比一点五小的,只有甲烷,所以一定有甲烷,选项B正确!1年前查看全部
- 将50毫升0.1摩每升的氯化钡溶液加入到30毫升0.2摩每升的硫酸溶液中,有硫酸钡多少克?
 wvbiad1年前1
wvbiad1年前1 -
 羊二睡醒了1 共回答了28个问题
羊二睡醒了1 共回答了28个问题 |采纳率89.3%氯化钡的物质的量为0.005mol,硫酸的物质的量为0.006mol,两者反应为1:1反应,所以硫酸过量,生成硫酸钡0.005Mol
m=0.005*233=1.165g1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 zhenachu1年前3
zhenachu1年前3 -
 withher 共回答了13个问题
withher 共回答了13个问题 |采纳率100%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 newcaser20001年前3
newcaser20001年前3 -
 xhp99 共回答了22个问题
xhp99 共回答了22个问题 |采纳率81.8%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A.3:2:2
B.1:2:3
C.1:3:3
D.3:1:1 含笑问檀郎1年前1
含笑问檀郎1年前1 -
 yani9231 共回答了18个问题
yani9231 共回答了18个问题 |采纳率88.9%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 资深草根1年前6
资深草根1年前6 -
 whaet035 共回答了22个问题
whaet035 共回答了22个问题 |采纳率81.8%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 已知,往0.1摩每升的氨水中滴入酚酞试剂,溶液将呈粉红色现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅
已知,往0.1摩每升的氨水中滴入酚酞试剂,溶液将呈粉红色现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅
A
滴加稀硫酸B加入氯化铵
C把溶液加热至沸腾D加入NAOH WTA111年前1
WTA111年前1 -
 2007101010 共回答了22个问题
2007101010 共回答了22个问题 |采纳率95.5%D
A和B都是酸性的溶液
C把氨都蒸发掉了1年前查看全部
- 用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀
用10亳升的0.1摩/升BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 cytsjy1年前1
cytsjy1年前1 -
 pgycs 共回答了16个问题
pgycs 共回答了16个问题 |采纳率81.3%解题思路:根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~[1/3]Fe2(SO4)3~ZnSO4~K2SO4,
1 [1/3] 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为[1/3]:1:1=1:3:3,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 朱令的nn1年前1
朱令的nn1年前1 -
 fanjunqi 共回答了21个问题
fanjunqi 共回答了21个问题 |采纳率90.5%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 0.6摩尔硝酸使一定量铁,氧化亚铁,氧化铁,四氧化三铁混合物完全溶解,产生0.1摩一氧化氮,足量氢气
0.6摩尔硝酸使一定量铁,氧化亚铁,氧化铁,四氧化三铁混合物完全溶解,产生0.1摩一氧化氮,足量氢气
与同质量的铁,氧化亚铁,氧化铁,四氧化三铁的混合物反应,生成铁多少摩 381820261年前1
381820261年前1 -
 tl_daekn 共回答了18个问题
tl_daekn 共回答了18个问题 |采纳率100%溶质全部是硝酸铁.溶液中硝酸根离子的物质的量是0.6mol-0.1mol=0.5mol,那么硝酸铁的物质的量是0.5/3mol,那么铁的物质的量就是0.5/3mol=0.167mol.1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 herufu1年前2
herufu1年前2 -
 lovershihan 共回答了18个问题
lovershihan 共回答了18个问题 |采纳率83.3%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 寒江雪11年前1
寒江雪11年前1 -
 摇晃的烛影 共回答了24个问题
摇晃的烛影 共回答了24个问题 |采纳率91.7%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 在某100毫升混合溶液中,硝酸和硫酸的物质的量浓度分别是0.4摩每升和0.1摩每升,向该混合溶液中加入1.92克铜粉,加
在某100毫升混合溶液中,硝酸和硫酸的物质的量浓度分别是0.4摩每升和0.1摩每升,向该混合溶液中加入1.92克铜粉,加热,待充分反应后,所得溶液中的铜离子的物质的量浓度是多少
 圣手丹心1年前1
圣手丹心1年前1 -
 hgbtxz 共回答了21个问题
hgbtxz 共回答了21个问题 |采纳率90.5%该溶液中氢离子有0.04+0.02=0.06mol
3Cu +8 H+ +2 NO3- = 2Cu2+ + 2NO + 4H2O
3 8 2
0.03 0.06 0.04 可知氢离子不足量,铜和硝酸根均过量,所以按照氢离子的量计算
参加反应的铜 为0.06x3/8=0.0225mol 所以铜离子物质的量浓度为0.0225/0.1=0.225mol/L1年前查看全部
- 实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,操作正确的是( )
A. 称取7.68克硫酸铜,加入500毫升水
B. 称取12.0克胆矾配成500毫升溶液
C. 称取8.0克硫酸铜,加入500毫升水
D. 称取12.5克胆矾配成500毫升溶液 可口可靠1年前4
可口可靠1年前4 -
 依剑倾心 共回答了19个问题
依剑倾心 共回答了19个问题 |采纳率100%解题思路:实验室需480毫升0.1摩每升硫酸铜溶液,用500毫升容量瓶进行配制,需要溶质的质量为:硫酸铜:0.5L×0.1mol/L×160g/mol=8.0g,胆矾:0.5L×0.1mol/L×250g/mol=12.5g,注意两个问题:一是溶液的体积按500ml计算,二是溶液的体积不等于水的体积.A、溶液的体积按500ml计算,需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,故A错误;
B、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,故B错误;
C、需要硫酸铜的质量为:0.5L×0.1mol/L×160g/mol=8.0g,但溶液的体积不能与水的体积,应加水至配成500毫升溶液,故C错误;
D、需要胆矾的质量为:0.5L×0.1mol/L×250g/mol=12.5g,加水至配成500毫升溶液,操作正确,故D正确.
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量浓度的相关计算.
考点点评: 本题考查配制一定物质的量浓度的溶液,题目难度不大,本题注意溶液的体积按500ml计算,溶液的体积不等于水的体积.1年前查看全部
- 0.1摩某饱和一元醛完全燃烧生成8.96升的二氧化碳.3.6克醛跟足量银氨溶液反应,生成固体物质的质量是多少
 miaoyulu1年前1
miaoyulu1年前1 -
 落叶作尘伤满怀 共回答了12个问题
落叶作尘伤满怀 共回答了12个问题 |采纳率100%CnH2n+1CHO (n+1) CO2
0.1 mol 0.1(n+1) mol
8.96L 0.4mol
0.1(n+1)=0.4
n=3
C3H7CHO,MW=72
C3H7CHO 2Ag
3.6g 0.05mol 0.1 mol 10.8g1年前查看全部
- 用0.1摩每升氢氧化钠滴定0.1摩每升盐酸,如达到滴定终点时不慎多加一滴氢氧化钠溶液(1滴体积为0.05毫升),
用0.1摩每升氢氧化钠滴定0.1摩每升盐酸,如达到滴定终点时不慎多加一滴氢氧化钠溶液(1滴体积为0.05毫升),
继续加水至50毫升,则所得溶液的PH值是多少? tqxobeewl_71_481年前1
tqxobeewl_71_481年前1 -
 纹荭幛o 共回答了24个问题
纹荭幛o 共回答了24个问题 |采纳率83.3%多加的OH-的物质的量=5*10^-6mol
加水至50毫升:c(OH-)=5*10^-6mol/0.05L=10^-5mol/l
c(H+)=10^-10mol/l
PH=-lgc(H+)=101年前查看全部
大家在问
- 1如何证明abc
- 2英语翻译还是,It will be closed at 4 p.m .
- 3求函数y=(x^2+8)/(x-1)的值域
- 4如果我们可以把空气压缩到一个1立方米的空间里,按照实验室的标准我们把空气压缩到1Mpa打开2平方厘米的阀
- 5这两起事故是同时发生的.(at the same time)翻译
- 6英语翻译这几句话我怎么都翻不好,1 一只甲虫躺在青石上,绝望地空划着细腿.她小心地帮它翻身.2 孩子们猫着腰,端着网,在
- 7想知道:f(x)=x3-3x k,g(x)=(2kx-k)/(x2 2)1/2×2/3×3/4×4/5×…×9
- 8给我些4个字母的单词,意思要积极向上的(例如努力、奋斗、勇敢啊什么的,就是和这些类似的)不要复制.
- 9小屁孩日记 有关职业的、英语
- 10姓名中有(慕染)两个字 、请问这两个字的 含义是什么?
- 11文学常识的题目正确的一项是( )A春秋战国时期的历史散文有《左传》《国语》《孟子》等,诛子散文有《论语》《庄子》《韩非子
- 12Last summer vacation, we ______ many photos when we had a tr
- 13如何优化一日生活,提高保教质量
- 14一栋楼房,一共有120级台阶.如果每上一层楼要走20级台阶.这栋楼房一共有几层?
- 15概率 $P=\frac{3}{9}=\frac{1}{3}$