氯化铍是非极性分子么?它是直线型,应该是对称的啊
 luopo03132022-10-04 11:39:541条回答
luopo03132022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 Google测试员5555 共回答了16个问题
Google测试员5555 共回答了16个问题 |采纳率81.3%- 氯化铍是非极性分子.
Be是4号元素,电子排布为1s(2),2s(2).括号里指上标.另外还有3个空的2p轨道.
BeCl2是sp杂化,直线型分子,同时还有2个两两垂直的空p轨道.
由于有空的p轨道,可以接受外来电子,H2O中的O可以提供孤电子对,因此它可以形成水合物.
关于你说的非极性分子可以溶于极性溶剂(水)的问题,我觉得是否可溶应该看两者的亲和力大,从微观上说,氯化铍分子和水分子应该有一定亲和力,我没有去查相关资料,如果它确实可溶于水的话,这个解释应该可以说得过去吧.
我大三了,以前学的知识都忘得差不多了,大概就这样吧. - 1年前
相关推荐
- 氯化铝和氯化铍的化学键为什么是共价键而不是离子键?
氯化铝和氯化铍的化学键为什么是共价键而不是离子键?
详细!谢谢! 冰冷风风1年前5
冰冷风风1年前5 -
 kazushi1 共回答了18个问题
kazushi1 共回答了18个问题 |采纳率94.4%铝和铍的原子半径比较小,原子核距离最外层电子比较近,它对核外电子的引力比较大,当与氯结合时,氯原子不能完全夺取铝和铍的电子,只能形成共用电子对,即为共价键.1年前查看全部
- 用杂化轨道理论解释为何三氯化磷是三角锥形,且键角为101°,而三氯化铍却是平面三角形的几何构型.
 这答儿忒1年前1
这答儿忒1年前1 -
 忉力天宫 共回答了16个问题
忉力天宫 共回答了16个问题 |采纳率93.8%三氯化磷中磷原子sp3杂化,三个sp3杂化轨道分别与三个氯原子成键,还有一个sp3杂化轨道上有一对孤对电子.如果算上孤对电子,是近似正四面体构型,键角接近正四面体的109.5度.
三氯化铍中铍原子是sp2杂化,三个sp2杂化轨道分别与三个氯原子成键,呈平面正三角型的构型.1年前查看全部
- 已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是 A.铍的原子半径小于硼的原子半径 B.氯化铍分子中铍
已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是
A.铍的原子半径小于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8 C.氢氧化铍的碱性比氢氧化钙弱 D.单质铍易跟冷水反应产生氢气  sharp0011年前1
sharp0011年前1 -
 fangjiannan 共回答了20个问题
fangjiannan 共回答了20个问题 |采纳率100%C
1年前查看全部
- 氯化铍是共价化合物,熔融不导电,为什么能电解制出铍?而状况相似的氯化铝,为什么又不可以电解制铝?
 name_forlove1年前1
name_forlove1年前1 -
 tkbyqlgq 共回答了15个问题
tkbyqlgq 共回答了15个问题 |采纳率86.7%氯化铝也不是绝对不可以电解制取,但现有的电解氧化铝工艺成熟,而且成本也低,自然没有必要用电解法.但Be的制取比较难,工艺复杂,况且也不是直接将氯化铍进行电解的,而使要和纯NaCl混合电解,这样可以增大离子的浓度,有助于产生单质Be.1年前查看全部
- 求氯化铍分子的成键电子对数和孤对电子数
 cttynqy1年前1
cttynqy1年前1 -
 zhengke1020 共回答了16个问题
zhengke1020 共回答了16个问题 |采纳率87.5%氯化铍分子是电子八偶规则的一个例外.
Cl-Be-Cl 为线性分子,中心原子Be含两对成键点子,不含孤对电子.1年前查看全部
- 已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是( ) A.铍的原子半径大于硼的原子半径 B.氯化铍
已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是( ) A.铍的原子半径大于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8 C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气  冬洋之花1年前1
冬洋之花1年前1 -
 DojuceHoo 共回答了16个问题
DojuceHoo 共回答了16个问题 |采纳率100%A、同一周期,从左到右,元素原子半径逐渐减小,所以铍的原子半径大于硼的原子半径故,故A正确;
B、铍(Be)的外层电子数为4,BeCl 2 分子中铍原子的最外层电子数是4,故B错误;
C、同一主族,从上到下,元素的金属性逐渐增强,所以钙的金属性强于铍,氢氧化的碱性比钙氢氧化铍的强,故C正确;
C、同一主族,从上到下,元素的金属性逐渐增强,所以镁的金属性强于铍,而镁与冷水不反应,所以铍跟冷水不反应,故D错误;
故选:AC.1年前查看全部
- 氯化铍中铍原子的最外层有几个电子?
氯化铍中铍原子的最外层有几个电子?
它的电子式如何书写? ereera11年前3
ereera11年前3 -
 懿尘 共回答了16个问题
懿尘 共回答了16个问题 |采纳率100%楼上两位不要瞎扯
BeCl2是共价化合物,1楼图完全不对,2楼更是瞎扯
Cl:Be:Cl
其他电子略去
所以是4个电子1年前查看全部
- (2011•漳州一模)氯化铍是用于制有机铍化合物和金属铍的重要原料.
(2011•漳州一模)氯化铍是用于制有机铍化合物和金属铍的重要原料.
(1)Be原子的基态价电子排布式为______,其元素的第一电离能______B元素(填“>”或“<”或“=”),原因是______.
(2)已知BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为______; BeCl2中Be原子的杂化轨道类型是______.
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,则该阴离子内存在的微粒间的作用力是______,阴离子的结构式为______. breeze1151年前1
breeze1151年前1 -
 小蚊子爱睡觉 共回答了25个问题
小蚊子爱睡觉 共回答了25个问题 |采纳率100%解题思路:(1)根据核外电子排布规律书写Be原子的基态价电子排布式;Be的2s轨道为全充满稳定状态.
(2)根据晶体的性质判断晶体类型;BeCl2中Be原子的杂化轨道数为2.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构.(1)Be原子的电子排布式为1s22s2,Be原子的基态价电子排布式为2s2.Be的2s轨道为全充满,稳定状态,体系能量低,第一电离能高于同周期相邻元素.
故答案为:2s2;>;Be的2s轨道全充满,体系能量低.
(2)BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为分子晶体;BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取 sp 杂化方式.
故答案为:分子晶体; sp.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为.
故答案为:共价键、配位键;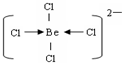 .
.点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用;化学键;晶体的类型与物质熔点、硬度、导电性等的关系;原子轨道杂化方式及杂化类型判断.
考点点评: 考查核外电子排布规律、元素周期律、晶体结构与化学键等,难度不大,注意基础知识的掌握.1年前查看全部
- Becl2(二氯化铍)是共价化合物吗?
 我有人六1年前5
我有人六1年前5 -
 schied 共回答了27个问题
schied 共回答了27个问题 |采纳率66.7%是的.不是所有的金属和非金属组成的化合物都是离子化合物,而且,我可以说,大部分都是共价化合物.但高中时接触的金属和非金属组成的化合物几乎都是离子化合物.AgI,AlCl3,HgCl21年前查看全部
- 偏铍酸钠溶液蒸干后再灼烧可得氧化铍吗 氯化铍溶液显酸性蒸干可得氢氧化铍
 法式烘培1年前3
法式烘培1年前3 -
 lzx430 共回答了24个问题
lzx430 共回答了24个问题 |采纳率100%偏铍酸钠溶液蒸干后再灼烧得不到氧化铍,因为铍的钠盐稳定性很高,就算达到沸点也不会分解.
而氯化铍溶液则不一样,因为在蒸发过程中就发生水解,生成挥发性HCl并同时生成氢氧化铍,灼烧后会得到氧化铍.
BeCl2 + 2H2O = Be(OH)2 + 2HCl
Be(OH)2 = BeO + H2O1年前查看全部
- 氯化铍的电子式是什么?氯化铍分子中铍原子的最外层电子数是多少?
氯化铍的电子式是什么?氯化铍分子中铍原子的最外层电子数是多少?
前面的图尽可能画吧!答案是铍原子的最外层电子数是4,为什么不是2呢? 斗兽棋1年前1
斗兽棋1年前1 -
 mikejack 共回答了20个问题
mikejack 共回答了20个问题 |采纳率70%铍原子最外层电子自然是2个,可是这是化合物.共价化合物中存在共价键,共价键的本质是共用电子对.两个氯原子要达到稳定结构均需要一个电子,与铍分别提供一个电子与对方共用,即分别与铍原子共用一对电子,这样,氯原子本身七个,由于共用一对,多了一个,成为八电子结构;铍原子本来两个电子,由于共用了两对,成为四个.
Cl:Be:Cl1年前查看全部
- 氯化锂和氯化铍是共价化合物还是离子化合物?
 拿什么和你计较1年前3
拿什么和你计较1年前3 -
 fairlyblue 共回答了21个问题
fairlyblue 共回答了21个问题 |采纳率100%一楼没文化楼主不要听他乱讲!前者为离子化合物;后者为共价化合物!氯化镁是离子化合物,氯化铝为共价化合物.氯化铝和氯化铍是特殊的含有金属元素的共价化合物,高中就只需要记住这两个1年前查看全部
- NH4NO3为什么不是共价化合物,氯化铍为什么是共价化合物?
 yinger0091年前1
yinger0091年前1 -
 karenbest 共回答了18个问题
karenbest 共回答了18个问题 |采纳率83.3%NH4NO3是离子化合物 主要取决于共享电子的方式1年前查看全部
- 氢氧化铍与氢氧化镁可用什么鉴别?氯化铍是什么化合物?
 woshisba1年前1
woshisba1年前1 -
 fotbbb 共回答了14个问题
fotbbb 共回答了14个问题 |采纳率100%加NaOH溶液可以,氢氧化铍会溶解,氢氧化镁不溶解.
BeCl2是共价化合物,直线型分子,sp杂化.1年前查看全部
- 证明氯化铍是共价化合物的简单实验
 showtime2002_31年前2
showtime2002_31年前2 -
 蒙得儿虎 共回答了16个问题
蒙得儿虎 共回答了16个问题 |采纳率100%将氯化铍加热至熔融状态,不能导电
解析:
共价化合物中不含离子,而离子化合物中含有离子,氯化铍类似于氯化铝,通熔融状态下能否导电,确定是否是共价化合物.注意:不能根据其水溶液能否导电判断是否是离子化合物,因为有些共价化合物也导电.1年前查看全部
- 氯化铍是共价化合物还是离子化合物,为什么?
 aazuiaa1年前1
aazuiaa1年前1 -
 平淡阿若 共回答了18个问题
平淡阿若 共回答了18个问题 |采纳率94.4%将氯化铍加热至熔融状态,不能导电 解析:共价化合物中不含离子,而离子化合物中含有离子,氯化铍类似于氯化铝,通熔融状态下能否导电,确定是否是共价化合物.注意:不能根据其水溶液能否导电判断是否是离子化合物,因为有些共价化合物也导电.1年前查看全部
- 氯化铍分子中铍原子的最外层电子数是多少?
 rayray1年前1
rayray1年前1 -
 楼猪的FM还是猪 共回答了19个问题
楼猪的FM还是猪 共回答了19个问题 |采纳率94.7%是2
氯原来最外层是7个电子,易得到电子.铍原来最外层是4个电子,易失去电子.因为铍的电子层是2-2,所以去掉2就只有2了1年前查看全部
- 二氯化铍是什么化合物
 孤风逸行1年前1
孤风逸行1年前1 -
 娃哈哈dkhc 共回答了18个问题
娃哈哈dkhc 共回答了18个问题 |采纳率100%分子1年前查看全部
- 氯化铍的杂化类型?用对到杂化理论解释
 wangyuyang1年前3
wangyuyang1年前3 -
 ripewzw0514 共回答了13个问题
ripewzw0514 共回答了13个问题 |采纳率84.6%楼上不要刷分了
BeCl2中Be是sp杂化,分子是直线型1年前查看全部
- 二氯化铍的大π键是怎样的为什么是两个三中心四电子
 anglelife1年前1
anglelife1年前1 -
 jiaqiumin 共回答了20个问题
jiaqiumin 共回答了20个问题 |采纳率100%铍的价组态是2s2,激发一个电子到2p轨道,再sp杂化,分别和氯的一个3p(有单电子)成两个σ键,Be剩余两个空的2p轨道分别和两侧的Cl到两个有成对电子的3p轨道平行,可以成大∏键.Be提供空轨道,Cl提供电子,形成两方向(都与σ键垂直)到三中心四电子的大∏键.1年前查看全部
- 氯化铍在离子方程式中拆不拆
 爱流浪王子1年前1
爱流浪王子1年前1 -
 莳苓蔬菜 共回答了9个问题
莳苓蔬菜 共回答了9个问题 |采纳率88.9%喂喂,楼上的,是共价化合物就不拆啊?照你这么说HCl,H2SO4,AlCl3……都不拆啰?化合物是否共价,和它在水中是否电离是没有必然联系的.依据对角线规则,铍的化合物与铝的化合物性质相近,故氯化铍和氯化铝性质相近,氯化铝在水中电离,氯化铍在水中也电离,所以是要拆的!1年前查看全部
- 铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
A. 溶于水加硝酸银溶液,观察是否有白色沉淀生成
B. 溶于水做导电实验,观察是否导电
C. 熔融状态,做导电实验,观察是否导电
D. 测定氯化铍熔点 泡菜拉面1年前1
泡菜拉面1年前1 -
 杨翀 共回答了19个问题
杨翀 共回答了19个问题 |采纳率100%解题思路:共价化合物与离子化合物的区别是:在熔融状态下,离子化合物能导电,而共价化合物不导电,以此解答该题.A.无论是共价化合物还是离子化合物,溶液中加入硝酸银溶液,都可观察到有白色沉淀生成,故A错误;
B.无论是共价化合物还是离子化合物,只要是电解质,则水溶液都能导电,不能证明,故B错误;
C.在熔融状态下,离子化合物能导电,而共价化合物不导电,故C正确;
D.测定熔点不能确定是共价键还是离子键,如原子晶体以及离子晶体,熔点都很高,不能证明,故D错误.
故选C.点评:
本题考点: 共价键的形成及共价键的主要类型.
考点点评: 本题考查共价键以及主要类型,为高频考点,侧重于基本概念的理解和运用的考查,主要把握共价键的分类以及与离子键的区别,主要相关基础知识的积累,难度不大.1年前查看全部
大家在问
- 1惟列爵而不临民,
- 2为什么计算利率的时候,总是年利率除以12,再除以30,怎么不除以31?
- 3写四字成语和ABC的谢谢啦
- 4若一个三角形的3个外角的度数之比为2:3:4,则与之相应的3个内角的度数之比为 [ &
- 5He is finding his new work far more exciting.
- 6张师傅开车从甲地开往乙地后立即反悔甲地,共用去20小时,一直往返所用时间的比是3:2
- 7(2012•建阳市模拟)动物细胞中有叶绿体______(判断对错)
- 8军机处是何时建立的,有哪些人
- 9To my s---,the man passed the driving test
- 10已知sin(π/4-a)sin(π/4+a)=六分之根号二(0
- 11某工程由甲、乙两工程队合作,则12天可以完成,已知乙工程队单独完成这项工程所需时间是甲工程队单独完成所需时间的2倍.求甲
- 12需求曲线是保留价格和需求量的曲线还是市场价格和需求量的曲线啊?
- 13平方11父亲现在45岁,儿子现在15岁,当父亲的年龄是儿子年龄的11倍时,父子年龄和应是多少?
- 14sin15度23分 等于多少
- 15113.5mm,57.1mm,12.7mm各换cm
