在铬酸钾中加入硫酸溶液的颜色有什么变化?再加入双氧水,加热后溶液什么颜色?顺便写下化学方程式...
 rain952022-10-04 11:39:542条回答
rain952022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 jums271158 共回答了19个问题
jums271158 共回答了19个问题 |采纳率100%- 加入硫酸溶液是提供溶液的酸性,此时以K2Cr2O7形式存在,颜色由黄色变成橙红色:
2CrO4 2- + 2 H+ = Cr2O7 2- + H2O
K2Cr2O7再与双氧水发生氧化还原反应产生Cr3+,颜色变成灰绿色:
Cr2O7 2- + 8H+ + 3H2O2 = 2Cr 3+ + 7H2O + 3O2 - 1年前
 050403 共回答了1个问题
050403 共回答了1个问题 |采纳率- 加入硫酸溶液是提供溶液的酸性,此时以K2Cr2O7形式存在,颜色由黄色变成橙红色:
2CrO4 2- + 2 H+ = Cr2O7 2- + H2O
K2Cr2O7再与双氧水发生氧化还原反应产生Cr3+,颜色变成灰绿色:
Cr2O7 2- + 8H+ + 3H2O2 = 2Cr 3+ + 7H2O + 3O2 - 1年前
相关推荐
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图:
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图: 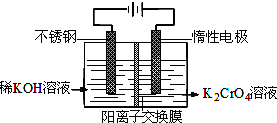
下列说法不正确的是( )A.在阴极区,发生的电极反应为:2H 2 O+2e - ═2OH - +H 2 ↑ B.在阳极区,通电后溶液逐渐由黄色变为橙色,是因为阳极区H + 浓度增大,使平衡2 C r
+2H + ═ C r 2O -4
+H 2 O向右移动O 2-7 C.该制备过程总反应的化学方程式为:4K 2 CrO 4 +4H 2 O
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+2O 2 ↑通电 . D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α= d 2  水间梦1年前1
水间梦1年前1 -
 aaron444 共回答了16个问题
aaron444 共回答了16个问题 |采纳率93.8%A、根据题意可知:电极均为惰性电极,在阴极室,水得电子变成氢气,电极反应为:2H 2 O+2e - =2OH - +H 2 ↑,故A正确;
B、阳极室水失去电子,电极反应为:2H 2 O-4e - =4H + +O 2 ↑,使阳极区氢离子浓度增大,平衡右移,故B正确;
C、总制备方程式为4K 2 CrO 4 +4H 2 O
电解
.
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+O 2 ↑,故C正确;
D、设加入反应容器内的K 2 CrO 4 为1mol,反应过程中有xmol K 2 CrO 4 转化为K 2 Cr 2 O 4 ,则阳极区剩余K 2 CrO 4 为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K 2 Cr 2 O 4 为
x
2 mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,解得x=2-d,转化率为
2-d
1 ×100% =2=d,故D错误;
故选D.1年前查看全部
- 沉淀滴定法中,用莫尔法测氯离子时,如何通过计算证明PH值最小为6.5,滴定用到的指示剂是铬酸钾,
沉淀滴定法中,用莫尔法测氯离子时,如何通过计算证明PH值最小为6.5,滴定用到的指示剂是铬酸钾,
考虑到铬酸银能溶于弱酸, marco20061年前1
marco20061年前1 -
 hnzhangsonghe 共回答了20个问题
hnzhangsonghe 共回答了20个问题 |采纳率95%1年前查看全部
- 采用铬酸钾指示剂法测定氯化钡样品是否可行?为什么?
 leion811年前2
leion811年前2 -
 liusiyang0922 共回答了20个问题
liusiyang0922 共回答了20个问题 |采纳率85%可行!
原理:铬酸钾做指示剂,硝酸银标准容易可以直接滴定测量氯离子含量
滴定反应:Ag+ +Cl- ——AgCl沉淀
指示剂终点反应:2Ag+ +(CrO4)2-——Ag2CrO4沉淀 砖红色
滴定开始,氯离子量大,银离子优先和氯离子反应,反应终点时,氯离子消耗到极小量,银离子开始和铬酸钾反应,生成砖红色沉淀,指示终点
条件:铬酸钾量要合适,过大或者或小会导致终点提前或延后1年前查看全部
- (2013•郑州一模)重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电
(2013•郑州一模)重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过).制备原理:2CrO42一(黄色)+2H+⇌Cr2O72一(橙色)+H2O.

(1)通电后阳极室产生的现象为______;其电极反应式是______.
(2)该制备过程总反应的离子方程式可表示为4CrO42一+4H2O
2Cr2O72一+4OH一+2H2↑+O2↑,若实验开始时在右室中加入38.8g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为______;此时电路中转移电子的物质的量为______.通电 . 爱管事的杂hh1年前1
爱管事的杂hh1年前1 -
 yuyue924 共回答了13个问题
yuyue924 共回答了13个问题 |采纳率84.6%解题思路:(1)依据电解原理分析,溶液中阴离子放电,氢氧根离子失电子发生氧化反应,氢离子浓度增大平衡正向进行,溶液呈橙色;
(2)依据原子守恒、电子守恒计算;(1)阳极室发生氧化反应,氢氧根离子失去电子放电,电极反应为:4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+,阳极区氢离子浓度增大,平衡右移,溶液由黄色逐渐变为橙色;
故答案为:阳极产生无色气体,溶液由黄色逐渐变为橙色;4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+;
(2)加入反应容器内的K2CrO4为38.8g 物质的量=[38.8g/194g/mol]=0.2mol,反应过程中有xmol K2CrO4转化为K2Cr2O4,则阳极区剩余K2CrO4为(0.2-x)mol,对应的n(K)=2(0.2-x)mol,n(Cr)=(0.2-x)mol,生成的K2Cr2O4为[x/2]mol,对应的n(K)=xmol,n(Cr)=xmol,根据K与Cr的物质的量之比为3:2;
2(0.2−x)+x
0.2−x+x=[3/2],计算得到x=0.1,溶液中K2CrO4和K2Cr2O7的物质的量之比=(0.2-0.1):[0.1/2]=2:1;4CrO42一+4H2O
通电
.
2Cr2O72一+4OH一+2H2↑+O2↑,
反应可知反应4molCrO42一转移电子4mol,所以反应0.1molK2CrO4,电子转移0.1mol;
故答案为:2:1;0.1 mol;点评:
本题考点: 电解原理.
考点点评: 本题考查了电解池原理分析判断,电极原理的计算应用没注意元素守恒是解题关键,题目难度中等.1年前查看全部
- 脱硫石膏中的氯离子检测中,用AgNO3滴定(+铬酸钾指示剂)中总是出现白色絮状沉淀是为什么,什么物质?
脱硫石膏中的氯离子检测中,用AgNO3滴定(+铬酸钾指示剂)中总是出现白色絮状沉淀是为什么,什么物质?
脱硫石膏溶于水后取上层清液加入双氧水想把SO3氧化成SO4,再加入Ca(OH)2想用来沉淀硫酸根, zxxgf1年前1
zxxgf1年前1 -
 cyyzaaaa 共回答了17个问题
cyyzaaaa 共回答了17个问题 |采纳率76.5%1.不就是氯化银吗?
2.不可行.硫酸钙仅微溶于水,不能将硫酸根全部沉淀.应该用BaCl2.1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是
A.在阴极式,发生的电极反应为:2H 2 O+2e -  2OH ― +H 2 ↑
2OH ― +H 2 ↑B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H + 浓度增大,使平衡2 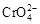 +2H +
+2H + 
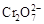 +H 2 O向右移动
+H 2 O向右移动C.该制备过程总反应的化学方程式为:4K 2 CrO 4 +4H 2 O  2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+2O 2 ↑
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+2O 2 ↑D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α= 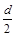
 z1010l1年前1
z1010l1年前1 -
 zz894286 共回答了22个问题
zz894286 共回答了22个问题 |采纳率86.4%D 本题是电解法在制备物质中的具体应用。分析该制备时,重点要把握其中的K 2 CrO 4 在转变为K 2 Cr 2 O 7 的过程中没有发生化合价的变化,所以要抓住是由于溶液的pH变化实现目标物的合成,制备的过程是...1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
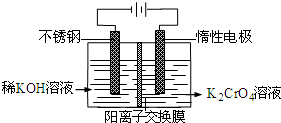 A. 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
A. 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+⇌Cr2O72-+H2O向右移动
C. 该制备过程总反应的化学方程式为:4K2CrO4+4H2O
2K2Cr2O7+4KOH+2H2↑+O2↑通电 .
D. 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-[d/2] zhzhzhlj1年前4
zhzhzhlj1年前4 -
 威廉母猪 共回答了19个问题
威廉母猪 共回答了19个问题 |采纳率84.2%解题思路:A、阴极上得电子发生还原反应,氢离子放电;
B、阳极上水失电子生成氧气和氢离子,氢离子浓度增大导致平衡移动,根据氢离子浓度的变化判断溶液颜色的变化;
C、将阳极室、阴极室发生的反应加合可得总的反应式,注意阴极室还发生反应衡2CrO42-+2H+═Cr2O72-+H2O;
D、根据原子守恒计算其转化率.A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H2O+2e-=2OH-+H2↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区氢离子浓度增大,平衡右移,故B正确;
C、阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,故总制备方程式为4K2CrO4 +4H2O
电解
.
2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为[x/2]mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
2(1−x)+x
1−x+x=d,解得x=2-d,转化率为[2−d/1]×100%=2-d,故D错误;
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,难点是计算转化率,根据原子守恒即可计算其转化率,根据阴阳极上发生的反应类型写出相应的电极反应式.1年前查看全部
- 在测食品的含盐量时,在做实验的过程中需要用到铬酸钾溶液,请问:铬酸钾溶液是怎样配制的?
 cc山庄之羊1年前3
cc山庄之羊1年前3 -
 caesar1104 共回答了16个问题
caesar1104 共回答了16个问题 |采纳率87.5%10%铬酸钾溶液:取100克铬酸钾,加600毫升水溶解,加水至1000毫升,用0.1mol/L硝酸银溶液滴至砖红色,过滤使用.1年前查看全部
- 称0.22g在105℃干燥至恒重的氯化钠加70ml水溶解 用硝酸银滴定,铬酸钾为指示剂,加几滴就变色,怎么回事?
称0.22g在105℃干燥至恒重的氯化钠加70ml水溶解 用硝酸银滴定,铬酸钾为指示剂,加几滴就变色,怎么回事?
硝酸银是17.5g溶解在1L水中配置的(操作完全避光) 硝酸银摩尔浓度是多少?氯化钠是多少摩尔? n5oic1年前1
n5oic1年前1 -
 mmm1217 共回答了24个问题
mmm1217 共回答了24个问题 |采纳率91.7%指示剂的用量.若Cr042-的量过大,会使终点提前,从而使测定结果产生较大的负误差.在实际滴定时,一般在反应液总体积为50~100ml溶液中加入5%K2Cr04指示剂l~2ml即可.1年前查看全部
- 多选题:铬酸钾指示剂法测氯化钠时先生成氯化银白色沉淀,终点时生成铬酸银沉淀原因是().
多选题:铬酸钾指示剂法测氯化钠时先生成氯化银白色沉淀,终点时生成铬酸银沉淀原因是().
A:氯化银溶解度比铬酸银小
B:氯化银溶解度比铬酸银大
C:铬酸银易于观察
D:氯化银的溶度积比铬酸银的溶度积小
选哪几个啊 张古文1年前1
张古文1年前1 -
 njw00 共回答了16个问题
njw00 共回答了16个问题 |采纳率75%AC
这是莫尔法的化学分析方法,主要用于以硝酸银标准溶液直接滴定氯离子(或溴离子)的反应,依据为氯化银(或溴化银)与铬酸银溶解度和颜色的显著差异.
滴定反应 Ag+ + Cl- = AgCl (白色) Ksp=1.8*10-10
指示反应 2Ag+ + CrO4 2- =Ag2CrO4 (砖红色)Ksp=2.0*10-12
氯化银的溶解度小于铬酸银但溶度积比铬酸银的溶度积大.
这很容易计算:
对氯化银而言,其溶解度为S mol/L
则有S*S=1.8*10-10 得出S=1.34*10-5
对铬酸银而言,
S(平方)*S=2*10-12 得出S=1.26*10-41年前查看全部
- (2012•浙江)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
 (2012•浙江)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
(2012•浙江)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+⇌Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O
2K2Cr2O7+4KOH+2H2↑+O2↑通电 .
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-[d/2] yunguiliu1年前1
yunguiliu1年前1 -
 dahailove_13 共回答了14个问题
dahailove_13 共回答了14个问题 |采纳率92.9%解题思路:A、阴极上得电子发生还原反应,氢离子放电;
B、阳极上水失电子生成氧气和氢离子,氢离子浓度增大导致平衡移动,根据氢离子浓度的变化判断溶液颜色的变化;
C、将阳极室、阴极室发生的反应加合可得总的反应式,注意阴极室还发生反应衡2CrO42-+2H+═Cr2O72-+H2O;
D、根据原子守恒计算其转化率.A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H2O+2e-=2OH-+H2↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区氢离子浓度增大,平衡右移,故B正确;
C、阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,故总制备方程式为4K2CrO4 +4H2O
电解
.
2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为[x/2]mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
2(1−x)+x
1−x+x=d,解得x=2-d,转化率为[2−d/1]×100%=2-d,故D错误;
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,难点是计算转化率,根据原子守恒即可计算其转化率,根据阴阳极上发生的反应类型写出相应的电极反应式.1年前查看全部
- 用铬酸钾标定硫代硫酸钠时,为什么需要采用间接碘量法?测定时为什么要用碘量瓶?
 胡虞1年前1
胡虞1年前1 -
 zhanzhonm 共回答了18个问题
zhanzhonm 共回答了18个问题 |采纳率77.8%1、硫代硫酸钠与碘可定量反应,围绕这个反应,人们建立了多种物质的测定方法.硫代硫酸钠与碘的标准溶液都不能直接配制,需要标定.标定硫代硫酸钠的目的是用它来标定碘.到目前为止,还找不到除碘以外能与硫代硫酸钠定量反应的氧化剂.因此,硫代硫酸钠的标定依然利用与碘的定量反应,而这个碘量必须确定,人们利用重铬酸钾(为基准物质,可直接配置为标准溶液)在酸性条件下放置一定时间(彼此不能快速反应,也不能用滴定法)可将碘化钾的碘离子定量氧化为碘的反应,加入过量碘化钾,释放出与重铬酸钾相当的碘.由这个碘是在锥形瓶里,况且体积、浓度不定(物质的量一定),只能用硫代硫酸钠来滴定(碘)了(间接碘量法,也叫滴定碘法).
2、碘分子易挥发,在放置反应过程中碘瓶可处于密封状态,可减少测定误差.1年前查看全部
- 我现在又铬酸钾,如何用铬酸钾配制重铬酸钾?
我现在又铬酸钾,如何用铬酸钾配制重铬酸钾?
若是否给出具体的试验过程,我就十分满意了。就这个答案已经是很好的了。 fenfei1231年前1
fenfei1231年前1 -
 winwhy 共回答了14个问题
winwhy 共回答了14个问题 |采纳率100%提高酸度就可以了,加入酸,CrO4 - + 2H+ ==(可逆)Cr2O7 2- + H2O
平衡会右移
恩具体的过程就是把铬酸钾溶于水,然后向其中加入硫酸(不能加盐酸),如果看到溶液变为橙红色那么溶液含有的就是重铬酸钾了1年前查看全部
- 准确称取氯化钠样品1.000g,溶于水后,加入铬酸钾指示剂,用0.100mol/L的硝酸银标准溶液滴定,终点时消硝酸银溶
准确称取氯化钠样品1.000g,溶于水后,加入铬酸钾指示剂,用0.100mol/L的硝酸银标准溶液滴定,终点时消硝酸银溶化19.60ml,计算氯化钠样品的含量
 tirlon1年前2
tirlon1年前2 -
 white1504 共回答了19个问题
white1504 共回答了19个问题 |采纳率100%属于沉定滴定~1年前查看全部
- 在铬酸钾中加入硫酸溶液的颜色有什么变化?再加入双氧水,加热后溶液什么颜色?顺便写下化学方程式.
 chaos881年前1
chaos881年前1 -
 zzzhhhwww222 共回答了24个问题
zzzhhhwww222 共回答了24个问题 |采纳率95.8%加入硫酸后溶液变成橙红色,这是由于生成了重铬酸钾的原故
2K2CrO4+H2SO4 =K2CrO7+K2SO4 +H2O
铬酸钾加热变成红色,冷却后又重新变为黄色1年前查看全部
- 先判断对错,然后讲为什么 探究酵母菌呼吸方式时,不能用澄清的石灰水来检测CO2的产生,但可以用冲铬酸钾来
 woundedbell1年前1
woundedbell1年前1 -
 我不是白莲 共回答了15个问题
我不是白莲 共回答了15个问题 |采纳率93.3%探究酵母菌呼吸方式时,酵母菌可以进行有氧呼吸也可以进行无氧呼吸,有氧和无氧都产生二氧化碳,但是无氧呼吸产生酒精,当重铬酸钾遇酒精是会变成灰绿色1年前查看全部
- 称取某一食品样品4.000g,用铬酸钾作指示剂,用去0.1028mol/L硝酸银10.10mL,求该食品中氯化钠的质量分
称取某一食品样品4.000g,用铬酸钾作指示剂,用去0.1028mol/L硝酸银10.10mL,求该食品中氯化钠的质量分数
最好具体点
 峰林佳树1年前1
峰林佳树1年前1 -
 wenshengmin 共回答了19个问题
wenshengmin 共回答了19个问题 |采纳率84.2%1.518%,0.00101*1028=0.00103828g为生成氯化银的量,即为原样中氯化钠的量1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( ) A.在阴极式,发生的电极反应为:2
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( ) A.在阴极式,发生的电极反应为:2H 2 O+2e - =2OH - +H 2 ↑ B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H + 浓度增大,使平衡2CrO 4 2- +2H + ⇌Cr 2 O 7 2- +H 2 O向右移动 C.该制备过程总反应的化学方程式为:4K 2 CrO 4 +4H 2 O
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+O 2 ↑通电 . D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1- d 2 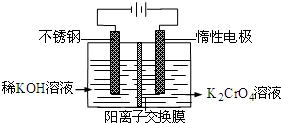
 怡萦1年前1
怡萦1年前1 -
 songyuezhu 共回答了20个问题
songyuezhu 共回答了20个问题 |采纳率90%A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H 2 O+2e - =2OH - +H 2 ↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H 2 O-4e - =4H + +O 2 ↑,阳极区氢离子浓度增大,平衡右移,故B正确;
C、阳极电极反应为:4H 2 O+4e - =4OH - +2H 2 ↑,阳极反应为:2H 2 O-4e - =4H + +O 2 ↑,4CrO 4 2- +4H + ═2Cr 2 O 7 2- +2H 2 O,故总制备方程式为4K 2 CrO 4 +4H 2 O
电解
.
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+O 2 ↑,故C正确;
D、设加入反应容器内的K 2 CrO 4 为1mol,反应过程中有xmol K 2 CrO 4 转化为K 2 Cr 2 O 4 ,则阳极区剩余K 2 CrO 4 为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K 2 Cr 2 O 4 为
x
2 mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
2(1-x)+x
1-x+x =d ,解得x=2-d,转化率为
2-d
1 ×100%=2-d,故D错误;
故选D.1年前查看全部
- 在BaCl2和CaCl2水溶液中分别加入碳酸铵,接着加入乙酸再加入铬酸钾的化学反应方程式是什么?
 草莓的棉花糖1年前1
草莓的棉花糖1年前1 -
 黄武凤 共回答了20个问题
黄武凤 共回答了20个问题 |采纳率95%CaCl2+(NH4)2CO3→CaCO3↓+2NH4Cl
BaCl2+(NH4)2CO3→BaCO3↓+2NH4Cl
CaCO3+2HAc→Ca(Ac)2+H2O+CO2↑
BaCO3+2HAc→Ba(Ac)2+H2O+CO2↑
Ca(Ac)2+K2CrO4→CaCrO4(微溶)+2KAc
Ba(Ac)2+K2CrO4→BaCrO4↓+2KAc1年前查看全部
- 做酸锌里的氯化钾分析,用硝酸银滴定,铬酸钾指示剂,取0.5mL待测液,有时滴定个两三次次结果都不一样,是
做酸锌里的氯化钾分析,用硝酸银滴定,铬酸钾指示剂,取0.5mL待测液,有时滴定个两三次次结果都不一样,是
是怎么回事? 晴天宝贝儿1年前1
晴天宝贝儿1年前1 -
 宙斯ZEUS 共回答了15个问题
宙斯ZEUS 共回答了15个问题 |采纳率80%建议你换用离子选择电极法测试,因为“沉淀滴定法”终点变化不敏锐,操作要求极为苛刻,难以应用于日常测试.1年前查看全部
- 有纯的氯化钠和溴化钠混合物0.3096g,溶解后,以铬酸钾作指示剂,用0.1137mol/L硝酸银滴定液滴定至终点...
有纯的氯化钠和溴化钠混合物0.3096g,溶解后,以铬酸钾作指示剂,用0.1137mol/L硝酸银滴定液滴定至终点...
有纯的氯化钠和溴化钠混合物0.3096g,溶解后,以铬酸钾作指示剂,用0.1137mol/L硝酸银滴定液滴定至终点,用去30.78ml,计算样品中氯化钠和溴化钠的含量. yu1127271年前1
yu1127271年前1 -
 sgxh2006 共回答了18个问题
sgxh2006 共回答了18个问题 |采纳率94.4%硝酸银消耗量:30.78*0.1137/1000=0.0035mol
即混合物氯离子与溴离子共0.0035mol
设氯化钠含量x,氯化钠中氯的质量比:35.5/(23+35.5)溴化钠中溴质量比:80/(23+80)
根据混合物0.3096g,可得
0.3096×x×35.5/(23+35.5)/35.5+0.3096×(1-x)×80/(23+80)/80=0.0035
x=21.6%
氯化钠为21.6%溴化钠为1-21.6%=78.4%1年前查看全部
- 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K 2 CrO 4 )为原料,采用电化学法制备重铬
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K 2 CrO 4 )为原料,采用电化学法制备重铬酸钾(K 2 Cr 2 O 7 )。制备装置如下图所示(阳离子交换膜只允许阳离子透过):

制备原理:2CrO 4 2- (黄色)+2H + Cr 2 O 7 2- (橙色)+H 2 O
Cr 2 O 7 2- (橙色)+H 2 O
(1)通电后阳极室产生的现象为 ,其电极反应式是 。
(2)该制备过程总反应的离子方程式可表示为4CrO 4 2- +4H 2 O="2" Cr 2 O 7 2- + 4OH - +2H 2 ↑+O 2 ↑,若实验开始时在右室中加入38.8g K 2 CrO 4 ,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K 2 CrO 4 和K 2 Cr 2 O 7 的物质的量之比为 ;此时电路中转移电子的物质的量为 。 光棍1号1年前1
光棍1号1年前1 -
 yfh99 共回答了15个问题
yfh99 共回答了15个问题 |采纳率80%(每空2分,共8分)
(1)阳极产生无色气体,溶液由黄色逐渐变为橙色;
4OH - -4e - =O 2 ↑+2H 2 O 或2H 2 O-4e - =O 2 ↑+4H +
(2)2:1 ; 0.1 mol
1年前查看全部
- 称取含铁式样0.31g,溶于酸,并把铁全部还原为Fe(2+),用0.02000mol/L纯铬酸钾溶液滴定,用去21.00
称取含铁式样0.31g,溶于酸,并把铁全部还原为Fe(2+),用0.02000mol/L纯铬酸钾溶液滴定,用去21.00ml,计算式样中Fe2O3的质量分数
 wenxinlan1年前1
wenxinlan1年前1 -
 mazhjn 共回答了15个问题
mazhjn 共回答了15个问题 |采纳率100%重铬酸钾的物质的量=0.02000mol/L*0.021L=4.2*10^-4mol
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
1 6
4.2*10^-4mol X
X=2.52**10^-3mol
式样中Fe2O3的物质的量=1/2n(Fe^2+)=1/2*2.52*10^-3mol =1.26*10^-3mol
式样中Fe2O3的质量=1.26*10^-3mol *160g/mol=0.2016g
式样中Fe2O3的质量分数=0.2016g/0.31g*100%=65.03%1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾…求方程式
以铬酸钾为原料,电化学法制备重铬酸钾…求方程式
阳极的材料是不绣钢,阴是惰性电极…中间有离子交换模,左边是KOH.右边是k2cro4溶液.求阴极室的电极反应室 梦幻失落1年前1
梦幻失落1年前1 -
 3lrfkhq 共回答了17个问题
3lrfkhq 共回答了17个问题 |采纳率82.4%2K2CrO4 + 2H+ = K2Cr2O7 + H2O
从铬酸钾制备重铬酸钾,氧化态没有变化,只是需要外界酸碱度的变化.没有弄明白题目到底想做什么.不需要什么电化学法啊.1年前查看全部
- 铬酸银为什么在硝酸银中的溶解度大于在铬酸钾中的溶解度
 轻轻飘扬1年前1
轻轻飘扬1年前1 -
 给我时间八 共回答了18个问题
给我时间八 共回答了18个问题 |采纳率83.3%题目有问题吧,应该是铬酸银在硝酸银中的溶解度小于在与硝酸银浓度相同铬酸钾中的溶解度.
铬酸银的沉淀溶解平衡:Ag2CrO4 ⇋ 2Ag+ + CrO42- Ksp=[Ag+]^2*[CrO42-]
若硝酸银与铬酸钾浓度相同,均为amol/L.
1.设铬酸银在硝酸银中溶解度为x,溶液中Ag+来自两部分:溶解的铬酸银和硝酸银;CrO42-全部来自溶解的铬酸银.
Ag2CrO4 ⇋ 2Ag+ + CrO42-
2x+a x
Ksp=[Ag+]^2*[CrO42-]=( 2x+a)^2*x (1)
2.设铬酸银在铬酸钾中溶解度为y,溶液中CrO42-来自两部分:溶解的铬酸银和铬酸钾;Ag+全部来自溶解的铬酸银.
Ag2CrO4 ⇋ 2Ag+ + CrO42-
2y y+a
Ksp=[Ag+]^2*[CrO42-]=( 2y)^2*(y+a) (2)
铬酸银的溶度积(Ksp)只与温度有关,温度不变,Ksp不变,所以在硝酸银和铬酸钾中Ksp相同,即(1)=(2).所以( 2x+a)^2*x=(2y)^2*(y+a),展开得4x^3+4ax^2+a^2x=4y^3+4ay^2 ,
显然x0,左边比右边多了一项).
因此在硝酸银中溶解度小于在铬酸钾中溶解度.1年前查看全部
- 环己酮的制备制备环己酮时,在加重铬酸钾溶液过程中,为什么要待反应物的橙红色完全消失后,方能加入下一批重铬酸钾?用铬酸氧化
环己酮的制备
制备环己酮时,在加重铬酸钾溶液过程中,为什么要待反应物的橙红色完全消失后,方能加入下一批重铬酸钾?用铬酸氧化法制备环己酮的实验,为什么要严格控制反应温度在55~60之间,温度过高或过低有什么不好? 臧晓磊1年前1
臧晓磊1年前1 -
 天空半爱 共回答了14个问题
天空半爱 共回答了14个问题 |采纳率100%是用重铬酸钾氧化环己醇么?重铬酸钾的氧化性比较强,如果一次加入很大量的话,会将环己醇氧化到环己酮,再继续氧化开环生成己二酸,所以加入重铬酸钾时要分批加入,防止过度氧化.而橙红色消失就是重铬酸钾反应完全的标志.
铬酸氧化法也是类似的,在温度过高的时候也会把环己酮氧化成己二酸,所以温度不能过高.而温度过低的话,反应又难以进行.另外环己醇的熔点只有25度,温度过低会使得环己醇凝固(其实应该不至于低到如此地步……)1年前查看全部
- 2准确移取氯化钠溶液20.00ml,加入铬酸钾指示剂,用0.1000mol/L的硝酸银标准溶液滴定,终点时消耗硝酸银溶液
2准确移取氯化钠溶液20.00ml,加入铬酸钾指示剂,用0.1000mol/L的硝酸银标准溶液滴定,终点时消耗硝酸银溶液25.00ml,计算氯化钠的物质的量浓度及其量浓度.
 语美人1年前1
语美人1年前1 -
 葵葵巫 共回答了20个问题
葵葵巫 共回答了20个问题 |采纳率90%根据反应方程式:
NaCl+AgNO3=AgCl(沉淀)+NaNO3
反应的NaCl和AgNO3的物质的量相等,因此:
氯化钠的物质的量浓度=0.1000*25.00/20.00=0.1250mol/L1年前查看全部
- 向氯化钠和铬酸钾混合溶液中加硝酸银是什么现象,原因是什么
 eyeforcampus1年前1
eyeforcampus1年前1 -
 lyzcz 共回答了17个问题
lyzcz 共回答了17个问题 |采纳率94.1%现象是现有白色沉淀生成然后有砖红色沉淀生成,原因是加入硝酸银时因氯化银的溶度积比铬酸银的溶度积小 由溶度积规则判定生成氯化银所需要的银离子浓度小 随着银离子浓度增大逐渐有铬酸银生成.1年前查看全部
- 为什么莫尔法测定NaCl时要使用铬酸钾作指示剂?
 卜尸1年前1
卜尸1年前1 -
 干什么为什么 共回答了20个问题
干什么为什么 共回答了20个问题 |采纳率100%因为滴定NaCl的滴定剂是AgNO3
AgCl的Ksp1年前查看全部
- 铬酸钾1g=?mol/L 硝酸银?%如何换算成mol/L
 爱君的小石头1年前1
爱君的小石头1年前1 -
 doosh 共回答了11个问题
doosh 共回答了11个问题 |采纳率81.8%先要知道化合物的相对分子质量M.
由质量m.
N=M/m.
不过mol/L是溶液的浓度.这个你的给出条件
同理.1年前查看全部
- 氯离子滴定,加入铬酸钾后,用硝酸银滴定,终点要求是出现砖红色沉淀.这个现象究竟是怎么个过程?
氯离子滴定,加入铬酸钾后,用硝酸银滴定,终点要求是出现砖红色沉淀.这个现象究竟是怎么个过程?
我的样品氯离子很少,不好观测、、、 sp71021年前1
sp71021年前1 -
 gg懒子 共回答了16个问题
gg懒子 共回答了16个问题 |采纳率81.3%氯离子和铬酸根离子都能与银离子反应生成沉淀,而氯化银溶解度小于铬酸银.在氯离子和铬酸根离子混合体系中滴加硝酸银,银离子首先与氯离子反应生成氯化银(白色沉淀),直到溶液中银离子基本消耗完毕(浓度小于10^-5mol/L),过量的银离子才与铬酸根离子反应生成铬酸银(砖红色沉淀).因此砖红色沉淀的出现意味着氯离子反应完毕,可以根据硝酸银浓度和用量计算氯离子的量.
由于是沉淀滴定,你的氯离子很少确实不易观测,只能采用一些预处理手段提高氯离子含量.1年前查看全部
- 用铬酸钾指示剂滴定不能在氨碱性为什么
 jiaowaimai1年前2
jiaowaimai1年前2 -
 aasclear 共回答了17个问题
aasclear 共回答了17个问题 |采纳率70.6%铬酸钾指示剂法是指在中性溶液中,用K2Cr04作指示剂,用硝酸银滴定液滴定氯化物或溴化物的方法.其反应为:
滴定反应Ag++c1-→AgCl↓(白色)
指示终点反应2Ag++Cr042-→Ag2Cr04↓(砖红色)
终点时,稍过量的Ag+立刻与Cr042-反应,产生砖红色的Ag2Cr04沉淀,即到达终点.
那么氯化银和铬酸银沉淀在氨碱性溶液中都是会溶解的,生成二铵合银离子溶
【AgCl+2NH3·H2O=[Ag(NH3)2] + +Cl- +2H2O】
所以不能在氨碱性溶液中.1年前查看全部
- 铬酸钾作指示剂,用量的多或少对式样有何影响
铬酸钾作指示剂,用量的多或少对式样有何影响
对实验的结果有何影响 nalan_yc1年前1
nalan_yc1年前1 -
 flyinnet66 共回答了21个问题
flyinnet66 共回答了21个问题 |采纳率85.7%用量多了,会造成溶液颜色过深以至于微小的变化不易观察到
太少就不够灵敏,不能准确指示是实验中的信息1年前查看全部
- 10%的铬酸钾指示剂10%的指示剂和(100g/L)指示剂配制一样吗
 iamtoby1年前1
iamtoby1年前1 -
 liueye 共回答了23个问题
liueye 共回答了23个问题 |采纳率87%10%的指示剂是10克铬酸钾加90毫升水
(100g/L)指示剂是10克铬酸钾加水至100毫升1年前查看全部
- 急求铬酸钾酸化后通入硫化氢气体的反应现象及方程式,
 zuiaixigua1年前1
zuiaixigua1年前1 -
 盼秋 共回答了25个问题
盼秋 共回答了25个问题 |采纳率92%铬酸钾酸化时,溶液颜色由黄色变为橙色,以硫酸为例:
H2SO4 + 2K2CrO4 = K2Cr2O7 + K2SO4 + H2O
通入硫化氢后,溶液颜色由橙色变为墨绿色,并有淡黄色沉淀生成.
K2Cr2O7 + 4H2SO4 + 3H2S = K2SO4 + Cr2(SO4)3 + 7H2O + 3S↓1年前查看全部
- 《容液中氯离子含量测定.》吸取5mL试液加入50mL水.7滴铬酸钾指示剂.用.标准硝酸银容液滴定至淡红色为终点.,.为什
《容液中氯离子含量测定.》吸取5mL试液加入50mL水.7滴铬酸钾指示剂.用.标准硝酸银容液滴定至淡红色为终点.,.为什么不同PH值试液测定结果不同.PH=6.5和PH=8测的结果差别很大.另一个现象滴到终点的淡红色容液,滴上一滴稀硫酸或稀氨水马上淡红色退去.再用硝酸银滴定还要消耗几毫升.容液又变成淡红色.容液没有加入氯离子为什么会有这种现象?
我提的《容液中氯离子含量测定。》是指(水容液中氯离子含量测定,) 其实到处都是rr1年前2
其实到处都是rr1年前2 -
 windflower2007 共回答了11个问题
windflower2007 共回答了11个问题 |采纳率100%水溶液中氯离子含量测定的滴定条件:
(1)酸度 是在中性或弱碱性介质中进行的,在酸性溶液中,CrO42-会有以下反应,使CrO42-浓度降低,影响Ag2CrO4沉淀的形成,降低指示剂的灵敏度.
H+ + CrO4 = HCrO4-
2HCrO4- = CrO72- + H2O
如果溶液的碱性太强,会析出Ag2O沉淀.
Ag+ + OH- = AgOH↓
2AgOH↓=AgO↓+ H2O
也不能在氨性溶液中进行滴定,因为容易生成Ag(NH3)2+,会使AgCl沉淀溶解.
AgCl+2NH3+= Ag(NH3)2++Cl-
(2)干扰离子 能与Ag+生成沉淀的阴离子和能与CrO42-生成沉淀的阳离子都不应存在(如PO43-、SO32-、S2-、CO32-、Ba2+、Pb2+等).另外有色离子如Cu2+Co2+Ni2+等也不应存在,否则会给滴定终点的观察带来较大的误差.若上述离子存在,可采用分离或掩蔽的方法将它们除去,然后才进行滴定.
(3)温度与振荡 在室温下进行滴定,可避免因Ag2CrO4沉淀溶解度增加而降低指示剂的灵敏度.充分振荡可以减少AgCl沉淀对Cl-的吸附作用,提高分析结果的准确度.
(4) 指示剂浓度为5.3×10-3mol/L为宜.如果试液浓度较低时,还需做指示剂空白值校正,以减少误差.1年前查看全部
- 为什么铬酸钾指示剂的加入量力求准确,对滴定结果有什么影响?
为什么铬酸钾指示剂的加入量力求准确,对滴定结果有什么影响?
我查到:若Cr042-的量过大,会使终点提前,从而使测定结果产生较大的负误差.若Cr042-的量过小,则使终点推后,使测定结果产生正误差. liuyao6152401年前1
liuyao6152401年前1 -
 眨眼即逝 共回答了15个问题
眨眼即逝 共回答了15个问题 |采纳率93.3%这个应该是莫尔发滴定卤素离子了
以氯离子为例
滴定反应 AG+ + CL- === AGCL沉淀
终点指示反应 AG+ + CRO4 2- ==== AG2CRO4 红色沉淀
我们希望反应1完成之后再发生反应2
但是CL- 和 CRO4 2- 对AG+有竞争
如果铬酸钾指示剂加入过多 对AG+的竞争能力提高 CL-还没有沉淀完全 体系就变色了 终点提前
同样地道理 终点来的晚
具体的用量可以通过计算
如果你需要具体怎么计算出来用量
我再帮你查数据1年前查看全部
- 重铬酸钾与碱反应的方程式怎么写?还有铬酸钾与硫酸反应的方程式怎么写?
 czm30421年前1
czm30421年前1 -
 远山之泪 共回答了23个问题
远山之泪 共回答了23个问题 |采纳率100%Cr2O7 (2-) + 2OH- = 2CrO4(2-) + H2O
2CrO4(2-) + 2H+ =Cr2O7 (2-) + H2O1年前查看全部
- 为什么铬酸钾与硝酸铅反应生成铬酸铅沉淀?
 33458751年前1
33458751年前1 -
 cuixiaowei_202 共回答了13个问题
cuixiaowei_202 共回答了13个问题 |采纳率92.3%铬酸铅溶解度小呗!1年前查看全部
- 用硝酸银滴定氯化钠铬酸钾指示剂终点是什么
 叼着奶瓶爱你1年前1
叼着奶瓶爱你1年前1 -
 哭泣的百合123 共回答了18个问题
哭泣的百合123 共回答了18个问题 |采纳率77.8%橙红色,铬酸根被氧化1年前查看全部
- 铬酸钾和盐酸反应的化学方程式和离子方程式
铬酸钾和盐酸反应的化学方程式和离子方程式
3Q 木糖唇1年前2
木糖唇1年前2 -
 没有说gg话的人 共回答了24个问题
没有说gg话的人 共回答了24个问题 |采纳率91.7%2K2CrO4 +16HCl= 2CrCl3 +4KCl +3Cl2+8H2O
2CrO42- +16H+ 6Cl- = 2Cr3+ +3Cl2 + 8H2O1年前查看全部
- 沉淀溶解平衡实验时的问题2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1
沉淀溶解平衡实验时的问题
2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol/L硝酸铅溶液,观察首先生成黄色沉淀还是黑色沉淀?离心沉降后向清液中加2滴0.1mol/L硝酸铅溶液,会出现什么沉淀?
我的问题是,实验的时候我看到先生成的是黄色沉淀,后来清液中生成的也是黄色的.但是硫化铅的沉淀溶解系数小于铬酸铅的,为什么先生成铬酸铅?是我看错了?后来清液中的铬酸铅是怎么生成的. zzg20081年前1
zzg20081年前1 -
 fchisking 共回答了20个问题
fchisking 共回答了20个问题 |采纳率90%选C 加入生石灰,发生反应CaO + H2O === Ca(OH)2 由于本来已经是悬浊液(饱和),加入CaO,不改变溶液中各微粒的浓度.(B、D)但由于反应消耗了水1年前查看全部
- 铬酸钾 1g=?mol/L 还有硝酸银 %和mol/L有什么区别
 paccdos1年前1
paccdos1年前1 -
 131452xin 共回答了12个问题
131452xin 共回答了12个问题 |采纳率91.7%(1).铬酸钾,分子式是:K2CrO4 ,分子量是:196.2 .
1克=1/(196.2克/摩尔)=0.005097摩尔(mol) .
如果把1克铬酸钾溶于水并稀释成1升溶液,则摩尔浓度时:
0.005097mol/L .
(2).硝酸银,分子式是:AgNO3 ,分子量是:169.9 .
1克=1/(169.9克/摩尔)=0.005886摩尔(mol) .
同上计算,它的摩尔浓度是:0.005886mol/L .
1克硝酸银溶于水并稀释成1000克溶液,则其质量百分比浓度是0.1% .1年前查看全部
- 什么物质的氧化性比重铬酸钾强?
 心欣然1年前2
心欣然1年前2 -
 537128 共回答了19个问题
537128 共回答了19个问题 |采纳率84.2%太多了啊,常见的臭氧,酸性高锰酸钾,四价铅,双氧水等等,
查附带的标准电极电势表,重铬酸酸性时电势1.33,比这个数值大的都比他氧化性强.1年前查看全部
- .铬酸钾法测定Cl—含量时,要求介质的pH范围
.铬酸钾法测定Cl—含量时,要求介质的pH范围
铬酸钾法测定Cl—含量时,要求介质的pH范围( )
A.任何条件下均可以 B.中性或弱碱性
C.强酸性 D.强碱性
这个答案是不是B? 蓝色的雨天1年前0
蓝色的雨天1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 重铬酸根与铬酸钾根互转化的方程式怎么写?
重铬酸根与铬酸钾根互转化的方程式怎么写?
硫酸铬溶液的颜色是什么?
CrO4---Cr2O7 200621171年前1
200621171年前1 -
 明君不明 共回答了20个问题
明君不明 共回答了20个问题 |采纳率90%如果把化学式写出来就好了
就是这样子了:
Cr2O72-+ H2O = 2H+ + 2CrO42-
硫酸铬溶液的颜色不清楚,不过其固态是这样的:
紫色或红色粉末(无水物),
深绿色片状(十五水物),
紫色立方晶体(十八水物).1年前查看全部
- 铬酸钾和重铬酸钾在21摄氏度下的饱和度是多少?
铬酸钾和重铬酸钾在21摄氏度下的饱和度是多少?
铬酸钾和重铬酸钾在21摄氏度下的饱和度是多少?
一楼的,我要的是饱和度不是溶解度,虽然可以换算。 WhiteFox19731年前1
WhiteFox19731年前1 -
 bianaizi 共回答了19个问题
bianaizi 共回答了19个问题 |采纳率94.7%铬酸钾在20摄氏度下的溶解度 63.7g
重铬酸钾在20摄氏度下的溶解度12.3g
21摄氏度应该略大一点1年前查看全部
- 为什么配制铬酸钾溶液还要加入硝酸银溶液至溶液出现棕红的悬浮物?
为什么配制铬酸钾溶液还要加入硝酸银溶液至溶液出现棕红的悬浮物?
配制的铬酸钾溶液就是作为硝酸银滴定氯化钠的指示剂的 小品客1年前1
小品客1年前1 -
 gavin_tyg 共回答了20个问题
gavin_tyg 共回答了20个问题 |采纳率85%硝酸银应该是来标定铬酸钾浓度的吧…
是不是你看错了?本来两者就能反应.1年前查看全部
- 沉淀溶解平衡的问题2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol
沉淀溶解平衡的问题
2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol/L硝酸铅溶液,观察首先生成黄色沉淀还是黑色沉淀?离心沉降后向清液中加2滴0.1mol/L硝酸铅溶液,会出现什么沉淀?
我的问题是,实验的时候我看到先生成的是黄色沉淀,后来清液中生成的也是黄色的.但是硫化铅的沉淀溶解系数小于铬酸铅的,为什么先生成铬酸铅?是我看错了?后来清液中的铬酸铅是怎么生成的. bud021年前1
bud021年前1 -
 784562560 共回答了19个问题
784562560 共回答了19个问题 |采纳率94.7%(Ag2CrO4),但实际上KCl溶液中产生沉淀时c(Ag+) 要远小于Ag2CrO4中银离子的浓度,因此KCl溶液中先有沉淀.这类题目不能光看Ksp,还要注意盐的形式 AB1年前查看全部
大家在问
- 11”.一杂合子植株连续自交n代后,隐性基因频率接近于0“为什么不对?
- 2是不是只有氢氧化钙的溶解度随温度上升而下降?
- 3用禁止吸烟写一段话【用英语】 4排左右
- 4一列数:a,0,a,0,a,0,……,其中第n个数是什么?
- 5写出二次函数的二次项系数、一次项系数和常数项
- 6请问配制25%的亚氯酸钠液体是用多少80%的固体亚氯酸钠
- 7(2009•宝安区)小丽将1000元存入银行,定期2年,年利率是2.66%,到期她可以从银行获得税后利息______元.
- 8下列图形中,有无数条对称轴的是 [ ] A.等边三角形
- 9已知函数f(x)=3x的立方减9x加5求单调递增区间和在[负2.2]上的最大最小值
- 10在极坐标系中,判断点O(0,∏/4)是否在曲线ρ=sin2θ上.
- 11下列反应属于置换反应的是( )
- 12中翻英~不要机译哦.口语的1.我的肚子从来没有这么痛过.2.我觉得我已经很幼稚了,没想到他们比我还要幼稚
- 13这个英文地址怎么写(中翻英)中国,北京市,海淀区北三环中路1号,1号楼1单元,111室.请帮忙翻译,谢谢!
- 14物质的量相同的硫酸,盐酸和醋酸分别和足量Zn反应,产生的氢气为什么是一样多的?
- 15英语翻译那些不是猴子.他们是老虎.—这是你的外套吗?—是的,它是.—这些是狮子吗?—是的,是狮子.那些是狐狸.桌子上有三