铜锌再硫酸锌溶液能否形成原电池
 xsl_leilei2022-10-04 11:39:543条回答
xsl_leilei2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 林下南 共回答了16个问题
林下南 共回答了16个问题 |采纳率87.5%- 不可以.因为Cu或者Zn都不能跟ZnSO4溶液发生明显的化学反应,因此不能形成有硫酸锌是电解质 不能构成原电池.没有反应.不能,原电池是把
- 1年前
 sky_2001 共回答了18个问题
sky_2001 共回答了18个问题 |采纳率77.8%- 装置中:两极之间、两极与电解液之间必须有可以凭借的可以自发进行的氧化还原反应(浓差电池除外)。这一点最重要,往往被老师忽略。
- 1年前
 weswes12 共回答了2个问题
weswes12 共回答了2个问题 |采纳率- 不行,形成源电池必须要有一极与电解液发生反应
- 1年前
相关推荐
- 银与稀硫酸 锌与硫酸铜溶液 铜与硫酸锌溶液 铅与硝酸铜溶液 以上全部化学方程式 怎么写
 Sylphyao1年前3
Sylphyao1年前3 -
 lwcbc 共回答了14个问题
lwcbc 共回答了14个问题 |采纳率85.7%银与稀盐酸 不发生反应
锌与硫酸铜溶液 Zn + CuSO4 → ZnSO4 + Cu
铜与硫酸锌溶液 不发生反应
铝与硝酸银溶液 Al + 3AgNO3 → Al(NO3)3 + 3Ag1年前查看全部
- 将过量铁粉放入盛硫酸铜和硫酸锌溶液的烧杯中充分反应后过滤,留在滤纸上的物质是( )
将过量铁粉放入盛硫酸铜和硫酸锌溶液的烧杯中充分反应后过滤,留在滤纸上的物质是( )
A. Zn
B. Cu
C. Zn 和Cu
D. Cu和Fe 库姆塔格1年前1
库姆塔格1年前1 -
 千千阕歌420 共回答了12个问题
千千阕歌420 共回答了12个问题 |采纳率100%解题思路:根据金属与盐反应的条件考虑本题,铁与哪种物质反应,过量铁粉说明什么问题,再具体分析问题.金属与盐反应的条件:①金属排在盐中金属的前面,②反应物中的盐溶于水,③金属钾、钙、钠除外.金属活动性:锌>铁>铜,铁粉只能与硫酸铜反应,生成铜和硫酸亚铁,因为过量铁粉,所以过滤,留在滤纸上的物质是铜和铁.
故选D.点评:
本题考点: 金属的化学性质.
考点点评: 如果在溶液中有一种金属单质剩余,则排在该金属后面的金属阳离子不能存在.1年前查看全部
- 求置换反应的现象!放在硫酸锌溶液中的铁丝 ,放在硫酸铜溶液中的铁丝 要简练的说.这是填空的,在两个“铁丝”后面
 wangry91年前1
wangry91年前1 -
 绿洲翡翠 共回答了14个问题
绿洲翡翠 共回答了14个问题 |采纳率85.7%第1个,铁丝跟溶液都没有任何反应
第2个,溶液中有红色物质生成(铜屑)1年前查看全部
- 铜锌原电池,锌棒插在硫酸锌溶液用NaCl溶液行吗?用水呢?
铜锌原电池,锌棒插在硫酸锌溶液用NaCl溶液行吗?用水呢?
那么反应与电解液的选择有关吗?比如说有盐桥,铜片在cuso4中,锌是不是就只能在氧化性小于Cu2+的溶液中?如何解释锌在nacl中的反应呢? 轸轸迦迦1年前1
轸轸迦迦1年前1 -
 zengxizoming 共回答了24个问题
zengxizoming 共回答了24个问题 |采纳率100%可以用氯化钠,但不能用水
只要是电解质溶液就可以,放在硫酸锌里比较好分析
水虽然是电解质,但导电能力太弱了点儿,所以不行
反应和电解液的选择是有关的,如果你放强酸当然就直接制氢气了,应该是放在氧化性比较小的电解液,而且仅仅比铜离子的氧化性小还不够,至于多小就够了,不好说,和浓度也有关,要计算才能知道
放在氯化钠里的反应也很好解释啊,这个反应是锌被氧化生成锌离子,换成氯化钠又没有影响,还是这么反应的.1年前查看全部
- 原电池反应两个烧杯,一个有硫酸锌溶液和锌棒,一个有硫酸铜和铜棒,锌棒和铜棒有导线链接,两种溶液有盐
原电池反应两个烧杯,一个有硫酸锌溶液和锌棒,一个有硫酸铜和铜棒,锌棒和铜棒有导线链接,两种溶液有盐
Cu怎么变成铜离子的 水涨船高761年前3
水涨船高761年前3 -
 李泳7869 共回答了17个问题
李泳7869 共回答了17个问题 |采纳率100%有盐桥才可以反应,Zn比铜活泼,失去电子通过导线流向铜那一端,也就是正极,铜离子得到电子变为铜,附着在原来的铜极上.所以是铜离子变为铜单质.1年前查看全部
- (2008•鄂尔多斯)现有下列四组物质:①铜、银、稀硫酸 ②铁、铜、硫酸锌溶液 ③铝、银、硫酸铜溶液
(2008•鄂尔多斯)现有下列四组物质:①铜、银、稀硫酸 ②铁、铜、硫酸锌溶液 ③铝、银、硫酸铜溶液 ④铜、硫酸锌溶液、硝酸银溶液.其中只用组内物质就能判断同组内金属活动性顺序的是( )
A.①②
B.②③
C.①③
D.③④ 青青851年前1
青青851年前1 -
 ztzn02 共回答了11个问题
ztzn02 共回答了11个问题 |采纳率100%解题思路:验证金属活动性顺序可利用氢前金属与酸反应,活动性强的金属能将活动性弱的金属从盐溶液中置换出来,分析所设计方案能否证明同组金属的活动性顺序.①铜、银排在氢后面,不能与稀硫酸反应,不能比较铜、银金属活动性;
②铁、铜都排在锌的后面,都不能与硫酸锌发生化学反应,故不能判断铁、铜、锌的活动性顺序;
③铝能置换硫酸铜溶液中的铜,说明了铝的活动性大于铜,银不能置换硫酸铜溶液中的铜,说明了铜的活动性大于银,能判断铝、铜、银的活动性顺序;
④铜不能置换硫酸锌溶液中的锌,说明了锌的活动性大于铜,铜能置换硝酸银溶液中的银,说明了铜的活动性大于银,能判断锌、铜、银的活动性顺序.
由以上分析可知:
A、①②不能判断同组内金属活动性顺序,故A错误;
B、②不能判断同组内金属活动性顺序,故B错误;
C、①不能判断同组内金属活动性顺序,故C错误;
D、能判断同组内金属活动性顺序的是③④.故D正确.
故选D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 验证三种金属活动性强弱关系时,通常采取“三取中”的方法:取中间金属的单质或两端金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.1年前查看全部
- 一个原电池,用锌作负极,浸在有硫酸锌溶液中,正极用铜,浸在硫酸铜溶液中,中间有盐桥.我想问为什么锌和铜要浸在装有硫酸锌和
一个原电池,用锌作负极,浸在有硫酸锌溶液中,正极用铜,浸在硫酸铜溶液中,中间有盐桥.我想问为什么锌和铜要浸在装有硫酸锌和硫酸铜溶液中呢?为什么要用盐桥,盐桥用什么作电解质啊?
 cg3385201年前2
cg3385201年前2 -
 uu娃娃的首饰 共回答了23个问题
uu娃娃的首饰 共回答了23个问题 |采纳率87%金属要浸在相对应的盐溶液中
盐桥一般用KCL 因为钾离子和氯离子的运动速度差不多 可以保证持续稳定的电流
如果不用盐桥 就是原来那种简单的原电池 电流是不稳的 一会就没电了1年前查看全部
- 下列物质能否发生反映?写出能发生反应的化学方程式。一,银与稀盐酸二,锌与硫酸铜溶液三,铜与硫酸锌溶液四,铝与硝酸银溶液
 娃哈哈r271年前1
娃哈哈r271年前1 -
 orsenla 共回答了1个问题
orsenla 共回答了1个问题 |采纳率100%第一个不能,因为银的金属活动性排在氢后,所以不能。第二个能,Zn+CuSO4=ZnSO4+Cu.第三个也不能,铜的金属活动性没有锌活泼。第四个能,Al+AgNO3=Al(NO)3+Ag1年前查看全部
- 在100g的硫酸锌溶液中,含有20g的硫酸锌,则该硫酸锌溶液中溶质的质量分数是多少?
 beyondxhh1年前1
beyondxhh1年前1 -
 天使沦落 共回答了19个问题
天使沦落 共回答了19个问题 |采纳率100%该硫酸锌溶液中溶质的质量分数是 溶质质量/溶液质量*100%=20g/100g*100%=20%1年前查看全部
- 检验硫酸锌溶液中含有SO42-的试剂
 dfsdfd1年前2
dfsdfd1年前2 -
 hamasking 共回答了26个问题
hamasking 共回答了26个问题 |采纳率88.5%BaCl2
∵BaCl2+ZnSO4=BaSO4↓+ZnCl2
(含可溶Ba2+的溶液均可)1年前查看全部
- 将锌和硫酸锌的混合物20g,放入180.4g稀硫酸中,完全反应后得到200g硫酸锌溶液,求...
将锌和硫酸锌的混合物20g,放入180.4g稀硫酸中,完全反应后得到200g硫酸锌溶液,求...
将锌和硫酸锌的混合物20g,放入180.4g稀硫酸中,完全反应后得到200g硫酸锌溶液,求:
(1)原混合物中锌的质量分数
(2)把200g硫酸锌溶液中的水蒸发干,可得到硫酸锌固体多少克? 红岭19911年前1
红岭19911年前1 -
 fjcrs 共回答了21个问题
fjcrs 共回答了21个问题 |采纳率100%反应后生成氢气的质量为:20g+180.4g-200g=0.4g
设混合物中锌的质量是x,生成硫酸锌的质量为y
Zn+H2SO4====ZnSO4+H2↑
65 161 2
x y 0.4g
65/x=161/y=2/0.4g
x=13g y=32.2g
原混合物中锌的质量分数为:13g/20g×100%=65%
溶液中硫酸锌的质量为:20g-13g+32.2g=39.2g1年前查看全部
- 想知道这个原电池的反应原理两个烧杯,一个有硫酸锌溶液和锌棒,一个有硫酸铜和铜棒,锌棒和铜棒有导线链接,两种溶液有盐桥链接
想知道这个原电池的反应原理
两个烧杯,一个有硫酸锌溶液和锌棒,一个有硫酸铜和铜棒,锌棒和铜棒有导线链接,两种溶液有盐桥链接,请问这个原电池的反应原理(比如:锌和什么物质反应?等等)
锌为何失电子?
是铜离子经过盐桥到硫酸锌溶液中与锌发生置换反应么?
回答者:教授王 - 探花 十一级 的回答为什么锌能与硫酸锌反应?不符合常理呀。 stone-9111年前5
stone-9111年前5 -
 在家男人 共回答了16个问题
在家男人 共回答了16个问题 |采纳率81.3%原理:Zn+CuSO4=Cu+SO4
1,锌比铜活泼,所以失电子;
2,铜离子不经过盐桥到硫酸锌溶液中与锌发生置换反应;
3,教授王 - 探花 十一级 的回答是电极反应.
正极:Cu2+ + 2e ----> Cu
负极:Zn - 2e ----> Zn2+
4,盐桥作用:
在两种溶液之间插入盐桥以代替原来的两种溶液的直接接触,减免和稳定液接电位(当组成或活度不同的两种电解质接触时,在溶液接界处由于正负离子扩散通过界面的离子迁移速度不同造成正负电荷分离而形成双电层,这样产生的电位差称为液体接界扩散电位,简称液接电位),使液接电位减至最小以致接近消除.
防止试液中的有害离子扩散到参比电极的内盐桥溶液中影响其电极电位.1年前查看全部
- 硫酸锌溶液中铁离子的消除的相关问题
硫酸锌溶液中铁离子的消除的相关问题
制备工业硫酸锌时,需将硫酸锌溶液中二价铁离子的消除,方法是加入高锰酸钾,使之形成氢氧化铁沉淀除却!
提问1:假设含二价铁量为350g/立方米,那么处理这样的溶液一立方米,理论上需要加入高锰酸钾固体多少克?(工艺规程规定的PH值是5.4,因为PH不同高锰酸钾有不同的反应方程式)本题要问的是在PH值是5.4的状况下,高锰酸钾的还原产物是几价锰?
2、怎样除去高锰酸钾的还原产物?
3另外,用什么方法检测化验硫酸锌溶液中的铁离子含量比较合理,需考虑铜离子干扰.
 giogio19851年前2
giogio19851年前2 -
 未名禄 共回答了15个问题
未名禄 共回答了15个问题 |采纳率86.7%1 MnO4- + 3Fe2+ + 4H+== 3Fe3+ + MnO2(固体)+ 2H2O
设需要KMnO4为x克
(x/158)*3=350/56
X=329.2克,还原产物为二氧化锰
2利用过滤即可除去
3充入H2S,除去多余的Cu2+,然后盐酸酸化后,使用氨水掩蔽Zn2+,再用EDTA络合滴定.1年前查看全部
- 有关原电池的问题槽内有一离子交换膜,只允许硫酸根离子通过,膜两边分别有硫酸锌溶液(并插入锌棒)和硫酸铜溶液(并插入铜棒)
有关原电池的问题
槽内有一离子交换膜,只允许硫酸根离子通过,膜两边分别有硫酸锌溶液(并插入锌棒)和硫酸铜溶液(并插入铜棒),为什么用导线连接锌、铜会产生电流? krees1年前1
krees1年前1 -
 狗头86年万众狂欢 共回答了15个问题
狗头86年万众狂欢 共回答了15个问题 |采纳率86.7%在两侧会有液接电位产生,所以会有电流.1年前查看全部
- 下列各组中两种物质不能发生化学反应的是( ) A.铜和硫酸锌溶液 B.铁和硫酸溶液 C.二氧化碳和水 D.三氧化硫与氢
下列各组中两种物质不能发生化学反应的是( ) A.铜和硫酸锌溶液 B.铁和硫酸溶液 C.二氧化碳和水 D.三氧化硫与氢氧化钠溶液  cctvcctv71年前1
cctvcctv71年前1 -
 windOfChaos 共回答了14个问题
windOfChaos 共回答了14个问题 |采纳率78.6%A、在金属活动性顺序中,铜位于锌的后面,铜和硫酸锌溶液不能发生反应.故A符合题意;
B、在金属活动性顺序中,铁位于氢的前面.铁和硫酸溶液能发生反应.故B不符合题意;
C、二氧化碳和水反应生成了碳酸.故C不符合题意;
D、三氧化硫与氢氧化钠溶液反应生成了硫酸钠和水.故D不符合题意;
故选A.1年前查看全部
- 求图中各物质所代表的化学式 利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图
求图中各物质所代表的化学式
利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图所示
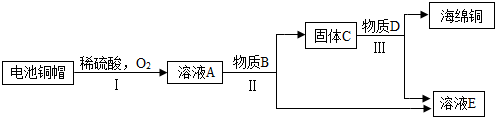
已知:2Cu+2H2SO4+O2 △ 2CuSO4+2H2O 遥远的风铃1年前2
遥远的风铃1年前2 -
 风啊那个吹 共回答了21个问题
风啊那个吹 共回答了21个问题 |采纳率85.7%A CuSO4
B Zn
C Cu Zn
D H2SO4
E ZnSO41年前查看全部
- 探究铁和铜试管,㬵头滴管,镊子,铁钉,铜片,硫酸锌溶液,硫酸亚铁溶液丶硫酸铜溶液
探究铁和铜试管,㬵头滴管,镊子,铁钉,铜片,硫酸锌溶液,硫酸亚铁溶液丶硫酸铜溶液
实验方案2种 chinhailu1年前1
chinhailu1年前1 -
 用眼看世界 共回答了23个问题
用眼看世界 共回答了23个问题 |采纳率95.7%探究铁和铜的活动性顺序:
1.把铁钉放入硫酸铜溶液中,观察现象.
2.把铜片放入硫酸亚铁溶液中,观察现象.1年前查看全部
- (2013•常州)某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液
(2013•常州)某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序.
(1)实验前,用砂纸打磨金属片的目的是______;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合弹的方案,如图l所示: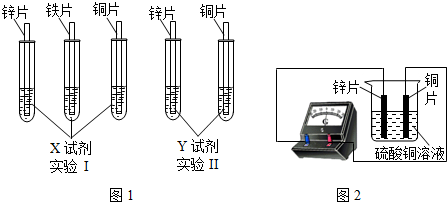
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为______、______;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现青色.
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至______色,最终变为无色;
B.向混合注中插人锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式:______;
②______;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表______;②铜片表面______. iampurch1年前1
iampurch1年前1 -
 米米蓓 共回答了14个问题
米米蓓 共回答了14个问题 |采纳率85.7%解题思路:(1)金属在空气中其表面能生成一层氧化膜,开始氧化膜先与酸接触反应生成盐和水几乎不能产生氢气,据此分析;
(2)根据金属的活动性顺序表的应用分析.在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸反应生成氢气进行设计实验;
(3)A、根据锌的活动性比铜和铁强,可以和其盐溶液发生置换反应,从而溶液的颜色也随着发生改变分析;
B、根据强金属和弱金属的盐溶液发生置换反应及原电池的工作原理分析;
(4)根据原电池的电子转移及电流的形成和发生的变化分析.(1)金属在空气中其表面能生成一层氧化膜,氧化膜会阻止金属与药品的接触,所以要先除去氧化膜;
(2)实验1:给定三种金属,因此可以和酸混合:将三种金属分别于稀硫酸混合后,铜与稀硫酸不反应,锌、铁均能与稀硫酸反应产生气体,且锌的反应比铁剧烈,可以得出锌>铁>铜;
实验2,给定两种金属,可以和中间金属的盐溶液混合,由于锌能与硫酸亚铁反应,说明锌在铁的前面,铜不与硫酸亚铁反应,说明铁在铜的前面.所以可以选用的另外一种药品是硫酸亚铁溶液;
(3)A、硫酸亚铁溶液是浅绿色,硫酸铜溶液是蓝色,离子溶液混合后呈现青色,加入过量锌粉后,先和硫酸铜发生置换反应,青色变浅;硫酸铜完全反应后,溶液变为浅绿色;接着锌再和硫酸亚铁发生置换反应,变成硫酸锌,溶液呈现无色;
B、混合盐溶液中插入锌片,铁单质可能有离子来源:当溶液中铜离子的浓度很稀时,锌与硫酸亚铁直接发生置换反应,反应的方程式为:Zn+FeSO4═ZnSO4+Fe;也可能是铜和锌构成原电池,电子从锌片转移到铜片上时,溶液中的铜离子、亚铁离子得到电子变成铜单质和铁单质;
(4)原电池中锌比铜活泼,所以锌失去电子,电子从锌片流向铜片,而电流从铜片流向锌片,所以电流表指针发生偏转;铜离子在铜片上得到电子,生成红色的铜单质,故锌片变薄,铜片表面变粗.
故答案为:(1)除去金属表面的氧化膜;(2)H2SO4;FeSO4;(3)浅绿色;Zn+FeSO4═ZnSO4+Fe;铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;(4)指针发生偏转;变粗.点评:
本题考点: 金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了金属活动性顺序的运用和原电池的原理,根据是熟练掌握位置在前的金属能将位于其后的金属从其盐溶液中置换出来,且活动性差别越大,越容易被置换;氢前的金属能与酸发生置换反应及原电池中电子转移的方向及电流的方向.1年前查看全部
- 如果向硫酸锌溶液中滴几滴盐酸生成的氯化锌会不会加速水解?
 祸福两依1年前3
祸福两依1年前3 -
 sgwz_1b1f_f46df 共回答了11个问题
sgwz_1b1f_f46df 共回答了11个问题 |采纳率100%由于硫酸锌可以看作是由硫酸(强酸)和氢氧化锌(弱碱,未显两性)中和尔而来,故属于强酸弱碱盐,所以会水解,加入盐酸后溶液呈强酸性.方程式
ZnSO4+2H2O=(可你符号)Zn(OH)2+H2SO4
可见,在酸性条件下会使反应更偏向左边,抑制水解1年前查看全部
- 以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上(阴极产物也不再参加反应损耗),通电一段时间后,
以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上(阴极产物也不再参加反应损耗),通电一段时间后,关闭电源,迅速撤去电极,若在电解后的溶液中加入4.95g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)( )
A. 0.56 L
B. 1.12 L
C. 2.24 L
D. 3.36 L 择偶不善键盘tt穿1年前2
择偶不善键盘tt穿1年前2 -
 幽幽5201314 共回答了24个问题
幽幽5201314 共回答了24个问题 |采纳率79.2%解题思路:加入4.95g Zn(OH)2时恰好能使溶液恢复到原浓度,Zn(OH)2从组成上可看成ZnO•H2O,所以电解过程中阴极上析出锌和氢气,4.95g Zn(OH)2固体的物质的量=[4.95g /99g/mol]=0.05mol,根据原子守恒知,阳极上析出n(O2)=n[Zn(OH)2],阴极上析出n(H2)=n[Zn(OH)2],再根据V=nVm计算气体体积.加入4.95g Zn(OH)2时恰好能使溶液恢复到原浓度,Zn(OH)2从组成上可看成ZnO•H2O,所以电解过程中阴极上析出锌和氢气,4.95g Zn(OH)2固体的物质的量=[4.95g /99g/mol]=0.05mol,根据原子守恒知,阳极上析出n(O2)=n[Zn(OH)2],阴极上析出n(H2)=n[Zn(OH)2],所以析出气体体积=(0.05+0.05)mol×22.4L/mol=2.24L,
故选C.点评:
本题考点: 电解原理.
考点点评: 本题以电解原理为载体考查了物质的量的计算,明确守恒思想是解本题关键,根据原子守恒计算氢气和氧气的物质的量,再结合V=nVm计算即可,难度不大.1年前查看全部
- 1某同学利用括号内的物质设计下列各实验方案,你认为可行的是()A、验证锌、铜、银的金属活动性顺序(硫酸锌溶液、铜片、银片
1某同学利用括号内的物质设计下列各实验方案,你认为可行的是()A、验证锌、铜、银的金属活动性顺序(硫酸锌溶液、铜片、银片)B、鉴别固体氢氧化钠、氯化钠、硝酸铵(水)C、除去二氧化碳中混有少量的一氧化碳(点燃)D、分离氧化钙中混有的碳酸钙粉末(加水溶解,过滤)【这题的正确答案是B,而我想问的是:答案B是如何鉴别的呢?答案C为什么不合理,一氧化碳点燃不是会变成二氧化碳的吗?还有答案D,我也不是很理解啊?请大家告诉我一点吧】 2将某气体混合物在氧气中充分燃烧后的气态生成物依次通过浓硫酸和烧碱溶液,结果两溶液的质量都增重.该混合气体组成不可能的是( )A、H₂和CH₄ B、N₂和CH₄ C、H₂和CO D、N₂和CO【这题的正确答案是D,但我完全不理解,只能列出几个选项中的气体与氧气反应的化学式:2H₂+2O₂=点燃=2H₂O+O₂↑;CH₄+2O₂=点燃=2H₂O+CO₂↑;N₂+2O₂=点燃=2NO₂↑;2CO+O₂=点燃=2CO₂↑;不知道我列的对不对,希望初中化学好的人能教教我,告诉我这题的道理.】 3某实验小组发现,一些含有金属元素的物质能够加快过氧化氢分解的速度,于是进行一下对比实验.下列实验组不能为相应的猜想提供证据的是( )【这题的正确答案是A,但我不理解为什么选A,C中的氧化亚铁与氧化铁是不是有一个很贵啊?选项D我勉强理解,望聪明人多给我一些指点.】
 greey_zhang1年前1
greey_zhang1年前1 -
 song1984 共回答了16个问题
song1984 共回答了16个问题 |采纳率81.3%1. 选B 用水,是根据在溶解时温度变化鉴别的 ,固体氢氧化钠溶于水中是放热的,温度会升高,氯化钠溶于水中温度基本不变,硝酸铵溶于水中会吸热,温度下降,由此也就鉴别了.
A 明显不正确.把铜片、银片放入硫酸锌溶液中均不会发生化学反应,(金属活动顺序 Zn>Cu>Ag)
C不正确,点燃需要什么条件? 氧气,也就是说,你点燃的时候,会引进新的杂质,而且,这样除杂也不能保证除干净.正确的应该是通过灼热的氧化铜以出去一氧化碳,发生氧化还原反应.
D不正确,氧化钙和水反应,生成氢氧化钙,在这里,可以理解为石灰乳,就算是加水多,但是氢氧化钙在水中是微溶的,经过过滤得到的碳酸钙,存在氢氧化钙的杂质,所以不行.这个应该是用高温煅烧,高温会使碳酸钙分解为氧化钙和氧气.
2这个真没法答.题出现错误了,不过我试试蒙着答吧
A应该是氢气和甲烷吧?完全燃烧后生成水蒸气和二氧化碳.先经过浓硫酸,水被吸收,再经过氢氧化钠,二氧化碳被吸收,所以成立.
B氮气和甲烷?也可以啊,完全燃烧后是氮气,水蒸气和二氧化碳,氮气可以忽略掉,跟A完全一样.
C氢气和一氧化碳?完全燃烧后生成水蒸气和二氧化碳.跟A完全一样.
D氮气和一氧化碳?完全燃烧后,氮气不反应,所以气体变成氮气和二氧化碳.通过浓硫酸,这两种气体都不能被浓硫酸吸收,所以浓硫酸不会增重,所以D项错误.
3根本就没复制完全.
你可以加我QQ,为你解答 295260771年前查看全部
- 在盛有硝酸银溶液和硫酸锌溶液的试管中,分别浸入一段洁净的铜丝,过一会儿取出,观察有什么变化.
在盛有硝酸银溶液和硫酸锌溶液的试管中,分别浸入一段洁净的铜丝,过一会儿取出,观察有什么变化.
在硝酸银溶液中,铜丝表面变黑 银不是白色的嘛? 5211314bin1年前4
5211314bin1年前4 -
 nickfon1 共回答了22个问题
nickfon1 共回答了22个问题 |采纳率90.9%金属之所以有金属光泽,与她的晶体结构有关,金属晶体一般是由,金属阳离子和自由移动的电子组成的,电子会吸收,一定频率的光,光是有能量的,电子吸收以后就会发生跃迁,当向低能级跃迁的时候就会发出光来,这时候就被你看到了,但是置换出来的银是没有晶体结构的,举一个简单的例子,铁粉是黑色的吧,但铁片却是银白色的,这是一样的道理~1年前查看全部
- 硫酸锌溶液,阳极锌片,阴极铁片问硫酸锌溶液浓度会怎么变 是不是阳极 Zn 失电子 阴极 H+ 得电子 Zn2
硫酸锌溶液,阳极锌片,阴极铁片问硫酸锌溶液浓度会怎么变 是不是阳极 Zn 失电子 阴极 H+ 得电子 Zn2
硫酸锌溶液,阳极锌片,阴极铁片问硫酸锌溶液浓度会怎么变 是不是:阳极 Zn 失电子 阴极 H+ 得电子 .Zn2+ 浓度变大 ,H+ 得电子变成H2 水减少,硫酸锌溶液浓度就变大了? 乱率妻子1年前8
乱率妻子1年前8 -
 zhangml 共回答了13个问题
zhangml 共回答了13个问题 |采纳率84.6%Zn比H活泼,所以阴极上是H2O得电子变为H2(氢气)和OH-(氢氧根),而由于阳极是Zn,所以Zn会不断失去电子变为Zn2+,再和OH-结合生成Zn(OH)2沉淀
阴极反应式:2H2O + 2e- = H2 + 2OH-
阳极反应式:Zn - 2e- +2OH- = Zn(OH)2
总反应式:Zn + 2H2O =电解= Zn(OH)2↓ + H2↑
所以水的浓度减小了,而ZnSO4物质的量不变,浓度也就增大了1年前查看全部
- 化学中的疑问,关于盐桥前几天的一个题里提到盐桥,当左边是锌浸泡在硫酸铜溶液中,右边是铜浸泡在硫酸锌溶液中中间用盐桥连接烧
化学中的疑问,关于盐桥
前几天的一个题里提到盐桥,
当左边是锌浸泡在硫酸铜溶液中,右边是铜浸泡在硫酸锌溶液中中间用盐桥连接烧杯是,铜锌间的电流表没有反应.当烧杯交换后,电流表就动了.锌和硫酸锌不反应的,没有自发的氧化还原反应为什么会有电流呢?
盐桥是怎样工作的呢?
最好简单易懂的讲述, hldyk1年前3
hldyk1年前3 -
 longling10 共回答了14个问题
longling10 共回答了14个问题 |采纳率85.7%第一个因为左边直接发生了反应,不会有电子通过导线转移,自然就没有电流
第二个 因为整个装置通过导线里的电子,烧杯和盐桥中的离子构成了闭合回路,
因为Zn的电极电势比铜小,所以两侧产生了电势差,离子和电子什么的就开始运动.电子从导线中出来会遇到Cu 2+发生氧化反应变声Cu Zn会失去电子变为Zn 2+进入溶液.
整个反应还是Zn和CuSO4,只不过是两个半反应在两边进行罢了1年前查看全部
- 硫酸锌溶液中硫酸铁怎样除去而且不能混入其他杂质
 _ey_t5b0afe16_b31年前1
_ey_t5b0afe16_b31年前1 -
 sadfjiqwgqw 共回答了23个问题
sadfjiqwgqw 共回答了23个问题 |采纳率91.3%利用复分解反应,加过量的锌使硫酸铁变成硫酸锌就行了.
上面那位兄弟,硫酸铁与锌反映是不会产生氢气的1年前查看全部
- 硫酸锌溶液是酸性的还是中性的?氢氧化锌应该是一种弱碱?所以会水解?那铜片和锌片用导线连接后浸入硫酸锌会不会形成原电池?电
硫酸锌溶液是酸性的还是中性的?氢氧化锌应该是一种弱碱?所以会水解?那铜片和锌片用导线连接后浸入硫酸锌会不会形成原电池?电极反应方程式怎样写?
 贼随意1年前1
贼随意1年前1 -
 nuauamc 共回答了20个问题
nuauamc 共回答了20个问题 |采纳率95%酸性,因为是强酸弱碱盐.可以形成原电池的,负极:Zn-2e-=Zn2+
正极∶2H++2e-=H2↑这些原电池反应不能和化学反应一同看待1年前查看全部
- 硫酸锌溶液为什么显酸性.为什么它是强酸弱碱盐?氢氧化锌不就是强碱吗
 bjilt1年前2
bjilt1年前2 -
 能不让我哭吗 共回答了17个问题
能不让我哭吗 共回答了17个问题 |采纳率82.4%锌离子会反生很弱的水解,生成氢氧化锌1年前查看全部
- 硫酸锌溶液中的铝怎么除去?
 天天62501年前3
天天62501年前3 -
 一毫纸 共回答了16个问题
一毫纸 共回答了16个问题 |采纳率100%铝和锌都是弱碱阳离子,在水中都水解.氢氧化铝沉淀PH范围是3.3到5.2,氢氧化锌沉淀PH范围是5.4到8.0.也就是说向溶液中加ZnO调节PH至5.2到5.4之间即可(纠结的范围)1年前查看全部
- 硫酸锌溶液中含有,镍,钴,铬,铜,铁,应该怎么分离,用锌粉置换都有什么条件?
 五指弦上舞1年前2
五指弦上舞1年前2 -
 野猪林-tom 共回答了11个问题
野猪林-tom 共回答了11个问题 |采纳率90.9%加锑盐和硫酸铜进行置换.1年前查看全部
- 电解氯化铜,氯化锌,硫酸锌溶液是否都生成了单质金属
 子沐水1年前1
子沐水1年前1 -
 sukie_gigi 共回答了16个问题
sukie_gigi 共回答了16个问题 |采纳率93.8%只有电解氯化铜溶液才会得到单质Cu2+,从的电子能力而言
Cu2+ > H+ >Zn2+
所以在电解氯化锌,硫酸锌溶液是会产生H2,不会电解出单质Zn1年前查看全部
- 原电池中的一些问题1.把两片锌片放在硫酸锌溶液中电流表有电流显示.2.刚把锌片和铜片放进溶液时,电流表示数会突然增大然后
原电池中的一些问题
1.把两片锌片放在硫酸锌溶液中电流表有电流显示.
2.刚把锌片和铜片放进溶液时,电流表示数会突然增大然后减少.
3.若把一部分电线换为硫酸锌溶液也能导电,为什么?
知道的说下,可以的话请写详细点,谢谢. 可以追加积分!
 jiachao02091年前1
jiachao02091年前1 -
 YoaoY 共回答了17个问题
YoaoY 共回答了17个问题 |采纳率100%把两片锌片放在硫酸锌溶液中电流表有电流显示,那是因为两片锌片纯度不同
2.刚把锌片和铜片放进溶液时,电流表示数会突然增大然后减少.那是因为随着反应的进行反应越来越缓慢拉1年前查看全部
- 将硫酸锌溶液滴到氢氧化钠溶液中会发生反应吗?为什么?
将硫酸锌溶液滴到氢氧化钠溶液中会发生反应吗?为什么?
ZnSO4和NaOH互滴能不能鉴别?氢氧化锌沉淀能不能溶于氢氧化钠? 晕兮1年前1
晕兮1年前1 -
 maomao820306 共回答了16个问题
maomao820306 共回答了16个问题 |采纳率93.8%硫酸锌滴到氢氧化钠溶液内会发生反应,生成的是氢氧化锌的沉淀
但是这两者互滴不能鉴别,因为无论是硫酸锌滴到氢氧化钠中还是反过来的现象都是一样的1年前查看全部
- cu zn 原电池中有盐桥的话锌怎么会在硫酸锌溶液中失去电子?
 等你爱你到最后1年前1
等你爱你到最后1年前1 -
 三星小瓢虫 共回答了26个问题
三星小瓢虫 共回答了26个问题 |采纳率88.5%盐桥不会运输Cu2+,它是为了保持电荷平衡的,比如左边Cu2+变为Cu导致溶液负离子比正离子多,而右边Zn变为Zn2+,正离子多,就把右边的负离子运到左边,左边负离子运到右边.原电池该怎么反应还怎么反应.1年前查看全部
- 锌铜原电池中,为什么锌能在硫酸锌溶液中溶解
锌铜原电池中,为什么锌能在硫酸锌溶液中溶解
课本上说,锌在硫酸锌溶液中溶解, tian787271年前1
tian787271年前1 -
 夏天下雪a 共回答了18个问题
夏天下雪a 共回答了18个问题 |采纳率83.3%因为在原电池中,锌作为负极,失去电子形成了阳离子,进入电解质溶液中.1年前查看全部
- 为什么有的书上说电解硫酸锌溶液可以电解出单质锌.氢离子不会先放电生成氢气吗?
 hua867536261年前2
hua867536261年前2 -
 桃源明 共回答了22个问题
桃源明 共回答了22个问题 |采纳率90.9%本来氢离子的标准电极电位比锌要正一些,应该优先于锌离子析出.但析出时还要考虑到氢离子在该析出的材料上的超电位,这就使得锌离子的实际电位比氢的还要正,故是锌的析出而不是氢的析出.1年前查看全部
- 配制0.1%的硫酸锌溶液作为追肥使用,溶液总量为3000毫升,那么应称取硫酸锌多少克
 爱儿08251年前1
爱儿08251年前1 -
 task3 共回答了15个问题
task3 共回答了15个问题 |采纳率80%首先要知道溶液的密度是多少,才能知道溶液的质量,溶液质量乘以0.1%就是硫酸锌的质量1年前查看全部
- 关于盐类水解的问题实验室在配制硫酸锌溶液时,先把硫酸锌晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是 抑制硫
关于盐类水解的问题
实验室在配制硫酸锌溶液时,先把硫酸锌晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是 抑制硫酸锌水解?
.这个答案我不懂.
我的思路是 加入稀硫酸相当于增加H离子的浓度 ,抑制水解
但是同学说不是.
然后我还想问 如果是照我们平常的配制溶液 步骤又是什么呢? hsuzh1年前5
hsuzh1年前5 -
 yyyy123 共回答了14个问题
yyyy123 共回答了14个问题 |采纳率85.7%你的思路是对的.
配制其它易水解的盐的溶液时,都按类似操作.1年前查看全部
- 1.用硫酸锌溶液区分黄铜(Cu、Zn)和黄金的现象 2. 用碳酸钡区分稀硫酸和硫酸钠溶液的现象
 幸福的小猪012341年前1
幸福的小猪012341年前1 -
 Mars_liu 共回答了24个问题
Mars_liu 共回答了24个问题 |采纳率83.3%手机不方便 简单说下 1部分溶解有气泡 无现象 因为硫酸锌是酸性 2 有气体产生 无明显现象 都生成硫酸钡 但碳酸钡也是沉淀所以看不出来 然后前者还有碳酸生成 所以有气体1年前查看全部
- 如何去除硫酸锌溶液中混有的少量硫酸铜?
 84531301年前1
84531301年前1 -
 xj5107 共回答了18个问题
xj5107 共回答了18个问题 |采纳率100%直接加锌啊!1年前查看全部
- 电极分别为锌和铁,电解质为硫酸锌溶液,是否能构成原电池
 nirushe1年前1
nirushe1年前1 -
 逃跑的孩子 共回答了23个问题
逃跑的孩子 共回答了23个问题 |采纳率95.7%不能.因为不能发生自发的氧化还原.即硫酸锌与锌和铁都不反应.1年前查看全部
- 原电池:用Zn,Cu做电极,Zn在硫酸锌溶液里,Cu在硫酸铜离,盐桥相连 很疑惑,它是怎么实现的反应
原电池:用Zn,Cu做电极,Zn在硫酸锌溶液里,Cu在硫酸铜离,盐桥相连 很疑惑,它是怎么实现的反应
两半池都没有自发反映啊,为什么连了盐桥就反应了呢? 不再善良了1年前3
不再善良了1年前3 -
 仨人 共回答了20个问题
仨人 共回答了20个问题 |采纳率90%盐桥相当于导线.所以又了它就形成了闭合回路.
只不过它是通过盐桥内的盐的阴阳离子定向移动形成电流!1年前查看全部
- 分别将以下物质测定锌和铜的活动性:1)Zn、Cu、稀硫酸;2)Zn、Cu、硫酸镁溶液 3)Zn、Cu、硫酸锌溶液.
 mjfgary1年前2
mjfgary1年前2 -
 znlovejn 共回答了17个问题
znlovejn 共回答了17个问题 |采纳率94.1%选1
Zn+H2SO4=ZnSO4+H2↑,Cu不能反应,证明Zn比Cu活泼.
2都不反应
3都反应1年前查看全部
- 用实验比较铜锌银的金属活动性最好的方法是选用下列试剂中的 A.硫酸锌溶液 B.氢氧化钠溶液 C.稀硫酸 D.硫酸铜溶液
 爱琳琳的男人1年前1
爱琳琳的男人1年前1 -
 edward520 共回答了17个问题
edward520 共回答了17个问题 |采纳率88.2%D
将锌片放入硫酸铜溶液有红色物质析出说明锌比铜活动性强,将银丝放入硫酸铜溶液无现象,说明银比铜的活动型弱.1年前查看全部
- 如何除去硫酸锌溶液中的铝和硅?铝和硅都混在溶液当中了,单靠过滤是不行的.
 窗台门口1年前1
窗台门口1年前1 -
 bb2000 共回答了19个问题
bb2000 共回答了19个问题 |采纳率94.7%过滤?1年前查看全部
- 以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上(阴极产物也不再参加反应损耗),通电一段时间后,
以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上(阴极产物也不再参加反应损耗),通电一段时间后,关闭电源,迅速撤去电极,若在电解后的溶液中加入4.95g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)( )
A. 0.56 L
B. 1.12 L
C. 2.24 L
D. 3.36 L 堂之海1年前2
堂之海1年前2 -
 苏雨晨 共回答了16个问题
苏雨晨 共回答了16个问题 |采纳率93.8%解题思路:加入4.95g Zn(OH)2时恰好能使溶液恢复到原浓度,Zn(OH)2从组成上可看成ZnO•H2O,所以电解过程中阴极上析出锌和氢气,4.95g Zn(OH)2固体的物质的量=[4.95g /99g/mol]=0.05mol,根据原子守恒知,阳极上析出n(O2)=n[Zn(OH)2],阴极上析出n(H2)=n[Zn(OH)2],再根据V=nVm计算气体体积.加入4.95g Zn(OH)2时恰好能使溶液恢复到原浓度,Zn(OH)2从组成上可看成ZnO•H2O,所以电解过程中阴极上析出锌和氢气,4.95g Zn(OH)2固体的物质的量=[4.95g /99g/mol]=0.05mol,根据原子守恒知,阳极上析出n(O2)=n[Zn(OH)2],阴极上析出n(H2)=n[Zn(OH)2],所以析出气体体积=(0.05+0.05)mol×22.4L/mol=2.24L,
故选C.点评:
本题考点: 电解原理.
考点点评: 本题以电解原理为载体考查了物质的量的计算,明确守恒思想是解本题关键,根据原子守恒计算氢气和氧气的物质的量,再结合V=nVm计算即可,难度不大.1年前查看全部
- 化学方程式.铁和硫酸锌溶液反应.镁和氯化银反应铝和硫酸亚铁溶液反应锌和硝酸汞溶液反应
 897571101年前2
897571101年前2 -
 香雪世界681025 共回答了16个问题
香雪世界681025 共回答了16个问题 |采纳率81.3%1.因为锌活动性比铁强不反映
2.因为氯化银沉淀也不反映
3.因为铝活动性比铁强不反映
4.Zn+2HgNO3=Zn(NO3)2+2Hg(这个不大确定)1年前查看全部
- 利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图所示(反应条件已略去):
利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图所示(反应条件已略去):
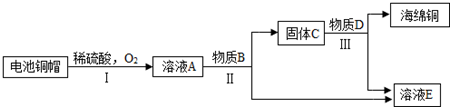
已知:2Cu+2H2SO4+O2
2CuSO4+2H2O△ .
(1)过程Ⅱ中加入的物质B为______.
(2)过程Ⅲ中有气体产生,反应的化学方程式为______.
(3)A~E中含铜、锌两种元素的物质有______(填字母序号及所含物质的化学式). 土鱼_1年前1
土鱼_1年前1 -
 雷橙cc 共回答了22个问题
雷橙cc 共回答了22个问题 |采纳率72.7%解题思路:根据转化流程可知,含Cu、Zn铜帽与稀硫酸和氧气反应生成了硫酸铜和硫酸锌的混合液A,依据实验的目的,为了得到铜和硫酸锌,应向A溶液加入过量的锌,通过过滤得到了硫酸锌溶液和铜锌的固体混合物C,为了得到铜和硫酸锌,应加入稀硫酸,然后结合题中的问题进行分析.通过分析转化流程可知,含Cu、Zn铜帽与稀硫酸和氧气反应生成了硫酸铜和硫酸锌的混合液A,依据实验的目的,为了得到铜和硫酸锌,应向A溶液加入过量的锌,通过过滤得到了硫酸锌溶液和铜锌的固体混合物C,为了得到铜和硫酸锌,应加入稀硫酸,所以
①过程Ⅱ的反应是锌与硫酸铜反应生成硫酸锌和铜,过程Ⅱ中加入的物质B为金属锌;
②过程Ⅲ中是稀硫酸与锌反应生成了硫酸锌和氢气,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑;
③通过上述分析可知,溶液A是硫酸铜和硫酸锌的混合物,固体C是铜和锌的混合物,所以,含铜、锌两种元素的物质有:A、C.
故答案为:
(1)金属Zn;
(2)Zn+H2SO4=ZnSO4+H2↑;
(3)A:CuSO4、ZnSO4C:Cu、Zn.点评:
本题考点: 物质的相互转化和制备;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,要熟记和理解金属的性质及用途、常见金属的特性及其应用等相关知识,然后结合题中的问题进行分析解答.1年前查看全部
- 将一根洁净的铁丝分别插入盛有①硫酸锌溶液、②稀盐酸、③硫酸铜溶液的试管中.
将一根洁净的铁丝分别插入盛有①硫酸锌溶液、②稀盐酸、③硫酸铜溶液的试管中.
(1)请按照顺序分别写出能反应的化学方程式①______②______属于______反应 ③______,观察到的现象为______.
(2)铁生锈就是铁与______、______发生复杂的化学变化,生成______色铁锈,防止钢铁制品生锈的办法有在表面涂保护膜:如自行车的车篓采用______、自行车链条采用______方法达到隔氧、隔水的目的而防锈.
(3)多数食品容易吸收空气中的水分变潮湿,并与空气中的氧气反应而***.生产上多在食品中放入一小包cao粉末 吸收水生成氢氧化钙,可使食品保持干燥:其反应的化学方程式是______;现已研究成功在食品中放入一小包铁粉(包裹在多孔泡沫中),铁粉吸收水分和氧气变为铁锈,从而保护食品.下列说法不正确的是______
a.生成的铁锈是一种混合物b.铁粉干燥剂能与水和氧气发生化学反应
c.cao保护食品的效果比铁粉好d.两种干燥剂袋上都要有明显的“误食”字样. 侯少子1年前1
侯少子1年前1 -
 青衫之交 共回答了15个问题
青衫之交 共回答了15个问题 |采纳率86.7%解题思路:(1)根据方程式的书写方法和反应类型判断、实验现象考虑;(2)根据铁生锈的条件和防止生锈的方法考虑;(3)根据方程式的书写,根据铁粉的成分进行分析;根据铁生锈的原理进行分析;根据氧化钙与铁粉的区别不同考虑;根据两者的产物进行分析.(1)①由于铁排在锌的后面,所以铁与硫酸锌不反应,②铁与盐酸反应生成氯化亚铁和氢气,用观察法配平,氢气后面标上上升符号,所以方程式是:Fe+2HCl═FeCl2+H2↑;一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应;③铁与硫酸铜反应生成硫酸亚铁和铜,所以方程式为:Fe+CuSO4═FeSO4+Cu;实验现象是:铁的表面附着着一层红色固体,溶液由蓝色变为浅绿色;
(2)铁生锈就是铁与氧气和水发生复杂的化学变化,生成红棕色铁锈;自行车的车篓采用刷漆的方法防止生锈,自行车链条采用涂油的方法防止生锈.
(3)反应物是氧化钙和水,生成物是氢氧化钙,所以方程式是:CaO+H2O═Ca(OH)2;
A、铁锈的主要成分为氧化铁,说明该物质是混合物,故A说法正确;
B、铁生锈实际是铁和氧气、水共同作用的结果,故B说法正确;
C、氧化钙和水生成氢氧化钙具有吸水性,铁粉既能吸收水分,也能消耗氧气,所以铁粉要比氧化钙保护食品效果好,故C说法错误;
D、氧化钙和水生成的氢氧化钙有腐蚀性,铁也不能过量食用,故D说法正确.
故选C.
故答案为:(1)①不能反应;
②Fe+2HCl═FeCl2+H2↑;置换;
③Fe+CuSO4═FeSO4+Cu;铁的表面附着着一层红色固体,溶液由蓝色变为浅绿色;
(2)氧气;水;红棕;刷漆;涂油;
(3)CaO+H2O═Ca(OH)2;C.点评:
本题考点: 金属的化学性质;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要熟悉化学方程式的书写方法,要掌握实验现象与变化之间的关系,只有这样才能对问题做出正确的判断.1年前查看全部
大家在问
- 1·一列火车从甲地开往乙地的时间,由原来的25小时减少到20小时.这列火车的速度提高了百分之几?
- 2有一根绳子,第一次剪了一半又1米,第二次剪了余下的一半又1米,剩1米.问一共有多少米?
- 3将同温同压下对氢气的相对密度为4.25的氮气和氢气的混合气体通入密闭容器中,在一定条件下反应生成氨气...
- 4描写祖国美好的诗词
- 5温度是物体内所有分子热运动的平均动能的标志
- 6置于水平转盘边缘的物体,当转动的角速度增大时,物体离开圆盘沿切线方向飞出
- 7一个在圆盘上做匀速圆周运动的物体,为什么其向心力是由它的摩擦力提供
- 8由氢元素氮元素氧元素硫元素组成的化合物的化学式是什么
- 9写出一个由氢.氮.氧.硫组成的化合物的化学式
- 10由铝,氮气、氧组成的化合物的化学式
- 11描写祖国的诗句知道的+969275225
- 12这词怎么读,第几声?媲美
- 13描写故乡的诗句
- 14红黄两只甲虫沿一条路同向爬行,红甲虫每小时爬9米,黄甲虫第一小时爬2米,第二小时爬4米,
- 15一氧化氮与二氧化硫的反应方程式快
