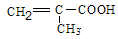T ℃时,将6 mol CO 2 和8 mol H 2 充入2 L密闭容器中,发生反应CO 2 (g)+3H 2 (g)
 lhmshy2022-10-04 11:39:541条回答
lhmshy2022-10-04 11:39:541条回答| T ℃时,将6 mol CO 2 和8 mol H 2 充入2 L密闭容器中,发生反应CO 2 (g)+3H 2 (g) 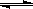 CH 3 OH(g)+H 2 O(g),容器中H 2 的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H 2 的物质的量随时间的变化。下列说法正确的是 CH 3 OH(g)+H 2 O(g),容器中H 2 的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H 2 的物质的量随时间的变化。下列说法正确的是
|

已提交,审核后显示!提交回复
共1条回复
 apple717621 共回答了18个问题
apple717621 共回答了18个问题 |采纳率77.8%- A
- 1年前
相关推荐
- 2.3g某有机物A完全燃烧后,生成0.1 mol CO 2 和 2.7gH 2 O,测得该化合物的蒸气与空气的相对密度是
2.3g某有机物A完全燃烧后,生成0.1 mol CO 2 和 2.7gH 2 O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
 w79201361年前1
w79201361年前1 -
 lenaray 共回答了20个问题
lenaray 共回答了20个问题 |采纳率95%(1)求2.3g该有机物中组成元素的质量:
C: C → CO 2
12 44
m(C) 44g/mol×0.1mol

=1.2g
H: 2H → H 2 O
2 18
m(H) 2.7g
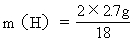
=0.3g
m(C)+m(H)=1.2g+0.3g=1.5g<2.3g
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量
(2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:

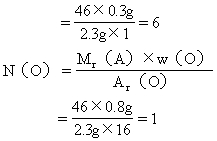
答:该有机物的分子式是C 2 H 6 O。
根据实验,该有机物燃烧的产物只有CO 2 和H 2 O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身。因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断。该有机物的相对分子质量,则可以利用实验测出的相对密度来求。1年前查看全部
- 已知充分燃烧a g乙炔(C 2 H 2 )气体时生成1 mol CO 2 气体和液态水,并放出热量b kJ,则乙炔燃烧的
已知充分燃烧a g乙炔(C 2 H 2 )气体时生成1 mol CO 2 气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.2C 2 H 2 (g)+5O 2 (g)=4CO 2 (g)+2H 2 O(l)ΔH=-4b kJ·mol -1 B.C 2 H 2 (g)+  O 2 (g)=2CO 2 (g)+H 2 O(l)ΔH=2b kJ·mol -1
O 2 (g)=2CO 2 (g)+H 2 O(l)ΔH=2b kJ·mol -1 C.2C 2 H 2 (g)+5O 2 (g)=4CO 2 (g)+2H 2 O(l)ΔH=-2b kJ·mol -1 D.2C 2 H 2 (g)+5O 2 (g)=4CO 2 (g)+2H 2 O(l)ΔH=-b kJ·mol -1  ummuu1年前1
ummuu1年前1 -
 找抽茶花烟的你 共回答了15个问题
找抽茶花烟的你 共回答了15个问题 |采纳率86.7%A
1年前查看全部
- 下列各组物质中,其分子数一定相同的是 A.1 g H 2 和8 g O 2 B.1 mol CO和22.4 L CO 2
下列各组物质中,其分子数一定相同的是
A.1 g H 2 和8 g O 2 B.1 mol CO和22.4 L CO 2 C.标准状况下,1.12 L N 2 和2.24 L He D.常温常压下,16 g O 2 和0.5 mol N 2  sandfox1191年前1
sandfox1191年前1 -
 地图龟负出 共回答了9个问题
地图龟负出 共回答了9个问题 |采纳率88.9%D
A、不正确,分子数之比为(1/2):(8/32)=2:1;B、22.4 L CO 2 的状态末知;C、分子数之比为1:2;D正确,选D。1年前查看全部
- 已知2H2(g)+O2(g)==2H2O(l) △H=-571.6KJ/mol CO(g)+1/2O2(g)==CO2(
已知2H2(g)+O2(g)==2H2O(l) △H=-571.6KJ/mol CO(g)+1/2O2(g)==CO2(g) △H=-283KJ/mol
某H2和CO的混合气体完全燃烧放出113.74KJ的热量,同时生成3.6g的液态水,求原混合气体中H2和CO的物质的量.
提问:这个题我是这样做的啊 3.6g液态水是0.2mol根据第一个反应方程式可以看到氢气反应了0.2mol 也就是放出57.16kj的热量是吧 然后113.74-57.16=56.58kj 然后我用56.58除283 再算出co反应了几mol 这样做对不对 为什么算不出数算的是0.1999几 啊我做错了吗 abclihenglin1年前2
abclihenglin1年前2 -
 ougia 共回答了18个问题
ougia 共回答了18个问题 |采纳率83.3%算对了,应当是近似为0.2mol1年前查看全部
- 2mol CO(NH2)2所含的原子数和多少克H2O所含原子数相同?
 wanbu0031年前2
wanbu0031年前2 -
 shenmedexiatian 共回答了15个问题
shenmedexiatian 共回答了15个问题 |采纳率93.3%2molCO(NH2)2所含的原子数是2X8=16mol
16mol/3=5.33mol ,即5.33mol的H2O
5.33molX18g/mol=96g,即是96g的水1年前查看全部
- 下列说法正确的是 A.0.25 mol CO 2 B.1 mol小麦含有6.02×10 23 个麦粒 C.1 mol 氧
下列说法正确的是
A.0.25 mol CO 2 B.1 mol小麦含有6.02×10 23 个麦粒 C.1 mol 氧 D.0.5 mol H 2 含有 3.01×10 23 个氢原子  定安木子1年前1
定安木子1年前1 -
 linyueqing1986 共回答了20个问题
linyueqing1986 共回答了20个问题 |采纳率90%A
1年前查看全部
- 某温度下,将1 mol CO和3 mol H2充入1 L的密闭容器中,充分反应后,达到平衡时 c(C0) =0.1 mo
某温度下,将1 mol CO和3 mol H2充入1 L的密闭容器中,充分反应后,达到平衡时 c(C0) =0.1 mol/L.若保持温度和体积不变,将起始物质的物质的量改为A mol CO、b mol H2 ,c mol CH3OH,欲使开始时该反应向逆反应方向进行,c的取值范围是_________.反应式是co(g)+2H2(g)=ch3oh(g)
 cc的cc1年前1
cc的cc1年前1 -
 fert 共回答了22个问题
fert 共回答了22个问题 |采纳率72.7%平衡时
CO(g)+2H2(g)=CH3OH(g)
0.1 1.2 0.9
因为体积不变,反应要逆向进行,所以CH3OH的物质的量一定要大于0.9mol,若反应进行完全,CO完全反应,则应该生成CH3OH1mol,这是极限情况.
所以c的取值范围是0.91年前查看全部
- 2mol co(NH2)2 所含H原子数跟多少克H2O所含原子数相同?我刚开始学啦求解答
 王先进1年前1
王先进1年前1 -
 lovefy5242 共回答了21个问题
lovefy5242 共回答了21个问题 |采纳率95.2%由于原子数与物质的量成正比(这你知道吧),所以我们只要看物质的量
2mol co(NH2)2 所含H原子的物质的量为2mol×4=8mol所以水中也要有8molH,即需要4mol水1年前查看全部
- 下列关于燃烧热的描述中正确的是( ) A.已知a g乙烯气体充分燃烧时生成1 mol CO 2 和液态水,放出b kJ
下列关于燃烧热的描述中正确的是( )
A.已知a g乙烯气体充分燃烧时生成1 mol CO 2 和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C 2 H 4 (g)+6O 2 (g)=4CO 2 (g)+4H 2 O(l) ΔH=-4b kJ·mol -1 B.将甲醇蒸气转化为氢气的热化学方程式是CH 3 OH(g)+  O 2 (g)=CO 2 (g)+2H 2 (g) ΔH=-192.9 kJ·mol -1 ,则CH 3 OH(g)的燃烧热为192.9 kJ·mol -1
O 2 (g)=CO 2 (g)+2H 2 (g) ΔH=-192.9 kJ·mol -1 ,则CH 3 OH(g)的燃烧热为192.9 kJ·mol -1 C.H 2 (g)的燃烧热是285.8 kJ·mol -1 ,则2H 2 O(g)=2H 2 (g)+O 2 (g) ΔH=+571.6 kJ·mol -1 D.葡萄糖的燃烧热是2800kJ·mol -1 ,则  C 6 H 12 O 6 (s)+3O 2 (g)=3CO 2 (g)+3H 2 O(l) ΔH=-1400kJ·mol -1
C 6 H 12 O 6 (s)+3O 2 (g)=3CO 2 (g)+3H 2 O(l) ΔH=-1400kJ·mol -1  谭果果1年前1
谭果果1年前1 -
 rohan 共回答了22个问题
rohan 共回答了22个问题 |采纳率100%D
1年前查看全部
- 有五种物质是①6 g H 2 ②0.5 mol CO 2 ③1.204×10 个氯化氢分子④147 g硫酸
有五种物质是①6 g H 2 ②0.5 mol CO 2 ③1.204×10
 个氯化氢分子④147 g硫酸
个氯化氢分子④147 g硫酸
⑤92 g乙醇(C 2 H 5 OH),它们的物质的量最大的是 ,所含分子数最多的是 ,含有原子个数最多的是 ,质量最大的是 。 wang1xiaofeng1年前1
wang1xiaofeng1年前1 -
 吴地一棵树 共回答了19个问题
吴地一棵树 共回答了19个问题 |采纳率89.5%① ① ⑤ ④
首先“见量化摩”,以物质的量为核心再进行转换。
①n(H 2 )="3" mol
②n(CO 2 )="0.5" mol
③n(HCl)="2" mol
④n(H 2 SO 4 )="1.5" mol
⑤n(C 2 H 5 OH)="2" mol
所以物质的量最大的是①。因物质的量越大,所含分子数越多,所以所含分子数最多的也是①。
①~⑤含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,故含原子个数最多的是⑤。
经计算可知质量最大的是④。1年前查看全部
- H2(g)+1/2O2(g)=H2O(l) 焓变= -282.8KJ/mol CO(g)+1/2O2(g)=CO2(g)
H2(g)+1/2O2(g)=H2O(l) 焓变= -282.8KJ/mol CO(g)+1/2O2(g)=CO2(g) 焓变= -282.9KJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(l),并放出114.3KJ热量,则混合气体中CO的物质的量为
A.0.22mol B. 0.15mol C.0.1mol D.0.05mol 笔划过的痕迹1年前2
笔划过的痕迹1年前2 -
 63925441 共回答了18个问题
63925441 共回答了18个问题 |采纳率100%先根据水求出H2的量 5.4/18=0.3mol 0.3molH2O 就是由0.3molH2燃烧得到,因此放热为0.3x282.8=84.84KJ 那么CO放出的热为 114.3-84.84=29.46KJ 所以参加反应的CO为
29.46/282.9=0.1mol1年前查看全部
- 下列叙述正确的是( ) A.1 mol CO 2 的质量为44g/mol B.CO 2
下列叙述正确的是( ) A.1 mol CO 2 的质量为44g/mol B.CO 2 的摩尔质量为44g C.64g氧气中含有2mol氧 D.N A 个CO 2 的质量(以g为单位)与CO 2 的相对分子质量在数值上相同  zhenjieli1年前1
zhenjieli1年前1 -
 怕鼠猫 共回答了19个问题
怕鼠猫 共回答了19个问题 |采纳率84.2%A、1 mol CO 2 的质量为44g,故A错误;
B、CO 2 的摩尔质量为44g/mol,故B错误;
C、64g氧气的物质的量为2mol,含有2mol氧气分子,故C错误;
D、N A 个CO 2 的物质的量为1mol,质量为44g,CO 2 的相对分子质量为44,两者在数值上相同,故D正确;
故选:D.1年前查看全部
- )已知:C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol CO(g)+1/2O2(g)== CO
)已知:C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol CO(g)+1/2O2(g)== CO2(g) △H= -283kJ/mol
)已知:C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol
CO(g)+1/2O2(g)== CO2(g) △H= -283kJ/mol
则1 mol C(s)与O2(g)反应生成CO(g)的热化学方程式为 骑游兵1年前2
骑游兵1年前2 -
 霜河GG 共回答了18个问题
霜河GG 共回答了18个问题 |采纳率100%C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol ①
CO(g)+1/2O2(g)== CO2(g) △H= -283kJ/mol ②
①-②得:
C(s)+1/2O2(g)=CO(g) △H= -110.5kJ/mol1年前查看全部
- 有五种物质① 0.5 mol CO 2 , ② 6 g H 2 ,③ 10 ml H 2 O,④ 1.024×10 24
有五种物质① 0.5 mol CO 2 , ② 6 g H 2 ,③ 10 ml H 2 O,④ 1.024×10 24 个HCl,⑤147 g H 2 SO 4 ,它们中物质的量最大的是_________,所含分子数最多的是_______,含有原子数最多的是___________,质量最大的是_____________。(用序号填空)
 Anboni1年前1
Anboni1年前1 -
 才才2007 共回答了17个问题
才才2007 共回答了17个问题 |采纳率94.1%②,②,⑤,⑤
1年前查看全部
- 在一定条件下,将1 mol CO和1 mol水蒸气通入容器中发生下述反应:CO+H 2 O CO 2 +H 2 ,达到平
在一定条件下,将1 mol CO和1 mol水蒸气通入容器中发生下述反应:CO+H 2 O
 CO 2 +H 2 ,达到平衡后,测得CO 2 0.6 mol;再通入0.3 mol水蒸气,又达到平衡后,CO 2 的物质的量为
CO 2 +H 2 ,达到平衡后,测得CO 2 0.6 mol;再通入0.3 mol水蒸气,又达到平衡后,CO 2 的物质的量为A.0.7mol B.0.8mol C.0.6mol D.0.9mol  爱艾蓝咖啡1年前1
爱艾蓝咖啡1年前1 -
 smallpanda_2000 共回答了10个问题
smallpanda_2000 共回答了10个问题 |采纳率100%A
第一次平衡后再通入0.3 mol水蒸气平衡向右移动,达新平衡时二氧化碳的物质的量一定大于0.6摩尔,故排除答案C;依平衡移动原理0.3 mol水蒸气不会全部转化为二氧化碳及氢气,从而排除答案D;又依平衡移动原理知新平衡下的反应物转化率一定小于前次平衡的转化率,而第一次平衡时水蒸气的转化率为百分之六十,按此计算0.3*60/100=1.8摩尔,0.6+1.8=7.8摩尔,而达新平衡时二氧化碳的物质的量应小于7.8摩尔,排除B,而选A。1年前查看全部
- 某有机物A与氢气的相对密度是38,取有机物A 7.6 g完全燃烧后,生成0.2 mol CO 2 和0.2 mol H
某有机物A与氢气的相对密度是38,取有机物A 7.6 g完全燃烧后,生成0.2 mol CO 2 和0.2 mol H 2 O。此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应。
下列有关A的说法中不正确的是()A.A的分子式为C 2 H 4 O 3 B.A的结构简式为HO—CH 2 —COOH C.A分子中的官能团有两种 D.1 mol A与足量的单质Na反应时放出H 2 的物质的量为0.5 mol  simonluo0091年前1
simonluo0091年前1 -
 郁蓝默墨 共回答了12个问题
郁蓝默墨 共回答了12个问题 |采纳率100%D
1年前查看全部
- 向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应CO+H2 O(g)=CO2+H2(可逆)
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应CO+H2 O(g)=CO2+H2(可逆)
若维持容器的体积和温度不变,起始物质按下列配比充入容器中:0.5molCO+2molH2O(g)+1molCO2+1molH2.
为什么等价转换后CO的物质的量为1.5mol而不是2.5mol;H2O的物质的量为3mol,而不是4mol 冰尘1年前2
冰尘1年前2 -
 艾隆 共回答了18个问题
艾隆 共回答了18个问题 |采纳率88.9%CO+H2 O(g)=CO2+H2
依照此方程式可以知道该化学反应发生时,所有的物质的化学计量数均为一.将CO2和H2等效为方程式左边的CO和H2O时计量数仍然为1mol.可以认为1mol的CO2和1molH2反应生成1mol CO和 1molH2O.再加上原来体系中就有的0.5molCO和2molH2O就为1.5mol CO和3molH2O1年前查看全部
- 1 mol C(石墨)完全燃烧生成CO2气体,放热393.5 kJ,1 mol CO完全燃烧生成CO2气体放热283.0
1 mol C(石墨)完全燃烧生成CO2气体,放热393.5 kJ,1 mol CO完全燃烧生成CO2气体放热283.0 kJ,下列说法正确
A,在25℃,105 Pa时,C(石墨)燃烧生成CO气体的热化学方程式是:
2C(石墨) + O2(气) = 2CO(气) ;△H=-110.5 kJ/mol
B,C(石墨)不完全燃烧,生成CO2和CO混合气体时,放热283.0 kJ
C,C(石墨)和CO2(气)反应生成CO(气)的反应是吸热反应
D,如果金刚石的燃烧热大于石墨的燃烧热,则可以断定从石墨转变为金刚石的变化需要放热.
求怎么从已知推出B、C选项的正误.
那么C项到底要如何推出呢? 多情子爵1年前1
多情子爵1年前1 -
 shinan55 共回答了14个问题
shinan55 共回答了14个问题 |采纳率100%B 选项 :如果是CO和CO2的混合气体放热一定大于(不能等于)283.0kj
C 选项 :你要明白方程式的反应次序,只要O2充足的时候不会有CO的产生(一点也没有),当O2的mol和C的mol不能达到1:1时(O2少的时候),才有C+CO2=2CO这个事实.
楼主,反应过程不是简单的方程式相加减,你补充的那个式子是不存在的.
C 选项 : C+CO2=2CO (条件高温缺氧)1年前查看全部
- 1 mol某气态烃燃烧时生成1 mol CO 2 、3 mol CO、3 mol H 2 O,若该烃只能与Br 2 按1
1 mol某气态烃燃烧时生成1 mol CO 2 、3 mol CO、3 mol H 2 O,若该烃只能与Br 2 按1∶1物质的量之比发生加成反应,则关于该烃的叙述中正确的是 [ ]A.分子式为C 4 H 6
B.可能是炔烃或二烯烃
C.只可能是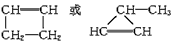
D.无法确定 飞鸽20081年前1
飞鸽20081年前1 -
 大眼睛可可 共回答了14个问题
大眼睛可可 共回答了14个问题 |采纳率100%AC1年前查看全部
- 标准状况下,44.8L CO(一氧化碳)为多少mol CO,质量为多少g?rt
 阿发70991年前2
阿发70991年前2 -
 rr上了谁 共回答了19个问题
rr上了谁 共回答了19个问题 |采纳率89.5%标准情况下,1mol的CO体积为22.4,因此44.8LCO为2mol,CO的摩尔质量是28g/mol,因此,2molCO质量为56g1年前查看全部
- 下列说法正确的是( )A.已知1 mol NO2和1 mol CO反应生成CO
下列说法正确的是( )
A.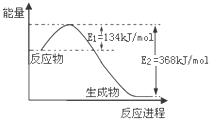 已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图,则NO和CO2反应的热化学方程式为NO (g)+CO2 (g)=CO (g)+NO2 (g)△H=-234kJ/mol
已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图,则NO和CO2反应的热化学方程式为NO (g)+CO2 (g)=CO (g)+NO2 (g)△H=-234kJ/mol
B.一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
当醋酸浓度为0.1mol•L-1时,求得该温度下醋酸的电离度为1%,且随着醋酸浓度增大,醋酸的电离常数逐渐减小醋酸浓度(mol•L-1) 1 0.1 0.01 pH 2.50 3.00 3.50
C.甲烷和乙醇的燃烧热分别是891.0 kJ•mol-1、1366.8 kJ•mol-1,利用乙醇更“低碳”
D.向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使C(H+)/c(CH3COOH)值增大 每人在家1年前1
每人在家1年前1 -
 vincentqian 共回答了21个问题
vincentqian 共回答了21个问题 |采纳率85.7%解题思路:A、据图象分析,NO2和 CO反应生成CO2和NO过程放热,则其逆反应吸热;
B、弱电解质的电离平衡常数只受温度影响,与浓度无关;
C、据分子中含C原子数的多少分析;
D、醋酸是弱酸,存在电离平衡,从影响其电离平衡移动的方面考虑.A、NO2和 CO反应生成CO2和NO过程放热,则其逆反应吸热,应为NO (g)+CO2 (g)=CO (g)+NO2 (g)△H=234kJ/mol,故A错误;
B、弱电解质的电离平衡常数只受温度影响,与浓度无关,随着醋酸浓度增大,醋酸的电离常数不变,故B错误;
C、从分子中C原子多少分析,生成相同量的二氧化碳,甲烷放热多,故C错误;
D、若使C(H+)/c(CH3COOH)值增大,可加水稀释使平衡正向移动,也可以直接加入酸,增大氢离子浓度,故D正确;
故选D.点评:
本题考点: 反应热和焓变;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了放热反应的逆反应吸热、电离平衡常数的影响因素、燃烧热、弱电解质的电离平衡,题目难度不大.1年前查看全部
- 2MOL CO(NH2)2中含_____MOL的炭原子,多少的氧原子,多少的氢原子,多少的氮原子,所含氧原子数跟____
2MOL CO(NH2)2中含_____MOL的炭原子,多少的氧原子,多少的氢原子,多少的氮原子,所含氧原子数跟_____MOL水所含的氧原子数相同.
 无奈10001年前4
无奈10001年前4 -
 小小臭屁虫 共回答了11个问题
小小臭屁虫 共回答了11个问题 |采纳率100%因为每个CO(NH2)2分子中含有1个碳原子C,1个氧原子O,2*2=4个氢原子H,2*1个氮原子N.所以2MOL CO(NH2)2中含2 MOL的炭原子,2 MOL的氧原子,8 MOL的氢原子,4 MOL的氮原子.
每个水H2O分子与每个CO(NH2)2分子所含有的氧原子相同,都是1个.故2MOL CO(NH2)2中所含氧原子数跟2MOL水所含的氧原子数相同.1年前查看全部
- 下列说法中,正确的是( )A.CO2的摩尔质量为44 gB.标准状况下,1 mol CO
下列说法中,正确的是( )
A.CO2的摩尔质量为44 g
B.标准状况下,1 mol CO2所占的体积约是22.4 L
C.1 mol N2的质量是14 g
D.将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L huxianhao1年前1
huxianhao1年前1 -
 wanglingzhihua 共回答了26个问题
wanglingzhihua 共回答了26个问题 |采纳率92.3%解题思路:A.二氧化碳的摩尔质量为44g/mol;
B.标准状况下,气体摩尔体积为22.4L/mol,据此判断;
C.氮气的摩尔质量为28g/mol,根据m=nM计算判断;
D.40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液中NaOH的物质的量浓度为1 mol/L.A.二氧化碳的摩尔质量为44g/mol,1mol二氧化碳的质量为44g,故A错误;
B.标准状况下,气体摩尔体积为22.4L/mol,1 mol CO2所占的体积约是22.4 L,故B正确;
C.1 mol N2的质量是14 g=1mol×28g/mol=28g,故C错误;
D.40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液中NaOH的物质的量浓度为1 mol/L,体积1L是指溶剂的体积,不是溶液的体积,故D错误;
故选B.点评:
本题考点: 摩尔质量;气体摩尔体积;物质的量浓度.
考点点评: 本题考查摩尔质量、气体摩尔体积、物质的量浓度等,比较基础,注意对概念的理解掌握.1年前查看全部
- 在一个体积为2L的容器中,充入4mol CO和4mol H2O,一段时间后反应CO(g)+H2O(g
在一个体积为2L的容器中,充入4mol CO和4mol H2O,一段时间后反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在密闭容器中达到了平衡状态.平衡后c[CO2]=1.8mol•L-1,则该温度下此反应的平衡常数K为( )
A. 27
B. 36
C. 54
D. 81 fengxietao1年前1
fengxietao1年前1 -
 全球英语594 共回答了18个问题
全球英语594 共回答了18个问题 |采纳率94.4%解题思路:化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数k=
,根据三段式计算出平衡时各组分的平衡浓度,代入平衡常数表达式计算.c(CO2)•c(H2) c(CO)•c(H2O) 平衡后c(CO2)=1.8mol•L-1,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol/L):2 2 0 0
变化(mol/L):1.8 1.8 1.8 1.8
平衡(mol/L):0.20.21.81.8
故该温度下平衡常数k=
c(CO2)•c(H2)
c(CO)•c(H2O)=[1.8×1.8/0.2×0.2]=81,
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡常数的有关计算,难度不大,注意三段式解题法的利用,书写化学平衡常数是关键.1年前查看全部
- (8分)为了测定某有机物A的结构,做如下实验:①将2.3 g该有机物完全燃烧,生成0.1 mol CO 2 和2.7 g
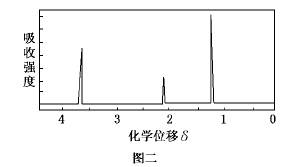
(8分)为了测定某有机物A的结构,做如下实验:①将2.3 g该有机物完全燃烧,生成0.1 mol CO 2 和2.7 g水;②用质谱仪测定其相对分子质量,得如图一所示的质谱图;③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1:2:3。试回答下列问题:

(1)有机物A的相对分子质量是 ________ 。
(2)有机物A的实验式是 ________ 。
(3)能否根据A的实验式确定A的分子式 ________ (填“能”或“不能”),若能,则A的分子式是 ________ (若不能,则此空不填)。
(4)写出有机物A可能的结构简式 ________ 。 sunliang721年前1
sunliang721年前1 -
 a6331060 共回答了23个问题
a6331060 共回答了23个问题 |采纳率69.6%(共8分) (1)46 (2分) (2)C 2 H 6 O (2分)
(3)能(1分) C 2 H 6 O(1分) (4)CH 3 CH 2 OH(2分)
略1年前查看全部
- 已知有机物A由C、H、O三种元素组成,取1 mol 充分燃烧生成4 mol CO 2 和54 g H 2 O,A 的相对
已知有机物A由C、H、O三种元素组成,取1 mol 充分燃烧生成4 mol CO 2 和54 g H 2 O,A 的相对分子质量为86。回答下列问题:
(1)A物质的分子式是 。
(2)A物质符合下列条件:
① 能与Br 2 的CCl 4 溶液发生化学反应使其褪色;② 能与NaHCO 3 溶液反应放出CO 2 气体;
符合上述要求的A有多种,其结构简式分别是 。(不要求顺反异构与立体异构) qglny01年前1
qglny01年前1 -
 天使翅膀8023 共回答了19个问题
天使翅膀8023 共回答了19个问题 |采纳率89.5%1年前查看全部
- 在一个体积为2L的容器中,充入4mol CO和4mol H 2 O,一段时间后反应CO(g)+H 2
在一个体积为2L的容器中,充入4mol CO和4mol H 2 O,一段时间后反应CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)在密闭容器中达到了平衡状态.平衡后C[CO 2 ]=1.8mol•L -1 ,则该温度下此反应的平衡常数K为( ) A.27 B.36 C.54 D.81  我们的目标很简单1年前1
我们的目标很简单1年前1 -
 kennethkwg 共回答了17个问题
kennethkwg 共回答了17个问题 |采纳率88.2%平衡后c(CO 2 )=1.8mol•L -1 ,则:
CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)
开始(mol/L):2 2 0 0
变化(mol/L):1.8 1.8 1.8 1.8
平衡(mol/L):0.20.21.81.8
故该温度下平衡常数k=
c(C O 2 )•c( H 2 )
c(CO)•c( H 2 O) =
1.8×1.8
0.2×0.2 =81,
故选D.1年前查看全部
- 已知298K时,有下列反应:C(s) + O2(g)=C O2(g) ;△r1HmΘ=-393.51kJ/mol CO(
已知298K时,有下列反应:C(s) + O2(g)=C O2(g) ;△r1HmΘ=-393.51kJ/mol CO(g) + O2(g)= C O2(g) ; △r3Hm
已知298K时,有下列反应:C(s) + O2(g)=C O2(g) ;△r1HmΘ=-393.51kJ/mol
x09CO(g) + O2(g)= C O2(g) ; △r3HmΘ=-282.99 kJ/mol,求反应C(s) + O2(g) = CO
x09的△r2HmΘ nfsgl1年前1
nfsgl1年前1 -
 猪头67515013 共回答了24个问题
猪头67515013 共回答了24个问题 |采纳率83.3%本题可以用盖斯定律来求解
C(s) + O2(g)=C O2(g) ;△r1HmΘ=-393.51kJ/mol……①
CO(g) + 1/2O2(g)= C O2(g) ; △r3HmΘ=-282.99 kJ/mol……②
因为方程①-方程②为C(s) + 1/2O2(g) = CO
所以该反应的△r2HmΘ=-393.51+282.99 =-110.16kJ/mol1年前查看全部
- 将6 mol H 2 和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
将6 mol H 2 和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2 H 2 (g) + CO(g)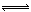 CH 3 OH(g),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,
CH 3 OH(g),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,
求:(1)H 2 的反应速率;(2)CO的转化率。 落日红颜1年前1
落日红颜1年前1 -
 巧克力小毛头 共回答了17个问题
巧克力小毛头 共回答了17个问题 |采纳率88.2%(1)1.2 mol·(L·s) —1 (2)60%
1年前查看全部
- 在一定温度下将1 mol CO和1 mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H 2 O(g) CO
在一定温度下将1 mol CO和1 mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g)达平衡后,得到0.6 mol CO 2 ;再通入0.3 mol水蒸气,达到新平衡状态后,CO 2 的物质的量可能是( )
CO 2 (g)+H 2 (g)达平衡后,得到0.6 mol CO 2 ;再通入0.3 mol水蒸气,达到新平衡状态后,CO 2 的物质的量可能是( )A.0.9 mol B.0.8 mol C.0.7 mol D.0.6 mol  儿时情景1年前1
儿时情景1年前1 -
 lscc9 共回答了19个问题
lscc9 共回答了19个问题 |采纳率94.7%C
根据平衡时生成0.6molCO 2 可知,水蒸气的转化率是60%。再加入0.3mol水蒸气,则平衡向正反应方向进行,因此CO 2 的物质的量大于0.6mol,但水蒸气的转化率降低,所以平衡时生成的CO 2 最多是0.6×1.3mol=7.8mol,因此答案选C。1年前查看全部
- 将2 MOL CO和6MOL H2通入2L密闭容器中平衡后CH3OH浓度为0.5,再通入1 MOL CO 和4 MOL
将2 MOL CO和6MOL H2通入2L密闭容器中平衡后CH3OH浓度为0.5,再通入1 MOL CO 和4 MOL H2,X MOL CH3OH 要使平衡不逆向移动,X的范围怎么算 答案是大于等于0小于等于7
 灯火斑斓你在哪里1年前1
灯火斑斓你在哪里1年前1 -
 0o唯辛o0 共回答了23个问题
0o唯辛o0 共回答了23个问题 |采纳率95.7%反应:CO + 2H2 = CH3OH
起始:1mol/L 3mol/L 0
平衡:0.5mol/L 2mol/L 0.5mol/L
则:平衡常数K=0.5/(0.5×2的平方)=1/4
此时再加入1mol CO 和4mol H2和Xmol CH3OH ,则加入好的瞬间,c(CO)=1mol/L,c(H2)=4mol/L,c(CH3OH)=(0.5+X/2) mol/L,算得该时刻的浓度商Q=(0.5+X/2) /(1×4的平方),要使平衡不逆向移动,则要求Q≤K,即(0.5+X/2) /(1×4的平方) ≤ 1/4,从而可知:X ≤7,所以X的范围为:0 ≤ X≤71年前查看全部
- 1MOL CO 与1MOL CO2比较 正确的是 A 分子数相等 B原子数相等 C电子数相等 D 质子数相等
 茶暖心香1年前3
茶暖心香1年前3 -
 wuvs007 共回答了17个问题
wuvs007 共回答了17个问题 |采纳率76.5%A 分子数相等
物质的量相同 分子数相同1年前查看全部
- 1 mol甲烷在空气中完全燃烧/1 mol co在空气中完全燃烧要放热多少
1 mol甲烷在空气中完全燃烧/1 mol co在空气中完全燃烧要放热多少
请问:1mol甲烷在空气中完全燃烧要放出热量多少
1 mol co在空气中完全燃烧要放热多少
在加一个:2H2S+3O2=2H2O+2SO2(即硫化氢与氧气反应,1mol多少) 会计小男生1年前1
会计小男生1年前1 -
 paulinena 共回答了16个问题
paulinena 共回答了16个问题 |采纳率81.3%甲烷的燃烧热是 890kj/mol ,即燃烧1摩尔甲烷放出890KJ的热量.
CO的燃烧热是 283kj/mol ,即燃烧1摩尔CO放出283KJ的热量.1年前查看全部
- 1mol co和1mol co2是否具有相同的分子数和离子数
1mol co和1mol co2是否具有相同的分子数和离子数
原子数呢 lyq19821031年前1
lyq19821031年前1 -
 小小中 共回答了20个问题
小小中 共回答了20个问题 |采纳率90%具有相同的分子数 都不含有离子 不同的原子数1年前查看全部
- 在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下变化:CO(g)+H 2 O(g) CO 2 (g)+H
在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下变化:CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H 2 密度的
CO 2 (g)+H 2 (g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H 2 密度的A.5.75倍 B.11.5倍 C.30.67倍 D.46倍  李军文1年前1
李军文1年前1 -
 菲尼布贾 共回答了22个问题
菲尼布贾 共回答了22个问题 |采纳率86.4%B
1年前查看全部
- 高二化学第二章的问题6、在一定温度下,将1 mol CO和1mol水蒸气放入一固定容积的密闭容器中,发生反应CO(g)+
高二化学第二章的问题
6、在一定温度下,将1 mol CO和1mol水蒸气放入一固定容积的密闭容器中,发生反应
CO(g)+H2O (g) CO2(g)+H2(g),达平衡状态后,得到CO20.6 mol;再通入0.3 mol水
蒸气,达到新的平衡状态后,CO2的物质的量可能是( ).
A、0.9 mol B、0.8 mol C、0.7 mol D、0. 6 mol
请告诉我步骤 谢谢你们 遇到个为你哭的人1年前4
遇到个为你哭的人1年前4 -
 djwzhl 共回答了13个问题
djwzhl 共回答了13个问题 |采纳率84.6%选C
解法一:
1.原平衡H2O的转化率为60%
2.再加入0.3mol水后,水的转化率小于60%
0.3mol中最多转化:0.3*60%=0.18mol
3.平衡时的CO2小于0.6+0.18;大于0.6.
当选项有2个符合上面,而又是单项选的话!看下面的解法二!
解法二:
首先算出此温度下的反应平衡常数,因为容积固定,所以反应平衡常数与容积无关;
再通入0.3mol水蒸气相当于反应开始时向容器中通入1mol co和1.3mol水蒸气,由反应方程式和平衡常数可算出新平衡时co2的物质的量1年前查看全部
- 在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O……转化
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O……转化率?
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol.
如果继续向该平衡体系中通入1.0 mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率是?为什么? skynancy2081年前3
skynancy2081年前3 -
 WOAINIDESHIHOU 共回答了23个问题
WOAINIDESHIHOU 共回答了23个问题 |采纳率91.3%CO(g)+H2O(g) CO2(g)+H2(g)
起始 1 1 0 0
反应 x x x x
平衡 1-x 1-x x x
由已知得1-x = 0.5
x = 0.5
K = x^2/(1-x)^2 = 1
向该平衡体系中通入1.0 mol的H2O(g):
CO(g)+H2O(g) CO2(g)+H2(g)
起始 1 2 0 0
反应 y y y y
平衡 1-y 2-y y y
平衡时有K = y^2/[(1-y)(2-y)] = 1
得y = 2/3
所以达到新的平衡状态,则CO的转化率 = y/1 = 66.7%1年前查看全部
大家在问
- 1丙烯聚合常用何种溶剂?
- 2有机物CH3CH2C三CCH3为什么所有碳原子共平面?(2010全国卷I,30题5小题)
- 3在父亲的田野间1.试用简洁的语言概况文中父亲的形象2.文章的语言生动而蕴藉,请从AB任选一处加以赏析文章结尾说“夜,渐渐
- 4there is as much competition among countries to host the oly
- 5相同质量的钠镁铝和硫酸反应,消耗的硫酸的体积比是
- 6求二十道六年级上册数学难度题各位大哥大姐 急
- 7由于地形限制黑非洲地区的发展缓慢但东北非地区较早形成高度繁荣的古代文明,这得益于(单选)
- 8连用三个动词,写出自己在校园里快乐的学习和生活的惜景.
- 9六十厘米等多少毫米
- 10高二语文考试作文写不完,语文考试2个小时我做前面的题1个半小时,剩下半个小时写作文只写了400字能得多少
- 11脚气真菌喜欢酸性还是碱性
- 12英语助我成功.,我要写一篇英文的文章阿..题目是"英语助我成功"200字左右..大概就初中水平就可以了.不翻译!
- 13求以dy结尾的单词dy结尾的 比如 candy 有寓意一点的 谢谢~
- 14求详细解答:我会照样子写句子. 我会照样子写句子. 例:瓶子里的水渐渐升高了. 1.天气渐渐
- 15读伯乐相马里感受最深的句子是哪句