在25℃时,将0.1mol•L-1的HA溶液与0.1mol•L-1的NaOH溶液等体积混合后,测得混合溶液pH=8,则下
 猪城晚报2022-10-04 11:39:541条回答
猪城晚报2022-10-04 11:39:541条回答A.c(HA)+c(A-)=c(Na+)=0.1mol•L-1
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(Na+)>c(A-)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)

已提交,审核后显示!提交回复
共1条回复
 sisiflfl 共回答了11个问题
sisiflfl 共回答了11个问题 |采纳率90.9%- 解题思路:在25℃时,等体积等浓度的HA和NaOH溶液恰好反应生成NaA,测得混合溶液pH=8,说明NaA是强碱弱酸盐,根据电荷守恒和物料守恒判断.
在25℃时,等体积等浓度的HA和NaOH溶液恰好反应生成NaA,测得混合溶液pH=8,说明NaA是强碱弱酸盐,
A.混合溶液体积增大一倍,其浓度降为原来的一半,根据物料守恒得c(HA)+c(A-)=c(Na+)=0.05mol•L-1,故A错误;
B.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+),故B正确;
C.溶液呈碱性,则c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)>c(A-),溶液中以盐的电离为主,水解程度较弱,所以离子浓度大小顺序是c(Na+)>c(A-)>c(OH-)>c(H+),故C正确;
D.根据电荷守恒得c(Na+)+c(H+)=c(A-)+c(OH-),根据物料守恒得c(HA)+c(A-)=c(Na+),所以得c(OH-)=c(H+)+c(HA),故D正确;
故选:A.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了离子浓度大小的判断,根据盐溶液的酸碱性确定酸碱的相对强弱,再结合物料守恒和电荷守恒来分析解答,难度中等. - 1年前
相关推荐
- 现有物质的量浓度均为0.1mol•L-1的 ①NaOH溶液 ②Na2CO3溶液
现有物质的量浓度均为0.1mol•L-1的 ①NaOH溶液②Na2CO3溶液③CH3COONa溶液各25mL,下列说法正确的是( )
A. 3种溶液pH的大小顺序是 ①>②>③
B. 若将3种溶液稀释相同倍数,pH变化最大的是③
C. 若分别加入25mL0.1mol•L-1盐酸后,pH最大的是②
D. 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② Ψ黄孩儿Ψ1年前1
Ψ黄孩儿Ψ1年前1 -
 无法忘记的爱恋 共回答了14个问题
无法忘记的爱恋 共回答了14个问题 |采纳率71.4%解题思路:A.碱溶液pH最大,盐溶液中,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大;
B.稀释相同的倍数,促进含有弱离子盐的水解,pH变化最大的是强碱;
C.碳酸氢钠溶液呈碱性,醋酸溶液呈酸性;
D.pH相等的这三种溶液,强碱的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小.A.碱溶液pH最大,盐溶液中,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大,醋酸根离子水解程度小于碳酸根离子,所以这三种溶液pH大小顺序是:①>②>③,故A正确;
B.稀释相同的倍数,促进含有弱离子盐的水解,强碱完全电离,所以pH变化最大的是强碱①,故B错误;
C.若分别加入相同物质的量的HCl,HCl和NaOH恰好完全反应生成NaCl,溶液呈中性,碳酸钠和HCl恰好完全反应生成碳酸氢钠和氯化钠,溶液呈碱性,和醋酸钠恰好完全反应生成氯化钠和醋酸,溶液呈酸性,所以pH最大的是②,故C正确;
D.pH相等的这三种溶液,强碱的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小,醋酸根离子水解程度小于碳酸根离子,所以若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>②>①,故D错误;
故选AC.点评:
本题考点: 盐类水解的应用;pH的简单计算.
考点点评: 本题考查了pH的简单计算、盐类水解等知识点,明确弱酸根离子的水解程度与酸的酸性强弱的关系是解本题关键,再结合物质的性质分析解答,题目难度不大.1年前查看全部
- 用铁片与10mL 0.1mol•L-1硫酸反应制取氢气时,下列措施中不能使氢气生成速率加快的是( )
用铁片与10mL 0.1mol•L-1硫酸反应制取氢气时,下列措施中不能使氢气生成速率加快的是( )
A.加热
B.加入10mL 0.1mol•L-1硫酸
C.滴加少量CuSO4
D.不用铁片,改用铁粉 永飞1年前1
永飞1年前1 -
 participation 共回答了10个问题
participation 共回答了10个问题 |采纳率80%解题思路:增大反应速率可增大浓度、升高温度或增大固体的表面积,注意不能用浓硫酸,也可形成原电池反应,以此解答.A.加热,温度升高,活化分子百分数增加,反应速率增大,故A不选;
B.加入10mL 0.1mol•L-1硫酸,浓度不变,反应速率不变,故B选;
C.滴加少量CuSO4,铁置换出铜,形成原电池反应,加快反应速率,故C不选;
D.不用铁片,改用铁粉,固体表面积增大,反应速率增大,故D不选.
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.1年前查看全部
- (2012•广州二模)对于0.1mol•L-1 (NH4)2SO4溶液,下列说法正确的( )
(2012•广州二模)对于0.1mol•L-1 (NH4)2SO4溶液,下列说法正确的( )
A.溶液中存在电离平銜:(NH4)2SO4⇌NH4++SO42-
B.向溶液中滴加少量浓硫酸,c(NH4+ )、c( SO42-)均增大
C.加水稀释,溶液中所有离子的浓度均减小
D.溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H2O) 婷婷的狗狗1年前1
婷婷的狗狗1年前1 -
 xxieyying 共回答了20个问题
xxieyying 共回答了20个问题 |采纳率80%解题思路:A、强电解质能完全电离,用等号连接;
B、根据水解平衡移动知识来回答判断;
C、加水稀释对水解平衡起到促进作用,但是稀释过程会导致溶液体积增大;
D、根据溶液中的物料守恒知识来回答.A、硫酸铵是强电解质能完全电离,用等号连接,即(NH4)2SO4═NH4++SO42-,故A错误;
B、向溶液中滴加少量浓硫酸,电离出氢离子和硫酸根离子,其中氢离子对铵根离子的水解平衡NH4++H2O⇌NH3•H2O+H+产生抑制作用,所以c(NH4+)、c(SO42-)均增大,故B正确;
C、加水稀释对水解平衡NH4++H2O⇌NH3•H2O+H+起到促进作用,但是稀释过程会导致溶液体积增大,所以酸性减弱,但是氢氧根离子浓度会增大,故C错误;
D、该溶液中的物料守恒:2c(SO42-)=c(NH4+)+c(NH3•H2O),故D错误.
故选:B.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查学生影响盐的水解平衡移动的因素知识,注意越稀越水解规律的应用,难度不大.1年前查看全部
- 在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Y为0.2mol•L-1
B.Y2为0.35mol•L-1
C.X2为0.2mol•L-1
D.Z为0.4mol•L-1 路人霍元甲1年前1
路人霍元甲1年前1 -
 LY-tempo 共回答了20个问题
LY-tempo 共回答了20个问题 |采纳率95%解题思路:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)⇌2Z(气),
开始(mol/L):0.1 0.30.2
变化(mol/L):0.1 0.10.2
平衡(mol/L):0 0.20.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)⇌2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.40
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,故B正确、ACD错误.
故选B.点评:
本题考点: 化学反应的可逆性.
考点点评: 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法1年前查看全部
- 在密闭容器内进行下列反应:X2(g)+Y2(g)⇌2Z(g).已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0
在密闭容器内进行下列反应:X2(g)+Y2(g)⇌2Z(g).已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,当反应在一定条件下达到平衡时各物质的浓度不可能是( )
A. Z为0.3 mol•L-1
B. Y2为0.35 mol•L-1
C. X2为0.2 mol•L-1
D. Z为0.35 mol•L-1 我真的真的好困啊1年前1
我真的真的好困啊1年前1 -
 今天我蒙面 共回答了16个问题
今天我蒙面 共回答了16个问题 |采纳率93.8%解题思路:可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物不可能100%地全部转化为生成物;
全部转到一边,求算各物质浓度的取值范围,依此得出正确结论.Z全部转化时,X2的物质的量浓度为:0.1+[0.2/2]=0.2 mol•L-1,Y2的物质的量浓度为:0.3+[0.2/2]=0.4mol•L-1,故c(X2)的取值范围为:0<c(X2)<0.2 mol•L-1;当X2全部转化时,Z的物质的量浓度为:0.2+0.1×2=0.4mol•L-1,Y2的物质的量浓度为:0.3-0.1=0.2mol•L-1,故c(Y2)的取值范围为:0.2mol•L-1<c(Y2)<0.4 mol•L-1,c(Z)的取值范围为:0<c(Z)<0.4 mol•L-1;故
A.c(Z)的取值范围为:0<c(X2)<0.4 mol•L-1,故A正确;
B.0.2mol•L-1<c(Y2)<0.4 mol•L-1,故B正确;
C.0<c(X2)<0.2 mol•L-1,故C错误;
D.0<c(Z)<0.4 mol•L-1,故D正确,
故选C.点评:
本题考点: 化学反应的可逆性.
考点点评: 本题考查可逆反应的特点,难度不大.要注意对于可逆反应,反应物不可能100%地全部转化为生成物.1年前查看全部
- 对于0.1mol•L -1 的Na 2 S溶液,下列判断正确的是( ) A.溶液中阴离子浓度的大小顺序:c(S 2-
对于0.1mol•L -1 的Na 2 S溶液,下列判断正确的是( ) A.溶液中阴离子浓度的大小顺序:c(S 2- )>c(OH - )>c(HS - ) B.c(Na + )=2c(S 2- )+c(OH - )+c(HS - ) C.向Na 2 S溶液中加水稀释,其所有离子的浓度都减小 D.向溶液中加入少量NaOH固体,能促进水的电离  sky夜无崖1年前1
sky夜无崖1年前1 -
 zhangyong2000 共回答了19个问题
zhangyong2000 共回答了19个问题 |采纳率89.5%A.Na 2 S溶液存在S 2- +H 2 O⇌HS - +OH - ,HS - +H 2 O⇌H 2 S+OH - ,则有c(OH - )>c(HS - ),一般来说水解程度较小,则应有c(S 2- )>c(OH - )>c(HS - ),故A正确;
B.溶液存在电荷守恒,应有c(Na + )+c(H + )=2c(S 2- )+c(OH - )+c(HS - ),故B错误;
C.向Na 2 S溶液中加水稀释,c(OH - )降低,则c(H + )增大,故C错误;
D.向溶液中加入少量NaOH固体,c(OH - )增大,抑制水的电离,故D错误.
故选A.1年前查看全部
- 将25℃、100mL 0.1mol•L-1下列物质的水溶液加热至80℃(溶液体积变化忽略不计).溶液的pH保持
将25℃、100mL 0.1mol•L-1下列物质的水溶液加热至80℃(溶液体积变化忽略不计).溶液的pH保持不变的是( )
A. H2SO4
B. CH3COOH
C. (NH4)2SO4
D. NaOH onedaykiss1年前5
onedaykiss1年前5 -
 想天天 共回答了15个问题
想天天 共回答了15个问题 |采纳率100%解题思路:弱电解质的电离和盐类水解都是吸热反应,升高温度促进弱电解质电离和盐类水解,导致溶液中水的离子积常数增大,根据溶液中氢离子浓度变化来确定pH变化.A.硫酸是强电解质,在水溶液里完全电离,升高温度不影响硫酸电离,虽然促进水的电离,但水电离的程度小于硫酸电离的程度,则可以忽略,所以溶液中氢离子浓度基本不变,则pH不变,故A正确;
B.醋酸是弱电解质,升高温度促进醋酸电离,则溶液中氢离子浓度增大,pH减小,故B错误;
C.硫酸铵是强酸弱碱盐,铵根离子水解而使其溶液呈酸性,升高温度促进铵根离子水解,溶液中氢离子浓度增大,则溶液的pH减小,故C错误;
D.升高温度时NaOH溶液中氢氧根离子的浓度不变,但升高温度时水的离子积变大,则氢离子的浓度变大,故溶液的pH变小,故D错误;
故选A.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了pH的简单计算,明确温度对弱电解质的电离、盐类水解的影响是解本题关键,注意A和D选项的比较,升高温度导致水的离子积常数增大,根据溶液中氢离子浓度变化来判断即可,难度中等.1年前查看全部
- 在含有Cl-、Br-、I-的溶液中,已知其浓度均为0.1mol・L-1
在含有Cl-、Br-、I-的溶液中,已知其浓度均为0.1mol・L-1
已知氯化银、溴化银、碘化银的溶度积(mol2・L-2)分别为:1.6×10-10、、 4.1×10-15 、1.5×10-16.若向混合溶液中逐滴加入硝酸银溶液,
当AgCl沉淀开始析出时溶液中的Br- I-是否沉淀完全(小于1 .0*10^-5认为已沉淀完全)求过程啊拜托了 riot转圈圈1年前2
riot转圈圈1年前2 -
 a7386 共回答了11个问题
a7386 共回答了11个问题 |采纳率90.9%当开始有氯化银沉淀时,银离子的浓度为:Ksp(AgCl)/[Cl-]=1.6*10^-10/0.1=1.6*10^-9M,此时Br-的浓度:Ksp(AgBr)/[Ag+]=4.1*10^-15/1.6*10^-9是10^-6数量级的,所以沉淀完全了1年前查看全部
- 将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L
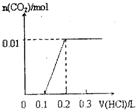
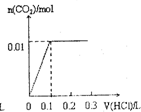
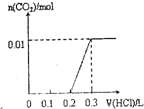
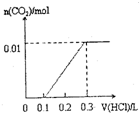
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.下列图象能正确表示加入盐酸的 kerk5551年前1
kerk5551年前1 -
 山神也 共回答了14个问题
山神也 共回答了14个问题 |采纳率71.4%第4个图,先和氢氧化钠反应 消耗0.1mol稀盐酸.再和碳酸钠反应消耗0.2mol稀盐酸1年前查看全部
- 实验室用密度为1.25g•mL-1,质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请
实验室用密度为1.25g•mL-1,质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为______.
(2)配制240mL 0.1mol•L-1的盐酸应量取浓盐酸体积______mL,应选用容量瓶的规格______mL.
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)______.
A.用30mL水洗涤______2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线______处
(4)操作A中,将洗涤液都移入容量瓶,其目的是______.
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线______.
②向容量瓶中转移溶液时不慎有溶液溅出______. duckgz1年前1
duckgz1年前1 -
 fjt007 共回答了29个问题
fjt007 共回答了29个问题 |采纳率93.1%解题思路:(1)依据C=[1000ρω/M]计算浓盐酸的物质的量浓度;
(2)依据溶液稀释前后所含溶质的物质的量不变计算需要浓盐酸的体积,依次选择合适的量筒;
(3)依据用浓溶液配置稀溶液的一般操作步骤解答;
(4)烧杯和玻璃棒上都沾有溶质,不全部转移到容量瓶中会造成误差;
(5)分析操作对溶质的物质的量、溶液的体积的影响,作出判断.(1)浓盐酸的物质的量浓度C=[1000×1.25g/ml×36.5%/36.5g/mol]=12.5mol/L;
故答案为:12.5mol/L;
(2)要配置240ml的溶液,应选择250ml的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L=250mL×0.1mol•L-1,解得V=2.0ml,所以需要选择5ml的量筒;
故答案为:2.0;5;
(3)浓溶液配置稀溶液的一般操作步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,
烧杯壁上沾有溶质,为防止引起误差,必须洗涤烧杯内壁2-3次;
定容时,开始时直接加入蒸馏水,为防止加水过量,到离刻度线2-3cm时改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:BCAFED;烧杯内壁;2-3ml;
(4)将洗涤液全部转移到容量瓶是因为避免溶质的量的减少,减小误差;
故答案为:避免溶质的量的减少,减小误差;
(5)①加蒸馏水时不慎超过了刻度线,实验失败,无法挽回,必须重新配置;
故答案为:重新配置;
②向容量瓶中转移溶液时不慎有溶液溅出,溶质的物质的量不准确,实验失败,必须重新配置;
故答案为:重新配置.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,明确配置原理和操作步骤是解题关键,注意量筒的选择方法.1年前查看全部
- 实验室配制480mL 0.1mol•L -1 的Na 2 CO 3 溶液,回答下列问题:
实验室配制480mL 0.1mol•L -1 的Na 2 CO 3 溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体______g,应选用______ m L的容量瓶.
(2)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的______.(填数字符号)
(3)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是______.(填写字母,每种仪器只能选择一次)
(4)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了______种用途.(填写数字)
(5)若实验时遇到下列情况,将使溶液的浓度偏低的是______.
A.配制前设有将容量瓶中的水除尽;
B.试剂溶解后,在转移到容量瓶中时有洒出;
C.忘记将洗涤液转入容量瓶;
D.定容、摇匀、静置后发现凹液面低于刻度线又加水至刻度线;
E.定容时俯视刻度线. 望崖1年前1
望崖1年前1 -
 xcming1981 共回答了19个问题
xcming1981 共回答了19个问题 |采纳率94.7%(1)没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故选择500mL容量瓶;
配制500mL0.1mol•L -1 的Na 2 CO 3 溶液需要碳酸钠的质量为:0.1mol•L -1 ×0.5L=0.05mol,碳酸钠晶体与碳酸钠的物质的量相等,故需要碳酸钠晶体的质量为:0.05mol×286g/mol=14.3g;
故答案为:14.3;500;
(2)容量瓶上标有:温度、容量、刻度线;
故选①③⑤;
(3)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故在操作过程中使用的前后顺序是:d b a c;
故答案为:d b a c;
(4)溶解是玻璃棒用于搅拌加速溶解,移液时引流作用;
故答案为:2;
(5)A.溶液配制需加水定容,配制前设有将容量瓶中的水除尽,对所配溶液无影响,故A不符合;
B.试剂溶解后,在转移到容量瓶中时有洒出,移入容量瓶内碳酸钠的物质的量偏小,所配溶液浓度偏低,故B符合;
C.没有将洗涤液转入容量瓶,移入容量瓶内碳酸钠的物质的量偏小,所配溶液浓度偏低,故C符合;
D.定容、摇匀、静置后发现凹液面低于刻度线,少量溶液残留在瓶口与瓶塞之间,又加水至刻度线,导致所配溶液的体积偏大,配制溶液的浓度偏低,故D符合;
E.定容时俯视刻度线,导致所配溶液的体积偏大,配制溶液的浓度偏高,故E不符合;
故选BCD.1年前查看全部
- 将Cu片放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3
将Cu片放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为( )
A. 3:2
B. 3:5
C. 3:4
D. 4:3 向往yy1年前1
向往yy1年前1 -
 皆为虚妄 共回答了20个问题
皆为虚妄 共回答了20个问题 |采纳率90%解题思路:先利用假设法求出二价铁离子、三价铁离子的物质的量,再根据离子方程式中铜离子和二价铁离子的关系求出铜离子的物质的量.将Cu片放入FeCl3溶液中.发生反应:Cu+2Fe3+=Cu2++2Fe2+,假设溶液中n(Fe2+)=3mol,则溶液中n(Fe3+)=2mol,
由离子方程式可知,n(Cu2+)=[1/2]n(Fe2+)=[1/2]×3mol=1.5mol,所以n(Cu2+):n(Fe3+)=1.5mol:2mol=3:4,
故选C.点评:
本题考点: 铜金属及其重要化合物的主要性质;离子方程式的有关计算.
考点点评: 本题考查的是铜的化学性质、离子方程式的有关计算,巧妙利用假设法是解本题的关键.1年前查看全部
- 现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤
现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥,称得质量为0.013g,则此沉淀是( )
A. LiF
B. LiCl
C. AgF
D. AgCl hsqujy1年前1
hsqujy1年前1 -
 小丫的杯子 共回答了15个问题
小丫的杯子 共回答了15个问题 |采纳率86.7%解题思路:根据银离子和卤素离子形成沉淀的情况,结合沉淀的物质的量和银离子物质的量之间的关系,可以获得沉淀的物质的量,再根据沉淀质量可以求得沉淀的摩尔质量,进而求得沉淀的成分.由于卤化物完全沉淀,则假设银完全沉淀,则沉淀物质的量为0.005L×0.1mol/L=0.0005mol,则沉淀的摩尔质量M=[m/n]=[0.013g/0.0005mol]=26g/mol.
故选A.点评:
本题考点: 卤化银.
考点点评: 本题考查学生银离子和卤素离子反应的实质,可以根据反应相关物质的量之间的关系来解答,难度不大,注意LiF、AgCl不溶于水.1年前查看全部
- 1mol・L-1氢氟酸溶液中c(H+)约为0.1mol・L-1为什么能说明他是弱电解质
1mol・L-1氢氟酸溶液中c(H+)约为0.1mol・L-1为什么能说明他是弱电解质
 xiaoh07331年前1
xiaoh07331年前1 -
 aaempire 共回答了14个问题
aaempire 共回答了14个问题 |采纳率100%1mol・L-1氢氟酸溶液中c(H+)约为0.1mol・L-1为什么能说明他是弱电解质
侠盗猎车4的收音机不响啊1年前查看全部
- 常温下有0.1mol•L-1的NaHC2O4溶液,其pH=4,下列说法正确的是( )
常温下有0.1mol•L-1的NaHC2O4溶液,其pH=4,下列说法正确的是( )
A. c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)
B. c(H2C2O4)>c(C2O42-)
C. c(H+)+c(Na+)=c(OH-)+c(C2O42-)+c(HC2O4-)
D. c(Na+)>c(HC2O4-)>c(H+)>c(OH-) ran0311年前2
ran0311年前2 -
 hkfg2844 共回答了30个问题
hkfg2844 共回答了30个问题 |采纳率86.7%解题思路:A、溶液中存在物料守恒;
B、NaHC2O4溶液pH=4,证明溶液显示酸性,阴离子的电离程度大于其水解程度;
C、根据溶液中的电荷守恒来回答;
D、根据溶液中离子的来源以及离子浓度大小比较方法来回答.A、0.1mol•L-1的NaHC2O4溶液中存在物料守恒:c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故A正确;
B、NaHC2O4溶液pH=4,证明溶液显示酸性,阴离子HC2O4-的电离程度大于其水解程度,所以c(H2C2O4)<c(C2O42-),故B错误;
C、该溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HC2O4-),故C错误;
D、溶液中直接电离出来的离子浓度最高,但是阴离子会存在水解和电离,所以c(Na+)>c(HC2O4-),阴离子HC2O4-的电离程度大于其水解程度,溶液显示酸性,即c(H+)>c(OH-),所以离子浓度大小顺序是:c(Na+)>c(HC2O4-)>c(H+)>c(OH-),故D正确.
故选AD.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查学生盐的水解原理的应用:离子浓度大小比较知识,注意知识的归纳和整理是关键,难度大.1年前查看全部
- 25℃时,在0.1mol•L-1的下列溶液中,微粒的物质的量浓度关系正确的是( )
25℃时,在0.1mol•L-1的下列溶液中,微粒的物质的量浓度关系正确的是( )
A.NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO
)>c(SO−3
)>c(H2SO3)2−3
C.CH3COONa溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.Na2CO3溶液中:2c(Na+)=c(CO
)+c(HCO2−3
)+c(H2CO3)−3 penghoufly1年前1
penghoufly1年前1 -
 yongzhao_l 共回答了15个问题
yongzhao_l 共回答了15个问题 |采纳率73.3%解题思路:A、氯化铵溶液中,铵离子部分水解,溶液中铵离子浓度小于氯离子浓度;
B、硫酸氢钠溶液为酸性溶液,亚硫酸氢根离子的电离程度大于其水解程度;
C、醋酸钠溶液中一定满足电荷守恒,根据电荷守恒进行判断;
D、根据物料守恒可知,[1/2]c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3).A、NH4Cl溶液中,铵离子部分水解,溶液显示酸性,铵离子浓度减小,所以正确的离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B、NaHSO3溶液(呈酸性)中,HSO3-的电离程度大于其水解程度,亚硫酸根离子浓度大于亚硫酸浓度,溶液中离子浓度关系为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故B正确;
C、CH3COONa溶液中,根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正确;
D、碳酸钠溶液中,根据物料守恒可知:[1/2]c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误;
故选BC.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了溶液中离子浓度大小比较、盐的水解、弱电解质的电离等知识,题目难度中等,注意掌握溶液中离子浓度大小的方法,注意电荷守恒、物料守恒在比较离子浓度大小中的应用.1年前查看全部
- (1)25℃时,浓度为0.1mol•L-1的6种溶液:①HCl,②CH3OOH,③Ba(OH)2,④Na 2C
(1)25℃时,浓度为0.1mol•L-1的6种溶液:①HCl,②CH3OOH,③Ba(OH)2,④Na 2CO3,⑤KCl,
⑥NH4Cl溶液pH由小到大的顺序为______(填写编号).
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=______mol•L-1(保留到小数点后一位).
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈______(填“酸性”,“中性”或“碱性”),请写出溶液中离子浓度间的一个等式:______.
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=______,m与n的大小关系是m______n(填“>”“=”或“<”).
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Ka=______. beilei19191年前1
beilei19191年前1 -
 三月人面桃花 共回答了13个问题
三月人面桃花 共回答了13个问题 |采纳率100%解题思路:(1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH;
(2)CH3COONa的水解平衡常数Kh=
=c(CH3COOH).c(OH−) c(CH3COO−)
=c(CH3COOH).c(H+).c(OH−) c(CH3COO−).c(H+)
;Kw Ka
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,溶液中存在物料守恒和电荷守恒;
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,溶液中存在物料守恒;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等.(1)盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾和氯化铵为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤④③,
故答案为:①②⑥⑤④③;
(2)CH3COONa的水解平衡常数Kh=
c(CH3COOH).c(OH−)
c(CH3COO−)=
c(CH3COOH).c(H+).c(OH−)
c(CH3COO−).c(H+)=
Kw
Ka=
10−14
1.7×10−5=5.9×10-10,故答案为:5.9×10-10;
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,导致混合溶液呈酸性,溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
故答案为:酸性;c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以m>n,二者混合时溶液体积增大一倍,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.5mmol/L,
故答案为:0.5mmol/L;>;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3•H2O的电离常数Ka=1.7×10-5mol/L,故答案为:1.7×10-5mol/L.点评:
本题考点: 弱电解质在水溶液中的电离平衡;盐类水解的应用;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了弱电解质的电离,涉及pH大小的判断、酸碱混合溶液定性判断等知识点,明确物质的性质及弱电解质电离特点是解本题关键,难点是(2),会根据微粒间的关系进行公式转换,难度较大.1年前查看全部
- 常温下,有关下列4种溶液的说法正确的是( ) ① ② ③ ④ 0.1mol•L -1 氨水 Ph=11
常温下,有关下列4种溶液的说法正确的是( ) ① ② ③ ④ 0.1mol•L -1 氨水 Ph=11
氨水0.1mol•L -1
盐酸pH=3
盐酸A.由水电离出的c(H + ):③>① B.①稀释到原来的100倍,pH与②相同 C.①与③混合,若溶液pH=7,则溶液中c(NH 4 + )>C(Cl - ) D.②与④等体积混合,混合液pH>7  狂人19441年前1
狂人19441年前1 -
 ycwgr 共回答了29个问题
ycwgr 共回答了29个问题 |采纳率89.7%A.酸和碱抑制水的电离,氢离子或氢氧根的浓度越大,水的电离程度越小;0.1mol•L -1 氨水电离出来的氢氧根的浓度小于0.1mol•L -1 盐酸电离的氢离子浓度,所以对水的电离抑制程度小,则由水电离出的c(H + ):①>③,故A错误;
B.一水合氨是弱电解质,在溶液中部分电离,0.1mol•L -1 氨水中PH<13,所以①稀释到原来的100倍,pH与②不相同,故B错误;
C.①与③混合,若溶液pH=7,由溶液中电荷守恒可知:c(NH 4 + )+c(H + )=C(Cl - )+c(OH - ),因为c(H + )=c(OH - ),所以c(NH 4 + )=C(Cl - ),故C错误;
D.一水合氨是弱电解质,在溶液中一水合氨的浓度大于氢氧根离子的浓度,所以Ph=11氨水的浓度大于10 -3 mol•L -1 ,因此②与④等体积混合时,氨水过量,溶液显碱性,混合液pH>7,故D正确.
故选D.1年前查看全部
- 在给定条件下,可以大量共存的离子组是( ) A.含有0.1 mol•L -1 Fe 3+ 的溶液中:H + 、Fe
在给定条件下,可以大量共存的离子组是( ) A.含有0.1 mol•L -1 Fe 3+ 的溶液中:H + 、Fe 2+ 、Na + 、Br - B.强碱性溶液中:K + 、Al 3+ 、Cl - 、SO 4 2- C.在pH=1的溶液中:Mg 2+ 、Na + 、ClO - 、NO 3 - D.加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca 2+ 、HCO 3 - 、NH 4 + 、Cl -  花落水飘零1年前1
花落水飘零1年前1 -
 shlean2000 共回答了21个问题
shlean2000 共回答了21个问题 |采纳率90.5%A.含有0.1 mol•L -1 Fe 3+ 的溶液中,离子之间不发生任何反应,可大量共存,故A正确;
B.强碱性溶液中存在大量的OH - 离子,Al 3+ 不能大量共存,故B错误;
C.pH=1的溶液呈酸性,ClO - 与H + 反应生成弱电解质而不能大量共存,故C错误;
D.加入强碱再加热,Ca 2+ 、HCO 3 - 、NH 4 + 反应生成氨气和碳酸钙沉淀,且离子之间不发生任何反应,可大量共存,故D正确.
故选AD.1年前查看全部
- HA为酸性略强于醋酸的一元弱酸.在0.1mol•L-1 NaA溶液中,离子浓度关系正确的是( )
HA为酸性略强于醋酸的一元弱酸.在0.1mol•L-1 NaA溶液中,离子浓度关系正确的是( )
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(OH-)=c(A-)+c(H+)
D.c(Na+)+c(H+)=c(A-)+c(OH-) 79202191年前1
79202191年前1 -
 难忘他 共回答了14个问题
难忘他 共回答了14个问题 |采纳率85.7%解题思路:HA为酸性略强于醋酸的一元弱酸,NaA为强碱弱酸盐,A-水解导致溶液呈碱性,溶液中存在电荷守恒和物料守恒.A.NaA为强碱弱酸盐,A-水解导致溶液呈碱性,则c(H+)<c(OH-),A-水解、钠离子不水解,所以c(Na+)>c(A-),A-水解程度较小,则溶液中离子浓度大小顺序是c(Na+)>c(A-)>c(OH-)>c(H+),故A错误;
B.根据A知,c(OH-)<c(A-),故B错误;
C.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),溶液呈碱性,钠离子不水解,所以c(Na+)+c(OH-)>c(A-)+c(H+),故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故D正确;
故选D.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了离子浓度大小比较,明确盐的特点结合“谁强谁显性、谁弱谁水解”来分析解答,注意守恒思想的运用,题目难度不大.1年前查看全部
- 常温下,0.1mol•L-1的下列溶液中,有关微粒的物质的量浓度关系正确的( )
常温下,0.1mol•L-1的下列溶液中,有关微粒的物质的量浓度关系正确的( )
A.(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D.NaHCO3溶液:c(Na+)+c(H+)+c(H2CO3)=c(OH-)+c(CO32-) junwji80231年前1
junwji80231年前1 -
 三又七分之二 共回答了26个问题
三又七分之二 共回答了26个问题 |采纳率92.3%解题思路:A、铵根离子和亚铁离子水解显酸性;
B、氯化铵溶液中铵根离子水解显酸性;
C、结合溶液中电荷守恒分析判断;
D、结合溶液中电荷守恒和物料守恒分析判断.A、铵根离子和亚铁离子水解显酸性,(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),故A正确;
B、氯化铵溶液中铵根离子水解显酸性,NH4Cl溶液中离子浓度大小:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
C、结合溶液中电荷守恒分析判断,Na2CO3溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故C错误;
D、结合溶液中电荷守恒和物料守恒分析判断,电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),物料守恒为:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),合并计算c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故D错误;
故选A.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了电解质溶液中离子浓度大小、电荷守恒、物料守恒、盐类水解的分析应用和计算分析判断,掌握方法是关键,题目难度中等.1年前查看全部
- 1L稀H2SO4和稀HNO3的混合液,其物质的量浓度分别为0.4mol•L-1和0.1mol•L-1.若向该混合液中加入
1L稀H2SO4和稀HNO3的混合液,其物质的量浓度分别为0.4mol•L-1和0.1mol•L-1.若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A. 2.4g
B. 3.2g
C. 6.4g
D. 9.6g 望城石页1年前4
望城石页1年前4 -
 llu7890 共回答了24个问题
llu7890 共回答了24个问题 |采纳率83.3%解题思路:1L稀H2SO4和稀HNO3的混合液,其物质的量浓度分别为0.4mol•L-1和0.1mol•L-1,则n(H+)=1L×2×0.4mol/L+1L×0.1mol/L=0.9mol,n(NO3-)=1L×0.1mol/L=0.1mol,
铜屑投入HNO3和H2SO4的混合溶液中发生的反应:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,结合反应的离子方程式计算.1L稀H2SO4和稀HNO3的混合液,其物质的量浓度分别为0.4mol•L-1和0.1mol•L-1,
则n(H+)=1L×2×0.4mol/L+1L×0.1mol/L=0.9mol,
n(NO3-)=1L×0.1mol/L=0.1mol,
发生3Cu+8H++2NO3-=3Cu2++2NO+4H2O
3 8 2
0.9mol0.1mol
可知H+过量,NO3-完全反应,
则消耗铜的质量为[3×0.1mol/2]×64g/mol=9.6g,
故选D.点评:
本题考点: 硝酸的化学性质;离子方程式的有关计算.
考点点评: 本题考查硝酸的性质,侧重于学生的分析能力和计算能力的考查,注意把握离子方程式的书写以及过量问题的判断,难度不大.1年前查看全部
- 将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
A. c(HCN)<c(CN-)
B. c(Na+)>c(CN-)
C. c(HCN)-c(CN-)=c(OH-)
D. c(HCN)+c(CN-)=0.1 mol•L-1 tiantian1101191年前2
tiantian1101191年前2 -
 夜色张狂 共回答了18个问题
夜色张狂 共回答了18个问题 |采纳率88.9%解题思路:将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明
CN-水解程度大于HCN电离程度,以此解答该题.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,则
A.等浓度的CN-水解程度大于HCN电离程度,则c(HCN)>c(CN-),故A错误;
B.溶液显碱性,则c(OH-)>c(H+),根据c(Na+)+c(H+)=c(CN-)+c(OH-)可知,c(Na+)>c(CN-),故B正确;
C.根据物料守恒可知,c(HCN)+c(CN-)=2c(Na+),根据电荷守恒可知c(Na+)+c(H+)=c(CN-)+c(OH-),二者联式可得:c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,c(HCN)+c(CN-)=0.1mol•L-1,故D正确.
故选BD.点评:
本题考点: 离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,溶液显碱性,说明CN-水解程度大于HCN电离程度,结合电荷守恒和物料守恒解答.1年前查看全部
- 以1L 0.1molL-1 的硫酸溶液 与 1L 0.4molL-1 的氨水溶液反应,反应后溶液的PH值是多少
以1L 0.1molL-1 的硫酸溶液 与 1L 0.4molL-1 的氨水溶液反应,反应后溶液的PH值是多少
氨水Kb=1.77X10-5
求详解 wbmq1年前1
wbmq1年前1 -
 身曹心汉 共回答了10个问题
身曹心汉 共回答了10个问题 |采纳率100%混合后,
[NH4+]=0.1mol/L,[NH3.H2O]=0.1mol/L
∴Kb=1.77X10^-5=[OH-]
∴pH=14+lg[1.77X10^-5]≈9.251年前查看全部
- 在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A. H+的物质的量
B. 醋酸的电离常数
C. 中和时所需NaOH的量
D. CH3COOH的物质的量 zqc200515331年前2
zqc200515331年前2 -
 fast3721 共回答了21个问题
fast3721 共回答了21个问题 |采纳率90.5%解题思路:根据醋酸的浓度越小,其电离程度越大,但浓度小,电离产生的离子的浓度、离子的物质的量都小,并结合n=cV来解答,注意电离平衡常数与温度有关.A.由n=cV可知,100mL 0.01mol/L的醋酸溶液中溶质的物质的量为0.001mol,10mL0.1mol/L的醋酸溶液中溶质的物质的量为0.001mol,但后者的浓度大,醋酸的电离程度小,所以氢离子的物质的量前者大于后者,故A正确;
B.电离平衡常数只与温度有关,温度相同则电离平衡常数相同,故B错误;
C.由于溶质n(CH3COOH)都为0.001mol,中和时所需NaOH的量应相同,故C错误;
D.由n=cV可知,100mL 0.01mol/L的醋酸溶液中溶质的物质的量为0.001mol,10mL0.1mol/L的醋酸溶液中溶质的物质的量为0.001mol,但前者浓度小,电离程度大,前者的CH3COOH的物质的量小,故D错误;
故选A.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质的电离,明确温度与电离平衡常数的关系,浓度与电离程度的关系是解答本题的关键,题目难度不大.1年前查看全部
- (2010•广州二模)下列关于0.1mol•L-1氯化铵溶液的说法正确的是( )
(2010•广州二模)下列关于0.1mol•L-1氯化铵溶液的说法正确的是( )
A.溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.向溶液中加入适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-)
C.向溶液中加滴加几滴浓盐酸,c(NH4+)减少
D.向溶液中加入少量CH3COONa固体,c(NH4+)减少 hntj1401年前1
hntj1401年前1 -
 花上客 共回答了25个问题
花上客 共回答了25个问题 |采纳率96%解题思路:A.氯化铵为强酸弱碱盐,水解呈酸性;
B.根据电荷守恒判断;
C.向溶液中加滴加几滴浓盐酸,抑制NH4+的水解;
D.CH3COONa为强碱弱酸盐,水解呈碱性,促进NH4+的水解.A.氯化铵为强酸弱碱盐,水解呈酸性,则c(H+)>c(OH-),c(Cl-)>c(NH4+),一般来说水解程度较小,则c(NH4+)>c(H+),故A正确;
B.溶液存在四种离子,Cl-、NH4+、H+、OH-,当溶液PH值等于7时,c(H+)=c(OH-),c(NH4+)=c(Cl-),故B错误;
C.向溶液中加滴加几滴浓盐酸,抑制NH4+的水解,则c(NH4+)增大,故C错误;
D.CH3COONa为强碱弱酸盐,水解呈碱性,促进NH4+的水解,c(NH4+)减少,故D正确.
故选:AD.点评:
本题考点: 离子浓度大小的比较;盐类水解的应用.
考点点评: 本题考查离子浓度大小比较,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握盐类水解的规律,结合电荷守恒解答该题,难度中等.1年前查看全部
- 常温时0.1mol•L-1HA溶液的pH>1,0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,将两溶
常温时0.1mol•L-1HA溶液的pH>1,0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断一定正确的是( )
A.c(A-)=c(OH-)+c(HA)
B.c(OH-)<c(H+)<c(B+)<c(A-)
C.c(H+)+c(B+)=c(A-)+c(OH-)
D.c(A-)=c(B+)>c(H+)=c(OH-) 杰瑞曾1年前1
杰瑞曾1年前1 -
 ii发哥 共回答了23个问题
ii发哥 共回答了23个问题 |采纳率95.7%解题思路:常温时0.1mol•L-1HA溶液的pH>1,则HA为弱酸;0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,
由于c(OH-)•c(H+)=10-14,联立解得c(OH-)=0.1mol/L,故BOH为强碱.将两溶液等体积混合,HA与BOH恰好发生反应,为BA溶液,BA是强碱弱酸盐,A-离子水解,溶液呈碱性.
A、水解程度很小,c(A-)远大于c(OH-)+c(HA).
B、将两溶液等体积混合,HA与BOH恰好发生反应,为BA溶液,BA是强碱弱酸盐,A-离子水解,溶液呈碱性.水解程度不大,据此判断.
C、根据溶液电荷守恒判断.
D、将两溶液等体积混合,HA与BOH恰好发生反应,为BA溶液,BA是强碱弱酸盐,A-离子水解,溶液呈碱性.水解程度不大,据此判断.常温时0.1mol•L-1HA溶液的pH>1,则HA为弱酸;0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,由于c(OH-)•c(H+)=10-14,联立解得c(OH-)=0.1mol/L,故BOH为强碱.将两溶液等体积混合,HA与BOH恰好发生反应,为BA溶液,BA是强碱弱酸盐,A-离子水解A-+H2O
 HA+OH-,溶液呈碱性.
HA+OH-,溶液呈碱性.
A、水解程度很小,c(A-)远大于c(OH-)+c(HA),故A错误;
B、因A-能水解,则c(B+)>c(A-),水解使溶液呈酸性,则c(OH-)>c(H+),再由水解的程度很弱,
则c(A-)>c(OH-),所以离子浓度顺序为c(B+)>c(A-)>c(OH-)>c(H+),故B错误;
C、因溶液不显电性,即电荷守恒式为c(B+)+c(H+)=c(A-)+c(OH-),故C正确;
D、因A-能水解,则c(B+)>c(A-),水解使溶液呈酸性,则c(OH-)>c(H+),再由水解的程度很弱,
则c(A-)>c(OH-),所以离子浓度顺序为c(B+)>c(A-)>c(OH-)>c(H+),故D错误.
选:C.点评:
本题考点: 离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合后溶液PH以及离子浓度的大小比较问题,题目难度中等,注意根据题目所提供的信息判断酸碱的强弱为解答该题的关键,注意溶液电中性原则.1年前查看全部
- 已知在25℃条件下向10.00mL0.1mol•L -1 HCOOH溶液中逐滴加入0.1mol•L -1 NaOH溶液,
已知在25℃条件下向10.00mL0.1mol•L -1 HCOOH溶液中逐滴加入0.1mol•L -1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( ) A.a点表示的溶液中c(HCOO - )约为10 -3 mol•L -1 B.用25mL的酸式滴定管量取HCOOH溶液 C.c点NaOH溶液的体积小于10mL D.在a、c间任一点,溶液中一定都有c(Na + )>c(HCOO - )>c(H + )>c(OH - ) 
 斯小林1年前1
斯小林1年前1 -
 xa鹰 共回答了11个问题
xa鹰 共回答了11个问题 |采纳率90.9%A.由于甲酸中水电离的氢离子浓度很小,所以溶液中氢离子浓度与甲酸电离的甲酸根离子浓度基本相等,a点时溶液pH=3,氢离子浓度为10 -3 mol•L -1 ,则甲酸溶液中甲酸根离子浓度约为10 -3 mol•L -1 ,故A正确;
B.甲酸为一元弱酸,溶液显示酸性,所以取用甲酸应该使用酸式滴定管,故B正确;
C.由于甲酸为弱酸,若加入10mL氢氧化钠溶液时,反应生成强碱弱酸盐甲酸钠,反应后的溶液为碱性,由于c点显示中性,则加入的氢氧化钠溶液体积应该小于10mL,故C正确;
D.在a、c间任一点,溶液显示酸性,则一定满足:c(H + )>c(OH - ),根据电荷守恒:c(Na + )+c(H + )=c(HCOO - )+c(OH - )可知,c(Na + )<c(HCOO - ),所以离子浓度正确关系为:c(HCOO - )>c(Na + )>c(H + )>c(OH - ),故D错误;
故选D.1年前查看全部
- 实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下
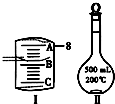 实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下列问题:
(1)应该用托盘天平称取Na2CO3•10H2O______g.
(2)如图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中液体的体积是______mL.
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”):A.定容前容量瓶底部有水珠______;B.定容时加水超过刻度线______;C.最终定容时俯视观察液面______.D.为加速溶解过程对烧杯中溶液进行加热,未冷却至室温就将其转移到Ⅱ所示的仪器中,并迅速定容______. kingsj1年前1
kingsj1年前1 -
 brayan_lv 共回答了20个问题
brayan_lv 共回答了20个问题 |采纳率95%解题思路:(1)根据n=CV和m=nM来计算;
(2)根据量筒小刻度在下,A与B,B与C刻度间相差1mL,则AB间每一小格为0.2mL,得出量筒中液体的体积.
(3)根据C=[n/V],通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.(1)实验室配制500mL0.1mol/LNa2CO3溶液需要Na2CO3•10H2O的质量为:0.5L×0.1mol/L×286g/mol=14.3g,故答案为:14.3;
(2)量筒小刻度在下,A与B、B与C刻度间相差1mL,刻度A为8,则刻度B为7,AB间每一小格为0.2mL,则量筒中液体的体积为7.2mL,故答案为:7.2;
(3)A.定容前容量瓶底部有水珠,只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,故答案为:无影响;
B.定容时加水超过刻度线,则溶液体积偏大,浓度偏低,故答案为:偏低;
C.最终定容时俯视观察液面.则导致溶液体积偏小,则浓度偏高,故答案为:偏高;
D.为加速溶解过程对烧杯中溶液进行加热,未冷却至室温就将其转移到Ⅱ所示的仪器中,并迅速定容,则冷却后溶液体积偏小,则浓度偏高,故答案为:偏高.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
- HA为酸性略强与醋酸的一元弱酸,在0.1mol•L-1 NaA溶液中,离子浓度关系正确的是( )
HA为酸性略强与醋酸的一元弱酸,在0.1mol•L-1 NaA溶液中,离子浓度关系正确的是( )
A. c(Na+)>c(A-)>c(H+)>c(OH-)
B. c(Na+)>c(OH-)>c(A-)>c(H+)
C. c(Na+)+c(OH-)=c(A-)+c(H+)
D. c(Na+)+c(H+)=c(A-)+c(OH-) 真水无香09231年前1
真水无香09231年前1 -
 7825370 共回答了19个问题
7825370 共回答了19个问题 |采纳率84.2%解题思路:根据HA为一元弱酸,则在0.1mol•L-1 NaA溶液中利用盐类水解及电荷守恒来分析溶液中离子的关系.A、因HA为一元弱酸,则NaA溶液中A-+H20═HA+OH-,即溶液显碱性,则c(OH-)>c(H+),故A错误;
B、由溶液中A-+H20═HA+OH-,则c(OH-)>c(H+),但水解的程度很弱,则c(A-)>c(OH-)>c(H+),故B错误;
C、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故C错误;
D、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故D正确;
故选:D.点评:
本题考点: 离子浓度大小的比较;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查溶液中离子的关系,正确利用水解来判断溶液的酸碱性是解答的关键,并注意溶液中水解的程度及利用电荷守恒来分析解答即可.1年前查看全部
- (2010•抚顺二模)将Cu片放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):
(2010•抚顺二模)将Cu片放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为( )
A.3:2
B.3:5
C.3:4
D.4:3 失乐的天堂1年前1
失乐的天堂1年前1 -
 lyon168 共回答了19个问题
lyon168 共回答了19个问题 |采纳率84.2%解题思路:先利用假设法求出二价铁离子、三价铁离子的物质的量,再根据离子方程式中铜离子和二价铁离子的关系求出铜离子的物质的量.将Cu片放入FeCl3溶液中.发生反应:Cu+2Fe3+=Cu2++2Fe2+,假设溶液中n(Fe2+)=3mol,则溶液中n(Fe3+)=2mol,
由离子方程式可知,n(Cu2+)=[1/2]n(Fe2+)=[1/2]×3mol=1.5mol,所以n(Cu2+):n(Fe3+)=1.5mol:2mol=3:4,
故选C.点评:
本题考点: 铜金属及其重要化合物的主要性质;离子方程式的有关计算.
考点点评: 本题考查的是铜的化学性质、离子方程式的有关计算,巧妙利用假设法是解本题的关键.1年前查看全部
- HA为酸性略强与醋酸的一元弱酸,在0.1mol•L-1 NaA溶液中,离子浓度关系正确的是( )
HA为酸性略强与醋酸的一元弱酸,在0.1mol•L-1 NaA溶液中,离子浓度关系正确的是( )
A. c(Na+)>c(A-)>c(H+)>c(OH-)
B. c(Na+)>c(OH-)>c(A-)>c(H+)
C. c(Na+)+c(OH-)=c(A-)+c(H+)
D. c(Na+)+c(H+)=c(A-)+c(OH-) bonoda1年前1
bonoda1年前1 -
 流利界 共回答了20个问题
流利界 共回答了20个问题 |采纳率85%解题思路:根据HA为一元弱酸,则在0.1mol•L-1 NaA溶液中利用盐类水解及电荷守恒来分析溶液中离子的关系.A、因HA为一元弱酸,则NaA溶液中A-+H20═HA+OH-,即溶液显碱性,则c(OH-)>c(H+),故A错误;
B、由溶液中A-+H20═HA+OH-,则c(OH-)>c(H+),但水解的程度很弱,则c(A-)>c(OH-)>c(H+),故B错误;
C、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故C错误;
D、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故D正确;
故选:D.点评:
本题考点: 离子浓度大小的比较;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查溶液中离子的关系,正确利用水解来判断溶液的酸碱性是解答的关键,并注意溶液中水解的程度及利用电荷守恒来分析解答即可.1年前查看全部
- 0.1mol•L -1 氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
0.1mol•L -1 氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②c(NH 3 •H 2 O)增大③NH 4 + 数目增多
④c(OH - )增大 ⑤导电性增强 ⑥
增大.C(N
)H +4 C(N H 3 • H 2 O) A.①②③ B.①③⑤ C.①③⑥ D.②④⑥  jiacj78880161年前1
jiacj78880161年前1 -
 凉茶BOB 共回答了19个问题
凉茶BOB 共回答了19个问题 |采纳率94.7%①因加水促进弱电解质的电离,则氨水的电离程度增大,故①正确;
②加水时电离平衡正向移动,n(NH 3 •H 2 O)减小,且溶液的体积变大,则c(NH 3 •H 2 O)减小,故②错误;
③加水时电离平衡正向移动,n(NH 4 + )增大,由N=n×N A ,则NH 4 + 数目增多,故③正确;
④加水时电离平衡正向移动,n(OH - )增大,但溶液的体积变大,则c(OH - )减小,故④错误;
⑤加水稀释时,溶液中的离子的浓度减小,则导电性减弱,故⑤错误;
⑥加水时电离平衡正向移动,n(NH 4 + )增大,n(NH 3 •H 2 O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则
C(N
H +4 )
C(N H 3 • H 2 O) 增大,故⑥正确;
故选C.1年前查看全部
- 配制0.1mol•L-1的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
配制0.1mol•L-1的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘高,右盘低
B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥
D.定容时液面超过了刻度线 伊人梦1年前1
伊人梦1年前1 -
 dragon不再忧郁 共回答了18个问题
dragon不再忧郁 共回答了18个问题 |采纳率100%解题思路:分析具体操作对n、V的影响,根据c=[n/V]分析不当操作对溶液浓度的影响.A、用托盘天平称量药品时天平左盘放药品,右盘放砝码,称量时,左盘高,右盘低,药品实际质量偏下,n偏小,则所配溶液浓度偏低,故A不符合;
B、定容时俯视读取刻度,导致所配溶液体积偏小,所配溶液浓度偏高,故B符合;
C、配制最后需加水定容,原容量瓶洗净后未干燥对实验结果无影响,故C不符合;
D、定容时液面超过了刻度线,导致所配溶液体积偏大,所配溶液浓度偏低,故D不符合.
故选B.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查配制一定物质的量浓度溶液的方法,本题难度不大,根据c=[n/V]分析理解.1年前查看全部
- 为什么100mL 0.1molL -1 稀硫酸中含有硫酸根个数为0.1NA
 小月衣橱1年前1
小月衣橱1年前1 -
 oalht 共回答了21个问题
oalht 共回答了21个问题 |采纳率95.2%错 0.01NA个1年前查看全部
- 已知某硫酸和盐酸组成的混合溶液中c(H+)=0.1mol•L-1,将50mL上述混合溶液与50mL Ba(OH)2溶液混
已知某硫酸和盐酸组成的混合溶液中c(H+)=0.1mol•L-1,将50mL上述混合溶液与50mL Ba(OH)2溶液混合,充分反应后过滤,得0.466g沉淀,此时溶液中OH-的浓度为0.1mol•L-1(设此时溶液体积为100mL).试计算:
(1)原混合液中SO42-、Cl-的物质的量;
(2)混合前Ba(OH)2溶液的物质的量浓度. weihuan31年前1
weihuan31年前1 -
 g002 共回答了25个问题
g002 共回答了25个问题 |采纳率88%解题思路:(1)0.466g沉淀为硫酸钡,根据n=[m/M]计算n(BaSO4),根据SO42-~BaSO4计算n(SO42-),根据n=cV计算n(H+),由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),据此计算n(Cl-);
(2)根据Ba(OH)2~2H+计算参加反应n[Ba(OH)2],根据n=cV计算反应后溶液中n(OH-),进而计算剩余n[Ba(OH)2],再计算氢氧化钡总物质的量,再根据c=[n/V]计算.反应后碱有剩余,酸完全反应,硫酸根完全沉淀,n(BaSO4)=[0.466g/233g/mol]=0.002mol,则:
SO42-~BaSO4
1 1
n(SO42-) 0.002mol
故n(SO42-)=[0.002mol×1/1]=0.002mol
原混合反应中n(H+)=c•V=0.05L×0.1mol/L=0.005mol
由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),n(Cl-)=0.005mol-0.002mol×2=0.001mol,
答:原混合液中SO42-的物质的量为0.002mol、Cl-的物质的量为0.001mol.
(2)原混合反应中n(H+)=c•V=0.05L×0.1mol/L=0.005mol,
令参加反应的氢氧化钡的物质的量为y,则:
Ba(OH)2~2H+
1 2
y0.005mol
y=0.005mol÷2=0.0025mol
反应后溶液中:n(OH-)=c•V=0.1L×0.1mol/L=0.01moL,故n剩余[Ba(OH)2]=0.01mol÷2=0.005mol,故混合前Ba(OH)2溶液的物质的量:0.005mol+0.0025mol=0.0075mol,故混合前Ba(OH)2溶液的物质的量浓度:C=[0.0075mol/0.05L]=0.15mol/L,
答:混合前Ba(OH)2溶液的物质的量浓度为0.15mol/L.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,难度不大,清楚发生的反应是关键,注意根据方程式计算.1年前查看全部
- 实验室配制500ml 0.1mol•L-1的Na2CO3溶液,回答下列问题:
实验室配制500ml 0.1mol•L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末______ g.
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、______.
(3)配制时,该实验两次用到玻璃棒,其作用分别是______、______.
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒______.
②如果加水超过了刻度线,取出水使液面恰好到刻度线______.
③容量瓶没有干燥______. xyj99991年前1
xyj99991年前1 -
 gqb5613 共回答了16个问题
gqb5613 共回答了16个问题 |采纳率100%解题思路:(1)根据n=C•V和m=n•M来计算;
(2)根据配制溶液的实验操作过程选择所需的仪器;
(3)玻璃棒的使用分别是在溶解和移液时用到的,结合操作来分析;
(4)分析操作对溶质物质的量、溶液体积的影响,根据c=[n/V]判断对所配溶液浓度的影响.(1)配制500ml 0.1mol•L-1的Na2CO3溶液需要的Na2CO3的物质的量n=C•V=0.5L×0.1mol•L-1=0.05mol,质量m=n•M=0.05mol×106g/mol=5.3g,
故答案为:5.3;
(2)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所用仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙,
故答案为:玻璃棒、胶头滴管;
(3)玻璃棒的使用分别是在溶解和移液时用到的,溶解时玻璃棒的作用:是搅拌,加速溶解;在移液时玻璃棒的作用是引流,故答案为:搅拌,加速溶解;引流;
(4))①没有洗涤烧杯和玻璃棒,烧杯壁与玻璃棒上沾有少量溶质硫酸,移入容量瓶内溶质硫酸的物质的量减小,所配溶液的浓度偏低,
故答案为:偏低;
②加水超过了刻度线,溶液的体积偏大,所配溶液的浓度偏低,溶液是均匀的,取出水使液面恰好到刻度线,剩余溶液的浓度与原溶液的浓度相等,故偏低,
故答案为:偏低;
③溶液配制需加水定容,容量瓶没有干燥,对所配溶液的浓度无影响,
故答案为:不影响.点评:
本题考点: 溶液的配制.
考点点评: 本题考查一定物质的量浓度溶液的配制,难度不大,注意浓硫酸的稀释,根据c=[n/V]判断理解溶液配制原理与误差分析.1年前查看全部
- 常温下,稀释0.1mol•L-1的醋酸溶液,下列叙述正确的是( )
常温下,稀释0.1mol•L-1的醋酸溶液,下列叙述正确的是( )
A.c(H+)增大
B.醋酸的电离常数增大
C.溶液中所有离子的浓度都减小
D.c(H+)/c(CH3COOH)值增大 唔知啊1年前1
唔知啊1年前1 -
 leizhao0318 共回答了21个问题
leizhao0318 共回答了21个问题 |采纳率95.2%解题思路:A.稀释醋酸时,促进醋酸电离,但氢离子浓度增大程度小于溶液体积增大程度;
B.醋酸的电离平衡常数只与温度有关;
C.稀释醋酸时,醋酸根离子、氢离子、醋酸分子浓度都减小,但氢氧根离子浓度增大;
D.加水稀释醋酸,促进醋酸电离,氢离子的物质的量增大,醋酸分子的物质的量减小.A.稀释醋酸时,促进醋酸电离,但氢离子浓度增大程度小于溶液体积增大程度,所以c(H+)减小,故A错误;
B.醋酸的电离平衡常数只与温度有关,温度不变,醋酸的电离平衡常数不变,故B错误;
C.稀释醋酸时,促进醋酸电离,醋酸根离子、氢离子的物质的量增大,醋酸分子的物质的量减小,但醋酸根离子、氢离子的物质的量增大程度小于溶液体积增大程度,所以醋酸根离子、氢离子、醋酸分子浓度都减小,但氢氧根离子浓度增大,故C错误;
D.加水稀释醋酸,促进醋酸电离,氢离子的物质的量增大,醋酸分子的物质的量减小,所以c(H+)/c(CH3COOH)值增大,故D正确;
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意稀释醋酸时,不是所有粒子浓度都减小,氢氧根离子浓度增大,为易错点.1年前查看全部
- 常温下0.1mol•L -1 某一元酸(HA)溶液中c(OH - )/c(H + )=1×10 -8 ,下列正确是(
常温下0.1mol•L -1 某一元酸(HA)溶液中c(OH - )/c(H + )=1×10 -8 ,下列正确是( ) A.该溶液中由水电离出的c(H + )=1×10 -11 mol•L -1 B.浓度均为0.1mol•L -1 的HA和NaA溶液等体积混合后,若溶液呈酸性,则有:c(A - )>c(HA)>c(Na + )>c(H + )>c(OH - ) C.0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后所得溶液中:c(A - )+c(HA)=c(Na + ) D.0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后所得溶液中:c(H + )+c(HA)=c(OH - )  tianviv1年前1
tianviv1年前1 -
 770707chen 共回答了23个问题
770707chen 共回答了23个问题 |采纳率95.7%A、根据
c(O H - )
c( H + ) =1 0 -8 和c(H + )×c(OH - )=10 -14 可知,溶液中
c( H + )
10 -14
c( H + ) = 10 8 ,解之得c(H + )=0.001mol/L,该溶液中由水电离出的
c(H + )=c(OH - )=
Kw
0.001 mol/L=10 -11 mol/L,故A正确;
B、浓度均为0.1mol•L -1 的HA和NaA溶液等体积混合后,若溶液呈酸性,,说明溶液中HA的电离程度大于A - 离子的水解程度,则有c(Na + )>c(HA),故B错误;
C、0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后,根据物料守恒应有c(A - )+c(HA)=2c(Na + ),故C错误;
D、0.1mol•L -1 HA溶液与0.05mol•L -1 NaOH溶液等体积混合后所得溶液中,根据溶液的电中性可知溶液中存在c(H + )+c(Na + )=c(OH - )+c(A - ),根据物料守恒应有
c(A - )+c(HA)=2c(Na + ),则有2c(H + )+c(A - )+c(HA)=2c(OH - )+2c(A - ),即2c(H + )+c(HA)=2c(OH - )+c(A - ),故D错误.
故选A.1年前查看全部
- 常温时0.1mol•L-1HA溶液的pH>1,0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,将两溶
常温时0.1mol•L-1HA溶液的pH>1,0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断正确的是( )
A. c(H+)<c(OH-)<c(A-)<c(B+)
B. c(OH-)<c(H+)<c(B+)<c(A-)
C. c(H+)+c(B+)<c(A-)+c(OH-)
D. c(A-)=c(B+)>c(H+)=c(OH-) 长角牛牛1年前0
长角牛牛1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在烧杯里加入20mL 0.1mol•L-1的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物
 在烧杯里加入20mL 0.1mol•L-1的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol•L-1的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
实验现象如下:
①灯泡逐渐变暗;②烧杯中有白色沉淀生成,溶液红色变浅甚至消失.请依据实验现象回答下列问题:
(1)灯泡变暗的原因是______.
(2)有白色沉淀生成,说明______,红色变浅说明______.
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为______mL,溶液呈______色,离子反应方程式为______.
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为______. 轻吟狂啸1年前1
轻吟狂啸1年前1 -
 bdlzdq 共回答了14个问题
bdlzdq 共回答了14个问题 |采纳率78.6%解题思路:Ba(OH)2与NaHSO4发生反应:①Ba2+沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O;②溶液呈中性:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;反应过程中,溶液中离子的浓度减小,其导电能力减弱,灯泡变暗,以此来解答.(1)反应生成硫酸钡,使溶液中可自由移动离子的浓度变小,导电性减弱,则灯泡变暗,故答案为:溶液中可自由移动离子的浓度变小;
(2)白色沉淀为硫酸钡,是Ba2+与SO42-发生了反应,红色变浅,氢氧根离子浓度减小,发生了H+与OH-发生了反应,使溶液碱性减弱,
故答案为:Ba2+与SO42-发生了反应;发生了H+与OH-发生了反应,使溶液碱性减弱;
(3)当Ba2+恰好完全沉淀时,发生Ba2++OH-+SO42-+H+═BaSO4↓+H2O,以1:1反应,浓度相等,则体积相同,即NaHSO4溶液的体积为20mL,碱性减弱,颜色变浅,
故答案为:20;浅红;Ba2++OH-+SO42-+H+═BaSO4↓+H2O;
(4)向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,只发生H+与OH-的反应,离子反应为H++OH-═H2O,故答案为:H++OH-═H2O.点评:
本题考点: 离子方程式的书写;电解质溶液的导电性.
考点点评: 本题考查离子反应方程式的书写,为高考常见题型,明确发生的化学反应为解答的关键,把握反应的先后顺序及现象与导电性的关系,题目难度不大.1年前查看全部
- 常温下,在20mL0.1mol•L-1Na2CO3溶液中逐渐滴入0.1mol•L-1HCl溶液40mL,溶液的PH逐渐降
常温下,在20mL0.1mol•L-1Na2CO3溶液中逐渐滴入0.1mol•L-1HCl溶液40mL,溶液的PH逐渐降低,下列说法正确的是( )
A.完全反应以后,溶液呈现中性
B.当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-)
C.在20mL0.1mol•L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)
D.当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) 可口可爱1年前1
可口可爱1年前1 -
 tt甲110 共回答了21个问题
tt甲110 共回答了21个问题 |采纳率95.2%解题思路:碳酸钠的物质的量为:0.1mol/L×0.02L=0.002mol,盐酸的物质的量=0.1mol/L×0.04L=0.004mol,当二者反应时,碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,碳酸氢钠和盐酸反应生成氯化钠和二氧化碳,根据二者的物质的量可知,二者恰好反应生成氯化钠、二氧化碳和水,
A.反应后的溶液中含有部分二氧化碳,溶液为弱酸性;
B.加入10mL盐酸时,恰好反应生成碳酸氢钠,碳酸氢根离子浓度大于碳酸根离子;
C.根据碳酸钠溶液中的质子守恒进行判断;
D.加入盐酸后,溶液中存在氯离子,电荷守恒中必须含有氯离子.A.完全反应后,部分二氧化碳溶于水,导致溶液呈弱酸性,故A错误;
B.当盐酸加入20mL时,二者恰好反应生成碳酸氢钠,碳酸氢根离子水解导致溶液中NaHCO3的物质的量小于0.002mol,故B错误;
C.碳酸钠溶液中存在质子守恒,根据质子守恒得:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-),故C正确;
D.加入20mL盐酸后,溶液中含有了氯离子,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),故D错误;
故选C.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了离子浓度大小的判断,题目难度中等,明确反应过程及混合液中的溶质组成为解本题关键,结合电荷守恒和物料守恒判断溶液中各离子浓度大小.1年前查看全部
- 现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤
现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥,称得质量为0.013g,则此沉淀是( )
A. LiF
B. LiCl
C. AgF
D. AgCl 我爱本田和丰田1年前1
我爱本田和丰田1年前1 -
 wyj9348 共回答了19个问题
wyj9348 共回答了19个问题 |采纳率89.5%解题思路:根据银离子和卤素离子形成沉淀的情况,结合沉淀的物质的量和银离子物质的量之间的关系,可以获得沉淀的物质的量,再根据沉淀质量可以求得沉淀的摩尔质量,进而求得沉淀的成分.由于卤化物完全沉淀,则假设银完全沉淀,则沉淀物质的量为0.005L×0.1mol/L=0.0005mol,则沉淀的摩尔质量M=[m/n]=[0.013g/0.0005mol]=26g/mol.
故选A.点评:
本题考点: 卤化银.
考点点评: 本题考查学生银离子和卤素离子反应的实质,可以根据反应相关物质的量之间的关系来解答,难度不大,注意LiF、AgCl不溶于水.1年前查看全部
- 常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH−)c(H+)=1×10−8,下列叙述正确的是( )
常温下,0.1mol•L-1某一元酸(HA)溶液中
=1×10−8,下列叙述正确的是( )c(OH−) c(H+)
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的c(H+)=1×10-11mol•L-1
C.该溶液中水的离子积常数为1×10-22
D.用pH=11的NaOH溶液V1L与V2L0.1 mol•L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2 淡定自若间1年前1
淡定自若间1年前1 -
 uu不是狼 共回答了22个问题
uu不是狼 共回答了22个问题 |采纳率95.5%解题思路:根据溶液中c(OH-)与c(H+)的比值结合溶液的离子积常数Kw计算出溶液的c(H+),判断出酸的强弱性质,再根据与碱反应的性质判断反应后溶液的pH;
A.根据溶液中氢离子浓度计算溶液的PH;
B.酸溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
C.温度不变,水的离子积常数不变;
D.氢氧化钠是强碱,HA是弱酸,要使混合溶液呈中性,则酸应该稍微过量.A.常温下,0.1mol•L-1某一元酸(HA)溶液中
c(OH−)
c(H+)=1×10−8mol/L结合c(H+)×c(OH-)=10-14可知,溶液中氢离子浓度=
Kw
c(H+)
C(H+)=10-8mol/L,所以c(H+)=0.001mol/L,氢离子浓度小于酸浓度,所以该酸是弱酸,溶液的PH=3,故A错误;
B.酸溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以该溶液中由水电离出的c(H+)=1×10-11mol•L-1,故B正确;
C.温度不变,水的离子积常数不变,所以该溶液中水的离子积常数为1×10-14,故C错误;
D.pH=11的NaOH溶液中氢氧化钠的浓度=0.001mol/L,氢氧化钠是强碱,HA是弱酸,要使混合溶液呈中性,则酸应该稍微过量,所以0.001mol/L×V1L<V2 L×0.1 mol•L-1,0.01V1<V2 ,故D错误;
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质的电离、pH的简单计算等知识点,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,为易错点.1年前查看全部
- 在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol•L-1和0.1mol•L-1.向该混合液中
在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol•L-1和0.1mol•L-1.向该混合液中加入1.92g铜粉,加热使其充分反应,试计算所得溶液中的Cu2+的物质的量浓度(设溶液的体积仍为100mL).
 lalacaicai1年前2
lalacaicai1年前2 -
 suns1019 共回答了18个问题
suns1019 共回答了18个问题 |采纳率83.3%解题思路:n(Cu)=[1.92g/64g/mol]=0.03mol,n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,判断过量后以不足量代入计算.n(Cu)=[1.92g/64g/mol]=0.03mol,n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,
由 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 82
0.03mol 0.08mol 0.02mol
显然氢离子的物质的量不足,
由氢离子的物质的量及离子方程式可知0.06mol氢离子反应,生成的铜离子的物质的量为0.06mol×[3/8]=0.0225mol,
所以溶液中c(Cu2+)=[0.0225mol/0.1L]=0.225mol/L,
答:所得溶液中的Cu2+的物质的量浓度为0.225mol/L.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查离子反应的计算,解答该题的关键是把握反应的离子方程式及判断反应的过量问题,侧重分析能力和计算能力的考查,题目难度中等.1年前查看全部
- 常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A. 该溶液中水电离出的c(H+)=1×10-10mol•L-1
B. 该溶液中c(H+)+c(A-)+c(HA)=0.1mol•L-1
C. 该溶液与0.05mol•L-1NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D. 向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 ookii1年前11
ookii1年前11 -
 282983647 共回答了14个问题
282983647 共回答了14个问题 |采纳率78.6%解题思路:根据溶液中c(OH-)与c(H+)的比值结合溶液的离子积常数Kw计算出溶液的c(H+),判断出酸的强弱性质,再根据与碱反应的性质判断反应后溶液的pH,进而判断反应后溶液中离子浓度的大小比较.
A、依据c(OH-)/c(H+)=1×10-8和水的离子积Kw=1×10-14,计算得到酸溶液中的氢离子浓度为c(H+)=0.001mol/L,C(OH-)=10-11mol/L;
B、依据溶液中的物料守恒可知c(A-)+c(HA)=0.1mol•L-1;
C、依据反应得到的是HA和盐NaA的混合液,根据计算判断酸是弱酸,溶液中的电荷守恒来判断离子浓度大小比较的正误;
D、依据弱电解质的电离平衡影响因素影响平衡移动的方向分析;A、溶液中c(OH-)/c(H+)=1×10-8,Kw=c(H+)•c(OH-)=1×10-14,两式中的氢离子浓度是溶液中酸电离出的,氢氧根离子浓度是水电离出的,联立解得c(H+)=0.001mol/L,确定为弱酸溶液,所以溶液中c(OH-)=10-11mol/L,即水电离出的氢离子浓度为10-11mol/L;故A错误;
B、0.1mol•L-1某一元酸(HA)溶液中存在电离平衡,所以根据物料守恒可知c(A-)+c(HA)=0.1mol•L-1,所以c(H+)+c(A-)+c(HA)=0.1mol•L-1是错误的,故B错误;
C、0.1mol•L-1某一元酸(HA)溶液与0.05mol•L-1NaOH溶液等体积混合后反应,反应后的溶液为等浓度的酸HA和盐NaA的混合液,溶液中一定存在电荷守恒;[H+]+[Na+]=[OH-]+[A-],按照选项中的离子浓度大小,若c(A-)>c(Na+),根据电荷守恒应有c(OH-)<c(H+),故C错误;
D、通过计算可知酸为弱酸存在 电离平衡HA⇌H++A-,加水稀释促进电离,氢离子浓度减小,加入一定量NaA晶体,溶解生成的A-离子抑制了酸的电离,氢离子浓度减小,根据温度一定时溶液中氢离子浓度与氢氧根离子浓度乘积为常数,加入水和加入一定量NaA晶体,使氢离子浓度减小,氢氧根离子浓度增大,故D正确;
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查酸碱混合后溶液pH的判断,题目难度不大,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),判断出HA为弱酸.1年前查看全部
- 用等体积的0.1mol•Lˉ 1 的BaCl 2 溶液,可使相同体积的Fe 2 (SO 4 ) 3 、Na 2 SO 4
用等体积的0.1mol•Lˉ 1 的BaCl 2 溶液,可使相同体积的Fe 2 (SO 4 ) 3 、Na 2 SO 4 、MgSO 4 三种溶液中的SO 4 2 ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为( ) A.1:3:3 B.3:1:2 C.3:2:3 D.1:1:3  hbcw20001年前1
hbcw20001年前1 -
 Water_Reflection 共回答了24个问题
Water_Reflection 共回答了24个问题 |采纳率87.5%设Fe 2 (SO 4 ) 3 、Na 2 SO 4 、MgSO 4 的物质的量分别为x、y、z,
分别加入等量的BaCl 2 溶液,恰好都完全反应Ba 2+ +SO 4 2- =BaSO 4 ↓,则等体积的Fe 2 (SO 4 ) 3 、Na 2 SO 4 、MgSO 4 三种溶液中SO 4 2- 的物质的量相等,则:
3x=y=z,
解得x:y:z=1:3:3,
因溶液的体积相同,则溶液浓度之比等于物质的量之比,所以浓度之比为1:3:3,
故选A.1年前查看全部
- (1)已知含11.2g KOH的稀溶液与1L0.1mol•L-1的H2SO4稀溶液反应放出11.46KJ的热量
(1)已知含11.2g KOH的稀溶液与1L0.1mol•L-1的H2SO4稀溶液反应放出11.46KJ的热量.请写出KOH的稀溶液与的H2SO4稀溶液发生中和反应,表示中和热的热化学方程式为KOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O△H=-56.3kJ/molKOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O△H=-56.3kJ/mol
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2 (g)+O2(g)=2H2O(g)△H1,
②2H2 (g)+O2(g)=2H2O(l)△H2,则△H1和△H2的关系为______. 一无所有DD1年前1
一无所有DD1年前1 -
 Goozla 共回答了21个问题
Goozla 共回答了21个问题 |采纳率81%解题思路:(1)根据酸碱的物质的量判断反应的情况,根据中和热的概念书写热化学方程式;
(2)根据物质的不同聚集状态判断反应热的大小.(1)n(KOH)=[11.2g/56g/mol]=0.2mol,n(H2SO4)=1L×0.1mol/L=0.1mol,二者恰好反应生成0.2mol水,放出11.46KJ的热量,
则生成1mol水时放出的热量为[1/0.2]×11.26kJ=56.3kJ,
所以表示中和热的热化学方程式为 KOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O△H=-56.3kJ/mol,
故答案为:KOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O△H=-56.3kJ/mol;
(2)物质的聚集状态不同,放出的热量不同,水蒸气液化时放热,则有|△H1|<|△H2|,由于氢气的燃烧为放热反应,
△H<0,则△H1>△H2,故答案为:△H1>△H2.点评:
本题考点: 中和热;热化学方程式.
考点点评: 本题考查中和热的计算以及反应热的大小比较,注意比较反应热时不能忽略“+”“-”.1年前查看全部
- 下列有关溶液中粒子浓度的关系式正确的是( ) A.25℃时,0.1 mol•L -1 pH=4.5的NaHC 2 O
下列有关溶液中粒子浓度的关系式正确的是( ) A.25℃时,0.1 mol•L -1 pH=4.5的NaHC 2 O 4 溶液:c(HC 2 O 4 - )>c(H 2 C 2 O 4 )>c(C 2 O 4 2- ) B.向0.2 mol•L -1 NaHCO 3 溶液中加入等体积的0.1 mol•L -1 NaOH溶液:c(H + )+c(Na + )=c(OH - )+c(CO 3 2- )+-c(HCO 3 - ) C.常温下,NH 4 Cl和NH 3 •H 2 O的混合溶液[pH=7,c(C1 - )=0.l mol/L]中:c(Cl - )>c(NH 4 + )>c(OH - )=c(H + ) D.浓度均为0.1 mol•L -1 的CH 3 COONa和CH 3 COOH的混合溶液中:c(CH 3 COO - )-c(CH 3 COOH)=2[c(H + )-c(OH - )]  rr的呼吸1年前1
rr的呼吸1年前1 -
 scarlett199 共回答了19个问题
scarlett199 共回答了19个问题 |采纳率100%A.NaHC 2 O 4 溶液呈酸性说的HC 2 O 4 - 的电离程度大于水解程度,所以c(C 2 O 4 2- )>c(H 2 C 2 O 4 ),故A错误;
B.等物质的量的碳酸钠和碳酸氢钠溶液中存在电荷守恒,即c(H + )+c(Na + )=c(OH - )+2c(CO 3 2- )+c(HCO 3 - ),故B错误;
C.溶液呈中性,即c(OH - )=c(H + ),溶液中存在电荷守恒c(Cl - )+c(OH - )=c(NH 4 + )+c(H + ),所以c(Cl - )=c(NH 4 + ),故C错误;
D.根据电荷守恒得c(H + )+c(Na + )=c(CH 3 COO - )+c(OH - ),根据物料守恒得c(CH 3 COO - )+c(CH 3 COOH)=2c(Na + ),所以得c(CH 3 COO - )-c(CH 3 COOH)=2[c(H + )-c(OH - )],故D正确;
故选D.1年前查看全部
大家在问
- 1如图.直线a b c两两相交.已知角一等于30度.角四等于140度.则角3等于
- 2在一定地域内生物与环境所形成的统一整体叫做生态系统.下列不属于生态系统的一是( ) A.一只空鱼缸 B.一个养鱼池 C
- 3市场上某一防晒霜宣称可以防晒.暑假期间,几个学生邀约徒步旅行,准备利用此机会做一个关于防晒霜的实验,看它是否有效.设计实
- 4读图,回答问题小题1:图中景观的形成,与天气关系最为密切的是( ) 小题2:从旅游资源
- 5我乘地铁去上班I ____ the subway _____ go to work.
- 6He s( )himself away for a month to catch up on his academic
- 7如图,一人在A测得山顶M的仰角∝=45°,由A沿AB前进100米,测得M的仰角β=60°,求山高MB.
- 8Sally goes to see a film at seven o'clock on Saturday.seven
- 9如何能提高自己的说话能力、沟通能力、辩论能力、描述能力
- 10She__last night,but I didn't see her A.can have arrived B,mu
- 11某船从甲地顺流航行到乙地需1.6小时,从乙地逆流航行到甲地需2小时,已知船在静水中的速度为一小时45千米
- 12若函数y=√(2x∧2+1),则dy =
- 13as easy to understand as falling off a log”是什么意思
- 14暑假作业——关于科学的问题(浙教版初一下册)
- 15下列说法正确的是( )A.32gO2占有的体积约为22.4LB.28gN2含阿伏加德罗常数个氮原子C.在标准状况下,2
