归中反应和歧化反应如何快速配平比如KClO3与浓HCl反应,氯酸钾中的Cl从+5降为0.盐酸中的Cl从-1升到0,怎么利
 myjjyy2022-10-04 11:39:541条回答
myjjyy2022-10-04 11:39:541条回答
归中反应和歧化反应如何快速配平
比如KClO3与浓HCl反应,氯酸钾中的Cl从+5降为0.盐酸中的Cl从-1升到0,怎么利用这些配平啊,
比如KClO3与浓HCl反应,氯酸钾中的Cl从+5降为0.盐酸中的Cl从-1升到0,怎么利用这些配平啊,

已提交,审核后显示!提交回复
共1条回复
 海南zz团 共回答了14个问题
海南zz团 共回答了14个问题 |采纳率85.7%- 标价,分析变化价位,升的价等于降的价
- 1年前
相关推荐
- 归中反应KClO3 + 6HCl = KCl + 3Cl2 + 3H2O为什么转移5mol电子
归中反应KClO3 + 6HCl = KCl + 3Cl2 + 3H2O为什么转移5mol电子
为什么+5价的Cl 给了3Cl2 五个电子?为什么不用5乘以6(氯气的原子数)? yehong1111年前3
yehong1111年前3 -
 默默等待她 共回答了16个问题
默默等待她 共回答了16个问题 |采纳率100%因为还有HCL是负一价 他要升高失去五个电子才行1年前查看全部
- 铁和过量稀硝酸反应为什么是归中反应?
 巴哈鱼1501年前2
巴哈鱼1501年前2 -
 雨月儿 共回答了5个问题
雨月儿 共回答了5个问题 |采纳率80%你的题目不对.
铁和过量稀硝酸反应:Fe+4HNO3=Fe(NO3)3+NO(气体)+2H2O;是一个氧化还原反应,
但不是归中反应.
归中反应是指同种元素的不同化合物发生氧化还原反应,两种元素的化合价向中间靠拢.
过量铁与稀硝酸反应分两步:
第一步:稀硝酸还足的时候 Fe+4HNO3=Fe(NO3)3+NO(气体)+2H2O;是一个氧化还原反应;
第二步:稀硝酸不足的时候 Fe将三价铁还原为二价铁 2Fe(NO3) 3+Fe=3Fe(NO3)2 ;是一个归中反应,离子反应方程式:Fe+2Fe3+=3Fe2+ .
总化学反应方程式:3Fe + 8HNO3 =3 Fe(NO3) +2NO(气体)+ 4H2O.1年前查看全部
- 归中反应与歧化反应不能交叉什么意思 怎么避免交叉 怎么解决这类问题【即怎么配平方程式】急
归中反应与歧化反应不能交叉什么意思 怎么避免交叉 怎么解决这类问题【即怎么配平方程式】急
请多举几个例子 并写清配平的过程 smilefish02261年前2
smilefish02261年前2 -
 stock_ 共回答了17个问题
stock_ 共回答了17个问题 |采纳率82.4%归中反应 同一元素的化合价由两边向中间价态移动 例2H2S+SO2=2S+2H2O
歧化反应 同一元素的化合价由中间向两边价态移动 CL2+H2O=HCL+HCLO 3NO2+H2O=2HNO3+NO
生成物与反应物的化合价一旦交叉生成物就会再参加反应,最终生成物与反应物的化合价不会交叉(详细可见大学教材)
解决过程:标价态,看价态的改变情况.主要是要多做题目,找感觉.1年前查看全部
- 怎样才能快速配平归中反应和歧化反应的化学方程式
 响当当的心寒141年前1
响当当的心寒141年前1 -
 魔气 共回答了14个问题
魔气 共回答了14个问题 |采纳率78.6%归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢,例如:2H2S+SO2===3S+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开,
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
歧化反应
同一物质中,同一价态的同种元素之间发生电子转移的反应叫做歧化反应.
宜以氧化产物和还原产物为基准分析配平.
例2:Br2 + NaOH — NaBr + NaBrO3 +H2O
分析:该反应属歧化反应,应以氧化产物NaBrO3和还原产物NaBr为基准分析配平.
归中反应
不同价态的同一种元素之间发生电子转移的反应叫做归中反应.
归中反应又可分为不同物质之间发生的归中反应,同种物质中发生的归中反应.
不同物质之间发生的归中反应(同时又属一般氧化还原反应的),这类反应与歧化反应相反,宜以氧化剂和还原剂为基准分析配平.
例3:NaBr + NaBrO3 + CO2 — Na2CO3 + Br2
分析:该反应既是归中反应,又属一般氧化还原反应,应以氧化剂NaBrO3和还原剂NaBr为基准分析配平.1年前查看全部
- 为什么在归中反应中,化合价不会交叉?
为什么在归中反应中,化合价不会交叉?
RT fnjcfjk1年前3
fnjcfjk1年前3 -
 幸福青鸟 共回答了18个问题
幸福青鸟 共回答了18个问题 |采纳率94.4%同种元素的高价态氧化低价态,高价态化合价降低,低价态化合价升高.若氧化产物和还原产物的化合价相同时,称为归中反应.也存在高价态化合价降低,低价态化合价升高,未归中的,但不存在交叉.因为当化合价归中时,该元素的的氧化性或还原性已不存在差别,不会再发生氧化还原反应.1年前查看全部
- 氯酸钾与浓盐酸反应为什么不是归中反应
氯酸钾与浓盐酸反应为什么不是归中反应
为什么KClO3的还原产物不是氯气? 小冰蝎1年前1
小冰蝎1年前1 -
 且开眉 共回答了10个问题
且开眉 共回答了10个问题 |采纳率100%因为同时生成Cl2与ClO2
目前,欧洲一些国家主要采用氯酸钠(NaClO3)氧化浓盐酸的制备方法,化学反应方程式为:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O
http://baike.baidu.com/view/4814.html?wtp=tt1年前查看全部
- 归中反应的氧化剂和还原剂是不是同一种物质?是不是同一种元素?
 乱了乱了全乱了1年前2
乱了乱了全乱了1年前2 -
 mikilv 共回答了11个问题
mikilv 共回答了11个问题 |采纳率81.8%归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢.
所以氧化剂和还原剂不是同一种物质
而歧化反应刚好与归中反应相反,一种元素的化合价向两边散开.这样的反应氧化剂和还原剂是同一种物质.1年前查看全部
- 是不是酸性条件下发生的一定是归中反应,碱性条件下发生的一定是歧化反应?
 MENGZHIXING1年前1
MENGZHIXING1年前1 -
 dalki 共回答了22个问题
dalki 共回答了22个问题 |采纳率90.9%一般来说是这样
但是归中反应不一定在酸性条件下进行,比如C+CO2高温=2CO
歧化反应也不一定在碱性条件下进行,比如2Na2O2+2CO2=2Na2CO3+O21年前查看全部
- 关于归中反应.H2S+H2SO4(浓)===S+SO2+2H2O是归中反应吗?为什么不是+2的S变为+4,+6的S也变为
关于归中反应.
H2S+H2SO4(浓)===S+SO2+2H2O是归中反应吗?
为什么不是+2的S变为+4,+6的S也变为+4呢?
还有归中反应的氧化产物和还原产物都是同一个吗? 天空耀眠的十字星1年前1
天空耀眠的十字星1年前1 -
 hc903 共回答了18个问题
hc903 共回答了18个问题 |采纳率94.4%如果都变为+4价,方程式就是H2S+3H2SO4(浓)=4SO2+4H2O .
是归中反应,归中反应也是氧化还原反应,所以得电子数和失电子数要相等,产物不一定是同一个.归中反应要符合价态只相遇不交叉(比如S-2价和6价反应,6价的不可能把-2价的氧化到+4价,同时-2价的不能把+6价的还原到0价),所以同一产物同价态只是归中反应的极限.1年前查看全部
- 硫离子和硫酸根离子能不能发生归中反应?
硫离子和硫酸根离子能不能发生归中反应?
只生成单质硫吗?硫离子是-2价,硫酸根离子中的硫是+6价,中间价态有0价和+4价,那么硫化钠和硫酸铜能不能发生归中啊? jackhlin1年前4
jackhlin1年前4 -
 永州不ww鸟 共回答了23个问题
永州不ww鸟 共回答了23个问题 |采纳率95.7%硫离子和硫酸根离子能发生归中反应
可生成单质硫,也可转为+4价,
H2S+H2SO4(浓)==== S↓+SO2↑+2H2O
S中化合价为0价,SO2中S显+4价1年前查看全部
- 歧化反应和归中反应怎么判断方程式是发生的是歧化反应还是归中反应 高一学习氧化还原反应有点晕啊!
 stone04311年前1
stone04311年前1 -
 20022443 共回答了20个问题
20022443 共回答了20个问题 |采纳率95%歧化反应是氧化还原反应中只有一种元素变价,且一部分化合价升高,一部分化合价降低.
氯气和水反应就是典型的歧化反应.
归中反应可以说与歧化反应刚好到过来,是只有一种元素变价,且部分元素化合价降低,部分升高,最终化合价在反应物中该元素化合价之间
硫化氢和浓硫酸就是典型的归中反应:-2价和+6价的S归中生成0价的硫单质和+4价二氧化硫气体.1年前查看全部
- 归中反应怎么配平:比如说 Naclo3与弄盐酸反应的方程式生成Cl2,怎么配平,电子得失,
归中反应怎么配平:比如说 Naclo3与弄盐酸反应的方程式生成Cl2,怎么配平,电子得失,
要写出反应方程式 混在多伦多1年前2
混在多伦多1年前2 -
 zym0011 共回答了14个问题
zym0011 共回答了14个问题 |采纳率78.6%NaClO3 ---Cl2 ,+5------0 一个得到5个电子
HCl--------Cl2, -1-------0,一个失去1个电子
1,和5的最小公倍数为5, 所以,给5*1,1*5
1* NaClO3 + (5+1) HCl NaCl + 3Cl2 + 3 H2O1年前查看全部
- 氧化还原反应的不交叉规律是不是归中反应规律的其中一种?
 朵朵3971年前1
朵朵3971年前1 -
 famyear 共回答了15个问题
famyear 共回答了15个问题 |采纳率93.3%不交叉就是指归中1年前查看全部
- 归中反应方程用电子得失法陪平,如Cu2S十H2SO4一CuSO4十S十SO2十H2O.不要给我解释什么是归中反应!用电子
归中反应方程用电子得失法陪平,
如Cu2S十H2SO4一CuSO4十S十SO2十H2O.不要给我解释什么是归中反应!用电子得失法来配平, shmily0221年前2
shmily0221年前2 -
 sugar0923 共回答了16个问题
sugar0923 共回答了16个问题 |采纳率93.8%这个并不是完全的归中反应,除了S的价态在发生归中外,铜的价态也在上升,这样使得用归中反应的配平方法很麻烦,还不如直接利用整体法,
从方程式分析可以看出,Cu2S变成CuSO4和S,而H2SO4变成SO2和CuSO4,
反应中Cu2S的S和Cu都失去电子,一共失去4mol电子,而得到电子的只有H2SO4,1mol得到2mol电子,所以生成的SO2是2mol,再根据质量守恒配平其他物质的系数
Cu2S十4H2SO4==2CuSO4十S十2SO2十4H2O
根据电子得失不能直接配出H2SO4的系数,因为这个反应对H2SO4而言是不完全氧化还原反应.
希望对你有所帮助!1年前查看全部
- 含有同一元素 的不同价态的两种物质,只生成含有此元素的物质和水,其一定是归中反应吗
 weronica1年前1
weronica1年前1 -
 谁有空 共回答了21个问题
谁有空 共回答了21个问题 |采纳率85.7%不一定,H2O2+H2=2H2O,有此反应式可知不一定是1年前查看全部
- 归中反应和歧化反应的化学方程式应该怎么配平?
 老各输己键1年前1
老各输己键1年前1 -
 糖儿宝贝 共回答了14个问题
糖儿宝贝 共回答了14个问题 |采纳率85.7%归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢.
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开,不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象.——归中反应规律 价态归中是指,高价态的化合价降低,低价态的化合价升高,但不可能低的最后升的比原来高价态化合价还高.1年前查看全部
- 归中反应怎么看转移的电子数 LIH+H2O=LIOH+H2,H2有16mol,转移了多少电子
 hope1234567891年前2
hope1234567891年前2 -
 小程酒鬼 共回答了13个问题
小程酒鬼 共回答了13个问题 |采纳率92.3%LIH+H2O=LIOH+H2
-1 +1 +1 0 氢的化合价
我们可以认为 每一个氢气都是一个-1价的氢把电子转移给了+1的氢
所以16mol的氢气就转移了16mol的电子1年前查看全部
- 碱性反应一般为歧化反应吗?酸性反应一般我为归中反应?什么是酸性,碱性反应?
 gang8011年前1
gang8011年前1 -
 狼丫头 共回答了13个问题
狼丫头 共回答了13个问题 |采纳率100%请给我一个好评哦 谢谢一般来说是这样
但是归中反应不一定在酸性条件下进行,比如C+CO2高温=2CO
歧化反应也不一定在碱性条件下进行,比如2Na2O2+2CO2=2Na2CO3+O21年前查看全部
- 氯酸根和氯离子在碱性条件下归中反应产生氯气的方程式
氯酸根和氯离子在碱性条件下归中反应产生氯气的方程式
恨 急 滴 defany1年前1
defany1年前1 -
 2106188 共回答了21个问题
2106188 共回答了21个问题 |采纳率95.2%碱性条件下不能得到氯气1年前查看全部
- 过氧化钠和水反应的电子转移为什么成生物的水中O的电子是过氧化钠转移的,而不是反应物的水和归中反应有关系吗
 改喝红茶的猫1年前1
改喝红茶的猫1年前1 -
 shfl05 共回答了16个问题
shfl05 共回答了16个问题 |采纳率87.5%2Na2O2+2H2O——O2+4NaOH 过氧化钠中的氧为-1价,O2中的氧是0价,NaOH中的氧为-2价,其中2个氧原子得到电子,成为OH-根,2个氧原子失去电子形成氧气.在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原.这种自身的氧化还原反应称为歧化反应.1年前查看全部
- 一个歧化反应和一个归中反应的配平
一个歧化反应和一个归中反应的配平
1、_KClO3 + _HCl =_KCl +_Cl2 + _H2O
根据不交叉原则,Cl2既是氧化产物又是还原产物.Cl分别从+5变成0,从-1变成0.因此KClO3前面应该配1,HCl前面应该配5.氧原子守恒,于是H2O前面配3,还没配完,就发现氢原子不守恒了,这是怎么回事?
2、_H2S + _SO2 =_S + _H2O
S分别从-2,4价变成0,于是H2S前面配4,SO2前面配2,硫原子守恒,于是S前面配6,再配H2O,可是发现H2O的O和H两边怎么也配不平,这到底是怎么回事? 小金蟾1年前2
小金蟾1年前2 -
 visavivi 共回答了11个问题
visavivi 共回答了11个问题 |采纳率90.9%KClO3 + 6HCl =KCl +3Cl2 +3H2O
所有的氯中,KCl中的化合价没有发生变化,因此HCl不能配5,要为这个Cl额外加一个,配6.
2H2S + SO2 =3S +2H2O
你的思路没错的,怎么会配不平呢1年前查看全部
- 关于两道方程式的电子转移数目归中反应的电子转移数目计算6HCL+KClO2==KCl+3Cl2+3H2O中电子转移数目为
关于两道方程式的电子转移数目
归中反应的电子转移数目计算
6HCL+KClO2==KCl+3Cl2+3H2O中电子转移数目为5Na
是怎么计算出来的
双线桥要怎么画
歧化反应呢
Cl2+H2O==HClO+HCl 1mol氯气参加反应,电子转移数目为Na
6HCL+KClO3==KCl+3Cl2+3H2O 女后1年前3
女后1年前3 -
 00112 共回答了21个问题
00112 共回答了21个问题 |采纳率95.2%双线桥:HCL中的CL→CL2(桥上写失5e-)、KCLO3中的CL→CL2(桥上写得5e-)
一个+5的CL被还原成0,五个-1的CL被氧化成0
HCL作还原剂,不可能吧KCLO3中的+5价的CL还原成-1价
就如KCLO3作氧化剂,不可能把HCL中的CL-也氧化成+5价一样
化学的氧还里可没有青出于蓝而胜于蓝的情况1年前查看全部
- 氧化还原反应.1)什么是归中反应2)什么是歧化反应3)氧化反应是元素化合价升高的反应.那为什么有元素化合价升高的物质是还
氧化还原反应.
1)什么是归中反应
2)什么是歧化反应
3)氧化反应是元素化合价升高的反应.那为什么有元素化合价升高的物质是还原剂不是氧化剂?是不是没什么原因就是这样规定的?
4)怎么判断物质具有还原性还是氧化性?例如:

最上面那排物质怎么判断.不太清楚. hanzongan11年前1
hanzongan11年前1 -
 feitianmao1998 共回答了19个问题
feitianmao1998 共回答了19个问题 |采纳率94.7%【1】氧化还原反应中的归中反应: 含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应.【2】在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,...1年前查看全部
- 归中反应电荷转移怎么不正常啊 比如KClO3+6HCl===KCl+3Cl2+3H2O 怎么确定转移的电荷 和别的不一样
归中反应电荷转移
怎么不正常啊 比如KClO3+6HCl===KCl+3Cl2+3H2O 怎么确定转移的电荷 和别的不一样
就是归中反应 月亮Anne1年前1
月亮Anne1年前1 -
 christine515 共回答了20个问题
christine515 共回答了20个问题 |采纳率90%1molKClO3中+5价的Cl得到5molHCl中Cl-的电子共6molCl变成3molCl2,有一份HCl中的Cl-不变和钾+离子生成KCl盐
这完全是正确的呀!反应共转移5mol电子1年前查看全部
- 有关归中反应和歧化反应我们老师说歧化反应被歧化的元素在反应后化合价一个升高,一个降低,我问他那么能不能一个升高(或降低)
有关归中反应和歧化反应
我们老师说歧化反应被歧化的元素在反应后化合价一个升高,一个降低,我问他那么能不能一个升高(或降低)而另一个不变呢?他说不能.他还说过归中反应和歧化反应是相反的,那么归中反应中某元素的化合价能不能一个归中而一个不变呢?
说个例子,MnO2+4HCl=====MnCl2+Cl2↑+2H2O中,氯元素发生歧化反应,一个降到0价,一个不变,按老师的话来说这不应该是歧化反应,但我看很多人都说过这是一个歧化反应,那么它到底是不是歧化反应呢? 隆高贯云霓1年前1
隆高贯云霓1年前1 -
 翠美 共回答了22个问题
翠美 共回答了22个问题 |采纳率81.8%气化是一部分化合价变高,一部分变低,不能不变的啊
像你这个,既不是岐化,也不是归中
归中可以说是岐化的逆过程,一个高的,一个低的,反应到中间价态1年前查看全部
- 归中反应和歧化反应如何快速配平比如KClO3与浓HCl反应,怎么配平,讲详细一点,
 liu7312121年前2
liu7312121年前2 -
 zhdshzh 共回答了20个问题
zhdshzh 共回答了20个问题 |采纳率80%化合价升降法(得失电子守恒),可以快速配平.详细的解答资料书里都有,你自己仔细看看啊.比如正五价的氯离子和负一价的氯离子(就是你上面的例子中氯的化合价)发生归中反应,那么生成物是单质氯气(0价态)那么正五价的氯离子就获得了5个电子,而负一价的氯离子就得到了一个电子,那么负一价的氯离子所在的化合物氯化氢就得五倍的量才能和正五价的氯所在的化合物达到一个得失电子平衡,但同时我们也要考虑到盐酸不仅做了还原剂,同时还起了酸的作用.1年前查看全部
- 卤族元素为什么与碱发生歧化反应rt从0价有的变成正价有的变成负价,这些正价与负价的元素什么不会发生归中反应
 hd5631年前1
hd5631年前1 -
 chipi 共回答了19个问题
chipi 共回答了19个问题 |采纳率94.7%首先歧化反应是氧化还原反应,那么肯定存在化合价的升高和下降,很明显碱不会有化合价的升高和下降,卤族元素有多种价态,有正的负的和0,歧化就是一中物质化合价的升高和下降,卤族元素满足!
可以发生呀,但是你说的是卤族元素碱发生歧化反应,碱是金属阳离子或NH4-加OH形成,卤族元素在这是0价,发生氧化还原反应只有他化合价的升高和下降,金属阳离子或NH4-它们不会发生价态变化,卤族元素和碱发生歧化反应不可能金属阳离子化合价降低生成金属吧!1年前查看全部
- 归中反应都是化合反应么 歧化反应都是分解反应么.不是的话举一个例子.
归中反应都是化合反应么 歧化反应都是分解反应么.不是的话举一个例子.
歧化反应和归中反应的复杂化学方程式有什么配平的规律么.
是不是可以将“还原反应和氧化反应在同种元素中进行就是歧化或者归中反应”? 小小小了1年前3
小小小了1年前3 -
 帅的想ee 共回答了17个问题
帅的想ee 共回答了17个问题 |采纳率94.1%SO2+2H2S=3S+2H2O 归中
Cl2+H2O=HClO+HCl 歧化
是的 规律一般跟普通的配平一样 找最小公倍数么,1年前查看全部
- 2Na2O2+2CO2====2Na2CO3+O2 能发生归中反应吗?
 kryx0021年前3
kryx0021年前3 -
 雨点妹妹 共回答了19个问题
雨点妹妹 共回答了19个问题 |采纳率78.9%Na2O2中的O是-1价,它和CO2反应后生成O为-2价的Na2CO3和O为0价的O2
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象.1年前查看全部
- 请列举归中反应和歧化反应的常见方程式至少各五个
 艾翊翎1年前2
艾翊翎1年前2 -
 海水心 共回答了27个问题
海水心 共回答了27个问题 |采纳率96.3%归中反应:
C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
2FeCl3+Fe=3FeCl2
歧化反应:
Cl2+2NaOH=NaCl+NaClO+H2O
2Na2O2+2CO2====2Na2CO3+O2
3NO2+H2O=2HNO3+NO
Br2+H2O=HBr+HBrO
Cu2O+H2SO4=CuSO4+Cu+H2O1年前查看全部
- 什么是归中反应,它的用法是什么呢?能举一化学方程式电子转移的双线桥吗?
 ca2241年前1
ca2241年前1 -
 独往来 共回答了17个问题
独往来 共回答了17个问题 |采纳率94.1%归中反应就是指含有同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢,例如:2H2S+SO2===3S+2H2O Fe3+ + Fe=Fe2+1年前查看全部
- 氯离子什么情况下生成氯气除了归中反应以外
 宇宙彼岸1年前2
宇宙彼岸1年前2 -
 柳萌萌 共回答了16个问题
柳萌萌 共回答了16个问题 |采纳率75%浓盐酸与二氧化锰加热制取氯气.1年前查看全部
- 方程式配平求讲解.两端配平法,逆向配平,归中反应的配平,缺项配平,会几个讲几个
 萄就是不吐葡萄皮1年前1
萄就是不吐葡萄皮1年前1 -
 一点红 共回答了20个问题
一点红 共回答了20个问题 |采纳率95%汗,来搞这么多 搞乱学生.我就2个 百配百行!你先看看反应有没化合价的变化 你高一学了氧化还原了吗?你懂没化合价的变化吧?例如复分解反应那些 看到没化合价变化的 直接用初中的方法去配!看到有化合价的变化的 如果是书本的方程式 我建议你背1背 不用每次都配这么麻烦 当然你要掌握氧化还原的配平方法.!其实只要用电子守恒 电子守恒懂吧?我举个例子 稀硝酸和铜的反应 CU+HNO3=NO+CU(NO3)2+H2O 这个方程式好难直接去配 所以用电子守恒去搞 先标出反应物、生成物的化合价CU0价 hon3的 N是+5 然后其他化合价都标出来 然后写生成物的化合价 NO中 N是+2 CU是+2 那么你想 根据电子得失守恒 1个CU变成1个硝酸铜失去2个电子 1个硝酸变成1个一氧化氮失去3个电子 然后既然要电子守恒嘛 那么就乘他的最小公倍数 又因为HNO3变成硝酸铜和NO 先不配他 先配铜 铜乘以3 然后再配NO是2 然后再配出HNO3就是8了!然后把其他方程式配平
高中只要掌握这2种就行了.!纯手打 累啊!1年前查看全部
- -2价的硫和 6的硫发生归中反应的产物
-2价的硫和 6的硫发生归中反应的产物
0价和正4的价的硫都有.
可以都是一个价态吗?比如都是0价的 赤道朝阳1年前2
赤道朝阳1年前2 -
 十一月二五礼拜几 共回答了14个问题
十一月二五礼拜几 共回答了14个问题 |采纳率85.7%可以啊 都有可能的 依据题意来看的1年前查看全部
- O3+2KI+H2O===2KOH+I2+O2是价态归中反应吗?
 三朵云21年前1
三朵云21年前1 -
 lhbyi 共回答了10个问题
lhbyi 共回答了10个问题 |采纳率90%不属于
归中反应只是只同一元素的价态变化,反应物中某元素价态既有降,又有升,最后在生成物中归为同一个价态,即为归中反应:
2H2S+SO2===3S+2H2O1年前查看全部
- 电极电势 当电极电势满足什么条件时有利于发生归中反应 和 歧化反应?
 文竹雅静1年前2
文竹雅静1年前2 -
 hermit2003 共回答了18个问题
hermit2003 共回答了18个问题 |采纳率83.3%这个应该书上有的,这个是电化学和分析化学上有的
解释太复杂...1年前查看全部
- 氧化还原反应中的归中反应和歧化反应的特点是什么
 下沙半岛1年前2
下沙半岛1年前2 -
 皇家马德里0314 共回答了18个问题
皇家马德里0314 共回答了18个问题 |采纳率100%⑴电子转移发生在不同价态的同种元素之间;⑵电子转移发生在同种价态的同种元素之间.第一种情况为归中反应.元素化合价变化特点是:高价降低,低价升高.归中反应的特点是:价态靠拢.第二种情况为歧化反应.元素化合价变化特点是:某元素一部分原子价态升高,另一部分原子价态降低.歧化反应的特点是:价态分开.1年前查看全部
- 除了有置换反应 化合反应 复分解反应 氧化还原反应 分解反应 归中反应 歧化反应 还有什么反应类型
除了有置换反应 化合反应 复分解反应 氧化还原反应 分解反应 归中反应 歧化反应 还有什么反应类型
可不可以给我解释一下:归中反应和歧化反应的区别,还有和氧化还原反应的区别. hahatu1年前3
hahatu1年前3 -
 蓝色风吟 共回答了23个问题
蓝色风吟 共回答了23个问题 |采纳率91.3%你说的那些反应并不是属于同一分类下的……
对于无机反应来说,其实就分为氧化还原反应和非氧化还原反应.
化合、分解、置换、复分解被称为“四大基本反应”,但是囊括的范围并不大,有许多的反应都不属于这四类.但是,置换一定是氧化还原反应,复分解一定是非氧化还原反应.化合和分解则有些是氧化还原反应,有些不是.举例:
SO3 + H2O = H2SO4(化合,非氧化还原)
4K + O2 = 2K2O(化合,氧化还原)
H2CO3 = H2O + CO2↑(分解,非氧化还原)
2H2O2 = 2H2O + O2↑(分解,氧化还原)
Fe + CuSO4 = FeSO4 + Cu(置换,氧化还原)
CH3COONa + HCl = CH3COOH + NaCl(复分解,非氧化还原)
注:一般情况下,除了同素异形体之间的转化(如O2和O3之间的转化),只要有单质参与反应(不管是作为反应物还是生成物),这个反应都是氧化还原反应!但是不是所有的氧化还原反应都必须有单质参与!
归中和歧化是两种特殊的氧化还原反应.归中和歧化有一个共同点,就是氧化剂、还原剂中,变价的元素是一样的.归中是指,氧化产物和还原产物中变价元素的化合价相同;歧化是指,氧化剂和还原剂中变价元素的化合价相同.
而且通常情况下,归中反应的氧化产物和还原产物是相同的,歧化反应的氧化剂和还原剂是相同的.
举例:
2K2S + K2SO3 + 3H2SO4 = 3S↓ + 3K2SO4(归中反应,氧化剂是K2SO3,还原剂是K2S,两者中变价元素都是S.氧化产物和还原产物都是S,价态相同)
3S + 6KOH = 2K2S + K2SO3 + 3H2O(歧化反应,氧化剂和还原剂都是S,变价元素相同,价态相同)1年前查看全部
- 硫代硫酸钠和氧气反应还有此物在空气中加热分解的反应以及2个反应的反应类型。是歧化反应还是归中反应?
 不浪费1年前1
不浪费1年前1 -
 汉司 共回答了19个问题
汉司 共回答了19个问题 |采纳率94.7%硫代硫酸钠和氧气反应,在常况下加热,氧气先置换不在硫代硫酸根中心的的硫原子,所以在空气中加热会看到白色的硫代硫酸钠逐渐变黄.
之后硫单质再进一步被氧化,生成二氧化硫.
以上以此有反应:
2Na2S2O3 + O2 =△= 2Na2SO4 + S
S + O2 =△= SO2
按照中学普遍的观点,第一步是O2氧化硫代硫酸根中心的的硫原子,并还原出外侧S原子.
但是中学也存在这样的观点,认为硫代硫酸根中心的的硫原子的化合价为+6价,外侧S原子化合价为-2价,所以中心S原子反应后化合价不变,只有外侧S原子的氧化.
第二步为化合反应.
以上反应既无歧化也无归中.
楼主对歧化的认识恐怕有存在问题,歧化反应是没有外界反应物介入,而同一物质中同一类原子,一部分化合价升,一部分化合价降的反应.
有疑问就再问吧~1年前查看全部
- 溴化钾和溴酸钾在酸性溶液中发生归中反应,溴元素全部变为溴单质的反应方程式是什么?
 zzfrent1年前2
zzfrent1年前2 -
 a310054903 共回答了22个问题
a310054903 共回答了22个问题 |采纳率90.9%5KBr+KBrO3+3H2SO4===3Br2+3H2O+3K2SO41年前查看全部
- 可以帮忙归纳一下高中所有歧化、归中反应吗
可以帮忙归纳一下高中所有歧化、归中反应吗
感激不尽 穿心箭11111年前1
穿心箭11111年前1 -
 leeweizh 共回答了19个问题
leeweizh 共回答了19个问题 |采纳率89.5%归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢.
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开,
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象.——归中反应规律
价态归中是指,高价态的化合价降低,低价态的化合价升高,但不可能低的最后升的比原来高价态化合价还高.
归中现象:
1、氧化还原反应中的归中反应:
含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应.发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应.而且高低价态变化的结果是生成该元素的中间价态.归中反应的特点是氧化产物和还原产物是同一种物质.利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的硫).
C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
2Fe3++Fe=3Fe2+
6HCl+KClO3=KCl+3Cl2↑+3H2O
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O
CuO+Cu=Cu2O
2Na+Na2O2 2Na2O
2.、复分解反应中的归中反应:
复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应.其中反映的归中规律正是酸式盐的形成条件.
(1) 碱与多元酸反应:当多元酸过量时可形成酸式盐:
NaOH+H2S=NaHS+H2O;
H2SO4十NaOH=NaHSO4十H2O
(2) 多元酸与对应的正盐反应:
Na2S+H2S=2NaHS
CaCO3+H2O+CO2=Ca(HCO3)2
MgCO3+H2O+CO2=Mg(HCO3)2
Na2SO4+H2SO4=2NaHSO4
(NH4)2SO3+SO2+H2O=2NH4HSO3
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
(3) 多元酸与对应的酸式盐
Na2HPO4+H3PO4=2NaH2PO4
(4) 正盐与对应的酸式盐:
NaH2PO4+Na3PO4=2Na2HPO4
如果把正盐和碱中所含的可电离的氢离子看成是零,那么,生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子.如果两种反应物的组成相差两个以上可电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合“显强性”原理,即生成物的组成接近于过量物的组成.
如 (注:n表示物质的量)
≤1,其反应为:H3PO4+NaOH=NaH2PO4+H2O
在1—2之间,其反应为:2H3PO4+3NaOH=NaH2PO4+Na2HPO4+3H2O
=2,其反应为:H3PO4+2NaOH=Na2HPO2+2H2O
在2—3之间,其反应为:2H3PO4+5NaOH=Na2HPO4+Na3PO4+5H2O
≥3,其反应为:H3PO4+3NaOH=Na3PO4+3H2O
又如
≥2,其反应为:2H3PO4+Na3PO4=3NaH2PO4
=1,其反应为:H3PO4+Na3PO4=NaH2PO4+Na2HPO4
≤ ,其反应为:H3PO4+2Na3PO4=3Na2HPO4
3.、双水解反应中的归中反应:
这类归中反应是指能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的一类反应.这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉淀的归中现象.如:
Al3++3 +6H2O=4Al(OH)3↓
Zn2++ +2H2O=2Zn(OH)2↓
“高价+低价→中间价”解释:
例:2H2S+SO2===3S+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水
编辑词条歧化反应
在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原.这种自身的氧化还原反应称为歧化反应.
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
还有Cl2+H2O=HClO+HCl
此反应中Cl2原本是0价
反应后一个升为+1价,一个降为-1价
歧化反应是化学反应的一种,反应中某个元素的化合价既有上升又有下降.
例子
氯气与氢氧化钠溶液反应,生成氯化钠、氯酸钠和水.其离子方程式为:
3Cl2 + 6OH− = 5Cl− + ClO3− + 3H2O
氯气中氯的化合价为0.氯化钠中氯的化合价下降到-1;而氯酸钠中氯的化合价则上升到+5.所以,该反应是歧化反应.1年前查看全部
- 什么是归中反应KI与ICl,IBr反应是否是归中反应,从化合价角度帮我解释下
 sillygeorgia1年前1
sillygeorgia1年前1 -
 风吹云乱心动 共回答了19个问题
风吹云乱心动 共回答了19个问题 |采纳率94.7%是
归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢
KI中I的化合价为-1,ICl与IBr中I的化合价为+1,KI与ICl,IBr反应产物中I的化合价为0,I元素的化合价向中间靠拢1年前查看全部
- 请问什么是归中反应 请举一例说明
 litao37211年前1
litao37211年前1 -
 醉里得真如 共回答了17个问题
醉里得真如 共回答了17个问题 |采纳率94.1%归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢.
归中现象:1、氧化还原反应中的归中反应:含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应.发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应.而且高低价态变化的结果是生成该元素的中间价态.利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的硫).C+CO2=2CO SO2+2H2S=3S↓+2H2O H2SO3+2H2S=3S↓+3H2O H2S+3H2SO4(浓)=4SO2+4H2O 2Fe3++Fe=3Fe2+ 6HCl+KClO3=KCl+3Cl2↑+3H2O 5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O CuO+Cu=Cu2O 2Na+Na2O2=2Na2O 2.、复分解反应中的归中反应:复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应.其中反映的归中规律正是酸式盐的形成条件.(1) 碱与多元酸反应:当多元酸过量时可形成酸式盐:NaOH+H2S=NaHS+H2O; H2SO4十NaOH=NaHSO4十H2O (2) 多元酸与对应的正盐反应:Na2S+H2S=2NaHS CaCO3+H2O+CO2=Ca(HCO3)2 MgCO3+H2O+CO2=Mg(HCO3)2 Na2SO4+H2SO4=2NaHSO4 (NH4)2SO3+SO2+H2O=2NH4HSO3 Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2 (3) 多元酸与对应的酸式盐 Na2HPO4+H3PO4=2NaH2PO4 (4) 正盐与对应的酸式盐:NaH2PO4+Na3PO4=2Na2HPO41年前查看全部
- 元素 归中反应同一元素的最高价化合物与最低价化合物之间反应,能举出几个例子?比如,S H2S+H2SO4=S+SO2+2
元素 归中反应
同一元素的最高价化合物与最低价化合物之间反应,能举出几个例子?
比如,S H2S+H2SO4=S+SO2+2H2O 一个男人两个蛋1年前3
一个男人两个蛋1年前3 -
 task1985 共回答了20个问题
task1985 共回答了20个问题 |采纳率85%C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
2Fe3++Fe=3Fe2+
6HCl+KClO3=KCl+3Cl2↑+3H2O
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O1年前查看全部
- 请问此反应属于归中反应么?Na2SO3+H2SO4=Na2SO4+H20+SO2反应物无非就是进行了复分解反应.那么这个
请问此反应属于归中反应么?
Na2SO3+H2SO4=Na2SO4+H20+SO2
反应物无非就是进行了复分解反应.那么这个是不是属于归中反应呢?
另外判断同种元素的化合物之间是否有氧化还原反应,是不是只要看有没有中间价态即可?
话说回来,那我怎么能知道到底是发生复分解反应还是氧化还原反应呢? 呼吸的不只是空气1年前3
呼吸的不只是空气1年前3 -
 寻人启示2007 共回答了18个问题
寻人启示2007 共回答了18个问题 |采纳率94.4%不属于,连氧化还原反应都不是
不是,要看氧化性,譬如氯气氧化溴离子
看化合价是否改变1年前查看全部
- 同种元素不同价态间发生归中反应时,元素的化合价只接近而 不交叉,最多只能达到同种价态 为什么
 youth20091年前2
youth20091年前2 -
 athws 共回答了12个问题
athws 共回答了12个问题 |采纳率91.7%同种元素不同价态间发生归中反应时,元素的化合价只接近而不交叉,最多只能达到同种价态.为什么?含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应.发生归中反应的条件是要...1年前查看全部
- 问题如图所示 请问反应②是归中反应吗?如果是怎样用在同种元素不同价态间若发生反应化合价只靠近不交叉
问题如图所示 请问反应②是归中反应吗?如果是怎样用在同种元素不同价态间若发生反应化合价只靠近不交叉
问题如图所示 请问反应②是归中反应吗?如果是怎样用在同种元素不同价态间若发生反应化合价只靠近不交叉的规律解释?
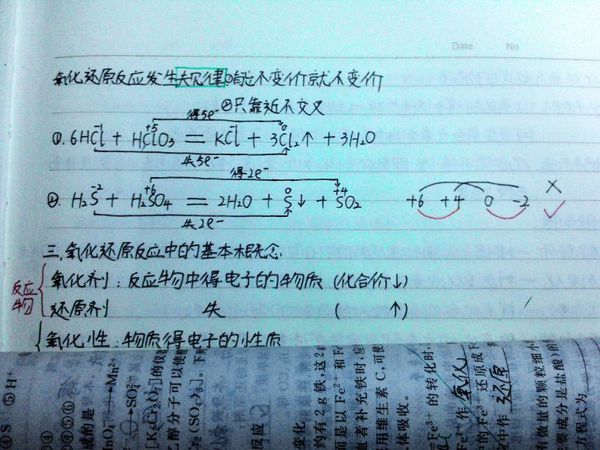
 四夜3311年前1
四夜3311年前1 -
 爱谦的巴豆1 共回答了18个问题
爱谦的巴豆1 共回答了18个问题 |采纳率94.4%不是归中反应,+6到+4 -2到0价.也不属于歧化.只是氧化还原1年前查看全部
- 归中反应中的化合价只靠拢,(主要是不交叉)
 马拉松石油1年前1
马拉松石油1年前1 -
 大钢蹦儿 共回答了12个问题
大钢蹦儿 共回答了12个问题 |采纳率91.7%就是假如-1价和+5价,不能分别变成+3价和+1价,这样就交叉了,第一个升了四价第二个降了四价.所以不能交叉.1年前查看全部
- 硫化钠和亚硫酸钠为什么要共存?硫离子不是负二价,而亚硫酸钠中硫又是正四价,两者应该发生归中反应,生成硫单质吗?为什么它们
硫化钠和亚硫酸钠为什么要共存?
硫离子不是负二价,而亚硫酸钠中硫又是正四价,两者应该发生归中反应,生成硫单质吗?为什么它们不反应,而要共存呢?
但是为什么必须要在酸性条件下才可以呢?
那么,硫化氢和亚硫酸钠共存吗? nkkn20001年前2
nkkn20001年前2 -
 shi0897 共回答了18个问题
shi0897 共回答了18个问题 |采纳率88.9%四价硫只有在酸性条件下才有氧化性,能斯特方程是大学中学到的,见无机化学,硫化氢和亚硫酸钠能反应生成S沉淀,硫化氢电离出H离子,使溶液成酸性1年前查看全部
大家在问
- 1氮气球飘得起来吗相对分子质量是28 空气差不多是29 气球就是普通大小那么加上气球原本的质量 应该漂不起来反而下降吧我这
- 2化学 苯酚钠苯酚钠和CO2反应为什么能生成 苯酚钠带一个羧基啊?还有 连接在C原子上的-CN 加浓硫酸加热 能变成-CO
- 3这条牛仔裤不是新的用英语
- 4(2014•滨州)水是生命之源.植物的生命活动离不开水,同时还要不断地向外散失水分,水分的散失受多种因素的影响.小刚同学
- 5“the girl play the piano very wonderful”有没有错?
- 6解释下列现象.(从微观角度)(1)晾干湿的衣服(2)打开白酒瓶,闻到酒香(3)将红墨水滴入水中,水变红色
- 7继写狐狸与乌鸦 作文
- 8直线l与椭圆 x 2 3 + y 2 =1 交于不同的两点P 1 ,P 2 ,线段P 1 P 2 的中点为P,设直线l的
- 9lucy often goes to the zoo after school 对goes to zoo 提问
- 10截竿进城老父提出建议之前为什么要说“吾非圣人,但见事多矣”
- 11(2005•宣武区二模)下列几种物质在盛满空气的密闭容器中燃烧,会使瓶内压强明显降低的是( )
- 12下面是阳光小学春季植树情况统计表
- 13以“我身边的爱”为题写一篇不少于60个词的英语短文.
- 14下雨了 作文
- 15挂式空调一小时多少度电怎么计算?
