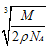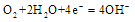Cu电子排布到底是3d94s2还是3d104s1
 dav701812022-10-04 11:39:542条回答
dav701812022-10-04 11:39:542条回答为什么?

已提交,审核后显示!提交回复
共2条回复
 怪浪人人 共回答了21个问题
怪浪人人 共回答了21个问题 |采纳率95.2%- 3d10 4s1
因为轨道半满和全满的时候原子结构更稳定,3d10全满4s1是半满,比3d9 4s2稳定 - 1年前
 loner1999 共回答了2个问题
loner1999 共回答了2个问题 |采纳率- 是3d104s1,Cu是B1族的,所以s轨道上都是一个电子。d轨道是五条轨道,铜一价时失的就是s上的电子。
- 1年前
相关推荐
- 最外层电子排布(追50分)看元素周期表上写了一些东西 由字母和数字组成 比如说 铀 下面写 5f3 6d1 7s2
 大智于1年前1
大智于1年前1 -
 jiang8679 共回答了14个问题
jiang8679 共回答了14个问题 |采纳率85.7%这些东西,是对原子核外电子运动状态的数字化描述.s,p,d,f是电子亚层的名称.例如7s2,是指在第七电子层的s亚层上,有两个电子.元素周期表中,由于每一格空间较小,只够写出外围电子排布式.你给出的示例铀,是从1s2 2s2 2p6.开始排列的,一直到7s2结束.
排布原理:你知道,电子分布在不同的电子层上,实际上他们分布的规则是根据电子的能量差异和空间运动范围.
而在同一电子层中,电子之间也是有能量差异的,于是将他们细分为电子亚层.各个电子层中电子亚层的数目与电子层的序数相等,同一电子层中,处于不同亚层的电子是按照s,p,d,f递增的.s亚层最多容纳2个电子,p最多6个,d最多10个,f最多14个,
排布方式:每一个原子的核外电子,都是先进入第一电子层的s亚层,因为s亚层只能容纳2电子且第一层只有s亚层,剩余电子进入第二层s亚层,剩余进入第二层p亚层,剩余进入第三层s亚层……一直到核外电子全部排列完毕,原则是按能量排列.
细节上的轨道能级与电子云,这里不作介绍.你感兴趣可以查一查资料.1年前查看全部
- 溴的外围电子排布为什么是氩4s24p5而不是氩3d104s24p5
 airily1年前2
airily1年前2 -
 koalaannie 共回答了16个问题
koalaannie 共回答了16个问题 |采纳率93.8%Br的核外电子排布应该是 [Ar] 3d10 4s2 4p5
但价电子是4s2 4p5
因为主族元素的价电子,不包括内层电子.1年前查看全部
- (1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有______种,原子中所有电子占有_____
(1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有______种,原子中所有电子占有______个轨道,核外共有______个不同运动状态的电子.
(2)E原子核外占有9个轨道,且具有1个未成对电子,E离子结构示意图是______.
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是______,F2-的电子排布式是______.
(4)M能层上有______个能级,有______个轨道,作为内层最多可容纳______个电子,作为最外层时,最多可含有______个未成对电子.
(5)在元素周期表中,最外层只有1个未成对电子的主族元素原子处于______族;最外层有2个未成对电子的主族元素原子处于______族. fhy10131年前0
fhy10131年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 电子排布表达式在用轨道表示式画电子分布得时候亚层d会不会出现?比如说:Cu得轨道表达式具体该怎么画?
 徐雪芳1年前3
徐雪芳1年前3 -
 注定成灰 共回答了15个问题
注定成灰 共回答了15个问题 |采纳率100%不需要区分亚层.
Cu 2 8 18 11年前查看全部
- 关于电子层一个原子,为什么最外层电子8个时容易稳定?过度元素的电子排布为什么那么奇怪?这个我都知道的!泡利不相容原理是不
关于电子层
一个原子,为什么最外层电子8个时容易稳定?
过度元素的电子排布为什么那么奇怪?
这个我都知道的!
泡利不相容原理是不是在某种情况下两个费米子不能有相同的量子数?
第三个同学说的好像没道理,像“砹”这种元素呢? gzpwb1年前1
gzpwb1年前1 -
 温少 共回答了16个问题
温少 共回答了16个问题 |采纳率87.5%电子层之一
电子层是电子在原子中处于不同的能级状态,粗略说是分层分布的.电子层可用n(n=1、2、3…)表示,n=1表明第一层电子层(K层),n=2表明第二电子层(L层),依次n=3、4、5时表明第三(M层)、第四(N层)、第五(O层).一般随着n值的增加,即按K、L、M、N、O…的顺序,电子的能量逐渐升高、电子离原子核的平均距离也越来越大.
电子层之二
在多电子的原子里,根据电子的能量的差异和通常运动区域离核的远近不同,将核外电子分成不同的电子层.
通过对许多种元素的电离能分析,人们发现,电子可以分成能量相近的若干组电子,每一个电子组即为一个电子层.依据能量由低到高,电子离核由近及远,依次称为1、2、3、……电子层,分别用符号K、L、M、N、O、P等表示.
电子层又叫能层.电子层不能理解为电子在核外一薄层空间内运动,而是按电子出现几率最大的区域,离核远近来划分的.1年前查看全部
- 有人把氢在周期表的位置从第ⅠA移至第ⅦA,怎样从电子排布和化合价理解
 kirkzx1年前1
kirkzx1年前1 -
 陶工 共回答了20个问题
陶工 共回答了20个问题 |采纳率85%从电子排布上,氢的最外电子层上有一个电子,还差一个就可以形成稳定结构,而ⅦA族的元素最外电子层上有7个电子,还差1个形成稳定结构,.从化合价上,氢元素有-1价,而ⅦA族得大部分元素都有-1价.综合以上两点,把氢在周期表的位置从第ⅠA移至第ⅦA有一定道理1年前查看全部
- 电子排布相同 电子层结构相同 这两者有什么区别,分别是什么意思.离子核外电子总数又是什么意思?
电子排布相同 电子层结构相同 这两者有什么区别,分别是什么意思.离子核外电子总数又是什么意思?
如题. 零点我难眠1年前1
零点我难眠1年前1 -
 6165623 共回答了18个问题
6165623 共回答了18个问题 |采纳率88.9%电子排布相同就是指粒子的核外电子在电子轨道、空间结构等反面相同,这个比较复杂,这里很难细说.电子层结构相同就是核外电子的分布表观上相同,如氖原子:2,8(表示第一层电子层有两个电子、第二层电子层有8个电子.)和钠离子(Na+):2,8就是电子层结构相同.粒子核外电子总数就是某离子所带的电子总数,如上述的Na+离子核外电子总数是10,Ca2+(2,8,8)子核外电子总数是18.还有离子的最外层电子数,如Ca2+的是81年前查看全部
- 主族元素和副族元素的电子排布有什么不同的特征?——主族元素包含S区和P区,副族元素则包含D区,ds区
 粗面条1年前1
粗面条1年前1 -
 rooney2 共回答了13个问题
rooney2 共回答了13个问题 |采纳率92.3%d区:从IIIB族至VIII族,(n-1)d电子数+ns电子数=族序数(VIII族的是8、9、10),其中VIB族的,(n-1)d电子数一般为5,ns电子数为1
ds区:指的是IB和IIB两族,(n-1)d电子数为10,ns电子数为1、2f区:无论高中还是大学都暂不要求1年前查看全部
- 核电荷数为12的元素的原子失去两个电子,形成的粒子符号——,他的河外电子排布与什么元素的原子核外电子排布相同
 carollujuan1年前1
carollujuan1年前1 -
 zhangyu881215 共回答了20个问题
zhangyu881215 共回答了20个问题 |采纳率95%Mg2+
Ne1年前查看全部
- 一到高二化学题(共价化合物电子排布)求解
一到高二化学题(共价化合物电子排布)求解
能形成XY2共价化合物的元素X和Y,其原子最外层电子排布是
A 3s2和3s2 3p5
B 2s2 2p2和2s2 2p4
C 1s1和3s2 3p4
D3s2 3p4和2s2 2p4 002857001年前3
002857001年前3 -
 杭铁头 共回答了23个问题
杭铁头 共回答了23个问题 |采纳率95.7%用代入法解决就行
A 3s2和3s2 3p5 分别为 Mg 和 Cl 形成离子化合物 MgCl2
B 2s2 2p2和2s2 2p4 分别为 C和O 形成共价化合物CO2或CO
C 1s1和3s2 3p4 分别为 H和S 形成共价化合物H2S
D3s2 3p4和2s2 2p4 分别为 S和O 形成共价化合物SO2或SO3
所以答案为BD1年前查看全部
- BF3是平面三角形,NF3是三角锥形,用杂化轨道理论解释.我想请问的是,N原子价电子排布为2s^2 2p^3,原来有五个
BF3是平面三角形,NF3是三角锥形,用杂化轨道理论解释.我想请问的是,N原子价电子排布为2s^2 2p^3,原来有五个电子五条轨道,为什么会出现一个sp^3杂化,只有四条轨道?
好吧、五个电子四条轨道。我知道了。 skidrow1年前1
skidrow1年前1 -
 cxp495 共回答了20个问题
cxp495 共回答了20个问题 |采纳率80%NF3分子中的N原子使用了比较特殊的不等性sp3杂化,
其中3个杂化轨道分别与3个F原子形成N-F单键,
另一个杂化轨道为孤对电子所占据,所以NF3分子呈三角锥形
2个s电子占据一个轨道,三个p电子各占据一个轨道,所以也就是4个轨道
并不是你所认为的一个电子一个轨道1年前查看全部
- A、B、C、D、E、F六种短周期元素的原子序数依次增大.A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D
A、B、C、D、E、F六种短周期元素的原子序数依次增大.A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D元素的最外层电子数是其电子层数的3倍,F的最高价氧化物对应水化物有两性,能溶于C、E的最高价氧化物对应水化物中.试回答:
(1)写出C原子的价层电子轨道表示式:______;D原子的价层电子排布式:______,E的原子结构示意图:______;
(2)B位于元素周期表的第______族,A、B形成原子个数比1:1且直线形分子的结构式:______;
(3)C的基态原子核外有______种不同运动状态的电子;
(4)E单质在空气中燃烧生成物的电子式:______,其中的阳离子与阴离子的个数比是______;
(5)F的固态氧化物的用途有______(说出一种).F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是4Al+3TiO2+3C
2Al2O3+3TiC高温 .4Al+3TiO2+3C.
2Al2O3+3TiC高温 . star-1111年前0
star-1111年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为什么铜通常显+2价?铜的外围电子排布是1s2 2s2 2p6 3s2 3p6 3d10 4s1它最外层只有一个电子,且
为什么铜通常显+2价?
铜的外围电子排布是1s2 2s2 2p6 3s2 3p6 3d10 4s1
它最外层只有一个电子,且d轨道又处于全满状态,为什么铜通常会显+2价? xinjiangyrc1年前6
xinjiangyrc1年前6 -
 323029 共回答了14个问题
323029 共回答了14个问题 |采纳率92.9%+2价较稳定,就像为什么空气中氧是0价一样,O2 0价
CO2 -2价
H2O2 -1价
OF2 +2价其他的都不稳定1年前查看全部
- 为什么主族元素在电子排布是不用考虑洪特规则?
 wave4521年前2
wave4521年前2 -
 满地开花 共回答了14个问题
满地开花 共回答了14个问题 |采纳率92.9%主族元素当然要考虑洪特规则,你举的例子有点问题需要注意,不同的电子亚层能量是不同的,2s轨道的能量比2p轨道要更低,所以电子优先填满2s层,结构就是[He]2s22p2,而自旋相反的两个电子相互排斥的能量小于这两个亚层的能量差;
打个比方:整个原子的空间轨道就像一座大楼,主量子数(电子层)就是楼层,但每一层还有分隔,就好像复式结构的房子一样1年前查看全部
- 下列离子的电子排布与氩原子核外电子层不同的是( )
下列离子的电子排布与氩原子核外电子层不同的是( )
A.Cl-
B.S2-
C.K+
D.Mg2+ 0602201101年前1
0602201101年前1 -
 qinxinziyuan 共回答了24个问题
qinxinziyuan 共回答了24个问题 |采纳率95.8%解题思路:根据氩原子核外有3个电子层,然后再分析其他离子的核外电子层.A.氯原子得1个电子形成氯离子,氯离子核外有3个电子层,与氩原子核外电子层相同,故A错误;
B.硫原子得2个电子形成硫离子,硫离子核外有3个电子层,与氩原子核外电子层相同,故B错误;
C.钾原子失去1个电子形成钾离子,钾离子核外有3个电子层,与氩原子核外电子层相同,故C错误;
D.镁原子失去2个电子形成镁离子,镁离子核外有2个电子层,与氩原子核外电子层不相同,故D正确;
故选:D.点评:
本题考点: 原子构成.
考点点评: 本题主要考查了原子与离子的核外电子排布,需要注意的是原子变成阳离子,电子层数减少,原子变成阴离子,电子层数不变.1年前查看全部
- 有人把氢在周期表中的位置从第一主族移至第七主族,怎样从电子排布和化合价理解这种做法
 lzlwf5201年前3
lzlwf5201年前3 -
 snakeivan 共回答了18个问题
snakeivan 共回答了18个问题 |采纳率94.4%都是需要再结合1个电子就可以变成稳定的电子排布结构,也就是和惰性气体一样的电子排布结构;
化合价上氢元素与钠、钾结合是都是-1价,因此从这两方面解释氢在周期表中的位置从第一主族移至第七主族.希望楼主满意1年前查看全部
- A元素的原子失去3个电子,B元素的电子得到2个电子后,它们形成的微粒的电子排布与氖原子的电子排布相同 过
 17191年前6
17191年前6 -
 发啊额贫苦派 共回答了18个问题
发啊额贫苦派 共回答了18个问题 |采纳率100%氖是10号元素,其电子排布是 2 8
A失掉3个电子和氖一样,那A原来的电子排布是2 8 3 ,即A的电子数是13,A是铝 Al
B得到2个电子和氖一样,那B原来的电子排布是2 6,即B的电子数是8,B是氧 O1年前查看全部
- 短周期元素A、B、C、D、E、F的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子排布为nsnn
短周期元素a、b、c、d、e、f的原子序数依次增大,其中a为周期表中原子半径最小的元素;b原子的最外层电子排布为nsnnpn;c是地壳中含量最高的元素; 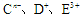 具有相同的电子层结构,e、f的质子数之和是
具有相同的电子层结构,e、f的质子数之和是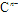 电子数的3倍。试回答下列问题:
电子数的3倍。试回答下列问题:
(1)a与b组成的一种分子中所有原子共直线,该分子中b原子杂化方式是__________。
(2)d与f形成的化合物其晶体结构模型如图,它代表该晶体的一个结构单元。(图中小黑点、小白圈分别代表阴、阳离子)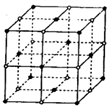
①此结构单元中与  距离最近且相等的
距离最近且相等的 离子个数为_____________。
离子个数为_____________。
②已知该晶体的密度为rg/cm 3 ,该化合物摩尔质量mg/mol,阿伏加德罗常数为n a ,则在该晶体里距离最近的阳离子和阴离子之间的核间距大约是:_____________cm。
(3)***首创利用c、e两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为_______________________。 zhyzxn1年前1
zhyzxn1年前1 -
 9imm 共回答了14个问题
9imm 共回答了14个问题 |采纳率92.9%1年前查看全部
- 已知A、B、C、D、E、F均为前四周期元索.A元索的原子价电子排布为ns2np2,B元索的最外层电子数是其电子层数的3倍
已知A、B、C、D、E、F均为前四周期元索.A元索的原子价电子排布为ns2np2,B元索的最外层电子数是其电子层数的3倍,C元索原子的M电子层的P亚层中有3个未成对电子.D元素原子核外的M层中只有2对成对电子.B离子与E离子具有相同的电子层结构,可形成E2B2、E2B型化合物.F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数.请回答下面的问题:
(1)根据以上信息推断:①B元素为______,F原子核外的价电子排布为______.D元素在______区.
(2)当n=2时,A与氢元素形成相对分子质量为28的分子中有______个σ键.
(3)当n=3时,A与B形成的晶体属于______晶体.A单质的晶体结构中,A原子采用______杂化,A原子数与A-A键数之比为______.
(4)DCl2分子中,中心原子D有______对孤对电子,用价层电子对互斥模型推测:DCl2分子的空间构型为______形.
(5)元素F的某种氧化物的晶体晶胞结构如右图所示,其中实心球表示F原子,则该氧化物的化学式为______.
(6)F元素的醋酸盐晶体局部结构如右图,该晶体中含有的化学键是______(填选项序号).
①极性键 ②非极性键③配位键④金属键
(7)A-F六种元素中,有一种元素的部分电离能数据如下,它可能是______(写元索符号)(其中I1-I2分别表示该元素第一电离能--第七电离能).电离能 I, I2 I3 U I5 h I7 (KJ.mol-1) 14.5 29.6 47.4 77.5 97.9 551.9 666.8  1803201031年前1
1803201031年前1 -
 vividly1973 共回答了13个问题
vividly1973 共回答了13个问题 |采纳率92.3%解题思路:A、B、C、D、E、F均为前四周期元素.B元素的最外层电子数是其电子层数的3倍,B原子只能有2个电子层,最外层电子数为6,则B为O元素;C元素原子的M电子层的P亚层中有3个未成对电子,则其原子核外电子排布为1s22s22p63s23p3,故C为P元素;D元素原子核外的M层中只有2对成对电子,则其原子核外电子排布为1s22s22p63s23p4,故D为S元素;B离子与E离子具有相同的电子层结构,核外电子数为10,可形成E2B2、E2B型化合物,则E为Na;F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数,则F为Cu,A元素的原子价电子排布为ns2np2,属于第ⅣA族;
(1)根据能量最低原理书写Cu原子核外电子排布;根据最后电子填充的能级确定其在周期表中的区域;
(2)A元素的原子价电子排布为ns2np2,当n=2时A为碳元素,与氢元素形成的相对分子质量为28的分子为乙烯;(3)A元素的原子价电子排布为ns2np2,当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,属于原子晶体;Si晶体中每个Si原子与另外4个Si原子形成正四面体结构,每个Si-Si键为Si原子提供[1/2],根据均摊法计算Si原子所处共价键数目,据此解答;
(4)ABn型分子A原子孤对电子数=[1/2](a-xb),a为A原子价电子数目,x为A原子结合原子数,b为B原子最多结合电子数目;
(5)根据均摊法计算晶胞中Cu原子、O原子数目,据此确定化学式;
(6)Cu为金属晶体,晶体中Cu位于顶点和面心;由Cu的醋酸盐晶体局部结构图可知,存在C-C、C=O共价键和铜离子提供空轨道、O原子提供孤对电子的配位键,以此来解答;
(7)相同能层电子能量相差不大,不能能层电子能量相差较大,故失去不同能层电子时电离能会发生突跃,由表中数据可知,失去第6个电子时,电离能剧增,故该元素最外层电子数为5.A、B、C、D、E、F均为前四周期元素.B元素的最外层电子数是其电子层数的3倍,B原子只能有2个电子层,最外层电子数为6,则B为O元素;C元素原子的M电子层的P亚层中有3个未成对电子,则其原子核外电子排布为1s22s22p63s23p3,故C为P元素;D元素原子核外的M层中只有2对成对电子,则其原子核外电子排布为1s22s22p63s23p4,故D为S元素;B离子与E离子具有相同的电子层结构,核外电子数为10,可形成E2B2、E2B型化合物,则E为Na;F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数,则F为Cu;
(1)由上述分析可知,B为氧元素;F为Cu原子,核外电子数为29,根据能量最低原理,核外的价电子排布为3d104s1,D为S元素,外围电子排布为3s23p4,电子最后填充p能级,属于p区元素,
故答案为:氧元素;3d104s1;p;
(2)A元素的原子价电子排布为ns2np2,当n=2时A为碳元素,与氢元素形成的相对分子质量为28的分子为乙烯,含有4C-H、1个C=C,因此含有5个σ键,
故答案为:5;
(3)A元素的原子价电子排布为ns2np2,当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,属于原子晶体;Si晶体中每个Si原子与另外4个Si原子形成正四面体结构,Si原子成4个σ键、不含孤对电子,采取sp3杂化,每个Si-Si键为Si原子提供[1/2],即每个Si原子成共价键数目为4×[1/2]=2,故硅晶体中Si原子与Si-Si键数目之比=1:2,
故答案为:原子;sp3;1:2;
(4)SCl2分子中,中心原子S含有孤对电子对数=[6-1×2/2]=2,SCl2分子中S原子价层电子对数=2+2=4,故其空间构型为V形,
故答案为:2;V;
(5)由晶胞结构可知,晶胞中Cu原子数目=4、O原子数目=1+8×[1/8]=2,故该氧化物的化学式为Cu2O,故答案为:Cu2O;
(6)Cu为金属晶体,晶体中Cu位于顶点和面心;由Cu的醋酸盐晶体局部结构图可知,存在C-C非极性键、C=O极性共价键和铜离子提供空轨道、O原子提供孤对电子的配位键,即含有的化学键为①②③,
故答案为:①②③;
(7)相同能层电子能量相差不大,不能能层电子能量相差较大,故失去不同能层电子时电离能会发生突跃,由表中数据可知,失去第6个电子时,电离能剧增,故该元素最外层电子数为5,可能为上述P元素,
故答案为:P.点评:
本题考点: 原子核外电子排布;共价键的形成及共价键的主要类型;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查物质结构与性质,题目比较综合,涉及结构性质位置关系、核外电子排布、分子结构与性质、价层电子对互斥理论、杂化理论、化学键、电离能、晶胞计算等,侧重考查主干知识,需要学生具备扎实的基础知识,难度中等,(3)为易错点、难点,注意识记中学常见晶体结构.1年前查看全部
- 基态原子电子排布为1s22s22p63s23p1的元素最可能的价态是( )
基态原子电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A. +1
B. +2
C. +3
D. -1 lihao5211年前3
lihao5211年前3 -
 大阳台 共回答了18个问题
大阳台 共回答了18个问题 |采纳率83.3%解题思路:根据核外电子排布可确定最外层电子数,根据最外层电子数可确定化合价.基态原子电子排布为1s22s22p63s23p1,价电子为3s23p1,说明最外层电子数为3,在反应中已失去,则化合价为+3,
故选C.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查原子核外电子排布与化合价的关系,题目难度不大,本题注意价电子的确定,当原子最外层电子数少于4个时候,一般为正价,多于4个时可能有负价.1年前查看全部
- 化学原子的得失电子问题我们知道化合价是原子得失电子的数目举个例子 AL吧 电子排布 2 8 1失去一个电子 为什么化合价
化学原子的得失电子问题
我们知道化合价是原子得失电子的数目
举个例子 AL吧 电子排布 2 8 1
失去一个电子 为什么化合价是+1 倪尘1年前6
倪尘1年前6 -
 onshore 共回答了18个问题
onshore 共回答了18个问题 |采纳率88.9%它本来不带电失去一个电子后不就带一个正电吗?所以就是正一价咯1年前查看全部
- 银原子的电子排布为什么是Ag的电子排布是4d10 5s1 而不是4d9
银原子的电子排布为什么是Ag的电子排布是4d10 5s1 而不是4d9
我算了一下难道不是这样吗?半充满全充满全空等规律究竟是怎样的? 情书一千封1年前3
情书一千封1年前3 -
 hainanlongmao 共回答了22个问题
hainanlongmao 共回答了22个问题 |采纳率86.4%这要符合洪特规则.
洪特规则 又称等价轨道规则.在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同.如氮原子中的3个p电子分布于3个p轨道上并取向相同的自旋方向.p轨道上有3个电子、d轨道上有5个电子、f轨道上有7个电子时,都是半充满的稳定结构.另外量子力学的研究表明;等价轨道全空(p0、d0、f0)和全满时(p6、d10、f14)的结构,也具有较低能量和较大的稳定性.像铁离子Fe3+(3d5)和亚铁离子Fe2+(3d6)对比看,从3d6→3d5才稳定,这和亚铁离子不稳定易被氧化的事实相符合.根据洪特规则铬的电子排布式应为1s2 2s2 2p6 3s2 3p6 3d5 4s1.1年前查看全部
- 为什么钨原子最外层电子排布是4d4 5s2,而不是5d5 4s1,半充满不是能量么?
为什么钨原子最外层电子排布是4d4 5s2,而不是5d5 4s1,半充满不是能量么?
和钻孔效应是不是有关? qingwood1年前5
qingwood1年前5 -
 daizin 共回答了27个问题
daizin 共回答了27个问题 |采纳率92.6%你看看元素周期表,这是从钨开始有f层的电子,对于d层有屏蔽作用吧,所以此时是5d4 6s2.
而之前的铬,钼没有f亚层,所以都是d5s1的1年前查看全部
- O2,O+2,O-2,O2-2的分子轨道电子排布!
 sweetpotato11151年前0
sweetpotato11151年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
(1)当n=2时,AB2属于______分子(填“极性”或“非极性”).
(2)当n=3时,A与B形成的晶体属于______晶体.
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是______(用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3•5NH3•H2O.该配合物中的中心离子钴离子在基态时核外电子排布式为______,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是______. 明天要下yy1年前1
明天要下yy1年前1 -
 双龙151 共回答了17个问题
双龙151 共回答了17个问题 |采纳率100%解题思路:A、B、C、D为前四周期元素,B元素的最外层电子数是其电子层数的3倍,最外层电子数不超过8个,所以该元素O元素,C元素原子的M电子层的P亚层中有3个未成对电子,则C是P元素,D元素原子核外的M层中只有2对成对电子,则D是S元素;
(1)当n=2时,A是C元素,则AB2是CO2,根据二氧化碳分子正负电荷重心是否重合判断;
(2)当n=3时,A是Si元素,根据A、B形成晶体的微粒判断晶体类型;
(3)若A元素的原子价电子排布为3s23p2,则A是Si元素,同一周期中,原子的电负性随着原子序数的增大而呈增大趋势,但第VA族元素大于第VIA族元素;
(4)根据电子排布式的书写规则书写,中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该物质中氯元素是外界,为氯离子,则氨气分子和水分子为配体.A、B、C、D为前四周期元素,B元素的最外层电子数是其电子层数的3倍,最外层电子数不超过8个,所以该元素O元素,C元素原子的M电子层的P亚层中有3个未成对电子,则C是P元素,D元素原子核外的M层中只有2对成对电子,则D是S元素;
(1)当n=2时,A是C元素,则AB2是CO2,二氧化碳是直线型结构,正负电荷重心重合,所以是非极性分子,故答案为:非极性;
(2)当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,二氧化硅晶体是由原子构成的,属于原子晶体,
故答案为:原子;
(3)若A元素的原子价电子排布为3s23p2,则A是Si元素,同一周期中,原子的电负性随着原子序数的增大而呈增大趋势,但第VA族元素大于第VIA族元素,所以A、C、D三种元素的第一电离能由大到小的顺序P>S>Si,故答案为:
P>S>Si;
(4)钴离子的化合价是+3价,钴离子核外有24个电子,其基态时核外电子排布式为1s22s22p63s23p63d6,
中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该物质中氯元素全部是外界,为氯离子,则氨气分子和水分子为配体,其化学式为[Co(NH3)5 H2O]Cl3,
故答案为:1s22s22p63s23p63d6,氨气分子和水分子.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查了元素的推断、电离能大小的判断、核外电子排布式的书写等,注意书写基态原子核外电子排布式时要根据构造原理,但原子失去电子变成阳离子时,电子从外向内依次失去,为易错点.1年前查看全部
- H2S分子中两个共价键的夹角接近90度,其原因是:A.共价键的饱和性 B.S原子电子排布 C.共价键的方向性 D.S原子
H2S分子中两个共价键的夹角接近90度,其原因是:A.共价键的饱和性 B.S原子电子排布 C.共价键的方向性 D.S原子中p轨道的形状和空间伸展方向
请重点解答CD两个选项, 水中的香皂1年前1
水中的香皂1年前1 -
 ly零点咖啡 共回答了23个问题
ly零点咖啡 共回答了23个问题 |采纳率82.6%D、p轨道往xyz轴三个方向延伸,任两个轴之间呈90度1年前查看全部
- Cu的电子排布为3d10 4s1,
Cu的电子排布为3d10 4s1,
则Cu+的电子排布为3d10,而Cu2+为3d9,那么根据洪特规则,Cu+应该比Cu2+更稳定,但事实并非如此,请问化学高手这是怎么回事,或请指正我理解上的问题, tq02mci1年前3
tq02mci1年前3 -
 藤上枯枝 共回答了15个问题
藤上枯枝 共回答了15个问题 |采纳率80%事实上,在高温下,Cu+确实比Cu2+稳定
将氧化铜加高温,到一定程度会转化为氧化亚铜
没有什么特殊不特殊1年前查看全部
- 能不能帮我特别详细的讲解一下电子排布和杂化的有关知识?
能不能帮我特别详细的讲解一下电子排布和杂化的有关知识?
越详细越好,就当我除了背过原子序数,其他什么都不知道…… kinghwatan1年前1
kinghwatan1年前1 -
 mwh_ma 共回答了23个问题
mwh_ma 共回答了23个问题 |采纳率82.6%一、原子核外电子排布的原理
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生.
1.最低能量原理
电子在原子核外排布时,要尽可能使电子的能量最低.怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕.这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用.电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态.当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势.一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的.这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p……
2.保里不相容原理
我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向.在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的.根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反.也就是说,每一个轨道中只能容纳两个自旋方向相反的电子.这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间).根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子.我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子.
3.洪特规则
从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于
全满(s2、p6、d10、f14)
半满(s1、p3、d5、f7)
全空(s0、p0、d0、f0)时比较稳定.这类似于我们坐电梯的情况中,要么电梯是空的,要么电梯里都有一个人,要么电梯里都挤满了两个人,大家都觉得比较均等,谁也不抱怨谁;如果有的电梯里挤满了两个人,而有的电梯里只有一个人,或有的电梯里有一个人,而有的电梯里没有人,则必然有人产生抱怨情绪,我们称之为不稳定状态.
二、核外电子排布的方法
对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个.最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为
1s22s22p63s23p64s23d4
根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:
1s22s22p63s23p64s13d5
最后,按照人们的习惯“每一个电子层不分隔开来”,改写成
1s22s22p63s23p63d54s1
即可.
三、核外电子排布在中学化学中的应用
1.原子的核外电子排布与轨道表示式、原子结构示意图的关系:原子的核外电子排布式与轨道表示式描述的内容是完全相同的,相对而言,轨道表示式要更加详细一些,它既能明确表示出原子的核外电子排布在哪些电子层、电子亚层上, 还能表示出这些电子是处于自旋相同还是自旋相反的状态,而核外电子排布式不具备后一项功能.原子结构示意图中可以看出电子在原子核外分层排布的情况,但它并没有指明电子分布在哪些亚层上,也没有指明每个电子的自旋情况,其优点在于可以直接看出原子的核电荷数(或核外电子总数).
2.原子的核外电子排布与元素周期律的关系
在原子里,原子核位于整个原子的中心,电子在核外绕核作高速运动,因为电子在离核不同的区域中运动,我们可以看作电子是在核外分层排布的.按核外电子排布的3条原则将所有原子的核外电子排布在该原子核的周围,发现核外电子排布遵守下列规律:原子核外的电子尽可能分布在能量较低的电子层上(离核较近);若电子层数是n,这层的电子数目最多是2n2个;无论是第几层,如果作为最外电子层时,那么这层的电子数不能超过8个,如果作为倒数第二层(次外层),那么这层的电子数便不能超过18个.这一结果决定了元素原子核外电子排布的周期性变化规律,按最外层电子排布相同进行归类,将周期表中同一列的元素划分为一族;按核外电子排布的周期性变化来进行划分周期
如第一周期中含有的元素种类数为2,是由1s1~2决定的
第二周期中含有的元素种类数为8,是由2s1~22p0~6决定的
第三周期中含有的元素种类数为8,是由3s1~23p0~6决定的
第四周期中元素的种类数为18,是由4s1~23d0~104p0~6决定的.
轨道的相互叠加过程叫原子轨道的杂化.原子轨道叠加后产生的新的原子轨道叫杂化轨道.
⑴ 在形成分子(主要是化合物)时,同一原子中能量相近的原子轨道 (一般为同一能级组的原子轨道) 相互叠加(杂化)形成一组的新的原子轨道.
⑵ 杂化轨道比原来的轨道成键能力强,形成的化学键键能大,使生成的分子更稳定.由于成键原子轨道杂化后,轨道角度分布图的形状发生了变化(形状是一头大,一头小),杂化轨道在某些方向上的角度分布,比未杂化的p轨道和s轨道的角度分布大得多,它的大头在成键时与原来的轨道相比能够形成更大的重叠,因此杂化轨道比原有的原子轨道成键能力更强.
⑶ 形成的杂化轨道之间应尽可能地满足最小排斥原理(化学键间排斥力越小,体系越稳定),为满足最小排斥原理, 杂化轨道之间的夹角应达到最大.
⑷ 分子的空间构型主要取决于分子中σ键形成的骨架,杂化轨道形成的键为σ键,所以,杂化轨道的类型与分子的空间构型相关.两个P轨道形成的大π键
杂化类型有
1)sp杂化
同一原子内由一个ns轨道和一个np轨道发生的杂化,称为sp杂化.杂化后组成的轨道称为sp杂化轨道.sp杂化可以而且只能得到两个sp杂化轨道.实验测知,气态BeCl2中的铍原子就是发生sp杂化,它是一个直线型的共价分子.Be原子位于两个Cl原子的中间,键角180°,两个Be-Cl键的键长和键能都相等
2)sp2杂化
同一原子内由一个ns轨道和二个np轨道发生的杂化,称为sp2杂化.杂化后组成的轨道称为sp2杂化轨道.气态氟化硼(BF3)中的硼原子就是sp2杂化,具有平面三角形的结构.B原子位于三角形的中心,三个B-F键是等同的,键角为120°
(3)sp3杂化
同一原子内由一个ns轨道和三个np轨道发生的杂化,称为sp3杂化,杂化后组成的轨道称为sp3杂化轨道.sp3杂化可以而且只能得到四个sp3杂化轨道.CH4分子中的碳原子就是发生sp3杂化,它的结构经实验测知为正四面体结构,四个C-H键均等同,键角为109°28′.这样的实验结果,是电子配对法所难以解释的,但杂化轨道理论认为,激发态C原子(2s12p3)的2s轨道与三个2p轨道可以发生sp3杂化,从而形成四个能量等同的sp3杂化轨道1年前查看全部
- 主族元素和副族元素的电子排布有什么不同的特征?——主族元素包含S区和P区,副族元素则包含D区,ds区和f区.我在自学选修
主族元素和副族元素的电子排布有什么不同的特征?——主族元素包含S区和P区,副族元素则包含D区,ds区和f区.我在自学选修三,
 wkx6661年前1
wkx6661年前1 -
 zj4338 共回答了18个问题
zj4338 共回答了18个问题 |采纳率94.4%s区、p区:最外层电子数=族序数 d区:从IIIB族至VIII族,(n-1)d电子数+ns电子数=族序数(VIII族的是8、9、10),其中VIB族的,(n-1)d电子数一般为5,ns电子数为1 ds区:指的是IB和IIB两族,(n-1)d电子数为10,ns电子数为1、2 f区:无论高中还是大学都暂不要求1年前查看全部
- 问个问题关于硅的电子排布14号元素 硅 P轨道上的2个电子,是充满1整个P轨道,还是2个电子各占一个轨道?相关的电子排布
问个问题关于硅的电子排布
14号元素 硅 P轨道上的2个电子,是充满1整个P轨道,还是2个电子各占一个轨道?相关的电子排布有什么规律吗? 只好tt上阵1年前1
只好tt上阵1年前1 -
 马来狂人 共回答了21个问题
马来狂人 共回答了21个问题 |采纳率85.7%洪特规则 在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低.所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道.例如碳原子核外有6个电子,按能量最低原理和泡利不相容原理,首先有2个电子排布到第一层的1s轨道中,另外2个电子填入第二层的2s轨道中,剩余2个电子排布在2个p轨道上,具有相同的自旋方向,而不是两个电子集中在一个p轨道,自旋方向相反.1年前查看全部
- 1.X、Y、Z三种元素的原子,其最外层电子排布分别为
1.X、Y、Z三种元素的原子,其最外层电子排布分别为
为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3 jixiaojuan1年前2
jixiaojuan1年前2 -
 偶系小纯蠢 共回答了15个问题
偶系小纯蠢 共回答了15个问题 |采纳率86.7%答案 A 解析 由X、Y、Z三元素的最外层电子排布可知X为ⅠA族中的元素,在化合物中呈+1价,Y为铝,在化合物中呈+3价,Z为氧,在化合物中呈-2价,再由化合物中各元素的化合价代数和为0,可推知答案为A.1年前查看全部
- 分子结构怎么看?凯库勒式电子排布、轨道杂化、晶胞结构
 baby66881年前1
baby66881年前1 -
 霹雳狗 共回答了27个问题
霹雳狗 共回答了27个问题 |采纳率88.9%凯库勒式电子排布、轨道杂化都是原子内部或之间的问题,不存分子结构
晶胞结构一般存在于无机物和有机晶体中,在无机物中,除了水,基本不存在分子结构,只有结晶有机物有分子结构.
这部分要用高分子物理来解释了,一句两句说不清,总的来说分子都是有规律折叠排列的,有各向异性.
这问题问的,外行1年前查看全部
- COCl2的C是什么杂化成键的,电子排布要怎么排哦?
 跨栏背心1年前0
跨栏背心1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 正二价镍离子的配位我想知道正二价镍离子在其配合物为正四面体构型时镍的d电子排布和其配合物为平面正方形构型时的镍的d电子排
正二价镍离子的配位
我想知道正二价镍离子在其配合物为正四面体构型时镍的d电子排布和其配合物为平面正方形构型时的镍的d电子排布! 呼延飞1年前1
呼延飞1年前1 -
 亚当山 共回答了14个问题
亚当山 共回答了14个问题 |采纳率92.9%原子镍价电子是:3d8,4s2
二价镍为3d8
正四面体构型是sp3杂化,接受4个配体的4对电子,d电子依照原先情况填充
平面正方形构型为sp2d杂化,接受4个配体的4对电子,8个d电子填满能量较低的4个d轨道,未参与杂化的p轨道空
配位化合物不适宜用VB法分析其成键,更适合用晶体场或者配位场理论,如果用VB法解释分子磁性,可能与事实产生大量冲突.1年前查看全部
- 正二价镍的电子排布为什么是3d8?
正二价镍的电子排布为什么是3d8?
最外层电子数不是不能超过8吗
如果排布是1s2 2s2 2p6 3s2 3p6 3d8的话
那最外层不是有2+6+8=16个了吗? supertian_ya1年前1
supertian_ya1年前1 -
 mmanyy 共回答了18个问题
mmanyy 共回答了18个问题 |采纳率94.4%原子的最外层电子数一般不超过8个电子(钯最外层18个),而离子是没有这个限制,一般 不超过18个1年前查看全部
- 化学电子排布式无机化合物甲,乙分别由三种元素组成,组成元素外围电子排布都可表示如下:3aSa,bSb bPb,cSc c
化学电子排布式
无机化合物甲,乙分别由三种元素组成,组成元素外围电子排布都可表示如下:3aSa,bSb bPb,cSc cPc,甲的饱和溶液与乙反应.出现混浊,则甲乙化学式分别是.反应方程式是什么?我确定有钡,钠,碳,氧四种元素符合,但做不来么,
此题错误 139065007011年前2
139065007011年前2 -
 tingting0105_9 共回答了12个问题
tingting0105_9 共回答了12个问题 |采纳率91.7%你好《外围电子排布:3aSa,bSb bPb,cSc cPc写法对不?Na2CO3,BaNO31年前查看全部
- 主族元素和副族元素的电子排布有什么不同的特征
 阿超脱1年前3
阿超脱1年前3 -
 天边雪崖 共回答了20个问题
天边雪崖 共回答了20个问题 |采纳率75%主族元素就是指除了最外层电子层以外的电子层的电子数都是满电子的化学元素.
副族元素又称过渡元素
随着核电荷数增大的顺序,原子增加的电子填充入次外层或倒数第三层中,而不是填入最外层.由于最外层电子通常为1~2个.随着核电荷数增加内层电子数增多,半径变化不如主族元素明显,过渡元素均为中等活泼或不活泼金属,是主族典型金属元素向主族典型非金属元素过渡的元素,所以叫过渡元素.1年前查看全部
- 为什么铁原子的电子排布是2.8.14.2
 monicabb1年前1
monicabb1年前1 -
 鸡不可吃 共回答了21个问题
鸡不可吃 共回答了21个问题 |采纳率95.2%高中生不必掌握这个.等到大学里学到原子结构就知道了.
这是由于电子间的斥力导致的“能级交错”现象造成的.
当第三层s亚层、p亚层填满8个电子后,电子先填入第四层的s亚层.
表现在元素周期表上,就是氩(2,8,8)后面是钾(2,8,8,1)
等第四层s亚层填满两个电子后,电子再填入第三层的d亚层.
表现在元素周期表上,就是钙(2,8,8,2)后面是钪(2,8,9,1)
之后是十个过渡元素,铁就是其中之一.
等到第三层d亚层填满10个电子后,电子再填入第四层的p亚层.
表现在元素周期表上,就是锌(2,8,18,2)后面是镓(2,8,18,3)1年前查看全部
- 正六价的铁的电子排布是什么样?各个亚层有多少电子
正六价的铁的电子排布是什么样?各个亚层有多少电子
各个亚层有多少电子? lily09_811年前1
lily09_811年前1 -
 想做新娘 共回答了14个问题
想做新娘 共回答了14个问题 |采纳率92.9%铁还有正六价的,不太清楚,我只知道铁有+2 +3价1年前查看全部
- 原子价电子排布与最外层电子排布区别
原子价电子排布与最外层电子排布区别
A元素的原子最外层电子排布为ns1
B元素的原子价电子排布为ns2np2
当n=2时,A,B原子排布式为?
它俩有区别吗?最外层电子排布=原子价电子排布? 龙城ff1年前1
龙城ff1年前1 -
 郁闷孤城 共回答了16个问题
郁闷孤城 共回答了16个问题 |采纳率87.5%n=2时,A排布:1s2 2s1 为锂 ,B的排布:1s2 2s2 2p2 为碳.
最外层电子排布可以是原子也可以是离子的最外层电子的排布,而原子价电子排布只能是原子的最外层电子排布的情况.对于原子来说,这两种情况是一样的.1年前查看全部
- 铁的外层电子排布为什么中间会有“14”的排布?
 无所谓的我20031年前2
无所谓的我20031年前2 -
 kycy1523 共回答了19个问题
kycy1523 共回答了19个问题 |采纳率89.5%2.8.14.2
其实铁原子的电子排布式是:1s2 2s2 2p6 3s2 3p6 3d6 4s2
第一层 第二层 第三层 第四层
2 8 14 2
(s最多只能放2个电子;p最多只能放6个电子;d最多只能放10个电子;而且3d能级比4s的能级高,所以先放4s中的两个电子,然后剩余的6个电子放在3d能级上.你可能不懂.)1年前查看全部
- 什么粒子电子排布要遵循泡利原理?什么粒子排布不遵循泡利原理?
 chen_19821年前1
chen_19821年前1 -
 taoyang123 共回答了19个问题
taoyang123 共回答了19个问题 |采纳率94.7%一般的,常见的元素都遵循泡利原理,
自旋为整数的粒子被称为玻色子.玻子遵守玻色-爱因斯坦统计,泡利不相容原理对它们无效.玻子可以占据相同的量子态.1年前查看全部
- 某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素原子的最外层电子排布是( )
某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素原子的最外层电子排布是( )
A. 3s23p3
B. 2s22p5
C. 2s22p3
D. 3s23p5 威尔士gg1年前1
威尔士gg1年前1 -
 阻一般矫顽 共回答了28个问题
阻一般矫顽 共回答了28个问题 |采纳率82.1%解题思路:可假设电子层数为x,则核电荷数=质子数=5x,质子数是最外层电子数的3倍,则最外层电子数为[5/3]x,最外层电子数不超过8,x只能为3,以此来推断元素,据此解答.设电子层数为x,则核电荷数=质子数=5x,质子数是最外层电子数的3倍,则最外层电子数为[5/3]x,最外层电子数不超过8,显然x为3时,符合实际,即3个电子层,最外层电子数为[5/3]×3=5,所以元素为P,其最外层电子排布是3s23p3,故选A.
点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查原子结构、核外电子排布,推断元素是解答的关键,注意电子层与最外层电子数的关系,难度不大.1年前查看全部
- 教授级人物进根据能级交错的原理,4s比3d的能量小,填充电子时应先充满4s而后才填入3d轨道.故出现钙 的 电子排布 2
教授级人物进
根据能级交错的原理,4s比3d的能量小,填充电子时应先充满4s而后才填入3d轨道.故出现钙 的 电子排布 2882 而非 2891.
但 按此原理 氩 的 电子排布 为 2862
而 教科书上 都为 288 为什么?
既然各位都说了K 是发生能级交错的
那么 K 就为什么不是 2872? zhanghuimeifans1年前0
zhanghuimeifans1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于氢键的理解比如说hf,是否能把它理解为电子排布稳定与电性异性相吸的问题?同一分子内为了电子排布稳定出现了电价,不同分
关于氢键的理解
比如说hf,是否能把它理解为电子排布稳定与电性异性相吸的问题?同一分子内为了电子排布稳定出现了电价,不同分子内没有电子排布稳定问题的影响,只剩下电性异性相吸?同一分子内是否也有电性异性相吸存在? 娃哈哈v981年前0
娃哈哈v981年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 副族元素电子的排布规律是什么?要说得通俗点的,最好是可以根据这个写出副族元素电子排布,
 失意的青青1年前2
失意的青青1年前2 -
 gavin_gc 共回答了21个问题
gavin_gc 共回答了21个问题 |采纳率90.5%首先根据每一周期元素个数,确定该副族元素的周期序数n,然后根据核外电子排布的构造原理:[A]ns(n-3)g(n-2)f(n-1)dnp,即可写出该元素简化的电子排布式.如72号元素的核外电子排布式的书写过程:
由于第五周期最后一个元素Xe的原子充数为54,而第六周期最后一个元素Rn的原子充数为86,故72号元素在第六周期,最后一个能级组为6s4f5d6p(第三能层没有g能级),一共填充72-54=18个电子,6s填2个电子,4f填14个电子,5d填2个电子,所以72号元素的核外电子排布式为:[Xe] 4f14 5d2 6s2.1年前查看全部
- 这个化学物质:正二价的六水合铁离子,它的d电子排布,和晶体场稳定化能是什么?
 试磨光阴剑1年前2
试磨光阴剑1年前2 -
 神之风 共回答了16个问题
神之风 共回答了16个问题 |采纳率93.8%d电子排布为t2g4eg2
4和2分别是t2g和eg上的数字
晶体场稳定化能是-4Dq1年前查看全部
- 元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为( )
元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为( )
A. 9
B. 10
C. 17
D. 18 舒亦纤尘1年前1
舒亦纤尘1年前1 -
 匠人爱芳直 共回答了14个问题
匠人爱芳直 共回答了14个问题 |采纳率85.7%解题思路:根据排布规律可知nsn-1应排满,为2个电子,故n=3,元素X的基态原子最外层电子排布为3s2np5.nsn-1应排满,为2个电子,故n=3,元素X的基态原子最外层电子排布为3s2np5,为Cl元素,故选C.
点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查原子结构与元素的性质,难度不大,注意根据构造原理,先排能量低的再排能量高的.1年前查看全部
- 电子排布2、8、9、2为什么有个原子的电子排布是2、8、9、2而不是2、8、8、3?帮我讲详细点...弄弄懂.谢谢啊~
 jijeff331年前2
jijeff331年前2 -
 踏雪无痕0558 共回答了19个问题
踏雪无痕0558 共回答了19个问题 |采纳率89.5%原子核外排布.高二学的知识.现在不知道也没什么用原子核外电子排布规律 1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对 2、能量最低原理:电子尽可能占据能量最低的轨道 3、Hund规则:简并轨道(...1年前查看全部
大家在问
- 1燕子从北极飞到南极,行程是17000千米,如果它每天飞780千米,20天能飞到吗?
- 2400字读后感和一篇日记,日记内容最好是写去爬山啊,旅游什么的
- 3红宝石的主要成分是什么呢?
- 4we are all floating around accidental.其中accidental是什么意思?词性?修
- 5下列化学用语表达正确的是( )
- 6We asked ten students at No.3 middle School what they did la
- 7在下面各个算式中添上括号使计算结果都等于1.
- 8关于密度公式ρ=m/V,下列说法正确的是( ) A.ρ与m成正比,与V成反比 B.同一种物质的密度一定相同,不同的物质
- 9小学语文题近义词:魁梧()分外()万籁俱寂()反义词:专心致志()持之以恒()引人注目()迫不及待()收复()填空:(各
- 10分子式为C3H4Cl2且含有碳碳双键 结构的有机物的同分异构体共有多少个
- 11在图中R1=14Ω,R2=9Ω.当开关处于位置1时,电流表读数I1=0.2A;当开关处于位置2时,电流表读数I2=0.3
- 12他今年12岁用英语怎么说?
- 13我就是我 作文
- 14新华农场修一条长7.5千米的水渠,已经修了4天,每天修0.65千米,剩下的要7天修完.平均每天修多少千米?
- 15一个长方形的面积是780平方米,长和宽都是整米数.已知长比宽到4米,求它的周长.