化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是 A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁
 激活十二2022-10-04 11:39:541条回答
激活十二2022-10-04 11:39:541条回答| 化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是
|

已提交,审核后显示!提交回复
共1条回复
 dw284716363 共回答了16个问题
dw284716363 共回答了16个问题 |采纳率81.3%- D
- 1年前
相关推荐
- 电解原理在化学工业中有广泛应用.如图表示十个电解池,若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各
 电解原理在化学工业中有广泛应用.如图表示十个电解池,若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
电解原理在化学工业中有广泛应用.如图表示十个电解池,若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
(手)电解池中X极他的电极反应式是______.在X极附近观察到的现象是______.
(你)Y电极他的电极反应式是______,检验该电极反应产物的方法是______.
(2)电解池的总反应为你NaCl+你H你O
H你↑+Cl你↑+你NaOH电解 .你NaCl+你H你O.
H你↑+Cl你↑+你NaOH电解 . rr方网巡1年前1
rr方网巡1年前1 -
 qinyitao110 共回答了19个问题
qinyitao110 共回答了19个问题 |采纳率100%解题思路:(1)该电解池中,Y是阳极,X是阴极,且都是惰性电极,电解时阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,无色酚酞遇碱变红色;
(2)阳极上氯离子放电生成氯气,氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色;
(3)根据电极反应式书写电池反应式.(1)该电解池9,Y是阳极,X是阴极,且都是惰性电极,电解时阴极上氢离子放电生成氢气,电极反应式为sH++se-=Hs↑,同时溶液9生成氢氧化钠,无色酚酞遇碱变红色,所以看到的现象是溶液变红色,
故答案为:sH++se-=Hs↑;溶液变红色;
(s)阳极上氯离子放电生成氯气,电极反应式为sCh--se-=Chs↑,氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验,
故答案为:sCh--se-=Chs↑;用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
(3)根据电极反应式知,电池反应式为sNaCh+sHs0
电解
.
Hs↑+Chs↑+sNa0H,故答案为:sNaCh+sHs0
电解
.
Hs↑+Chs↑+sNa0H.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题以电解氯化钠为载体考查了电解原理、物质的检验等知识点,明确电极原理内涵及物质的性质即可解答,知道氯气的检验方法,难度不大.1年前查看全部
- Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.
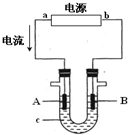 Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.
Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.
(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时向U型管两边各滴入几滴酚酞试液,试判断
①a是______极(填“正”或“负”);
②B电极上的电极反应式为______,
(2)如要用电解方法精炼粗铜,电解液c选用CuSO4溶液,则B电极的材料是______,电极反应式为______.
(3)用惰性电极电解CuSO4溶液.若阴极上析出Cu的质量为3.2g,则阳极上产生的气体在标准状况下的体积为______;
Ⅱ、设计出燃料电池使汽油氧化直接产生电流是对21世纪最富有挑战性的课题之一.最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.回答如下问题:
(1)以庚烷(C7H16)代表汽油,这个电池放电时发生的化学反应的化学方程式是:______
(2)这个电池的负极发生的反应是:______;正极发生的反应是:______;固体电解质里的O2-向______(填“正”或“负”)极移动(1分) wuliangnet1年前1
wuliangnet1年前1 -
 道法自然也 共回答了21个问题
道法自然也 共回答了21个问题 |采纳率81%解题思路:Ⅰ、(1)①根据电流的流向是从电源的正极→电解池的阳极来判断电极;②阴极是阳离子的得电子过程;(2)电解精炼铜时,阳极材料是粗铜,阴极材料是纯铜;(3)根据电解时的阴极和阳极反应方程式进行计算;Ⅱ、(1)燃料电池的总反应是燃料在氧气中燃烧的反应;(2)燃料电池的负极反应是燃料失电子的氧化反应,正极是氧气得电子的还原反应,在原电池中,电解质里的阳离子移向正极,阴离子移向负极.Ⅰ、(1)①电流的流向是从电源的正极→电解池的阳极,所以a是正极,故答案为:正;
②和电源的正极a相连的A是电解池的阳极,所以B是电解池的阴极,电极反应为:2H++2e-═H2↑,故答案为:2H++2e-═H2↑;
(2)电解精炼铜时,阳极材料是粗铜,阴极材料是纯铜,B是电解池的阴极,发生铜离子的得电子反应,故答案为:纯铜;Cu2++2e-═Cu;
(3)用惰性电极电解CuSO4溶液,阴极上的电极反应为:Cu2++2e-→Cu,当析出Cu的质量为3.2g,则转移电子0.1mol,阳极上的电极反应为:4OH-→4e-+2H20+O2↑,转移电子0.1mol时,阳极上产生的气体的物质的量是0.025mol,在标准状况下的体积为0.025mol×22.4L/mol=0.56L,故答案为:0.56L;
Ⅱ、(1)燃料电池的总反应是燃料在氧气中燃烧的反应,即C7H16+11O2=7CO2+8H2O,故答案为:C7H16+11O2=7CO2+8H2O;
(2)燃料电池的负极反应是燃料失电子的氧化反应,即C7H16+22O2--44e-=7CO2+8H2O; 正极是氧气得电子的还原反应,即11O2+44e-=22O2-;原电池中电解质里的阴离子移向负极,故答案为:C7H16+22O2--44e-=7CO2+8H2O;11O2+44e-=22O2-;负极.点评:
本题考点: 原电池和电解池的工作原理;铜的电解精炼;电极反应和电池反应方程式;化学电源新型电池.
考点点评: 本题考查学生原电池和电解池的工作原理,要求学生熟记教材知识,学以致用.1年前查看全部
- “绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染.你认为“绿色化学”是指化学工业生产中
“绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染.你认为“绿色化学”是指化学工业生产中( )
A.对废气、废水、废渣进行严格处理
B.在化工厂种草、种树,使其成为花园工厂
C.不使用任何化学物质
D.少用或不用有害物质以及少排或不排放有害物质 照亮oo的手电1年前1
照亮oo的手电1年前1 -
 tsgrzx 共回答了15个问题
tsgrzx 共回答了15个问题 |采纳率86.7%解题思路:根据绿色化学的核心和特点判断,其核心是要从源头上杜绝污染,特点是:(1)充分利用资源和能源,采用无毒无害的原料;(2)在无毒无害的条件下进行反应,以减少向环境排放废物;(3)提高原子利用率,力图使原料的原子都被产品所消纳,实现零排放;(4)生产出有利于环境保护、社区安全和人体健康的环境友好产品.A、对废气、废水、废渣进行严格处理符合绿色化学理念,故A正确;
B、在化工厂种草、种树,使其成为花园式工厂只是环境的绿化,与绿色化学无关,故B错误;
C、自然界的所有物质都是化学物质,故C错误;
D、少用或不用有害物质以及少排或不排放有害物质符号绿色化学的理念,故D正确;
故选AD点评:
本题考点: 绿色化学.
考点点评: 本题考查绿色化学的有关理念.核心是利用化学原理从源头上减少或消除化学工业对环境的污染,又称为“环境友好化学”.1年前查看全部
- 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题 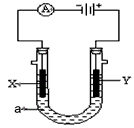
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
电解池中X极上的电极反应式为_______________________。 Y电极上的电极反应式为_______________________,检验该电极反应产物的方法是_______________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO 4 溶液,则
①X电极的材料是______________,电极反应式是_______________________。
②Y电极的材料是______________,电极反应式是_______________________。 具云水趣1年前1
具云水趣1年前1 -
 杨杨逸晨 共回答了28个问题
杨杨逸晨 共回答了28个问题 |采纳率92.9%(1)2H + +2e - ==H 2 ↑;2Cl - -2e - ==Cl 2 ↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
(2)①纯铜;Cu 2+ +2e - ==Cu;② 粗铜;Cu-2e - ==Cu 2+1年前查看全部
- (10分)电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连
(10分)电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
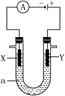
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X电极上的电极反应式为________。在X极附近观察到的现象是________。
②Y电极上的电极反应式为________,检验该电极反应产物的方法是________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO 4 溶液,则
①X电极的材料是________,电极反应式为________________。
②Y电极的材料是________,电极反应式为________________(说明:杂质发生的电极反应不必写出)。 不想在风中1年前1
不想在风中1年前1 -
 主犯不使用 共回答了20个问题
主犯不使用 共回答了20个问题 |采纳率90%(1)①2H + +2e - ====H 2 ↑ 放出气体,溶液变红 ②2Cl - -2e - ====Cl 2 ↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
(2)①纯铜 Cu 2+ +2e - ="===Cu " ②粗铜 Cu-2e - ====Cu 2+
X与电源负极相连作阴极(2H + +2e - ====H 2 ↑),放出H 2 ,剩余OH - ,使酚酞试液变红。Y与电源正极相连作阳极(2Cl - -2e - ====Cl 2 ↑),放出Cl 2 ,使湿润的KI淀粉试纸变蓝。电解精炼铜,粗铜作阳极(Cu-2e - ====Cu 2+ ),纯铜作阴极(Cu 2+ +2e - ====Cu)。1年前查看全部
- (2011•吴中区二模)化学工业上常说的“三酸两碱”中的“两碱”是指( )
(2011•吴中区二模)化学工业上常说的“三酸两碱”中的“两碱”是指( )
A.NaOH和Ca(OH)2
B.NaOH和氨水
C.NaOH和Na2CO3
D.NaOH和KOH seasqq1年前1
seasqq1年前1 -
 peiwind 共回答了15个问题
peiwind 共回答了15个问题 |采纳率93.3%解题思路:酸是指电离出的阳离子全部为H+的一类化合物,生产生活中使用的酸有很多种,我们把酸性很强且常用的三种酸合称为“三酸”;而“二碱”是指在生产生活中广泛使用的两种俗名为某碱的两种物质.盐酸、硫酸、硝酸是化学实验室的三大强酸,它们是化工生产的原料,被合称为“三酸”;在碱类物质中,烧碱氢氧化钠作为工业原料在化工生产中大量使用的一种碱;而碳酸钠因其溶液呈碱性又在生产生活中广泛使用,所以人们俗称其为纯碱,但它属于盐类.纯碱与烧碱合称为“二碱”.
故选:C.点评:
本题考点: 常见碱的特性和用途;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 氢氧化钠俗称火碱、烧碱、苛性钠;碳酸钠俗称纯碱、苏打.二者被称为工业上的“两碱”,注意纯碱不是碱而属于盐类.1年前查看全部
- (7分)电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请
(7分)电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
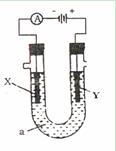
(1)若X、Y都是惰性电极,a是饱和CuSO 4 溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
②在Y电极附近观察到的现象是
(2)若X、Y都是铜电极,a是浓度均为2mol·L -1 的AgNO 3 与Cu(NO 3 ) 2 的混合溶液1L,电解一段时间后X电极上有12.8g铜析出,此时直流电源已输出 mol电子。
(3)用石墨电极电解100mLH 2 SO 4 和CuSO 4 混合液,通电一段时间后,两极各出现气体3.36L(标准状况),求原来溶液中CuSO 4 的浓度 。 恋上茉莉清茶1年前1
恋上茉莉清茶1年前1 -
 511500 共回答了9个问题
511500 共回答了9个问题 |采纳率88.9%(1)①4OH - →O 2 + 2H 2 O+ 4 e - (1分)②溶液变红色,产生无色气泡(2分)
(2)2.4(2分)(3)1.50mol/L(2分)
略1年前查看全部
- (2012•曲阜市模拟)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一
(2012•曲阜市模拟)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.以粗盐为原料的“氯碱工业”流程如下:

回答下列问题:
(1)操作④的名称是______.
(2)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3,溶液必须在BaCl2溶液之______(填“前”或“后”)加入,原因是______,有同学提出用______溶液代替BaCl2溶液可达到同样的目的.
(3)电解饱和NaCl溶液的化学方程式是2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑通电 . chenjing09081年前1
chenjing09081年前1 -
 宝贝乐乐爱 共回答了20个问题
宝贝乐乐爱 共回答了20个问题 |采纳率95%解题思路:根据题干提供的信息结合物质的性质进行分析,要将氯化钠溶液变成氯化钠的饱和溶液,可以采用加热蒸发的方法;在除去氯化钠中混有的可溶性杂质时,所加入的试剂反应后不能引入新的杂质,后面加的试剂要能把前面加的多余的试剂除掉,据此解答即可.(1)氯化钠溶液经过操作④得到了氯化钠的饱和溶液,则该操作是蒸发,故填:蒸发;
(2)Na2CO3,溶液必须在BaCl2溶液之后,以便把多余的氯化钡溶液反应掉,防止含有新的杂质,要除去硫酸根离子,还可以使用氢氧化钡溶液,反应后能生成硫酸钡沉淀和氢氧化钠,生成的氢氧化钠能在后面加入盐酸时反应生成氯化钠,故填:后,Na2CO3可以与过量的BaCl2反应,转变成NaCl和BaCO3沉淀,Ba(OH)2;
(3)电解饱和氯化钠溶液,能生成氢氧化钠、氯气和氢气,故填:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑.点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题考查了常见物质间的转化,完成此题,可以依据已有的物质的性质进行.书写反应的化学方程式要注意配平.1年前查看全部
- “绿色化学”在20世纪90年代兴起并将成为21世纪化学发展的主导方向,其核心是利用化学原理从源头上减少或消除化学工业对环
“绿色化学”在20世纪90年代兴起并将成为21世纪化学发展的主导方向,其核心是利用化学原理从源头上减少或消除化学工业对环境的污染,又称为“环境友好化学”。据此思考判断,下面不属于“绿色化学”考虑内容的是 [ ]A.反应在无毒、无公害的条件下进行,如采用无毒无害的溶剂和催化剂
B.化工生产的原料和产品尽可能无毒、无害或毒性极小
C.尽可能通过最小的成本取得最大的利润
D.尽可能采用可再生原料,且原料利用率尽可能最大化,副产物或废料最小化 老狼621年前1
老狼621年前1 -
 怡泉斋主 共回答了16个问题
怡泉斋主 共回答了16个问题 |采纳率93.8%C1年前查看全部
- “绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染.你认为“绿色化学”是指化学工业生产中
“绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染.你认为“绿色化学”是指化学工业生产中( )
A.对废气、废水、废渣进行严格处理
B.不使用任何化学物质
C.少用或不用有害物质以及少排或不排放有害物质
D.在化工厂种草、种树,使其成为花园式工厂 无色无欲皆为空1年前1
无色无欲皆为空1年前1 -
 joyce0922 共回答了24个问题
joyce0922 共回答了24个问题 |采纳率95.8%A.对废气、废水、废渣进行严格处理不是从源头上减少或消除化学工业对环境的污染,故A错误;
B.自然界的所有物质都是化学物质,故B错误;
C.少用或不用有害物质以及少排或不排放有害物质符号绿色化学的理念,故C正确;
D.在化工厂种草、种树,使其成为花园式工厂只是环境的绿化,与绿色化学无关,故D错误.
故选C.1年前查看全部
- (2012·德阳)氨气(NH 3 )是一种无色有刺激性气味的气体,极易溶于水,它的水溶液称为氨水。它在化学工业中有着广泛
(2012·德阳)氨气(NH 3 )是一种无色有刺激性气味的气体,极易溶于水,它的水溶液称为氨水。它在化学工业中有着广泛的用途,如制化肥、制纯碱等。近年来,人们还利用氨来治理环境污染。(每空2分)
(1)氨分子中,氮原子和氢原子的个数之比为 。
(2)在细菌的作用下,用氨来出来含甲醇(CH 3 OH)的工业废水,使其变为CO 2 和N 2 等物质,从而清除它对环境的污染。反应的化学方程式为:6NH 3 + 5CH 3 OH +12O 2 = 5CO 2 +3N 2 +19X,其中X物质的化学式是 。
(3)化学肥料是农作物生长的一种营养元素,工业上常用氨气和酸等物质生产铵态氮肥。写出氨气与硫酸反应生成硫酸铵的化学方程式 。 zlhpy1年前1
zlhpy1年前1 -
 daheilangc 共回答了20个问题
daheilangc 共回答了20个问题 |采纳率95%(1)1:3 (2)H 2 O (3)2NH 3 + H 2 SO 4 =(NH 4 ) 2 SO 4
(1)化学式物质原子个数比即元素符号右下角码的比;
(2)化学反应前后原子的种类和原子的个数保持不变故推得X的化学式为H 2 O;
(3)根据题意提供的产物和和生成物以及正确的化学式可以写出化学方程式,注意其配平即可。1年前查看全部
- (10分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连。
(10分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连。

(1)若X是锌,Y是碳棒电极,a是饱和NaCI溶液,则①该原理可制得化工原料有 ;②Y极的电极反应式为
(2)若要用电解方法精炼粗铜,则①电解液a选用 ;②Y电极反应式是 。(说明:杂质发生的电极反应不必写出)
(3)若要在某铁制小饰品上镀上一层银,则①Y电极的材料是 ;②X电极反应式是 。 fenglinbi1年前1
fenglinbi1年前1 -
 大灰521 共回答了15个问题
大灰521 共回答了15个问题 |采纳率86.7%(1)①氢气、氯气和氢氧化钠(2分)②2Cl - +2e=Cl 2 (2分)
(2)①CuSO 4 溶液(1分) ②Cu-2e - = Cu 2+ (2分)
(3)①银(1分) ②Ag + +e - = Ag(2分)
略1年前查看全部
- 电解原理在化学工业中有广泛应用。下图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以
电解原理在化学工业中有广泛应用。下图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题 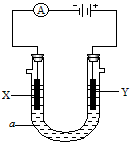
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是_________________。在X极附近观察到的现象是________________。
②Y电极上的电极反应式是________________,检验该电极反应产物的方法是________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO 4 溶液,则
①X电极的材料是________________,电极反应式是________________
②Y电极的材料是________________,电极反应式是________________(说明:杂质发生的电极反应不必写出) hoverdream1年前1
hoverdream1年前1 -
 平江不肖生 共回答了14个问题
平江不肖生 共回答了14个问题 |采纳率100%(1)①2H + +2e - ==H 2 ↑;放出气体,溶液变红;②2Cl - -2e - ==Cl 2 ;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜;Cu 2+ +2e - ==Cu;②粗铜;Cu-2e - ==Cu 2+1年前查看全部
- 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
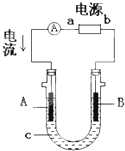 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①A电极的材料是______,电极反应式是______.(说明:杂质发生的电极反应不必写出)
②下列说法正确的是______.
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.在阳极的底部可回收Ag、Pt、Au等金属
(2)用惰性电极电解CuSO4溶液.若阴极析出Cu的质量为12.8g,则阳极上产生的气体在标准状况下的体积为______L.
(3)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用______,阳极材料是用______,阴极电极反应式为______. skywalker6191年前1
skywalker6191年前1 -
 水果有益 共回答了26个问题
水果有益 共回答了26个问题 |采纳率76.9%解题思路:(1)①根据电流方向知,a是正极,b是负极,电解精炼中,粗铜作阳极,纯铜作阴极;
②a.电能不能全部转化为化学能;
b.在电解精炼过程中,阳极上金属放电;
c.溶液中Cu2+向阴极移动;
d.在阳极的底部可回收不活泼金属;
(2)根据转移电子相等计算;
(3)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应.(1)①根据电流方向知,a是正极,b是负极,电解精炼中,粗铜作阳极,纯铜作阴极,
A是阳极,则A极材料是粗铜,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:粗铜;Cu-2e-=Cu2+;
②a.电能不能全部转化为化学能,还有部分转化为热能,故错误;
b.在电解精炼过程中,阳极上金属放电,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.在阳极的底部可回收不活泼金属,如Ag、Pt、Au,故正确;
故选bd;
(2)电解硫酸铜溶液时,阳极上氢氧根离子放电,生成1mol氧气需要4mol电子,根据转移电子相等得阳极上产生的气体在标准状况下的体积=
12.6g
64g/mol×2
4×22.4L/mol=2.24L,
故答案为:2.24;
(3)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用 铜,阴极电极反应式为O2+4H++4e-=2H2O,
故答案为:硫酸溶液;铜;O2+4H++4e-=2H2O.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,正确判断阴阳极是解本题关键,注意根据转移电子守恒计算阳极上生成气体的体积,为难点.1年前查看全部
- 环渤海地区发长江三角洲建立化学工业不同的主导区位因素各是什么?
环渤海地区发长江三角洲建立化学工业不同的主导区位因素各是什么?
 vv体育赛事网1年前1
vv体育赛事网1年前1 -
 bmtc 共回答了20个问题
bmtc 共回答了20个问题 |采纳率95%环渤海地区:资源优势
长江三角洲:技术优势1年前查看全部
- 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
(1)若X是锌,Y是碳棒电极,a是饱和NaCI溶液,则①该原理可制得化工原料有______;②Y极的电极反应式为______
(2)若要用电解方法精炼粗铜,则①电解液a选用______;②Y电极反应式是______.(说明:杂质发生的电极反应不必写出)
(3)若要在某铁制小饰品上镀上一层银,则①Y电极的材料是______;②X电极反应式是______. myasura1年前1
myasura1年前1 -
 wyjfjha 共回答了14个问题
wyjfjha 共回答了14个问题 |采纳率85.7%解题思路:(1)若X是锌、Y是碳棒,a是氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电;
(2)若要用电解方法精炼粗铜,阳极为粗铜,阴极为纯铜,电解质为可溶性的铜盐,阳极上铜失电子发生氧化反应;
(3)若要在铁上镀银,镀层作阳极,镀件作阴极,电解质为含有与阳极材料相同金属元素的可溶性盐,阴极上银离子得电子发生还原反应.(1)①若X是锌、Y是碳棒,a是氯化钠溶液,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中产生氢氧化钠,则该原理可制得化工原料氢气、氯气和氢氧化钠,故答案为:氢气、氯气和氢氧化钠;
②Y电极上氯离子反应生成氯气,电极反应式为2Cl-+2e=Cl2↑,故答案为:2Cl-+2e=Cl2↑;
(2)①若要用电解方法精炼粗铜,阳极为粗铜,阴极为纯铜,电解质为可溶性的铜盐,如硫酸铜,则a为硫酸铜溶液,故答案为:CuSO4溶液;
②Y电极上铜失电子生成铜离子,电极反应式为:Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
(3)①若要在铁上镀银,镀层作阳极,镀件作阴极,要想在铁上镀银,则阳极材料是Ag,故答案为:Ag;
②X电极上银离子得电子生成银,电极反应式为Ag++e-=Ag,故答案为:Ag++e-=Ag.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题以电解原理为载体考查了电镀和电解精炼,明确电镀时镀层和镀件分别作哪种电极、电解精炼时混合物和纯净物分别作哪种电极、阳极材料与电解质溶液的关系是解本题关键,难度不大.1年前查看全部
- 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则 
(1)电解过程中反应的总化学方程式为________________;X极附近观察到的现象是____________。
(2)Y电极上的电极反应式为__________________;检验该电极反应产物的方法是_______________。 百英1年前1
百英1年前1 -
 将进酒123 共回答了25个问题
将进酒123 共回答了25个问题 |采纳率100%1年前查看全部
- 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是100mL饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为______.
②Y电极上的电极反应式为______,
③一段时间后,在阴极得到112mL标准状况下的气体,此时溶液的pH为______.
(溶液体积变化忽略不计)
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是______,电极反应式是______.
②Y电极的材料是______,电极反应式是______.(说明:杂质发生的电极反应不必写出) angel_z9891年前1
angel_z9891年前1 -
 xmz138 共回答了14个问题
xmz138 共回答了14个问题 |采纳率100%解题思路:(1)电解饱和食盐水时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子;(2)根据电解精炼铜的工作原理知识来回答.(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
③由2NaOH~H2↑,阴极得到112mL标准状况下的气体,则n(OH-)=[0.112L/22.4L/mol]×2=0.01mol,
c(OH-)=[0.01mol/0.1L]=0.1mol/L,所以pH=13,
故答案为:13;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+.点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.1年前查看全部
- 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中化学反应方程式为2H2O+2NaCl
H2↑+Cl2↑+2NaOH通电 .2H2O+2NaCl.在X极附近观察到的现象是______.
H2↑+Cl2↑+2NaOH通电 .
②检验Y电极上反应产物的方法是______.
③当导线中有0.1mol的电子通过时,在标况下理论上两极可收集的气体的体积共______L
(2)如要用电解方法精炼含有少量Zn、Fe、Ag、Au杂质的粗铜,电解液a选用CuSO4溶液,则X电极的材料是______,此电极反应式为______.
(3)若想利用此装置在铁上镀银,则电解液a可以选用______,Y极上的电极反应式为______. 嗲qq1年前1
嗲qq1年前1 -
 E网情迷 共回答了26个问题
E网情迷 共回答了26个问题 |采纳率88.5%解题思路:(1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝,阳极电子守恒和电极反应计算;(2)根据电解精炼铜的工作原理知识来回答;(3)依据电镀原理分析,镀层做阳极,待镀金属做阴极,含镀层金属离子的盐为电解质溶液.(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是溶液中氢离子得到电子生成氢气,反应的化学方程式为:2H2O+2NaCl 通电 . H2↑+Cl2↑+2NaOH;和电源的负极相连的电极X...
点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解池的工作原理知识,主要是电解精炼,电镀原理的分析,电极反应电极判断是解题关键,可以根据所学知识进行回答,难度中等.1年前查看全部
- 建造航母需要大量的金属材料,一种新兴的金属由于其密度小、强度高、耐腐蚀性强,它和它的合金在航空、航海和化学工业正逐步取代
建造航母需要大量的金属材料,一种新兴的金属由于其密度小、强度高、耐腐蚀性强,它和它的合金在航空、航海和化学工业正逐步取代铝和铝合金而被广泛应用,该金属是( ) A.锌 B.钛 C.镁 D.锰  Vivian_he1年前1
Vivian_he1年前1 -
 柯南17bt 共回答了14个问题
柯南17bt 共回答了14个问题 |采纳率85.7%在航空航海领域有着广泛的应用的新兴金属是钛,观察选项,故选B.1年前查看全部
- 氨气在化学工业中用途广泛.一定条件下,合成氨反应的微观过程如图所示,( 其中表示氮原子,表示氢原子)请结合图示
氨气在化学工业中用途广泛.一定条件下,合成氨反应的微观过程如图所示,( 其中表示氮原子,表示氢原子)请结合图示回答问题:
(1)写出上述反应的化学方程式3H2+N2
2NH3一定条件 .3H2+N2.该反应属于______(填“化合反应”、“分解反应”、“置换反应”、“复分解反应”).
2NH3一定条件 .
(2)根据物质变化的微观图示,可知化学反应前后肯定发生变化的是______(填序号).
①元素的种类②原子的质量③分子的种类④原子的数目
(3)工业上常用氨气来处理有毒气体NO2,反应原理是8NH3+6NO2
7X+12H2O,其中X的化学式是______.催化剂 .400℃  wp01zhanghong1年前1
wp01zhanghong1年前1 -
 瞎猫xx老鼠 共回答了13个问题
瞎猫xx老鼠 共回答了13个问题 |采纳率100%解题思路:(1)观察合成氨反应的微观过程,分析反应物、生成物及条件,写出反应的方程式.根据反应物、生成物的种类及反应的特点分析反应的基本类型;(2)根据物质变化的微观图示,分析化学反应前后肯定发生变化的量;(3)根据质量守恒定律分析.在化学反应前后,原子的种类及数目不变.(1)由合成氨反应的微观过程可知,反应物是氮气和氢气,在一定条件下反应生成了氨气,反应的方程式是:3H2+N2
一定条件
.
2NH3.该反应由两种物质生成了一种物质,属于化合反应;
(2)由物质变化的微观图可知,在化学反应前后肯定发生变化的是分子的种类,原子的种类、质量,元素的种类不变;
(3)由质量守恒定律可知,在化学反应前后各种原子的数目及种类不变:在方程式的反应物中含有的原子种类及原子个数为H:24;N:14;O:12;已知生成物中含有的原子种类及原子个数为H:24;O:12;比较分析可知X中含有N元素,其分子中原子个数为2,故X的化学式为N2.
故答为:(1)3H2+N2
一定条件
.
2NH3化合反应 (2)③(3)N2.点评:
本题考点: 微粒观点及模型图的应用;反应类型的判定;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 此类试题属于微观粒子模型的图示题,解答时一定要弄清各微观粒子的构成情况,并能把微观粒子与宏观物质很好的联系起来,才能根据微观粒子来推测物质的种类与实验结论等.1年前查看全部
- 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为______.
②Y电极上的电极反应式为______,
③该反应的总反应方程式是:______
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是______,电极反应式是______.
②Y电极的材料是______,电极反应式是______.
(3)若a为CuSO4溶液,则电解时的化学反应方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4、2H2O电解 .
O2↑+2H2↑电解 .2CuSO4+2H2O通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为______.
2Cu+O2↑+2H2SO4、2H2O电解 .
O2↑+2H2↑电解 .
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的C(H+)=______(假设电解后溶液体积不变). xukunlunshan1年前1
xukunlunshan1年前1 -
 szj_erry 共回答了19个问题
szj_erry 共回答了19个问题 |采纳率84.2%解题思路:(1)电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子,阴极上是氢离子得电子;
(2)根据电解精炼铜的工作原理知识来回答;
(3)若a为CuSO4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电;Y电极上氢氧根离子放电;通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH2O,根据氧气和转移电子之间的关系式计算;
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,则生成n(Cl2)=[1/2]n(NaCl)=0.02mol,当阳极产生的气体672mL(标准状况下)时,生成气体的物质的量=[0.672L/22.4L/mol]=0.03mol>0.02mol,在阳极上还有氧气生成,生成氧气的物质的量为0.01mol,阳极上转移电子的物质的量=2n(Cl2)+4n(O2)=0.04mol+0.04mol=0.08mol,阴极上铜离子完全放电时转移电子的物质的量=2×0.04mol=0.08mol,所以阴极上氢离子不放电,根据生成氧气的量计算c(H+).(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,故答案为:2H++2e-=H2↑;②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.1年前查看全部
- 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中X极上的电极反应式为______.在X极附近观察到的现象是______.
(2)Y电极上的电极反应式为______,当有4mol电子转移时,产生的气体在
标准状况下的体积是______L
(3)该电解饱和NaCl溶液的总反应式为2Cl-+2H2O
Cl2↑+H2↑+2OH-通电 .2Cl-+2H2O.
Cl2↑+H2↑+2OH-通电 . jhanyu1年前1
jhanyu1年前1 -
 半兽人闯hh 共回答了14个问题
半兽人闯hh 共回答了14个问题 |采纳率92.9%解题思路:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,X电极上氢离子放电,同时X电极附近有氢氧根离子生成,导致溶液呈碱性,无色酚酞试液遇碱液变红色;
(2)Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,根据电极反应计算;
(3)电解氯化钠溶液,产物是氯气、氢气、氢氧化钠.(1)若X、Y都是惰性电极,a是饱和NaCl溶液,X电极上氢离子放电生成氢气,反应为:2H++2e-=H2↑,同时X电极附近有氢氧根离子生成,导致溶液呈碱性,无色酚酞试液遇碱液变红色,所以看到的现象是溶液变红色,
故答案为:2H++2e-=H2↑;放出气体、溶液变红色;
(2)Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,当有4mol电子转移时,产生的气体在标准状况下的体积2×22.4L=44.8L,故答案为:2Cl--2e-=Cl2↑;44.8L;
(3)电解氯化钠溶液,产物是氯气、氢气、氢氧化钠,即2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-;
故答案为:2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解原理,明确离子放电顺序是解本题关键,会正确书写电极反应式,题目难度不大.1年前查看全部
- 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图A装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图A装置制备乙酸乙酯.

(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______.与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是______.
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是______mL和______mol•L-1.实验编号 试管Ⅰ中试剂 试管Ⅱ中试剂 有机层的厚度/cm A 2mL乙醇、1mL乙酸、
1mL 18mol•L-1浓硫酸饱和Na2CO3溶液 3.0 B 2mL乙醇、1mL乙酸 0.1 C 2mL乙醇、1mL乙酸、
3mL 2mol•L-1 H2SO40.6 D 2mL乙醇、1mL乙酸、盐酸 0.6
②分析实验______(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为______.
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中______内为适当的试剂,______内为适当的分离方法.
①试剂a是______;分离方法②是______,分离方法③是______.分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后______(填标号).
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是______.
(5)为充分利用反应物,甲、乙两位同学分别设计了如图甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是______. xieyiyahoo1年前1
xieyiyahoo1年前1 -
 michaellongwang 共回答了12个问题
michaellongwang 共回答了12个问题 |采纳率100%解题思路:(1)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;
球形干燥管容积较大,利于乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用;
(2)①对比试验关键是要采用控制变量,即控制一个变量,其它条件不变;
②分析使用浓硫酸和稀硫酸的稀硫酸的实验,比较哪种条件下生成的乙酸乙酯多;
(3)先判断过量情况,根据反应方程式及不足量计算出生成乙酸乙酯的质量,然后计算出乙酸乙酯的产率;
(4)①由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,乙酸乙酯的密度小于水,分层后乙酸乙酯在上层,下层为水层,先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出;
②无水碳酸钠粉末是一种良好的吸水剂,可以除掉乙酸乙酯中混有的少量水;
(5)根据图中甲、乙两个装置的不同点和制取乙酸乙酯的反应原理进行解答;(1)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为
CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O;球形干燥管容积较大,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用,
CH3CO18OC2H5+H2O;球形干燥管容积较大,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用,
故答案为:冷凝和防止倒吸;
(2)①本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C 2mol•L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C 3mL乙醇、2mL乙酸、2mol•L-1 H2SO4,实验D 3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为4mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为4mol•L-1,
故答案为:3,4;
②对照实验A和C可知:试管Ⅰ中试剂实验A中使用1mL18mol•L-1 浓硫酸,生成的乙酸乙酯比C中生成的乙酸乙酯大很多,说明浓硫酸的吸水性提高了乙酸乙酯的产率,
故答案为:A C;
(3)90g乙酸的物质的量为:[90/60g/mol]=1.5mol,138g乙醇的物质的量为:[138g/46g/mol]=3mol,显然乙醇过量,理论上生成的乙酸乙酯的物质的量需要按照乙酸的量进行计算,根据反应CH3COOH+C2H5OH CH3COOC2H5+H2O可知,理论上生成乙酸乙酯的物质的量为1.5mol,而实际上生成了88g,则乙酸乙酯的产率为:[88g/88g/mol×1.5mol]×100%=66.7%,
CH3COOC2H5+H2O可知,理论上生成乙酸乙酯的物质的量为1.5mol,而实际上生成了88g,则乙酸乙酯的产率为:[88g/88g/mol×1.5mol]×100%=66.7%,
故答案为:66.7%;
(4)①乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可.对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇.然后水层中的乙酸钠,根据强酸制弱酸,要用浓硫酸反应得到乙酸,再蒸馏得到乙酸;乙酸乙酯的密度小于水,分层后乙酸乙酯在上层,下层为水层,先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出;
故答案为:ab;①②③;饱和Na2CO3溶液;蒸馏;蒸馏;D;
②无水碳酸钠粉末是一种良好的吸水剂,可以除掉乙酸乙酯中混有的少量水,
故答案为:除去乙酸乙酯中混有的少量水;
(5)图中甲、乙两个装置的不同点,乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,而甲不可,
故答案为:乙.点评:
本题考点: 乙酸乙酯的制取;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了乙酸乙酯的制备、混合物的分离和提纯,题目综合性强,注意掌握乙酸乙酯的制备原理和产物分离和提纯的实验方法,难度中等.1年前查看全部
- 下列说法不正确的是( )A.原子论和分子学说的创立,奠定了近代化学的基础B.化学是一门以实验为基础的科学C.化学工业给
下列说法不正确的是( )
A.原子论和分子学说的创立,奠定了近代化学的基础
B.化学是一门以实验为基础的科学
C.化学工业给人类带来的只有益处没有坏处
D.化学使世界变得更加绚丽多彩 rdgs_wang1年前1
rdgs_wang1年前1 -
 菲比和我 共回答了25个问题
菲比和我 共回答了25个问题 |采纳率88%解题思路:A、根据原子分子论对化学的贡献来分析;
B、根据研究化学的基础来分析;
C、要一分为二的看待化学工业;
D、根据化学对社会发展的贡献来分析.A、道尔顿在化学上的主要贡献是提出了原子学说;阿伏加德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说,奠定了近代化学发展的基础,正确;
B、化学是一门以实验为基础的学科,化学理论的得出都离不开化学实验,正确;
C、化学工业在给人类带来益处的同时,不当使用也会造成危害,所以要合理空气中化学工业,向着有利于人类生产和生活的方面发展,错误;
D、化学使世界变得更加绚丽多彩,社会的文明和进步离不开化学,正确.
故选:C.点评:
本题考点: 化学的历史发展过程;化学的用途.
考点点评: 了解化学与人类的关系,才能利用化学知识服务于社会,造福于人类,有利于培养学生的学习兴趣,提高社会责任感.1年前查看全部
- 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
问题:
(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
①a是______ 极(填“正”或“负”) B极附近溶液呈______性.
②电解池中A极上的电极反应式为______.
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①A电极的材料是______,B电极反应式是______.
②下列说法正确的是______.
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液.若阴极析出Cu的质量为12.8g,则阳极上产生的气体在标准状况下的体积为______L.
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用______,阳极材料是用______,阴极电极反应式______. yang_ymy1年前1
yang_ymy1年前1 -
 琉璃猫22 共回答了22个问题
琉璃猫22 共回答了22个问题 |采纳率81.8%解题思路:(1)①根据电流方向知,a是正极、b是负极,则A是阳极、B是阴极,阴极上氢离子放电,同时阴极附近有氢氧根离子生成,导致溶液碱性增强;
②A电极上氯离子放电生成氯气;
(2)①电解精炼粗铜时,粗铜作阳极、纯铜作阴极,阴极上铜离子放电生成铜;
②a.电能全部转化为化学能、热能等;
b.粗铜中,越活泼的金属越容易失电子;
c.电解质溶液中Cu2+向阴极移动;
d.利用阳极泥可回收Ag、Pt、Au等金属;
(3)阴极析出Cu的质量为12.8g转移电子的物质的量=
×2=0.4mol,根据转移电子相等计算;12.8g 64g/mol
(4)根据电池反应式知,稀硫酸作电解质溶液,阳极是Cu,阴极上氧气得电子发生还原反应.(1)①根据电流方向知,a是正极、b是负极,则A是阳极、B是阴极,阴极上氢离子放电,同时阴极附近有氢氧根离子生成,导致溶液碱性增强,无色酚酞试液遇碱变红色,所以B电极附近溶液呈红色,故答案为:正;碱;
②A电极上氯离子放电生成氯气,电极反应式为2Cl--2 e-═Cl2↑,故答案为:2Cl--2 e-═Cl2↑;
(2)①电解精炼粗铜时,粗铜作阳极、纯铜作阴极,所以A的电极材料是粗铜,阴极上铜离子放电生成铜,
电极反应式为Cu2++2e-═Cu,故答案为:粗铜;Cu2++2e-═Cu;
②a.电能全部转化为化学能、热能等,故错误;
b.粗铜中,越活泼的金属越容易失电子,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.电解质溶液中Cu2+向阴极移动,硫酸根离子向阳极移动,故错误;
d.阳极上较活泼的金属失电子,导致阳极材料疏松,则Ag、Pt、Au以单质进入电解质溶液中,所以利用阳极泥可回收Ag、Pt、Au等金属,故正确;
故选b、d;
(3)阴极析出Cu的质量为12.8g转移电子的物质的量=
12.8g
64g/mol×2=0.4mol,根据转移电子相等得氧气体积=
0.4mol
4×22.4L/mol=2.24L,故答案为:2.24;
(4)根据电池反应式知,稀硫酸作电解质溶液,阳极是Cu,阴极上氧气得电子发生还原反应,电极反应式为O2+4H++4e-=2H2O,故答案为:H2SO4;Cu;O2+4H++4e-=2H2O.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,涉及电解精炼、物质的量的计算等知识点,明确阴阳极上放电的物质或离子是解本题关键,再结合转移电子相等计算,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度不大.1年前查看全部
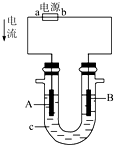
- 电解原理在化学工业中有广泛应用.如图所示,在U形管中加入NaCl溶液,在两极各滴入几滴石蕊试液,插入惰性电极,接通电源.
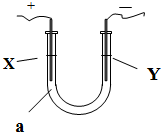 电解原理在化学工业中有广泛应用.如图所示,在U形管中加入NaCl溶液,在两极各滴入几滴石蕊试液,插入惰性电极,接通电源.
电解原理在化学工业中有广泛应用.如图所示,在U形管中加入NaCl溶液,在两极各滴入几滴石蕊试液,插入惰性电极,接通电源.
(1)①一段时间后可观察到的Y电极附近观察到的现象是______.
②X电极上的电极反应式为______,③请写出电解饱和NaCl溶液的化学方程式2NaCl+2H2O
2NaOH+Cl2↑+H2↑电解 .2NaCl+2H2O.
2NaOH+Cl2↑+H2↑电解 .
(2)如果电解液a选用CuCl2溶液,则在电解过程中被氧化的是:______在此变化过程中发生的能量转化的形式是______. mingli97991年前1
mingli97991年前1 -
 1802648 共回答了22个问题
1802648 共回答了22个问题 |采纳率90.9%解题思路:(1)①根据电极判断生成物,从而确定反应现象;
②根据离子放电顺序判断生成物并写出电极反应式;
③阴阳极上电极反应式相加得电池反应式;
(2)根据得失电子判断被氧化的离子,根据电解池的定义分析.(1)①根据图知,Y电极为阴极,氢离子在阴极上得电子生成氢气,所以Y电极附近氢离子浓度降低,氢氧根离子浓度增大,溶液呈碱性,加入石蕊试液溶液呈蓝色,故观察到的现象是:溶液呈蓝色并有气泡产生.
故答案为:溶液呈蓝色并有气泡产生;
②氯离子的放电能力大于氢氧根离子,所以X电极上氯离子失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑.
故答案为:2Cl--2e-=Cl2↑;
③通过以上分析知,氯化钠和水在电解条件下生成氢气、氯气和氢氧化钠,所以电池反应式为
2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑;
(2)如果电解液a选用CuCl2溶液,失电子的离子为Cl-,所以Cl-被氧化;该装置借助外加电源,所以是将电能转化为化学能.
故答案为:Cl-;电能转化为化学能.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解池中电极反应式的书写及电解池的反应现象等知识点,只有明确溶液中离子的放电顺序,才能正确书写电极反应式.1年前查看全部
- (15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N 2 (g)+3H 2 (g) 2NH
(15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N 2 (g)+3H 2 (g)
 2NH 3 (g)ΔH=-92kJ·mol - 1
2NH 3 (g)ΔH=-92kJ·mol - 1
请回答下列问题:
(1)取1 mol N 2 (g)和3 molH 2 (g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92kJ(填“大于”、“等于”或“小于”) ,原因是
,原因是
;若加入催化剂,ΔH (填“变大”、“变小”或“不变”)。
(2)下列有关合成氨反应速率的叙述,不正确的是 (选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N N键、1mol H
N键、1mol H H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N H键需要吸收的能量为 kJ。
H键需要吸收的能量为 kJ。
(4)N 2 H 4 可视为:NH 3 分子中的H被-NH 2 取代的产物。
发射卫星用N 2 H 4 (g)为燃料,NO 2 为氧化剂生成N 2 和H 2 O(g)。
已知:N 2 (g)+2O 2 (g)=2NO 2 (g) ΔH 1 =+67.7 kJ/mol
ΔH 1 =+67.7 kJ/mol
N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(g) ΔH 2 =-534 kJ/mol。
则:1mol N 2 H 4 完全反应的热化学方程式为 。 可硕20011年前1
可硕20011年前1 -
 Ogopogo狼 共回答了29个问题
Ogopogo狼 共回答了29个问题 |采纳率96.6%(1)小于(2分),由于是可逆反应,反应物无法全部转化为生成物,所以不可能生成2molNH 3 (g) (2分), 不变(2分)
(2)c (2分)(3)391 (3分)
(4)N 2 H 4 (g)+NO 2 (g)=3/2 N 2 (g)+2H 2 O(g) ΔH 2 =-567.85 kJ/mol (4分)
略1年前查看全部
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N 2 (g)+3H
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N 2 (g)+3H 2 (g) 
2(((NH 3 (g)△H=-92.2kJ/mol.合成氨工业中原料气N 2 可从空气中分离得到,H 2 可用甲烷在高温下与水蒸气反应制得.
(1)在一容积固定的密闭容器中注入N 2 和H 2 两种气体,发生上述反应.在某温度下达到平衡时各物质的浓度分别为c(H 2 )=9.00mol/L,c(N 2 )=3.00mol/L,c(NH 3 )=4.00mol/L,此温度下该反应的平衡常数为______.
(2)三个相同容器中各充入1molN 2 和3molH 2 ,在不同条件下反应并达到平衡,氨的体积分数随时间的变化如图所示.下列说法正确的是______(填序号).
A.图I可能是不同压强对反应的影响,且P 2 >P 1
B.图Ⅱ可能是不同压强对反应的影响,且P 1 >P 2
C.图Ⅲ可能是不同温度对反应的影响,且T 1 >T 2
D.图Ⅱ一定是在同温同压下不同催化剂对反应的影响,且催化剂效果1>2
(3)将水蒸气通过红热的炭即产生水蒸气,化学方程式为:C(s)+H 2 O(g)
H 2 (g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发______(填:能或否).
(4)甲烷在高温下与水蒸气反应反应方程式为:CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g).部分物质的燃烧热数据如下表:
已知1mol H 2 O(g)转变为1mol H 2 O(l)时放出44.0kJ热量.写出CH 4 和H 2 O在高温下反应的热化学方程式______.物质 燃烧热(kJ•mol -1 ) H 2 (g) -285.8 CO(g) -283.0 CH 4 (g) -890.3
(5)有人设想寻求合适的催化剂和电极材料,以N 2 、H 2 为电极反应物,以HCl-NH 4 Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______. 乔襄1年前1
乔襄1年前1 -
 dongege 共回答了20个问题
dongege 共回答了20个问题 |采纳率85%(1)k= c 2 (N H 3 ) n( N 2 )• c 3 ( H 2 ) = 4. 00 2 3.00×9.0 0 3 =7.32×10 -3 ,故答案为:7.32×10 -3 ;(2)A.增大压强,平衡向正反应分析移动,氨...1年前查看全部
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响. (1) 500℃、50MPa时,在容
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响. (1) 500℃、50MPa时,在容
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________.
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 .
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率.某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g•L-1,从合成塔出来的混合气体在相同条件下密度为0.693g•L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________.
(4)的理由
 sonic11221年前1
sonic11221年前1 -
 百色mm网 共回答了24个问题
百色mm网 共回答了24个问题 |采纳率91.7%(1) N2 + 3H2 = 2NH3
起始: 0.8 1.6 0
转化: 0.2 0.6 0.4
平衡: 0.6 1.0 0.4
K=c(NH3)^2 / [c(N2)·c(H2)^3]=(0.4)^2÷[0.6×(1.0)^3]=4/15.
(2)C、D.
(3)阳极反应:3H2 - 6e- = 6H+;阴极反应:N2 + 6e- + 6H+ = 2NH3.
(4)因为气体密度均为标准状况下测得,设原反应混合气中N2的物质的量为amol,H2的物质的量为bmol:气体总质量为28a+2b=(a+b)×22.4×0.554,解得:a/b=2/3.
又根据质量守恒定律,反应前后气体总质量不变.
在同温同压同质量情况下,气体密度之比就等于其体积比的倒数,同时等于气体物质的量之比的倒数.
N2 + 3H2 = 2NH3
起始: a b 0
转化: n 3n 2n
平衡: a-n b-3n 2n
(a+b) / [(a-n)+(b-3n)+2n)=0.693 / 0.554,且a/b=2/3.解得转化率:n/a×100%=25%.1年前查看全部
- 急求大量高中化学工业流程类题目
 鱿鱼20081年前0
鱿鱼20081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高中化学工业流程题解法(方程式与概念)
 神经质的面包1年前1
神经质的面包1年前1 -
 bluenini 共回答了19个问题
bluenini 共回答了19个问题 |采纳率100%先看反应条件,1年前查看全部
- 化学工业制二氧化碳的方程式
 zh_q__uaa6yu46361年前1
zh_q__uaa6yu46361年前1 -
 九眼狐 共回答了17个问题
九眼狐 共回答了17个问题 |采纳率82.4%高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑ NH3+COCO2+Na2CO3+H2O-这个就是工业上用二氧化碳制取小苏打的分布化学方程式 NH3+1年前查看全部
- 有机溶剂中无机物的溶解度例如 为什么可以用乙醇洗在KNO3上残留的NaCl为什么在某些化学工业问题中(反应物都是无机物时
有机溶剂中无机物的溶解度
例如 为什么可以用乙醇洗在KNO3上残留的NaCl
为什么在某些化学工业问题中(反应物都是无机物时),在乙醇反应液中反应可以提高产率
可以具体回答有哪些无机物在乙醇中溶解度小 又有哪些溶解度大吗? ruarua1年前1
ruarua1年前1 -
 是你错过了 共回答了21个问题
是你错过了 共回答了21个问题 |采纳率95.2%因为KNO3不溶于乙醇 而NaCl易溶于水 乙醇与水也易溶 所以用乙醇洗(原理是萃取)1年前查看全部
- 硫酸是化学工业的重要产品也是我们实验室常用常备的化学试剂.
硫酸是化学工业的重要产品也是我们实验室常用常备的化学试剂.
某同学为鉴定某一无色溶液是否为稀硫酸,进行了以下实验:
①取少量溶液于试管中,滴加石蕊试液,溶液变红色,表明溶液中一定有氢离子;
②用玻璃棒蘸取少量溶液,滴到pH试纸上,测得pH=0,表明溶液呈酸性;
③取少量溶液于试管中,滴加氯化钡溶液,振荡,有白色沉淀生成,证明溶液中一定有硫酸根离子;
④取少量溶液于试管中,滴加硝酸钡溶液,振荡,有白色沉淀生成,滴加稀硝酸,沉淀不溶解.证明溶液中一定有硫酸根离子
若确定该溶液为硫酸,能达到目的实验组合是( )
A.①② B.②③ C.①④ D.③④ hp101022511年前1
hp101022511年前1 -
 513385995 共回答了20个问题
513385995 共回答了20个问题 |采纳率80%应该是1、4或者2、4,但是题目只有C.①④,所以选C【1、2是检验溶液显酸性,3是检验SO42-离子的存在.3中加入没有酸化的氯化钡溶液,会有CO32-或者SO32-或者Ag+离子的干扰,所以错误.】1年前查看全部
- 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞溶液,试判断:
①a是______极(填“正”或“负”),B是______极(填“阴”或“阳”);
②A电极上的电极反应式为______,B电极上的电极反应式为______;
③检验A电极产物的方法是______.
(2)用惰性电极电解CuSO4溶液.若阴极上析出Cu的质量为3.2g,则阳极上产生的气体在标准状况下的体积为______;常温下,若将电解后的溶液稀释至1L,则溶液的pH约为______. tianqibucuo1年前1
tianqibucuo1年前1 -
 bobhmz 共回答了17个问题
bobhmz 共回答了17个问题 |采纳率88.2%解题思路:(1)电解饱和食盐水时,由电流流向可知,A为阳极与电源正极相连,B为阴极与电源负极相连,阳极上是氯离子失电子,阴极上是氢离子得电子;A电极生成的氯气检验方法是利用氯气使湿润的淀粉碘化钾试纸变蓝检验;
(2)根据电解精硫酸铜的电极反应和电子守恒,氢离子守恒分析计算.(1)①由电流流向可知,和电源的正极相连的电极A极是阳极,和电源的负极相连的电极B极是阴极,该a为正极,b为负极.A为阳极,B为阴极,
故答案为:正;阴;
②A电极为阳极,溶液中氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,B电极为电解池的阴极,电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑;
故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;
③检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色,
故答案为:用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
(2)电解硫酸铜溶液时,阳极上氢氧根离子放电,生成1mol氧气需要4mol电子;生成3.2gCu转移电子数为[3.2g/64g/mol]×2=0.1mol,根据转移电子相等得阳极上产生的气体在标准状况下的体积=[0.1mol/4]×22.4L/mol=0.56L;阴极电极反应:4OH--4e-=2H2O+O2↑,消耗氢氧根离子物质的量,0.1mol,溶液中增加氢离子物质的量为0.1mol,常温下,若将电解后的溶液稀释至1L,溶液中氢离子浓度=[0.1mol/1L]=0.1mol/L,溶液pH=1,
故答案为:0.56L;1.点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.1年前查看全部
- 氨气(NH 3 )是一种无色、有刺激性气味的气体,极易溶于水,它的水溶液称为氨水,显碱性,氨在化学工业中用途很广泛,例如
氨气(NH 3 )是一种无色、有刺激性气味的气体,极易溶于水,它的水溶液称为氨水,显碱性,氨在化学工业中用途很广泛,例如制化肥、制纯碱等;近年来,氨还用于环境治理.
(1)实验室收集氨气可采用的方法为______,干燥氨气可选用试剂为______.
(2)工业上在细菌作用下用氨处理含甲醇的废水,使其变为毒的N 2 和CO 2 ,从而消除对环境的污染,有关的反应为:6NH 3 +5CH 3 OH+12B
3N 2 +5CO 2 +19H 2 O,上述反应中B的化学式是______.细菌 .
(3)在400℃、催化剂存在的条件下,用氨气可将有毒气体NO还原,生成N 2 和H 2 O.
试写出该反应的化学方程式:______. 恶从胆边生1年前1
恶从胆边生1年前1 -
 fs_a 共回答了21个问题
fs_a 共回答了21个问题 |采纳率85.7%(1)因为氨气的密度比空气小,可以固体氢氧化钠或碱石灰或生石灰等(任一种)用向下排空气法收集氨气.可以用显碱性的干燥剂干燥氨气.故填:向下排空气法;
(2)根据质量守恒定律可知,B中含有两个氧原子,是氧气.故填:O 2
(3)反应的化学方程式为:4NH 3 +6NO
催化剂
.
△ 5N 2 +6H 2 O1年前查看全部
- 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
问题:
(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
①a是正正 极(填“正”或“负”) B极附近溶液呈碱碱性.
②电解池中A极上的电极反应式为2Cl--2e-═Cl2↑2Cl--2e-═Cl2↑.
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①A电极的材料是粗铜粗铜,B电极反应式是Cu2++2e-═CuCu2++2e-═Cu.
②下列说法正确的是bdbd.
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液.若阴极析出Cu的质量为12.8g,则阳极上产生的气体在标准状况下的体积为2.242.24L.
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用稀硫酸稀硫酸,阳极材料是用CuCu,阴极电极反应式O2+4H++4e-=2H2OO2+4H++4e-=2H2O. cornermen1年前1
cornermen1年前1 -
 茕孑yyw 共回答了15个问题
茕孑yyw 共回答了15个问题 |采纳率66.7%(1)①根据电流方向知,a是正极、b是负极,则A是阳极、B是阴极,阴极上氢离子放电,同时阴极附近有氢氧根离子生成,导致溶液碱性增强,无色酚酞试液遇碱变红色,所以B电极附近溶液呈红色,故答案为:正;碱;
②A电极上氯离子放电生成氯气,电极反应式为2Cl--2 e-═Cl2↑,故答案为:2Cl--2 e-═Cl2↑;
(2)①电解精炼粗铜时,粗铜作阳极、纯铜作阴极,所以A的电极材料是粗铜,阴极上铜离子放电生成铜,
电极反应式为Cu2++2e-═Cu,故答案为:粗铜;Cu2++2e-═Cu;
②a.电能全部转化为化学能、热能等,故错误;
b.粗铜中,越活泼的金属越容易失电子,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.电解质溶液中Cu2+向阴极移动,硫酸根离子向阳极移动,故错误;
d.阳极上较活泼的金属失电子,导致阳极材料疏松,则Ag、Pt、Au以单质进入电解质溶液中,所以利用阳极泥可回收Ag、Pt、Au等金属,故正确;
故选b、d;
(3)阴极析出Cu的质量为12.8g转移电子的物质的量=
12.8g
64g/mol×2=0.4mol,根据转移电子相等得氧气体积=
0.4mol
4×22.4L/mol=2.24L,故答案为:2.24;
(4)根据电池反应式知,稀硫酸作电解质溶液,阳极是Cu,阴极上氧气得电子发生还原反应,电极反应式为O2+4H++4e-=2H2O,故答案为:H2SO4;Cu;O2+4H++4e-=2H2O.1年前查看全部
- 超临界流体是物质介于气态和液态之间的一种新的状态.目前应用最广的是超临界二氧化碳在化学工业上可取代氟利昂等溶剂、发泡剂.
超临界流体是物质介于气态和液态之间的一种新的状态.目前应用最广的是超临界二氧化碳在化学工业上可取代氟利昂等溶剂、发泡剂.下列有关超临界二氧化碳的说法中错误的是( )
A. 超临界二氧化碳由CO2分子聚集而成
B. 超临界二氧化碳是新合成的一种物质
C. 用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去
D. 用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏 八分齋1年前1
八分齋1年前1 -
 aicaojian 共回答了17个问题
aicaojian 共回答了17个问题 |采纳率94.1%解题思路:可以根据超临界二氧化碳的性质方面进行分析、判断,从而得出正确的结论.A、超临界二氧化碳就是二氧化碳,是由CO2分子构成的,故A正确;
B、超临界二氧化碳与其气态或液态之间的转化没有新物质生成,是物理变化,并不是新合成的物质,故B错误;
C、超临界二氧化碳是在特殊条件下的一种的新状态,在常温下变为二氧化碳气体,故C正确;
D、用超临界二氧化碳代替氟氯代烷可减轻对臭氧层的破坏,故D正确;
故选B点评:
本题考点: 二氧化碳的用途;二氧化碳对环境的影响.
考点点评: 解答本题要充分理解超临界二氧化碳的性质,只有这样才能对问题做出正确的解释.1年前查看全部
- 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为______,在X极附近观察到的现象是______.
电解液中向X极方向移动的离子是______.
②Y电极上的电极反应式为______.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO 4 溶液,则:
①X电极的材料是______.
②Y电极的电极反应式为______.(说明:杂质发生的反应不必写出)
③溶液中的c(Cu 2+ )与电解前相比______(填“变大”、“变小”或“不变”).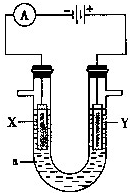
 L柒八zao1年前1
L柒八zao1年前1 -
 superzhu 共回答了21个问题
superzhu 共回答了21个问题 |采纳率85.7%(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H + +2e - =H 2 ↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
故答案为:2H + +2e - =H 2 ↑或2H 2 O+2e-=H 2 +2OH - ;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl - -2e - =Cl 2 ↑,故答案为:2Cl - -2e - =Cl 2 ↑;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu 2+ +2e - =Cu,故答案为:精铜;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e - =Cu 2+ ,故答案为:粗铜;Cu-2e - =Cu 2+ ;
③粗铜做阳极,其中的杂质锌、镍等也会失电子,所以依据电子守恒,阴极析出的铜比阳极溶解的铜多,溶液中铜离子浓度减小,故答案为:变小.1年前查看全部
- 纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域.工业上以食
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域.工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱.其流程如下:
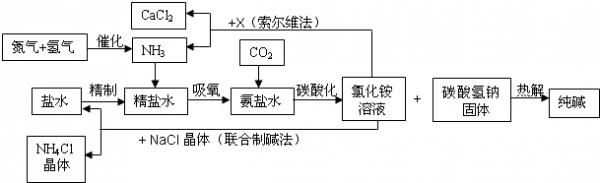
已知有关物质重要反应的化学方程式如下:
①NaCl+NH3+H2O+CO2
NaHCO3↓+NH4Cl△ .
②2NaHCO3
Na2CO3+H2O+CO2↑△ .
③2NH4Cl+X
2NH3↑+CaCl2+2H2O△ .
④NH4Cl═NH3↑+HCl↑
根据以上信息回答下列问题.
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉积,可以向其一和加入过量纯碱.此时将混合液中不溶物除去的方法是______;溶液中多余的纯碱可以加______试剂来除去.
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出.试分析该流程需要加压条件的原因是:______.
(3)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”.即在氯化铵溶液中加入物质X______(填化学式),产生了可循环使用的氨气,和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化氨的______,使氯化铵晶体单独析出得到另一种产品--氮肥.氯化钠溶液则可以循环利用.
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?答:______. gxb0031年前1
gxb0031年前1 -
 雾海碧竹 共回答了21个问题
雾海碧竹 共回答了21个问题 |采纳率81%解题思路:(1)根据过滤的原理回答前一空;根据碳酸钠的化学性质和除杂的原理回答后一空.
(2)根据气体的溶解度随压强的增大而增大回答.
(3)根据铵盐与碱性物质反应生成氨气的性质回答前一空;根据氯化钠溶液和氯化铵溶液中都含氯离子,氯化钠是制纯碱的原料回答.
(4)根据氯化铵的化学性质回答.(1)过滤是把不溶于液体的固体与液体分开的操作,所以除去液体混合物中的不溶性杂质用过滤的方法;碳酸钠能和盐酸反应生成氯化钠、水、二氧化碳,用盐酸除去多余的碳酸钠不会产生新杂质.
(2)二氧化碳能溶于水,但溶解性较差,气体的溶解度随压强的增大而增大,为了促进更多二氧化碳溶解,使反应更充分,所以需加压条件.
(3)铵盐与碱性物质反应生成氨气,在氯化铵溶液中加入物质X产生了可循环使用的氨气,定是加入的碱性物质,最廉价的碱是熟石灰,所以加入的物质是熟石灰;氯化钠溶液和氯化铵溶液中都含氯离子,在氯化铵溶液中加入适量氯化钠晶体可降低氯化铵的溶解度,使氯化铵晶体单独析出.
(4)不直接蒸发结晶析出氯化铵固体,是因氯化铵受热易分解.
故答案为:(1)过滤;盐酸;
(2)促进更多二氧化碳溶解,使反应更充分;
(3)Ca(OH)2;溶解度;
(4)因氯化铵受热易分解.点评:
本题考点: 过滤的原理、方法及其应用;物质除杂或净化的探究;纯碱的制取.
考点点评: 化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,二氧化碳和氨气通入的顺序及原因,反应时析出碳酸氢钠的原因与物质溶解度的关系.1年前查看全部
- “很多日常用品与化学工业生产有关”,如果同意这一说法,请举例出一些用品可能与哪类化工生产有关?
 xiaoxuezz1年前1
xiaoxuezz1年前1 -
 loaqxb 共回答了21个问题
loaqxb 共回答了21个问题 |采纳率90.5%玻璃,水泥属于硅酸盐工业.
塑料,合成纤维这些制品属于有机化工.
食盐,纯碱等调料的精炼提纯属于精细化工.
转基因技术是生物化学.
钢铁等金属制品源于金属冶炼(热还原法,电解法)1年前查看全部
- 一.下面是氮肥包装的部分文字硝酸铵 (NH4NO3)净重 50kg含氮量 31.5%xxx化学工业公司求:1.氮肥中氮元
一.下面是氮肥包装的部分文字
硝酸铵 (NH4NO3)
净重 50kg
含氮量 31.5%
xxx化学工业公司
求:1.氮肥中氮元素的质量
2.此氮肥的纯度
二.纯度为80%的尿素样品中含氮元素的质量分数是多少? wooog1年前1
wooog1年前1 -
 静然Hebe 共回答了16个问题
静然Hebe 共回答了16个问题 |采纳率87.5%第一题:氮元素的质量,直接用净重50kg乘以含氮量31.5%就行;氮肥的纯度,根据硝酸铵中氮的相对质量分数算出理论含氮量,比较第一小题的实际氮元素质量,即得纯度.
第二题:尿素CON2H4,算出氮的相对质量分数,乘上80%1年前查看全部
- 硫酸是基础化学工业的重要的产品.它是许多化工生产的原料,大量用于制化肥,如磷肥、氮肥等.某化学兴趣小组围绕浓硫酸及其盐的
硫酸是基础化学工业的重要的产品.它是许多化工生产的原料,大量用于制化肥,如磷肥、氮肥等.某化学兴趣小组围绕浓硫酸及其盐的性质进行如下探究,请你回答:
(1)将适量的蔗糖放入一烧杯中,再加入浓硫酸,观察到蔗糖变黑,体积膨胀,并产生刺激性气味的气体.该实验表明浓硫酸具有______.(填序号)
A.强酸性B.强氧化性C.脱水性D.吸水性
(2)取一小粒金属钠,小心放入盛有硫酸铜稀溶液的烧杯中,用漏斗倒扣在烧杯上,观察到金属钠在液面上四处游动,有大量气泡生成,收集产生的气体并点燃,火焰呈淡蓝色,该气体是______(填化学式).溶液中立即有蓝色沉淀生成,写出生成蓝色沉淀的离子方程式______.
(3)“绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线.若以铜为原料制取硫酸铜,通过以下两种方法均可以制得硫酸铜:
方法1:铜屑在空气中灼烧后,在加热条件下与稀硫酸反应.
方法2:铜与浓硫酸在加热条件下反应.请写出制取过程中发生反应的化学方程式.
方法1:______.方法2:______.
从原料利用率、环境保护等角度对比,应该选用哪种方法______.
(4)明矾KAl(SO 4 ) 2 •12H 2 O是一种很好的净水剂,请用简要的文字描述其原理______. 我是龙一1年前1
我是龙一1年前1 -
 san123 共回答了13个问题
san123 共回答了13个问题 |采纳率76.9%(1)蔗糖逐渐变黑表现了浓硫酸的脱水性,放出有刺激性气味的气体说明浓硫酸具有强氧化性;
故答案为:BC.
(2)钠在硫酸铜溶液中先和水反应生成氢氧化钠和氢气,2Na+2H 2 O=2NaOH+H 2 ↑,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,2NaOH+CuSO 4 =Cu(OH) 2 ↓+Na 2 SO 4 ,生成的气体为氢气,生成的蓝色沉淀为氢氧化铜沉淀,反应的离子方程式为:Cu 2+ +2OH - =Cu(OH) 2 ↓;
故答案为:H 2 ,Cu 2+ +2OH - =Cu(OH) 2 ↓;
(3)方法1、铜屑在空气中灼烧后生成氧化铜,氧化铜在加热条件下与稀硫酸反应生成硫酸铜和水,反应的化学方程式为:2Cu+O 2 +2H 2 SO 4 =2CuSO 4 +2H 2 O;
方法2、铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H 2 SO 4 (浓)
△
.
CuSO 4 +SO 2 ↑+2H 2 O;
相同质量的硫酸生成硫酸铜方法1多,且无污染性气体,方法2反应过程中有二氧化硫污染性的气体生成,消耗同质量硫酸生成的硫酸铜少;
故答案为:2Cu+O 2 +2H 2 SO 4 =2CuSO 4 +2H 2 O,Cu+2H 2 SO 4 (浓)
△
.
CuSO 4 +SO 2 ↑+2H 2 O;方法1;
(4)明矾溶解于水中,溶液中铝离子水解生成氢氧化铝胶体具有吸附悬浮在水中的杂质的作用,明矾溶于水后溶液中的铝离子水解生成氢氧化铝胶体,胶体具有吸附悬浮杂质的作用,起到净水的作用;
故答案为:明矾溶于水后溶液中的铝离子水解生成氢氧化铝胶体,胶体具有吸附悬浮杂质的作用,起到净水的作用;1年前查看全部
- 中学化学中涉及到一些重要的化学工业,以下有关化工生产叙述正确的是( ) A.氯气通入到饱和的石灰水中可制得大量漂粉精
中学化学中涉及到一些重要的化学工业,以下有关化工生产叙述正确的是( ) A.氯气通入到饱和的石灰水中可制得大量漂粉精 B.钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来 C.工业上,用SiO 2 +2C
Si+2CO↑制得粗硅高温 . D.接触法制H 2 SO 4 在接触室中SO 2 氧化条件一般选择高温、高压、催化剂  雅俗yasuo1年前1
雅俗yasuo1年前1 -
 wdfb 共回答了14个问题
wdfb 共回答了14个问题 |采纳率92.9%A、工业上是将氯气通到石灰乳中来生产大量的漂粉精,故A错误;
B、钠和盐溶液的反应规律是:钠和盐溶液中的水先反应生成氢氧化钠和氢气,不能将金属从其盐溶液中置换出来,故B错误;
C、工业上用焦炭还原二氧化硅中的硅来制取粗硅,故C正确;
D、工业制硫酸在常压或低压下进行,高压不利于提高反应物的转化率,故D错误.
故选C.1年前查看全部
- 一道化学工业题:工业上将FeCl2氧化为FeCl3通常用什么试剂?用Cl2和H2O2 (盐酸环境下)
一道化学工业题:工业上将FeCl2氧化为FeCl3通常用什么试剂?用Cl2和H2O2 (盐酸环境下)
工业上将FeCl2氧化为FeCl3通常用什么试剂?
用Cl2和H2O2 (盐酸环境下).
为什么要用双氧水呀 小风爱三三1年前1
小风爱三三1年前1 -
 明月凝霜 共回答了20个问题
明月凝霜 共回答了20个问题 |采纳率90%FeCl2+H2O2=FeCl3+2H2O
H2O2便宜,工艺简单1年前查看全部
- [化学一有机化学基础]对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料.(1)写出PX的结构
[化学一有机化学基础]对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料.(1)写出PX的结构
[化学一有机化学基础]
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料.
(1)写出PX的结构简式______.
(2)PX可发生的反应有______、______(填反应类型).
(3)增塑剂(DEHP)存在如图所示的转化关系,其中A 是PX的一种同分异构体.
①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是______.
②D分子所含官能团是______(填名称).
③C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是______
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应.
写出F与NaHCO3溶液反应的化学方程式______.
 bocyf1年前1
bocyf1年前1 -
 罗湖放飞心情 共回答了17个问题
罗湖放飞心情 共回答了17个问题 |采纳率100%(1)对二甲苯的结构简式为: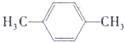 ,故答案为:
,故答案为: ;
;
(2)对二甲苯中的苯环能和氢气发生加成反应,甲基能被酸性高锰酸钾溶液氧化生成羧基,苯环和甲基上氢原子能发生取代反应,所以可发生的反应有加成反应、氧化反应、取代反应,故答案为:取代反应;加成反应;
(3)A 是PX的一种同分异构体,A被酸性高锰酸钾氧化生成B,根据B的分子式知,B中含有两个羧基,则A是含有两个甲基二甲苯,B是含有两个羧基的二甲酸;
DEHP发生水解反应生成B和C,B是酸,根据A和B的分子式知,C是一元醇,且分子中含有8个碳原子,C被氧化生成D,D能发生银镜反应,说明C中羟基在边上;
在加热、浓硫酸作用下,B发生消去反应生成烯烃E,E和氢气发生加成反应生成烷烃3-甲基庚烷;
①B 的苯环上存在2 种不同化学环境的氢原子,说明两个羧基处于相邻位置,则B 的结构简式是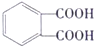 ,故答案为:
,故答案为: ;
;
②D能发生银镜反应,说明D中含有醛基,故答案为:醛基;
③C分子有1个碳原子连接乙基和正丁基,则C的结构简式为:CH3(CH2)3CH(CH2CH3)CH2OH,B和C发生酯化反应生成DEHP,所以DEHP的结构简式是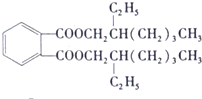 ,故答案为:
,故答案为: ;
;
(4)F 是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物,说明取代基处于邻位,b.遇FeCl3溶液显示特征颜色,说明含有酚羟基;c.能与碳酸氢钠溶液反应,说明含有羧基,所以F的结构简式为 ,F 与NaHCO3溶液反应的化学方程式为
,F 与NaHCO3溶液反应的化学方程式为 ,
,
故答案为: .
1年前查看全部
.
1年前查看全部
- “绿色化学”在20世纪90年代兴起并将成为21世纪化学发展的主导方向,其核心是利用化学原理从源头上减少或消除化学工业对环
“绿色化学”在20世纪90年代兴起并将成为21世纪化学发展的主导方向,其核心是利用化学原理从源头上减少或消除化学工业对环境的污染,又称为“环境友好化学”.据此思考判断,下面不属于“绿色化学”考虑内容的是 [ ]A.反应在无毒、无公害的条件下进行,如采用无毒无害的溶剂和催化剂
B.化工生产的原料和产品尽可能无毒、无害或毒性极小
C.尽可能通过最小的成本取得最大的利润
D.尽可能采用可再生原料,且原料利用率尽可能最大化,副产物或废料产生率最小化 168-123-8901年前1
168-123-8901年前1 -
 crystal_200610 共回答了26个问题
crystal_200610 共回答了26个问题 |采纳率100%C1年前查看全部
- 化学工业制氢氧化钠为什么非要用碳酸钠与氢氧化钙反应?
 微微_麦子1年前1
微微_麦子1年前1 -
 loveinbj 共回答了10个问题
loveinbj 共回答了10个问题 |采纳率90%用的是碳酸钠和氢氧化钙悬浊液反应.一个是因为原料便宜,另一个是反应生成碳酸钙沉淀,不会引入新的杂质.1年前查看全部
大家在问
- 1搭配词语【快、】优秀( ) 性质( ) 性能( )纯熟( ) 纯朴( ) 纯洁( )坚持( )职责( )职守( )简洁(
- 2人类有一天会灭绝吗?俗话都说"物极必反"人类的发展处于青年时期,可人类衰落时会离开地球,还是坐以待毙?
- 3一质点由A点出发沿直线AB运动,行程的第一部分是加速度为a1的匀加速运动,接着做加速度大小为a2的匀减速直线运动,抵达B
- 4在图1中作出反射光线并标出反射角的度数;在图2中作出镜面的位置;在图3中作出物体在平面镜中的像.
- 590度除以24=()度
- 6重力、摩擦力、支持力怎样画?
- 7读下面的“太平洋表层洋流分布图”,完成1—2题。
- 8酸碱中和滴定为什么不能用石蕊先写下几种指示剂变色的范围.酚酞 8.0----10.0 甲基橙 3.1----4.4 石蕊
- 9绿绳七分之六米,是红绳的四分之三米,红绳多少米?用方程解
- 10用辗转相除法求168和70的最大公因数,快.
- 11999 乘997减 998乘 996等于多少怎么简便 ‘
- 12though (suprised)to see us,the professor gave us a warm welc
- 13“人固有一死,或重于泰山,或轻于鸿毛.”解释与体会
- 14前面是光的四字成语有吗
- 15一个平行四边形的面积是12平方分米,它的底是四分之一米.它的高是多少米

