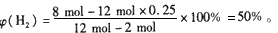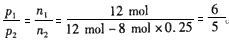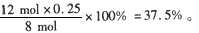合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N 2 (g)+3H
 乔襄2022-10-04 11:39:541条回答
乔襄2022-10-04 11:39:541条回答 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N 2 (g)+3H 2 (g) 2(((NH 3 (g)△H=-92.2kJ/mol.合成氨工业中原料气N 2 可从空气中分离得到,H 2 可用甲烷在高温下与水蒸气反应制得.  (1)在一容积固定的密闭容器中注入N 2 和H 2 两种气体,发生上述反应.在某温度下达到平衡时各物质的浓度分别为c(H 2 )=9.00mol/L,c(N 2 )=3.00mol/L,c(NH 3 )=4.00mol/L,此温度下该反应的平衡常数为______. (2)三个相同容器中各充入1molN 2 和3molH 2 ,在不同条件下反应并达到平衡,氨的体积分数随时间的变化如图所示.下列说法正确的是______(填序号). A.图I可能是不同压强对反应的影响,且P 2 >P 1 B.图Ⅱ可能是不同压强对反应的影响,且P 1 >P 2 C.图Ⅲ可能是不同温度对反应的影响,且T 1 >T 2 D.图Ⅱ一定是在同温同压下不同催化剂对反应的影响,且催化剂效果1>2 (3)将水蒸气通过红热的炭即产生水蒸气,化学方程式为:C(s)+H 2 O(g)  H 2 (g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发______(填:能或否). (4)甲烷在高温下与水蒸气反应反应方程式为:CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g).部分物质的燃烧热数据如下表:
(5)有人设想寻求合适的催化剂和电极材料,以N 2 、H 2 为电极反应物,以HCl-NH 4 Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______. |

已提交,审核后显示!提交回复
共1条回复
 dongege 共回答了20个问题
dongege 共回答了20个问题 |采纳率85%- (1)k= c 2 (N H 3 ) n( N 2 )• c 3 ( H 2 ) = 4. 00 2 3.00×9.0 0 3 =7.32×10 -3 ,故答案为:7.32×10 -3 ;(2)A.增大压强,平衡向正反应分析移动,氨...
- 1年前
相关推荐
- 氨在国民经济中占有重要地位。(1)合成氨工业中,合成塔中每产生2molNH 3 ,放出92.2 kJ热量。①工业合成氨的
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH 3 ,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN 2 和6molH 2 ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH 3 和CO 2 为原料合成尿素[CO(NH 2 ) 2 ],反应的化学方程式为2NH 3 (g)+CO 2 (g) CO(NH 2 ) 2 (l)+H 2 O(l),该反应的平衡常数和温度关系如下:
CO(NH 2 ) 2 (l)+H 2 O(l),该反应的平衡常数和温度关系如下:T / ℃ 165 175 185 195 K 111.9 74.1 50.6 34.8
①焓变ΔH(填“>”、“<”或“=”)_______0。
(3)已知:
①N 2 (g)+O 2 (g)=2NO(g) ΔH 1 =+180 kJ·mol -1
②N 2 (g)+3H 2 (g) 2NH 3 (g) ΔH 2 =-92.4 kJ·mol -1
2NH 3 (g) ΔH 2 =-92.4 kJ·mol -1
③2H 2 (g)+O 2 (g)=2H 2 O(g) ΔH 3 =-483.6 kJ·mol -1
氨的催化氧化反应的热化学方程式为 fengsheng1年前1
fengsheng1年前1 -
 alexseo 共回答了17个问题
alexseo 共回答了17个问题 |采纳率82.4%1年前查看全部
- 1.合成氨时把1体积N2和3体积H2混合后,通过合成塔,若合成塔排出的混合气体中氨占体积的15%,求H2所占的体积分数及
1.合成氨时把1体积N2和3体积H2混合后,通过合成塔,若合成塔排出的混合气体中氨占体积的15%,求H2所占的体积分数及N2的平衡转化率(体积均在同温同压下测定)(答案:63.74% 26.1%)
2.常温下于一密闭容器中充入NO2,当反应2NO2(g)(双箭头)N2O4(g)达到平衡后,测知有80%的NO2转化为N2O4,则平衡时混合气体的平均相对分子质量约为多少?76.7) 独自躲在墙角dd1年前1
独自躲在墙角dd1年前1 -
 wuya0000 共回答了18个问题
wuya0000 共回答了18个问题 |采纳率88.9%H2%=(1-15%)*3/4 ;
N2 + 3H2 ===== 2NH3
1.3.
x.3x.2x
2x/(4-2x)=15%
a(N2)=x
M=(14+32)/0.61年前查看全部
- 合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密
合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是( )
A、由图1可知2NH3(g)N2(g)+3H2(g)△H=-92kJmol-1
B、图2中0~10min内该反应的平均速率v(H2)=0.045molL-1min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C、图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
主要是c选项不懂,我知道增加氢气的量会提高氮气的转化率,但是为什么在b点时氨气的百分数最高,这不代表此时氮气的转化率最高吗?而且为什么从b点到c点氮气转化率升高而图像是往下走的? asynchronism1年前1
asynchronism1年前1 -
 将军帅 共回答了11个问题
将军帅 共回答了11个问题 |采纳率100%首先要说明的是逆反应的速率低是相对的,那就说明正反应的速率在加大.就是氮气反应得更快了1年前查看全部
- 把4 mol N 2 和8mol H 2 置于5L密闭容器中合成氨,达到平衡时测得混合气体中NH 3 的体积分数为20%
把4 mol N 2 和8mol H 2 置于5L密闭容器中合成氨,达到平衡时测得混合气体中NH 3 的体积分数为20%,
求:
(1)混合气体中H 2 的体积分数;
(2)反应前后容器内的压强比;
(3)N 2 和H 2 的转化率。 softsdown1年前1
softsdown1年前1 -
 lailingzhi 共回答了15个问题
lailingzhi 共回答了15个问题 |采纳率80%1年前查看全部
- 在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A. v(H2)=0.1 mol•L-1•min-1
B. v(N2)=0.2 mol•L-1•min-1
C. v(NH3)=0.15 mol•L-1•min-1
D. v(H2)=0.3 mol•L-1•min-1 整齐画一1年前1
整齐画一1年前1 -
 梦龙hh 共回答了17个问题
梦龙hh 共回答了17个问题 |采纳率94.1%解题思路:利用速率之比等于化学计量数之比转化为用同一物质表示的速率,然后再进行比较.都转化为氢气表示的速率进行比较,对于N2+3H2⇌2NH3,
A、v(H2)=0.1 mol•L-1•min-1,
B、v(N2)=0.2 mol•L-1•min-1,速率之比等于化学计量数之比,故v(H2)=3v(N2)=0.6mol•L-1•min-1
C、v(NH3)=0.15 mol•L-1•min-1,速率之比等于化学计量数之比,故v(H2)=[3/2]v(N2)=[3/2]×0.15mol•L-1•min-1=0.225mol•L-1•min-1,
D、v(H2)=0.3mol•L-1•min-1,
故速率B>D>C>A,
故选B.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查反应速率快慢的比较,难度不大,注意比较常用方法有:1、归一法,即按速率之比等于化学计量数之比转化为用同一物质表示的速率,2、比值法,即由某物质表示的速率与该物质的化学计量数之比,比值越大,速率越快.1年前查看全部
- 把1LN2和3LH2放在一个密闭容器中合成氨,在一定温度下反应达到平衡,此时NH3在混合
把1LN2和3LH2放在一个密闭容器中合成氨,在一定温度下反应达到平衡,此时NH3在混合
求1 平衡是NH3的体积
2、平衡是N2的转化率
此时NH3在混合气体中的体积分数为12% wangji91001年前1
wangji91001年前1 -
 跳舞的鸡蛋 共回答了12个问题
跳舞的鸡蛋 共回答了12个问题 |采纳率91.7%设氮气到平衡时反应了X(L) 可以列出方程
2X/(1+3-4X+2X)=12%
计算可得X=3/14 平衡时NH3的体积 为3/7L
N2的转化率 为3/14 (21%)1年前查看全部
- 为什么合成氨工厂不用电解水的方法来制取氢气?
 lianglhs1年前1
lianglhs1年前1 -
 13600249925 共回答了14个问题
13600249925 共回答了14个问题 |采纳率85.7%成本高啊.电解水制备氢气只用于对氢气要求纯度很高的场合.1年前查看全部
- 1.一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,与反应前的体积相比,反应后体积缩小的百分率是
1.一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,与反应前的体积相比,反应后体积缩小的百分率是多少?
2.在一定条件下的密闭容器中,一定能说明A+3B=2C+2D反应达到平衡的是
A 反应体积总压恒定
B 反应体系的总质量不变
C c(A):c(B)=1:3
D 2v正(B)=3v逆(C)
3.直角三角形的两条直角边和为定值a(a>0),求此三角形的最大面积和取得最大面积时的斜边长.
(不一定要求出答案,只要把思路过程告诉我即可.感激不尽!) qawsedzxc1年前1
qawsedzxc1年前1 -
 hot865 共回答了21个问题
hot865 共回答了21个问题 |采纳率100%我只懂得数学.
法一:基本不等式法
设两直角边分别为m,n,则S=mn/2《(m+n)^/8=a^/8
当且仅当m=n=a/2时取得最大值为a^/8,此时,斜边长为a的平方除以根号2.
法二:函数法
令一直角边为x,则另一直角边为a-x
则S=x(a-x)/2=(-x^+ax)/2
面积式子中分子是一个开口向下的二次函数,则在对称轴取得最大值,即x=a/2时取得最大值,S的最大值为a^/8,此时斜边长为a的平方除以根号2.1年前查看全部
- 合成氨中,开始充入1mol氮气和2mol氢气,在一定条件下,反应达平衡,测得氨气占混合气体的25%,则平衡时氮气的转化率
合成氨中,开始充入1mol氮气和2mol氢气,在一定条件下,反应达平衡,测得氨气占混合气体的25%,则平衡时氮气的转化率是?
 泡泡xy1年前0
泡泡xy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 等效平衡与移动合成氨的反应如果已经达到平衡,然后再加1mol氨气,横容,若果按照浓度左移;要是压强,右移,那到底怎么移动
等效平衡与移动
合成氨的反应如果已经达到平衡,然后再加1mol氨气,横容,若果按照浓度左移;要是压强,右移,那到底怎么移动.
另外,加的反应物一瞬间是不是应该左移,但是平衡的 时候按照压强的话氨气应该增加,这是怎么样一个过程~求教 cjhssq1年前1
cjhssq1年前1 -
 我是晴 共回答了13个问题
我是晴 共回答了13个问题 |采纳率84.6%再加1mol氨气 恒容 左移 压强改变本质是改变浓度.
你加NH3 NH3肯定多了 平衡移动只是减弱改变 不能消除改变1年前查看全部
- 在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%,若反应前后条件保持不变,则反映后缩小的气体体积与
在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%,若反应前后条件保持不变,则反映后缩小的气体体积与原反应物体积的比值是
A 五分之一 B四分之一C三分之一D二分之一
本人对体积分数一窍不通TT
现在连方程式也忘了TT
求指教~ cwfeng1年前1
cwfeng1年前1 -
 了了的了了 共回答了22个问题
了了的了了 共回答了22个问题 |采纳率86.4%应该选A
过程
设N2的体积为x,H2的体积为y,
N2+3H2 = 2NH3
始 x y
变 n 3n 2n
平 x-n y-3n 2n
总体积是x+y-4n+2n=x+y-2n,依照题意,2n/(x+y-2n)=25%
可得,x+y=10n
所以总体积又可表示为:x+y-2n=x+y-1/5(x+y)=4/5(x+y)
所以缩小了五分之一
有不明白可以追问1年前查看全部
- 怎样提高工业合成氨的产率?
 juzi-liu1年前1
juzi-liu1年前1 -
 wanbulu 共回答了22个问题
wanbulu 共回答了22个问题 |采纳率95.5%增加反应物浓度,即时转移氨,降低氨浓度!1年前查看全部
- 工业制造硫酸、合成氨、高炉炼铁、海水提镁的化学方程式
 蓝天空wxx1年前1
蓝天空wxx1年前1 -
 无心无知 共回答了19个问题
无心无知 共回答了19个问题 |采纳率84.2%制硫酸:
2SO2+O2==2SO3 (可逆反应,条件:高温高压、催化剂)
SO3+H2O==H2SO4(实际操作时用98%的浓硫酸吸收SO3 )
合成氨:
N2+3H2==2NH3(可逆反应,条件:高温高压、催化剂)
高炉炼铁:(原料是焦炭和铁矿石)
C+O2==CO2 (条件:高温或点燃)
CO2+C==2CO (条件:高温)
3CO+Fe2O3==2Fe+3CO2(CO是主要的还原剂,条件:高温)
海水提镁:
MgSO4+2NaOH==Na2SO4+Mg(OH)2(富集,也有MgCl2反应)
Mg(OH)2==MgO+H2O(条件:加热)
2MgO==2Mg+O2(条件:电解)(也可以将MgO与HCl反应制成更纯净的MgCl2再电解)1年前查看全部
- 合成氨所需要的氢气可由水煤气反应制得,方程式:CO(g)+H2O(g) 可逆 CO2(g)+H2(g)+43KJ,能提高
合成氨所需要的氢气可由水煤气反应制得,方程式:CO(g)+H2O(g) 可逆 CO2(g)+H2(g)+43KJ,能提高CO转换率的是:增大水蒸气的浓度
为什么增大CO的浓度的不可以? guyu09071年前1
guyu09071年前1 -
 天使的翅膀x 共回答了25个问题
天使的翅膀x 共回答了25个问题 |采纳率88%因为条件是要提高CO的转化率,如果增大CO浓度 那么CO的转化率会减小(根据勒夏特列原理,虽然平衡会正向移动消耗一部分CO,但是CO的量还是会增多),水蒸气的转化率就增大
同理,加入水蒸气就能使CO转化率增大,同时水蒸气的转化率减小.
ps:CO的转化率=反应掉的CO浓度/反应前CO的浓度1年前查看全部
- 12、一定条件下,合成氨反应呈平衡状态:
12、一定条件下,合成氨反应呈平衡状态:
3H2 + N2 2NH3 ----- K1 32 H2 + 12 N2 NH3 ------ K2
则K1与K2的关系为:
A.K1 = K2 B.K22 = K1 C.K12 = K2 D.无法确定
13、在下面的电子结构中,第一电离能最小的原子可能是:
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
15、I2的CCl4溶液中分子间主要存在的作用力是:A
A.色散力 B.取向力
C.取向力.诱导力.色散力 D.氢键.诱导力.色散力
16、完全中和10升0.01mol•L-1 H2SO4需NaOH的物质的量为:
A.0.2mol B.2mol C.0.5mol D.0.4mol
二、判断题(正确的打“√”错误的打“×” ,1分/小题,
( )16、任一化学反应的速率方程,都可根据化学反应方程式写出.
( )17、氢键具有方向性和饱和性,因此氢键与共价键均属化学键.
( )18、 配离子的电荷数等于中心离子的电荷数.
( )19、F是电负性最大的元素,则HF是卤素无氧酸中,酸性最强的.
( F )20、H2O2只能做氧化还原反应的还原剂.
( F )21、H+为10 - 6 的酸溶液稀释1000倍,此时酸的溶液浓度为10 – 9 .
( )22、稀释HAC溶液后,电离度增大,酸性增大.
( )23、影响平衡移动的因素有:温度,浓度,压力和催化剂.
( F )24、酸性溶液中不存在OH-,碱性溶液中不存在H+ .
( )25、每个半反应中一定包括同一种元素的两种不同的氧化态.
26、对于元反应 A + 2 B Y ,已知A、B的浓度分别为C(A)、C(B),则反应速率为 = .当CA = 0.5mol•L-1,CB = 0.6mol•L-1时的反应速率为0.018 mol•L-1•min-1,该反应的速率常数k= ;若在一定条件下反应达到平衡时CA= 0.25mol•L-1,则可逆反应的平衡常数 = .
27、组成配位键的两个必要条件是 和 ,配合物中 和 之间是以配位键结合,和 之间则以离子键结合.
28、写出下列元素的外层电子构型:第四周期第ⅣB族 ;第五周期第ⅦA族 .
29、氧化还原反应中,氧化剂是E值较高电对中的 物种,还原剂是E值较低电对中的 物种.
30、K3 [Fe(CN)6]的中心离子是 ,配位数是 ,根据命名原则可命名为 .
31、化学反应必须遵守的两个基本定律是 量守衡定律 、 .
32、H2O2 在酸性条件下,分别与KMnO4和KI 作用,它所表现出的化学性质分别是 还原性 、 氧化性 .
33、试解释在标准状态下,三氯化铁溶液为什么可以溶解铜板?(4分)
已知:EΘFe3+/ Fe2+ = 0.77V ,EΘCu2+/ Cu = 0.337V
34、BF3分子构型是平面三角形,而NF3分子构型是三角锥形,试用杂化轨道理论解释.
35、向含有0.001mol•L-1 Br -和10.00 mol•L-1 Cl-的混合物溶液中,滴加AgNO3溶液(设溶液体积不改),哪种离子先沉淀出来?当第二种沉淀析出时,第一种离子的浓度是多少?
( KSPθAgBr = 5.0×10-13 KSPθAgCl = 1.8×10-10 )
36、在25℃时,Ca(OH)2的溶解度为0.15 g / 100gH2O,试计算饱和Ca(OH)2 溶液的pH是多少?
附:相对原子质量 Ca-40 H-1 O -16 对数:lg2 = 0.3010 (6分)
37、已知25℃时,某一元弱酸0.010mol•L-1溶液的pH为4.00,求:( 1 )该浓度下酸的离解度 ; ( 2 ) 该酸的 .(4分) wangtao86881年前2
wangtao86881年前2 -
 7071211 共回答了21个问题
7071211 共回答了21个问题 |采纳率90.5%自己做,才有用,不要利用网络找答案1年前查看全部
- 合成氨反应,恒容合成氨反应1.恒温恒容,通入氩气.平衡怎样移动.2.恒温恒压,通入氩气.平衡怎样移动.---------
合成氨反应,恒容
合成氨反应
1.恒温恒容,通入氩气.平衡怎样移动.
2.恒温恒压,通入氩气.平衡怎样移动.
---------------------------------------
我想的是,
1.恒容,通氩气,相当于压强增大,影响压强减小的方向移动.
2.恒压,通氩气,体积增大,各反应物浓度均减小,平衡不移动.
可是答案不是这样的.
为什么对反应物影响比生成物影响大 崇天1年前3
崇天1年前3 -
 再见依然 共回答了19个问题
再见依然 共回答了19个问题 |采纳率94.7%1.恒温恒压 通入惰性气体 虽然压力增加了 但是 反应物的浓度c=n/v不变~
2.恒温恒压,通入惰性气体,要维持恒压 必须膨胀体积 所以体积V增大 各物质浓度C=n/v 都变小了 反应物 生成物浓度都变小了 但是对反应物影响比生成物影响大 故向气体体积膨胀的方向移动 也就向左反应
N2+3H2====2NH3
大学三年级学化学的解答 因为大学还会分析大气压 体积 温度 对反应方向的影响 因为看这是高中化学题 就不详细解释了~平衡反应说到底在恒温恒压下对浓度的分析就可以知道方向1年前查看全部
- 合成氨的反应 两个恒温恒容容器 一个加1molN2 2molH2 一个加4molNH3第二个反应较第一个反应向那方向移动
合成氨的反应 两个恒温恒容容器 一个加1molN2 2molH2 一个加4molNH3第二个反应较第一个反应向那方向移动
答案是正反应方向移动因为增大压强 第二个反应浓度也增大了呀 应该向逆反应方向移动啊 到底应该看那一项 东山唐老鸦1年前1
东山唐老鸦1年前1 -
 boram 共回答了18个问题
boram 共回答了18个问题 |采纳率100%题目的问题应该理解为,第二个容器内达到平衡后,
相对 第一个容器内达到平衡后 ,反应的移动方向
第一个容器中
N2 + 3H2= 2NH3
1 3 2
1mol 2mol
第二个容器中
N2+ 3H2= 2NH3
1 3 2
2mol 6mol 4mol
将第二个容器中的4mol氨气折算成 氮气和氢气就是
2mol氮气和6mol氢气
两个容器是恒容的
第二个容器相对于第一个容器达到平衡状态后,
再加入1moN2和4moH2,从而增加了容器内的压强,同时也使得反应物的浓度升高,
所以平衡正向移动1年前查看全部
- 刚刚接触苏教版的高中化学,讲到选修四有一些问题,碘化氢的分解的熵变如何?工业合成氨的熵变如何?一个反应前后都是气体的,如
刚刚接触苏教版的高中化学,讲到选修四有一些问题,碘化氢的分解的熵变如何?工业合成氨的熵变如何?一个反应前后都是气体的,如何判断熵变呢?
 伸出舌头ee鼻子1年前1
伸出舌头ee鼻子1年前1 -
 iverjin 共回答了14个问题
iverjin 共回答了14个问题 |采纳率92.9%熵就是混乱度
同一物质,气态熵大于液态熵,液态熵大于固态熵 相同原子组成的分子中,分子中原子数目越多,熵值越大 相同元素的原子组成的分子中,分子量越大,熵值越大
碘化氢的分解固体变为气体自然是熵增加
1摩尔数增加的一般
2反映产生气体的△S>0
3气体的你可以简单的看摩尔数 反应前的大于反映后的 熵增加
后面这三条足以应对高中化学1年前查看全部
- 在合成氨的反应中,将等物质的量的氮气和氢气充入一密闭容器中,两分钟时间则得氨的平均反应速率为2MOL/(L*MIN),C
在合成氨的反应中,将等物质的量的氮气和氢气充入一密闭容器中,两分钟时间则得氨的平均反应速率为2MOL/(L*MIN),C(N2)=7MOL/L,求氢气的起始浓度为多少?
55/15 天翼之恋1年前4
天翼之恋1年前4 -
 zhd2911962 共回答了14个问题
zhd2911962 共回答了14个问题 |采纳率100%-----N2 + 3H2= 2NH3
开始 x x 0
反应 2 3*2=6 2*2=4
最后 x-2 x-6 4
根据N2的浓度,X-2=7,计算出X=9,则氢气的起始浓度为X=9MOL/L1年前查看全部
- 已知299K时,合成氨反应 N2 + 3H2 (可逆符号略)生成 2NH3 (反应物生成物都为气态) 反应热为-92.0
已知299K时,合成氨反应 N2 + 3H2 (可逆符号略)生成 2NH3 (反应物生成物都为气态) 反应热为-92.0KJ/mol 将此温度下的1mol N2 和 3mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失) :一定小于92.0 KJ
有人给出解释是:由于反应可逆所以1mol N2 和 3mol H2 放在一密闭容器中生成的NH3小于2mol.所以反应放热小于92.0 KJ
为什么在密闭容器里就不能完全反应了呢? johnnysangel1年前3
johnnysangel1年前3 -
 花思语 共回答了21个问题
花思语 共回答了21个问题 |采纳率90.5%热化学方程式是按照反应物完全反应所产生的热效应来表示的.
合成氨反应为可逆反应.
在一定条件下加入N2、H2开始反应,开始的一瞬间,正反应速率最大,逆反应速率为0.
刚开始一段时间,正反应速率大于逆反应速率,N2、H2浓度减少,NH3浓度增加,同时正反应速率减小,逆反应速率增大.
当正逆反应速率变化到相等时,N2、H2浓度将不再减少,NH3浓度也不再增加,反应达到平衡状态,反应物、生成物共存.
所以说只要条件不变,合成氨反应是进行不到底的,反应放出的热量当然就小于按完全反应表示的92.0kJ/mol了.1年前查看全部
- 根据合成氨的反应,增大压强能提高氨的生产率,所以在合成氨工业中在条件允许的情况下应尽量增大压强
根据合成氨的反应,增大压强能提高氨的生产率,所以在合成氨工业中在条件允许的情况下应尽量增大压强
这句话对吗 未来宝宝1年前1
未来宝宝1年前1 -
 天地_有用 共回答了24个问题
天地_有用 共回答了24个问题 |采纳率87.5%这要抓关键字眼“条件允许”了, 自己思考吧1年前查看全部
- 工业商利用合成氨进行人工固氮.反应原理?要化学方程式.
 天使爱ss1年前1
天使爱ss1年前1 -
 孤狼吼月 共回答了23个问题
孤狼吼月 共回答了23个问题 |采纳率69.6%目前主要是工业合成氨,即:N2十3H2=(高温高压催化剂)=2NH3.400-500du Fe催化剂
利用高温提供高能量,段N2的3键 H2单键,便可从新合成,新建.但是个可逆反应.理由就是NH键也会被高能量断开又变回N2的3键 H2单键.要控制好反应进度,得到最高效益.1年前查看全部
- (14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为: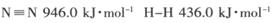
 ,
,
写出以N 2 和H 2 为原料合成NH 3 的热化学方程式________________________。
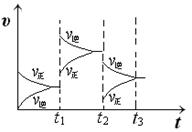
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t 1 时刻改变的条件为__________________。
②t 2 时刻,恒压充入氦气,t 3 时刻达到平衡。在图中画出t 2 时刻后的速率变化图像。
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图所示反应物,初始时控制活塞K使三者体积相等,一段时间后均达到平衡。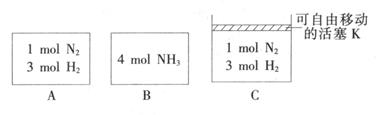
①达到平衡时,A、C两个容器中NH 3 的浓度分别为c l 、c 2 ,则c 1 ______c 2 (填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A),α(B),则α(A)+α(B)______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的3/4,则平衡时容器C中H 2 的体积分数为_______。
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH 3 +3O 2 =2N 2 +6H 2 O,则负极的电极反应式为__________________。 青石20071年前1
青石20071年前1 -
 方式完 共回答了18个问题
方式完 共回答了18个问题 |采纳率94.4%1年前查看全部
- 【化学】浓度对平衡的影响在合成氨反应中,请问若要增大正反应速率,是否可以增大氨气的浓度?
 绿快红台1年前4
绿快红台1年前4 -
 西月狂刀 共回答了16个问题
西月狂刀 共回答了16个问题 |采纳率100%请注意 只要增加物质(不论是反应物还是生成物)的浓度 反应速率均会增加 但平衡移动的方向不确定 若增加反应物浓度则正移 若增加生成物则逆移1年前查看全部
- 请问煤化工中的甲醇和合成氨生产流程有什么区别啊?
请问煤化工中的甲醇和合成氨生产流程有什么区别啊?
都是先煤气化》?然后合成氨或者甲醇?气化装置有不同吗?合成装置不一样? yzd10201年前1
yzd10201年前1 -
 dichangxie 共回答了20个问题
dichangxie 共回答了20个问题 |采纳率100%气化部分没什么区别,区别就是CO的去除,合成氨在变换开始就是尽量的降低CO的含量,增加H2的含量.可以说是全变换,而甲醇不是一般采用部分变换.一般为3部分,每一部分的变换程度不一样,主要根据甲醇洗后的CO2的含量来调节.合成氨有一氧化碳清除部分,也就是现在一般用的液氮洗,氨合成是要避免有CO的存在的.一般要求在10PPM一下.而甲醇合成的主要反应就是CO+H2,所以必须保留CO,用CO2来协助控制炉温.所以甲醇项目中没有CO脱出工序. 查看原帖>>
记得采纳啊1年前查看全部
- 化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是 A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁
化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是
A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁 C.硫酸厂用接触法生产硫酸 D.炼油厂用分馏法生产汽油  激活十二1年前1
激活十二1年前1 -
 dw284716363 共回答了16个问题
dw284716363 共回答了16个问题 |采纳率81.3%D
1年前查看全部
- 工业合成氨时使用催化剂条件为500摄氏度而不选择其他温度的原因是什么?
 zb199007211年前1
zb199007211年前1 -
 yxypc 共回答了16个问题
yxypc 共回答了16个问题 |采纳率93.8%N2 + 3H2 =高温高压= 2NH3
合成氨反应是可逆放热反应
温度的选择受所使用的催化剂决定
催化剂铁触媒在500摄氏度时的活性最大
所以合成氨反应一般选择在此温度下进行1年前查看全部
- 下列说法中不正确的是( ) A.氨气极易溶于水,所以它是农业上常用的氮肥 B.工业上用H 2 和N 2 合成氨与自然界
下列说法中不正确的是( ) A.氨气极易溶于水,所以它是农业上常用的氮肥 B.工业上用H 2 和N 2 合成氨与自然界中放电时O 2 和N 2 反应都属于氮的固定 C.大型中央空调的致冷剂可用液氨 D.铵盐易溶于水,且可与强碱发生复分解反应  相思雨潸然下1年前1
相思雨潸然下1年前1 -
 marriage60 共回答了20个问题
marriage60 共回答了20个问题 |采纳率90%A、氨气极易溶于水形成氨水,氨水以及铵盐是农业上常用的氮肥,而不是氨气,故A错误;
B、H 2 和N 2 合成氨以及自然界中放电时O 2 和N 2 反应生成一氧化氮的反应都是将氮的单质转化为含氮化合物的过程,属于氮的固定,故B正确;
C、因液氨易气化,吸收热量,则液氨可以做制冷剂,故C正确;
D、铵盐和强碱反应生成氨气,该反应属于复分解反应,故D正确.
故选A.1年前查看全部
- 怎么判断化学反应速率大小例如 A强酸强碱溶液的中和反应B不使用催化剂的合成氨反应C氢气还原氧化铜的反应
 龙太太CC1年前4
龙太太CC1年前4 -
 Aline1979 共回答了17个问题
Aline1979 共回答了17个问题 |采纳率94.1%1、气泡冒出的速率;2、溶液变浑浊的快慢;3、溶液变色的快慢等等.
总之,只要本来有现象的反应,看现象出来的快慢即可.
你说的一般情况下,1最快,2最慢,3居中
原因1、液体间比气固快,2不加催当然最慢
不可控因素太多,我还是坚持看现象
以下参考看吧外界条件对化学反应速率的影响
(1)纯液体和固体浓度视为常数,它们的量的改变不会影响化学反应速率.但颗粒的大小导致接触面积的大小发生变化,故影响反应速率.
(2)固体、液体物质,由于压强改变时对它们的体积影响很小,因而压强对它们浓度的影响可看作不变,压强对无气体参加的化学反应的速率无影响.
(3)升高温度,不论吸热反应还是放热反应,也不论是正反应速率还是逆反应速率都增大.
(4)对于有气体参加的化学反应,有以下几种情况:
①恒温时:压缩反应体系的体积导致引起压强增大,进而导致引起反应物浓度增大,从而引起反应速率加快.
②恒温时,对于恒容密闭容器:
a.充入气体反应物导致引起气体反应物浓度增大(压强也增大),从而引起反应速率加快.
b.充入“惰性”气体导致引起气体总压强增大,但气体反应物的浓度没有改变,从而反应速率不变.
③恒温恒压时:充入“惰性”气体导致引起反应体系的体积增大,进而引起气体反应物浓度减小,从而引起反应速率减小.
(5)在其他条件相同时,使用催化剂,化学反应速率加快.
(6)另外光波、电磁波、超声波、溶剂等也能影响化学反应速率.1年前查看全部
- 2.合成氨工业中原料气的脱硫需要如何控制工艺条件?(
 晓风残月28881年前1
晓风残月28881年前1 -
 1230cui 共回答了21个问题
1230cui 共回答了21个问题 |采纳率85.7%脱硫液相的温度,从脱硫塔进气就开始控制了,一般取35度以下.
各塔的液位当然也要控制好,防止跑气.
控制好脱硫液循环量和煤气量的定值范围.
还有就是每天分析脱硫液的成分.包括副盐含量和PH等.1年前查看全部
- 一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数是百分之20,
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数是百分之20,
与反应前的体积相比,反应后体积缩小的百分率是?(请给出解释,) 走进你的天堂1年前1
走进你的天堂1年前1 -
 Jamiro 共回答了20个问题
Jamiro 共回答了20个问题 |采纳率90%设反应前N2和H2混合气体的体积为V,参加反应的混合气体体积为V'生成氨气的体积为X,平衡时气体体积为Y
N2+3H2====2NH3--
1+3=4-------2
V’-----------x
x==V'/2
平衡时气体总体积为:Y===V-V'+X==V-V'+V'/2=V-V'/2
又:X/Y=20%.即:(V'/2)/(V-V'/2)==20%,得3V'=V
Y==V-V'/2=V-V/6=5V/6
反应后混合气体体积缩小的百分率为:(V-Y)/V=(V-5V/6)/V=1/6*100%1年前查看全部
- 合成氨反应转化率计算通入H2,N2混合密度为0.38g/L(S,P,T),出来的混合气密度是氢气的5倍,求氢气转化率.我
合成氨反应转化率计算
通入H2,N2混合密度为0.38g/L(S,P,T),出来的混合气密度是氢气的5倍,求氢气转化率.
我可以求出反应后混合气的平均分子质量是10,有人说通过0.38可以算出反应前两反应物物质的量之比为1: 风行牛仔1年前1
风行牛仔1年前1 -
 gupiao778 共回答了17个问题
gupiao778 共回答了17个问题 |采纳率100%设N2为V1,H2为V2,则p混合密度=(V1*28/22.4g+V2*2/22.4g)/(V1+V2)=0.3819.488*V1=6.512V2V1/V2=1/3 则 应前两反应物物质的量之比为1:3设参加反应的N2为V,H2的密度为pp=2*V2/22.4*V2=1/11.23H2+N2==2NH3根据质量守...1年前查看全部
- 在一定温度下,将N2、H2按体积比1:3投料,合成氨反应达到平衡时,混合气体中氨气所占体积分数为25%,若反应条件前后保
在一定温度下,将N2、H2按体积比1:3投料,合成氨反应达到平衡时,混合气体中氨气所占体积分数为25%,若反应条件前后保持不变,则平衡时缩小的气体体积与原反应物气体体积的比为:
A.1/5 B.1/4 C.1/3 D.1/2
怎么做的?
 欧盛cc1年前1
欧盛cc1年前1 -
 黑裙子-- 共回答了33个问题
黑裙子-- 共回答了33个问题 |采纳率97%设原来投入了N2是1,H2是3
N2反应了x,则H2减少了3x,生成NH3 2x
余下N2 1-x
H2 3-3x
NH3 2X
总共是4-2x
则0.25(4-2x)=2x
则x=0.4
所以减少的量是2x=0.8
比例是0.8:4=1:5
选A1年前查看全部
- 合成氨反应N2(g)+3H2(g)==2NH3(g) 可视为理想气体反应,平衡后加入惰性气体,且保持体系温度总压不变,则
合成氨反应N2(g)+3H2(g)==2NH3(g) 可视为理想气体反应,平衡后加入惰性气体,且保持体系温度总压不变,则压力商Jp值___
变大还变小还不变啊?请说明原因.我觉得是变小...因为v(B)=2-3-1=-2,因为是负的.所以平衡方向朝反应物那里动.所以Jp的分母会变大.Jp就变小了.
应该就是活度商Q zhenxiqi1年前4
zhenxiqi1年前4 -
 冰峰李 共回答了14个问题
冰峰李 共回答了14个问题 |采纳率92.9%是体积不变的容器吗?是的话当让是变大了,勒夏特列原理只是减弱这种变化,而不是抵消.1年前查看全部
- 化学反应的限度:合成氨对反应N2+3H2≒2NH3,将N2和H2以体积比为1:3通入合成塔,当反应达到平衡后,氨的体积分
化学反应的限度:合成氨
对反应N2+3H2≒2NH3,将N2和H2以体积比为1:3通入合成塔,当反应达到平衡后,氨的体积分数为16%,则平衡混合气体中N2的体积分数为多少?H2的转化率为多少.这个题的思路是什么,要设未知数吗?是不是体积比就是物质的量之比? 昏睡de小笨鸟1年前1
昏睡de小笨鸟1年前1 -
 亚洲称霸郑秀文 共回答了17个问题
亚洲称霸郑秀文 共回答了17个问题 |采纳率100%NH3 0.16
反应了的N2 0.08
原来是0.25
现在0.25-0.08=0.17
H2反应了0.24
原来是0.75
转化率0.24/0.75=0.32
同温同压时,气体物质的量的比等于体积的比
这个题应为投放的反应物的物质的量与系数相等,不存在过量问题,按照系数之比计算就可以了1年前查看全部
- (1)25℃时,合成氨反应的热化学方程式为:
(1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是______92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是______.
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率[2/3]v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3•H2O的电离平衡常数为______.向此溶液中加入少量的氯化铵固体,此时
值将______(填“增大”,“减小”或“不变”).c(N
)H +4c(OH−)
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=______时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33) CCAXLZ1年前1
CCAXLZ1年前1 -
 亲1切 共回答了16个问题
亲1切 共回答了16个问题 |采纳率87.5%解题思路:(1)①根据合成氨的反应为可逆反应,反应物不可能完全转化成生成物判断该反应放出的热量;
②根据可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不变进行判断;
(2)根据氨水电离生成等量的铵根离子和氢氧根离子,求出平衡时各离子的浓度,在利用电离平衡常数的表达式计算出NH3•H2O的电离平衡常数;
(3)根据Ksp[Al(OH)3]=1.0×10-33求出氢氧根离子浓度.(1)①由N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol可知,生成2mol氨气放出92.4kJ热量;l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,由于可逆反应不可能完全转化,所以生成氨气的物质的量小于2mol,放出的热量小于92.4kJ,
故答案为:小于;
②A.NH3生成的速率与NH3分解的速率相等,表明正逆反应速率相等,达到了平衡状态,故A正确;
B.混合气体的反应速率[2/3]v正(NH3)=v逆(H2),表示的是正逆反应速率,但是不满足化学计量数关系,所以正逆反应速率不相等,没有达到平衡状态,故B错误;
C.容器内的密度不再变化,该反应两边都是气体,气体的质量不变,反应中容器的容积不变,根据ρ=[m/V]可知,密度在反应过程中始终不变,所以密度不能作为判断平衡状态的依据,故C错误;
D.单位时间内消耗a mol N2,同时生成2a mol NH3,表示的都是正反应速率,无法判断正逆反应速率是否相等,故D错误;
故选A;
(2)氨水溶液PH=11,则c(H+)═10-11 mol•L-1,c(0H-)═10-3mol•L-1,
NH3•H2O⇌NH4++OH-
起始(mol•L-1) 0.1 00
反应(mol•L-1)-)10-3 10-3 10-3
平衡(mol•L-1) 0.1 10-3 10-3
NH3•H2O的电离平衡常数为:
10−3×10−3
0.1=1.0×10-5;
向此溶液中加入少量的氯化铵固体,溶液中铵离子浓度增大,氨水的电离程度减小,所以氢氧根离子浓度减小,此时
c(N
H+4)
c(OH−)值将增大,
故答案为:10-5; 增大;
(3)0.001mol/LAlCl3溶液中铝离子浓度为0.001mol/L,带人Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3可得:c(OH-)=1.0×10-10mol/L,常温下,氢离子浓度为:1.0×10-4mol/L,溶液pH=4,
故答案为:4.点评:
本题考点: 化学平衡状态的判断;化学反应的可逆性;化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了化学平衡状态判断、可逆反应特点、化学平衡常数的计算等知识,本题难度中等,试题涉及的知识点较多,注意掌握化学平衡状态的判断方法、化学反应的可能性,电离平衡常数的计算方法.1年前查看全部
- 合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如下:
合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如下: 
(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为______.
(2)制取氢气的反应过程为:C+H 2 O
CO+H 2 .上述化学方程式中表现氧化性的物质是______(填化学式).高温 .
(3)写出N 2 、H 2 反应生成NH 3 的化学方程式______,属于______反应.(填“化合反应”或“分解反应”)
(4)将沸点不同的气体分离开来,常采用液化分离法.如,控制温度在-183℃时,可将空气中N 2 与O 2 分离.根据下表中物质的沸点判断,要将产物NH 3 与N 2 、H 2 分离开来,最适宜的温度应该控制在______℃.物质 H 2 N 2 O 2 NH 3 沸点 -252℃ -195.8℃ -183℃ -33.35℃  信息垃圾筒1年前1
信息垃圾筒1年前1 -
 瓶中的绿箩 共回答了20个问题
瓶中的绿箩 共回答了20个问题 |采纳率100%(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为78%;故答案为:78%;
(2)水在上述两个化学方程式中,提供氧元素,表现为氧化性;化学式为:H 2 O
(3)氮气和氢气在有催化剂和高温高压的条件下生成氨气,方程式为:N 2 +3H 2
催化剂
.
高温高压 2NH 3 ,该反应的反应物是两种而生成物是一种,所以是化合反应;
(4)根据表中物质的沸点判断,要将产物NH 3 与N 2 、H 2 分离开来,最适宜的温度应该控制在-33.35℃;
故答案为:(1)78%;(2)H 2 O;(3)N 2 +3H 2
催化剂
.
高温高压 2NH 3 ;化合;(4)-33.35.1年前查看全部
- 下列说法中正确的是( )A.硫酸工业、合成氨工业、玻璃工业中都涉及氧化还原反应B.因氨水对许多金属有腐蚀作用,所以氨水
下列说法中正确的是( )
A.硫酸工业、合成氨工业、玻璃工业中都涉及氧化还原反应
B.因氨水对许多金属有腐蚀作用,所以氨水不能用金属容器盛装
C.一般合金的硬度比各成分金属要高,多数合金的熔点也比成分金属要高
D.在氧气参加的任何发光、发热的剧烈的化学反应才能称之为燃烧 韬武1年前1
韬武1年前1 -
 羔羊不迷途 共回答了20个问题
羔羊不迷途 共回答了20个问题 |采纳率90%解题思路:A.凡是有化合价升降的反应为氧化还原反应;
B.氨水腐蚀金属;
C.合金的硬度大熔点低;
D.燃烧是一种发光、发热的剧烈的化学反应.A.普通玻璃工业中不涉及氧化还原反应,故A错误;
B.氨能够与金属离子反应生成络合离子,从而腐蚀金属,故B正确;
C.合金的熔点比组成它的各成分的熔点都低,故C错误;
D.燃烧是一种发光、发热的剧烈的化学反应,不一定有氧气参与,故D错误.
故选B.点评:
本题考点: 金属与合金在性能上的主要差异;工业制取硫酸;工业合成氨;氨的化学性质.
考点点评: 本题考查氧化还原反应、金属腐蚀、合金和燃烧,题目难度不大,注意燃烧不一定有氧气参与.1年前查看全部
- 下列工业上制备物质的过程中,无氧化还原反应发生的是 A.合成氨 B.从铝土矿中获得铝 C.玻璃制备 D.从海水中获得氯气
 bluelong1年前1
bluelong1年前1 -
 柠檬水88 共回答了18个问题
柠檬水88 共回答了18个问题 |采纳率83.3%C
A 用氮气和氢气反应合成氨气,有化合价变化,是氧化还原反应
B从铝土矿中获得铝,铝元素由+3价变为0价,是氧化还原反应
C玻璃制备是硅酸钠和二氧化硅反应,硅酸钙和二氧化硅反应,不是氧化还原反应
D从海水中获得氯气是电解饱和的食盐水,有化合价变化,是氧化还原反应
故选C。1年前查看全部
- 一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
A. 16.7%
B. 20.0%
C. 80.0%
D. 83.3% wjun751年前1
wjun751年前1 -
 从不oo人 共回答了17个问题
从不oo人 共回答了17个问题 |采纳率88.2%解题思路:根据合成氨的化学反应可知氨气的体积等于反应中缩小的气体体积,然后再利用气体缩小的体积与原气体体积来计算反应后体积缩小的百分率.由合成氨的化学反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,
设平衡时气体总体积为100L,则氨气为100L×20%=20L,
气体缩小的体积为x,则
N2+3H2⇌2NH3△V
1 3 2 2
20L x
[2/20L=
2
x],解得x=20L,
原混合气体的体积为100L+20L=120L,
反应后体积缩小的百分率为[20L/120L]×100%=16.7%,
故选:A.点评:
本题考点: 数据缺省型的计算.
考点点评: 本题考查缺省数据的计算,学生应学会假设有关的计算数据及利用气体体积差来进行化学反应方程式的计算即可解答.1年前查看全部
- 已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)⇌2NH3(g)△H=-92.0KJ•mol-1,将1mol
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)⇌2NH3(g)△H=-92.0KJ•mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%.若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是______(填“吸收”或“放出”)______kJ热量.
 chunbmw1年前1
chunbmw1年前1 -
 msb98117 共回答了13个问题
msb98117 共回答了13个问题 |采纳率92.3%解题思路:已知合成氨反应:N2(g)+3H2(g)⇌2NH3(g);△H=-92.0KJ•mol-1,则有2NH3(g)⇌N2(g)+3H2(g);△H=+92.0KJ•mol-1,保持恒温恒压,将1mol N2和3mol H2充入一密闭容器中与起始时在该容器中充入2mol NH3,为等效平衡状态,平衡时两种不同的途径平衡状态相同,各物质的含量、物质的量等都相同,以此计算.N2(g)+3H2(g)⇌2NH3(g)△H=-92.0KJ•mol-1起始:1mol 3mol 0转化:0.2mol 0.6mol 0.4mol平衡:0.8mol 2.4mol&nb...
点评:
本题考点: 有关反应热的计算;化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度中等,解答本题的关键是判断两种途径为等效平衡状态,注意等效平衡的特征.1年前查看全部
- 高中物理:下列事实不能用勒夏特列原理解释的是 ( ) A.合成氨工业采用高温和催化剂等条件
高中物理:下列事实不能用勒夏特列原理解释的是 ( ) A.合成氨工业采用高温和催化剂等条件
下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业采用高温和催化剂等条件
B.H2.I2.HI混合气体加热后颜色变深
C.合成氨时尽可能增大体系压强
D.打开汽水瓶,看到大量的气泡逸出
标准答案是 A.这与网上的答案不同.请您向详细解释其中的道理.谢谢.
是高中化学 tuna_lover1年前1
tuna_lover1年前1 -
 NoRoomintheArk 共回答了18个问题
NoRoomintheArk 共回答了18个问题 |采纳率88.9%合成氨是一个放热反应,按照勒夏特列原理,降低温度有利于提高氨气产率.实际工业中取高温是为了最大发挥催化剂的活性.且催化剂不影响化学平衡,所以本题选A1年前查看全部
- 为什么在实际生产合成氨过程要分离出氨气
 萧闽清1年前1
萧闽清1年前1 -
 雾里的泪 共回答了27个问题
雾里的泪 共回答了27个问题 |采纳率92.6%N2 + 3 H2 = 2 NH3
这是一个可逆反应.及时分离出产物NH3,降低了生成物浓度,能促进平衡向正反应方向移动.
提高产率和原料的利用率1年前查看全部
- 氮气和氢气混合气体在一定条件下合成氨时体积减少6L,则生成氨气的体积为?
 品位男儿1年前2
品位男儿1年前2 -
 小白_1010 共回答了20个问题
小白_1010 共回答了20个问题 |采纳率95%6L,用差量法计算.
N2+3H22NH3 △V
1 3 2 2(1+3-2)
V 6L
V=6L1年前查看全部
- 将8mol氢气和2mol氮气充入2升密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6
将8mol氢气和2mol氮气充入2升密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6mol氢气,求NH3的体积分数
 了拂尘1年前1
了拂尘1年前1 -
 fengxueyi 共回答了25个问题
fengxueyi 共回答了25个问题 |采纳率92%3H2 + N2=====2NH3
起:8 2 0
变:2.4 0.8 1.6
平:5.6 1.2 1.6
1.6/(5.6+1.2+1.6)=19%1年前查看全部
- 下列有关说法,错误的是( ) A.氮氧化物、二氧化硫都是形成酸雨的主要物质 B.工业合成氨及用NH 3 制化肥(NH
下列有关说法,错误的是()
A.氮氧化物、二氧化硫都是形成酸雨的主要物质 B.工业合成氨及用NH 3 制化肥(NH 4 ) 2 SO 4 都属于氮的固定 C.一定条件下,镁能与一些非金属氧化物反应,铝能与一些金属氧化物反应 D.玻璃中含有硅酸钠和二氧化硅  阳光喜悦1年前1
阳光喜悦1年前1 -
 iudanshaner 共回答了21个问题
iudanshaner 共回答了21个问题 |采纳率100%B
氮的单质生成氮的化合物的反应,才是氮的固定,用NH 3 制化肥(NH 4 ) 2 SO 4 不属于氮的固定。1年前查看全部
- 下列说法正确的是( )A. 在合成氨反应中,相同条件下有催化剂时(a)和无催化剂时(b)速率时间图象可用图1表示B.
下列说法正确的是( )

A. 在合成氨反应中,相同条件下有催化剂时(a)和无催化剂时(b)速率时间图象可用图1表示
B. 已知:A+H2O⇌B+C两份初始浓度不同的A溶液得到c(A)随时间变化如图2.由图可以充分说明A的水解反应速率随温度升高而增大
C. 图3表示合成氨反应在其他条件不变的情况下,改变n(H2)起始对平衡的影响.由此可知,N2的转化率最高的是b点
D. 用0.1000 mol/L NaOH溶液分别滴定浓度相同的两种一元酸①和②,由图4曲线可确定酸性:②强于① 诸葛火逍遥1年前1
诸葛火逍遥1年前1 -
 逸然930 共回答了23个问题
逸然930 共回答了23个问题 |采纳率91.3%解题思路:A.加入催化剂,反应速率增大;
B.应在浓度相同的条件下比较;
C.氮气的转化率最大的是c;
D.浓度相同的两种一元酸①和②,pH越小,酸的电离程度越大.A.加入催化剂,反应速率增大,a、b的反应速率不等,故A错误;
B.比较温度对反应速率的影响,应在同浓度下比较,否则不具有可比性,故B错误;
C.增大氢气的浓度,平衡向正向移动,氢气的起始量越大,氮气的转化率越大,故C错误;
D.浓度相同的两种一元酸①和②,pH越小,酸的电离程度越大,故D正确.
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;化学反应速率的影响因素;化学平衡的影响因素.
考点点评: 本题考查较为综合,涉及化学反应速率的影响、平衡移动以及酸碱混合的定性判断等知识,为高考常见题型,侧重于学生的分析能力的考查,难度中等,注意相关基础知识的积累.1年前查看全部
- 合成氨流程中为什么先分氨和后分氨都可采用
 hkz4i1年前1
hkz4i1年前1 -
 ayaowe 共回答了20个问题
ayaowe 共回答了20个问题 |采纳率95%合成氨的反应是个可逆变化,不管先后,将氨分离了,反应气中的氨浓度就降低了,就更有利于氢和氮向合成为氨进行反应.因此,分离氨有利于反应效率的提高.1年前查看全部
- 5.24-化学1/ 20.在氮气、氢气合成氨的合成塔中,进入的N2和H2体积比为1:3,
5.24-化学1/ 20.在氮气、氢气合成氨的合成塔中,进入的N2和H2体积比为1:3,
塔中起始压强为1.67* 10^7 Pa ,又知从塔中出来的气体中,NH3占25%(体积分数).求:
(1)合成塔中出来的混合气体中,N2和H2的体积分数.
(2)反应达到平衡时,合成塔中混合气体的总压强.
我第一题做出来1:3,第二题3.24*10^7 Pa .感觉不对. 星月681年前1
星月681年前1 -
 藏一手80 共回答了26个问题
藏一手80 共回答了26个问题 |采纳率88.5%第一个问题:
N2+3H2=2NH3
开始时,1:3:0
反映了,X:3X,生成了2X
剩余1-X:3-3X:2X
最后2X占了25%
所以列方程:2X/(4-2X)=0.25
解得X=0.4
则N2体积分数=(1-0.4)/(4-2*0.4)=18.75%
H2的体积分数=(3-1.2)/(4-2*0.4)=56.25%
(验算,0.25+0.1875+0.5625=1,答案正确)
第二个问题:
压强和气体在容器中物质的量有关
1.67*10^7/x=(1+3)/(0.6+1.8+0.8)
解得x=1.336*10^61年前查看全部
大家在问
- 1如何分辨英语中的过去式与现在完成时
- 2【英语完形填空题】英语高手来一、Fill in the blanks with the words or express
- 3they are wonderful actors!要变成带what的感叹句怎么变?
- 4高级脂肪酸钠 是 肥皂的主要成分?
- 5You got to put the past behind you before you can move on.这是
- 6在矩形ABCD中,AB=12cm,BC=6cm.E延边AB从A以2cm/s的速度向B移动,F延边DA从D以1cm/s的速
- 7请问为什么会有连续和不连续的?
- 8一桶水,第一次用去5分之3千克,第二次用去10分之9千克,这时还剩下这桶水的2分之1。这水原来重多少千克?
- 9一个数分别与14和16相乘,积的和1200,这个数
- 10对不起,我不爱你(大结局) 作文
- 11一个直角三角形的三条边分别为3厘米、4厘米、5厘米,沿它的一条直角边为轴旋转一周,可得什么图形?体积最小是多少?体积最大
- 12文学是情感的宣泄,情感可用情感书写.以“沙漠中的蒲公英”为主题,文体不限.
- 13判断下列句子使用了哪种修辞手法。
- 14若2分之x+y=3分之y+z=5分之x+z 且x+y+z=18 求x,y,z的值
- 15在三角形abc中,角A小于等于角B小于等于角C,且2角B=5角A,求角B的取值范围