将0.05molso2(g)和0.03molo2(g)放入1L容器中,反应2So2(g)+O2(g)=2SO2(g),经
 24lou2022-10-04 11:39:542条回答
24lou2022-10-04 11:39:542条回答注:要过程全都要啊!

已提交,审核后显示!提交回复
共2条回复
 fghfhfgjhgnn 共回答了22个问题
fghfhfgjhgnn 共回答了22个问题 |采纳率86.4%- 2SO2 + O2 = 2SO3
初:0.05 0.03 0
反应:0.04 0.02 0.04
末:0.01 0.01 0.04
u(SO3)=0.04/30=0.0013 mol/s
u(SO2)=0.04/30=0.0013 mol/s
u(O2)=0.02/30=0.0006 mol/s
SO2转化率:(0.02/0.03)*100%=66.67% - 1年前
 Kim_11 共回答了5个问题
Kim_11 共回答了5个问题 |采纳率- 首先,题目打错了,应是2SO3
速率等于浓度变化量除以时间但对于各个物质的反应速率又不一样,所以
V(SO3)=0.04/30 mol/(L.s)=0.0013mol/(L.s)
根据方程的比例,
V(SO2)=V(SO3)=0.0013mol/(L.s)
V(O2)=1/2V(SO3)=0.00065mol/(L.s)
SO... - 1年前
相关推荐
- 标准状况下,1molSO2的体积约为22.4L?
 深蓝81年前2
深蓝81年前2 -
 paul7211 共回答了23个问题
paul7211 共回答了23个问题 |采纳率91.3%对的
标况下,气体的摩尔体积约为22.4L(包括混合气体,纯净的气体)
在一定的温度,压强下,气体的摩尔体积是确定的.1年前查看全部
- 化学平衡状态实验室用4molSO2与2molO2进行下列反应.2SO2+O2=2SO3 △H=--196.64kj/mo
化学平衡状态
实验室用4molSO2与2molO2进行下列反应.
2SO2+O2=2SO3 △H=--196.64kj/mol
当放出314.624kj/mol热量时,SO2的转化率约为? Ling12211年前1
Ling12211年前1 -
 cdm777216 共回答了21个问题
cdm777216 共回答了21个问题 |采纳率90.5%放出314.624kj/mol热量时生成SO2约3.2mol,SO2的转化率约为3.2/4=80%1年前查看全部
- 1molSO2和1molSO3具有相同的①分子数 ②原子数 ③S原子数
1molSO2和1molSO3具有相同的①分子数②原子数③S原子数④O原子数( )
A. ①②
B. ①③
C. ①④
D. ②④ 茶水酒水1年前1
茶水酒水1年前1 -
 cctv116 共回答了19个问题
cctv116 共回答了19个问题 |采纳率94.7%解题思路:①根据N=nNA判断.
②每个SO2分子含有3个原子,每个 SO3分子含有4个原子,计算原子的物质的量,根据N=nNA计算判断.
③每个SO2分子含有1个硫原子,每个 SO3分子含有1个硫原子,根据N=nNA计算判断.
④每个SO2分子含有2个氧原子,每个 SO3分子含有3个氧原子,计算氧原子的物质的量,根据N=nNA计算判断.①根据N=nNA可知,物质的量相同分子数目相同,1molSO2和1molSO3都含有NA分子,故①正确;
②每个SO2分子含有3个原子,1molSO2含有的原子物质的量为3mol,每个 SO3分子含有4个原子,1molSO3含有的原子物质的量为4mol,1molSO2和1molSO3含有原子的物质的量之比为3:4,所以原子数目之比为3:4,故②错误;
③每个SO2分子含有1个硫原子,每个 SO3分子含有1个硫原子,1molSO2和1molSO3都含有1mol硫原子,含有硫原子数目相同,故③正确;
④每个SO2分子含有2个氧原子,1molSO2含有的氧原子物质的量为2mol,每个 SO3分子含有3个氧原子,1molSO3含有的氧原子物质的量为3mol,1molSO2和1molSO3含有氧原子的物质的量之比为2:3,所以氧原子数目之比为2:3,故④错误;
所以①③一定相等.
故选:B.点评:
本题考点: 阿伏加德罗常数.
考点点评: 考查化学常用计量有关计算,难度不大,注意三氧化硫标准状况下为固体,通常情况下为液体.1年前查看全部
- 把1molso2和1molo2放在2l密闭容器中反应,测得2min后氧化产物是0.2mol,请问氧化产物是指全部so3吗
把1molso2和1molo2放在2l密闭容器中反应,测得2min后氧化产物是0.2mol,请问氧化产物是指全部so3吗,还是一部分的啊因为它也是还原产物,所以反应物的速率是?
 _晴天飘雨_1年前1
_晴天飘雨_1年前1 -
 琥珀1010 共回答了11个问题
琥珀1010 共回答了11个问题 |采纳率100%氧化产物指的是反应达到化学平衡时SO3的量,反应速率(2SO2+O2=SO3)所以0.4mol的SO2反应后会生成0.2mol的SO3,又反应时间是2分钟,反应容器为2L,反应速率就是0.4/2/2=0.1mol/L/min1年前查看全部
- 等效平衡的问题同样等温等压条件下,一个容器中加入2molSO2和1molO2,一个容器中加入2molSO3和1molHe
等效平衡的问题
同样等温等压条件下,一个容器中加入2molSO2和1molO2,一个容器中加入2molSO3和1molHe,请问这两个平衡等效吗? netcmq1年前1
netcmq1年前1 -
 joy-ce 共回答了15个问题
joy-ce 共回答了15个问题 |采纳率80%不等效,因为在同温同压下,加入了1MOL的He.会让体积增大,而SO3的物质浓度就减小了.还有不懂的再问.1年前查看全部
- 1.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)→2SO
1.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)→2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是: A、保持温度和容器不变,充入1mol SO3(g) B、保持温度和容器内压强不变,充入1mol SO3(g) C、保持温度和容器内压强不变.充入1molSO2(g) D、保持温度和容器内压强不变,充入1molAr(g)答案是B 解释一下C为什么不对,B为什么对. 2.某温度在一容积可变的容器中反应2A(g)+B(g)→2C(g)达平衡时,A、B、C物质的量分别为4mol、2mol、4mol,保持温度和压强不变,对平衡混合物三者的物质的量做如下调整,可使平衡向右移动的是 A、均减半 B、均加倍 C、均增加1mol D、均减少1mol答案是C,
 回首05191年前3
回首05191年前3 -
 天空i 共回答了15个问题
天空i 共回答了15个问题 |采纳率93.3%(1)因为反应前后的体积是会变的,所以保持压强充入三氧化硫,会造成体积改变,不能单用等效平衡来看.(2)这道题可以用K来解,假设第一次平衡时体积为1L,之后的体积都可以用PV=nRT来解,让后和第一次的K比,小则向右移动.我算了一下按我的假设C选项的K值应该是1.3/3小于第一次的0.5.望采纳~1年前查看全部
- 标准状况下,1molSO2和SO3的混合物所占的体积是22.4L 标准情况下22.4L的任何气体的物质的量都是1mol
标准状况下,1molSO2和SO3的混合物所占的体积是22.4L 标准情况下22.4L的任何气体的物质的量都是1mol
两句话哪个对?
另一个是怎么错的? 莱博瑞1年前1
莱博瑞1年前1 -
 开心无边 共回答了16个问题
开心无边 共回答了16个问题 |采纳率93.8%标准状况下,1molSO2和SO3的混合物所占的体积是22.4L
此话错!因为SO3在标况下不是气体(是固体),所以体积小于22.4L
标准情况下22.4L的任何气体的物质的量都是1mol
此话对!1年前查看全部
- 一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)⇌2SO3(g),进行
一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)⇌2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到前2min末时,容器中n(SO2)为( )
A. 1.6mol
B. 1.2mol
C. 大于1.6mol
D. 小于1.2mol 翠羽黄衫1年前1
翠羽黄衫1年前1 -
 浓茶小罐 共回答了14个问题
浓茶小罐 共回答了14个问题 |采纳率92.9%解题思路:依据化学反应速率的概念进行分析计算,并注意浓度越大,反应速率越大来解答.根据化学反应速率的概念可知,进行到4min时,测得n (SO2)=0.4mol,此时反应的速率为V(SO2)=
(2−0.4)mol
2L
4min=0.2mol/L•min;反应进行到前2min末时设二氧化硫物质的量为x,依据速率定义可得V′(SO2)=
(2−x)mol
2L
2min;进行到2min时的物质浓度大于4min时的物质的浓度,所以反应时4min的反应速率小于2min的反应速率,即V′(SO2)=
(2−x)mol
2L
2min>0.2mol/L•min;整理得,x<1.2mol;
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学反应速率的概念应用,化学反应速率的影响因素,主要是浓度对速率的影响判断.1年前查看全部
- 一定条件下,可发生反应2so2+o2可逆反应生成2so3,现取4molso2和2molo2混合,
一定条件下,可发生反应2so2+o2可逆反应生成2so3,现取4molso2和2molo2混合,
反应应物与生成物体积之比为1:2,求(1)so2的转化率 (2)平衡混合气体中so3的物质的量分数 seagull19871年前1
seagull19871年前1 -
 linacc 共回答了21个问题
linacc 共回答了21个问题 |采纳率95.2%2SO2+O2=2SO3 设反应生成的SO3为n mol.则此时反应体系中各物质的量分别为
4-n 2-n/2 n
由反应物与生成物体积比为1/2可得(4-n+2-n/2)/n=1/2 (反应物与生成物均为气体,此时体积比既为物质的量比)
解得n=4
则此时n(SO2)=0 ;n(O2)=2;n(SO3)=4
可得SO2的转化率为100%;SO3的物质的量分数=4/(4+2)=66.7%1年前查看全部
- 一定温度下,向一带活塞体积为2L的容器中充2molSO2和1molO2,达到平衡后体积变为1.6L则SO2转化率是?
一定温度下,向一带活塞体积为2L的容器中充2molSO2和1molO2,达到平衡后体积变为1.6L则SO2转化率是?
答案=60%,求详解过称 ju7y1年前2
ju7y1年前2 -
 止若冰 共回答了20个问题
止若冰 共回答了20个问题 |采纳率95%解设平衡时混合气体的总物质的量为X,设反应的SO2的物质的量为Y
根据体积比等于物质的量之比得2L:1L=(2mol+1mol):X
解得X=2.4mol
反应减少的物质的量为3mol+1mol-2.4mol=0.6mol
2SO2+O2=(可逆)2SO3 减少的物质的量
2 1 2 1
Y 0.6mol
2:1=Y:0.6mol
解得Y=1.2mol
SO2转化率是1.2mol/2mol*100%=60%
答SO2转化率是60%1年前查看全部
- 在2L的容器中充入4molSO2和2molO2 反应;2SO2+O2=2SO3反应2min后、测的容器中有1.6molS
在2L的容器中充入4molSO2和2molO2 反应;2SO2+O2=2SO3反应2min后、测的容器中有1.6molSO2 问(1)2min末SO
问(1)2min末SO3的物质的量 (2)2min内SO2的平均反应速率 (3)2min末SO2的转化率 hhIVY1年前1
hhIVY1年前1 -
 jsprepc 共回答了18个问题
jsprepc 共回答了18个问题 |采纳率88.9%n变SO2=4-1.6=2.4mol
c变so2 =2.4/2=1.2mol/L
c变so2 :c变so3=2:2 c变so3=1.2mol/L
vso2=c变so2 /t =1.2/2=0.6mol/(L*min)1年前查看全部
- 向恒温恒容(2L)的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2+O2=2SO2,进行到4min后达到平
向恒温恒容(2L)的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2+O2=2SO2,进行到4min后达到平衡,这时C(SO2)=0.2molL,且二氧化硫和氧气转化率相等,在向容器中冲入1molSO3,达到心平衡,为什么二氧化硫和氧气物质的量的比为二比一?
 爱你没有永远1年前2
爱你没有永远1年前2 -
 钓鱼台7块钱一包 共回答了27个问题
钓鱼台7块钱一包 共回答了27个问题 |采纳率92.6%2SO2 + O2= 2SO3
开始(mol/L) 1.0 x 0
转化(mol/L) 0.8 0.4 0.8
平衡(mol/L) 0.2 x-0.4 0.8
因为二氧化硫和氧气转化率相等,而SO2的转化率为(0.8/1.0)=80%.所以O2的转化率为(0.4/x)=80%.解方程0.4/x=80%,解得X=0.5mol/L.但由于容器的体积为2L,所以O2的物质的量为1mol.因此SO2:O2=2:11年前查看全部
- 化学反应速率和平衡问题1、在容积相同的A、B两个容器中,分别充入2molSO2和2molO2,使它们在相同温度下发生反应
化学反应速率和平衡问题
1、在容积相同的A、B两个容器中,分别充入2molSO2和2molO2,使它们在相同温度下发生反应,2SO2(g)+O2(g)=2SO3(可逆反应)并达到平衡,在反应过程中,若A容器的体积不变,B容器的压强不变,A中SO2的转化率为a%,B中的转化率为b%,则a与b的关系为什么是a vncldd01年前2
vncldd01年前2 -
 hahadada1 共回答了14个问题
hahadada1 共回答了14个问题 |采纳率92.9%1:A体积不变 该正反应体积是减少的 故 压强降低抑制正反应
B压强不变 反应体积减少 压强不变 正反应增加 故b>a
2:50% 减少 0.5MOL 减少的就是B反应的 故A反应1MOL
3:kc=2.6是什么 好久没用化学 不懂1年前查看全部
- 在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,下列反应:
在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,下列反应:
2SO2(g)+O2(g)=2so3(g)
达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A保持温度和容器体积不变,充入1molSO2(g)
B保持温度和容器内压强不变,充入1molSO3(g)
C保持温度和容器内压强不变,充入1molO2(g)
D保持温度和容器内压强不变,充入1molAr(g) 游蜂儿1年前3
游蜂儿1年前3 -
 ll和qq 共回答了19个问题
ll和qq 共回答了19个问题 |采纳率89.5%等效平衡问题,选择B
恒温恒容时,平衡等效要求投料相等,A错误
恒温恒压时,平衡等效要求投料比相当,B正确,C错误
充入惰性气体时,恒压相当于减压,平衡会向做移动,浓度不等,D错误1年前查看全部
- 2so2+o2=2so3 带活塞的密闭容器中,加入2molso2,1molo2,达到平衡后,改变条件,平衡浓度不变的是A
2so2+o2=2so3
带活塞的密闭容器中,加入2molso2,1molo2,达到平衡后,改变条件,平衡浓度不变的是
A温度体积不变,加入1mol so3
B温度压强不变 加入1mol so3
c温度压强不变 加入1mol o2
D温度压强不变 加入1mol ar(g)
但我不明白A怎么判断,体积不变,加入生成物,生成物浓度变大,向逆向移动,但体积不变,压强变大了,向正向体积减小的方向移动,那怎么判断向哪个方向移动呢?
so3平衡浓度不变 心佛和陶妖1年前1
心佛和陶妖1年前1 -
 nelson1000 共回答了13个问题
nelson1000 共回答了13个问题 |采纳率92.3%因为加入1mol so3引起的生成物浓度变化而导致化学平衡方程式的移动远小于由压强变化导致的化学方程式的移动变化~所以A判断为向正向体积减小的方向移动~1年前查看全部
- 高中化学等效平衡问题在一定温度下,容积相同的两个密闭容器中,一个充入2molSO2,1molO2,另一个充入2molSO
高中化学等效平衡问题
在一定温度下,容积相同的两个密闭容器中,一个充入2molSO2,1molO2,另一个充入2molSO3,发生反应2SO3+O2=2SO3;△H=-196.6KJ/mol时,下列六种说法正确的有
①二氧化硫的转化率与三氧化硫的分解率之和为1
②达到平衡所需的时间相等
③密度相等
④压强相等
⑤放出与吸收的热量相等
⑥二氧化硫的浓度相等
答案是①②④⑥求解释,④和⑥没懂啊
不是说什么反应进行的程度不确定吗?那两种情况下二氧化硫的浓度怎么会相等呢? ylin1181年前3
ylin1181年前3 -
 luxiaolei123 共回答了15个问题
luxiaolei123 共回答了15个问题 |采纳率93.3%单看反应 2SO3 + O2 = 2SO3
第一种投料 2mol 1mol 0mol
第二种 0mol 0mol 2mol
可知这两种为等效平衡.(这个应该知道吧?)
所以这两种投料达到的平衡的结果是一样的,看起来相同.
即这两种容器内各物质的百分含量相同.所以不管是SO2、O2还是SO3它们的物质的量均相同.所以总压强相同 so2浓度也一定想通了.
是反应进行的程度不确定.但是这两个投料最后达到的是同一种平衡(始态终态法.考虑最后就可以了)1年前查看全部
- 在一个温度恒定的密闭容器中,SO2和O2发生反应.已知1molSO2和足量O2完全反应,放出的热量为Q.请按要求回答下列
在一个温度恒定的密闭容器中,SO2和O2发生反应.已知1molSO2和足量O2完全反应,放出的热量为Q.请按要求回答下列问题.
[恒压条件下]
(1)若开始时放入1molSO2和0.5molO2,达平衡后,生成0.9molSO3,这时SO2的转化率为________________;
(2)若开始时放入 和 达平衡后,生成 的物质的量为________,反应放出的热量为_____________.
[恒容条件下]
(3)若开始时放入 和 ,达平衡后,生成amol ,则a______0.9(填“>”、“ 天枯oip1年前1
天枯oip1年前1 -
 shendan69 共回答了19个问题
shendan69 共回答了19个问题 |采纳率94.7%(1)0.9/1=90%
(2)你的这一问不全
(3)相当于把恒压条件改成恒容,体积变大,压强变小,平衡向左移动,a1年前查看全部
- 保持温度不变,向2L容积固定的密闭容器中充入2molSO2和1molO2.已知2SO2+O2==2SO3,放热akj/m
保持温度不变,向2L容积固定的密闭容器中充入2molSO2和1molO2.已知2SO2+O2==2SO3,放热akj/mol(a>0)
经2min达到平衡状态,反应放热0.25akj.下列判断正确的是( )
B.2min内,v(SO2)=0.25mol/(L.min)
C.若再充入2molSO3,达平衡时SO3的体积分数减小
D.反应条件相同,若起始时向上述反应容器中充入2molSO3,平衡时反应吸热0.25akj
答案上说B项中v(SO2)=0.125mol/(L.min),还有D中应该吸热0.75akj.不懂这些数是如何算出的.
回答呢?怎么没看到. 030332631年前1
030332631年前1 -
 lvufaraway 共回答了21个问题
lvufaraway 共回答了21个问题 |采纳率90.5%有反应式可知 当消耗2mol二氧化硫时放热akj 而现在放出0.25kj热 则消耗二氧化硫0.5mol 浓度变化为0.25mol/l 因此速率为0.25/2=0.25mol/(l.min).D项中,这是一个完全等效平衡,从两个方向进行放热(或吸热)之和为焓变的绝对值,因此吸热为(a-0.25a)kj 即0.75akj,这是一个定理经常用要记住的.1年前查看全部
- (2009•广州二模)在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)
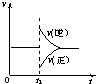 (2009•广州二模)在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图.下列对t1时刻改变条件的推断中正确的是( )
(2009•广州二模)在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图.下列对t1时刻改变条件的推断中正确的是( )
A.保持压强不变,升高反应温度
B.保持温度不变,增大容器体积
C.保持温度和容器体积不变,充入1molSO3(g)
D.保持温度和压强不变,充入1molSO3(g) 纵横天下NO11年前1
纵横天下NO11年前1 -
 老李广 共回答了16个问题
老李广 共回答了16个问题 |采纳率100%解题思路:A、升高温度,正逆反应速率都增大,化学平衡向吸热反应方向移动.
B、减小压强,正逆反应速率都减小,化学平衡向气体体积增大的方向移动.
C、保持温度和容器体积不变,充入1molSO3(g)的瞬间,生成物的浓度增大,反应物的浓度不变,根据浓度对化学反应速率的影响分析.
D、保持温度和压强不变,充入1molSO3(g)的瞬间,容器的体积增大,导致生成物的浓度增大,反应物的浓度减小,根据浓度对反应速率的影响分析.A、该反应是放热反应,升高温度,正逆反应速率都增大,正逆反应速率曲线都在原直线上方,逆反应速率增大倍数大于正反应速率增大的倍数,导致平衡向逆反应方向移动,故A错误.
B、保持温度不变,增大容器体积,导致容器内减小压强,正逆反应速率都减小,即正逆反应速率曲线都在原直线的下方,正反应速率减小的倍数大于逆反应速率减小的倍数,导致平衡向逆反应方向移动,故B错误.
C、保持温度和容器体积不变,充入1molSO3(g)的瞬间,三氧化硫的浓度增大,二氧化硫和氧气的浓度不变,所以逆反应速率大于正反应速率,所以正反应速率与原速率有接触点,故C错误.
D、保持温度和压强不变,充入1molSO3(g)的瞬间,容器的体积增大,导致生成物的浓度增大,反应物的浓度减小,逆反应速率大于正反应速率,平衡向逆反应方向移动,故D正确.
故选D.点评:
本题考点: 化学反应速率与化学平衡图象的综合应用.
考点点评: 本题考查了外界条件对化学反应速率和平衡的影响,难度较大,明确浓度变化引起化学反应速率变化是解本题的关键.1年前查看全部
- 一定的温度下向2L容积不变的密闭容器中通入2molSO2和2molO2,发生反应:2SO2(g)+O2 (g)
一定的温度下向2L容积不变的密闭容器中通入2molSO2和2molO2,发生反应:2SO2(g)+O2 (g)⇌2SO3(g);5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1)反应5min内,v(O2)=______mol.L-1.min-1.
(2)化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为______;此时,容器中 c(O2)=______,压强是起始时的______倍.
(3)判断该反应达到平衡的标志是______;
A.2v消耗(SO2)=v生成(O2 )B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变D.容器中气体的总物质的量不再变化
E.容器内压强不再变化F.反应2mol SO2同时生成2mol O2. flyhawk101年前2
flyhawk101年前2 -
 28806860 共回答了20个问题
28806860 共回答了20个问题 |采纳率90%解题思路:(1)可以先求三氧化硫的速率,再利用速率之比等于对应物质的化学计量数之比计算;
(2)应用三行式求化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为,氧气的浓度,平衡时混合物的总的物质的量,从而得到压强是起始的倍数;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.(1)v(SO3)=
1.6mol
2L
5min=0.16mol/(L.min),所以反应5min内,v(O2)=
v(SO3)
2=0.08mol.L-1.min-1,故答案为:0.08mol.L-1.min-1;
(2)2SO2(g)+O2 (g)⇌2SO3(g)
初起 2mol 2mol0
变化1.6mol0.8mol 1.6mol
平衡0.4mol1.2mol1.6mol
所以SO2消耗的浓度占起始浓度的百分比为
1.6mol
2mol×100%=80%;此时,容器中 c(O2)=
1.2mol
2L=0.6 mol.L-1,压强是起始时的
0.4mol+ 1.2mol+1.6mol
2mol+2mol×100%=80%,
故答案为:80%;0.6 mol.L-1;0.8;
(3)A.2v消耗(SO2)=4v消耗(O2)=v生成(O2 ),正逆反应速度不等,故不选;
B.混合气体的平均相对分子质量不再改变,说明总物质的量不变,正逆反应速度相等,故选;
C.混合气体的密度不再改变,一直不变,故不选;
D.容器中气体的总物质的量不再变化,说明各组分的物质的量不变,故选;
E.容器内压强不再变化,说明各组分的物质的量不变,故选;
F.反应2mol SO2等效于反应1mol O2,同时生成2mol O2,正逆反应速度不等,故不选;
故选BDE.点评:
本题考点: 化学平衡状态的判断;反应速率的定量表示方法.
考点点评: 本题考查了化学反应速率和化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.1年前查看全部
- 转化率题目实验室用4molso2与2molo2进行下列反应:2so2+o2生成2so3 △H=-Q当放出1.6QKJ热量
转化率题目
实验室用4molso2与2molo2进行下列反应:2so2+o2生成2so3 △H=-Q
当放出1.6QKJ热量时,SO2的转化率为
谢谢请我具体的过程 yt_wuxbing1年前1
yt_wuxbing1年前1 -
 黑猫一按即射 共回答了23个问题
黑猫一按即射 共回答了23个问题 |采纳率91.3%80%
so2+o2=so3完全反应是放热-Q
现在放1.6Q
应放2Q
1.6/2=80%1年前查看全部
- 化学平衡2so2+O2=2SO2(加入1molso2、0.5mol o2)把so2和o2极值归0后,为什么加...
化学平衡2so2+O2=2SO2(加入1molso2、0.5mol o2)把so2和o2极值归0后,为什么加...
化学平衡2so2+O2=2SO2(加入1molso2、0.5mol o2)把so2和o2极值归0后,为什么加入1molSO2与0.5mol o2相当于1mol so3(为什么不是2mol) riqi0411年前2
riqi0411年前2 -
 北斗导航 共回答了19个问题
北斗导航 共回答了19个问题 |采纳率94.7%题目打错了吧!是不是应该是:2SO+2O2=2SO3吧?若是这样,从化学式的比例中可以看出,2摩尔的二氧化硫和1摩尔的氧气反应生成2摩尔的三氧化硫,是2:1:2的关系!所以当左边化学式的东西完全反应后,生成的东西——三氧化硫——也应该服从这个比例!现在题目中的量相当于1:0.5:1.所以是生成1摩尔的二氧化硫,不是两摩尔!1年前查看全部
- 2so2+o2==2so3 H=-196千焦/mol 开始时在100L的密闭容器中,加入4molso2,和10mol的o
2so2+o2==2so3 H=-196千焦/mol 开始时在100L的密闭容器中,加入4molso2,和10mol的o2 当反应达到平衡时,共放出热量196kj .此时反应掉的so2是多少mol?答案是2mol,可是燃烧热(我查了,说高中阶段燃烧热和标准燃烧热一样)的定义不是1mol该反应物放出的热吗 为什么不是1mol ,还是说不是燃烧热而是反应热?有什么区别?
 下雨了8681年前1
下雨了8681年前1 -
 cfkslqm123 共回答了18个问题
cfkslqm123 共回答了18个问题 |采纳率88.9%同学,你定义搞混了.ΔH是焓变,即反应热;而燃烧热是一种特殊条件下(也就是你说的1mol,还有完全燃烧生成稳定产物)的反应热.这个题和燃烧热没有半点关系.
(话说我也高3了,不过这题怎么看也不像是高三的……)1年前查看全部
- 在容积相同的甲(体积不变),乙(压强不变)两个密闭容器中,分别充入2molSO2和1molO2,平衡所用时哪个长
在容积相同的甲(体积不变),乙(压强不变)两个密闭容器中,分别充入2molSO2和1molO2,平衡所用时哪个长
为什么?
温度相同的。 kkhh551年前2
kkhh551年前2 -
 ypyuyu 共回答了17个问题
ypyuyu 共回答了17个问题 |采纳率76.5%甲温度升高,平衡所用时短;乙体积增加,平衡用时长.
虽然初始温度相同,但是充入气体之后就不同了.甲体积不变,充入气体后必然压力增加温度上升.乙压强不变,充入气体之后必然体积膨胀.1年前查看全部
- 有A、B两只密闭容器,A容器有1个移动的活赛,能使容器内保持恒压.B容器能保持恒容,起始时间A容器中充入2molSO2、
有A、B两只密闭容器,A容器有1个移动的活赛,能使容器内保持恒压.B容器能保持恒容,起始时间A容器中充入2molSO2、1molO2,并使AB容积都为1L,在保持400摄氏度的条件下,发生2S02+02====2SO3的可逆反应,平衡时,A容器的体积为0.8L.问:
当AB两容器连通后,打开开关使互通一段时间后又重新达平衡时,A容器的体积为多少?(设连通管内气体体积不变) weiqiansou1年前2
weiqiansou1年前2 -
 dimitar 共回答了23个问题
dimitar 共回答了23个问题 |采纳率95.7%利用化学平衡和等效平衡来解~
首先2S02+02====2SO3 反应为体积减小的反应.
A、B中开始时都是2molSO2、1molO2,所以不管它们过程中怎么反应,里面的物质都可以看作是2molSO2、1molO2,所以,当你把A、B联通(假设这是C容器)时,相当于在一个恒压的容器中充入了4molSO2、2molO2,而A也是一个恒压容器,温度又相同,所以A与C是一个等效平衡~
因此:C容器在反应达到平衡时的体积(即A与B总体积)为A的2倍,即1.6L,而B的体积恒定为1L,所以A最终体积为0.6L1年前查看全部
- 1L0.1MOI/L的NAOH溶液吸收0.08MOLSO2,求所得溶液中溶质的成分及物质的量
 renyisnow1年前1
renyisnow1年前1 -
 mumudingyi 共回答了17个问题
mumudingyi 共回答了17个问题 |采纳率88.2%阳离子:Na离子0.1M,
SO3离子0.08M
所以H离子0.06M
溶质NaSO3 0.02M NaHSO3 0.06M1年前查看全部
- 在容积相同的甲乙两容器中分别充入2molSO2和1molO2
在容积相同的甲乙两容器中分别充入2molSO2和1molO2
发生可逆反应,甲容器体积不变,乙容器压强不变
【压强不变和体积不变在化学可逆反应的平衡中分别意味着什么?】 淡水轩1年前1
淡水轩1年前1 -
 88768275 共回答了18个问题
88768275 共回答了18个问题 |采纳率100%压强不变就是体积可变
体积不变就是压强可变1年前查看全部
- 在一个容积为2L的密闭容器中,充入1molSO2和O2,一定条件下发生反应,2SO2+O2=(可逆)2SO2
在一个容积为2L的密闭容器中,充入1molSO2和O2,一定条件下发生反应,2SO2+O2=(可逆)2SO2
2分钟后测得SO2的物质的量为0.6mol,则用SO2和O2表示化学反应的速率分别是__________、_______________________,二者的关系是_______ juzi12171年前4
juzi12171年前4 -
 liuersanyi 共回答了16个问题
liuersanyi 共回答了16个问题 |采纳率87.5%你好像写错了吧!SO3!用so2 v1=((1-0.6)/2)/2 mol/L.min=0.1mol/L.min 同理o2 v2=0.05mol/L.min.!关系v1=2v2!1年前查看全部
- 一定温度下,把4molSO2和xmolO2放入10L容器中,当反应达到平衡时,测得平衡时压强是原压强的0.75倍,容器中
一定温度下,把4molSO2和xmolO2放入10L容器中,当反应达到平衡时,测得平衡时压强是原压强的0.75倍,容器中还剩余0.5molO2.试求x的值和SO2的转化率.
 adegrgr1年前2
adegrgr1年前2 -
 沙湾大盘鸡 共回答了22个问题
沙湾大盘鸡 共回答了22个问题 |采纳率90.9%2SO2 + O2 =2SO3,根据pV=nRT,反应前后V、R、T都不变,所以反应平衡后压强变为原来0.75,物质的量也变为原来0.75倍,即0.75*(4+x)mol;根据反应方程式,2mol SO2 加上 1mol的 O2 生成2mol的SO3,δn=1mol,即每反应1mol氧气,总物质的量减小1mol,减小的摩尔量=反应掉的氧气的摩尔量,反应的O2物质的量为0.25*(4+x)mol.则x=0.5+0.25*(4+x),得出x=2mol,反应的氧气=1.5mol.反应的SO2=3mol,转化率=3/4=75%1年前查看全部
- 在一固定容积的密闭容器中充入2molSO2和1molO2,在t°C时发生反应:2SO2(g)+O2(g)==2SO3(g
在一固定容积的密闭容器中充入2molSO2和1molO2,在t°C时发生反应:2SO2(g)+O2(g)==2SO3(g)
2min后反应达到平衡状态,此时O2转化率为90%,则反应前后的压强之比为 zuoyunyima1年前2
zuoyunyima1年前2 -
 sethchow 共回答了16个问题
sethchow 共回答了16个问题 |采纳率87.5%10:7
压强之比等于物质的量之比.
O2反应掉的物质的量是1*90%=0.9mol
2SO2(g)+O2(g)2SO3(g)
化学计量数 2 1 2
起始 2 1 0
变化 1.8 0.9 1.8
平衡 0.2 0.1 1.8
反应前的物质的量的和是2+1=3mol
反应后的物质的量的和是0.2+0.1+1.8=2.1mol
压强之比等于物质的量之比,是3:2.1=10:7.1年前查看全部
- 在一定温度下的2L密闭容器中充入0.4molSO2和0.2molO2发生反应若温度不变,在容器中再加1molO2.重新达
在一定温度下的2L密闭容器中充入0.4molSO2和0.2molO2发生反应若温度不变,在容器中再加1molO2.重新达到平衡,则氧气的转化率为什么降低,SO3的体积分数如何证明减小(不通过计算)
 zhould1年前1
zhould1年前1 -
 huanlingxl 共回答了23个问题
huanlingxl 共回答了23个问题 |采纳率87%其实,有个公认的定理,叫做:在一个可逆反应中,添加某一种反应物的量,其他所有反应物的转化率的升高,被添加的转化率就降低,记住这个定理解题可以快很多.
现在来解释一下:温度不变的情况下,添加O2,反应向右进行,但是SO2的量已经不多,所以能反应的O2也少了.先举一例帮助理解.
例(数字的单位都是mol) :
10 SO2和 10 O2 反应后剩下 5 SO2 和 4 O2 .
添加10 O2 ,可以将反应 分成两份 分别都是5 SO2 和 10O2
反应后剩下的O2肯定大于4(因为SO2量减少),而SO2经过两次反应当然剩下少于5.
所以O2的转化率就减小了,SO2的转化率就增大了.
SO3的体积分数减小是因为,增加的氧气中,反应的比消耗的多,也就是说剩余的O2多余新生成的SO3,而容器体积不变,所以SO3的体积分数减小.1年前查看全部
- 化学双选题析一定条件下,想一带活塞的密闭容器中充入2molSO2和1mol O2,发生以下反应(可逆)2SO2(g)+O
化学双选题析
一定条件下,想一带活塞的密闭容器中充入2molSO2和1mol O2,发生以下反应(可逆)
2SO2(g)+O2(g)——SO3(g)到达平衡后,改变下列条件,SO3平衡浓度不变的是
1、保持温度和容器压强不变,充入1molSO3(g)
2、保持温度和容器体积不变,充入1molAr(g)
两项都是正确答案,请为我解析这题 534292581年前1
534292581年前1 -
 涂墙壁的鱼 共回答了18个问题
涂墙壁的鱼 共回答了18个问题 |采纳率88.9%1.这个问题应该这么看待:影响平衡的条件有什么?温度和压强.这里都没有变化,因此,平衡本身不会移动,因此各组分的平衡浓度也不会改变
2.充入惰性气体,各反应气体的分压并没有改变.知道压强的公式吗?克拉伯龙方程pV=nRT,充入惰性气体,反应气体的所有参数都没有变化,因此压强也不会改变,平衡也不会移动,平衡浓度也不会改变1年前查看全部
- 在一定条件下,在一密闭容器中,充入1molSO3气体,平衡后压强增大了20%.若在等体积容器中充入1molSO2和1mo
在一定条件下,在一密闭容器中,充入1molSO3气体,平衡后压强增大了20%.若在等体积容器中充入1molSO2和1molO2,则相同条件下平衡后SO2的转化率可能是
A.等于40% B大于60% guoxh1年前1
guoxh1年前1 -
 helen726 共回答了15个问题
helen726 共回答了15个问题 |采纳率93.3%根据PV=nRT可知,在恒温恒容时气体压强与物质的量成正比,所以压强增大了20%就是指气体物质的量增大了20%,即平衡时气体总量为1.2mol
2SO3=2SO2+O2 气体物质的量增加
2 2 1 1
(0.4mol) (0.4molL) 0.2mol 0.2mol
可以计算出平衡时SO21年前查看全部
- 开始在10L的密闭容器内加入4molso2和5molO2.当反应达到平衡时共放出热量196kj,求平衡常数
 tdm9977121年前2
tdm9977121年前2 -
 嘎嘎佳 共回答了19个问题
嘎嘎佳 共回答了19个问题 |采纳率89.5%是不是你的条件没给足?...
要做的话,先查表得到 SO2与O2 反应的反应热H,这样才能做这道题.
由196/H(查表得到),得到反应的物质的量n,由K=[SO3]^2/[SO2]^2 x [O2] =n^2/(4-n)^2 X (5-n)
这样答案就出来了.
PS:反应热在化学书上就能找到,嫌麻烦的话,在网上搜一下应该也有.1年前查看全部
- 下列说法正确的是( )A.18gH2O中含有2mol氢B.1molSO3比1molSO2多一个氧原子C.1mol任何物
下列说法正确的是( )
A.18gH2O中含有2mol氢
B.1molSO3比1molSO2多一个氧原子
C.1mol任何物质都含有约6.02×1023个原子
D.1molO3中约含有1.806×1024个氧原子 油油的招摇1年前1
油油的招摇1年前1 -
 chen9408 共回答了14个问题
chen9408 共回答了14个问题 |采纳率100%解题思路:A、依据物质的质量与物质的量之间的转换关系分析解答;B、依据物质的量的含义分析解答即可;C、依据物质的量的含义分析解答;D、根据臭氧分子的结构分析解答即可;A、依据物质的质量与物质的量之间的转换关系可知18gH2O的物质的量是[18g/18g/mol]=1mol,所以含有2mol的氢原子;
B、依据物质的量的含义可知1molSO3含有的氧原子3mol;1molSO2含有的氧原子2mol,所以1molSO3比1molSO2多一摩尔氧原子比1mol;
C、物质的量的含义可知1mol任何物质都含有约6.02×1023个该物质的微粒;
D、臭氧分子的结构可知1molO3中约含有6.02×1023×3=1.806×1024个氧原子;
故选D点评:
本题考点: 有关化学式的计算和推断.
考点点评: 此题是对物质的质量与物质的量的考查,解题的关键是掌握两者之间的转化关系和1mol任何物质都含有约6.02×1023个该物质的微粒;1年前查看全部
- 求详解在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2=2SO3,
求详解
在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2=2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态.现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2、SO3的物质的量.如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同.请填写下列空白:
(1)若a=0,b=0,则c=----.(2)若a=0.5,则b=----和c=----.(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a 和c,另一个只含b和c):---------------------.
第三问 不懂 a+c=2 或者 b+c/2=1 求 .. 心如大醉吴淞月1年前1
心如大醉吴淞月1年前1 -
 mini659 共回答了13个问题
mini659 共回答了13个问题 |采纳率84.6%2SO2+O2=2SO3
2molSO2和1molO2通入一个一定容积的密闭容器里,平衡了
现通入amolSO2和bmolO2和cmolSO3
我可以假设SO3是平衡移动到某个阶段生成的
那么我通(a+c)molSO2和(b+0.5c)molO2,平衡也不改变
即a+c=2,b+0.5c=11年前查看全部
- 2.把3molSO2和2molO2通到一个固定容积的密闭容器中,发生如下反应:
2.把3molSO2和2molO2通到一个固定容积的密闭容器中,发生如下反应:
2SO2(g)+O2(g) 2SO3(g),当此反应进行到一定程度时,反应混合物就处于化学平衡状态.保持温度体积不变,令a,b,c分别代表初始加入的SO2,O2和SO3的物质的量(mol),若a,b,c取不同的数值,它们必须满足一定的相互关系,才能使其达到平衡时,反应混合物中三种气体的百分含量仍与上述平衡时完全相同,请填写下列空白:
若a=0,则b=________,c=____________;
若a=1,则b=________,c=____________;
a,b,c数值之间应满足的关系,请用两个方程式表示,一个只含a和c____________________;另一个只含b和c__________________. 诗溪散人1年前1
诗溪散人1年前1 -
 datouyuan 共回答了20个问题
datouyuan 共回答了20个问题 |采纳率100%是有关等效平衡的题目
此反应为恒温恒容的题目,只有一模一样的投量才等等效平衡,所以
1)B=0.5,C=1.5
2)B=1 C=2
3)a+c=2 ,2b+c=21年前查看全部
- ..对你们来说很简单某状态下将1molO2、2molSO2和1molSO3的混合气体压入装有V2O5的密闭容器中平衡时测
..对你们来说很简单
某状态下将1molO2、2molSO2和1molSO3的混合气体压入装有V2O5的密闭容器中平衡时测得混合气体对H2的相对密度为28.5求:①反应前混合气体的平均分子量②平衡混合气体的平均分子量③根据上述计算结果,写出原混合气发生反应的化学方程式④求反应的转化率.
.. 维城1年前1
维城1年前1 -
 薇风倩影 共回答了24个问题
薇风倩影 共回答了24个问题 |采纳率91.7%①反应前混合气体的平均分子量
32*1/4+64*2/4+80*1/4=60
②平衡混合气体的平均分子量
混合气体的相对分子质量=28.5*2=57
③根据上述计算结果,写出原混合气发生反应的化学方程式
2SO3?2SO2+O2
④求反应的转化率
----2SO3?2SO2+O2
起始1------2-----1
转化X------X----x/2
平衡1-X----2+X---1+X/2
总物质的量=1-X+2+X+1+X/2=4+X/2
则有:
80*(1-X)/(4+X/2)+64*(2+X)/(4+X/2)+32*(1+X/2)/(4+X/2)=57
X=0.42mol
反应的转化率=0.42/1=42%1年前查看全部
- 将0.05molso2(g)和0.03molo2(g)放入1L容器中,反应2So2(g)+O2(g)=2SO2(g),经
将0.05molso2(g)和0.03molo2(g)放入1L容器中,反应2So2(g)+O2(g)=2SO2(g),经30秒后在一定的条件下达到平衡
将0.05molso2(g)和0.03molo2(g)放入1L容器中,反应2So2(g)+O2(g)=2SO2(g),在一定的条件下达到平衡,测得c(SO3)=0.04mol/L.则该条件下反应的平衡常数为? 香冰玫瑰1年前1
香冰玫瑰1年前1 -
 loumingjie 共回答了15个问题
loumingjie 共回答了15个问题 |采纳率73.3%.2SO2(g) + O2(g) = 2SO3(g)
起始 / mol·L-1 0.05 0,03 0
平衡 / mol·L-1 0.01 0,01 0.04
Kc = c(SO3)^2 / c(SO2)^2 c(O2)
= 0.04^2 / 0.01^3 = 1600
根据题目已知条件,只能计算出浓度平衡常数Kc.
对于气相反应,更常用的是压力平衡常数Kp :
Kp = p(SO3)^2 / p(SO2)^2 p(O2)
由 p(B)V = n(B)RT 得:
p(B) = c(B)RT,代入 Kp 表达式,得:
Kp = [c(SO3)RT]^2 / [c(SO2)RT]^2 [c(O2)RT]
= Kc / RT
代入 Kc、R、T(题目中缺少温度数据),即可计算出 Kp 值.1年前查看全部
- 已知2SO2+O2=2SO3 H=-197KJ/MOL 同温下,往相同体积的密闭容器甲、乙中分别充入2MOLSO2、1M
已知2SO2+O2=2SO3 H=-197KJ/MOL 同温下,往相同体积的密闭容器甲、乙中分别充入2MOLSO2、1MOLO2和1MOLSO2 1MOLSO3 0.5MOLO2,当他们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是:A Q2=1/2Q1=98.5 BQ2=1/2Q1<98.5 CQ2<1/2Q1<98.5 D1/2Q1<Q2<98.5 会的请解决下 说明判断依据
这反应不是等效平衡么 那么平衡时各物质百分含量不是都一样的么 为什么还会有浓度大小和平衡移动的说法? 一个人过的日子1年前1
一个人过的日子1年前1 -
 larkin25930 共回答了19个问题
larkin25930 共回答了19个问题 |采纳率94.7%应该选C吧
该反应为气体反应,增大压强可以使平衡正移,反应1中各物种分压均高于反应2,又平衡常数Kp为广度量,可知Q21年前查看全部
- 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(
一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g),达到平衡后改变下述条件,SO3(g)平衡浓度不变的是( )
A. 保持温度和容器体积不变,再充入1molSO3(g)
B. 保持温度和容器内压强不变,再充入1molSO3(g)
C. 保持温度和容器体积不变,再充入2molSO2(g) 和1molO2(g)
D. 保持温度和容器内压强不变,再充入1molAr(g) 无心luck1年前1
无心luck1年前1 -
 12249098 共回答了16个问题
12249098 共回答了16个问题 |采纳率93.8%解题思路:达到平衡后,改变条件,SO3的平衡浓度不改变的,说明为等效平衡,恒温恒容按化学计量数转化到左边满足2molSO2,1molO2或恒温恒压按化学计量数转化到左边满足n(SO2):n(O2)=2:1,再结合平衡移动分析.A、温度和容器的体积不变,充入1mol SO3(g),按化学计量数转化到左边,得到n(SO2)=1mol,n(O2)=0.5mol,不满足2molSO2,1molO2,与原来的平衡不是等效平衡,所以SO3气体平衡浓度改变,故A不符合;B、温度和容...
点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查平衡移动、等效平衡等,难度中等,注意掌握等效平衡规律.1年前查看全部
- 33、(8分)在2L密闭容器中加入4molSO2和2molO2,发生下列反应2SO2(g)+O2(g) 2SO3(g),
33、(8分)在2L密闭容器中加入4molSO2和2molO2,发生下列反应2SO2(g)+O2(g) 2SO3(g),
(1)若充分反应后能否得到4molSO3?为什么?
(2)若经5s后,剩下的SO2为2.5mol,则用O2表示的反应速率是多少?5s末SO3浓度是多少? oceanyan1年前3
oceanyan1年前3 -
 巡逻一队 共回答了20个问题
巡逻一队 共回答了20个问题 |采纳率85%(1)否,因为此反应为可逆反应,在一定条件下达到反应限度——化学平衡,而不是完全反应.
(2)
反应:2SO2 + O2 = 2SO3
起始:4 2 0
转化:2x x 2x
5s :4-2x 2-x 2x
4-2x = 2.5,x = 0.75
v(O2) = 0.75mol ÷ 2L ÷ 5s = 0.075mol/(L·s)
C(SO3) = 2xmol / 2L = 0.75mol/L1年前查看全部
- 一道关于浓度和反应速率的化学题在1密封的1L容器里,有4MOLSO2和2MOLSO2,在一定条件下开始反应.2MIN末测
一道关于浓度和反应速率的化学题
在1密封的1L容器里,有4MOLSO2和2MOLSO2,在一定条件下开始反应.2MIN末测得容器中有3.6MOLSO2
(1)2MIN末SO3浓度(怎么算啊~~帮帮我)
(2)2MIN内SO2的平均反应速率(?) 杂乱0无章1年前2
杂乱0无章1年前2 -
 穷得只剩下美貌 共回答了13个问题
穷得只剩下美貌 共回答了13个问题 |采纳率100%题目有问题啊.
是2molO2还是4mol?
你写的都是SO2了1年前查看全部
- 香溢阁容积为4L的密闭容器中充入7MOLSO2和4摩尔氧气,在一定温度和压强下,发生如下反应2摩尔的二氧化硫和一摩尔的氧
香溢阁容积为4L的密闭容器中充入7MOLSO2和4摩尔氧气,在一定温度和压强下,发生如下反应2摩尔的二氧化硫和一摩尔的氧气可逆反应为2摩尔的三氧化硫,经4s后达到平衡状态,测得1摩尔的二氧化硫的物质的量是3摩尔,计算(1)分别以单位时间内氧气和二氧化硫的物质的量浓度的改变量来表示该反应的反应速率(2)平衡时体系中二氧化硫和三氧化硫的物质的量浓度
 fishshi1年前1
fishshi1年前1 -
 shss5678 共回答了15个问题
shss5678 共回答了15个问题 |采纳率93.3%"测得1摩尔的二氧化硫的物质的量是3摩尔”是什么意思?是剩余了3摩尔SO2吧?如果是,那么这样做:
2SO2 + O2 == 2SO3
起始物质的量 7mol 4mol 0
转化的物质的量 4mol 2mol 4mol
平衡时物质的量 3mol 2mol 4mol
接下来就好分析了,用物质的量的变化量(即上面转化的物质的量)除以容器的体积再除以时间,即可得到相应的物质所表示的反应速率了.
v(O2)=2mol/(4L乘4s)=0.13mol/(l.min),v(SO2)=2v(O2)
平衡时体系中二氧化硫和三氧化硫的物质的量浓度 根据上面的分析可以得到,平衡时的物质的量除以体积.1年前查看全部
- 在一定温度下,把2molSO2和1molO2通入一个密闭容器中发生反应;
在一定温度下,把2molSO2和1molO2通入一个密闭容器中发生反应;
在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如反应:2SO2+O2 ==2SO3(g),当此反应进行到一定程度时,反应混合物处于化学平衡状态.维持该容器中温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol).如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时完全相同,请填写下列空白:
①若a=0,b=0,则c= .
②若a=0.5,则b= 和c= .
③a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)
我完全不懂这跟守恒有什么关系啊,比方说第二问吧,a=0.5,为什么不填b=0.25,c=0.5不就直接平衡了么, oo奥特曼1年前1
oo奥特曼1年前1 -
 偶是新粽 共回答了18个问题
偶是新粽 共回答了18个问题 |采纳率100%请看清楚题目要求“三种气体体积分数要仍跟上述平衡完全相同”.还有,这个容器是定容的,反应物气体的计量数之和大于生成物的计量数之和,所以要完全等效,也就是说把加入的物质完全转化为反应物时,SO2和O2的物质的量一定要分别是2mol和1mol.
重点解释③吧!
①c=2
②b=0.25 ; c=1.5
③根据上面的解释,a+c=2 ; b+c/2=1,即2b+c=2,
所以,
abc满足的关系是a+c=2和2b+c=2.1年前查看全部
- 2molSO2和2molO2放在密闭容器中反应,反应达到平衡时,O2的物质的量在什么范围内?
 luobin10011年前1
luobin10011年前1 -
 ruojun 共回答了26个问题
ruojun 共回答了26个问题 |采纳率88.5%1到2之间,如果完全反应,消耗1molO2,剩余1mol,但因为该反应是可逆反应,不可能完全反应,所以剩余量应该大于1mol.1年前查看全部
- 在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,达到平衡后改变下列条件,SO2、O2、SO3气体平
在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,达到平衡后改变下列条件,SO2、O2、SO3气体平
在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,
达到平衡后改变下列条件,SO2、O2、SO3气体平衡浓度都比原来增大的是ACF(为什么?还有E
的选项原因?)平衡浓度的影响因素是什么
A 保持温度和容积不变,充入2molSO3
B 保持温度和容积不变,充入2molN2
C 保持温度和容积不变,充入0.5molSO2和0.25molO2
D 保持温度和压强不变,充入1molSO3
E 升高温度
F 移动活塞压缩气体问题补充:
额外问下 G 保持温度和压强不变,充入0.5molSO2和0.25molO2
和B的作用区别 linw041年前1
linw041年前1 -
 liuhew 共回答了21个问题
liuhew 共回答了21个问题 |采纳率95.2%ACF都是相当于增大了反应物的浓度
B.压强大了,但各反应物的分压是不变的.浓度没有变化
G与ACF相同1年前查看全部
- 1molSO2与氧气反应,转移几摩电子
 Tom的新车1年前1
Tom的新车1年前1 -
 该文艺台 共回答了23个问题
该文艺台 共回答了23个问题 |采纳率78.3%不能计算,因为这是一个可逆反应,不同条件下SO2转化率不同.1年前查看全部
- 20ml 0.1mol/L的Na2CO3溶液通入0.03molSO2,求生成什么物质?各多少摩尔
20ml 0.1mol/L的Na2CO3溶液通入0.03molSO2,求生成什么物质?各多少摩尔
请将化学方程式也写上, 绝武1年前1
绝武1年前1 -
 数码万年历 共回答了15个问题
数码万年历 共回答了15个问题 |采纳率93.3%SO2+H2O=H2SO3
H2SO3+Na2CO3=Na2SO3+H2O+CO2
SO2--Na2SO3--CO2--H2SO3--Na2CO3 (它们之间摩尔数之比都是1,用比例法很容易算出)1年前查看全部
大家在问
- 1从地面上方同一点向东与向西分别平抛出两个等质量的小物体,抛出速度大小分别为v和2v不计空气阻力,则两个小物体
- 2如图所示打开手电筒照在墙上时会在墙上形成一个大圆光斑这个光斑形成的原因是
- 3破阵子 为破阵子 为陈同甫赋壮语以寄之 辛弃疾 醉里挑灯看剑,梦回吹角连营.八百里分麾下炙,五十弦翻塞外声,沙场秋点兵.
- 41.圆的半径扩大3倍,面积也扩大3倍
- 5太空培育出来的新品种,(普遍)具有产量高、品质好、生命力强等优点. 这句话对不对
- 6一个圆柱的体积是141.3立方厘米,底面半径是3厘米,它的侧面积是多少?
- 7列算式 应用题(列式) 星期天,实验小学租一辆汽车到佛子山玩,租车费大家平摊.临上车时又来了3个同学,这样租车费就有15
- 8FeO+CO==Fe+CO2 在1092℃时平衡常数为0.35,在1L的密闭容器中投入7.2gFe和0.1molCO加热
- 9请问:七大洲分别是哪七洲?
- 10根号0.5与根号8的近似值是怎么算的,
- 11如何更好地利用网络佛山市南海区大沥实验小学三年作文
- 12先天下之忧而忧 后天下之乐而乐运用什么修辞手法
- 13在圆o中 已知圆o的直径为2 弦ac=√3 弦ad的长为√2 则cd的平方为多少
- 14先天下之忧而忧 后天下之乐而乐 运用了什么修辞手法
- 15现代汉语中笔画最多的是哪一个字?
