往AgNO3和Cu(NO3)2的混合液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,
 vivinne2022-10-04 11:39:542条回答
vivinne2022-10-04 11:39:542条回答A. 滤渣中一定有Fe
B. 滤渣中一定有Ag
C. 滤液中一定有Fe2+
D. 滤液中一定有Ag+、Cu2+

已提交,审核后显示!提交回复
共2条回复
 Zoe汀 共回答了22个问题
Zoe汀 共回答了22个问题 |采纳率95.5%- 解题思路:根据已有的知识进行分析,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
在金属活动性顺序中,铁在铜和银的前面,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,铜能与硝酸银反应生成硝酸铜和银,故在硝酸银和硝酸铜同时存在时,铁首先与硝酸银反应,当硝酸银全部参...
点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行. - 1年前
 one_some 共回答了15个问题
one_some 共回答了15个问题 |采纳率86.7%- 无气泡产生证明滤渣中一定没有Fe
Ag+比Cu2+氧化性强,因此铁会先与AgNO3反应
滤渣中一定有Ag,但不一定有Cu
因为铁粉还原产生Fe2+.滤液中一定有Fe2+
滤液中是否有Ag+、Cu 2+ 无法确定 - 1年前
相关推荐
- cu(no3)2,cu化合价
 rose_rain_19881年前1
rose_rain_19881年前1 -
 儒雅林枫 共回答了23个问题
儒雅林枫 共回答了23个问题 |采纳率100%Cu +2 价1年前查看全部
- 某混合溶液中含有AgNO3、Mg(NO3)2和Cu(NO3)2,进行下列实验:
某混合溶液中含有AgNO3、Mg(NO3)2和Cu(NO3)2,进行下列实验:
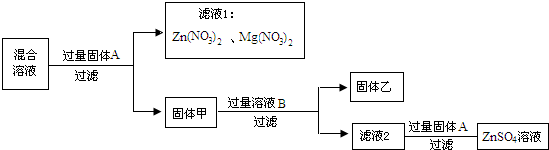
固体甲是______;滤液2中的溶质是______. 田小美1年前1
田小美1年前1 -
 Sprite_9013 共回答了19个问题
Sprite_9013 共回答了19个问题 |采纳率94.7%解题思路:分析框图所示的反应流程,结合反应后溶液或固体组成,确定每次操作的目的,最终判断固体甲和滤液2的组成.混合溶液中加入过量的固体A后,混合溶液变成硝酸锌和硝酸镁溶液并且产生固体甲,据此可推断该操作是加入过量锌置换混合溶液中的铜和银;所以固体甲为置换出的铜、银及反应后剩余的锌;
故选Ag、Cu、Zn;
为完全除去固体银、铜、锌混合物中的锌且得到硫酸锌溶液,可把固体混合物甲放入过量硫酸或硫酸铜的溶液中,反应后所得溶液为硫酸锌和未反应完的硫酸(或硫酸铜);
故答案为:ZnSO4、H2SO4(或ZnSO4与CuSO4).点评:
本题考点: 物质的鉴别、推断;金属活动性顺序及其应用.
考点点评: 金属活动性顺序表中,位于前面的金属可把位于其后的金属从盐溶液中置换出来;而位于H之前的金属可把酸中的H置换出来.1年前查看全部
- CU(NO3)2加热分解的化学方程式怎么写,还有化学分子方程式配平的原理是根据质量守恒定律,想咨询一下具体的操作方法,应
CU(NO3)2加热分解的化学方程式怎么写,还有化学分子方程式配平的原理是根据质量守恒定律,想咨询一下具体的操作方法,应该先找出哪个原子作为入手点配平方程的基础,有什么规律?
 掐架爱好者1年前1
掐架爱好者1年前1 -
 foodlan 共回答了13个问题
foodlan 共回答了13个问题 |采纳率100%2Cu(NO3)2 =2CuO+4NO2↑+O2↑
质量守恒定律就是分子式等式两边的各元素的原子个数总和要相等.1年前查看全部
- 硝酸的计算将0.30molCu2S与足量稀硝酸混合,在加热条件下反应,生成的产物有Cu(NO3)2、H2SO4、NO、和
硝酸的计算
将0.30molCu2S与足量稀硝酸混合,在加热条件下反应,生成的产物有Cu(NO3)2、H2SO4、NO、和H2O,则被还原的硝酸的物质的量是多少mol gaara6101年前2
gaara6101年前2 -
 D版KELLY 共回答了24个问题
D版KELLY 共回答了24个问题 |采纳率87.5%第一种方法可以配平方程式
3Cu2S + 22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O
3 22
0.3mol x
解的x=2.2mol
被还原的HNO3的物质的量2.2 *10/22 =1.0mol
第二种方法是根据得失电子守恒
+1 +2
Cu Cu 失去0.3*2*1=0.6mol 电子
-2 +6
S S 失去0.3*8=2.4mol电子
共失去3.0 mol的电子
+5 +2
N N 被还原的硝酸的物质的量*3 =30.mol
则被还原的硝酸的物质的量=1.0mol1年前查看全部
- (2014•江西模拟)将一定量的铁粉加入Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,对滤出固体的组成同学们
(2014•江西模拟)将一定量的铁粉加入Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,对滤出固体的组成同学们进行了以下探究:
【提出猜想】猜想①:可能是铁和银; 猜想②:可能是铁、铜和银; 猜想③:可能是______ 猜想④:可能是______.
猜想①肯定不成立,原因是______.
【设计实验】请你设计实验验证滤出固体中组成成分最多的猜想正确:
实验操作 实验现象 实验结论 ______ ______ ______  冰山来客阿波罗1年前1
冰山来客阿波罗1年前1 -
 lzz888 共回答了14个问题
lzz888 共回答了14个问题 |采纳率85.7%解题思路:根据金属活动性顺序中排在前面的金属能把排在后面的金属从它的化合物溶液中置换出来和排在氢前的金属能把稀盐酸中的氢置换出来进行分析.将一定量的铁粉加入Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,关于滤出固体的组成与铁粉量的多少有关.Ⅰ、铁粉太少,没能把AgNO3的银全部置换出来,则滤出固体的组成成分是银.Ⅱ、铁粉能把AgNO3的银全部置换出来而有剩余,没能或刚好把Cu(NO3)2的铜全部置换出来,则滤出固体的组成成分是银和铜.Ⅲ、铁粉过量,能把AgNO3的银和Cu(NO3)2的铜全部置换出来而有剩余,则滤出固体的组成成分是铁、银和铜.
猜想①肯定不成立,原因是铁的活动性比铜强,有铁存在就一定会置换出铜,所以不可能只有铁和银.
滤出固体中组成成分最多即为铁、铜和银,如果向滤出固体滴加稀盐酸,其中铁会与盐酸反应放出氢气气体;由于铁有剩余,混合溶液中的银和铜已全部被置换出来.
故答案应填写:
银;
银或铜;
铁的活动性比铜强,有铁存在就一定会置换出铜,所以不可能只有铁和银;
向滤出固体滴加稀盐酸;
有气体生成;
滤出固体中组成成分是铁、铜和银.点评:
本题考点: 金属的化学性质.
考点点评: 本题主要考查了正确分析实验方面的内容,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 向AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后有金属析出,过滤、洗涤后向滤渣中加入稀盐酸,有无色
向AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后有金属析出,过滤、洗涤后向滤渣中加入稀盐酸,有无色气体放出,则滤液中一定存在的物质是______.
 dongyanbing1年前1
dongyanbing1年前1 -
 kamkamen 共回答了13个问题
kamkamen 共回答了13个问题 |采纳率84.6%解题思路:铁比铜、银活泼,铁和硝酸银反应生成硝酸亚铁和银,和硝酸铜反应生成硝酸亚铁和铜;
铁能和稀盐酸反应生成氯化亚铁和氢气,铜和银不能和稀盐酸反应.向滤渣中加入稀盐酸,有无色气体放出,说明滤渣中含有铁,进一步说明铁和硝酸银、硝酸铜反应后有剩余,则滤液中一定存在的物质是硝酸亚铁.
故填:硝酸亚铁.点评:
本题考点: 金属的化学性质.
考点点评: 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.1年前查看全部
- 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A. Mg
B. Cu
C. Ag
D. H2 piao8110011年前0
piao8110011年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象
往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,你能得出的结论是( )
A. 滤渣中一定有Fe
B. 滤渣中一定有Cu
C. 滤液中一定有Fe2+
D. 滤液中一定有Ag+、Cu2+ fangsfico1年前1
fangsfico1年前1 -
 hollent 共回答了14个问题
hollent 共回答了14个问题 |采纳率92.9%解题思路:根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.由题意可知,向滤渣中加入稀盐酸,无气泡产生.说明加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.由以上分析可知:
A、滤渣中一定没有Fe粉.故A说法错误;
B、不能确定滤渣中是否含有Cu.故B说法错误;
C、滤液中一定有Fe2+,故C说法正确;
D、不能确定滤液中是否含有Ag+、Cu2+.故D说法错误.
故选C.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- 在AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入过量的铁粉,充分反应后过滤,滤渣中一定含有( )
在AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入过量的铁粉,充分反应后过滤,滤渣中一定含有( )
A.Zn、Cu、Fe
B.Ag、Cu、Fe
C.Ag、Cu
D.Fe、Ag 木然回首1年前1
木然回首1年前1 -
 YWMAHUI 共回答了14个问题
YWMAHUI 共回答了14个问题 |采纳率85.7%解题思路:本题考查根据金属的活泼性来判断置换反应的发生,确定过滤后滤渣的成分.金属活泼性Zn>Fe>Cu>Ag,则发生
Fe+Cu(NO3)2═Fe(NO3)2+Cu,Fe+2AgNO3═Fe(NO3)2+2Ag,Cu+2AgNO3═Cu(NO3)2+2Ag,因加入过量的铁粉,
则滤渣中一定含有Ag、Cu、Fe.A中锌比铁活泼,铁不会置换出锌,故A错误.
B中根据活泼性和铁粉过量,则先发生Fe+2AgNO3═Fe(NO3)2+2Ag,后发生Fe+Cu(NO3)2═Fe(NO3)2+Cu,不会发生Cu+2AgNO3═Cu(NO3)2+2Ag,都完全反应,滤渣中一定含有Ag、Cu、Fe,故B正确.
C中因铁粉过量,最后滤渣中应有铁,故C错误.
D中铁比铜活泼,一定有铜,故D错误.
故选B.点评:
本题考点: 金属活动性顺序与置换反应.
考点点评: 本题要求学生熟悉金属的活动性顺序表,能利用活动性判断反应的发生,还要注意思维的严谨性,如不可忽略铁粉过量这一信息.1年前查看全部
- 往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象
往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,你能得出的结论是( )
A. 滤渣中一定有Fe
B. 滤渣中一定有Cu
C. 滤液中一定有Fe2+
D. 滤液中一定有Ag+、Cu2+ snyj58381年前2
snyj58381年前2 -
 日比日月 共回答了20个问题
日比日月 共回答了20个问题 |采纳率75%解题思路:根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.由题意可知,向滤渣中加入稀盐酸,无气泡产生.说明加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.由以上分析可知:
A、滤渣中一定没有Fe粉.故A说法错误;
B、不能确定滤渣中是否含有Cu.故B说法错误;
C、滤液中一定有Fe2+,故C说法正确;
D、不能确定滤液中是否含有Ag+、Cu2+.故D说法错误.
故选C.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- (2010•中山二模)在Cu(NO3)2和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫
(2010•中山二模)在Cu(NO3)2和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生,则滤出的固体的组成可能是:(1)______(2)______.若向滤液滴加稀盐酸发现有白色沉淀生成,则该滤液的组成是______(填化学式),请写出生成白色沉淀反应的方程式______.
 zhangzongliang1年前1
zhangzongliang1年前1 -
 深圳中年男子 共回答了13个问题
深圳中年男子 共回答了13个问题 |采纳率100%解题思路:利用金属的活动性强弱关系,判断金属铁加入硝酸铜和硝酸银的混合溶液中发生反应的情况;由于反应情况与所加入铁粉的量密切相关,因此通过固体的成分的检验或滤液成分的检验,对所得固体或所得溶液的组成进行判断.滤出的固体滴加稀硫酸没有有气泡产生,说明所得固体中不含铁粉;加入的铁粉完全反应,则反得固体中一定含有金属活动性最差的金属银;如果完全置换混合溶液中的银离子后,还有铁粉,则铁粉继续与硝酸铜反应而置换出铜,所以所得固体也可能为银和铜的混合物;
故答案为:(1)Ag(2)Cu、Ag;
向滤液中滴加稀盐酸发现的白色沉淀,说明溶液中还含有硝酸银,可判断铁粉量不足,并没有完全置换出溶液中的银离子,因此也就没有与硝酸铜发生反应;综上所述,可得知滤液中含有硝酸银、硝酸铜和生成的硝酸亚铁;盐酸与硝酸银反应生成氯化银的白色沉淀和硝酸;
故选AgNO3、Cu(NO3)2、Fe(NO3)2(填化学式);HCl+AgNO3═AgCl↓+HNO3.点评:
本题考点: 金属活动性顺序及其应用;物质的鉴别、推断;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 金属与盐的混合溶液发生反应时,反应的顺序由金属活动性从弱到强依次进行,即先置换出活动性最差的金属,最后置换出活动性最强的金属.1年前查看全部
- (2014•丹东二模)把一定量的铁粉加入Cu(NO3)2和AgNO3的混合溶液中,反应结束后过滤,向滤渣中加入稀盐酸,无
(2014•丹东二模)把一定量的铁粉加入Cu(NO3)2和AgNO3的混合溶液中,反应结束后过滤,向滤渣中加入稀盐酸,无明显现象,下列对滤液和滤渣的说法错误的是( )
A.滤渣中一定含有银
B.滤液中一 定含有Fe2+
C.滤渣中可能含有铜
D.滤液中一定含有Cu2+ fewfew331年前1
fewfew331年前1 -
 飞浪44 共回答了18个问题
飞浪44 共回答了18个问题 |采纳率94.4%解题思路:根据金属活动性由强到弱的关系(Fe>Cu>Ag),铁可置换硝酸银中的银、铁可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银.充分反应后再加入稀盐酸无明显现象,说明了溶液中没有硝酸银,铁全部参加了反应,根据以上反应及现象,分析反应的发生情况,推断所得固体及溶液中的离子.由题意可知,向AgNO3和Cu(NO3)2混合溶液中加入一定量的铁粉,发生的反应有铁可置换硝酸银中的银、铁可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银.充分反应后再加入稀盐酸无明显现象,说明铁没有剩余.由此可知:
A、铁优先置换硝酸银中的银,充分反应后,则滤渣中一定含有银,故A正确;
B、铁可置换硝酸银中的银、铁可置换硝酸铜中的铜,则滤液中一定含有Fe2+,故B正确;
C、铁可置换硝酸铜中的铜,则滤渣中可能含有铜,故C正确;
D、铁可能恰好与AgNO3和Cu(NO3)2发生反应,故滤液中恰好没有Cu2+,故D错误.
故选:D.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag.下列结论错误的是( )
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Cu2+的量在反应前后没有发生改变
C.溶液中Cu2+与Fe2+物质的量之比为2:3
D.0.05mol Fe可还原0.1mol Fe3+ qiubackup1年前1
qiubackup1年前1 -
 笑笑宝 共回答了10个问题
笑笑宝 共回答了10个问题 |采纳率100%解题思路:A、金属活动顺序表中,排在后面的金属离子氧化性越强;金属铜和三价铁反应生成氯化铜和氯化亚铁,氧化剂的氧化性强于氧化产物的氧化性;
B、0.1mol铁粉与0.1mol的Fe(NO3)3和0.1mol的AgNO3恰好完全反应;
C、根据氧化还原反应的先后顺序进行判断;
D、根据金属铁和三价铁之间的反应方程式进行判断.A、根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,根据金属铜和三价铁反应生成氯化铜和氯化亚铁,可知氧化性Cu2+<Fe3+,故A错误;
B、0.1mol铁粉与0.1mol的Fe(NO3)3和0.1mol的AgNO3恰好完全反应,所以Cu2+的量在反应前后没有发生改变,故B正确;
C、Fe先还原Ag+,所以Fe2+:Cu2+=(0.1+0.1):0.1=2:1,故C错误;
D、0.05mol Fe恰好还原0.1mol Fe3+,故D正确;
故选AC.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生氧化还原反应中氧化性强弱的判断方法,可以根据所学知识进行回答,难度不大.1年前查看全部
- 某电镀厂排放的废水中含有大量的有毒重金属盐Ba(NO3)2、Cu(NO3)2、 AgNO3,
某电镀厂排放的废水中含有大量的有毒重金属盐Ba(NO3)2、Cu(NO3)2、 AgNO3,
该厂想用氢氧化钾溶液、盐酸、硫酸三种试剂,将所排废水的重金属离子逐一变成沉淀回收,最后得到只含一种可做化肥的中性溶液.假设每种试剂只用一次,每部恰好完全反应.所加试剂中第二种试剂的阴离子是 硫酸根离子 请问为什么是硫酸根离子呢? 路思思1年前1
路思思1年前1 -
 kelly0213 共回答了21个问题
kelly0213 共回答了21个问题 |采纳率100%首先加入盐酸,除去银离子(银离子与氢氧根离子和硫酸根离子都会形成沉淀)
然后加入硫酸除去钡离子,最后加入氢氧化钾溶液 除去铜离子和前两步反应生成的酸中的氢离子,最后就得到只含一种可做化肥的中性溶液(硝酸钾溶液).1年前查看全部
- (2011•驻马店二模)2010年上海世博会开幕式燃放的焰火五颜六色.其中一种焰火药剂的组成中含有Cu(NO3)2,当火
(2011•驻马店二模)2010年上海世博会开幕式燃放的焰火五颜六色.其中一种焰火药剂的组成中含有Cu(NO3)2,当火药燃烧时发生反应的方程式为:2Cu(NO3)2
2CuO+O2↑+4X↑,则X的化学式为______,反应前后氮元素的化合价由______价变为______价.点燃 . lovechao81年前1
lovechao81年前1 -
 qing_feng-11 共回答了17个问题
qing_feng-11 共回答了17个问题 |采纳率94.1%解题思路:根据化学变化前后原子的种类、数目不变,由反应的化学方程式推断反应中生成物X的分子构成,根据分子的构成确定X物质的化学式;
根据化合物中正负化合价代数和为零来计算氮元素的化合价.(1)由反应的化学方程式2Cu(NO3)2
点燃
.
2CuO+O2↑+4X↑,可得知反应前后各原子的个数为
反应前 反应后
Cu原子 2 2
N原子 4 0
O原子 12 4
根据化学反应前后原子的种类、数目不变,生成物X的4个分子中含有4个N原子和8个O原子,则每个X分子由1个N原子和2个O原子构成,因此,物质X的化学式为NO2;
(2)设中Cu(NO3)2氮元素的化合价为x,+2+2x+(-2)×3×2=0,x=+5;
设NO2中氮元素的化合价为y,y+(-2)×2=0,y=+4;
反应前后氮元素的化合价由+5价变为+4价.
故答案为:NO2;+5,+4.点评:
本题考点: 质量守恒定律及其应用;有关元素化合价的计算.
考点点评: 根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.1年前查看全部
- (2005•桂林)将铁粉加入到一定量AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸发现有气
(2005•桂林)将铁粉加入到一定量AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸发现有气体逸出,则滤渣的组成为( )
A.铁
B.铁和铜
C.铁和银
D.铁、铜、银 我是ll我怕谁啊1年前1
我是ll我怕谁啊1年前1 -
 汪精卫含 共回答了17个问题
汪精卫含 共回答了17个问题 |采纳率88.2%解题思路:根据金属活动性顺序铁氢铜银,向滤渣中加入稀盐酸发现有气体逸出,可判断铁粉过量,据此推断所发生的反应,判断滤渣的组成.根据金属活动性顺序铁氢铜银,向滤渣中加入稀盐酸发现有气体逸出,可判断铁粉过量,则混合溶液中的AgNO3、Cu(NO3)2被完全反应,铜、银完全被置换,因此滤渣中含有铁、铜、银;
故选D.点评:
本题考点: 金属活动性顺序及其应用;金属的化学性质;物质的鉴别、推断.
考点点评: 金属活动性顺序中位于氢之前的金属能从酸中置换出氢,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- (2014•江都市模拟)向AgNO3、Cu(NO3)2、Mg(NO3)2混合溶液中加入一些锌粉完全反应后过滤.不可能存在
(2014•江都市模拟)向AgNO3、Cu(NO3)2、Mg(NO3)2混合溶液中加入一些锌粉完全反应后过滤.不可能存在的是( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+、Mg2+ 斯万斯万1年前1
斯万斯万1年前1 -
 丫头0402 共回答了25个问题
丫头0402 共回答了25个问题 |采纳率96%解题思路:金属与盐溶液发生置换反应的规律是:位置在前的金属能将位于其后的金属从其盐溶液中置换出来;“加入一些锌粉”,根据金属活动性顺序镁>锌>铜>银,锌粉不能和硝酸镁反应,锌粉首先与硝酸银反应,待硝酸银完全反应后继续和硝酸铜进行反应.AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中加入一些锌粉,由于镁>锌>铜>银,锌不能与硝酸镁反应,锌与硝酸银反应生成硝酸锌和银,待硝酸银完全反应后继续和硝酸铜进行反应,生成了铜和硝酸锌;
A、若锌的量较少,只与部分硝酸银反应,生成银,则滤纸上只有银;滤液中有Ag+、Cu2+、Zn2+、Mg2+.所以该选项是有可能的;
B、若锌粉的量恰好将溶液中的银、铜置换出来,则滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+.所以该选项是有可能的;
C、若锌粉过量,则滤纸上有银、铜、锌,则液中的硝酸银、硝酸铜全部反应,溶液中滤液中有Zn2+、Mg2+.所以该项有可能;
D、由于锌的活动性小于镁的活动性,滤纸上不会有镁.所以该选项是不可能的.
故选D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题主要考查了金属的活动性顺序,能够培养学生灵活运用知识解决问题的能力;金属与盐的混合溶液反应,置换的先后顺序为:活动性最弱的金属先被置换出来,然后按照活动性由弱到强依次置换.1年前查看全部
- 在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体
在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生.则下列结论正确的是( )
A. 滤液中一定有Fe(NO3)3
B. 滤渣只含Ag和Cu,一定无Zn
C. 滤渣中一定有Ag、Cu和Fe,一定无Zn
D. 滤渣中一定有Ag、Cu、Fe和Zn 秋儿kenny1年前1
秋儿kenny1年前1 -
 asdb2228 共回答了20个问题
asdb2228 共回答了20个问题 |采纳率90%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.在金属活动性顺序中,锌>铁>氢>铜>银,铁不能与硝酸锌反应,故滤渣中一定不含有锌,在滤渣中加入盐酸有气体产生,则一定含有铁,说明加入的铁粉过量,铁能与硝酸银反应生成银和硝酸亚铁,能与硝酸铜反应生成铜和硝酸亚铁和铜,所以一定含有银和铜,滤液中不会含有硝酸铁,观察选项,故选C.
点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行,解此题的关键是看哪种物质有剩余,与这种剩余物质反应的物质将均不能与此共存.1年前查看全部
- (2006•眉山)向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,反应完成后过滤,下列情况不可
(2006•眉山)向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,反应完成后过滤,下列情况不可能存在的是( )
A. 滤纸上有Ag、Cu、Fe,滤液中有Zn2+、Fe2+
B. 滤纸上有Ag、Cu,滤液中有Zn2+、Fe2+
C. 滤纸上有Ag、Cu,滤液中有Cu2+、Zn2+、Fe2+
D. 滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+ 24冰红茶1年前1
24冰红茶1年前1 -
 我土容易吗 共回答了23个问题
我土容易吗 共回答了23个问题 |采纳率91.3%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,在金属活动性顺序中,锌>铁>铜>银,铁不能与硝酸锌反应,滤液中一定含有锌离子,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成铜和硝酸亚铁,铜能与硝酸银反应生成硝酸铜和银.A、当加入的铁过量时,铁能与硝酸银反应生成银和硝酸亚铁,能与硝酸铜反应生成硝酸亚铁和铜,铁有剩余,故滤纸上有铁、铜、银,滤液中含有锌离子和亚铁离子,故A可能存在;
B、当加入的铁适量时,铁能将混合液中的硝酸银和硝酸铜全部置换出来,则滤纸上有银和铜,滤液中有锌离子和亚铁离子,故B可能存在;
C、当加入铁的量较少时,铁能将混合液中的硝酸银全部置换出来,能与部分硝酸铜反应,滤纸上有银和铜,滤液中含有锌离子、亚铁离子和铜离子,故C可能存在;
D、铁能与硝酸铜反应生成铜和硝酸亚铁,当滤纸上有铁时,滤液中不可能含有铜离子,故D不可能存在;
故选:D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- (2006•海淀区一模)某溶液中含有AgNO3、Cu(NO3)2、Ba(NO3)2三种溶质,用①NaCl ②N
(2006•海淀区一模)某溶液中含有AgNO3、Cu(NO3)2、Ba(NO3)2三种溶质,用①NaCl ②Na2CO3③Na2SO4溶液分别将溶液中的Ag+、Cu2+、Ba2+离子沉淀出来,其加入顺序正确的是( )
A.①②③
B.③②①
C.②③①
D.①③② rp461年前1
rp461年前1 -
 热cc店2 共回答了21个问题
热cc店2 共回答了21个问题 |采纳率85.7%解题思路:要求是分别将三种离子沉淀出来,则第一步不能选择Na2SO4是因为会得到硫酸银(硫酸银微溶于水,微容物溶解度较小也相当于沉淀),硫酸钡两种沉淀;Na2CO3同理,会得到氢氧化铜、碳酸银、碳酸钡三种沉淀(碳酸铜水解生成氢氧化铜).先加入NaCl,它与硝酸银反应,只会生成AgCl沉淀;再加入Na2SO4,它与硝酸钡反应,只会生成硫酸钡沉淀;③最后加入Na2CO3,它与硝酸铜反应只得到氢氧化铜沉淀.
故选D.点评:
本题考点: 离子或物质的共存问题.
考点点评: 本题考查了酸、碱、盐的溶解性,掌握复分解反应的条件与实质,探究分离杂质的操作步骤和方法原则.1年前查看全部
- (2006•宜宾)若从H2SO4、Na2CO3、Na2SO4、NaCl、NaNO3、Cu(NO3)2、HNO3七种溶液中
(2006•宜宾)若从H2SO4、Na2CO3、Na2SO4、NaCl、NaNO3、Cu(NO3)2、HNO3七种溶液中取出其中的两种,进行混合及有关实验,所观察到的现象记录如下表.试根据各步实验及其现象先进行分步推断,再推断所取的两种溶液的可能组合.
步骤 实验操作 实验现象 分步推断 (1) 将取出的2种溶液进行混合 混合溶液无色、澄清.
无其它明显现象混合溶液中肯定不含Cu(NO3)2 (2) 用pH试纸测定混合溶液的pH 测定结果pH=2 混合溶液中肯定不含______ (3) 向混合溶液中滴入足量的Ba(NO3)2溶液 有白色沉淀出现 混合溶液中可能含有______ (4) 向(3)中溶液过滤所得的滤液中滴加AgNO3溶液 无明显现象 混合溶液中肯定不含______ 混合溶液的可能组合(写出溶质的化学式) ①______和______ 或
②______和______(写出两种组合即可) ansonillusion1年前1
ansonillusion1年前1 -
 美食爱好者yy 共回答了25个问题
美食爱好者yy 共回答了25个问题 |采纳率96%解题思路:(1)依据实验无现象进行判断,相互间能生成沉淀、气体的反应均不行;
(2)依据题目中各物质溶液的酸碱性,结合实验结果进行判断;
(3)依据能与硝酸钡反应生成沉淀的特点进行判断;
(4)依据不与硝酸银反应进行判断;
结合以上分析,写出满足各个实验现象的组合.(1)相互间能生成沉淀、气体的反应均不行,如H2SO4与Na2CO3或HNO3与Na2CO3它们反应会生成气体,故答案为:H2SO4与Na2CO3或HNO3与Na2CO3.
(2)实验测定pH为2,故溶液显酸性,而题目中显酸性的物质有两种:H2SO4、HNO3,结合实验(1)的结论,不能存在碳酸钠.故答案为:溶液中含有H2SO4或HNO3中的至少一种,不含碳酸钠.
(3)能与硝酸钡反应生成沉淀的物质有:H2SO4、Na2SO4,故答案为:H2SO4和Na2SO4至少含有一种.
(4)加入硝酸银无现象说明溶液中没有与硝酸银反应的物质,题目中能与硝酸银反应的有氯化钠和碳酸钠,而碳酸钠在(2)中已经排除,故答案为:溶液中不含NaCl.
根据各处实验结论可得满足所有情况的组合只有四种,
故答案为:①H2SO4与Na2SO4
②H2SO4与NaNO3
③H2SO4与HNO3
④HNO3与Na2SO4点评:
本题考点: 物质的鉴别、推断;盐的化学性质;离子或物质的共存问题.
考点点评: 该题为推断题,解题时要看清实验现象,把握各物质的性质特点,明确各物质间的反应关系,综合各个步骤的结论,最终得出答案,最后最好再进行检验.1年前查看全部
- 往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象
往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,你能得出的结论是( )
A. 滤渣中一定有Fe
B. 滤渣中一定有Cu
C. 滤液中一定有Fe2+
D. 滤液中一定有Ag+、Cu2+ laochh1年前1
laochh1年前1 -
 zdf9121 共回答了14个问题
zdf9121 共回答了14个问题 |采纳率78.6%解题思路:根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.由题意可知,向滤渣中加入稀盐酸,无气泡产生.说明加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.由以上分析可知:
A、滤渣中一定没有Fe粉.故A说法错误;
B、不能确定滤渣中是否含有Cu.故B说法错误;
C、滤液中一定有Fe2+,故C说法正确;
D、不能确定滤液中是否含有Ag+、Cu2+.故D说法错误.
故选C.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- (2013•泰兴市二模)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进
 (2013•泰兴市二模)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和实验探究.
(2013•泰兴市二模)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和实验探究.
[提出问题]溶液A中的溶质可能有哪些?
[作出猜想]①只有Zn(NO3)2②Zn (NO3)2、AgNO3
③Zn (NO3)2、Cu(NO3)2④Zn (NO3)2、AgNO3、Cu(NO3)2
[交流讨论]不合理的猜想是______(填标号),其理由是______.
[实验探究]若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
实验步骤 现象 有关反应的化学方程式 取少量固体B,
滴加______有气泡产生 ______  harva1年前1
harva1年前1 -
 我爱猪头 共回答了15个问题
我爱猪头 共回答了15个问题 |采纳率86.7%解题思路:根据金属活动性顺序及其运用分析.排在氢之前的金属可与稀盐酸或稀硫酸反应产生氢气,排在前面的金属(除钾、钙、钠外)可将排在后面的金属从其盐溶液中置换出来.由金属活动性顺序及其运用可知,向AgNO3和Cu(NO3)2混合溶液中加入锌粉,Zn应先与AgNO3反应后与Cu(NO3)2反应,由于锌粉量的不同,溶液A中的溶质不同,溶液中的溶质可能是:只有Zn(NO3)2或Zn (NO3)2、Cu(NO3)2 或Zn (NO3)2、AgNO3、Cu(NO3)2.由以上分析可知,
[交流讨论]不合理的是②;理由是:Zn应先与AgNO3反应后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2;
[实验探究]当锌粉过量时,溶液中的溶质只有Zn(NO3)2,固体B中有锌,当加入酸时有气泡生成,故下表为:
实验步骤 现象 有关反应的化学方程式
稀盐酸(或稀硫酸等) Zn+2HCl=ZnCl2+H2↑
(或Zn+H2SO4=ZnSO4+H2↑)故答为:[交流讨论]②,②Zn应先与AgNO3反应后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2;[实验探究]见上表.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题难度不是很大,主要考查了对金属活动性顺序的应用和理解,培养学生的应用能力和解决问题的能力.1年前查看全部
- (2012•德州模拟)向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉充分反应后过滤,向滤液
(2012•德州模拟)向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉充分反应后过滤,向滤液中滴加稀盐酸有白色沉淀析出,滤渣有______,滤液中的阳离子有______.
 马击长空1年前1
马击长空1年前1 -
 5750160 共回答了16个问题
5750160 共回答了16个问题 |采纳率93.8%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,利用此知识分析即可.在金属活动性顺序中,锌>铁>氢>铜>银,铁能与硝酸银反应生成银和硝酸亚铁,可以和硝酸铜反应生成铜和硝酸亚铁,不能与硝酸锌反应;所以放入铁后铁要先置换出硝酸银中银再去置换硝酸同种的铜,所以如果向所得滤液中加稀盐酸有白色沉淀生成,说明溶液中还存在银离子其白色沉淀是氯化银,因此硝酸铜一定还没有反应,所以滤渣会是银;所以溶液中的金属阳离子会有亚铁离子和没有反应的锌离子、铜离子.
故答案为:银;Fe2+、Zn2+、Cu2+点评:
本题考点: 金属的化学性质.
考点点评: 此题考查了金属活动顺序表中锌、铁、铜、银的金属活动性强弱,及其金属活动性顺序表的应用,锻炼了学生分析问题解决问题的能力.1年前查看全部
- 同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序.实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe
同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序.实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝.
(1)小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中;②把铜丝插入装有稀盐酸的试管中;
③把银丝插入装有稀盐酸的试管中;④把铜丝插入装有AgNO3溶液的试管中.
观察到①中的实验现象是______,④中的化学方程式是______.你认为小华所做的实验______(填序号)是多余的.
(2)后来,小贝只选用了上述药品中的三种,通过两步实验,也达到了实验目的.他选用的三种药品是______(写出一种药品组合即可). zhaoyang4561年前1
zhaoyang4561年前1 -
 hblfwf 共回答了14个问题
hblfwf 共回答了14个问题 |采纳率100%解题思路:(1)在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序.
(2)验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.(1)①把铁丝插入装有稀盐酸的试管中,铁能与稀盐酸反应生成氯化亚铁和氢气,会观察到铁丝表面有气泡产生,溶液由无色变为浅绿色.
④把铜丝插入装有AgNO3溶液的试管中,铜能与AgNO3溶液反应生成硝酸铜和银,反应的化学方程式为:Cu+2AgNO3═Cu(NO3)2+2Ag.
由①、②可知,铁比铜活泼;由④可知,铜比银活泼,所以无需再做银丝与稀盐酸的反应,故③是多余的.
(2)Cu、Fe、Ag的金属活动性顺序是铁>铜>银;在验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应,因此可选用金属铜,铜与硝酸银溶液反应生成硝酸铜和银,铜不与氯化亚铁溶液反应,可得出三种金属活动性强弱顺序是铁>铜>银(或铁丝、银丝、Cu(NO3)2溶液).
故答案为:(1)铁丝表面有气泡产生,溶液由无色变为浅绿色,Cu+2AgNO3═Cu(NO3)2+2Ag;③;(2)铜丝、AgNO3溶液、Fe(NO3)2溶液(或铁丝、银丝、Cu(NO3)2溶液).点评:
本题考点: 金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键.1年前查看全部
- (2005•鄂尔多斯)在Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,使之充分反应后,有下列情况(填化学式
(2005•鄂尔多斯)在Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,使之充分反应后,有下列情况(填化学式):
(1)若反应后锌有剩余,则溶液中所含溶质是______;
(2)若反应后过滤,向所得固体物质中加盐酸没有气体产生,则固体物质中一定有______,可能有______;
(3)若反应后过滤,向滤液中滴加KCl溶液,有不溶于稀硝酸的白色沉淀生成,则此时溶液中含有的溶质为______. 粉色西瓜1年前1
粉色西瓜1年前1 -
 the cloud 共回答了24个问题
the cloud 共回答了24个问题 |采纳率79.2%解题思路:在金属活动性顺序中,锌>氢>铜>银,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.(1)在金属活动性顺序中,锌>氢>铜>银,锌能与硝酸银反应生成银和硝酸锌,锌能与硝酸铜反应生成铜硝酸锌;反应后锌有剩余,则硝酸铜和硝酸银全部参加反应,滤液中只有硝酸锌,铜和银全部被置换出来;
(2)将反应后的混合物过滤,向所得的固体物质中滴加稀盐酸,没有气泡产生,说明固体中没有锌,则加入的锌粉量不足,此时锌与硝酸铜反应生成的铜,能与硝酸银反应生成银和硝酸铜,由于铜能与硝酸银反应,所以锌先与硝酸银反应,当把银全部置换出来时才能与硝酸铜反应,所得的固体中一定含有银,可能含有铜;
(3)向滤液中滴加KCl溶液,有不溶于稀硝酸的白色沉淀生成,说明其中含有银离子,即锌粉没有把硝酸银反应完,所以溶液中既有硝酸银、硝酸铜也有硝酸锌.
故答案为:(1)Zn(NO3)2;(2)Ag;Cu;(3)Cu(NO3)2、Zn(NO3)2、AgNO3.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 在AgNO3、Cu(NO3)2和铁的混合物中加入足量的水,充分搅拌反应后,过滤得到滤渣和溶液.向溶液中加入稀盐酸,产生白
在AgNO3、Cu(NO3)2和铁的混合物中加入足量的水,充分搅拌反应后,过滤得到滤渣和溶液.向溶液中加入稀盐酸,产生白色沉淀,则过滤得到的滤渣中一定含有( )
A. Fe Cu Ag
B. Fe Ag
C. Cu Ag
D. Ag dongjia0101年前1
dongjia0101年前1 -
 papa2005 共回答了21个问题
papa2005 共回答了21个问题 |采纳率100%解题思路:根据金属活动性顺序的意义进行分析,在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,硝酸银能与盐酸反应生成氯化银沉淀.在金属活动性顺序中,铁>铜>银,所以在AgNO3、Cu(NO3)2和铁的混合物中加入足量的水,铁能与硝酸银反应生成硝酸亚铁和银,铁能与硝酸铜反应生成硝酸亚铁和铜,铜能与硝酸银反应生成硝酸铜和银,由于生成的铜能与硝酸银反应生成硝酸铜和银,所以铁先与硝酸银反应,当把银全部置换出来再与硝酸铜反应,向溶液中加入稀盐酸,产生白色沉淀,说明所得的溶液中一定含有硝酸银,所以所置换的金属一定为银,观察选项即可得出答案.
故选D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 在Cu(NO3)2和Al(NO3)3的混合溶液中,硝酸根的物质的量为0.7mol.向该溶液中加入100ml8mol/L的
在Cu(NO3)2和Al(NO3)3的混合溶液中,硝酸根的物质的量为0.7mol.向该溶液中加入100ml8mol/L的KOH溶液,使之充分反应,反应前,若铝离子的物质的量与混合溶液中的离子总物质的量比值为X(不考虑Mg2+和Al3+的水街积水的电离所引起的离子总数的变化)求1〉X的取值范围〈2〉若铝离子的物质的量为amol,则a=___(用含x的式子表示) 当KOH刚完全消耗且Al3+全部转换成AlO2-时,X的取值
 新中酷哥1年前1
新中酷哥1年前1 -
 灭东洋扬gg威 共回答了16个问题
灭东洋扬gg威 共回答了16个问题 |采纳率81.3%“只要最后一小题详细过程”.
(1)0<X<0.25
(2)2.1x/(2+x)
(3)0.1
(4)因为KOH的物质的量=0.8mol>0.7mol,故反应的情况是,Cu(NO3)2已完全沉淀,Al(NO)3为沉淀至少已部分溶解.
设Al(NO)3、Cu(NO3)2的物质的量分别为m、n.则有
3m+2n=0.7
m÷(m+n+0.7)=x
解之,可得,m=2.1x/(2+x),n=(0.7-2.8x)/(2+x)
当x≤0.1时,沉淀只有Cu(OH)2,故y=(0.7-2.8x)/(2+x)
当0.25>x>0.1时,沉淀为Cu(OH)2和尚未溶解的Al(OH)3.故y=m+n-0.1=(0.5-0.8x)/(2+x)
此题计算较繁琐.再来点分吧.
另外,你是学生还是老师?经常做这样的题吗?1年前查看全部
- 下列有三种制取硝酸铜的方案:下列有三种制取硝酸铜的方案:方案一:Cu+4HNO3(浓) = Cu(NO3)2 + 2NO
下列有三种制取硝酸铜的方案:
下列有三种制取硝酸铜的方案:
方案一:Cu+4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O
方案二:3Cu+8HNO3(稀) = 3Cu(NO3)2 + 2 NO↑+ 4H2O
方案三:2Cu+O2+4HNO3(稀) = 2Cu(NO3)2+ 2H2O
请你从经济、环保的角度分析考虑选择一种最适宜的方案 ,你选择该方案而不选其它方案的理由 写两点 lchenf1年前1
lchenf1年前1 -
 xue0457300 共回答了21个问题
xue0457300 共回答了21个问题 |采纳率76.2%选方案三,因为方案三在制得相同的硝酸铜时消耗的原料硝酸最少,也没有产生污染气体.比如要得到6mol的硝酸铜.方案三只需12mol硝酸,方案一要24mol硝酸,还产生污染气体2NO2↑,方案二要16mol的硝酸,也产生了污染气体 NO.所以方案三最好!1年前查看全部
- Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A. 1:9
B. 1:7
C. 1:5
D. 2:9 沙漠一匹狼121年前1
沙漠一匹狼121年前1 -
 riyue521 共回答了18个问题
riyue521 共回答了18个问题 |采纳率83.3%解题思路:Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.令NO2和NO的物质的量分别为1mol、1mol,根据电子转移守恒计算参加反应的Cu2S的物质的量,由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4),由硫元素守恒可知n(Cu2S)=n(CuSO4),据此计算参加反应的硝酸的物质的量.据此计算判断.Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.
令NO2和NO的物质的量分别为1mol、1mol,根据电子转移守恒可知:
n(Cu2S)×[6-(-2)+1×2]=1mol×(5-4)+1mol×(5-2),解得n(Cu2S)=0.4mol.
由硫元素守恒可知n(CuSO4)=n(Cu2S)=0.4mol,
根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4)=2×0.4mol-0.4mol=0.4mol.
由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=2×0.4mol+1mol+1mol=2.8mol.
所以实际参加反应的Cu2S与HNO3的物质的量之比为n(Cu2S):n(HNO3)=0.4mol:2.8mol=1:7,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的基本概念与计算,难度中等,判断元素化合价变化,利用电子转移守恒与元素守恒计算是关键,转移守恒思想在氧化还原反应计算中的运用.1年前查看全部
- 用电子守恒法配平Cu2S+HNO3 → Cu(NO3)2+CuSO4+N2O3+H20如何配平啊.我配得都快崩溃了~
 zishanlinger1年前3
zishanlinger1年前3 -
 brading 共回答了15个问题
brading 共回答了15个问题 |采纳率93.3%S:-2价变为+6价,失去8个电子
Cu:+1价变为+2价,失去一个电子
N:+5价变为+3价,得两个电子
根据得失电子平衡
假设Cu2S系数为x,N2O3系数为y;
x*(2+8)=2y*2
x取2,则y=5,可以得到Cu2S系数和N2O3系数,Cu2S系数知道,根据S原子就可以得到CuSO4,从而可以确定2Cu(NO3)2的系数,最后得到HNO3和H20得系数……
2Cu2S+14HNO3 = 2Cu(NO3)2+2CuSO4+5N2O3+7H20
配平后,检查两边原子数是否相等……1年前查看全部
- 在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,既能被氧化又能被还原的是?为什么?理由
 liudehen19831年前2
liudehen19831年前2 -
 难民的耳朵 共回答了10个问题
难民的耳朵 共回答了10个问题 |采纳率90%选NO2、NaNO2.
元素处于最低价,只能被氧化.
元素处于最高价,只能被还原.
元素处于中间价态,既能被氧化又能被还原.
N的最低价是-3(NH3),最高价是+5(Cu(NO3)2).1年前查看全部
- 在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,其中氮元素只能被氧化的是?只能被还原的是?
在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,其中氮元素只能被氧化的是?只能被还原的是?
同时四种含氮化合物中既能被还原又能被氧化的是?
为什么?理由! 欢颜猫猫1年前3
欢颜猫猫1年前3 -
 baidu88s8 共回答了20个问题
baidu88s8 共回答了20个问题 |采纳率90%这种题要看其中N的价位,像氨气中的N是负三价的,这样的N的价位只能升高,所以只能被氧化,硝酸铜的N是正五价的,只能被还原,因为N的价位是最高的,剩下的二氧化氮的N是正四,亚硝酸钠的N是正三的,N的价位处于中间,所以既可以被还原,也可以被氧化1年前查看全部
- (2005•岳阳)有一包固体粉末可能由Cu(NO3)2、NH4Cl、CaCO3、K2SO4、Ba(NO3)2中的一种或几
(2005•岳阳)有一包固体粉末可能由Cu(NO3)2、NH4Cl、CaCO3、K2SO4、Ba(NO3)2中的一种或几种组成,做实验观察到以下现象:①将此固体粉末加入到足量水中,有白色沉淀出现,上层清液为无色;②过滤,在滤渣中加入稀硝酸,固体全部不溶.回答:从实验①可判断该固体粉末中一定不含______,从实验②可判断该固体粉末中一定含有______,一定不含有______.综合实验①②可知该固体粉末中可能含有______.若要探究该物质是否存在?你的方法是(简述实验操作步骤、现象和结论)______.
 kisser20051年前1
kisser20051年前1 -
 stjcb 共回答了17个问题
stjcb 共回答了17个问题 |采纳率100%解题思路:根据铜离子在溶液中显蓝色,碳酸钙难溶于水,碳酸钙会溶于酸而硫酸钡不溶于酸进行分析.将此固体粉末加入到足量水中,有白色沉淀出现,上层清液为无色,所以一定不存在硝酸铜,沉淀可能是碳酸钙,也可能是硫酸钡,在滤渣中加入稀硝酸,固体全部不溶,所以一定不存在碳酸钙,一定存在硝酸钡和硫酸钾,可能存在氯化铵,故答案为:硝酸铜,硫酸钾、硝酸钡,碳酸钙,氯化铵;
铵根离子会与碱反应放出氨气,故答案为:取样品加入氢氧化钠研磨后,会生成刺激性气味的含有氯化铵,没有刺激性气味的气体发出的不含有氯化铵.点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价;物质的鉴别、推断.
考点点评: 在解此类题时,首先分析需要鉴别物质的性质,然后根据题中的现象进行分析,对于现象不能确定的,需要再设计实验进行验证.1年前查看全部
- (2012•槐荫区二模)向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,则滤液中一定含有
(2012•槐荫区二模)向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,则滤液中一定含有的溶质是.
A.Fe(NO3)2
B.Cu(NO3)2
C.AgNO3
D.无法确定 v冰冰v1年前1
v冰冰v1年前1 -
 zdf7755 共回答了16个问题
zdf7755 共回答了16个问题 |采纳率87.5%解题思路:根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜.根据加入铁粉的质量多少,可得到以下几种可能:
①若加入的铁的量只能与部分硝酸银发生反应,所得滤液所含溶质为:AgNO3、Cu(NO3)2和生成的Fe(NO3)2;
②若加入的铁的量与硝酸银恰好完全反应或与部分硝酸铜能发生反应,所得滤液所含溶质为:Cu(NO3)2和生成的Fe(NO3)2;
③若加入过量的铁的量,硝酸银与硝酸铜都被全部反应,所得滤液所含溶质为生成的Fe(NO3)2;
所以滤液中一定含有的溶质是Fe(NO3)2;
故选项为:A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查的是金属和盐溶液的反应,把金属放入多种盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- 将一定量的铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,当铁与Cu(NO3)2恰好完全反应后,过滤,则以下的分析中
将一定量的铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,当铁与Cu(NO3)2恰好完全反应后,过滤,则以下的分析中正确的是( )
A. 滤纸上留下的物质是铜
B. 滤纸上留下的物质是银和铜
C. 滤液中的溶质是Fe(NO3)2和AgNO3
D. 滤液中的溶质是Fe(NO3)3 shenwj20041年前2
shenwj20041年前2 -
 luyongminfox 共回答了23个问题
luyongminfox 共回答了23个问题 |采纳率100%解题思路:根据金属活动性顺序的意义进行分析,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.将一定量的铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,能发生的反应是Fe+2AgNO3=Fe(NO3)2+2Ag,Fe+Cu(NO3)2=Fe(NO3)2+Cu,当铁与Cu(NO3)2恰好完全反应,硝酸银已经全部参加反应
A、滤纸上留下的物质有铜和银,故A错误;
B、滤纸上留下的物质是银和铜,故B正确;
C、滤液中只含有硝酸亚铁,故C错误;
D、滤液中的溶质是硝酸亚铁,不是硝酸铁,故D错误;
故选B.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- (2009•香坊区一模)某溶液中含有AgNO3和Cu(NO3)2两种溶质,将其分装在三个试管A、B、C中.现向三支试管中
(2009•香坊区一模)某溶液中含有AgNO3和Cu(NO3)2两种溶质,将其分装在三个试管A、B、C中.现向三支试管中分别加入一定量的铁粉,反应后过滤,得到滤渣和滤液.依据以下信息填空,要求填写化学式.
(1)若向A试管的滤渣中加入稀盐酸有气泡生成,则A试管中的滤液中的溶质是______.
(2)若向B试管的滤渣中加入稀盐酸无气泡生成,则B试管中的滤渣中一定有______.
(3)若向C试管的滤液中加入稀盐酸有白色沉淀,则C试管中的滤液一定有溶质______. deaf_sophia1年前1
deaf_sophia1年前1 -
 wengxiansheng 共回答了21个问题
wengxiansheng 共回答了21个问题 |采纳率95.2%解题思路:(1)向A试管的滤渣中加入稀盐酸有气泡生成,根据三种金属中只有铁可能盐酸反应放出氢气,说明加入的铁粉过量而有剩余;
(2)向B试管的滤渣中加入稀盐酸无气泡生成,根据三种金属中只有铁可能盐酸反应放出氢气,说明滤渣中不含铁粉,铁粉可能不足也可能恰好完全反应;
(3)向C试管的滤液中加入稀盐酸有白色沉淀,根据盐酸可与硝酸银反应生成氯化银沉淀,说明滤液中仍含有硝酸银,所加铁粉量不足,未能完全反应硝酸银.(1)向A试管的滤渣中加入稀盐酸有气泡生成,则可得知所加入的铁粉有剩余,混合溶液中的AgNO3和Cu(NO3)2完全反应,此时滤液中只有Fe(NO3)2;
(2)向B试管的滤渣中加入稀盐酸无气泡生成,可判断滤渣中不含铁粉,所加入的铁粉一定与硝酸银发生了反应,是否与硝酸铜发生反应不可得知,因此,所得滤渣中一定含有Ag;
(3)向C试管的滤液中加入稀盐酸有白色沉淀,可判断滤液中仍含有硝酸银,说明所加入的铁粉量不足甚至没有完全反应硝酸银,因此,此时所得滤液中含有未反应完的AgNO3、Cu(NO3)2及反应生成的Fe(NO3)2;
故答案为:(1)Fe(NO3)2;(2)Ag;(3)AgNO3、Cu(NO3)2、Fe(NO3)2.点评:
本题考点: 金属活动性顺序及其应用;化学式的书写及意义.
考点点评: 活动性强的金属加入活动性弱的金属的盐的混合溶液中时,金属会首先把活动性最弱的金属从其盐溶液中置换出来.1年前查看全部
- 往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象
往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,你能得出的结论是( )
A. 滤渣中一定有Fe
B. 滤渣中一定有Cu
C. 滤液中一定有Fe2+
D. 滤液中一定有Ag+、Cu2+ sdhsdh20021年前1
sdhsdh20021年前1 -
 沙漠渔网 共回答了20个问题
沙漠渔网 共回答了20个问题 |采纳率90%解题思路:根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.由题意可知,向滤渣中加入稀盐酸,无气泡产生.说明加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.由以上分析可知:
A、滤渣中一定没有Fe粉.故A说法错误;
B、不能确定滤渣中是否含有Cu.故B说法错误;
C、滤液中一定有Fe2+,故C说法正确;
D、不能确定滤液中是否含有Ag+、Cu2+.故D说法错误.
故选C.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- (2012•仪征市二模)往AgNO3和Cu(NO3)2的混合液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无
(2012•仪征市二模)往AgNO3和Cu(NO3)2的混合液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,你得出的结论是( )
A.滤渣中一定有Fe
B.滤渣中一定有Ag
C.滤液中一定有Fe2+
D.滤液中一定有Ag+、Cu2+ 5273571年前1
5273571年前1 -
 sshimy 共回答了17个问题
sshimy 共回答了17个问题 |采纳率88.2%解题思路:根据已有的知识进行分析,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.在金属活动性顺序中,铁在铜和银的前面,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,铜能与硝酸银反应生成硝酸铜和银,故在硝酸银和硝酸铜同时存在时,铁首先与硝酸银反应,当硝酸银全部参加反应,铁再与硝酸铜反应,往AgNO3和Cu(NO3)2的混合液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生,则滤渣中不含有铁,
A、向滤渣中加入稀盐酸,无气泡产生,则滤渣中一定不含有铁粉,故A错误;
B、在硝酸银和硝酸铜同时存在时,铁首先与硝酸银反应,当硝酸银全部参加反应,铁再与硝酸铜反应,故滤渣中一定含有银,故B正确;
C、铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,故滤液中一定含有Fe2+,故C正确;
D、当铁粉少量时,不能与硝酸银全部反应,滤液中一定有Ag+、Cu2+,当加入的铁粉与硝酸银恰好完全反应时,滤液中不含有Ag+,当加入的铁粉与硝酸银和硝酸铜恰好完全反应时,滤液中不含有Ag+、Cu2+,故D错误;
故选BC.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 超紧急:CU2S + HNO3 = CU(NO3)2 + NO + S + H2O中文:硫化铜+硝酸=硝酸铜 + 一氧化
超紧急:
CU2S + HNO3 = CU(NO3)2 + NO + S + H2O
中文:硫化铜+硝酸=硝酸铜 + 一氧化氮 + 单质硫+水 naitou1年前5
naitou1年前5 -
 丢了的经典001 共回答了32个问题
丢了的经典001 共回答了32个问题 |采纳率87.5%3Cu2S+16HNO3=6Cu(NO3)2+4NO↑+3S↓+8H2O
一个Cu升1价,一个硫升2价,所以整体法,一个Cu2S升4价,而一个N降3价
所以3Cu2S 4NO 然后铜,硫原子守恒,所以6Cu(NO3)2 3S 氮原子守恒,所以16HNO3然后是氢守恒 8H2O,最后检查O1年前查看全部
- 把一定量的Fe粉放入AgNO3、Cu(NO3)2、Zn(NO3)2混合溶液中,充分反应后过滤,对滤出的固体和滤液中溶质的
把一定量的Fe粉放入AgNO3、Cu(NO3)2、Zn(NO3)2混合溶液中,充分反应后过滤,对滤出的固体和滤液中溶质的叙述正确的是( )
A.滤出的固体中含有Ag,滤液中一定含有Cu(NO3)2,Fe(NO3)2,Zn(NO3)2,可能含有AgNO3
B.滤出固体中有Ag,Cu,滤液中一定有Cu(NO3)2,Fe(NO3)2,Zn(NO3)2
C.滤出固体中有Ag,Cu,Fe,滤液中一定有Zn(NO3)2,可能含有Fe(NO3)2
D.滤出的固体中有Ag,Cu,Fe,滤液中一定含有Zn(NO3)2,Fe(NO3)2,可能含有Cu(NO3)2 luoquanfei1年前1
luoquanfei1年前1 -
 鲁提辖斩人来了 共回答了16个问题
鲁提辖斩人来了 共回答了16个问题 |采纳率87.5%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此分析有关的问题.由金属活动性顺序可知,锌>铁>铜>银,AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的铁粉,铁粉首先置换硝酸银中的银,待硝酸银完全反应后继续与硝酸铜发生反应而不能与硝酸锌发生反应;
A、如果铁粉的量不足,只能部分或全部置换出溶液中的银,则滤出的固体中含有Ag,滤液中一定含有Cu(NO3)2,Fe(NO3)2,Zn(NO3)2,可能含有AgNO3.故A正确;
B、滤出固体中有Ag,Cu,滤液中Fe(NO3)2,Zn(NO3)2,可能含有Cu(NO3)2.故B错误;
C、滤出固体中有Ag,Cu,Fe,滤液中一定有Zn(NO3)2、Fe(NO3)2.故C错误;
D、滤出的固体中有Fe,滤液中一定不含有Cu(NO3)2.故D错误.
故选A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- (2009•道外区一模)电镀厂的废水中含有AgNO3和Cu(NO3)2为回收金属Cu和Ag.有下列操作.试回答:
(2009•道外区一模)电镀厂的废水中含有AgNO3和Cu(NO3)2为回收金属Cu和Ag.有下列操作.试回答:
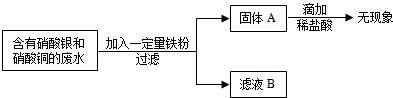
(1)固体A中一定含______
(2)确定滤液B中溶质化学式有多种情况.你认为有(填化学式):______. mrfish_111年前1
mrfish_111年前1 -
 超级女生牌nn 共回答了18个问题
超级女生牌nn 共回答了18个问题 |采纳率94.4%解题思路:根据回收流程图,过滤后固体A滴加稀盐酸无现象,说明固体中不含铁粉,即铁全部反应;废水为AgNO3和Cu(NO3)2混合溶液,由于金属铜的活动性大于银,铁粉先与AgNO3反应置换出银,银全部置换后再与Cu(NO3)2反应置换铜.(1)铁全部反应时固体A有四种可能:
①铁粉恰好与废水中的AgNO3和Cu(NO3)2完全反应,固体A为Cu、Ag混合物;
②铁粉恰好只与废水中的AgNO3完全反应,固体A为Ag;
③铁粉未能完全反应废水中的AgNO3,固体A为Ag;
④铁粉未能完全反应废水中Cu(NO3)2而完全反应的AgNO3,固体A为Cu、Ag.综合以上分析,固体A中一定含有金属Ag;
故选Ag;
(2)若Fe粉恰好与混合溶液完全反应,则AgNO3和Cu(NO3)2全部反应,滤液中不含这两种物质,滤液为Fe(NO3)2溶液;若Fe粉不足且恰好与混合溶液中的AgNO3完全反应,滤液中不含这种物质,滤液为Cu(NO3)2、Fe(NO3)2溶液;若Fe粉不足且未能把混合溶液中的AgNO3完全反应,滤液中仍含这种物质,滤液为AgNO3、Cu(NO3)2、Fe(NO3)2溶液;
故答:Fe(NO3)2,Cu(NO3)2、Fe(NO3)2,AgNO3、Cu(NO3)2、Fe(NO3)2.点评:
本题考点: 金属的化学性质;金属活动性顺序及其应用.
考点点评: 金属与盐的混合溶液或盐与酸的混合溶液发生反应时,根据金属活动性从小到的大顺序依次反应.1年前查看全部
- 将铁粉加到一定量AgNO3、Cu(NO3)2 的混合溶液中,等充分反应后过滤,向滤渣中加入稀盐酸,有气体产生,
将铁粉加到一定量AgNO3、Cu(NO3)2 的混合溶液中,等充分反应后过滤,向滤渣中加入稀盐酸,有气体产生,则滤渣含有的物质是( )
A. 铁、铜、银
B. 铜和银
C. 铁和银
D. 铁和铜 xiedong0081年前1
xiedong0081年前1 -
 医生的良心在哪里 共回答了13个问题
医生的良心在哪里 共回答了13个问题 |采纳率84.6%解题思路:根据已有的知识进行分析,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.在金属活动性顺序中,铁>铜>银,将铁粉加到一定量AgNO3、Cu(NO3)2 的混合溶液中,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,生成的铜能与硝酸银反应生成硝酸铜和银,故在硝酸铜和硝酸银的混合液中加入铁粉,铁首先与硝酸银反应,当硝酸银全部参加反应,硝酸铜再和铁反应,等充分反应后过滤,向滤渣中加入稀盐酸,有气体产生,说明有铁粉剩余,当有铁粉剩余时,混合液中的硝酸银和硝酸铜全部参加反应,故滤渣中含有的金属是铁、铜、银,观察选项,故选A.
点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 求解一道化学题,题目如下向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列
求解一道化学题,题目如下
向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列说法正确的是( )
A.一定有锌粉剩余
B.所得溶液中一定有Zn2+和Cu2+
C.一定有银粉生成
D.所得溶液中一定有Cu2+和Ag+
答案选C
解析说可能存在一下几种情况
锌粉刚好把Ag.Cu全部置换出来了
把Ag全部置换出来,但Cu未置换出来
Ag全部置换出来,但Cu只有部分被置换出来
Ag只有部分置换出来,Cu没有置换出来.
我想问为什么锌粉会先跟AgNO3反应,而不是先跟Cu(NO3)2反应或者同时跟两种一起反应?
 bjaya1年前2
bjaya1年前2 -
 jackey512 共回答了15个问题
jackey512 共回答了15个问题 |采纳率93.3%鸡蛋壳的主要成分是(碳酸钙),某同学做了如下的家庭小实验:在一个玻璃杯中放入了大半杯白醋,将一只洗净的鸡蛋放入杯中,观察到鸡蛋慢慢沉到杯底,又慢慢浮起来,马上又下沉……这样反复运动.请通过化学和物理等知识来解释该实验现象.(鸡蛋壳的主要成分为碳酸钙,与盐酸反应产生二氧化碳气体,以气泡形式存在在蛋壳周围,使鸡蛋受到的浮力大于重力而上浮,浮出水面后气泡破裂,鸡蛋受到的浮力小于重力而下沉,如此反复).
打字不易,1年前查看全部
- 向Cu(NO3)2溶液中加入一定量的铁粉充分反应,下列情况中可能出现的是( )
向Cu(NO3)2溶液中加入一定量的铁粉充分反应,下列情况中可能出现的是( )
①溶液中有Fe(NO3)2、Cu(NO3)2,不溶物为Cu②溶液中有Fe(NO3)2、Cu(NO3)2,不溶物为Fe③溶液中只有Cu(NO3)2,不溶物为Fe④溶液中只有Fe(NO3)2,不溶物为Fe、Cu.
A. ①③
B. ①④
C. ②③
D. ③④ 小鱼xinxin1年前5
小鱼xinxin1年前5 -
 ○o宝宝o○ 共回答了11个问题
○o宝宝o○ 共回答了11个问题 |采纳率100%解题思路:铁比铜活泼,能置换出硝酸铜中的铜,生成硝酸亚铁,根据加入的铁粉的多少,可能出现以下几种情况:①加入的铁粉的量少,没有全部把铜置换出来,这时溶液中就有Fe2+、Cu2+、不溶物为Cu,②加入的铁粉恰好与硝酸铜完全反应,这时溶液中只有Fe2+、不溶物为Cu,③加入的铁粉过量,这时溶液中只有Fe2+、不溶物为Fe、Cu①当加入的铁粉不足量时,溶液中有Fe(NO3)2、Cu(NO3)2,不溶物为Cu;故①正确;
②溶液中不能同时存在铁粉和Cu2+,因为它们能反应,故②错;
③溶液中不能同时存在铁粉和Cu2+,因为它们能反应,故③错;
④当加入的铁粉过量时,溶液中只有Fe2+、不溶物为Fe、Cu,故④正确.
故选B.点评:
本题考点: 金属的化学性质.
考点点评: 当参加反应的物质的质量不同时,所得生成物中的成分可能有多种组成情况.1年前查看全部
- (2014•昆明模拟)向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤.下列说法
(2014•昆明模拟)向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤.下列说法正确的是( )
A.滤纸上一定有Ag和Cu
B.滤纸上一定有Ag,可能有Cu、Mg
C.滤液中一定含有Zn(NO3)2、Mg(NO3)2
D.滤液中可能有Cu(NO3)2,滤纸上可能有Ag 坏鱼鱼1年前1
坏鱼鱼1年前1 -
 yuanfang6113 共回答了11个问题
yuanfang6113 共回答了11个问题 |采纳率90.9%解题思路:这类题目有个窍门,就是滤渣中一定会有最不活泼金属的单质,滤液中一定会有最活泼金属的盐溶液,也就是说滤渣中一定有银,滤液中一定有硝酸锌,但是整个过程硝酸镁并不参加反应,因为锌不如镁活泼,所以滤液中还应该有硝酸镁.
“加入一些锌粉”,根据金属活动性顺序镁>锌>铜>银,锌粉不和硝酸镁反应,和硝酸银、硝酸铜发生反应时首先与硝酸银反应,待硝酸银完全反应后继续和硝酸铜进行反应.A、根据金属活动性顺序镁>锌>铜>银,锌粉不和硝酸镁反应,和硝酸银、硝酸铜发生反应时首先与硝酸银反应,待硝酸银完全反应后继续和硝酸铜进行反应,因为锌粉的量未知,所以滤纸上一定有银,但不一定由铜,故说法错误;
B、由A的分析可知滤纸上一定有银,但不一定由铜,一定无镁,故说法错误;
C、根据金属活动性顺序镁>锌>铜>银可知:锌能置换出银所以溶液中一定含有Zn2+、但不能置换出镁所以也一定含有Mg2+,则滤液中一定含有Zn(NO3)2、Mg(NO3)2,故说法正确;
D、由C的分析可知溶液中一定含有Zn2+、Mg2+,而是否含有Ag+、Cu2+由A的分析可知:决定于放入锌粉的量,而滤纸上一定有Ag;故该项错误.
故选:C.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,利用化学反应判断物质组成的题目属于中考常考的知识点,通常在探究题中出现,考察基础知识和化学实验思想,注意仔细审题.1年前查看全部
- (2001•黄冈)向AgNO3、NaNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后,过滤洗涤,将滤渣放
(2001•黄冈)向AgNO3、NaNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后,过滤洗涤,将滤渣放入盐酸中有气泡产生,则滤液中存在的阳离子是( )
A.Ag+、Cu2+
B.Cu2+、Zn2+
C.Zn2+、Na+
D.Zn2+、Na+ 就萌乔峰1年前1
就萌乔峰1年前1 -
 CHI9527 共回答了21个问题
CHI9527 共回答了21个问题 |采纳率95.2%解题思路:理解金属活动性顺序,及灵活的运用有关的知识活泼的金属能把不活泼的金属从盐溶液中置换出来.金属的活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)Cu、Hg、Ag、Pt、Au,由于锌在钠后,不可能把钠离子从溶液中置换出来,锌在银和铜的前面,因此锌可以和硝酸银、硝酸铜反应,由于将滤渣放入盐酸中有气泡产生,说明滤渣中有过量的锌,因此在滤液中不可能再有硝酸银和硝酸铜.
故选C.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 主要考查了金属的活动性顺序的应用,培养学生分析问题、应用所学知识解决问题的能力.1年前查看全部
- 某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质
某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质量增加;c电解液pH减小,则应选用的电极是( )
①阴阳两极都用石墨
②铜作阳极铁作阴极
③铁作阳极铜作阴极
④铂作阳极铜作阴极.
A.①③
B.①②
C.③④
D.①④ 纪海1年前1
纪海1年前1 -
 忧游uu 共回答了16个问题
忧游uu 共回答了16个问题 |采纳率81.3%解题思路:依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小.依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小,
①阴阳两极都用石墨电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故①符合;
②铜作阳极,铁作阴极,阳极是活性电极铜失电子质量减小,不符合题干条件,故②不符合;
③铁作阳极,铜作阴极,阳极是活性电极铁失电子质量减小,不符合题干条件,故③不符合;
④铂作阳极,铜作阴极,阳极是惰性电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故④符合;
故选:D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的分析判断,主要是阳极材料的分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- 某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气
某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,某同学设计了一个除去废水中重金属离子的实验方案如下:
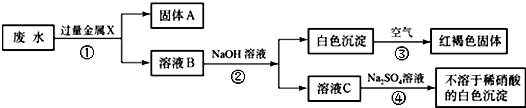
(1)固体A中一定含有的物质为______(写化学式).
(2)B溶液中的溶质一定含有______(写化学式).
(3)请写出③、④的化学方程式:______、______. 水ww泉1年前1
水ww泉1年前1 -
 yetta2008 共回答了25个问题
yetta2008 共回答了25个问题 |采纳率84%解题思路:由题中的框图可知:已知红褐色固体是氢氧化铁,可知X是金属铁,铁把银、铜置换出来,故固体A为Ag、Cu、Fe;又由于加入过量的铁和出现的白色沉淀,所以B溶液中一定有Fe(NO3)2和Ba(NO3)2.书写化学方程式时要注意配平和沉淀符号.(1)由题中的图知:废水加过量固体X,然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀,由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁;可知金属X是铁,废水中含有银离子、钡离子和铜离子,铁可将银离子和铜离子置换出来,还有过量的铁,所以固体A中一定含有Fe、Ag和Cu;
(2)溶液中含有没参加反应的硝酸钡和生成的硝酸亚铁,硝酸铜和硝酸银完全被过量的铁置换出来,所以B溶液中的溶质一定含有Fe(NO3)2、Ba(NO3)2;
(3)反应③是白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,因此反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
溶液C为Ba(NO3)2,加入硫酸钠发生反应的方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
故答案为:(1)Fe、Cu、Ag;(2)Ba(NO3)2、Fe(NO3)2;(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3;Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 .点评:
本题考点: 物质的鉴别、推断;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
大家在问
- 1We did a survey _____ our students.
- 22012年12月28日至2014年12月28日和至2014年1月11日分别共多少天了
- 3第一次做地铁 作文
- 4现将100克10%的食盐溶液,若将其溶质质量分数增大一倍,可采用的方法是( )
- 5一场足球比赛中,广州恒大足球队以5:1战胜了韩国联赛冠军足球队.赛后新浪网调查了球迷们队球队获胜原因
- 6(2007•福州)哈尔滨某医院急需从北京运一批血浆救治病人,最合适的运输方式是( )
- 7英语翻译我是XX的父亲,很荣幸因为我女儿XX来到你们家共同生活的关系认识你们,对你们即将因此而付出的爱心和辛苦照顾,我代
- 8综合单价=人工费+材料费+机械台班费+取费基数*(企业管理费率+利润率)+风险费用
- 9在距地面高为h处,同时以相等的初速度V0分别平抛、竖直上抛、竖直下抛一质量相等的物体m,当它们从抛出到落地时,比较它们的
- 10与曲线x^/9–y^/16=1有相同的渐近线,且经过点A(–3,2√3)的双曲线方程为_____
- 11已知f(-X)=-f(x),且f'(-x0)=k,则f'(x0)等于?
- 12括号里必须填成语!想到即将要与母校、老师和同学们分别,我真有些().回想起刚入学时,我们是一群()的儿童,是老师()的工
- 13微风、轻微的风 用一个字概括 什么字最恰当啊?
- 14下面的(1),(2)比较湖西遗址与河姆渡遗址距今的时间你认为“河姆渡原始居民种植了世界上最早的水稻”这句话对吗?请说说理
- 15已知关于x的方程x2+2(m-2)x+m2+4=0有两个实数根,且这两根的平方和比两根的积大21,求m的值.
