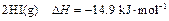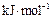200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对
 gaokeddk2022-10-04 11:39:543条回答
gaokeddk2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 clbdd 共回答了13个问题
clbdd 共回答了13个问题 |采纳率92.3%- 解题思路:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=[n/M]计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.
200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=[8g/32g/mol]=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:[11.6g/0.5mol]=23.2g/mol,故混合气体的平均相对分子质量为23.2,
答:原混合气体的平均相对分子质量为23.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法. - 1年前
 花开的声音_小草 共回答了184个问题
花开的声音_小草 共回答了184个问题 |采纳率- 2CO2+2Na2O2=2Na2CO3+O2 Δm 2H2O+2Na2O2=4NaOH+O2 Δm
88 32 56 36 32 4
x ... - 1年前
 buhuaiu 共回答了1个问题
buhuaiu 共回答了1个问题 |采纳率- ,,,
- 1年前
相关推荐
- 200℃的锡是 态,﹣100℃的氧是 态 100℃的水银是 态
 shriens1年前1
shriens1年前1 -
 bg45115 共回答了13个问题
bg45115 共回答了13个问题 |采纳率92.3%200℃的锡是固 态,﹣100℃的氧是气 态 100℃的水银是 液态1年前查看全部
- 一个真空密闭容器中盛有1mol PCl5,加热到200℃时发生了反应:PCl5(g)= PCl3(g)+Cl2(g)
一个真空密闭容器中盛有1mol PCl5,加热到200℃时发生了反应:PCl5(g)= PCl3(g)+Cl2(g)
反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%.M与N的关系是( ) 加入2mol的PCL5压强增大,反应向逆反应方向进行,所以PCL5的分解率变低, 满杯茶1年前1
满杯茶1年前1 -
 ggwwgw 共回答了23个问题
ggwwgw 共回答了23个问题 |采纳率95.7%正确;
就是变少,不过最好加上等效平衡的知识;
这里我们假设一个平衡,假设两个容器,加入2molPCl5,合并为1个容器,但是体积还是2V,那么转化率不变,=M%,现在把这个容器压缩至一半,那么转化率就变为N%,这个过程就是压强增大,反应逆向进行;
你理解的是一样的,但是你说的逆向,没有具体的反应对应起来;1年前查看全部
- (2010•通州区模拟)火山爆发喷出的炽热岩浆温度可达1 200℃,岩浆流入海水中产生了大量的“白气”,如图所
 (2010•通州区模拟)火山爆发喷出的炽热岩浆温度可达1 200℃,岩浆流入海水中产生了大量的“白气”,如图所示.关于这些“白气”的形成是( )
(2010•通州区模拟)火山爆发喷出的炽热岩浆温度可达1 200℃,岩浆流入海水中产生了大量的“白气”,如图所示.关于这些“白气”的形成是( )
A.空气中的水蒸气
B.海水遇到炽热的岩浆汽化形成的水蒸气
C.海水遇到炽热岩浆汽化形成的高温水蒸气,在上升过程又遇到低温的空气液化形成的小水滴聚集在一起形成的
D.空气中的水蒸气遇到高温岩浆液化形成的小水滴聚集在一起形成的 尘风881年前1
尘风881年前1 -
 蝴蝶结123 共回答了18个问题
蝴蝶结123 共回答了18个问题 |采纳率88.9%解题思路:要解答本题需掌握:液化是物质由气态变为液态,以及汽化是由液态变为气态.火山爆发喷出的炽热岩浆温度可达1 200℃,岩浆使海水冒出了大量“白气”;
这主要是火山爆发喷出的炽热岩浆使海水中的水先汽化,汽化后的水蒸气到空中又液化成小水滴.
故选C.点评:
本题考点: 液化及液化现象;汽化及汽化吸热的特点.
考点点评: 本题主要考查学生对:液化和汽化现象的了解和掌握.特别注意“白气”是液态的小液滴.1年前查看全部
- 热电偶E(200℃,
 yanzi8851年前1
yanzi8851年前1 -
 青阳后 共回答了18个问题
青阳后 共回答了18个问题 |采纳率94.4%热电偶E(200℃,100℃)的含义:
热电偶分度号是“E”,材质是由“镍铬-康铜”组成2极
热电偶的热端温度是200℃,冷端温度是100℃1年前查看全部
- 谁知道 二氧化硅和灰尘、烟尘的湿度、烟气的成分、200℃时排烟量为 这些词用英文怎么翻译 急用 谢谢
 chrisxue1年前1
chrisxue1年前1 -
 Satan小虾米 共回答了25个问题
Satan小虾米 共回答了25个问题 |采纳率88%二氧化硅 - silica
灰尘 - dust
湿度 - humidity
成分 - composition
200℃时排烟量为 - amount of exhaustion at 200℃ is1年前查看全部
- 标准大气压、20℃时干空气体积为1立方,温度上升至200℃气压上升至1.5mpa时干空气体积是多少,公式是什么
 -中中-1年前2
-中中-1年前2 -
 sgylln 共回答了19个问题
sgylln 共回答了19个问题 |采纳率89.5%pV=nRT
p为压强,千帕
V为体积,升
n为物质的量,
R为8.314
T为温度,开尔文(绝对温度)1年前查看全部
- 玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
A. 玻璃变大了
B. 玻璃是晶体
C. 玻璃是非晶体
D. 玻璃难熔化 给我的快乐幸福1年前4
给我的快乐幸福1年前4 -
 maomaosi 共回答了19个问题
maomaosi 共回答了19个问题 |采纳率100%解题思路:根据我们对晶体和非晶体熔化过程的了解来作答.常见的晶体有各种金属,海波,冰;常见的非晶体有石蜡,玻璃,沥青,松香.晶体有一定的熔化温度,在熔化的过程中虽然吸热但温度是不变的;非晶体没有一定的熔化温度,在熔化时吸热升温.玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,说明玻璃熔化时温度不断上升,没有固定的熔点,故玻璃是非晶体.
故选C.点评:
本题考点: 晶体和非晶体的区别.
考点点评: 本题考查了晶体和非晶体的区别:晶体和非晶体的区别是晶体有确定的熔点和凝固点,而非晶体没有.难度不大,是一道热学的基础题.1年前查看全部
- 在2L的密闭容器中,200℃时放入6molA气体和4molB气体,发生反应2A(g)+B(g)========C(g),
在2L的密闭容器中,200℃时放入6molA气体和4molB气体,发生反应2A(g)+B(g)========C(g),3秒后,反应达到平衡状态,这是能测得C气体为2.7mol,计算
(1)达到平衡时,A的转化率
(2)以A表示的反应速率
(3)平衡时B的浓度
呃...... 宁缺毋滥1年前1
宁缺毋滥1年前1 -
 世界是如此的暄哗 共回答了17个问题
世界是如此的暄哗 共回答了17个问题 |采纳率82.4%2A + B=========C
n 初 A:6 B:4 C:0
变 A:5.4 B:2.7 C:2.7
平 A:0.6 B:1.3 C:2.7
A的转化率:5.4mol/6mol=90%
v=5.4mol/3s=1.8mol/s
c(B)=1.3mol1年前查看全部
- (6分)按要求回答下列问题:(1)已知在200℃,101kPa时,H 2 与碘蒸气作用生成1mol HI放出7.45kJ
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H 2 与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:其中最适宜作为储能介质的是 。(选填物质序号)序号 盐 熔点/℃ 熔化热/ 
参考价格/ 
① CaCl 2 ·6H 2 O 29.0 37.3 780~850 ② Na 2 SO 4 ·10H 2 O 32.4 77.0 800~900 ③ Na 2 HPO 4 ·12H 2 O 36.1 100.1 1800~2400 ④ Na 2 SiO 3 ·5H 2 O 52.5 49.7 1400~1800
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:
 cydlq1年前1
cydlq1年前1 -
 被判无gg 共回答了16个问题
被判无gg 共回答了16个问题 |采纳率93.8%1年前查看全部
- (2014•宜昌模拟)在2L的密闭容器中发生反应xA(g)+yB(g)⇌zC(g).图甲表示200℃时容器中A、B、C物
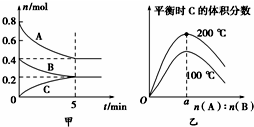 (2014•宜昌模拟)在2L的密闭容器中发生反应xA(g)+yB(g)⇌zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
(2014•宜昌模拟)在2L的密闭容器中发生反应xA(g)+yB(g)⇌zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)⇌zC(g)的△H<0,且a=2 mingchenzs1年前0
mingchenzs1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一定质量的理想气体,温度为100℃时压强为P,保持体积不变,使其温度从100℃升高到200℃,则其压强变为.(填选项前的
一定质量的理想气体,温度为100℃时压强为P,保持体积不变,使其温度从100℃升高到200℃,则其压强变为.(填选项前的字母)( ) A.2P B.
P473 373 C.
P100 273 D.
P100 373  贼贼地坏1年前1
贼贼地坏1年前1 -
 SleepBear007 共回答了14个问题
SleepBear007 共回答了14个问题 |采纳率100%由题意知,T 1 =273+100=373K,T 2 =273+200=473k,
气体发生等容变化,由查理定律可得:
P 1
T 1 =
P 2
T 2 ,即:
P
373K =
P 2
473K ,P 2 =
473
373 P;
故选B.1年前查看全部
- 已知反应:(反应见图片).在密闭容器中,放入碳酸氢铵和氢氧化钠的混合物共a克,将容器加热至200℃,经充分反应排除气体,
已知反应:(反应见图片).在密闭容器中,放入碳酸氢铵和氢氧化钠的混合物共a克,将容器加热至200℃,经充分反应排除气体,得剩余b克,求碳酸氢铵和氢氧化钠的质量
化学方程式:见图片
 wangjh9121年前1
wangjh9121年前1 -
 想了老半天 共回答了16个问题
想了老半天 共回答了16个问题 |采纳率87.5%200℃时,水处于气态,也被排出
所以b克即为Na2CO3的质量
Na2CO3相对分子质量:106——对应b克
那么2NaOH(80)——对应40b/53克
(NH4)2CO3就是(a-40b/53)克
希望我的回答对你有帮助,采纳吧O(∩_∩)O!1年前查看全部
- 把500g的金属块投入质量为1kg,温度为30℃的水中,水温升高到51℃,金属块温度从251℃降低了200℃,求金属块的
把500g的金属块投入质量为1kg,温度为30℃的水中,水温升高到51℃,金属块温度从251℃降低了200℃,求金属块的比热容,并判断该金属是何中物质.(不计热量损失)
 dog991年前1
dog991年前1 -
 月八 共回答了20个问题
月八 共回答了20个问题 |采纳率85%不计热量损失,则金属块放出的热量=水吸收的热量
Q放=Q吸
C金m金△t金=C水m水△t水
C金=C水m水△t水/(m金△t金)=4200J/(Kg℃)×1Kg×(51℃-30℃)/(0.5Kg×200℃)=882J/(Kg℃)
所以可能是铝1年前查看全部
- 小明的妈妈用食用油炸油条时,油的温度约为200℃.她不小心把几滴水溅到了油锅里,出现了“油花四溅”的现象.请解释这个现象
小明的妈妈用食用油炸油条时,油的温度约为200℃.她不小心把几滴水溅到了油锅里,出现了“油花四溅”的现象.请解释这个现象.
 借吻念旧1年前1
借吻念旧1年前1 -
 秋天割麦子 共回答了19个问题
秋天割麦子 共回答了19个问题 |采纳率94.7%解题思路:知道水的密度比油大,所以水会沉入水底;水的沸点比热油的温度低,所以会发生沸腾现象,据此分析回答.答:溅入油里的水滴,到达油面时有一定的速度,水的密度比油大,水要继续向下运动.由于油的温度远高于水的沸点,水滴向下运动过程中快速汽化,产生高压气泡,气泡迅速膨胀破裂把油溅起来.
点评:
本题考点: 沸点及沸点与气压的关系.
考点点评: 本题考查了生活中常见的物理现象,体现了物理和生活的联系,平时学习要注意多观察多思考.1年前查看全部
- 某物体从200℃开始熔化,直到250℃还未熔化完,则这种物质一定是______.(填“晶体”或“非晶体”)
 BOBO水楼唯一粉头1年前4
BOBO水楼唯一粉头1年前4 -
 月滑衫23 共回答了28个问题
月滑衫23 共回答了28个问题 |采纳率89.3%解题思路:固体有两种:一种是晶体另一种是非晶体.晶体有固定的熔点和凝固点,而非晶体则没有固定的熔点和凝固点.该物质在200℃开始熔化,直到250℃还未熔化完,说明该物质熔化过程吸收热量温度不断升高,没有一定的熔化温度,即没有熔点,所以这种物质一定是非晶体.
故答案为:非晶体.点评:
本题考点: 晶体和非晶体的区别.
考点点评: 本题考查了晶体和非晶体的区别:晶体有固定的熔点和凝固点,非晶体没有固定的熔点和凝固点.1年前查看全部
- 玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
A. 玻璃变大了
B. 玻璃是晶体
C. 玻璃是非晶体
D. 玻璃难熔化 amyslh1年前1
amyslh1年前1 -
 晓风残月阳 共回答了14个问题
晓风残月阳 共回答了14个问题 |采纳率92.9%解题思路:根据我们对晶体和非晶体熔化过程的了解来作答.常见的晶体有各种金属,海波,冰;常见的非晶体有石蜡,玻璃,沥青,松香.晶体有一定的熔化温度,在熔化的过程中虽然吸热但温度是不变的;非晶体没有一定的熔化温度,在熔化时吸热升温.玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,说明玻璃熔化时温度不断上升,没有固定的熔点,故玻璃是非晶体.
故选C.点评:
本题考点: 晶体和非晶体的区别.
考点点评: 本题考查了晶体和非晶体的区别:晶体和非晶体的区别是晶体有确定的熔点和凝固点,而非晶体没有.难度不大,是一道热学的基础题.1年前查看全部
- 在200℃时将11.6克CO2和水蒸气的混合气体通过足量的Na2O2,反应完全后,固体质量增加3.6克,求混合气体的平均
在200℃时将11.6克CO2和水蒸气的混合气体通过足量的Na2O2,反应完全后,固体质量增加3.6克,求混合气体的平均相对分子质量.如果设混合气体中 CO2和水蒸气的物质的量分别为X和Y.那么为什么 28×X+2×Y=3.6克 说下原因啊
 aucdca1年前1
aucdca1年前1 -
 potatodyy 共回答了23个问题
potatodyy 共回答了23个问题 |采纳率91.3%CO2~0.5O2
X CO2中的一个O到氧气中去,还有剩下的CO部分进入溶液,故增加28X克
H20~0.5O2
Y H2O中的一个O同样进入氧气,两个H进入溶液,故增加了2Y克1年前查看全部
- 在200℃时将11.6克CO2和H2O的混合气体通过足量的Na2O2,反映完全后,固体质量增加3.6克,求混合气体的平均
在200℃时将11.6克CO2和H2O的混合气体通过足量的Na2O2,反映完全后,固体质量增加3.6克,求混合气体的平均相对分子质量?设CO2Xmol H2O Ymol为什么答案解析上写着CO2~1/2O2,这不是不能写分数吗?以及为什么28X+2Y=3.6克
 半瓶醋_不晃1年前1
半瓶醋_不晃1年前1 -
 lilb_001 共回答了19个问题
lilb_001 共回答了19个问题 |采纳率94.7%没两个二氧化碳分子可以置换出一个氧气分子,所以每个二氧化碳分子可以置换出半个氧气分子,在解题过程中可以出现分数系数,热能方程式里也可以出现分数系数,所以解析真么写诗可以的.
再说解这道题:
2co2+2Na2O2= 2NaCO3+ O2 前后固体质量的差是 过氧化钠的分子量和碳酸钠的差,又因为每一摩尔二氧化碳需要一摩尔的过氧化钠,所以是由于二氧化碳增加的质量是28x,同理可得由于水增加的质量是2y,再根据一共有11.6g的水和二氧化碳,可以得到一个二元方程组,解得即为答案1年前查看全部
- 同样是Q235B材料制作的反应釜,蒸汽温度为150℃,和蒸汽温度为200℃对反应釜的影响大吗?不计算压力,设计压力0.5
同样是Q235B材料制作的反应釜,蒸汽温度为150℃,和蒸汽温度为200℃对反应釜的影响大吗?不计算压力,设计压力0.5MPa,肯定是够用的.请说明原因或者相关文献出处
 轻听花物语1年前3
轻听花物语1年前3 -
 肩膀疼 共回答了11个问题
肩膀疼 共回答了11个问题 |采纳率100%我是做退火窑的我们500度以上采用不锈钢,一下都用碳钢,没有问题的1年前查看全部
- (2013•本溪一模)锡、铅的熔点分别是232℃和327℃.焊锡是锡铅合金,焊锡的熔点小于200℃,把铅加入锡中制成合金
(2013•本溪一模)锡、铅的熔点分别是232℃和327℃.焊锡是锡铅合金,焊锡的熔点小于200℃,把铅加入锡中制成合金的主要目的是( )
A.增加强度
B.降低熔点
C.增加延展性
D.增强耐磨性 妄想mm1年前1
妄想mm1年前1 -
 寂默莲 共回答了15个问题
寂默莲 共回答了15个问题 |采纳率80%解题思路:A、合金的强度一般要比组成它们的纯金属要大;
B、合金的熔点一般要比组成它们的纯金属要低;
C、合金的延展性一般要比组成它们的纯金属要更高;
D、合金的抗腐蚀性能一般要比组成它们的纯金属强.最先熔化的应该是熔点最低的,根据分析焊锡是锡铅合金,其熔点低更适合做焊接金属用的焊锡,符合人们的需求根据题干知,焊锡是合金,根据合金的特性知道合金的熔点一般要比其组分低,焊锡的熔点要低于锡和铅,所以在焊接金属时,为节约时间,节约能源、节约成本采用锡铅合金.
故选B点评:
本题考点: 合金与合金的性质.
考点点评: 本题主要考查了合金的特性,合金的强度高、抗腐蚀是材料所需要的,合金的熔点比组分低便于加工制作,因此合金在生活中运用很广泛.1年前查看全部
- 压力0.648MP温度200℃蒸汽的密度是多少
 29660281年前2
29660281年前2 -
 ppgoeson 共回答了15个问题
ppgoeson 共回答了15个问题 |采纳率80%ol=pM/RT
p=0.648e6
M=18e-3
R=8.314
T=200+273.2=473.2
以上取国际单位
带入密度rol=2.96kg/m^31年前查看全部
- 在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V
在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)⇌2HI(g).
(1)反应刚开始时,由于c(H2)=[a/V]mol/L[a/V]mol/L,c(I2)=[a/V]mol/L[a/V]mol/L,而c(HI)=______,所以化学反应速率______最大而______最小(为零)(填“v正”或“v逆”).
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)______,c(I2)______,而c(HI)______,从而化学反应速率v正______,而v逆______ (填“增大”、“减小”或“不变”).
(3)当反应进行到v正与v逆______时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将______.
(4)若将1molH2和1molI2(g)充入一密闭容器中,则下列状态属于平衡状态的是______
A.混合气体的体积等于最初体积一半的状态
B.H2、I2、HI总物质的量不随时间延长而改变的状态
C.混合气体的颜色不随时间延长而改变的状态
D.单位时间内有0.5molHI分解的同时,有0.25molH2生成的状态
E.混合气体的密度不随时间延长而改变的状态. 择波1年前1
择波1年前1 -
 jarkmary 共回答了11个问题
jarkmary 共回答了11个问题 |采纳率90.9%解题思路:(1)根据公式c=[n/V]来计算各物质的浓度,开始阶段反应正向进行达平衡状态;
(2)开始阶段反应正向进行,反应物浓度减小,生成物浓度增大,直到达平衡状态,正逆速率相等;
(3)可逆反应就达到的最大限度是达平衡状态,正逆速率相等;平衡状态时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将保持不变;
(4)平衡状态时,各组分的浓度保持不变,正逆反应速率相等,检查判断.(1)根据公式c=nV可以计算出C(H2)=aVmol/L,C(I2)=bVmol/L,C(HI)=0,开始阶段反应正向进行,ν(正)最大,ν(逆)=0,故答案为:aVmol/L; bVmol/L;0;ν(正); ν(逆);(2)随着反应的进行,反应物...
点评:
本题考点: 化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查学生化学平衡状态的建立、平衡移动以及化学平衡状态的特征,可以根据所学知识进行回答,难度不大.1年前查看全部
- 常温下都为气态的混合气体,由分子内相同的碳原子数的烯烃和炔烃组成.将它们与过量氧气混合加热到200℃,充分燃烧后,再依次
常温下都为气态的混合气体,由分子内相同的碳原子数的烯烃和炔烃组成.将它们与过量氧气混合加热到200℃,充分燃烧后,再依次通过浓硫酸和碱石灰,分别减少7体积和10体积(相同条件下).试分析原混合气体的可能组成和体积比
 licheng12111年前1
licheng12111年前1 -
 胡盼 共回答了16个问题
胡盼 共回答了16个问题 |采纳率81.3%浓硫酸只吸收H2O,碱石灰吸收CO2.
所以H2O与CO2物质的量比为7/10 = 7 / 10
即有混合气体中H和C物质的量比为7:5 = 1.4
常温下都为气态,故C原子数不多于4
所以应该为C2H4与C2H2,或者C3H6与C3H4.
体积比分别为(1.4-1) / (2-1.4) = 2:3
和(1.4 - 4/3) / (2 - 1.4) = 1:91年前查看全部
- ( )Bake them in the hot oven __ 20 minutes __200℃.A.at at B.
( )Bake them in the hot oven __ 20 minutes __200℃.A.at at B.for for C.for at D.at for
 从流浪到流浪1年前1
从流浪到流浪1年前1 -
 kxz20 共回答了11个问题
kxz20 共回答了11个问题 |采纳率90.9%C1年前查看全部
- 物理化学题五氯化磷分解反应 PCl5(g)=PCl3(g)+Cl2(g)在200℃时的Kθ=0.312,计算:1) 20
物理化学题
五氯化磷分解反应
PCl5(g)=PCl3(g)+Cl2(g)
在200℃时的Kθ=0.312,计算:
1) 200℃时,200kPa下PCl5的解离度;
2) 摩尔比为1:5的PCl5与Cl2的混合物,在200℃,101.325kPa下,求达到化学平衡时PCl5的解离度.
注:上面 "PCl5""PCl3""Cl2"中的"5""3""2"都是下标;"Kθ"中的"θ"是上标.由于我不知道怎么打成上标和下标...所以...
反应式中的“=”是个双箭头符号,表示反应可逆。依然是由于我打不出这个符号,因此...
第一个问的答案是 36.7%,第二个问的答案是 26.8%。我需要的是计算过程... 2766232741年前1
2766232741年前1 -
 lxl8883 共回答了11个问题
lxl8883 共回答了11个问题 |采纳率72.7%1年前查看全部
- 热电偶试题!简述一下热电偶的热电势(200℃,100℃)表示意义.
 乐天0001年前1
乐天0001年前1 -
 mhtdh 共回答了14个问题
mhtdh 共回答了14个问题 |采纳率71.4%热电偶的热电势(200℃,100℃)表示的意义是:热电偶工作端温度是200℃,而冷端温度是100℃时所产生的热电势.1年前查看全部
- 200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体的质量增加了3.6g.从以上信息中,我们
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体的质量增加了3.6g.从以上信息中,我们得出的以下结论不正确的是( )
A 可以计算出混合气体中二氧化碳和水蒸气的质量
B 可以判断出混合气体的平均摩尔质量
C 可以计算出该反应中转移的电子数
D 可以总结出过氧化钠在任何反应中既作氧化剂也作还原剂 我来说一句吧1年前3
我来说一句吧1年前3 -
 萌萌lolo 共回答了12个问题
萌萌lolo 共回答了12个问题 |采纳率100%选D
设含xmolCO2,ymolH2O
2CO2+2Na2O2=2Na2CO3+O2 固体质量增加 转移的电子数
2mol 56g 2mol
xmol 28xg xmol
2H2O+2Na2O2=4NaOH+O2 固体质量增加 转移的电子数
2mol 4g 2mol
ymol 2yg ymol
依题意有
44*x+18y=11.6
28x+2y=3.6
联立解得
x=0.1
y=0.4
所以A; m(CO2)=0.1*44=4.4g,m(H2O)=0.4*18=7.2g
B M(平均)=11.6/(0.1+0.4)=23.2
C 转移电子数=x+y=0.5
D错误 如果和SO2反应它只作氧化剂1年前查看全部
- 25℃水加热到200℃饱和蒸汽,物理计算公式是怎么样的
25℃水加热到200℃饱和蒸汽,物理计算公式是怎么样的
200℃饱和蒸汽压力有没有关系
如果是25℃水常压下,加热到200℃蒸汽,压力为0.4MPa,蒸汽变化为等容, 冰封之泪1年前2
冰封之泪1年前2 -
 liuddxxx 共回答了19个问题
liuddxxx 共回答了19个问题 |采纳率94.7%计算水从25度到100度所吸收的热量,加上水的汽化潜热,再加上100度到200度的气体等压吸热过程.
要考虑气压的,如果题目没有提示的话,一般是指一个大气压吧.
因为气压的不同,沸点也不一样.气体吸热膨胀还是不膨胀,对于需要的热量也是不同的.1年前查看全部
- 200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6g,求原混合
200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6g,求原混合气体中CO2和水蒸气的质量比______.
 微风伴细雨1年前1
微风伴细雨1年前1 -
 鲜衣 共回答了21个问题
鲜衣 共回答了21个问题 |采纳率90.5%解题思路:向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=0.25mol,令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算.向足量的固体Na2O2中通入11.6gCO2和H2O,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=0.25mol,
令混合物中CO2和水蒸气的物质的量分别为xmol,ymol,则:
2Na2O2+2CO2=2Na2CO3+O2,
x 0.5x
2Na2O2+2H2O=4NaOH+O2↑
ymol0.5ymol
所以
0.5x+0.5y=0.25
44x+18y=11.6
解得:x=0.1mol,y=0.4mol
故原混合物中CO2和水蒸气的质量比为(0.1×44):(0.4×18)=11:18,
答:故原混合物中CO2和水蒸气的质量比为11:18.点评:
本题考点: 钠的重要化合物;有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算、过氧化钠的性质等,注意理解固体质量变化的原因,根据反应的方程式计算,难度中等.1年前查看全部
- 200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g.
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g.
求其原混合物中CO2和H2O的物质的量之比.
我有个疑问:2Na2O2+2H2O==4NaOH+O2.生成的NaOH不是会和CO2反应吗?生成的Na2CO3又会和H20,CO2反应生成NaHCO3.那这么多未知数怎么求解? yueerliu1年前3
yueerliu1年前3 -
 幸福的哲学 共回答了17个问题
幸福的哲学 共回答了17个问题 |采纳率100%我们只考虑固体质量的增加,如果是CO2反应,进去一个CO2,出来一个O原子,固体增加CO
如果是H2O进去,进去一个H2O,出来一个O.
另,因为是足量的Na2O2,所以H2O和CO2优先于足量的Na2O2反应,是不会和NAOH反应的,不然这题也没法做了1年前查看全部
- 新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全。已知电池总反
新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全。已知电池总反应式为C 2 H 5 OH+3O 2 →2CO 2 +3H 2 O。下列说法不正确的是 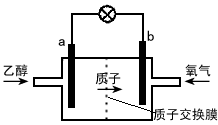 [ ]
[ ]A.a极为电池的负极,该电极发生氧化反应
B.电池工作时电流由b极沿导线经灯泡到a极
C.电池正极的电极反应式为O 2 +2H 2 O+4e - →4OH -
D.电池工作时,1mol乙醇被氧化转移12mol电子 xdict20061年前1
xdict20061年前1 -
 stapchyjh 共回答了19个问题
stapchyjh 共回答了19个问题 |采纳率78.9%C1年前查看全部
- .一个真空密闭容器中盛有1mol PCl5,加热到200℃时发生了反应:PCl5(g)= PCl3(g)+Cl2(g),
.一个真空密闭容器中盛有1mol PCl5,加热到200℃时发生了反应:PCl5(g)= PCl3(g)+Cl2(g),反应
反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%.M与N的关系是( ) wanjun56171年前2
wanjun56171年前2 -
 jinghe300 共回答了17个问题
jinghe300 共回答了17个问题 |采纳率100%m大于n 和化学平衡有关1年前查看全部
- 铜化学镀锡层经200℃烘烤后发黑是什么原因
铜化学镀锡层经200℃烘烤后发黑是什么原因
烘烤时间是1h 没有泪光1年前3
没有泪光1年前3 -
 Ale_Del_Piero 共回答了21个问题
Ale_Del_Piero 共回答了21个问题 |采纳率100%铜外的镀锡层由于在空气中烘烤转变为SnO(一氧化锡),为黑色或棕黑色.在空气中较稳定.继续加热一段时间后变为SnO2(氧化锡).为白色立方晶体.
你遇到的现象估计是初步烘烤后的SnO.1年前查看全部
- 铜的比热容为0.39×103J/(kg•℃).质量为20kg的铜块,吸收7.8×105J的热量后,温度升高至200℃,求
铜的比热容为0.39×103J/(kg•℃).质量为20kg的铜块,吸收7.8×105J的热量后,温度升高至200℃,求该铜块原来的温度为多少.
 我就是zz1年前1
我就是zz1年前1 -
 胡一牛 共回答了14个问题
胡一牛 共回答了14个问题 |采纳率85.7%解题思路:已知比热容、质量、吸收的热量,由热量公式可以求出铜升高的温度,然后求出铜的初温度.∵Q=cm△t,
∴铜块升高的温度:
△t=[Q/cm]=
7.8×105J
0.39×103J/(kg•℃)×20kg=100℃,
铜块原来的温度:
t0=t-△t=200℃-100℃=100℃;
答:该铜块原来的温度为100℃.点评:
本题考点: 热量的计算.
考点点评: 本题考查了求铜块的初温度,应用热量公式即可正确解题.1年前查看全部
- (2009•乐山一模)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体.有关的转换关系如下图
(2009•乐山一模)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体.有关的转换关系如下图所示,C是一种非极性分子.图中部分反应条件及生成物没有列出.请按要求填空:

(1)单质J的化学式______,E的分子式______;
(2)写出B和F反应的化学方程式4NH3+5O2
4NO+6H2O催化剂 .△ 4NH3+5O2,D和Na2O2反应的化学方程式______;
4NO+6H2O催化剂 .△
(3)写出K和I的稀溶液反应的离子方程式______
(4)A的分子式为______. daneil9961年前1
daneil9961年前1 -
 脱水蔬菜 共回答了19个问题
脱水蔬菜 共回答了19个问题 |采纳率89.5%解题思路:C是一种非极性分子且能与过氧化钠反应,应为CO2,则F为O2,B可与氧气在催化剂条件下加热反应,则应为NH3,G为NO,H为NO2,I为HNO3,D为H2O,与J在高温下反应,
J为Fe,K为Fe3O4,L为Fe(NO3)3,E可与反应生成Fe和CO2,则E具有还原性,应为CO,晶体A隔绝空气加热到200°C时,全部分解为B、C、G、E四种气体,且其物质的量相等,则A应为NH4HC2O4,结合对应物质的性质以及题目要求解答该题.C是一种非极性分子且能与过氧化钠反应,应为CO2,则F为O2,B可与氧气在催化剂条件下加热反应,则应为NH3,G为NO,H为NO2,I为HNO3,D为H2O,与J在高温下反应,J为Fe,K为Fe3O4,L为Fe(NO3)3,E可与反应生成Fe和CO2,则E具有还原性,应为CO,晶体A隔绝空气加热到200°C时,全部分解为B、C、G、E四种气体,且其物质的量相等,则A应为NH4HC2O4,
(1)由以上分析可知J为Fe,E为CO,故答案为:Fe;CO;
(2)B和F反应的化学方程式为4NH3+5O2
催化剂
.
△4NO+6H2O,D和Na2O2反应的化学方程式为2H2O+2Na2O2=4NaOH+O2↑,
故答案为:4NH3+5O2
催化剂
.
△4NO+6H2O;2H2O+2Na2O2=4NaOH+O2↑;
(3)Fe3O4与稀硝酸反应的离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(4)由以上分析可知A为NH4HC2O4,故答案为:NH4HC2O4.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合运用,注意本题可根据物质的颜色、状态为突破口进行推断,明确物质的种类为解答该题的关键,难度不大.1年前查看全部
- 200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比.

 风月2441年前1
风月2441年前1 -
 倩SIR 共回答了14个问题
倩SIR 共回答了14个问题 |采纳率85.7%解题思路:向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=[8g/32g/mol]=0.25mol,令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算.向足量的固体Na2O2中通入11.6gCO2和H2O,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=[8g/32g/mol]=0.25mol,
令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,则:
2Na2O2+2CO2=2Na2CO3+O2,
xmol0.5xmol
2Na2O2+2H2O=4NaOH+O2↑
ymol0.5ymol
所以
0.5x+0.5y=0.25
44x+18y=11.6
解得:x=0.1,y=0.4
故原混合物中CO2和H2O的物质的量比为0.1mol:0.4mol=1:4,
答:原混合物中CO2和H2O的物质的量比为1:4.点评:
本题考点: 有关混合物反应的计算;钠的重要化合物.
考点点评: 本题考查混合物的有关计算、过氧化钠的性质等,注意理解固体质量变化的原因,根据反应的方程式计算,难度中等.1年前查看全部
- 200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对
200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对分子质量为?
 comtoy1年前1
comtoy1年前1 -
 uu小漠 共回答了14个问题
uu小漠 共回答了14个问题 |采纳率92.9%解题思路:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=[n/M]计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=[8g/32g/mol]=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:[11.6g/0.5mol]=23.2g/mol,故混合气体的平均相对分子质量为23.2,
答:原混合气体的平均相对分子质量为23.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.1年前查看全部
- 200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6g,求原混合
200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6g,求原混合气体中CO2和水蒸气的质量比______.
 你搞什么啊1年前3
你搞什么啊1年前3 -
 说明白一点 共回答了17个问题
说明白一点 共回答了17个问题 |采纳率88.2%解题思路:向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=0.25mol,令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算.向足量的固体Na2O2中通入11.6gCO2和H2O,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=0.25mol,
令混合物中CO2和水蒸气的物质的量分别为xmol,ymol,则:
2Na2O2+2CO2=2Na2CO3+O2,
x 0.5x
2Na2O2+2H2O=4NaOH+O2↑
ymol0.5ymol
所以
0.5x+0.5y=0.25
44x+18y=11.6
解得:x=0.1mol,y=0.4mol
故原混合物中CO2和水蒸气的质量比为(0.1×44):(0.4×18)=11:18,
答:故原混合物中CO2和水蒸气的质量比为11:18.点评:
本题考点: 钠的重要化合物;有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算、过氧化钠的性质等,注意理解固体质量变化的原因,根据反应的方程式计算,难度中等.1年前查看全部
- E211048 AWM STYLE 1330 18AWG 200℃ 600V FEP VW-1 QIFURVI 2217
E211048 AWM STYLE 1330 18AWG 200℃ 600V FEP VW-1 QIFURVI 221756 CAS AWM 1A 200℃ 600V FT2 电线意思
请问电线上面印有上述文字,每个词语都代表什么意思, 海没天1年前1
海没天1年前1 -
 QRPUJQD 共回答了16个问题
QRPUJQD 共回答了16个问题 |采纳率93.8%E211048
℃-------额定温度
V--------额定电压
x09VW-1-----UL垂直燃烧试验
x09FT-1-----CSA垂直燃烧试验
FT-2 -----FT2水平燃烧试验
AWM------Appliance Wiring Material内部用电器用线,简称为AWM.
LF-------环保电线标准,低铅低镉,符舍欧共体环保要求.
FEP------聚四氟乙烯材质.1年前查看全部
- 200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对
200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对分子质量为?
 0320132101年前1
0320132101年前1 -
 xuyafei8283 共回答了21个问题
xuyafei8283 共回答了21个问题 |采纳率90.5%解题思路:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=[n/M]计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=[8g/32g/mol]=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:[11.6g/0.5mol]=23.2g/mol,故混合气体的平均相对分子质量为23.2,
答:原混合气体的平均相对分子质量为23.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.1年前查看全部
- 200℃时,11.6gCO2和水蒸气的混合气体与足量Na2O2充分反应后,固体增加了3.6g
200℃时,11.6gCO2和水蒸气的混合气体与足量Na2O2充分反应后,固体增加了3.6g
则原混合气体的平均分子量是多少? sun17311年前1
sun17311年前1 -
 疯中的臭虫 共回答了19个问题
疯中的臭虫 共回答了19个问题 |采纳率94.7%设混合气体中CO2和H2O的质量分别为X和Y,造成固体质量增加分别为M1和M2
2CO2+2Na2O2===2Na2CO3+O2-------固体质量增加
88---------------------32----------88-32=56
X---------------------------------------M1
2H2O+2Na2O2====4NaOH+O2----------固体质量增加
36--------------------32---------------4
Y--------------------------------------M2
X*56====M1*88----------(1)
Y*4====M2*36------------(2)
X+Y====11.6-------------(3)
M1+M2====3.6-------------(4)
解以上方程组就解出答案了.1年前查看全部
- 将2.0克某纯净固体A加热到200℃,完全分解后得到两种产物.气态
将2.0克某纯净固体A加热到200℃,完全分解后得到两种产物.气态
氧化物B和0.90克水蒸气.这两种气体混合物的总体积为1.68L(已折算成标
准状况).试通过计算推断固体A的分子式. aline_4121年前1
aline_4121年前1 -
 karen777_17 共回答了19个问题
karen777_17 共回答了19个问题 |采纳率89.5%0.9gH2O为0.9/18=0.05mol
STP下体积为0.05*22.4=1.12L
因此B的体积为1.68-1.12=0.56L
也就是B为0.56/22.4=0.025mol
B的质量为2-0.9=1.1g
所以B的摩尔质量为1.1/0.025=44g/mol
所以B为CO2或者N2O
可以看到分解的得到的n(CO2/N2O):n(H2O)=1:2
所以为A=加热=CO2/N2O+2H2O
所以A为H4CO4/N2H4O2,即C(OH)4或者NH4NO3
难道是原碳酸?
应该还是选NH4NO3,硝酸铵比较好.1年前查看全部
- 已知铝的比热容为0.88×103J/( kg•℃).有一初温200℃、质量为1kg的铝块,在温度降低50℃的过程中,放出
已知铝的比热容为0.88×103J/( kg•℃).有一初温200℃、质量为1kg的铝块,在温度降低50℃的过程中,放出的热量是______J.生活中我们经常看到司机往汽车发动机的水箱里灌水,这是因为水的______大,所以在相同条件下水能带走较多的热量,冷却效果好.
 毅天毅点爱恋1年前1
毅天毅点爱恋1年前1 -
 jianbing2005 共回答了16个问题
jianbing2005 共回答了16个问题 |采纳率93.8%解题思路:(1)知道铝块的质量、铝的比热容、铝的温度降低值,利用放热公式Q放=cm△t求铝块放出的热量.
(2)因水的比热容比其它物质的比热容大,所以相同质量的水和其它物质比较,升高或降低相同的温度,水吸收或放出的热量多,据此分析.(1)1kg的铝温度降低50℃放出的热量:
Q放=cm△t=0.88×103J/(kg•℃)×1kg×50℃=4.4×104J;
(2)因为水的比热容较大,相同质量的水和其它物质比较,升高相同的温度,水吸收的热量多,所以用水冷却发动机,冷却效果好.
故答案为:4.4×104;比热容.点评:
本题考点: 热量的计算;水的比热容的特点及应用.
考点点评: 本题主要考查了学生对放出热量公式的理解和对水的比热容大的特点及应用的掌握,注意在相同的m、△t条件下,c越大的Q越大.只要记住有关公式解答并不难.1年前查看全部
- 200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6g,求原混合气体中CO
200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6g,求原混合气体中CO2和水蒸气的质量比______.
 joey12211年前1
joey12211年前1 -
 我爱沙田柚 共回答了14个问题
我爱沙田柚 共回答了14个问题 |采纳率78.6%解题思路:向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=0.25mol,令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算.向足量的固体Na2O2中通入11.6gCO2和H2O,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=0.25mol,
令混合物中CO2和水蒸气的物质的量分别为xmol,ymol,则:
2Na2O2+2CO2=2Na2CO3+O2,
x 0.5x
2Na2O2+2H2O=4NaOH+O2↑
ymol0.5ymol
所以
0.5x+0.5y=0.25
44x+18y=11.6
解得:x=0.1mol,y=0.4mol
故原混合物中CO2和水蒸气的质量比为(0.1×44):(0.4×18)=11:18,
答:故原混合物中CO2和水蒸气的质量比为11:18.点评:
本题考点: 钠的重要化合物;有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算、过氧化钠的性质等,注意理解固体质量变化的原因,根据反应的方程式计算,难度中等.1年前查看全部
- 碳铵和消石灰在200℃共热时可发生如下反应 NH 4 HCO 3 +Ca(OH) 2 CaCO 3 +NH 3 ↑+2H
碳铵和消石灰在200℃共热时可发生如下反应 NH 4 HCO 3 +Ca(OH) 2  CaCO 3 +NH 3 ↑+2H 2 O↑
CaCO 3 +NH 3 ↑+2H 2 O↑
NH 4 HCO 3 NH 3 ↑+CO 2 ↑+H 2 O↑。现取碳铵和消石灰的混合物,其中碳酸氢铵的物质的量与混合物总物质的量的比值为x。在密闭容器中加热至200℃,充分反应后排出多余的气体,冷却称量,剩余固体质量为yg。
NH 3 ↑+CO 2 ↑+H 2 O↑。现取碳铵和消石灰的混合物,其中碳酸氢铵的物质的量与混合物总物质的量的比值为x。在密闭容器中加热至200℃,充分反应后排出多余的气体,冷却称量,剩余固体质量为yg。
(1)若碳铵和消石灰的混合物的总量为0.1mol,
①x=0.5时,剩余固体是________,质量是_______g。
(2)若x取不同数值,请以x为横坐标,y为纵坐标,在下图中画出变化的图像。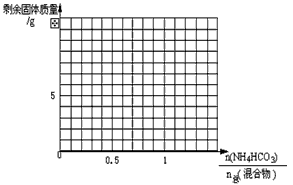
(3)若碳铵和消石灰的混合物的总量为amol,当x取不同值时,y的值是多少?(用含a、x的式子表示)  zhaoxuan19821年前1
zhaoxuan19821年前1 -
 左右互博罗 共回答了19个问题
左右互博罗 共回答了19个问题 |采纳率89.5%(1)碳酸钙;5
(2)“略”
(3)0<x≤0.5,y=74a-48ax;0.5≤x<1,y=100a(1-x)1年前查看全部
- 4千瓦的电热管 每分钟 产生多少热量 在一封闭箱体之内 多长时间到200℃ 我需要公式
4千瓦的电热管 每分钟 产生多少热量 在一封闭箱体之内 多长时间到200℃ 我需要公式
用6根4千瓦的电热管在 2*2*2的封闭箱体内 多长时间到 200℃ wind02201年前1
wind02201年前1 -
 月亮1980 共回答了15个问题
月亮1980 共回答了15个问题 |采纳率86.7%能量守恒 电热管功率*工作时间=箱体体积*温度差*空气的平均比热容1年前查看全部
- (2013•江苏三模)在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示200℃时容器中A
(2013•江苏三模)在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
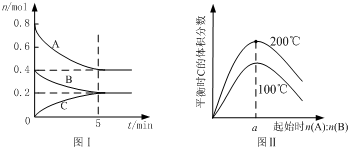
A.200℃时,反应从开始到平衡的平均速率v(B)=0.02 mol•L-1•min-1
B.图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 喜酸1年前1
喜酸1年前1 -
 whydo33 共回答了15个问题
whydo33 共回答了15个问题 |采纳率93.3%解题思路:A.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol-0.2mol,根据v=
计算v(B);△n V △t
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,由图Ⅰ判断200℃时A、B的起始物质的量,据此计算a的值;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移;
D.200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.A.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)
0.2mol
2L
5min=0.02 mol•L-1•min-1,故A正确;
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.8mol-0.4mol=0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,故B错误;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y;z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为[0.4mol/0.4mol+0.2mol+0.2m0l]=0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的增大,故达到平衡时,A 的体积分数小于0.5,故D正确;
故选AD.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素.
考点点评: 本题考查化学平衡图象、反应速率计算、影响化学平衡的因素、化学平衡有关计算等,难度中等,注意B选项中理解稀有气体对化学平衡移动的影响.1年前查看全部
- 【化学竞赛题】在真空容器中,将一种晶体A加热到200℃,产生四种气体,它们的物质的量之比为
【化学竞赛题】在真空容器中,将一种晶体A加热到200℃,产生四种气体,它们的物质的量之比为
在真空容器中,将一种晶体A加热到200℃,产生四种气体,它们的物质的量之比为1:1:1:1,冷却容器0℃时,生成结晶物质B,此时四种气体中有一种没参加反应,该气体相同状态下相对于H2的密度为14,能在空气中燃烧.
①具有与该气体相同质子数的另三种物质的化学式为( )
②A的化学式为( );A的名称为( );B的化学式为( ).
③上述气体中的两种按物质的量之比2:1进行反应生成结晶物质C,物质C在加热脱水时生成何种人们所共识的肥料,它的俗名为( );化学式为( ).
答案是①C2H2、N2、HCN②NH4HC2O4草酸氢铵NH4HCO3③尿素CO(NH2)2 nold1年前1
nold1年前1 -
 猪猪0924 共回答了21个问题
猪猪0924 共回答了21个问题 |采纳率100%据该气体相同状态下相对于H2的密度为14,可知该气体的相对分子质量为:14×2=28,又该气体能在空气中燃烧且是晶体A加热分解的产物,故该气体应为CO,A应为草酸盐且为铵盐(因加热分解的产物全为气体).
则A加热后生成氨气、一氧化碳、二氧化碳、水.故A的化学式为NH4HC2O4
①C的质子数为6、O的质子数为8,两者平均为7,则为N,一C一H的质子数也为7,
故具有与CO相同的质子数的另三种物质的化学式为(CH)2即C2H2、N2、HCN;
②NH4HC2O4草酸氢铵;氨气、水和二氧化碳反应生成B即碳酸氢铵NH4HCO3.
③2NH3+CO2→NH2COONH4
NH2COONH4→CO(NH2)2+H2O
尿素1年前查看全部
- 200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对
200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对分子质量为?
 angelalzn1年前1
angelalzn1年前1 -
 清醒糊涂 共回答了17个问题
清醒糊涂 共回答了17个问题 |采纳率88.2%解题思路:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=[n/M]计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=[8g/32g/mol]=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:[11.6g/0.5mol]=23.2g/mol,故混合气体的平均相对分子质量为23.2,
答:原混合气体的平均相对分子质量为23.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.1年前查看全部
大家在问
- 1一个物体在空中从静止开始下落(不计空气的阻力),如果在下落的过程中物体所受的重力突然消失,该物体将
- 2下列有关铝、铁、铜、银四种金属的共同性质归纳中,不正确的是 [ ] A.
- 3初中英语造句not..untill=not..before=...after造句
- 4《我把麻雀养在天空里》 1、文章第2自然段“绿意扑清了阳台”中的“扑”用得好,好在哪
- 5按下列要求扩展语句(任选一题)①请以“失败是成功之母”为结句,运用正反论证法加以拓展。
- 6法兰,用英语怎么讲?
- 7(2013•龙海市模拟)少年宫在人民广场西面1600米处,学校在人民广场南偏东40°方向1800米处.在图上画出少年宫、
- 8谁能给我高一至高三化学方程式总结
- 9证明:在所有的n级排列中,奇偶排列各占一半.(为什么s>=t )
- 10求各位大神帮我写一下这篇英语作文
- 11证明阶为素数的群必是循环群
- 12Not the best don't you touch 翻译成中文.
- 13e在单词中发/i/的音有哪些单词?
- 14DNA的半保留复制时为什么要选用氮进行标记呢?
- 15it's raining heavily now . 划线提问,划heavily