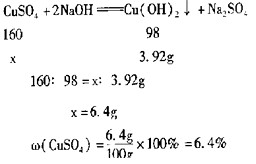收废液含有铁铝钠和硫酸离子同学为测定废液中离子的含量设计如下实验流程
 江湖最后的个体户2022-10-04 11:39:541条回答
江湖最后的个体户2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 今夜不潜水 共回答了23个问题
今夜不潜水 共回答了23个问题 |采纳率87%- 题目中提供信息太少 麻烦您把题目补充完整再行提问 如果打字不方便 可以拍张清楚的照片上传 我来为您解答
- 1年前
相关推荐
- 某工厂排出的废液中主要含有Zn(NO3)2和AgNO3,为了回收硝酸锌和金属银,设计了如下步骤.
某工厂排出的废液中主要含有Zn(NO3)2和AgNO3,为了回收硝酸锌和金属银,设计了如下步骤.
废液(加入过量X,过滤)→固体A和滤液B
固体A(加入过量Y,过滤)→金属Ag和滤液C,滤液C加适量Ba(NO3)2溶液可变为滤液B
滤液B(操作Z)→硝酸锌固体
XYABC各是什么?我总觉得多了一步,为什么固体A还要再加Y咧? 我爱蔓蔓1年前1
我爱蔓蔓1年前1 -
 散游 共回答了12个问题
散游 共回答了12个问题 |采纳率83.3%X是铁
B是硝酸锌溶液
C是硫酸亚铁
固体A还要再加Y是出去第一步中过量的铁,使得到的银是纯的1年前查看全部
- 向含有硝酸银的废液中加入过量的铁屑,充分反应后过滤,滤除固体和滤液分别是什么?
 脆脆1年前3
脆脆1年前3 -
 远走的孩子不回头 共回答了19个问题
远走的孩子不回头 共回答了19个问题 |采纳率73.7%加入过量的铁屑,滤除固体有 铁和银 滤液是硝酸亚铁溶液1年前查看全部
- 在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污
 在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:
在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:
取废液桶上层清液共11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示:
当碳酸钠溶液与废液恰好处理完时(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液),所得溶液中溶质的质量是多少?______. august_281年前1
august_281年前1 -
 情人节的风 共回答了15个问题
情人节的风 共回答了15个问题 |采纳率86.7%解题思路:根据碳酸钠和盐酸反应使溶液的PH值升高,碳酸钠和氯化钙反应时,溶液的pH值不变进行分析.从图象中的数据和PH值的变化可以看出,加入的碳酸钠在0~10kg之间时,PH值升高,所以和盐酸反应的碳酸钠是10kg,在10~15kg之间,ph值不变,所以和氯化钙反应的碳酸钠是5kg,盐酸和碳酸钠反应时生成的氯化钠为x,氯化钙和碳酸钠反应生成的氯化钠为y,
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 117
21.2%×10kg=2.12kgx
[106/2.12kg]=[117/x]
x=2.34kg;
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 117
21.2%×5kg=1.06kg y
[106/1.06kg]=[117/y]
y=1.17kg;
所以反应后的溶质质量为:1.17kg+2.34kg=3.51kg,
故答案为:3.51kg.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关溶质质量分数的简单计算;溶液的酸碱性与pH值的关系;根据化学反应方程式的计算.
考点点评: 在解此类题时,首先分析反应应用的原理,然后结合图象中的转折点,以及方程式中的比例关系进行解答.1年前查看全部
- 实验1铁锈2氧化铁3盐酸4氢氧化钠溶液5碳酸钠溶液,5种试剂在废液中不可能有的是什么溶质最多的是什么
实验1铁锈2氧化铁3盐酸4氢氧化钠溶液5碳酸钠溶液,5种试剂在废液中不可能有的是什么溶质最多的是什么
废液成酸性 临枫1年前2
临枫1年前2 -
 tglaoli 共回答了22个问题
tglaoli 共回答了22个问题 |采纳率86.4%不可能有的是氢氧化钠 碳酸钠 氧化铁 铁锈.它们都能和酸反应
溶质最多的是盐 可能是氯化钠 氯化铁 氯化亚铁 也可能是盐酸 因为你没给出量词
废液呈酸性 说明有氢离子 怎么可能会没盐酸呢1年前查看全部
- 将Fe(NO3)2与稀硫酸同时倒入废液缸 然后会怎样
将Fe(NO3)2与稀硫酸同时倒入废液缸 然后会怎样
书上说会污染空气 041410011年前2
041410011年前2 -
 鳓尉酯 共回答了14个问题
鳓尉酯 共回答了14个问题 |采纳率92.9%Fe(2+)+H(+)+NO3(-)=Fe(3+)+NO2+H2O
括号里为价态1年前查看全部
- 16.某工厂排出的废液中含有Ba2+,Ag+,Cu2+,用①Na2CO3溶液②NaOH溶液③盐酸 三种试剂将它们逐一沉淀
16.某工厂排出的废液中含有ba2+,ag+,cu2+,用①na2co3溶液②naoh溶液③盐酸 三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是
a.②③①b.③②①c.①②③d.③①②
17.进行焰色反应实验时,通常用来洗涤铂丝的是
a.硫酸b.烧碱溶液c.稀盐酸d.蒸馏水
18.可用来鉴别氧化铁溶液和氢氧化铁溶胶的简便方法是
a.过滤b.渗析c.电泳d.丁达尔效应
19、某物质灼烧时,焰色反应为黄色,下列判断中正确的是
a.该物质一定是钠的化合物 b.该物质一定含钠元素 c.不能确定该物质中是否含钾元素 d.该物质一定是金属钠
20、能把na2so4 、na4no3 、 kcl (nh4)2so4 四瓶无色溶液区别的是(可以加热)
a bacl2 b naoh c ba(oh)2 d agno3
21、某气体可能含有co co2 nh3 hcl h2 和水蒸气的一种或几种 ,***澄清石灰水 (无浑浊) 、氢氧化钡溶液(有浑浊) 、浓硫酸、灼热的氧化铜(变红) 和无水 cuso4 (变蓝),判断该气体中一定有
a hcl b co、h2 、h2o c co h2 nh3 d hcl co h2o 八卦教主1年前1
八卦教主1年前1 -
 ee归舟 共回答了24个问题
ee归舟 共回答了24个问题 |采纳率87.5%16.先将Ag+沉淀出来,再将Cu2+沉出来,最后沉Ba2+,避免有两种离子同时形成沉淀.故选B
17.选C.盐酸与金属形成的氯化物沸点较低,使得灼烧时杂质能很好的挥发掉.
18.选D.丁达尔效应,就是用光源照一下胶体,胶体中就产生一条明亮的光路.胶体能产生丁达尔效应,溶液不行.在鉴别胶体的方法中通过丁达尔效应来鉴别那是最简单的了.
19.选B.黄色那是钠元素的颜色反应的颜色,可以是金属钠也可以是钠的化合物灼烧产生.
20.选D.区别4种溶液加入的试剂需能与溶液产生3种不同的现象,产生沉淀,气体,或者发生颜色变化.Ag2SO4是微溶的,AgCl是难溶的于是两者在外观上溶液的浑浊程度不同后者更浑浊,铵盐加热能产生氨气.
21.选A.氢氧化钡溶液(有浑浊)说明一定有CO2了,但是通入澄清石灰水时没有浑浊,这说明混合气体中一定有HCl.CO是不能确定是否含有的,因为后面通过氧化铜后没有装置检验是否CO2产生.1年前查看全部
- (1)某化工厂排放的废液中只含有ZnCl2和CuCl2两种溶质,为回收金属Cu并得到ZnCl2固体,化学小组的同学们设计
(1)某化工厂排放的废液中只含有ZnCl2和CuCl2两种溶质,为回收金属Cu并得到ZnCl2固体,化学小组的同学们设计并进行了实验,你认为他们应该向废液中加入(用符号表示)______固体,充分搅拌后过滤,滤液中的物质是______(用化学式表示)
(2)分析比较Na2SO4、(NH4)2SO4、CuSO4在组成、性质等方面的异同,回答下列问题.①Na2SO4、(NH4)2 SO4中含有的相同离子是(用符号表示)______;
②这三种固体能检验水的是(用名称表示)______;
(3)完成下列反应的化学方程式,并回答有关问题.
①实验室制取氢气:______,基本反应类型是______.
②大理石和稀盐酸恰好完全反应:______.
③氯化铵晶体(NH4Cl)和熟石灰混合研磨生成氯化钙和水,同时生成一种氨臭味的气体(NH3)______. 十二月酷暑1年前1
十二月酷暑1年前1 -
 班长扑倒团rr 共回答了17个问题
班长扑倒团rr 共回答了17个问题 |采纳率94.1%解题思路:(1)根据在金属活动性顺序中只有前面的金属才可以和排在它后面的金属从盐溶液中置换出来,再结合题意分析加入的金属等;
(2)①比较物质的构成,找出相同离子,写出符号;
②根据白色的无水硫酸铜能与水反应,生成蓝色的硫酸铜晶体分析;
(3)根据制取气体的原理,写出反应的方程式并判断有关的反应类型.(1)由金属活动性顺序表可知,锌的活动性比铜强,所以回收金属Cu可以加入Zn将铜先置换出来,同时生成ZnCl2;
(2)①Na2SO4、(NH4)2 SO4中含有的相同离子是SO42-;
②由于白色的无水硫酸铜能与水反应,生成蓝色的硫酸铜晶体.所以,能检验水的是无水硫酸铜;
(3)①实验室常用锌和稀硫酸反应制取制取氢气,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑,该反应由一种单质和化合物反应,生成了另一种单质和化合物,属于置换反应;
②大理石和稀盐酸恰好完全反应生了氯化钙、水和二氧化碳,反应的方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③氯化铵晶体(NH4Cl)和熟石灰混合研磨生成氯化钙和水,同时生成一种氨臭味的气体(NH3),反应的方程式是:2NH4Cl+Ca(OH)2=CaCl2+2 NH3↑+2H2O.
故答为:(1)Zn,ZnCl2; (2)SO42-,无水硫酸铜;(3)①Zn+H2SO4=ZnSO4+H2↑;②CaCO3+2HCl=CaCl2+H2O+CO2↑;③.2NH4Cl+Ca(OH)2=CaCl2+2 NH3↑+2 H2O.点评:
本题考点: 金属活动性顺序及其应用;化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 该题主要是回收金属和化学方程式的书写.化学方程式重要的化学用语,应加强化学方程式的书写.1年前查看全部
- 如何利用制备二氧化碳的含酸废液制取无水氯化钙?
 疯子安1年前1
疯子安1年前1 -
 muzisong 共回答了18个问题
muzisong 共回答了18个问题 |采纳率94.4%用制备二氧化碳的含酸废液制取无水氯化钙:
告诉我们废液中有 CaCl2 HCl
加入足量的CaCO3
含酸废液----------------------------------------->
反应完后再过滤
----------------------------------------->滤液
蒸发结晶
----------------------------------------->无水氯化钙1年前查看全部
- 氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu 2+ 、Fe 3+ 的电镀废液中
氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu 2+ 、Fe 3+ 的电镀废液中制备氯化亚铜的工艺流程图. 
如图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系.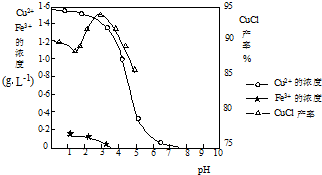
试填空.
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:______.
(2)由反应①制备CuCl时的最佳pH在______左右.
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有______的特性.
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为:______.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为:______. mybmwx51年前1
mybmwx51年前1 -
 blackpeter 共回答了26个问题
blackpeter 共回答了26个问题 |采纳率96.2%(1)当pH=5时,三价铁离子已经全部沉淀,在电镀废液中再加入氢氧化钠溶液,铜离子全部沉淀;反应离子方程式为:Cu 2+ +2OH - =Cu(OH) 2 ↓,故答案为:Fe 3+ +3OH - =Fe(OH) 3 ↓;Cu 2+ +2OH - =Cu(OH) 2 ↓;
(2)因减少生成物的浓度,化学平衡正向移动,OH - 中和了反应中的H + ,有利于平衡向右移动,提高CuCl的产率.但当OH - 浓度过大时,Cu + 能与OH - 结合,生成氢氧化亚铜沉淀(Cu 2+ 能与OH - 结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,图象中分析由反应①制备CuCl时的最佳pH=3.5时CuCl的产率最大,故答案为:3.5;
(3)在隔绝空气条件下进行反应①时CuCl产率较高,说明氯化亚铜能被空气中的氧气氧化,故答案为:能被空气中的氧气氧化;
(4)反应①中1mol铁粉完全反应转移2mol电子生成亚铁离子被铜离子氧化,生成氯化亚铜沉淀结合离子方程式书写方法写出的离子方程式为:2Cu 2+ +2Cl - +Fe=2CuCl↓+Fe 2+ ;如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,说明亚硫酸钠被铜离子氧化为硫酸钠,本身被还原为氯化亚铜,结合化学方程式书写方法写出的化学方程式为:2CuSO 4 +Na 2 SO 3 +2NaCl+H 2 O=2CuCl↓+2Na 2 SO 4 +H 2 SO 4 ;
故答案为:2Cu 2+ +2Cl - +Fe=2CuCl↓+Fe 2+ ;2CuSO 4 +Na 2 SO 3 +2NaCl+H 2 O=2CuCl↓+2Na 2 SO 4 +H 2 SO 4 ;1年前查看全部
- 某化学兴趣小组在实验室用大理石和稀盐酸(杂质忽略)做完制取二氧化碳的实验后,对废液中溶质的成分产生了兴趣.请你一同参与探
某化学兴趣小组在实验室用大理石和稀盐酸(杂质忽略)做完制取二氧化碳的实验后,对废液中溶质的成分产生了兴趣.请你一同参与探究并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【作出猜想】甲同学认为废液中溶质只有氯化钙.
乙同学认为除了氯化钙,还可能有的溶质是______(填化学式).
【查阅资料】碳酸钙不溶于水,氯化钙溶液呈中性.
【实验与结论】
(1)甲同学取少量废液于试管中,滴入几滴无色酚酞试液后,酚酞不变色.于是甲同学认为自己的猜想是正确的.
(2)你认为甲同学的实验______(填“能”或“不能”)证明他的猜想是正确的,你的理由是______.
(3)乙为了证明他的猜想是正确的,他邀请了丙同学一起探究,分别做了如表实验:
你认为还可以用下列中的______加以验证.实验操作 实验现象或反应 实验结论 乙 取废液少许于试管中,向其中滴加______ 现象:溶液由无色变为红色 取废液少许于试管中,向其中加入少量锌粒 反应的化学方程式是:
______
A.pH试纸B.澄清石灰水C.Fe(OH)3D.CuOE.碳酸盐
【拓展与应用】(1)若要从废液中得到尽可能多的纯净的氯化钙固体,兴趣小组的同学认为可以向剩余的废液中加入稍过量的______(填化学式),经过滤、蒸发等操作后即可完成.
(2)通过以上探究,如果该废液未经处理直接倒入下水道,可能造成的危害是______(写一条).
【交流与反思】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑______.
 斯文iiLover1年前1
斯文iiLover1年前1 -
 木手英一_kk 共回答了15个问题
木手英一_kk 共回答了15个问题 |采纳率93.3%【作出猜想】若盐酸与碳酸钙恰好完全反应,溶液中的溶质是氯化钙,若盐酸过量,溶液中的溶质除了氯化钙之外还有氯化氢气体.故答案为:HCl;
(2)氯化钙溶液显中性,不能使酚酞溶液变色,氯化钙与盐酸的混合溶液显酸性,也不能使酚酞溶液变色,因而酚酞溶液呈无色,两种猜想都有可能.故答案为:不能; 酚酞在酸性条件和中性条件下均为无色;
(3)如果要证明你的猜想是正确的,你选择的试剂是石蕊试液,实验中可以看到的现象是石蕊试液变红色;锌与盐酸反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;pH试纸测定溶液PH,若小于7,证明有盐酸;加入氢氧化铁、氧化铜、碳酸盐后,分别出现红褐色固体消失溶液变为黄色、黑色固体消失溶液变为蓝色、有气泡冒出等现象,证明有盐酸存在;而氢氧化钙与盐酸反应无任何现象,无法证明盐酸的存在;故选ACDE
【拓展与应用】(1)要加入过量的某物质将盐酸转化为氯化钙,该物质一定不溶于水,若溶于水的话,虽然除去了盐酸,溶液中还会有剩余的该物质,那么该物质可以是碳酸钙;故答案为:碳酸钙.
(2)盐酸显酸性会腐蚀铁制管道,排放前可以加碱性物质氢氧化钙处理成中性在排放,所以本题答案为:腐蚀下水道
【交流与反思】在分析化学反应后所得物质的成分时,除了考虑生成物外还需要考虑反应物是否有剩余.
故答案为:【做出猜想】HCl(1分)
【实验与结论】(2)不能(1分),盐酸不能使酚酞溶液变色,无法确定是否含有HCl(1分)
(3)乙:紫色石蕊试液(1分)丙:Zn+2HCl=ZnCl2+H2↑(2分)ACDE((1分),漏选不给分)
【拓展与应用】(1)CaCO3 (1分)(2)腐蚀铁质下水管(或污染水源)(1分)
【交流与反思】反应物是否有剩余(1分)1年前查看全部
- (2008•肇庆二模)用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌.同学们用制氢气的废液来制取
(2008•肇庆二模)用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌.同学们用制氢气的废液来制取皓矾(ZnSO4•7H2O),并探究其性质.
(l)制备皓矾实验流程如下图所示:
已知:氢氧化物沉淀的pH范围见下表.
请回答下列问题:氢氧化物 Fe(OH)3 Fe(OH)2 Zn(OH)2 开始沉淀pH 2.7 7.6 5.7 完全沉淀pH 3.7 9.6 8.0
①加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用______,其理由是______.
②加入的试剂b,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用______,其理由是______.
③从晶体l→晶体2,该过程的名称是______.
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是______.
(2)探究皓矾的性质
⑤称取28.7g ZnSO4•7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见上表.则1000℃时皓矾的反应方程式为______.温度(℃) 60 240 930 1000 残留固体质量(g) 19.7 16.1 8.1 8.1
⑥取少量ZnSO4•7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解.查资料得知Zn(OH)2具有两性,则Zn(OH)2溶于NaOH溶液的离子方程式为:______. 苹果宝贝8281年前1
苹果宝贝8281年前1 -
 zxf4759 共回答了17个问题
zxf4759 共回答了17个问题 |采纳率94.1%解题思路:(1)①依据流程分析判断,试剂1是为了把亚铁离子氧化为铁离子,在PH=2.7-3.可以全部沉淀,其他离子不沉淀,同时加入的试剂不能引入新的杂质;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;
③晶体重新结晶的过程是物质提纯的方法是重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;
(2)⑤根据ZnSO4•7H2O加热到1000℃时所的固体的质量情况来确定成分;
⑥氢氧化锌具有两性,可以和强碱反应可溶于水的盐.(1)①化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,溶于酸后生成亚铁离子锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,分析判断,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,除去亚铁离子需要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,来实现分离,加入的氧化剂不能引入新的杂质,氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸中只有20%的H2O2 在氧化亚铁离子不引入杂质,
故答案为:20%的H2O2;将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;Zn粉会把氧化得到的铁离子还原,起不到除去的作用,ZnO、Zn(OH)2、ZnCO3可以反应调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液PH,且引入杂质硫酸根离子,
故答案为:ZnO、Zn(OH)2、ZnCO3;调节溶液的pH至3.7~5.7使Fe3+全部转化为Fe(OH)3沉淀,同时避免Zn2+损失和引入其它杂质;
③晶体溶解再结晶是提纯晶体的方法为重结晶,故答案为:重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率,
故答案为:为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;
(2)⑤ZnSO4•7H2O加热到1000℃时所的固体的质量为8.1g,加热到60°会将所有的结晶水失去,到1000℃时硫酸锌已经分解为氧化锌、三氧化硫,故答案为:ZnSO4•7H2O
1000°C
.
ZnO+SO3↑+7H2O↑,故答案为:ZnSO4•7H2O
1000°C
.
ZnO+SO3↑+7H2O↑;
⑥向硫酸锌中逐滴加入NaOH溶液,发现先产生白色沉淀氢氧化锌,然后又逐渐溶解在氢氧化钠中,发生的化学反应为;Zn(OH)2+2OH-=ZnO22-+2H2O,
故答案为:Zn(OH)2+2OH-=ZnO22-+2H2O.点评:
本题考点: 氨的制取和性质.
考点点评: 本题是一道关于物质的分离和提纯的综合实验设计题,考查学生分析和解决问题的能力,难度大.1年前查看全部
- 某实验小组的同学取大理石和稀盐酸反应后的废液50g,逐滴加入质量分数为26.5%的碳酸钠溶液.他们根据实验测得的数据绘出
 某实验小组的同学取大理石和稀盐酸反应后的废液50g,逐滴加入质量分数为26.5%的碳酸钠溶液.他们根据实验测得的数据绘出右图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量.下列说法正确的是( )
某实验小组的同学取大理石和稀盐酸反应后的废液50g,逐滴加入质量分数为26.5%的碳酸钠溶液.他们根据实验测得的数据绘出右图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量.下列说法正确的是( )
A.图中oa段表示生成的沉淀量
B.c点表示碳酸钠合好完全反应
C.与50g废液恰好完全反应时消耗碳酸钠溶液的质量为30g
D.最终产生气体的质量为5g wo132661年前1
wo132661年前1 -
 岳洋洋 共回答了25个问题
岳洋洋 共回答了25个问题 |采纳率92%解题思路:根据右图可知碳酸钙与盐酸反应后盐酸过量,所以一开始没有产生沉淀原因是加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了.A、图中oa段表示生成的气体质量,故A错;
B、b点表示碳酸钠恰好完全反应,故B错;
C、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知10g碳酸钠与盐酸反应,20g碳酸钠与氯化钙反应,所以共消耗碳酸钠溶液30g,故C正确;
D、最终产生气体质量为1.1g,故D错.
故选C.点评:
本题考点: 根据化学反应方程式的计算;酸的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 解答本题关键要知道只有把盐酸反应完了,才能与氯化钙反应产生沉淀,因为如果碳酸钠与氯化钙先反应生成了碳酸钙沉淀,也会被剩余的盐酸溶解掉,将不会看到沉淀.1年前查看全部
- 除杂——除去溶液中的有害离子若溶液中存在Cu2+,Ba2+,Ag+这三种离子,你认为该废液应该进行怎样的处理后才能够倒掉
除杂——除去溶液中的有害离子
若溶液中存在Cu2+,Ba2+,Ag+这三种离子,你认为该废液应该进行怎样的处理后才能够倒掉?设计方案,并写出相关离子方程式,不要引入其他有污染的离子
那些离子方程式都不用加沉淀符号吗? houhjie1年前1
houhjie1年前1 -
 欧阳鸡 共回答了19个问题
欧阳鸡 共回答了19个问题 |采纳率94.7%加入碳酸钠
Cu(2+)+CO3(2-)=CuCO3
Ba(2+)+CO3(2-)=BaCO3
2Ag(+)+CO3(2-)=Ag2CO3
都转化为沉淀,过滤即可1年前查看全部
- 水的密度是1.0,当有废液进入,主要含有金属是锡,密度达到1.12.问:每立方米中还有多少锡 怎样计算?
 枫雪杏子1年前1
枫雪杏子1年前1 -
 风月348 共回答了22个问题
风月348 共回答了22个问题 |采纳率95.5%ゾ·铵瀞 同学,您好:
首先这里需要知道锡 的密度,一般按照7.31g/cm3 来计算.
设每立方米中有锡X立方米
那么:
总密度=(水的质量+锡的质量)/体积
=[(1-X)*1*1000+7.31*X]/1=1.12
解出来:X=1.0062立方米
换成质量是:7.36KG
希望我的回答对您有帮助,祝好!
及时采纳,谢谢.1年前查看全部
- 用TOC测定仪测试到的TCO的值怎么转化或换算成COD的值?我的样品是制革废液,
 huan10001年前1
huan10001年前1 -
 lycop 共回答了19个问题
lycop 共回答了19个问题 |采纳率94.7%TOC跟COD虽无直接联系,但是本质上都是表征水体中有机物污染程度的指标,因此是有线性对应关系的,这个换算系数,不同的水体是不一样的,如果你的水体中的污染物成分比较稳定,你可以通过实验确定这个系数.后面你就可以测TOC然后乘以这个系数就是COD了,比你直接做COD快得多,当然这个系数你隔一段时间需要校正一次.有问题可以继续提问.1年前查看全部
- 经检测某工厂废液中有大量Mg2+,Al3+,Ag+,Fe3+,Ba2+.请分析回答 该废液中可能大量存在的阴离子是?
经检测某工厂废液中有大量Mg2+,Al3+,Ag+,Fe3+,Ba2+.请分析回答 该废液中可能大量存在的阴离子是?
A.硫酸根离子 B.硝酸根离子 C.氯离子 D.碳酸根离子
 putaofang1年前1
putaofang1年前1 -
 shadowgirl 共回答了17个问题
shadowgirl 共回答了17个问题 |采纳率94.1%根据离子共存
A.硫酸根离子 不行,与Ba2+、Ag+不共存
B.硝酸根离子 可以
C.氯离子 不可以 与Ag+生成氯化银沉淀.
D.碳酸根离子 Mg2+,Al3+,Ag+,Fe3+,Ba2+都可以发生反应,不能共存
希望对你有所帮助,满意请采纳,亲!1年前查看全部
- 一个化学的推理问题某实验室的一瓶废液中,可能含有硫酸钠、硫酸、硫酸铜、氯化钠、氢化氧钠、碳酸钠、硝酸钡中的一种或几种.课
一个化学的推理问题
某实验室的一瓶废液中,可能含有硫酸钠、硫酸、硫酸铜、氯化钠、氢化氧钠、碳酸钠、硝酸钡中的一种或几种.课外活动小组的同学们对此废液进行了如下实验:1、取废液观察,为无色溶液;2、取少量废液,向其中加入氯化钡溶液,有白色沉淀产生,加稀硝酸后沉淀不溶解;3、另取少量废液,向其中加入铁粉后,产生大量气泡.
请根据以上实验现象推断,该废液中肯定含有什么物质,肯定不含有什么物质,不能确定是否含有的物质是什么?为什么?
能说明理由有追加! ss凯1234561年前5
ss凯1234561年前5 -
 Mr_vincent 共回答了20个问题
Mr_vincent 共回答了20个问题 |采纳率100%1是无色溶液 所以没有硫酸铜(兰色)
2向其中加入Ba离子,有沉淀生成,说明溶液中有与Ba生成沉淀的物质,所以由实验第1步,没有Ba离子,否则有沉淀是不会称为无色溶液的
这一步骤说明可能有硫酸钠 硫酸 或者碳酸钠
又因为加硝酸不溶解,所以不可能有碳酸钠
3加入铁粉 有气泡,所以和铁反映的只可能是氢气,所以有硫酸 有硫酸就不可能有氢氧化钠
综上:一定有硫酸
一定没有硫酸铜 氢氧化钠 硝酸钡 碳酸钠
可能有氯化钠 硫酸钠1年前查看全部
- 甲、乙两组同学分别做常见的酸和碱与同种指示剂反应的实验,使用的试剂是稀盐酸、稀硫酸、氢氧化钠溶液.实验后将废液分别集中到
甲、乙两组同学分别做常见的酸和碱与同种指示剂反应的实验,使用的试剂是稀盐酸、稀硫酸、氢氧化钠溶液.实验后将废液分别集中到各组的一个废液缸中.研究小组对两个小组的废液进行检测,结果见表格.下列说法错误的是
废液来源 甲组 乙组
检测方法和结果 观察废液呈无色 观察废液呈红色
A.甲组废液中一定含有稀盐酸和稀硫酸
B.将两组废液处理后再排放,可防止污染
C.乙组废液中一定含有氢氧化钠、氯化钠和硫酸钠
D.直接将甲组的废液排入铸铁管下水道,可能会腐蚀铸铁水管 tyghjg1年前1
tyghjg1年前1 -
 残殿 共回答了13个问题
残殿 共回答了13个问题 |采纳率92.3%B.1年前查看全部
- 用滴瓶上的滴管滴加液体,多余的液体不需要挤入废液缸吗?
 含情默默1年前1
含情默默1年前1 -
 tg2004 共回答了14个问题
tg2004 共回答了14个问题 |采纳率100%滴瓶中的滴管使用后,不用将剩余的液体挤入废液缸、、、、也不用清洗、、
你也许还木有进行过化学实验、、、
但在,生物实验中,滴加碘酒后,是不是就将滴管直接放入滴瓶中了呢?
所以不需要~】
可是、、胶头滴管是需要的哦~·
球采纳、、、、1年前查看全部
- 对实验过程中产生的废液,不能直接倒入下水道,正确的处理方法是
 怀昊1年前1
怀昊1年前1 -
 abckill321 共回答了20个问题
abckill321 共回答了20个问题 |采纳率90%首先收集起来,然后进行处理,处理的原则是去除废液中的有害成分,也可以转成无害或危害较小的成分,废液经过处理后再排放.例如酸碱性废液中和后再排放,含Cu2 的废液加入适量的NaOH后再排放,含Ba2 的加入适量H2SO4后再排放.1年前查看全部
- 氯化铜与氢氧化钙反应后的废液怎么处理
 stella_shao1年前3
stella_shao1年前3 -
 云天8899 共回答了22个问题
云天8899 共回答了22个问题 |采纳率95.5%废液可以通入稀盐酸中1年前查看全部
- (2010•济宁)甲、乙两组废液中各含有H+、K+、Ca2+、Cl-、OH-、CO32-六种离子中的三种,且所含离子各不
(2010•济宁)甲、乙两组废液中各含有H+、K+、Ca2+、Cl-、OH-、CO32-六种离子中的三种,且所含离子各不相同.为确定废液中的离子,分别向废液中滴加酚酞试液,经实验发现:甲组废液呈红色,表明甲组废液显______性,废液中一定含有______,由此推断,乙组废液中的三种离子是______.(填离子符号)
 doctor康夫1年前1
doctor康夫1年前1 -
 gg人07 共回答了11个问题
gg人07 共回答了11个问题 |采纳率90.9%解题思路:本题根据甲组废液呈红色,利用复分反应发生的条件及溶液呈电中性来分析甲、乙两组废液中的离子.因酚酞遇碱性溶液变红,则甲组废液显碱性,废液中应含有OH-;由于OH-与H+不能共存,则H+在乙组废液;
同理CO32-不能与H+和Ca2+共存,即Ca2+也在乙组;
又溶液不显电性,有阳离子时也应存在阴离子,所以乙组中应有Cl-,则乙组的离子为:H+、Ca2+、Cl-.
故答案为:碱;OH-;H+、Ca2+、Cl-.点评:
本题考点: 复分解反应的条件与实质;酸碱指示剂的使用;酸碱指示剂及其性质;酸碱盐的溶解性.
考点点评: 本题考查废水中离子的判断,学生应能利用复分解反应发生的条件及溶液不显电性来解答.1年前查看全部
- 做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下
做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
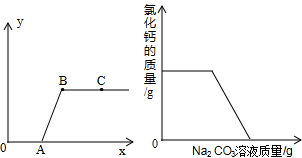
A.图中纵坐标(y)表示生成CO2的质量
B.反应进行到A点时,溶液中的溶质有2种;反应进行到B点时,溶液中的溶质只有1种;反应进行到C点时,溶液中的溶质有2种;
C.OA段溶液的pH增大,AB段溶液的pH不变,BC段溶液的pH增大,
D.纵坐标(y)表示氯化钙的质量,则反应过程可以用右图表示 老区堡垒户1年前1
老区堡垒户1年前1 -
 napolean1 共回答了15个问题
napolean1 共回答了15个问题 |采纳率93.3%解题思路:根据废液中主要含有盐酸与氯化钙,逐滴滴入碳酸钠溶液,碳酸钠应先和盐酸反应,等废液中盐酸被碳酸钠反应消耗完了,碳酸钠开始和氯化钙反应才能产生碳酸钙沉淀,进行分析解答本题.A、根据废液中主要含有盐酸与氯化钙,逐滴滴入碳酸钠溶液,碳酸钠应先和盐酸反应,等废液中盐酸被碳酸钠反应消耗完了,碳酸钠开始和氯化钙反应才能产生碳酸钙沉淀,所以OA段不会有沉淀,发生的反应是碳酸钠应和盐酸的反应.反应当氯化钙被碳酸钠反应完时沉淀达到最大值,反应进行到B点时,碳酸钠和氯化钙恰好完全反应,生成碳酸钙沉淀和氯化钠,因此溶液中所含溶质是NaCl、H2O,继续滴加碳酸钠溶液,沉淀不会增加,溶液中因为有多余的碳酸钠存在而显碱性.因此C点溶液的pH>7,综合分析图中纵坐标(y)轴表示应该是生成碳酸钙沉淀的质量;故A错误;
B、OA段发生的反应是碳酸钠应和盐酸的反应,反应进行到A点时,溶液中的溶质为氯化钠和氯化钙2种;反应进行到B点时,碳酸钠和氯化钙恰好完全反应,生成碳酸钙沉淀和氯化钠,因此溶液中所含溶质是NaCl;反应进行到C点时,溶液中的溶质有2种 NaCl,Na2CO3;故B正确;
C、OA段发生的反应是碳酸钠应和盐酸的反应,随滴入Na2CO3溶液显碱性,OA段溶液的pH增大;因为反应进行到B点时,碳酸钠和氯化钙恰好完全反应,此时溶液显中性;图上B到C点意思是继续滴加碳酸钠,溶液中因为有多余的碳酸钠存在而显碱性.故C点溶液的pH>7.故C正确;
D、根据废液中主要含有盐酸与氯化钙,逐滴滴入碳酸钠溶液,碳酸钠应先和盐酸反应,等废液中盐酸被碳酸钠反应消耗完了,碳酸钠开始和氯化钙反应才能产生碳酸钙沉淀,因此纵坐标(y)表示氯化钙的质量,则反应过程可以用右图表示;故D正确;
故选BCD.点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙;溶液、溶质和溶剂的相互关系与判断;酸的化学性质;溶液的酸碱性与pH值的关系;根据化学反应方程式的计算.
考点点评: 学生平时要加强课外实验探究,不断地培养自己的发现问题、分析问题、解决问题的能力.1年前查看全部
- 某工厂的废液中含有较多的铜离子,铁离子,锌离子,如何回收铜,并得到氯化亚铁.第一步加金属,再加盐酸.
 uu才子1年前1
uu才子1年前1 -
 zxszxs35849 共回答了17个问题
zxszxs35849 共回答了17个问题 |采纳率100%先加金属锌置换出铁和铜的混合物,然后向混合物中加入稀盐酸溶解铁.因为铜不能被稀盐酸所溶解,所以最终获得的溶液为氯化亚铁溶液,剩余金属为铜.1年前查看全部
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的
Cl - 、Fe 3+ 等杂质离子。在实验室中由“烂板液”制取ZnSO 4 ·7H 2 O的过程如下
已知有关金属离子形成氢氧化物沉淀时的PH见下表 
(1)第①反应是使Zn 2+ 、Fe 3+ 沉淀,检验Fe 3+ 是否沉淀完全的操作是____________________________。
(2)第②步操作中需要的玻璃仪器有_______________。
(3)第④步中PH应保持在_______________范围内。
(4)第⑥步调节溶液PH=2的目的是______________________________。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、_______________和过滤。 907891年前1
907891年前1 -
 网为媒 共回答了12个问题
网为媒 共回答了12个问题 |采纳率58.3%(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe 3+ 沉淀完全。
(2)漏斗、玻璃棒、烧杯
(3)3.2~6.4
(4)抑制Zn 2+ 水解
(5)冷却结晶1年前查看全部
- 重金属离子有毒性,实验室有甲,乙废液,均有一定毒性.
重金属离子有毒性,实验室有甲,乙废液,均有一定毒性.
甲废液经化验呈碱性 主要有毒离子为Ba 如将甲 乙两废液按一定比例混合 毒性明显降低 乙废液中可能含有的离子是 A Cu 和So4 B CU 和Cl C K和SO4 D Ag和No3
看到很多答案都说选A,为什么不能选C呢?不也把有毒离子沉淀了吗 lnnmb1年前1
lnnmb1年前1 -
 冯春敏 共回答了13个问题
冯春敏 共回答了13个问题 |采纳率92.3%应该是C选项中离子无毒吧.题目说都有毒性的1年前查看全部
- 某工厂要处理韩硫酸的废液.若中和等量的废液,需要物质的量是多少 A 氢氧化钙 B 碳酸钙 C 氯化钠 D 氢氧化
某工厂要处理韩硫酸的废液.若中和等量的废液,需要物质的量是多少 A 氢氧化钙 B 碳酸钙 C 氯化钠 D 氢氧化
我觉得把 他问的是溶液还是 固体啊 如果是固体的华 碳酸钠和 氢氧化钙的粉末 反应生成的 硫酸钙 就算是微溶的也可以的把 纠结 实在想不出了1年前1
实在想不出了1年前1 -
 daly0629 共回答了16个问题
daly0629 共回答了16个问题 |采纳率75%应该是你的题目输入有问题吧,我猜题目应该是说中和等物质的量的硫酸废液需要多少等物质的量的物质,应该选A,D选项补充完全应该是氢氧化钠吧,C,D选项钠离子是+1价,直接排除,B生成二氧化碳,会部分溶解与溶液中,使得滴定检测量不准确,选A最好,中和产物为水,懂了吗?O(∩_∩)O哈哈~1年前查看全部
- 实验剩余的钠为什么不能放入废液缸里呢
 lijunmijiu1801年前2
lijunmijiu1801年前2 -
 jiyuxiang 共回答了19个问题
jiyuxiang 共回答了19个问题 |采纳率89.5%因为钠是活泼金属,可以和水反应置换出水中的氢,生成氢气,并大量放热.
在实验室中,如果直接将Na扔进废液缸的话,因Na和里面的水、酸反应,放出大量热,会导致废液缸中的废液被溅射出来,此时这些废液温度是很高的,容易对周围的人造成伤害~1年前查看全部
- 实验室中,含有少量氰根的废液,如何处理?
 巴山话雨1年前2
巴山话雨1年前2 -
 yulei7750 共回答了18个问题
yulei7750 共回答了18个问题 |采纳率77.8%高锰酸钾或NaClO等强氧化剂将其氧化掉
2KMnO4 + 2NaCN + 4H2SO4 = K2SO4 + 2MnSO4 + Na2SO4 + 2CO2↑ + N2↑ + 4H2O1年前查看全部
- 回收纯银,废液里含有Ag离子,锌离子,亚铁离子
回收纯银,废液里含有Ag离子,锌离子,亚铁离子
费液(加过量X;操作I)得溶液C和固体A 然后固体A(加过量Y;操作II)得固体B和溶液D 然后溶液D(蒸发结晶)得固体E
回收的纯银存在于字母:中 X和Y的化学式是什么 gybfbb6go7cb81年前1
gybfbb6go7cb81年前1 -
 zwn126 共回答了17个问题
zwn126 共回答了17个问题 |采纳率100%X Fe
Y HCl1年前查看全部
- 在做完盐的变质实验后,某实验小组欲对废液成分进行研究。根据实验所用药品,他们初步分析该废液中可能含有HCl. NaCl.
在做完盐的变质实验后,某实验小组欲对废液成分进行研究。根据实验所用药品,他们初步分析该废液中可能含有HCl. NaCl. Na 2 SO 4 . Na 2 CO 3 . KNO 3 中的几种。为确定废液成分,他们设计了如下过程进行实验。 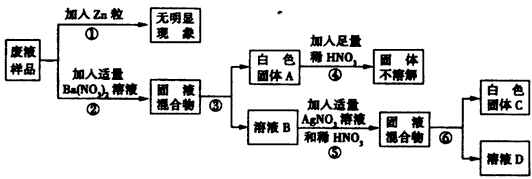
请仔细分析实验过程,回答下列问题:
(1)步骤③. ⑥的操作方法是_______________;
(2)白色固体A的化学式为__________;
(3)步骤⑤中发生反应的化学方程式为______________________________;
(4)废液中除了水以外,一定含有的物质是________,可能含有的物质是____________。
(5)溶液D中一定含有的溶质是_______。 潇洒虫虫1年前1
潇洒虫虫1年前1 -
 solidhouse123 共回答了14个问题
solidhouse123 共回答了14个问题 |采纳率85.7%(1)过滤
(2)BaSO 4
(3)NaCl+AgNO 3 ===NaNO 3 +AgCl↓
(4)硫酸钠、氯化钠(或Na 2 SO 4 、NaCl);硝酸钾(或KNO 3 )
(5)硝酸、硝酸钠(或HNO 3 、NaNO 3 )1年前查看全部
- 某金属制品厂清洗金属后产生一种黄色废液,小刚和小强欲对其成分进行探究.请你参与探究,填写空格:
某金属制品厂清洗金属后产生一种黄色废液,小刚和小强欲对其成分进行探究.请你参与探究,填写空格:
【查阅资料】工业上通常使用__________清洗金属表面的锈迹.
【猜想与假设】小刚认为废液中只含有硫酸铁;小强认为废液中可能还含有氯化铁.
【进行实验】小刚的实验报告如下:
实验现象
①取少量澄清废液于试管中,逐滴加入足量氢氧化钾溶液
刚开始没有明显现象,过一段时间后产生红褐色沉淀
生成红褐色沉淀的是______________
②过滤,向滤液中滴加氯化钡溶液至恰好完全反应
产生_____________
废液中一定含有硫酸铁
【反思与改进】
⑴小强通过改进小刚的实验,证明了自己的猜想是正确的.小强的实验操作要点是:______________________________________________________________________.
⑵通过分析小刚的实验现象,简要说明他们探究过程中的不足之处:__________________________________________________________________. 安静的发呆1年前1
安静的发呆1年前1 -
 hhnjl 共回答了23个问题
hhnjl 共回答了23个问题 |采纳率95.7%生成红褐色沉淀的是(氢氧化铁)
过滤,向滤液中滴加氯化钡溶液至恰好完全反应产生(白色沉淀)
小强的实验操作要点是:
取少量澄清废液,先加入足量硝酸钡溶液,过滤,向滤液中滴加硝酸银溶液,产生白色沉淀
通过分析小刚的实验现象,简要说明他们探究过程中的不足之处:
未考虑废液中含有酸1年前查看全部
- 某学习小组的同学做了酸碱盐的性质试验后,废液中可能含有硫酸铜、硫酸、氢氧化钠、碳酸钠、氯化钠中的一种或多种,他们又对废液
某学习小组的同学做了酸碱盐的性质试验后,废液中可能含有硫酸铜、硫酸、氢氧化钠、碳酸钠、氯化钠中的一种或多种,他们又对废液进行了如下检测活动:
(1)取废液观察,呈无色、均一、透明状,则该废液中一定不含______;
(2)向废液中滴加氯化钡溶液,产生了白色沉淀,再加入稀HNO3,白色沉淀不溶解,则该溶液中一定含有______,一定不含______.
(3)对可能存在的物质继续如图操作,确定了其确实存在.
则A是______,B是______. WESTWOODWING1年前1
WESTWOODWING1年前1 -
 大海中的我 共回答了15个问题
大海中的我 共回答了15个问题 |采纳率100%解题思路:根据硫酸铜在溶液中显蓝色,硫酸和氯化钡会生成白色的硫酸钡沉淀,硫酸和氢氧化钠会发生中和反应,硫酸和碳酸钠会生成二氧化碳,氯离子和银离子会生成氯化银沉淀等知识进行分析.硫酸铜在溶液中显蓝色,硫酸和氯化钡会生成白色的硫酸钡沉淀,硫酸和氢氧化钠会发生中和反应,硫酸和碳酸钠会生成二氧化碳,氯离子和银离子会生成氯化银沉淀.
(1)取废液观察,呈无色、均一、透明状,硫酸铜在溶液中显蓝色,所以该废液中一定不含:硫酸铜;
(2)向废液中滴加氯化钡溶液,产生了白色沉淀,再加入稀HNO3,白色沉淀不溶解,硫酸和氯化钡会生成不溶于硝酸的硫酸钡沉淀,所以该溶液中一定含有:硫酸,硫酸和氢氧化钠会发生中和反应,硫酸和碳酸钠会生成二氧化碳,所以一定不含:氢氧化钠、碳酸钠,题中的现象不能确定是否含有氯化钠;
(3)要检验氯离子需要排除硫酸根离子的干扰,但是还不能引入氯离子,所以A是硝酸钡,检验氯离子常用硝酸银,所以B是硝酸银.
故答案为:(1)硫酸铜;
(2)硫酸,氢氧化钠、碳酸钠;
(3)Ba(NO3)2,AgNO3.点评:
本题考点: 物质的鉴别、推断;酸的化学性质;碱的化学性质;盐的化学性质.
考点点评: 在解此类题时,首先分析题中所给物质的性质,然后依据题中的现象确定各种物质的存在性,最后确定混合物的成分.1年前查看全部
- 用含15%硫酸的废液2500kg与足量的铁屑反应,可生成绿矾(FeSO4 · 7H2O)多少千克?
 吃了tt1年前2
吃了tt1年前2 -
 yanbozhang 共回答了23个问题
yanbozhang 共回答了23个问题 |采纳率87%m(H2SO4)=2500kg*15%=375kg
m(SO4^2-)=375kg*96/98=18000/49 kg
由题意可知,硫酸与足量铁反应,即硫酸中的硫酸根离子全部变成绿钒中的硫酸根离子,于是有
m(FeSO4·7H2O)=18000/49 kg*278/96=52125/49≈1063.78kg
这道题要掌握的就是硫酸根的守恒 因为我们知道绿钒中的硫酸根全部都是由硫酸而来的 这样楼主还有什么疑问可以追加( # ▽ # )祝学习进步1年前查看全部
- (2007•石景山区一模)处理胶片的废液中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意倾倒会造成严重污
(2007•石景山区一模)处理胶片的废液中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意倾倒会造成严重污染.某同学想从上述的废液中回收金属银,并得到副产品硫酸亚铁固体,设计了如下图所示的生产流程.

(1)操作②是______.
(2)固体A是______,C中溶质是______,Y是______. yongyuanaiwl1年前1
yongyuanaiwl1年前1 -
 蓝海图腾 共回答了14个问题
蓝海图腾 共回答了14个问题 |采纳率92.9%解题思路:(1)根据操作②分离出液体和固体进行分析;
(2)结合实验意图分析实验流程图,根据对流程的分析,判断流程中所需要加入的物质及所采取的实验操作:根据使用的目的得到硫酸亚铁固体分析溶液D中只有一种盐是硫酸亚铁,可以分析出Y是硫酸,B是银,所以固体A就是铁和银,所以X就是铁,将推出的各种物质代入验证即可.(1)把固体与液体分离开的操作为过滤操作;
(2)溶液D中只有一种盐是硫酸亚铁,可以分析出Y是硫酸,B是银,所以固体A就是铁和银,所以X就是铁,根据流程铁能与溶液中的硝酸银反应得到金属银及过量而未完全反应的铁;硝酸银被过量的铁完全反应,因此溶液中含有不与铁反应的硝酸锌和反应后生成及原溶液中就含的硝酸亚铁;
故答案为:(1)过滤;(2)Ag、Fe; Zn(NO3)2、Fe(NO3)2;H2SO4点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序和过滤的原理及阅读流程图等,要记住锌、铁、银的活动性,并学会从实验方案图中提炼有用的信息结合金属活动性顺序的意义进行运用.1年前查看全部
- (2004•宣武区二模)向某工厂排出的一种澄清废液中加入BaCl2溶液,产生白色沉淀,再加入足量稀HNO3,沉淀部分溶解
(2004•宣武区二模)向某工厂排出的一种澄清废液中加入BaCl2溶液,产生白色沉淀,再加入足量稀HNO3,沉淀部分溶解并放出能使澄清石灰水变浑浊的气体,下列说法正确的是( )
A.废液中一定有Ag+
B.废液中一定有CO 2−3
C.废液中一定有H2SO4
D.废液中一定无SO 2−4 konglongdan1年前1
konglongdan1年前1 -
 kcxthd 共回答了20个问题
kcxthd 共回答了20个问题 |采纳率100%解题思路:根据已知条件“混入BaCl2溶液,产生白色沉淀”可知,生成的沉淀为硫酸钡(或氯化银)和碳酸钡,然后根据沉淀部分溶于硝酸推断生成的沉淀有哪些,据此推断废液中存在的离子.①由已知条件“加入BaCl2溶液,产生白色沉淀”可知,生成的沉淀为硫酸钡(或氯化银)和碳酸钡;②因为硫酸钡(或氯化银)不溶于稀硝酸,由已知条件“加入足量稀硝酸,沉淀部分溶解”可知,放出能使澄清石灰水变浑浊...
点评:
本题考点: 常见离子的检验方法及现象.
考点点评: 本题考查了混合物成分推断,完成此题,可以依据物质的性质、物质的共存问题结合题干提供的实验现象进行.要求同学们加强对物质性质的掌握,以便灵活应用.1年前查看全部
- (2010•黄浦区三模)实验室的废液缸中收集了同学们制取二氧化碳后残留的溶液(二氧化碳已全部逸出、石灰石中的杂质不参加任
 (2010•黄浦区三模)实验室的废液缸中收集了同学们制取二氧化碳后残留的溶液(二氧化碳已全部逸出、石灰石中的杂质不参加任何反应,也不溶于水).
(2010•黄浦区三模)实验室的废液缸中收集了同学们制取二氧化碳后残留的溶液(二氧化碳已全部逸出、石灰石中的杂质不参加任何反应,也不溶于水).
(1)实验室制取二氧化碳反应的化学方程式是______.
(2)为确定溶液成分甲同学设计了如图所示的实验,B试管中滴入紫色石蕊,若石蕊变红色,说明待测液中的溶质是______;若石蕊呈______色,说明待测液中的溶质是______.
(3)A试管的CaCl2溶液的作用是______. Sam我喜欢你1年前1
Sam我喜欢你1年前1 -
 碎碎梦 共回答了14个问题
碎碎梦 共回答了14个问题 |采纳率100%解题思路:根据已有的知识进行分析,实验室制取二氧化碳使用碳酸钙与盐酸反应,石蕊试液遇酸变红.(1)碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)B试管中滴入紫色石蕊,若石蕊变红色,说明试液呈酸性,含有的溶质为氯化钙和盐酸,若石蕊呈紫色,则只含有氯化钙,故填:CaCl2、HCl,CaCl2;
(3)A试管的CaCl2溶液的作用是起对比作用,故填:对比.点评:
本题考点: 酸的化学性质;二氧化碳的实验室制法;酸碱指示剂及其性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了酸的性质,完成此题,可以依据已有的知识进行.1年前查看全部
- 实验室中有一烧杯废液,可能是由硫酸钾,氯化钠,氢氧化钠,硝酸钠,硫酸,硝酸,氯化铁,七种溶液中的几种溶液混合而成,安宁同
实验室中有一烧杯废液,可能是由硫酸钾,氯化钠,氢氧化钠,硝酸钠,硫酸,硝酸,氯化铁,七种溶液中的几种溶液混合而成,安宁同学为探究其成分,进行如下实验,假设每一步都恰好完全反应,1观察混合溶液为无色,2取少量的混合溶液,向其中加入适量的硝酸钡溶液,过滤 得到白色沉淀A,和滤液M,3向滤液M中加入适量的硝酸银溶液,过滤,得到白色沉淀B和滤液N,4向滤液N中滴加几滴紫色石蕊溶液,溶液呈红色.
请判断
A是____ B是---------
原混合溶液的ph值 7 ( 大于 小于 等于)
滤液M中含有的阴离子是
原混合溶液中一定含有的溶质是什么 starlonely1年前4
starlonely1年前4 -
 彩蝶双飞翼 共回答了18个问题
彩蝶双飞翼 共回答了18个问题 |采纳率77.8%A是_硫酸钡__ B是--氯化银-
原混合溶液的ph值 小于7 ( 大于 小于 等于)
滤液M中含有的阴离子是 氯离子和硝酸根离子
原混合溶液中一定含有的溶质是 硫酸、氯化钠1年前查看全部
- 现有含硝酸锌、硝酸亚铁和硝酸银的混合废液。下列有关说法正确的是 A.若要回收银,较为经济合理的方案是向废液中加稍过量的铁
现有含硝酸锌、硝酸亚铁和硝酸银的混合废液。下列有关说法正确的是
A.若要回收银,较为经济合理的方案是向废液中加稍过量的铁粉,过滤后向滤渣中加过量盐酸 B.若向废液中加入过量的锌粉,先置换出来的是铁 C.若向废液中加入一定量锌粉充分反应后过滤,向滤液中加入稀盐酸一定无现象 D.若向废液中加入一定量锌粉充分反应后过滤,滤液与原溶液相比,质量一定减小  wswchen1年前1
wswchen1年前1 -
 v9egleni 共回答了13个问题
v9egleni 共回答了13个问题 |采纳率76.9%A
1年前查看全部
- (2009•大连二模)某次实验结束时,各实验小组将含有硫酸铜、硫酸锌、硫酸亚铁的废液倒在废液缸里,考虑到废液直接排放会造
(2009•大连二模)某次实验结束时,各实验小组将含有硫酸铜、硫酸锌、硫酸亚铁的废液倒在废液缸里,考虑到废液直接排放会造成水污染,某化学活动小组利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:

(1)固体A的成分是铜铁锌铜铁锌.
(2)步骤③从固体A中分离出固体B的实验操作是用磁铁吸引用磁铁吸引.
(3)步骤④中发生反应的化学方程式是:Zn+H2SO4=ZnSO4+H2↑.Zn+H2SO4=ZnSO4+H2↑..
(4)若忽略实验过程中的物质损失,利用以上实验能否测定该废水中硫酸锌的质量分数?若认为能,写出最少需要称量哪些物质的质量;若不能,说明理由. 相逢是首歌20051年前1
相逢是首歌20051年前1 -
 chunxiang033 共回答了15个问题
chunxiang033 共回答了15个问题 |采纳率93.3%解题思路:(1)根据金属活动性顺序表的应用分析固体A的成分.
(2)根据B的特性分析从固体A中分离出固体B的实验操作;
(3)根据反应写出反应的方程式;
(4)根据要计算该废液中硫酸锌的质量分数,必须知道废液的质量及废液中所含硫酸锌的质量,废液的质量可以直接进行称量,废液中硫酸锌的质量可通过称量所得硫酸锌固体质量减去回收过程中所加入锌粉反应生成硫酸锌的质量,因此还必须称量得到硫酸锌固体与所加锌粉的质量.(1)由于金属的活动性大小是:锌>铁>铜,所以,过量的锌加入到含有硫酸铜、硫酸锌、硫酸亚铁的废液中,能把铜、铁全部置换出来.所以,固体A的成分是铜铁锌;
(2)由于滤液A、B蒸发至干得硫酸锌,可得知两滤液中的硫酸锌皆为硫酸锌;固体C加入过量的稀硫酸得到滤液B和铜.由上述分析可知,固体A的成分是铜铁锌.说明固体C是铜和锌的混合物,则B是铁,由于铁能磁铁吸引.所以,步骤③从固体A中分离出固体B的实验操作是用磁铁吸引;
(3)由流程图可知,步骤④是锌与稀硫酸反应,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑;
(4)根据溶液中溶质质量分数计算公式,要计算该废液中硫酸锌的质量分数,必须知道废液的质量及废液中所含硫酸锌的质量,在称量废液质量后,还必须称量得到硫酸锌固体与所加锌粉的质量,利用锌粉质量计算出所得到的硫酸锌中由锌粉反应生成硫酸锌的质量,所得硫酸锌固体质量与锌粉反应生成硫酸锌的质量差即为原废液中所含硫酸锌的质量.
故答为:(1)铜铁锌;(2)用磁铁吸引;(3)Zn+H2SO4=ZnSO4+H2↑;(4)能测定,需要称量废液的质量、硫酸锌的质量、锌粉的质量.点评:
本题考点: 物质的相互转化和制备.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来1年前查看全部
- 某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO 4 .
某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO 4 .
(1)CuSO 4 是重金属盐,能与蛋白质发生______变化(选填“物理”或“化学”),使蛋白质失去原来的生理功能,所以CuSO 4 有毒.
(2)为了测定废液中CuSO 4 的质量分数,该小组取了100g废液,逐滴加入NaOH溶液至过量.测得生成Cu(OH) 2 沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如上图所示:
①说明图中的OA段未生成Cu(OH) 2 沉淀的原因.
②计算废液中CuSO 4 的质量分数(写出计算过程,结果保留1位小数).
如果仍取l00g废液,向其中逐滴加入过量的BaCl 2 溶液,充分反应后,过滤,将所得沉淀洗涤、干燥称得质量为m g,能否用含m的代数式表达废液中CuSO 4 的质量分数?______ (填“能’,或“不能”)并说明你的理由.______.
 qq1711年前1
qq1711年前1 -
 nirvanafnt 共回答了18个问题
nirvanafnt 共回答了18个问题 |采纳率77.8%(1)重金属离子可以改变蛋白质的结构,使蛋白质失去原来的生理功能,所以发生的是化学变化.
故答案为:化学
(2)①因为废液还有酸,氢氧化钠溶液先与废液中的酸性物质发生反应,没有沉淀产生.
故答案为:氢氧化钠溶液先与废液中的酸性物质发生反应,没有沉淀产生.
②根据图可以看出生成氢氧化铜的质量为3.92g
设废液中CuSO 4 的质量为x
CuSO 4 +2NaOH=Na 2 SO 4 +Cu(OH) 2 ↓
160 98
X 3.92g
160
x =
98
3.92g
解之得:x=6.4g
废液中CuSO 4 的质量分数=
硫酸铜的质量
废液的质量 ×100%=
6.4g
100g ×100%=6.4%
答:废液中CuSO 4 的质量分数6.4%
③因为废液中含有硫酸,硫酸也可以和氯化钡生成硫酸钡沉淀,不能用沉淀的质量来求出硫酸铜的质量.
故答案为:不能; 废液中的硫酸也能与氯化钡溶液反应生成硫酸钡1年前查看全部
- 1.普通镀液使用一段时间后就需更换新的镀液,电镀废液可以直接倒入下水道吗?为什么?电镀废液在排放之前应
 江枫渔火13141年前3
江枫渔火13141年前3 -
 辣笔小心43 共回答了27个问题
辣笔小心43 共回答了27个问题 |采纳率100%电镀废水是要经过处理之后才可以排放的,一般重金属含量都在0.5ppm以下,有的0.03ppm以下.
杜笙树脂1年前查看全部
- 2005年1月1日起,各地环保部门将对实验室类污染实施严格的环境监管.某校实验室里有50kg氢氧化钠废液,该校用某化工厂
2005年1月1日起,各地环保部门将对实验室类污染实施严格的环境监管.某校实验室里有50kg氢氧化钠废液,该校用某化工厂废弃的稀硫酸来中和后排放.当测得溶液pH=7时,中和后溶液的总质量为100kg,测得反应后的溶液中溶质的质量分数为7.1%,求:
(1)反应生成的硫酸钠的质量是多少?
(2)所用的稀硫酸中溶质的质量分数为多少?
(3)该校实验室的氢氧化钠废液中溶质的质量分数是多少? 芙蓉影1年前1
芙蓉影1年前1 -
 永恒一日 共回答了18个问题
永恒一日 共回答了18个问题 |采纳率88.9%(1)100kg×7.1%=7.1kg;
(2)设参与反应的H 2 SO 4 的质量为x,参与反应的NaOH的质量为y,
2NaOH+H 2 SO 4 =Na 2 SO 4 +2H 2 O
8098 142
y x 7.1kg
∴98:142=x:7.1kg,80:142=y:7.1kg,
解之得:x=4.9kg,y=4kg,
4.9kg
100kg-50kg ×100% =9.8%;
(3)
4kg
50kg × 100% =8%.
答:(1)反应生成的硫酸钠的质量是7.1kg;
(2)所用的稀硫酸中溶质的质量分数为9.8%;
(3)该校实验室的氢氧化钠废液中溶质的质量分数是8%.1年前查看全部
- 电镀废液中(Cr2O7)2-可通过下列反应转换成铬黄(PbCrO4):下列说法正确的是( )
电镀废液中(Cr2O7)2-可通过下列反应转换成铬黄(PbCrO4):下列说法正确的是( )
电镀废液中(Cr2O7)2-可通过下列反应转换成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)2 PbCrO4(s)+2H+ 为放热反应
A:加入一定量的水,平衡会向正反应方向进行,溶液的PH会减小
B:加入少量烧碱固体,不利于(Cr2O7)2-转化成铬黄
C:增大反应物Pb2+的浓度,平衡向正反应方向移动,铬黄的物质的量会增大
D:降低温度,平衡向正反应方向进行,正反应速率增大,逆反应速率减小 yudagou1年前3
yudagou1年前3 -
 nooneissafe 共回答了22个问题
nooneissafe 共回答了22个问题 |采纳率90.9%A:加入水,平衡向正反应方向移动,不过pH值不变,故错
B:加入氢氧化钠,会消耗掉生成物氢离子,平衡向正反应方向移动,有利于铬黄生成.故错
C:你因该会,如果不懂追问
D:降低温度,由于是放热反应,所以平衡向逆反应方向移动,故错1年前查看全部
- 某化工厂排放的废液中含有大量的硫酸锌和硫酸铜,化学兴趣小组的同学根据所学知识设计了一个方案,用来回收金属铜并得到硫酸锌晶
某化工厂排放的废液中含有大量的硫酸锌和硫酸铜,化学兴趣小组的同学根据所学知识设计了一个方案,用来回收金属铜并得到硫酸锌晶体,主要过程如图所示:

请回答下列问题:
(1)步骤②中分离物质的方法是______.
(2)固体A的成分是______.
(3)步骤②中发生反应的化学方程式为______,
(4)步骤③中加入的B物质是______. 老汤1年前1
老汤1年前1 -
 lclclc20909 共回答了15个问题
lclclc20909 共回答了15个问题 |采纳率80%解题思路:一般的除杂质题必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.根据题目给出的流程图和信息:固体与液体分开的方法叫过滤;硫酸锌和硫酸铜的混合液中加入过量的锌粉,锌与硫酸铜反应生成硫酸锌和铜,过滤后固体A是铜和锌的混合物,滤液是硫酸锌溶液;铜和锌的混合物中加入适量的稀硫酸,铜不反应,锌与硫酸反应生成硫酸锌和氢气,过滤得到铜,滤液是硫酸锌;然后把硫酸锌溶液蒸发结晶得到硫酸锌晶体.(1)固体与液体分开的方法叫过滤,故答案为:过滤
(2)硫酸锌和硫酸铜的混合液中加入过量的锌粉,锌与硫酸铜反应生成硫酸锌和铜,过滤后固体A是铜和锌的混合物,滤液是硫酸锌溶液;故答案为:锌和铜
(3)锌与硫酸铜反应生成硫酸锌和铜,故答案为:Zn+CuSO4═Cu+ZnSO4
(4)铜和锌的混合物中加入适量的稀硫酸,铜不反应,锌与硫酸反应生成硫酸锌和氢气,过滤得到铜,滤液是硫酸锌;故答案为:稀硫酸点评:
本题考点: 物质除杂或净化的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于物质的除杂或净化的探究,还考查了化学方程式的书写,是中考的一个难点,也是学生经常出错的题型.根据物质的溶解性和除杂质的条件,要认真分析,综合把握.还要加强记忆除去常用离子的方法和物质的溶解性,从而突破难点,本考点经常出现在填空题和实验题中.1年前查看全部
- 某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO 4 。
某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO 4 。
(1)CuSO 4 是重金属盐,能与蛋白质发生__________变化(选填“物理”、“化学”),使蛋白质失去原来的生理功能,所以CuSO 4 有毒。
(2)为了测定废液中CuSO 4 的质量分数,该小组取了100g废液,逐滴加入NaOH溶液至过量.测得生成Cu(OH) 2 沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如下图所示: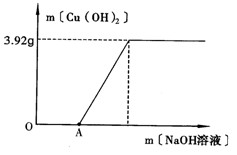
①说明图中的OA段未生成Cu(OH) 2 沉淀的原因。
②计算废液中CuSO 4 的质量分数(写出计算过程,结果保留1位小数)。
③如果仍取100g废液,向其中逐滴加入过量的BaCl 2 溶液,充分反应后,过滤,将所得沉淀洗涤、干燥称得质量为mg,能否用含m的代数式表达废液中CuSO 4 的质量分数?______(填“能”或“不能”)。 haisay12191年前1
haisay12191年前1 -
 vinery14 共回答了21个问题
vinery14 共回答了21个问题 |采纳率100%1年前查看全部
- 废液可能由NaCl、Na2SO4、NaCO3的混合液 猜想1 废液由NaCl、NaCO3组成 2 NACl、Na2SO4
废液可能由NaCl、Na2SO4、NaCO3的混合液 猜想1 废液由NaCl、NaCO3组成 2 NACl、Na2SO4组成
猜想3 NaCO3 Na2SO4
猜想4 NaCl、Na2SO4、NaCO3
实验操作 (1)用试管取一定量的废液,滴加过量的Ba(NO3)2溶液
(2) 在(1)的反应液中滴加过量的_______
(3) 将(2)的反应液静置,继续滴加适量的_____溶液
实验现象 (1) 有白色沉淀生成
(2) ____________
(3) _____________
实验结论 “猜想4成立”
(1) 第1步滴加Ba(NO3)2 为什么要过量
理由是__________________
(2) 只改变试剂的顺序,也可以把它们鉴别出来 滴加这些试剂的顺序为
_____________________、____________________、____________________. gengpanxin1年前4
gengpanxin1年前4 -
 油漆未干125 共回答了19个问题
油漆未干125 共回答了19个问题 |采纳率84.2%实验操作:(2)HNO3 (3)AgNO3
实验现象:(2)产生气泡,白色沉淀部分溶解 (3)产生白色沉淀
实验结论:(1)确保除尽Na2SO4和Na2CO3,防止在加入AgNO3时产生微溶的Ag2SO4干扰
(2)HNO3 Ba(NO3)2 AgNO31年前查看全部
- 某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份1
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量AgNO3溶液,得干燥沉淀3.50g.
②第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变.
根据上述实验,以下推测正确的是( )
①一定存在Mg2+②可能存在CO32-③一定存在Cl-④可能存在Ba2+⑤可能存在Mg2+.
A. ①③
B. ②③
C. ③⑤
D. ④⑤ 无敌双城1年前1
无敌双城1年前1 -
 打字小老鼠 共回答了21个问题
打字小老鼠 共回答了21个问题 |采纳率90.5%解题思路:据题意分析,pH=1的工业废液,含有H+,第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、SO42-.第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变,利用发生的离子反应,经过计算、推得一定存在SO42-,一定不存在Ba2+、根据溶液中阴阳离子的电荷守恒,即可推出Mg2+一定存在.①根据题意,pH=1的工业废液,含有H+,100mL溶液H+物质的量═0.01mol,因CO32-+2H+═CO2↑+H2O,因此两者不能大量共存,一定不存在CO32-,故②错误;
Ba2+和SO42-,可发生离子反应生成BaSO4沉淀,因此两者不能大量共存,一定存在SO42-,故④错误;
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、SO42-;
第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变,因BaCO3沉淀可溶于盐酸,BaCO3+2HCl═BaCl2+CO2↑+H2O,所以得沉淀2.33g为不溶于盐酸的BaSO4,发生反应SO42-+Ba2+═BaSO4↓,因此溶液中一定存在SO42-,一定不存在Ba2+、CO32-、由条件可知BaSO4为2.33g,物质的量为 [2.33g/233g/mol]=0.01mol,SO42-的物质的量等于0.01mol,根据SO42-+2Ag+═Ag2SO4↓,生成沉淀Ag2SO4为0.01mol×312g/mol=3.12g,第一份加入足量AgNO3溶液,得干燥沉淀3.50g,说明发生Cl-+Ag+═AgCl↓生成沉淀AgCl为3.50g-2.33g═1.17g,Cl- 的物质的量等于0.02mol,所以一定存在Cl-,故③正确;
Cl-、SO42-所带负电荷分别为0.02mol×1、0.01mol×2,H+所带正电荷为0.01mol,
根据溶液中的电荷守恒,溶液呈电中性,则一定含有镁离子,且镁离子的物质的量为0.02mol×1+0.01mol×2-0.01mol×1=0.03mol,故①正确;
故选A.点评:
本题考点: 常见离子的检验方法.
考点点评: 本题考查了离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,题目难度较大.1年前查看全部
- (2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体
(2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题:

(1)步骤①中,金属X是______,该反应的化学方程式为______;
(2)步骤②中,加入过量稀硫酸的目的是______;
(3)从滤液中获得硫酸亚铁晶体采用的方法是______. 踩了谁的尾巴1年前1
踩了谁的尾巴1年前1 -
 流浪的ll 共回答了14个问题
流浪的ll 共回答了14个问题 |采纳率92.9%解题思路:(1)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;
(2)由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)蒸发从溶液中获得晶体常采用的方法.(1)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4 ═FeSO4 +Cu;
(2)步骤②中,加入过量稀硫酸的目的是:使铁完全反应,除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发.
故答为:(1)铁,Fe+CuSO4 ═FeSO4 +Cu;(2)使铁完全反应,除去铜中的铁;(3)蒸发.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 解答本题时要注意混合物的分离要考虑为彻底分开而加入过量试剂,所以后一环节需要将之除去.1年前查看全部
大家在问
- 1come again next time有语法错误吗
- 2“打量某人”可以用look sb up and down吗?
- 3I cleaning the house now改错 DO you often talking with your st
- 4连词成句1、shupping you go do how 2、time great a at have park the
- 5l can't find the mp4.where did you put it? l it somewhe
- 6(本小题满分14分)(文科)已知曲线 的离心率 ,直线 过 、 两点,原点 到 的距离是 .
- 7(2009·山东模拟)下列家庭物品是用天然材料制成的是( ) A.门窗玻璃 B.木制写字台 C.
- 8一个蓄水池长8米,宽5米,深3米.在蓄水池的底面和四周都抹上水泥,抹水泥的面积有多大?
- 9假定一物体在下落时受到的空气阻力与它的速度平方成正比,已知物体的速度达到40m/s就匀速下落,则当它的速度为20m/s时
- 10关于英语with 放在句尾怎么翻译?the Peter had had dinner怎么翻译.为什么用两个had had
- 11以my favorite teacher 为题写一篇英语作文
- 12解一元二次不等式时,当方程无解时,解集怎么写
- 13现定义一种新运算aδb=(a+2b)(2a-b),其中a、b为有理数,求xδ(-y)的值
- 14用静组词填空 ( )的脸,( )地思考 快.快
- 15关于梦想会实现的英语好句要多排比啊什么的,用在演讲稿上的。