Ag2SO4的溶度积Ksp=1.4*10^-5,今有500mL 1mol/L的AgNO3溶液,如果用0.2mol/L的硫
 daisy_xd2022-10-04 11:39:541条回答
daisy_xd2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 c5232069 共回答了20个问题
c5232069 共回答了20个问题 |采纳率95%- 在保持固液共存即体系中有硫酸银固体、硫酸根及银离子的情况下,当C(Ag+)小于1*10^-5mol/L时由Ksp可求得此时C(SO42-)>1.4*10^5mol/L,显然不可达到..也就是说无法保持在溶液中存在硫酸银固体的情况下是C(Ag+)小于1*10^-5mol/L.
另一种使得C(Ag+)小于1*10^-5mol/L的方法是通过加硫酸溶液来稀释银离子.此时可轻易求得V>(5*10^4-0.5)L.显然也不可行.
因此不能用硫酸银沉淀来去净银离子. - 1年前
相关推荐
- 已知:Ksp(Ag2SO4)=1.4×10-5,Ksp(BaSO4)=1.1×10-10,Ksp(CaSO4)=9.1×
已知:Ksp(Ag2SO4)=1.4×10-5,Ksp(BaSO4)=1.1×10-10,Ksp(CaSO4)=9.1×10-6,Ksp(BaCO3)=2.6×10-9.则下列说法中不正确的是( )
A. 有关的四种盐中溶解性最强的是Ag2SO4
B. 有关的三种硫酸盐中,其饱和溶液中硫酸根离子浓度最小的是BaSO4
C. CaSO4沉淀能较容易地转化成为BaSO4沉淀
D. BaSO4沉淀不可能会转化成BaCO3沉淀 青茉1年前1
青茉1年前1 -
 qjs2004 共回答了14个问题
qjs2004 共回答了14个问题 |采纳率71.4%解题思路:根据溶度积常数的大小可比较物质的溶解性,一般来说,难溶电解质的溶度积常数越大,物质的溶解性越强,反之越小,难溶电解质之间可实现由溶度积常数较大的物质转化为溶度积常数较小的物质.A、Ag2SO4的溶度积常数最大,一般来说,难溶电解质的溶度积常数越大,物质的溶解性越强,故A正确;
B、Ag2SO4饱和溶液中硫酸根离子浓度为
3
1.4×10−5
2
,BaSO4饱和溶液中硫酸根离子浓度为
1.1×10−10,
CaSO4饱和溶液中硫酸根离子浓度为
9.1×10−6,三种硫酸盐中,其饱和溶液中硫酸根离子浓度最小的是BaSO4,故B正确;
C、BaSO4的溶度积常数小于CaSO4,则CaSO4沉淀能较容易地转化成为BaSO4沉淀,故C正确;
D、当溶液中c(Ba2+)×c(CO32-)>9.1×10-6时,可实现BaSO4沉淀转化成BaCO3沉淀,故D错误.
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡和沉淀转化,题目难度不大,注意理解溶度积常数与溶解性的关系.1年前查看全部
- (2008•广东)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100mL水中至刚好饱
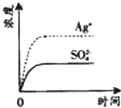 (2008•广东)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO32-浓度随时间变化关系如图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol•L-1).若t1时刻在上述体系中加入100mL. 0.020 mol•L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
(2008•广东)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO32-浓度随时间变化关系如图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol•L-1).若t1时刻在上述体系中加入100mL. 0.020 mol•L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
A.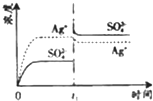
B.
C.
D.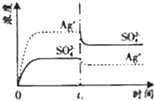
 貴族牛奶1年前1
貴族牛奶1年前1 -
 楚山碧 共回答了17个问题
楚山碧 共回答了17个问题 |采纳率94.1%解题思路:计算溶液混合后银离子和硫酸根离子的浓度,再 计算浓度幂之积,与平衡常数相比较,判断溶液离子浓度变化.Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol•L-1,则c(SO42-)=0.017mol•L-1;
当加入100ml 0.020mol•L-1Na2SO4溶液后,c(SO42-)=[0.017+0.020/2]=0.0185mol•L-1,c(Ag+)=0.017mol•L-1,
若没有沉淀析出,则混合后银离子浓度为原来的一半,硫酸根离子浓略有增大,由此可以看出应为B图象,
此时Q=c(SO42-)•c2(Ag+)=0.0185×(0.017)2=5.346×10-6<Ksp=2.0×10-3,则该溶液中没有沉淀析出,
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查本题考查了沉淀溶解平衡移动,考查了学生对图表、文字信息的获取与分析应用能力,要求学生掌握溶度积常数的基本概念以及简单应用.1年前查看全部
- 铁与银离子反应银离子的最小浓度其实就是Fe能否与Ag2SO4反应我觉得Ag+浓度太小但不会算
 52004151年前1
52004151年前1 -
 天空的云彩 共回答了25个问题
天空的云彩 共回答了25个问题 |采纳率80%Fe与Ag2SO4反应,离子方程式 Fe + Ag2SO4 = Fe2+ + 2Ag + SO42-
温度设为室温298K,按照电化学做法,
负极反应 Fe - 2e = Fe2+,φө(-)=φө(Fe2+/Fe)=-0.447V
正极反应 Ag2SO4 + 2e = Ag + SO42-,φө(+)=φө(Ag2SO4/Ag)=φө(Ag+/Ag)+0.0592/2×lgKspө(Ag2SO4)=0.799+0.0296×lg(1.2×10^-5)=0.653V
电池电动势 Eө=φө(+)-φө(-)=0.653-(-0.447)=1.100V
传递电子数 z=2
平衡常数 Kө=10^(2×1.100/0.0592)=1.4×10^37
反应可以进行到底.
事实上,别说Ag2SO4,哪怕是极难溶的AgI,也能够完全被Fe还原(平衡常数大约为10^10).1年前查看全部
- 常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17.下列有关说法中,错误的是( )
A. 常温下,AgCl、AgI在水中溶解能力依次减弱
B. 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C. Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D. 在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出 lubnbc1年前1
lubnbc1年前1 -
 骑龟去看大海龟 共回答了25个问题
骑龟去看大海龟 共回答了25个问题 |采纳率88%解题思路:因为硫酸银、氯化银、碘化银的化学式不类似,故需要根据其浓度积常数计算出银离子的浓度;在Ag2SO4饱和溶液中加入Na2SO4固体,[SO42-]增大,
Qc>Ksp,故有Ag2SO4沉淀析出.A、由于AgCl、AgI的化学式相似,所以Ksp越大,溶解能力越大,所以常温下AgCl、AgI在水中溶解能力依次减弱;故A正确;
B、AgCl比AgI的溶度积常数大,说明AgI难溶,在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成,故B正确;
C、由于AgCl、AgI的化学式相似,所以AgCl和AgI满足溶度积常数之比等于它们饱和溶液的物质的量浓度之比,但Ag2SO4不满足,Ksp(Ag2SO4)=[Ag+]2[SO42-],由于含有[Ag+]2项,因此它与另外两种的溶度积之比中含有[Ag+],故C错误;
D、在Ag2SO4饱和溶液中加入Na2SO4固体,[SO42-]增大,Qc>Ksp,故有Ag2SO4沉淀析出,故D正确.
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡,本题难度中等,注意平衡常数的理解和运用.1年前查看全部
- 检验氯离子为什么要用AgNo3?Ag2So4或其他的银不行吗?还有请写出粗盐提纯的每一步方法,写出化学方程式,还有怎样除
检验氯离子为什么要用AgNo3?Ag2So4或其他的银不行吗?还有请写出粗盐提纯的每一步方法,写出化学方程式,还有怎样除去杂质?
 半山小蛮腰1年前4
半山小蛮腰1年前4 -
 爱你才懂你 共回答了14个问题
爱你才懂你 共回答了14个问题 |采纳率85.7%银盐大部分都是微溶或难溶,只有硝酸银可溶,Ag2SO4也是微溶的.
粗盐提纯:溶于水,过滤,去除泥沙;滤液中含有Ca2+、SO42-、Mg2+;可以加入BaCl2、Na2CO3、NaOH分别除去SO42-、Ca2+、Mg2+;因为沉淀剂都加入过量,操作顺序要考虑后面操作可以除去前面的沉淀剂杂质离子,所以要BaCl2一定要比Na2CO3先加入,因为碳酸根可以除去Ba2+.最后用盐酸酸化,就可以除去过量的碳酸根和氢氧根离子.1年前查看全部
- MgCl2+Ag2SO4能不能制取MgSO4 Mg(OH)2+CuSO4能不能制取MgSO4
 kitty-zmn_cc1年前6
kitty-zmn_cc1年前6 -
 mm晴晴 共回答了15个问题
mm晴晴 共回答了15个问题 |采纳率66.7%从热力学上是可以的
Mg(OH)2+CuSO4==MgSO4+Cu(OH)2
写为离子方程式Mg(OH)2+Cu2+==Mg2+ +Cu(OH)2
反应的平衡常数K=[Mg2+]/[Cu2+]=([Mg2+]*[OH-]2)/([Cu2+]*[OH-]2)=Ksp(Mg(OH)2)/Ksp(Cu(OH)2)=(10ˆ-11))/(10ˆ-20)=)=10ˆ9>>1,反应向右进行
另一个反应以相同方法推出向右进行
但同时也要考虑动力学问题,因为是固液反应,速度可能很慢,甚至可能慢到实际上不反应.1年前查看全部
- AgNO3+HCl 与Ag2SO4+NaCl在溶液里的反应,可以用同一个离子方程式表示吗
AgNO3+HCl 与Ag2SO4+NaCl在溶液里的反应,可以用同一个离子方程式表示吗
答案说不行,我认为前提是在溶液中,Ag2SO4即使微溶,也可以电离 xx风1291年前4
xx风1291年前4 -
 xyzxyz_ 共回答了19个问题
xyzxyz_ 共回答了19个问题 |采纳率100%AgNO3+HCl 的反应一定是Ag++Cl-=AgCl↓;
Ag2SO4是微溶的,若是Ag2SO4是溶液,则Ag2SO4拆开写,离子方程式为:Ag++Cl-=AgCl↓,
如果Ag2SO4是浑浊液,则Ag2SO4不拆开写,离子方程式为:Ag2SO4+2Cl-=2AgCl↓+SO42-.1年前查看全部
- MgCl2+Ag2SO4反应能生成MgSO4么
 lijianyek0281年前2
lijianyek0281年前2 -
 yz126 共回答了23个问题
yz126 共回答了23个问题 |采纳率87%从高中化学来看能反应的,微溶的硫酸银能转化为更难溶解的氯化银,在生成氯化银的同时,生成硫酸镁.1年前查看全部
- 将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:Ag2SO4(s)⇌Ag2O(s
将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:Ag2SO4(s)⇌Ag2O(s)+SO3(g),2SO3(g)⇌2SO2(g)+O2(g).反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中不正确的是( )
A. 容器里气体的密度为40 g/L
B. SO3的分解率为20%
C. 在这10 min内的平均速率为υ(O2)=0.005 mol•L-1•min-1
D. 化学反应速率:υ(Ag2SO4)=υ(SO3) 边走边爱j1年前3
边走边爱j1年前3 -
 其实我很纯洁 共回答了13个问题
其实我很纯洁 共回答了13个问题 |采纳率92.3%解题思路:已知①Ag2SO4(s)⇌Ag2O(s)+SO3(g),②2SO3(g)⇌2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,以此解答该题.已知①Ag2SO4(s)⇌Ag2O(s)+SO3(g),②2SO3(g)⇌2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,
A.c (SO2)=0.1mol/L,则c (O2)=0.05mol/L,设容器体积为1L,则容器里气体的密度为[0.4mol/L×1L×80g/mol+0.1mol/L×1L×64g/mol+0.05mol/L×1L×32g/mol/1L]=40g/L,故A正确;
B.反应②中SO3的分解率为[0.1mol/L/0.5mol/L]×100%=20%,故B正确;
C.平衡时c (SO2)=0.1mol/L,则c(O2)=0.05mol/L,在这10min内平衡时氧气的反应速率=[0.05mol/L/10min]=0.005mol/(L•min),故C正确;
D.因为纯固体不可以用来表示反应速率,所以υ(Ag2SO4)表达错误,故D错误.
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度不大,注意根据两个反应的浓度关系结合方程式进行计算,易错点为D,注意纯固体不可以用来表示反应速率.1年前查看全部
- 用硫酸做电解质溶液的粗铜精炼的电解池,阳极泥成分是金属Ag还是硫酸盐Ag2SO4
 zy198602021年前2
zy198602021年前2 -
 4802647 共回答了20个问题
4802647 共回答了20个问题 |采纳率85%按理说,电性比铜正的银,在阳极泥中大部分是以金属Ag的极细粉末存在,(只有极少量银能被二价的铜离子所氧化进入溶液).1年前查看全部
- Ag2SO4能和HNO3反应吗,如果能,那么2AgNO3+H2SO4=Ag2SO4+2HNO3是不是就不存在了呢?
 tyrudo1年前2
tyrudo1年前2 -
 吴庭伟 共回答了26个问题
吴庭伟 共回答了26个问题 |采纳率88.5%注意HNO3的浓度,只和浓的反应,而生成的是稀的1年前查看全部
- 一条关于溶度积的高中化学题25℃时,Ag2SO4的溶度积为1.4×10-5.向100mL浓度为0.0100mol/L的A
一条关于溶度积的高中化学题
25℃时,Ag2SO4的溶度积为1.4×10-5.向100mL浓度为0.0100mol/L的AgNO3溶液中滴加Na2SO4溶液,当滴加到100mL时溶液刚好出现沉淀,则该Na2SO4溶液的浓度为
A,1.4×10-3mol/L B,2.8×10-3mol/L C,0.56mol/L D,1.12mol/L
我的财富不够啊.我只能提供这么多
我是高三的.帮帮忙啊 谢谢 meiwentang1年前2
meiwentang1年前2 -
 bkslu 共回答了17个问题
bkslu 共回答了17个问题 |采纳率76.5%选c [Ag2so4]=[ag+]^2[so42-] [ag+]=(0.01*100)/200=0.005 则(0.005)^2*[so42-]=1.4*10^-5 [so42-]=0.56mol/l 这样就的结果啦 快高考啦 祝你成功啊1年前查看全部
- 已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该
已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1).若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是(B)
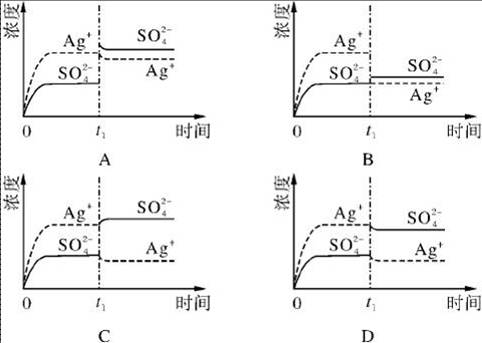
Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol/L,所以c(SO42-)=0.017mol/L;当加入100ml 0.020mol/LNa2SO4溶液后,c(SO42-)=0.0185mol/L,c(Ag+)=0.017mol/L(此时Q
我的问题如下:1.如果根据已知Ag2SO4的KW 为2.0×10-3,银离子浓度c(Ag+)=0.034mol/L,根据ksp=c2(Ag+)*c(SO42-)=2.0×10-3,计算出c(SO42-)浓度明显不是0.017mol/L
2.向饱和的Ag2SO4溶液加入Na2SO4后,不是应该使溶解平衡向逆方向移动么?可是解释中计算出来此时的Q 人生入梦醒时醉1年前4
人生入梦醒时醉1年前4 -
 黑泽翦 共回答了18个问题
黑泽翦 共回答了18个问题 |采纳率100%看了前三楼的回答,我想你已经明白是怎么回事了..具体解释我想是没必要了..我只想帮你总结下...尤其是透过这道题增加应试经验..希望对楼主有用...
1.准确理解概念(或名词术语).比如这道题kw就是表示水的离子积,而不是ksp浓度积常数,楼主你主观的把他认为了ks.其实就表明了这个概念在你脑海中并没有根深蒂固.如果你一开始看到kw就反应出这是表示水的,就不会有第一点的迷糊.殊不知,在高考或者平时考试中,对概念的准确把握,可以解决大部分自己迷惑的地方.我举个我的例子:2+6i的虚部是多少?我写了6i.其实虚部的概念为i前面的实数,即这里的6.我就是因为没理解好概念导致错了一个简单的选择题5分...如果这样的问题出现在高考,我想谁都会觉得惋惜的..
2.每一步推断都要合理,即有理有据的合理推断..比如说楼主的第二点疑问:你认为
向饱和的Ag2SO4溶液加入Na2SO4后,不是应该使溶解平衡向逆方向移动么? 这里就没有合理推断了..如果加的是硫酸钠固体那没问题,但这里是溶液,加溶液会影响体积,进而影响各组分的浓度,所以你只要按照Q的定义,先把Ag 和SO4的浓度算出来,再算浓度商,所有的问题就迎刃而解了...所以在准确理解概念的提前下,每一步都做到有理有据,“步步为营”,自然可以减少失误..1年前查看全部
- AG2SO4溶于稀HNO3吗
 Ivan61年前2
Ivan61年前2 -
 qq中的小猫咪 共回答了17个问题
qq中的小猫咪 共回答了17个问题 |采纳率88.2%不溶,银离子形成的沉淀除了碳酸银,氧化银,氢氧化银之外都不溶于稀硝酸1年前查看全部
- (2011•福建模拟)某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
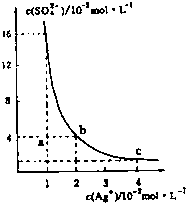 (2011•福建模拟)某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
(2011•福建模拟)某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
A.b点对应的Kap等于c点对应的Kap
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Kap)为1.6×10-5(mol•L-1)2
D.0.02mol•L-1的AgNO3溶液与的0.2mol•L-1的Na2SO4溶液等体积混合不会生成沉淀 ohyeahoh11年前1
ohyeahoh11年前1 -
 大头囡囡 共回答了20个问题
大头囡囡 共回答了20个问题 |采纳率95%解题思路:在相同温度下,Ag2SO4的溶度积为定值,随着浓度SO42-的增大,Ag+浓度逐渐减小,位于曲线的点b、c为平衡状态,即溶液达到饱和,a为不饱和状态,以此解答该题.A.在相同温度下,Kap相同,故A正确;
B.蒸发溶液,Ag+浓度和SO42-浓度都增大,不可能为a点达到b点,故B错误;
C.由图象可知,Ag2SO4的溶度积常数Ksp=(0.02)2×0.04=1.6×10-5((mol•L-1)2),故C正确;
D.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(Ag+)=0.01moL/L,c(SO42-)=0.1mol/L,则(0.01)2×0.1=1×10-5<1.6×10-5,没有沉淀生成,故D正确.
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度中等,注意把握题给图象曲线的意义,根据图象中的数据计算溶度积常数.1年前查看全部
- 将一定量的固体Ag2SO4置于容积不变的密闭容器中(装有少量V2O5),某温度下发生反应:Ag2SO4(s)⇌Ag2O(
将一定量的固体Ag2SO4置于容积不变的密闭容器中(装有少量V2O5),某温度下发生反应:Ag2SO4(s)⇌Ag2O(s)+SO3(g),2SO3(g)⇌2SO2(g)+O2(g),反应经过10min达到平衡,测得c(SO3)=0.4mol/L,c(SO2)=0.1mol/L,则下列叙述中不正确的是( )
A.这10 min内氧气的平均反应速率为0.005 mol•mol-1•min-1
B.SO3的分解率为20%
C.容器里气体的密度为40g/L
D.硫酸银与三氧化硫的化学反应速率相同 zycompass1年前1
zycompass1年前1 -
 xiaoyao6572004 共回答了21个问题
xiaoyao6572004 共回答了21个问题 |采纳率95.2%解题思路:反应经过10min达到平衡,测得c(SO3)=0.4mol/L,c(SO2)=0.1mol/L,由2SO3(g)⇌2SO2(g)+O2(g),可知消耗c(SO3)=0.1mol/L,平衡时剩余c(SO3)=0.4mol/L,则在反应Ag2SO4(s)⇌Ag2O(s)+SO3(g)中,生成c(SO3)=0.4mol/L+0.1mol/L=0.5moL/L,以此解答该题.A.v(O2)=[1/2]v(SO2)=[1/2]×[0.1mol/L/10min]=0.005 mol•mol-1•min-1,故A正确;
B.SO3的分解率为[0.1mol/L/0.5mol/L×100%=20%,故B正确;
C.c(SO3)=0.4mol/L,c(SO2)=0.1mol/L,由2SO3(g)⇌2SO2(g)+O2(g),可知c(O2)=0.05mol/L,则容器里气体的密度为
0.4mol×80g/mol+0.1mol×64g/mol+0.05mol×32g/mol
1L]=40g/L,故C正确;
D.硫酸银为固体,浓度基本不变,不能比较与三氧化硫的化学反应速率关系,故D错误.
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的移动,侧重于化学平衡的计算,注意根据两个化学反应确定三氧化硫的转化,为解答该题的关键,题目难度不大.1年前查看全部
- (2009•深圳二模)某温度下,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 (2009•深圳二模)某温度下,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2009•深圳二模)某温度下,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A.a点表示Ag2SO4的不饱和溶液,加入Na2SO4固体可以使溶液由a点变到b点
B.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到c点
C.0.04mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合有Ag2SO4沉淀生成
D.Ag2SO4的溶度积常数(Ksp)为1×10-3 _T_C_1年前1
_T_C_1年前1 -
 jeoh8 共回答了20个问题
jeoh8 共回答了20个问题 |采纳率95%解题思路:在相同温度下,Ag2SO4的溶度积为定值,随着浓度SO42-的增大,Ag+浓度逐渐减小,位于曲线的点c、b为平衡状态,即溶液达到饱和,a为不饱和状态,以此解答该题.A.点表示Ag2SO4的不饱和溶液,加入Na2SO4固体,Ag+浓度不变,SO42-浓度增大,可以使溶液由a点变到b点,故A正确;
B.蒸发溶液,Ag+浓度和SO42-浓度都增大,不可能达到c点,故B错误;
C.0.04mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(Ag+)=0.02moL/L,c(SO42-)=0.1mol/L,则(0.02)2×0.1=4×10-5,
Ag2SO4的溶度积常数Ksp=(0.02)2×0.05=2×10-5,所以有沉淀析出,故C正确;
D.由图象可知,Ag2SO4的溶度积常数Ksp=(0.02)2×0.05=2×10-5,故D错误.
故选AC.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度中等,注意把握题给图象曲线的意义,根据图象中的数据计算溶度积常数.1年前查看全部
- Ksp(Ag2SO4)=7.7*10^(-5),ksp(AgCl)=1.8*10^(-10),在水中溶解能力怎么比较?
Ksp(Ag2SO4)=7.7*10^(-5),ksp(AgCl)=1.8*10^(-10),在水中溶解能力怎么比较?
像这类不同元的难溶电解质在水中溶解能力怎么比较?看什么? lw65531701年前2
lw65531701年前2 -
 sxhzlzy 共回答了14个问题
sxhzlzy 共回答了14个问题 |采纳率100%对于不同类型的物质进行溶解能力比较时,不能直接用ksp进行,需要换算成溶解的浓度进行比较,计算如下:对Ag2SO4溶解度为:s = [Ksp / 4]^ 1/3 = [7.7*10^(-5) / 4]^1/3 = 9.2*10^ (-3) (mol/L)对AgCl,溶解度为:s = [ ...1年前查看全部
- (2011•平顶山二模)已知:Ksp(Ag2SO4)=1.4×10-5,Ksp(BaSO4)=1.1×10-10,Ksp
(2011•平顶山二模)已知:Ksp(Ag2SO4)=1.4×10-5,Ksp(BaSO4)=1.1×10-10,Ksp(CaSO4)=9.1×10-6,Ksp(BaCO3)=2.6×10-9.则下列说法中不正确的是( )
A.有关的四种盐中溶解性最强的是Ag2SO4
B.有关的三种硫酸盐中,其饱和溶液中硫酸根离子浓度最小的是BaSO4
C.CaSO4沉淀能较容易地转化成为BaSO4沉淀
D.BaSO4沉淀不可能会转化成BaCO3沉淀 wangkai19821年前1
wangkai19821年前1 -
 船迟野 共回答了20个问题
船迟野 共回答了20个问题 |采纳率100%解题思路:根据溶度积常数的大小可比较物质的溶解性,一般来说,难溶电解质的溶度积常数越大,物质的溶解性越强,反之越小,难溶电解质之间可实现由溶度积常数较大的物质转化为溶度积常数较小的物质.A、Ag2SO4的溶度积常数最大,一般来说,难溶电解质的溶度积常数越大,物质的溶解性越强,故A正确;
B、Ag2SO4饱和溶液中硫酸根离子浓度为
3
1.4×10−5
2
,BaSO4饱和溶液中硫酸根离子浓度为
1.1×10−10,
CaSO4饱和溶液中硫酸根离子浓度为
9.1×10−6,三种硫酸盐中,其饱和溶液中硫酸根离子浓度最小的是BaSO4,故B正确;
C、BaSO4的溶度积常数小于CaSO4,则CaSO4沉淀能较容易地转化成为BaSO4沉淀,故C正确;
D、当溶液中c(Ba2+)×c(CO32-)>9.1×10-6时,可实现BaSO4沉淀转化成BaCO3沉淀,故D错误.
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡和沉淀转化,题目难度不大,注意理解溶度积常数与溶解性的关系.1年前查看全部
- Ag2SO4是否溶于硝酸
 花无艺1年前4
花无艺1年前4 -
 HoLianYe 共回答了17个问题
HoLianYe 共回答了17个问题 |采纳率82.4%难溶或微溶,但不会不溶.
如果硝酸比较稀,在其中的溶解度仅仅会稍大于在水中的溶解度(少量SO4 2-变为硫酸氢根的平衡正向移动).
如果硝酸较浓,倒是有可能接近完全地形成酸式盐AgHSO4溶解.
LS说不存在可溶性酸式盐的一定错了.1年前查看全部
- 帮忙写下这几个化学反应方程式Ag2CO3 和 NH3的化学反应方程式Ag2SO4 和 NH3的化学反应方程式AgCl 和
帮忙写下这几个化学反应方程式
Ag2CO3 和 NH3的化学反应方程式
Ag2SO4 和 NH3的化学反应方程式
AgCl 和 NH3 的化学反应方程式 金南京烟1年前4
金南京烟1年前4 -
 zhp1616 共回答了16个问题
zhp1616 共回答了16个问题 |采纳率100%如下
1Ag2CO3+2NH3.H2O=2Ag(NH3)2OH+`````
其余自己写,1年前查看全部
- Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比、 这句话有哪里错的么?
Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比、 这句话有哪里错的么?
RT wxf0624781年前1
wxf0624781年前1 -
 老牛4957911 共回答了15个问题
老牛4957911 共回答了15个问题 |采纳率100%AgCl和AgI满足,但Ag2SO4不满足
Ksp(Ag2SO4)=[Ag+]²[SO42-]
由于含有[Ag+]²项,因此它与另外两种(我以AgCl为例)的溶度积之比含有[Ag+]:
Ksp(Ag2SO4)/Ksp(AgCl)=[Ag+][SO42-]/[Cl-]≠[SO42-]/[Cl-]1年前查看全部
- 什么物质是不溶与酸的请问有什么物质是不溶于任何酸的?像BaSO4和AgCl但是CuS和Ag2SO4溶于硝酸所以不是答案.
 沾衣ww1年前1
沾衣ww1年前1 -
 sbdgv 共回答了22个问题
sbdgv 共回答了22个问题 |采纳率100%不与酸反应 酸可以抑制他的电离 并且在水里溶解度小的
单质:大气中的大部分气体:O2,N2
稀有气体:Ar等
惰性金属:Ag Au Pt等
酸性不敏感的其他单质:C S P等
化合物:无机物:酸:硅酸等
盐:BaSO4等
氧化物:CO P2O5等
有机物:烃类基本不溶:CH4 CH2=CH2
高级脂肪酸:20C以上的
酮,醛等
其他酸性不敏感的化合物1年前查看全部
- 不吝赐教!1.Ag2SO4加到稀硝酸中,会怎样?(是有化学变化,还是……)2.MnO2溶于稀盐酸?3.Na2S和FeCl
不吝赐教!
1.ag2so4加到稀硝酸中,会怎样?(是有化学变化,还是……)
2.mno2溶于稀盐酸?
3.na2s和fecl3互滴全过程分析?
4.常见的吸热反应有……?
5.浓***干燥no.no2.ch2=ch2. 零肆赛车会1年前2
零肆赛车会1年前2 -
 crazybutclever 共回答了14个问题
crazybutclever 共回答了14个问题 |采纳率92.9%1.不溶
Ag2SO4溶于较浓的硝酸,太稀的硝酸不行,原理是生成HSO4-离子,水中硫酸第二步电离并不完全,相当于强酸制弱酸,但是高中回避这一问题
2.不溶 只有在浓盐酸而且加热的条件下 才会溶解
3.Na2S滴入FeCl3 由于Fe3+过量 反应生成Fe2+和S
S2- + 2Fe3+ ===2Fe2+ + S↓ 产生的淡黄色沉淀
FeCl3滴入Na2S 由于S2-过量 生成的Fe2+会和S2-结合成黑色的FeS
3S2- + 2Fe3+ === 2FeS↓ + S↓ 生成黑色我沉淀(黑色会掩盖黄色)
4.C+H2O C+CO2 NH4Cl+Ba(OH)2·8H2O C+CuO
5.干燥NO NO2可以 至于乙烯和乙炔 有两种说法 因为乙烯和乙炔是有还原性的 按理说应该不能干燥 可以大多数参考书上都写着可以干燥 这个你自己把握
如果还有疑问 百度HI找我 详谈1年前查看全部
- AgCl、Ag2CO3、Ag2SO4,都是白色沉淀吗
 gxjunior1年前1
gxjunior1年前1 -
 毋忘在莒 共回答了22个问题
毋忘在莒 共回答了22个问题 |采纳率86.4%分别是 白色 黄色 白色
后两者见光能分解.1年前查看全部
- 乙烯与苯反应的催化剂是什么是不是Ag2SO4啊 还是哪个硫化物我们老师说的是一种硫化物 你知道吗
 coco_ing1年前2
coco_ing1年前2 -
 musicpb 共回答了27个问题
musicpb 共回答了27个问题 |采纳率100%这是傅-克烷基化反应,催化剂应用路易斯酸或质子酸.
具体到乙烯和苯的反应,催化剂是三氯化铝+浓盐酸,95度下反应,生成乙基苯.1年前查看全部
- 硫酸盐 和盐酸反应吗如 AG2SO4 ,NA2SO4等等、
 terry8110081年前1
terry8110081年前1 -
 宝宝欢 共回答了17个问题
宝宝欢 共回答了17个问题 |采纳率82.4%硫酸银微溶于水溶于硫酸和硝酸,不溶于盐酸,不起反应,硫酸钠和盐酸的反应,是进行不到底的可逆反应.而硫酸汞与盐酸在缓慢加热的情况下,可生成硫酸与盐酸的化合物沉淀.所以说能与盐酸反应的硫酸盐极少1年前查看全部
- (2013•淄博一模)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
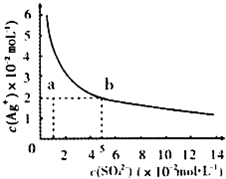 (2013•淄博一模)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
(2013•淄博一模)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
A.含有大量SO42-的溶液中肯定不存在Ag+
B.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
C.Ag2SO4的溶度积常数(Ksp)为l×l0-3
D.向AgNO3溶液中滴加Na2SO4溶液不一定会生成沉淀 wlijun1年前1
wlijun1年前1 -
 saojimo 共回答了24个问题
saojimo 共回答了24个问题 |采纳率75%解题思路:Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)⇌2Ag+(aq)+SO42-(aq),ksp=c2(Ag+)×c(SO42-),处于曲线上的点为饱和状态,不在曲线上的点为非饱和状态;
A.根据溶解为可逆过程;
B.加热蒸发时,溶液中银离子和硫酸根离子浓度都增大;
C.根据ksp=c2(Ag+)×c(SO42计算;
D.根据Qc=c2(Ag+)×c(SO42-)<ksp,不会生成沉淀;A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)⇌2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A错误;
B.a点表示Ag2SO4的不饱和溶液,加热蒸发时,溶液中银离子和硫酸根离子浓度都增大,故B错误.
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;.
D.向AgNO3溶液中滴加Na2SO4溶液混合,若Qc=c2(Ag+)×c(SO42-)<ksp,不会生成沉淀,故D正确;
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡,题目难度中等,注意把握溶度积的计算,并以此判断溶液是否饱和,为解答该题的关1年前查看全部
- 判断ABCD所代表的物质四种物质分别为:NaCl,Fe(NO3)3,Ba(OH)2,Ag2SO4.也就是说四种物质是氯化
判断ABCD所代表的物质
四种物质分别为:NaCl,Fe(NO3)3,Ba(OH)2,Ag2SO4.也就是说四种物质是氯化钠,硝酸铁,氢氧化钡,硫酸银.
四种物质存在以下反应:A+B→白色沉淀,C+D→红褐色沉淀,B+D→白色沉淀
1.由此推断A的化学式为___
2.写出上述的三个化学方程式:
①:
②:
③: 拒绝gg12341年前2
拒绝gg12341年前2 -
 wscbbk 共回答了19个问题
wscbbk 共回答了19个问题 |采纳率78.9%先判断B B和两个种都有沉淀 就可以知道B是Ag2SO4
然后D 和Ag2SO4有白色沉淀和C有红褐色沉淀就能知道D是Ba(OH)2
C:和D有红褐色沉淀的就是Fe(NO3)3
剩下A是 NaCl1年前查看全部
- 已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag
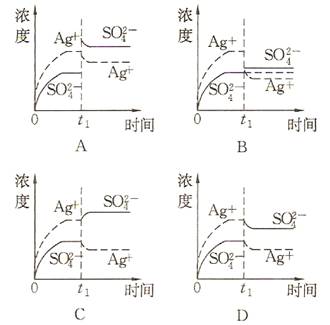
已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于100
mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034
mol·L-1).若t1时刻在上述体系中加入100 mL 0.020
mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( ) wxj07171年前3
wxj07171年前3 -
 单身的潜逃 共回答了20个问题
单身的潜逃 共回答了20个问题 |采纳率75%Ag2SO4=2Ag++SO42-,银离子浓度约为硫酸根浓度的2倍,所以银离子浓度曲线在上,硫酸根浓度曲线在下.
Ksp=[Ag+]^2*[SO42-]=2.0*10^-5,加入Na2SO4 等体积混合后,Na2SO4浓度=0.002/2=0.001摩尔/升.
此时,Ksp=X^2*(0.001+X)=2.0*10^-5,X即银离子约等于0.0058摩尔/升.
原饱和Ag2SO4溶液中c(Ag+)=0.034mol/L,现c(Ag+)=0.0058mol/L;原饱和Ag2SO4溶液中c(SO42-)=0.034/2=0.017mol/L,现c(SO42-)=0.0058+0.001=0.0068mol/L.
符合图意.1年前查看全部
- 微溶物作为反应物,若澄清溶液写离子符号,若悬浊液写成化学式.那么Ca(OH)2、CaSO4、Ag2SO4、MgCO4呢?
微溶物作为反应物,若澄清溶液写离子符号,若悬浊液写成化学式.那么Ca(OH)2、CaSO4、Ag2SO4、MgCO4呢?
改一改是MgCO3 少果加非1年前1
少果加非1年前1 -
 zzzhongwei 共回答了22个问题
zzzhongwei 共回答了22个问题 |采纳率100%Ca(OH)2,写离子符号
CaSO4、Ag2SO4,MgCO3写化学式
难电离的写化学式,容易电离的写离子符号.1年前查看全部
- 利用电解原理在铁上镀银,为什么电解质溶液不能用Ag2SO4而用AgNO3.
 joy9871年前3
joy9871年前3 -
 高鸣金鼓 共回答了25个问题
高鸣金鼓 共回答了25个问题 |采纳率88%电解质溶液不能用Ag2SO4是因为它微溶于水,溶液导电能力差
用AgNO3因为它易溶于水,溶液导电能力强1年前查看全部
- 将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:Ag2SO4(s)⇌Ag2O(s)+SO3(g)
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:Ag2SO4(s)⇌Ag2O(s)+SO3(g),2SO3(g)⇌2SO2(g)+O2(g),经10分钟后,反应达到平衡,此时C(SO3)=0.4mol/L,C(SO2)=0.1mol/L,则下列叙述不正确的是( )
A.SO3的分解率为20%
B.平衡时,v(O2)=0.005 mol/(L•min)
C.容器内气体的密度为40g/L
D.加压,容器内固体质量不变 阿迪_tt1年前1
阿迪_tt1年前1 -
 wind_wangyp 共回答了18个问题
wind_wangyp 共回答了18个问题 |采纳率88.9%解题思路:已知①Ag2SO4(s)⇌Ag2O(s)+SO3(g),②2SO3(g)⇌2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,以此解答该题.已知①Ag2SO4(s)⇌Ag2O(s)+SO3(g),②2SO3(g)⇌2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,
A.反应②中SO3的分解率为[0.1mol/L/0.5mol/L]×100%=20%,故A正确;
B.平衡时c (SO2)=0.1mol/L,则c(O2)=0.05mol/L,在这10min内平衡时氧气的反应速率=[0.05mol/L/10min]=0.005mol/(L•min),故B正确;
C.c (SO2)=0.1mol/L,则c (O2)=0.05mol/L,设容器体积为1L,则容器里气体的密度为[0.4mol/L×1L×80g/mol+0.1mol/L×1L×64g/mol+0.05mol/L×1L×32g/mol/1L]=40g/L,故C正确;
D.Ag2SO4(s)⇌Ag2O(s)+SO3(g),反应前后气体体积增大,增大压强平衡逆向进行,固体质量增加,故D错误.
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度不大,注意根据两个反应的浓度关系结合方程式进行计算,易错点为D,注意平衡常数的意义和表达式.1年前查看全部
- 已知Ag2SO4的KSP=c2(Ag+)× c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100 mL水
已知Ag2SO4的KSP=c2(Ag+)× c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,.见补充
已知Ag2SO4的KSP=c2(Ag+)× c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,此时溶液中c(Ag+)=0.030 mol·L-1.若t1时刻改变条件,下图中不正确的是(D)
...硫酸根和银离子浓度都变化,溶度积不就变了么,为什么也对啊
每个选项都求解 紫凌音韵1年前1
紫凌音韵1年前1 -
 sweeper1217 共回答了16个问题
sweeper1217 共回答了16个问题 |采纳率93.8%这个KSP是沉淀溶解平衡常数,意思是超过这个数就会产生沉淀,没超过这个数就不会有沉淀.
这个数值只与温度有关.
原溶液中Ag2SO4浓度为0.015Mol/L
A选项中,加入100ml水,所以离子浓度都变为原来的1/2.,正确.
B选项中,0.01mol/L的Ag2SO4是未饱和溶液,所以混合后,相当于稀释原溶液,离子浓度都下降.正确
C选项中,加入0.02mol/L Na2SO4溶液,SO4离子浓度比原来高,所以Ag离子浓度下降.正确
D选项中,加入0.04mol/L AgNO3溶液,Ag离子浓度上升,所以SO4离子浓度应该下降而不是上升.错误.
哪里不清楚再问,1年前查看全部
- 为什么Ag2SO4溶于硝酸而AgCl不溶于硝酸
为什么Ag2SO4溶于硝酸而AgCl不溶于硝酸
据说因为Ag2SO4微溶而使硝酸充当了一种中介溶质,以致Ag2SO4溶于硝酸.
那为什么AgCl不同理呢?AgCl多少也有一点溶于水吧.
或者请给出更好的理由解释Ag2SO4溶于硝酸的原因.
我确信Ag2SO4溶于硝酸(老师讲的,但没讲清原因,其他地方到处也是这么说的) qq53298801年前3
qq53298801年前3 -
 梅抽风 共回答了12个问题
梅抽风 共回答了12个问题 |采纳率100%AgCl不溶于HNO3,在水中的溶解度非常小,难溶于水.Ag2SO4不会溶于HNO3的,如果能溶,只是由于硝酸溶液中有水,才使微溶于水的Ag2SO4有一点溶解.这与Ag2CO3溶于硝酸完全是两回事,Ag2CO3+2HNO3=2AgNO3+H2O+CO2↑,这是符合复...1年前查看全部
- 一道高中"难"题25度时,Ag2SO4的溶度积为1.4x10^-5.向100mL浓度为0.0100mol/L的AgNO3
一道高中"难"题
25度时,Ag2SO4的溶度积为1.4x10^-5.向100mL浓度为0.0100mol/L的AgNO3溶液中滴加Na2SO4溶液,当滴加到100mL时溶液刚好出现沉淀,则该Na2SO4溶液的浓度为:()
A.1.4x10^-3 B.2.8x10^-3
C.0.56 D.1.12 lgphl1年前1
lgphl1年前1 -
 ckjiaodeping 共回答了23个问题
ckjiaodeping 共回答了23个问题 |采纳率87%设Na2SO4溶液的浓度是X摩尔/升,混合后溶液的体积是原来的2倍,则Ag+的浓度为0.01/2=0.005mol/L,SO4 2-的浓度为X/2 mol/L;由于25度时,Ag2SO4的溶度积为1.4x10^-5,则有:c(Ag+)^2*c(SO4 2-)=1.4*10^-5,即:(0.005)^2*(...1年前查看全部
- (2009•梅州模拟)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
(2009•梅州模拟)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
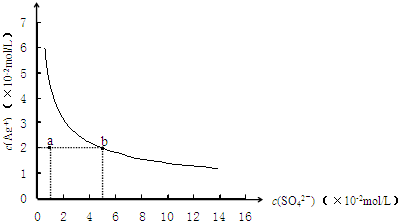
A.含有大量SO42-的溶液中肯定存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 一根天使稻草1年前1
一根天使稻草1年前1 -
 海豚轻吻 共回答了23个问题
海豚轻吻 共回答了23个问题 |采纳率91.3%解题思路:Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)⇌2Ag+(aq)+SO42-(aq),ksp=c2(Ag+)×c(SO42-),处于曲线上的点为饱和状态,随着SO42-浓度的增大,Ag+浓度减小,以此解答该题.A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)⇌2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A正确;
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(SO42-)=0.1mol/L时,c(Ag+)=0.01mol/L,c2(Ag+)×c(SO42-)=1×10-5<ksp,不会生成沉淀,故B正确;
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;
D.a点c(SO42-)=1×10-2mol/L,c(Ag+)=2×10-2mol/L,c2(Ag+)×c(SO42-)=4×10-6<ksp,不是饱和溶液,温度升高,物质溶解度也增大,溶度积常数增大,蒸发不能使溶液由a点变到b点,故D错误.
故选AB.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的计算,题目难度中等,注意把握溶度积的计算,并以此判断溶液是否饱和,为解答该题的关键.1年前查看全部
- 铜单质放入Ag2SO4(硫酸银)溶液中,能不能置换出银单质?
 taijiquan1231年前5
taijiquan1231年前5 -
 zcw_ql 共回答了11个问题
zcw_ql 共回答了11个问题 |采纳率90.9%不存在Ag2SO4(硫酸银)溶液]
Ag2SO4(硫酸银)溶液是不溶于稀酸的黑色沉淀1年前查看全部
- 在水中化学需氧量CODcr的测得中为什么要加入Ag2SO4,
 大象就是鱼1年前1
大象就是鱼1年前1 -
 165081 共回答了16个问题
165081 共回答了16个问题 |采纳率93.8%为了掩蔽水中的氯离子,阴离子和氯离子反应生成氯化银沉淀1年前查看全部
- 微溶的盐和碱如何使用?就是比如Ca(OH)2,Ag2SO4,CaSO4等物质,在复分解反应中,到底是像不溶的物质一样当做
微溶的盐和碱如何使用?
就是比如Ca(OH)2,Ag2SO4,CaSO4等物质,在复分解反应中,到底是像不溶的物质一样当做沉淀,还是像可溶的物质一样? 唧唧歪歪大哥1年前1
唧唧歪歪大哥1年前1 -
 garezhou 共回答了17个问题
garezhou 共回答了17个问题 |采纳率82.4%这个具体情况具体分析,这个要根据现实的情况来看,我们平常的打的沉淀箭号就是表示反应现象的,要是微溶物沉淀了,就打箭号,要是微溶物溶解了那就不打,明白了吗?就是要看现象的,所以说化学是一门建立在实验基础上的学科,理论也是出自于纯实验1年前查看全部
- 将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)⇌Ag2O(s)+SO3(g)2SO3(g)⇌2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
A.SO3的分解率为20%
B.10分钟内ν(SO2)=0.01mol/(L•min)
C.容器内气体的密度为40g/L
D.加压,容器内固体的质量不变 5923897791年前1
5923897791年前1 -
 紫玫瑰紅酒冰 共回答了22个问题
紫玫瑰紅酒冰 共回答了22个问题 |采纳率86.4%解题思路:已知①Ag2SO4(s)⇌Ag2O(s)+SO3(g),②2SO3(g)⇌2SO2(g)+O2(g),平衡时c (O2)=0.05mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,以此解答该题.已知①Ag2SO4(s)⇌Ag2O(s)+SO3(g),②2SO3(g)⇌2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,
A.反应②中SO3的分解率为[0.1/0.5]=20%,故A正确;
B.在这10min内氧气的平均反应速率为[0.05mol/L/10min]=0.005mol/(L•min),所以ν(SO2)=0.01mol/(L•min),故B正确;
C.c (SO2)=0.1mol/L,则c (O2)=0.05mol/L,设容器体积为1L,则容器里气体的密度为[0.4mol/L×1L×80g/mol+0.1mol/L×1L×64g/mol+0.05mol/L×1L×32g/mol/1L]=40g/L,故C正确;
D.加压时,反应Ag2SO4(s)⇌Ag2O(s)+SO3(g) 逆向移动,固体质量增加,故D错误.
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度不大,注意根据两个反应的浓度关系结合方程式进行计算,易错点为D,注意平衡常数的意义和表达式.1年前查看全部
- Ag2SO4到底能不能溶于HNO3?
Ag2SO4到底能不能溶于HNO3?
现在在高中做到关于此的题目,不知道应不应该考虑这个(老师也有争论)
不知道大学有没有讲 Strife_huang1年前2
Strife_huang1年前2 -
 爱薪无限 共回答了15个问题
爱薪无限 共回答了15个问题 |采纳率80%能的
因为Ag2SO4本身是微溶,溶解度相对较大(溶解度0.8g)
而且硫酸的二级电离不完全(电离度k=0.01)
2个原因使得Ag2SO4溶于较浓的HNO3,溶解度虽不大但绝对远大于1g1年前查看全部
- 微溶物的共存问题为什么微溶物:Ca(oH)2 CaSo4 MgCo3 Ag2So4 等物质不能大量共存?
 coilin1081年前2
coilin1081年前2 -
 绝不中立 共回答了23个问题
绝不中立 共回答了23个问题 |采纳率82.6%当中的离子会互相反应发生转换.1年前查看全部
- 硫酸与硝酸银反映?H2SO4+2AgNO3=Ag2SO4(微溶)+HNO3 可是复分解反应不是必须生成水或沉淀或气体吗?
硫酸与硝酸银反映?
H2SO4+2AgNO3=Ag2SO4(微溶)+HNO3
可是复分解反应不是必须生成水或沉淀或气体吗?
这个反应应该不进行才对!
困扰我好久啦!1
菜鸟请勿进
老师教过:微溶既不算沉淀,又不算易溶。 梦与醒的瞬间1年前1
梦与醒的瞬间1年前1 -
 memooff 共回答了17个问题
memooff 共回答了17个问题 |采纳率88.2%硫酸银算做沉淀,其实只要有物质脱离反应体系就行,沉淀气体水都脱离或几乎脱离了体系.1年前查看全部
- 常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5 mol3•
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5 mol3•L-3、Ksp(AgCl)=1.8×10-10 mol2•L-2、Ksp (AgI)=8.3×10-17 mol2•L-2.下列有关说法中,错误的是( )
A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出 aliice1年前1
aliice1年前1 -
 MUMUPI 共回答了21个问题
MUMUPI 共回答了21个问题 |采纳率95.2%解题思路:因为硫酸银、氯化银、碘化银的化学式不类似,故需要根据其浓度积常数计算出银离子的浓度,不难判断出A、B正确,C错误;在Ag2SO4饱和溶液中加入Na2SO4固体,[SO42-]增大,
Qc>Ksp,故有Ag2SO4沉淀析出.A、在Ag2SO4饱和溶液中,Ksp(Ag2SO4)=7.7×10-5 mol3•L-3=4c3(Ag+),因此c(Ag+)≈8.78×10-2mol/L,
在AgCl饱和溶液中,Ksp(AgCl)=1.8×10-10 mol2•L-2=c(Ag+)•c(Cl-)=c2(Ag+),因此c(Ag+)≈1.34×10-5mol/L
在AgI饱和溶液中,Ksp(AgI)=8.3×10-17mol2/L-2=c(Ag+)•c(I-)=c2(Ag+),因此c(Ag+)≈9×10-8mol/L.
所以常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小,故A正确;
B、AgCl比AgI的溶度积常数大,说明AgI难溶,在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成,故B正确;
C、AgCl和AgI满足,但Ag2SO4不满足,Ksp(Ag2SO4)=[Ag+]2[SO42-],由于含有[Ag+]2项,因此它与另外两种的溶度积之比中含有[Ag+],故C错误:
D、在Ag2SO4饱和溶液中加入Na2SO4固体,[SO42-]增大,Qc>Ksp,故有Ag2SO4沉淀析出,故D正确.
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡,本题难度中等,注意平衡常数的理解和运用.1年前查看全部
- Ag2SO4与NaOH反映后生成AgOH(>Ag2O+H2O)+Na2SO4,如何除去Na2SO4?
Ag2SO4与NaOH反映后生成AgOH(>Ag2O+H2O)+Na2SO4,如何除去Na2SO4?
黑褐色沉淀—氧化银 trauma1261年前3
trauma1261年前3 -
 cp9z 共回答了21个问题
cp9z 共回答了21个问题 |采纳率95.2%如果该反应能进行的话,Na2SO4是溶液,直接过滤即可1年前查看全部
- 请问怎么用溶度积判断AgI和Ag2SO4的溶解度大小?
 ersanbi1年前1
ersanbi1年前1 -
 对面的镜子 共回答了17个问题
对面的镜子 共回答了17个问题 |采纳率88.2%溶度积
Ksp1=[Ag][I]=n*10^-17
Ksp2=[Ag]^2*[SO4]=n*10^5
因为Ksp1特别小,所以,只需要极少的[Ag]和[I]就可以成沉淀
所以AgI溶解度小1年前查看全部
- 那caso4 ag2so4 mgco3就是反应生成都要写成化学式,且生成要加沉淀符号
 hrh71年前3
hrh71年前3 -
 whynot3 共回答了22个问题
whynot3 共回答了22个问题 |采纳率81.8%楼上答得很好.一般原则是:如果微溶物作反应物,要看题目叙述,题目说“该物质的水溶液”就写离子形式,题目说“固体或悬浊液”,就写化学式.如果微溶物作生成物,一般来说,必须该微溶物沉淀,才能满足复分解反应的要求,所以此时该微溶物为沉淀,写化学式.1年前查看全部
- 硫酸与硝酸钙是否反应既然浓h2so4与浓agno3溶液反映会生成微溶于水的ag2so4 那么为什么caso4也微溶于水却
硫酸与硝酸钙是否反应
既然浓h2so4与浓agno3溶液反映会生成微溶于水的ag2so4 那么为什么caso4也
微溶于水却无法生成? cctvfl1年前5
cctvfl1年前5 -
 lycily18 共回答了16个问题
lycily18 共回答了16个问题 |采纳率81.3%可以反应的呀.
H2SO4 +Ca(NO3)2 ==CaSO4↓ +2HNO3
这是复分解反应. 楼上的不对,硫酸钙是微溶的,化学方程式里看做沉淀!1年前查看全部
大家在问
- 1sin100°____ sin200°(填大于、小于)
- 2是什么能量产生力,促使生物运动的呢?
- 3等待一直等待的人 用英语怎么写
- 460米长的一段路上挂了11盏彩灯,每2盏彩灯之间距离相等.这个距离是多少米?
- 5那种氮肥效果最差已知土壤胶体颗粒带负电荷,同种电荷相排斥,因此土壤中施用含氮总量相同的下列化肥时,肥效最差的是:A.硫酸
- 6叶绿体的能量在哪里产生?
- 7地震按成因可分为---------地震、------------地震和-------------地震
- 8三个同学做20道数学题,已再多做1道就是甲的2倍,甲比丙少做了5道,求三人各做多少道?急……
- 9求于函数Y=X^2-2X-3的图像关于直线Y=1对称的图像的函数表达式,并画出图像
- 10一道数学题…计算题…急!1/(1+根3)+1/(根3+根5)+1/(根5+根7)+……+1/(根97+根99)…题就是这
- 11电场力做功与经过的什么无关
- 12为什么我做数学难题时冥思苦想也想不出来,而经老师一点拨就恍然大悟了?
- 132(x+1)-6为什么等于4x+2-6
- 14建水力工程,原计划投资7.5万元,实际用7.2万元,节约了几分之几?
- 15window和white中的i读音一样吗

