残余应变测量,电阻应变片是否须一直与应变仪连着一起才能测出应变变化量
 开水子2022-10-04 11:39:541条回答
开水子2022-10-04 11:39:541条回答残余应变测量,电阻应变片是否须一直与应变仪连着一起,能否先测出初始电阻值后断开与应变仪的连接,工件处理完后再电阻值,还能否测出应变变化量

已提交,审核后显示!提交回复
共1条回复
 为祖llaa 共回答了15个问题
为祖llaa 共回答了15个问题 |采纳率100%- 应变片和应变仪的连接中间存在一个接触电阻,理论上来说,如果断开了连接再接上,这个接触电阻可能会发生变化,也就意味着初始电阻值在再次连接后会发生变化,如果这个变化和应变值相比小到可以忽略不计,工件处理完后再电...
- 1年前
相关推荐
- 有一张长方形桌面,它的四个内角和是360°,现在锯掉它的一个内角,剩下的残余桌面所有的内角和是多少
 300190201年前2
300190201年前2 -
 一天三抱 共回答了18个问题
一天三抱 共回答了18个问题 |采纳率88.9%180 or 360 or 540
根据锯的方式不同有三种不同答案
沿对角线锯成三角形,内角和180度
从一个顶点锯起,锯到一边,剩一个四边形,就是360度
从一边上一点锯起,锯到邻边,剩下一个五边形,内角和540度1年前查看全部
- 取氯酸钾和二氧化锰的混合物15.5克,放入一大试管中加热,反应完全后冷却到反应前温度,称残余固体质量为10.7克.求:
取氯酸钾和二氧化锰的混合物15.5克,放入一大试管中加热,反应完全后冷却到反应前温度,称残余固体质量为10.7克.求:
(1)生成氧气多少克?
(2)原混合物中二氧化锰的质量是多少克?
(3)生成氯化钾多少克? cqp1231年前1
cqp1231年前1 -
 娜娜我LOVEYOU 共回答了20个问题
娜娜我LOVEYOU 共回答了20个问题 |采纳率80%解题思路:根据质量守恒定律,由反应前后固体质量差求得反应放出氧气的质量;再利用产生氧气的质量计算反应生成的氯化钾的质量即可.根据质量守恒定律,反应放出氧气的质量=15.5g-10.7g=4.8g
设反应生成的氯化钾的质量为x
2KClO3
MnO2
.
△2KCl+3O2↑
14996
x 4.8g
[149/x=
96
4.8g]
x=7.45g
由于产物中含有反应生成的氯化钾和催化剂二氧化锰,所以二氧化锰的质量是10.7g-7.45g=3.25g,由于二氧化锰在化学反应前后质量不变,故原混合物中的二氧化锰质量也是3.25g;
答:(1)该反应共生成氧气的质量为4.8g;(2)原混合物中二氧化锰的质量是3.25g;(3)生成氯化钾的质量为7.45g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答此类题的方法是:首先利用质量守恒定律,根据反应前后固体物质质量差求得反应生成气体的质量;然后利用化学方程式由气体质量计算其他物质的质量.1年前查看全部
- 现有氯酸钾和二氧化锰的混合物16.5克,将其加热到不再分解为止,冷却后称得残余固体物质质量为11.7克,求
现有氯酸钾和二氧化锰的混合物16.5克,将其加热到不再分解为止,冷却后称得残余固体物质质量为11.7克,求
(1)产生氧气的质量为多少克?
(2)原混合物中氯酸钾和二氧化锰各多少克? yunyun6192011年前1
yunyun6192011年前1 -
 cy雄鹰 共回答了24个问题
cy雄鹰 共回答了24个问题 |采纳率91.7%(1)m(O2)=16.5-11.7=4.8g
(2) 2KClO32KCl + 3O2
2*(39+35.5+16*3)=245 2*(39+35.5)=149 3*16*2=96
X 4.8g
x=12.25g
m(KClO3)=12.25g
m(MnO2)=16.5-12.25=4.25g1年前查看全部
- 某工厂化验室用10%的氢氧化钠溶液洗涤定量石油产品中残余的硫酸,洗涤后溶液呈中性,共消耗这种氢氧化钠溶液40g.求在这一
某工厂化验室用10%的氢氧化钠溶液洗涤定量石油产品中残余的硫酸,洗涤后溶液呈中性,共消耗这种氢氧化钠溶液40g.求在这一定量的石油产品里残余H 2 SO 4 的质量.  TRENAS1年前1
TRENAS1年前1 -
 紫夜清风 共回答了9个问题
紫夜清风 共回答了9个问题 |采纳率88.9%设残余硫酸的质量为x.
2NaOH+H 2 SO 4 =Na 2 SO 4 +2H 2 O
8098
40g×10% x
80
98 =
40g×10%
x ,x=4.9g
答:在这一定量的石油产品里残余硫酸的质量4.9.1年前查看全部
- 请翻译 “晚饭后2~3个小时散步,可以帮助散发身体中的热,燃烧残余的大量因白天摄取食物储存的能量.”
 ccva8861年前5
ccva8861年前5 -
 撒娇王道 共回答了13个问题
撒娇王道 共回答了13个问题 |采纳率92.3%2~ 3 hours’ walking after dinner can help you distribute the heat spread from your body and burn the large amount of energy that you store in the daytime because of the food ingestion.1年前查看全部
- 加热某紫黑色固体A能生成气体B,将受热后的残余固体与另一种无色液体C混合也生成气体B,把B与氮气以1:4体积混合充入一集
加热某紫黑色固体A能生成气体B,将受热后的残余固体与另一种无色液体C混合也生成气体B,把B与氮气以1:4体积混合充入一集气瓶中,将一定量暗红色粉末D点燃后伸入该集气瓶,即可见大量白烟E生成,并又得到较纯净氮气,试推断:
A为______B为______C为______
D为______E为______.(用化学式表示) alinab1年前1
alinab1年前1 -
 sophina_wl 共回答了12个问题
sophina_wl 共回答了12个问题 |采纳率100%解题思路:此题考查了常见物质的物理及化学性质,题目中“紫黑色固体A能生成气体B”,“受热后的残余固体与另一种无色液体C混合也生成气体B”,“暗红色粉末D点燃后伸入该集气瓶,即可见大量白烟E”,则推测个物质为:包括了高锰酸钾、二氧化锰、过氧化氢、氧气、红磷及五氧化二磷等常见物质的基本物理及化学性质.紫黑色固体高锰酸钾加热分解生成氧气,黑色固体二氧化锰与另一种无色液体C混合也生成气体B,则B为氧气,C为双氧水,“将一定量暗红色粉末D点燃后伸入该集气瓶,即可见大量白烟E”,则D为红磷,E为五氧化二磷.
故答案为:KMnO4;O2;H2O2;P;P2O5点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义.
考点点评: 此题属于推断题,对常见物质的物理及化学性质要熟练掌握,对常见化学反应类型要准确掌握.1年前查看全部
- (2010•晋江市)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是
(2010•晋江市)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是 ______.
(2)小亮取少量样品于试管中,滴加 ______试液,试液变红色,该溶液不可能是 ______(填写化学式),理由是 ______.
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
[设计实验方案]方案甲:选择氯化钙溶液来确定该溶液的成份;方案乙:选择稀盐酸来确定该溶液的成份.
[进行实验]你愿意选择方案 ______(选填“甲”或“乙”)进行实验.
[实验反思](4)有同学认为还可以用一种常见的碱溶液来确定,那么它是 ______溶液.实验步骤 实验现象 实验结论 取少量溶液于试管中,
滴加氯化钙溶液(或稀盐酸)产生白色沉淀(或有气泡冒出) 该溶液是碳酸钠溶液,
有关反应得化学方程式为:
CaCl2+Na2CO3═CaCO3↓+2NaCl(或Na2CO3+2HCl═2NaCl+H2O+CO2↑)
(5)小亮经过反思,向同学们提出如下建议,你认为合理的是 ______(填序号).
A.倾倒液体时应注意保护标签不被腐蚀B.要有严谨的科学实验的态度 C.无法辨认的药品,直接倒掉,无需保留. zhlhunter1年前1
zhlhunter1年前1 -
 无间xx了zz 共回答了13个问题
无间xx了zz 共回答了13个问题 |采纳率100%解题思路:(1)氢氧化钙常温下的溶解度为0.18g,据此可计算出其饱和溶液的质量分数达不到10%,所以可判断不可能为氢氧化钙;
(2)从题目中分析,氢氧化钠、氯化钠、碳酸钠中只有氯化钠是盐,其余两种都是碱,所以应该是加入酸碱指示剂判断是否为氯化钠;
(3)鉴别氢氧化钠和碳酸钠,可以用氯化钙溶液,能产生碳酸钙沉淀,也可以采用稀盐酸,能产生气体,两种方法都可以;
(4)常见的碱溶液就是氢氧化钠和氢氧化钙,可用氢氧化钙鉴别氢氧化钠和碳酸钠,氢氧化钙和碳酸钠反应能产生碳酸钙沉淀;
(5)从题中可得到很多反思,如实验需要有严谨的态度,使用药品时要注意不能腐蚀标签,鉴别药品可从多角度入手考虑等.(1)常温下氢氧化钙的溶解度为0.18g,其饱和溶液中溶质质量分数=
0.18g
100g+0.18g× 100%<0.18%,而该溶液溶质质量分数为10%,所以不可能是氢氧化钙;
(2)从题中分析,能使试液变红色,指示剂为无色酚酞,而氯化钠是盐,显中性,不能使无色酚酞试液变红色,可以排除氯化钠;
(3)氯化钙和稀盐酸都可以用来鉴别氢氧化钠和碳酸钠,氯化钙与碳酸钠反应产生碳酸钙白色沉淀,方程式为
CaCl2+Na2CO3═CaCO3↓+2NaCl,稀盐酸与碳酸钠反应产生二氧化碳气体,方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(4)鉴别氢氧化钠和碳酸钠还可用澄清石灰水,能产生碳酸钙沉淀,方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(5)使用药品时要注意不能腐蚀标签;实验需要有严谨的态度;无法辨认的药品,应放在指定位置统一处理,不能随意倒掉,否则会造成浪费,而且会污染环境.
故答案为:(1)Ca(OH)2微溶于水,其溶液质量分数不可能为10%;
(2)无色酚酞、NaCl,NaCl溶液呈中性,不能使无色酚酞试液变红色
(3)[进行实验]甲(或乙
实验步骤:氯化钙溶液(或稀盐酸)
实验现象:产生白色沉淀(或有气泡冒出)
CaCl2+Na2CO3═CaCO3↓+2NaCl(或Na2CO3+2HCl═2NaCl+H2O+CO2↑)
[实验反思](4)石灰水
(5)A、B点评:
本题考点: 缺失标签的药品成分的探究;证明碳酸盐;溶质的质量分数、溶解性和溶解度的关系;酸碱指示剂及其性质;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题是缺失标签的实验探究题,相当于物质鉴别题,在鉴别几种物质时要从物质的不同性质入手,先物理性质再化学性质,做到不重不漏,一一排除;(5)属于半开放性试题,注意解题时要从多方面考虑,不能漏选.1年前查看全部
- Na2CO3、NaHCO3、NaCl的固体混合物共4g,把它们加强热到质量不再减轻,冷却后称重为3.38g.在残余固体中
Na2CO3、NaHCO3、NaCl的固体混合物共4g,把它们加强热到质量不再减轻,冷却后称重为3.38g.在残余固体中加入过量的盐酸,产生CO20.88g.
回答:
(1)原混合物中NaHCO3的质量是______g,
(2)加热后新增加了Na2CO3______g.
(3)原混合物中含Na2CO3______g.
(4)4g该固体混合物最多可消耗盐酸的物质的量为______. isqie991年前1
isqie991年前1 -
 吴惜铭 共回答了20个问题
吴惜铭 共回答了20个问题 |采纳率85%解题思路:加热发生反应:2NaHCO3
Na2CO3+CO2↑+H2O,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,利用反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据CO2的质量可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量;根据反应Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O计算出4g该固体最多消耗氯化氢的物质的量.△ .(1)加热发生反应方程式为:2NaHCO3
△
.
Na2CO3+CO2↑+H2O,导致固体质量减少:4g-3.38g=0.62g,
设混合物中有NaHCO3的质量为x,新生成的Na2CO3的质量为y,
2NaHCO3=Na2CO3+CO2↑+H2O△m
168g106g62g
xy4g-3.38g=0.62g
解得x=[168g×0.62g/62g]=1.68g,y=[106g×0.62g/62g]=1.06g,
故答案为:1.68;
(2)根据(1)的计算可知,新生成的碳酸钠的质量为1.06g,
故答案为:1.06;
(3)设加热后碳酸钠的总质量是m,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
10644
m 0.88g
m=[106×0.88g/44]=2.12g,
故原混合物中碳酸钠的质量:2.12g-1.06g=1.06g,
故答案为:1.06g;
(4)根据以上计算可知,4g固体混合物中含有1.68g碳酸氢钠、1.06g碳酸钠,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106g 2mol
1.06g n(HCl)
n(HCl)=[2mol×1.06g/106g]=0.02mol;
NaHCO3+HCl=NaCl+CO2↑+H2O
84g 1mol
1.68g n(HCl)
n(HCl)=[1mol×1.68g/84g]=0.02mol,
则4g该固体最多消耗HCl的物质的量为:0.02mol+0.02mol=0.04mol,
故答案为:0.04mol.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查学生化学方程式的有关计算知识,题目难度中等,掌握碳酸钠、碳酸氢钠的化学性质为解答本题的关键,注意差量法在化学计算中的应用方法.1年前查看全部
- NaHCO3分解需要吸收热量.今取NaHCO3和Na2CO3混合粉末5.26g,将其加热至质量不再改变,残余固体质量为3
NaHCO3分解需要吸收热量.
今取NaHCO3和Na2CO3混合粉末5.26g,将其加热至质量不再改变,残余固体质量为3.71g.求该混合物中NaHCO3和Na2CO3的质量. (求过程) chenwin111年前3
chenwin111年前3 -
 ww5733 共回答了16个问题
ww5733 共回答了16个问题 |采纳率93.8%因为加热,所以H2O,CO2都变成气体扩散掉(质量就减小了)
减小的M=5.26-3.71=1.55g
2NAHCO3=NA2CO3+H2O+CO2,M
X --------------------1.55g
168-------------------18+44
X=168*1.55/62=4.2g
所以NAHCO3的质量为4.2g,NA2CO3的质量为1.06g1年前查看全部
- 加热KClO3和MnO2的混合物mg,一段时间后,称得残余固体的质量为ng,求:
加热KClO3和MnO2的混合物mg,一段时间后,称得残余固体的质量为ng,求:
(1)生成O2的质量是多少克?
(2)若将残留固体ng全部溶于水、过滤、洗涤、烘干得不溶物ag,则未分解的KClO3的质量是多少克?(用字母表示)
n是什么?n中是否含有KCl? blue007cn1年前1
blue007cn1年前1 -
 yuqinghai 共回答了26个问题
yuqinghai 共回答了26个问题 |采纳率100%(1)固体减少量为氧气量,所以M(O2)=m-n
(2)KClO3和KCL都可溶水,所以不容为MnO2,
由氧气质量反推消耗KClO3质量:2KClO3出3O2,所以M(KClO3消耗)=m-n*(245/96)
则未分解的KClO3的质量是m-a-(m-n*(245/96))
(3)n是反应产生的KCl和KClO3(不知是否反应完全,和具体数值有关)和MnO2的混合物,其中必有KCl(只要有反应产生)1年前查看全部
- 买了个烟雾弹,冒的白烟,地上有大量残余粉末,不知道什么颜色,烟有刺鼻气味,像烟花,是不是白磷烟雾弹,放出的是不是p2o5
 yvonnewu1年前1
yvonnewu1年前1 -
 wj9410 共回答了16个问题
wj9410 共回答了16个问题 |采纳率100%白磷烟雾弹一旦与空气接触,就会立即引爆,还会散发出一种显眼的黄色火花,并且附带着大量的白色烟雾(五氧化二磷).1年前查看全部
- 取1g含SiO2和FeS2的矿石样品,燃烧残余固体0.84g,用矿石1000t,可制98%的硫酸多少吨?(设硫损失2%)
 小小01011年前1
小小01011年前1 -
 ngacw 共回答了14个问题
ngacw 共回答了14个问题 |采纳率100%应用硫守恒进行计算1年前查看全部
- 在做托里拆利实验时,不小心玻璃管中留有小量残余空气,则( )
在做托里拆利实验时,不小心玻璃管中留有小量残余空气,则( )
A.大气压强的测量值与真实值相同
B.大气压强的测量值大于真实值
C.大气压强的测量值小于真实值
D.条件不足,无法判断 6720268361年前1
6720268361年前1 -
 ccme 共回答了18个问题
ccme 共回答了18个问题 |采纳率88.9%解题思路:要解决此题,需要掌握大气压强的测量方法,在测量过程中为保证测量结果的准确性,必须保证玻璃管内水银的上方为真空,否则会影响测量结果.
若玻璃管中不慎留有小量残余空气,则测量结果会偏小.在做托里拆利实验时,不小心玻璃管中留有小量残余空气,则此时里面空气的压强与水银柱的压强和等于外面大气压,所以通过水银柱的高度计算出的测量值会偏小.
故选C.点评:
本题考点: 大气压强的测量方法.
考点点评: 此题主要考查了有关大气压强的测量方法,要熟练掌握大气压的测量方法及技巧要求.为减小误差,必须保证水银柱的上方为真空,否则测量结果偏小.1年前查看全部
- 把56.1g的氯酸钾和高锰酸钾的混合物放在试管里充分加热至不再有气体发生为止.冷却后称得试管内残余固体
把56.1g的氯酸钾和高锰酸钾的混合物放在试管里充分加热至不再有气体发生为止.冷却后称得试管内残余固体
上网查人家最后给了我这个X*96/245+y*32/316=12.8,然后就直接得出X和Y,我想知道这怎么得?两个未知数一个就能算出来?或者给我另一个答案谢谢 thebeatles11年前1
thebeatles11年前1 -
 化羽随风 共回答了22个问题
化羽随风 共回答了22个问题 |采纳率95.5%56
.1-43.3=12.8g(O2)
2KCIO3 = 2KCI + 3O2
245------------96
X---------------Y
X=245Y/96
2KMnO4 = K2MnO4 + MnO2 + O2
316----------------------32
56.1-X-------------------12.8-Y
32(56.1-245Y/96)=316(12.8-Y)
Y=9.6,X=24.5g(KCIO3)
56.1-24.5=31.6g(KMnO4)1年前查看全部
- 将镁和铝的混合物a g投入到足量的氢氧化钠溶液中,充分反应后将残余固体洗净,然后使残余固体在足量的纯氧中加热,最终得到a
将镁和铝的混合物a g投入到足量的氢氧化钠溶液中,充分反应后将残余固体洗净,然后使残余固体在足量的纯氧中加热,最终得到a g固体,则镁铝混合物中铝的质量分数为( )
A.40% B.47% C.53% D.60%  szjw20031年前1
szjw20031年前1 -
 alen_he 共回答了25个问题
alen_he 共回答了25个问题 |采纳率100%A
1年前查看全部
- 某工厂化验室用溶质的质量分数为20%的氢氧化钠溶液洗涤一定量的石油产品中残余的硫酸,共消耗氢氧化钠40g
某工厂化验室用溶质的质量分数为20%的氢氧化钠溶液洗涤一定量的石油产品中残余的硫酸,共消耗氢氧化钠40g
洗涤后溶液呈中性.(1)求40g氢氧化钠溶液中溶质的质量.(2)求一定量的石油产品中含硫酸的质量. gufeng2581年前1
gufeng2581年前1 -
 dinding1 共回答了18个问题
dinding1 共回答了18个问题 |采纳率83.3%1.40g×20%=8g
2.H2SO4+2NaOH=Na2SO4+2H20
98 80
x 8g
解得x=9.8g1年前查看全部
- 在硫酸铁溶液中加入ag铜,完全溶解后,再加入b g铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是
在硫酸铁溶液中加入ag铜,完全溶解后,再加入b g铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是( )
A. 残余固体全部是铜
B. 残余固体可能为铁和铜的混合物
C. 残余固体是铁,溶液中一定不含Cu2+
D. 最后得到的溶液中可能含Fe3+ wb5b1年前4
wb5b1年前4 -
 山英之歌 共回答了18个问题
山英之歌 共回答了18个问题 |采纳率94.4%解题思路:发生的反应有:2Fe3++Cu=2Fe2++Cu2+,Cu2++Fe=Cu+Fe2+,a>c,说明铜没有被完全置换出,以此计算分析.a>c,说明铜没有被完全置换出;
则溶液中一定存在Cu2+,
铜有剩余,发生的反应有:2Fe3++Cu=2Fe2++Cu2+,
则一定不存在Fe3+,
故选A.点评:
本题考点: 有关混合物反应的计算;有关过量问题的计算.
考点点评: 本题考查混合物的过量问题,题目难度中等,注意氧化性和还原性的比较.1年前查看全部
- 几道初三科学化学计算题.(1)某实验室用百分之15的氢氧化钠溶液洗涤一定量的残余硫酸溶液,共消耗氢氧化钠溶液40克,洗涤
几道初三科学化学计算题.
(1)某实验室用百分之15的氢氧化钠溶液洗涤一定量的残余硫酸溶液,共消耗氢氧化钠溶液40克,洗涤后溶液呈中性,求这部分溶液中汗硫酸多少克?
(2)10克表面分布氧化的镁带(变成氧化镁),跟足量的稀盐酸反应,生成氢气0.8克,则该镁带中单质镁的质量分数是多少?
前面两个问题我做出了.
换一道题目.张同学为测定某儿童咀嚼片中碳酸钙的含量标注是否属实,他取出4片片剂,研碎后放入烧杯中,逐渐低价稀盐酸,至不再放出气体为止,共用去稀盐酸40g,称量烧杯中剩余物质质量为47.8g(不含烧杯质量,假定钙片其它成分不予盐酸反应,则反应的方程式为:CaCo3+2HCL=CaCl2+H2O+Co2)
(1)生成二氧化碳的质量
(2)通过计算判断钙片中碳酸钙的含量标注是否属实.
图片为:
儿童咀嚼片
(60片装)
主要成分:碳酸钙 维生素D
规格 2.5g/片
每片中含大于等于1.24g wooxoo1年前1
wooxoo1年前1 -
 我看书了 共回答了18个问题
我看书了 共回答了18个问题 |采纳率94.4%1 m总=40g+2.5g*4=50g
m co2=m总-47.8g=2.2g
2 设参加反应得CaCO3的质量为X
CaCO3+2HCL=CaCl2+H2O+CO2
100 44
X 2.2g
解得X=5g
5g/4=1.25g
1.25g>1.24g
答:钙片中碳酸钙的含量标注是否属实.1年前查看全部
- 向250克碘化钠溶液中通入氯气一段时间后,将溶液蒸干、灼烧,称得残余固体32.55克,经分析,固体含碘39%.
向250克碘化钠溶液中通入氯气一段时间后,将溶液蒸干、灼烧,称得残余固体32.55克,经分析,固体含碘39%.
求原溶液溶质的质量分数 = = gsq_821年前1
gsq_821年前1 -
 lotusgf 共回答了22个问题
lotusgf 共回答了22个问题 |采纳率90.9%2NaI + Cl2 ==2NaCl + I2
蒸干灼烧后碘单质都已经气化,故固体中只含有碘化钠和氯化钠
碘含量39%就是有碘12.6945g因此约有碘化钠15g(0.1mol),所以氯化钠约有17.55g(0.3mol)
因此含有Na 0.4mol故原溶液中含有碘化钠60g,质量分数为24%1年前查看全部
- (2007•漳州)(1)某工厂实验室技术人员煅烧l00g石灰石样品,完全反应后,冷却到反应前的温度,称得残余固体的质量为
(2007•漳州)(1)某工厂实验室技术人员煅烧l00g石灰石样品,完全反应后,冷却到反应前的温度,称得残余固体的质量为62.6g.根据______定律,生成二氧化碳气体的质量为______g.
(2)某兴趣小组利用废旧铝制品与氢氧化钠溶液反应制取氢气,现用80g 20%的氢氧化钠溶液和足量的废旧铝制品完全反应(氢氧化钠溶液与杂质不反应),理论上可制得氢气多少克?(反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑) 漫游的鱼1年前1
漫游的鱼1年前1 -
 竹林深处5188 共回答了18个问题
竹林深处5188 共回答了18个问题 |采纳率100%解题思路:根据质量守恒定律,减少的物质的质量即是生成的二氧化碳的质量,根据反应的化学方程式,找出氢氧化钠和氢气的质量关系,解答即可.(1)根据质量守恒定律,固体减少的质量即是生成的二氧化碳的质量,故二氧化碳质量为:100g-62.6g=37.4g,故填:质量守恒,37.4;
(2)设生成氢气的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
80 6
80g×20% x
[80/80g×20%=
6
x] x=1.2g
答:理论上可制得氢气1.2g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了根据化学方程式的计算,完成此题,可以依据质量守恒定律结合反应的化学方程式进行.1年前查看全部
- 现有氯酸钾和二氧化锰的混合物16.5克,将其加热到不再分解为止,冷却后称得残余固体物质的质量为11.7克,则原混合物中含
现有氯酸钾和二氧化锰的混合物16.5克,将其加热到不再分解为止,冷却后称得残余固体物质的质量为11.7克,则原混合物中含氯酸钾和二氧化锰多少克?
 蹦上沙滩的鱼1年前2
蹦上沙滩的鱼1年前2 -
 在下个十字路口1 共回答了18个问题
在下个十字路口1 共回答了18个问题 |采纳率100%利用差量法:
产生的氧气:16.5-11.7=4.8克
设氯酸钾质量为x
写出化学方程式
利用比例关系245/x=96/4.8
所以,氯酸钾为12.25克
所以二氧化锰=16.5-12.25=4.25克1年前查看全部
- 取氯酸钾和二氧化锰的混合物15.5克,放入一大试管中加热,反应完全后冷却到反应前温度,称残余固体质量为10.7克.求生成
取氯酸钾和二氧化锰的混合物15.5克,放入一大试管中加热,反应完全后冷却到反应前温度,称残余固体质量为10.7克.求生成氧气多少克?生成氯化钾多少克?
 我爱小猪啊1年前1
我爱小猪啊1年前1 -
 秋风65 共回答了14个问题
秋风65 共回答了14个问题 |采纳率92.9%解题思路:根据质量守恒定律,由反应前后固体质量差求得反应放出氧气的质量;再利用产生氧气的质量计算反应生成的氯化钾的质量即可.根据质量守恒定律,反应放出氧气的质量=15.5g-10.7g=4.8g
设反应生成的氯化钾的质量为x
2KClO3
MnO2
.
△2KCl+3O2↑
149 96
x 4.8g
[149/x=
96
4.8g]
x=7.45g
答:该反应共生成氧气的质量为4.8g;生成氯化钾的质量为7.45g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答此类题的方法是:首先利用质量守恒定律,根据反应前后固体物质质量差求得反应生成气体的质量;然后利用化学方程式由气体质量计算其他物质的质量.1年前查看全部
- 急在线等!一道高一化学题!向溴化钠,碘化钠混合溶液中通入一定量氯气之后,将溶液蒸干,并充分灼烧片刻,最后残余的物质可能是
急在线等!一道高一化学题!
向溴化钠,碘化钠混合溶液中通入一定量氯气之后,将溶液蒸干,并充分灼烧片刻,最后残余的物质可能是 ()
A、NaCl和Br2 B NaCl和NaI C NaCl、NaBr和NaI D NaCl和I2
请写一下过程 谢谢谢谢谢谢谢谢! 我爱张大民1年前3
我爱张大民1年前3 -
 dongjl_81 共回答了25个问题
dongjl_81 共回答了25个问题 |采纳率84%C NaCl、NaBr和NaI
通入氯气后,会置换出I2,如果氯气有剩余,还会置换出Br2,
蒸干时 Br2 I2 全都会挥发了
所以肯定会有NaCl,如果Cl2不够,肯定会有NaBr和NaI1年前查看全部
- 汽车排气管里排出的蒸汽全都是汽油燃烧后的残余气体么?
汽车排气管里排出的蒸汽全都是汽油燃烧后的残余气体么?
为什么有的车:
排气管在左面,有的在右面,有的是双排气管,双排气管有的俩个贴在一起,有的左右各一,有的还看不见排气管?
为什么有的车排气管排出的蒸汽很多很浓重,可以上升过车顶,而有的排出的不多,看起来也就二、三十厘米见方的样子,有的车还一点都没有?
从反光镜里看(没怠速下车看过),我的车有时候能看见排的蒸汽挺多,有的时候一点看不见.
排的浓、轻微、和几乎不见那个车况好? dragon7821年前1
dragon7821年前1 -
 洛水-女神 共回答了21个问题
洛水-女神 共回答了21个问题 |采纳率95.2%排气管在左右,是厂家根据汽车的整体结构设计,两个贴在一起,是为即节省资源又能达到车子的效果,比如宝来汽车,蒸汽式遇到冷空气式才会这样,只有冬天出现,夏季是不会出现的,排量大的车排除的气体多,有更多的气体遇冷,所以像你刚才说的那样1年前查看全部
- 某化工实验室用10%的氢氧化钠溶液洗涤40克残余硫酸溶液,共消耗氢氧化钠溶液40克
某化工实验室用10%的氢氧化钠溶液洗涤40克残余硫酸溶液,共消耗氢氧化钠溶液40克
某化工实验室用10%的氢氧化钠溶液洗涤40克残余硫酸溶液,共消耗氢氧化钠溶液40克,洗涤后溶液呈中性,求生成溶液中溶质质量分数 linjing7891年前1
linjing7891年前1 -
 菲菲猪jj 共回答了9个问题
菲菲猪jj 共回答了9个问题 |采纳率100%因为氢氧化钠的质量分数为10%,消耗氢氧化钠溶液40g,所以mNaOH=4g
2NaOH+H2SO4=2H20+Na2So4
80 142
4g x
所以80/4g=142/x x=7.1g
m总溶液=40+40=80g
所以生成溶液中溶质的质量分数为7.1/80×100%=8.875%1年前查看全部
- 化学中的一点小问题化学问题中总有说什么试管内的剩余固体,残余固体,我不知道到底指的是生成物中的还是反应物剩下的,能不能举
化学中的一点小问题
化学问题中总有说什么试管内的剩余固体,残余固体,我不知道到底指的是生成物中的还是反应物剩下的,能不能举几个例子帮我弄明白万分感谢~~~~~~~~~~
 红玫瑰和白玫瑰1年前1
红玫瑰和白玫瑰1年前1 -
 nmsudan2000 共回答了25个问题
nmsudan2000 共回答了25个问题 |采纳率92%反应后剩下的,才叫“剩余”“残余”,可以有没有参加反应的杂质,没有反应的物质,以及生成物几种.
不满意请追问,满意望采纳!
有问题可以点击我的名字后面的:向TA咨询.我只要在线尽量及时回答.1年前查看全部
- 足量铁粉与硫酸和硫酸铜混合液反应.残余固体与加入铁粉质量相等.原液H+和SO42-之比是?
 ddtt_0070071年前1
ddtt_0070071年前1 -
 泪为什么是咸的 共回答了26个问题
泪为什么是咸的 共回答了26个问题 |采纳率92.3%答案是1:4.
由题可知反应的铁粉与生成的铜质量相等.
又:H2SO4~Fe,CuSO4~Fe~Cu
有:[n(H2SO4)+n(CuSO4)]*56=64n(CuSO4)
[n(H2SO4)]/[n(CuSO4)]=1/7
得:n(H+)/n(SO42-)=2/(1+7)=1/41年前查看全部
- 请指教(最好现在哦)取少量混有碳酸氢钠的纯碱样品2.96克在坩埚中加热到固体质量不再减轻为止,剩余固体2.65克.在残余
请指教(最好现在哦)
取少量混有碳酸氢钠的纯碱样品2.96克在坩埚中加热到固体质量不再减轻为止,剩余固体2.65克.在残余固体中滴加盐酸至完全消耗盐酸20ml,求;(1)纯碱样品中碳酸钠的质量分数(2)盐酸的物质的量浓度 lixie1年前1
lixie1年前1 -
 luoyianzi123 共回答了19个问题
luoyianzi123 共回答了19个问题 |采纳率94.7%2NaHCO3=Na2CO3+H2O+CO2 减重
168 106 62
X 0.31g
X=0.84g
w(Na2CO3)%=(2.96-0.84)/2.96*100%=71.62%
n(Na2CO3)=2.65/106=0.025mol
n(HCl)=2n(Na2CO3)=0.05mol
c(HCl)=0.05/0.02=2.5mol/L1年前查看全部
- 现取20g某种黄铜投入100g某浓度的稀硫酸中,完全反应后剩余的溶液和残余固体的总质量为119.8g.请计算:
现取20g某种黄铜投入100g某浓度的稀硫酸中,完全反应后剩余的溶液和残余固体的总质量为119.8g.请计算:
(1)产生氢气的质量是多少
(2)这种黄铜中铜的质量分数为多少?剩余溶液中溶质的质量分数是多少?(计算结果精确到0.1%) ainiyanzi1年前1
ainiyanzi1年前1 -
 zero911 共回答了16个问题
zero911 共回答了16个问题 |采纳率87.5%1、120g-119.8=H2的质量=0.2g
2、转移电子2x0.2=0.4mol 所以Zn的物质的量=0.2mol mZn=0.2x65=13g Cu的质量分数啊7/20=0.35 溶质是ZnSO4=161x0.2=32.2g
32.2/(119.8-7)=0.285
纯手工望采纳!1年前查看全部
- 暗紫色的高锰酸钾完全分解后所残余的固体是化合物还是混合物?
暗紫色的高锰酸钾完全分解后所残余的固体是化合物还是混合物?
请说明为什么 漂泊龙1年前8
漂泊龙1年前8 -
 鱼儿三声笑 共回答了9个问题
鱼儿三声笑 共回答了9个问题 |采纳率88.9%应该是混合物
因为加热高锰酸钾是需要用到二氧化锰作为催化剂,而催化剂不参与反应,所以在反应后会剩余,于是和生成的锰酸钾就成了混合物1年前查看全部
- 在溴化钾和碘化钾的混合溶液中通入过量氯气,把溶液蒸干后并将剩余物灼烧,最后残余的物质是
在溴化钾和碘化钾的混合溶液中通入过量氯气,把溶液蒸干后并将剩余物灼烧,最后残余的物质是
A.氯化钾B.氯化钾和碘C.氯化钾和溴D.氯化钾和溴化钾 菜刀门下1年前1
菜刀门下1年前1 -
 住在外星球 共回答了14个问题
住在外星球 共回答了14个问题 |采纳率85.7%应该是A吧.
足量氯气把碘和溴都置换出来,生成氯化钾了.1年前查看全部
- 在Fe2(SO4)3溶液中,加入agCu,完全溶解后,又加入bgFe,充分反应后得到cg残余固体,且a>c,则
在Fe2(SO4)3溶液中,加入agCu,完全溶解后,又加入bgFe,充分反应后得到cg残余固体,且a>c,则
为什么残余固体全部是铜
为什么残余物体不是铁和铜的混合物? bobo7011年前3
bobo7011年前3 -
 hswkiller110 共回答了11个问题
hswkiller110 共回答了11个问题 |采纳率100%因为a>c啊,如果有铁残余的话,也就说铜被完全置换出来了,再加上残余的铁,那样的话a1年前查看全部
- 高锰酸钾加热制氧气后的残余固体是什么
 忍者Y1年前6
忍者Y1年前6 -
 五三十 共回答了21个问题
五三十 共回答了21个问题 |采纳率81%锰酸钾和二氧化锰
K2MnO4 MnO21年前查看全部
- 煤着火燃烧,残余一堆灰烬是什么变化
 avidzhu1年前4
avidzhu1年前4 -
 沧海一怒 共回答了12个问题
沧海一怒 共回答了12个问题 |采纳率100%化学变化1年前查看全部
- 高一化学钠的化合物测试题取碳酸氢钠和碳酸钠混合粉末5.26g,将其加热至质量不再改变,残余固体质量为3.71g.求该混合
高一化学钠的化合物测试题
取碳酸氢钠和碳酸钠混合粉末5.26g,将其加热至质量不再改变,残余固体质量为3.71g.求该混合物中NaHCO3和Na2CO3的物质的量. KIKI12011年前3
KIKI12011年前3 -
 童叶儿 共回答了15个问题
童叶儿 共回答了15个问题 |采纳率100%加热使NaHCO3分解,2NaHCO3=Δ=Na2CO3+CO2↑+H2O↑,减少质量为CO2及H2O总质量共1.55g,1.55/(44+18)=0.025mol,得n(NaHCO3)=0.05mol,m(NaHCO3)=4.2g,m(Na2CO3)=1.06g,n(Na2CO3)=0.01mol1年前查看全部
- 高温蒸汽灭菌的枪头会残余DNA吗?会对以后实验有污染吗?
高温蒸汽灭菌的枪头会残余DNA吗?会对以后实验有污染吗?
是做PCR,电泳应该会有杂带吧?枪头应该不是重复利用的,就是国产的。 fairne841年前2
fairne841年前2 -
 g1hjr5th5 共回答了17个问题
g1hjr5th5 共回答了17个问题 |采纳率100%灭菌的主要目的是去除细菌,如果原来枪头上存有DNA,在灭菌后DNA仍然会存在.因为DNA的性质相当稳定,高温高压不易破坏.但不影响之后的实验,因为高温高压后的DNA构象会发生变化,也有可能断裂,所以能影响后期实验的机会不大.不过像提取RNA等实验最好还是用进口枪头,因为本身就是无菌的,另外还没有RNA酶干扰.
应该不会的,我做了几年了,都没发现有什么影响.因为pcr是扩特定基因,出现干扰的概率很低.1年前查看全部
- 加热某紫黑色固体A生成气体B加热某紫黑色固体A生成气体B,将受热后的残余固体与另一种白色固体混合加热也生成气体B,把B与
加热某紫黑色固体A生成气体B
加热某紫黑色固体A生成气体B,将受热后的残余固体与另一种白色固体混合加热也生成气体B,把B与氮气以1:5体积中,将一定量暗红色粉末c点燃后伸入该瓶,即可见大量白眼D,并得到纯净氮气.求ABCD. 玉林生活1年前5
玉林生活1年前5 -
 你的抱抱遥遥 共回答了15个问题
你的抱抱遥遥 共回答了15个问题 |采纳率100%A:KMnO4
B:O2
C:红磷
D:P2O5
另一种白色固体:KClO31年前查看全部
- 加热氯酸钾和二氧化锰的混合物15g,使其完全反应.在一定温度下,向残余固体加入4g水,有9.24g固体?B
加热氯酸钾和二氧化锰的混合物15g,使其完全反应.在一定温度下,向残余固体加入4g水,有9.24g固体?B
加热氯酸钾和二氧化锰的混合物15g,使其完全反应.在一定温度下,向残余固体加入4g水,有9.24g固体未溶解,再加入2g水,仍有8.24g固体未溶解,且剩余固体为混合物.求氯酸钾的质量(计算结果保留一位小数) 每天都来八卦1年前1
每天都来八卦1年前1 -
 永恒在水一方 共回答了17个问题
永恒在水一方 共回答了17个问题 |采纳率94.1%加水时溶解的是氯化钾,依据:向残余固体加入4g水,有9.24g固体未溶解,再加入2g水,仍有8.24g固体未溶解,说明2克水溶解氯化钾9.24-8.24=1克,即原来加入4克水溶解了氯化钾2克.故加热后得到的固体质量是:9.24+2=11.24克
质量减小的是氧气的质量:15-11.24=3.76
2KClO3=2KCl+3O2
245-------96
x---------3.76
x=9.6克.1年前查看全部
- 已知Cu+2Fe3+=Cu2++2Fe2+.在硫酸铁溶液中,加入ag铜完全溶解后,再加bg铁.完全反应后得到cg残余固体
已知Cu+2Fe3+=Cu2++2Fe2+.在硫酸铁溶液中,加入ag铜完全溶解后,再加bg铁.完全反应后得到cg残余固体
且b小于c,则
残余固体可能为铁和铜
残余固体一定是铜
只含CU2+
只含Fe3+
 wty10011年前2
wty10011年前2 -
 祝--永保安康 共回答了15个问题
祝--永保安康 共回答了15个问题 |采纳率100%选第一个.
有残余固体,选项DC明显是错的,一定含有Fe2+,Cu2+和Fe3+就不一定了.1年前查看全部
- 塑性变形和残余变形有什么定义上的区别?拉伸断裂后不可恢复的那段长度属于塑性变形还是残余变形?
塑性变形和残余变形有什么定义上的区别?拉伸断裂后不可恢复的那段长度属于塑性变形还是残余变形?
还有塑性应变和残余应变的定义 zhouxingxion1年前1
zhouxingxion1年前1 -
 leona700 共回答了8个问题
leona700 共回答了8个问题 |采纳率87.5%这两个概念是有点含糊的,在不同的专业有不同的定义,不好作统一的解说
你可以这样理解,塑性变形侧重于过程,残余变形侧重于结果.
塑性变形在各个专业里都有应用,而残余变形更多在试验专业使用.1年前查看全部
- 将含3克氯酸钾和1克二氧化锰的混合物加热一段时间,冷却后称得残余固体的质量为3.04克,求生成氧气的质量为多少克?固体残
将含3克氯酸钾和1克二氧化锰的混合物加热一段时间,冷却后称得残余固体的质量为3.04克,求生成氧气的质量为多少克?固体残余物中含有什么物质?质量各为多少?  1364085391年前1
1364085391年前1 -
 meetwith 共回答了21个问题
meetwith 共回答了21个问题 |采纳率85.7%根据质量守恒定律可知,减少的固体的质量等于氧气的质量,因此氧气的质量=3g+1g-3.04g=0.96g;
氯酸钾分解生成氯化钾和氧气,二氧化锰是反应的催化剂,反应前后其质量不变,所以固体残余物中含有二氧化锰、氯化钾,还可能含有未分解的氯酸钾;
设生成氯化钾的质量是Y
2KClO 3
Mn O 2
.
△ 2KCl+3O 2 ↑
149 96
Y0.96g
149
Y =
96
0.96g
解得Y=1.49g
∵化学反应前后催化剂(二氧化锰)的质量保持不变.
∴残余物中还含有氯酸钾,氯酸钾的质量=3.04g-1.49g-1g=0.55g
答:生成氧气的质量为0.96g;固体残余物中含有氯化钾、二氧化锰和剩余的氯酸钾;其中二氧化锰1g,剩余氯酸钾0.55g,和生成的氯化钾1.49g.1年前查看全部
- 求求大虾们!好难过8.下列不属于残余小体的结构是(分值:1分)A.脂褐素B.多泡体C.髓样结构D.类核体E.含铁小体9.
求求大虾们!好难过
8.下列不属于残余小体的结构是(分值:1分)
A.脂褐素
B.多泡体
C.髓样结构
D.类核体
E.含铁小体
9.DNA电泳时出现特征性阶梯状条带的是(分值:1分)
A.细胞坏死
B.细胞衰老
C.细胞分化
D.细胞凋亡
E.细胞分裂 老李飞叉1年前1
老李飞叉1年前1 -
 柳园青青 共回答了13个问题
柳园青青 共回答了13个问题 |采纳率76.9%9 .选择 D1年前查看全部
- 过量的红磷在集气瓶中燃烧后是否还有残余的氧气
过量的红磷在集气瓶中燃烧后是否还有残余的氧气
装置图与课本相同,瓶内放着水 小文同学1年前1
小文同学1年前1 -
 雨落风飘 共回答了22个问题
雨落风飘 共回答了22个问题 |采纳率100%过量的红磷在集气瓶中燃烧后还有少量残余的氧气,但少到不足以使可燃物继续燃烧而已.1年前查看全部
- 如图是一块梯形铁片的残余部分,量得∠A=100°,∠B=115°,梯形另外两个角分别是多少度?
如图是一块梯形铁片的残余部分,量得∠A=100°,∠B=115°,梯形另外两个角分别是多少度?
如图是一块梯形铁片的残余部分,量得∠A=100°,∠B=115°,梯形另外两个角分别是多少度
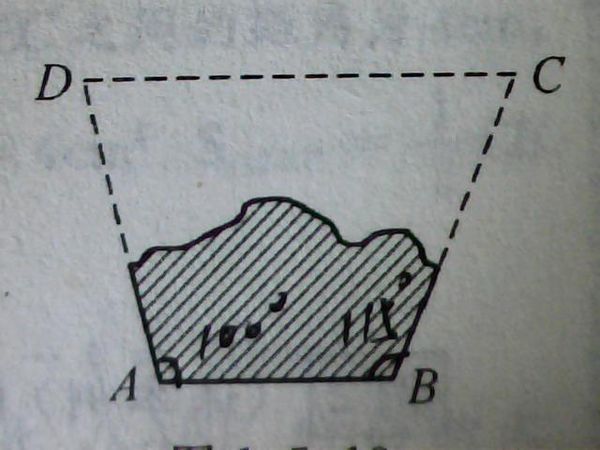
 浪迹金陵1年前9
浪迹金陵1年前9 -
 迷你猪- 共回答了23个问题
迷你猪- 共回答了23个问题 |采纳率100%∵AB‖DC,∴∠C+∠B=180°,∠C=180°-∠B=180°-115°=∠65°.
同理,∠D=180°-∠A=180°-100°=∠80°.1年前查看全部
- 将15.8克高锰酸钾加热至不产生气体,能生成氧气为多少克?残余固体中MnO2的质量分数为多少?
将15.8克高锰酸钾加热至不产生气体,能生成氧气为多少克?残余固体中MnO2的质量分数为多少?
KAL(SO4)2的相对分子质量为
KAL(SO4)2中钾元素、铝元素、硫元素、氧元素的质量比为
KAL(SO4)2中钾元素的质量分数为
CO(NH2)2的相对分子质量为
NH4NO3中氮元素的质量分数为
已知梯形ABCD与梯形A'B'C'D'相似,且CE垂直AB于E.下底AB=12厘米,上底CD=4厘米,CE=C'D'=6厘米,求梯形A'B'C'D'的面积?
全部答出 30分
看不懂 lovemeng5201年前1
lovemeng5201年前1 -
 alanick 共回答了26个问题
alanick 共回答了26个问题 |采纳率92.3%1 2582 K:15.1% AL:10.5% S:24.8% O:49.6%质量比约为 3:2:5:103 K:15.1%4 60 氮元素相对分数等于35%C'D'=6,说明相似比等于6除以4等于1.5那么面积的比等于相似比的平方等于2.25梯形ABCD的面积等于48 那么A'B'C...1年前查看全部
- 加热某紫黑色固体A能生成B,将受热后的残余固体与另一种白色固体混合加热也生成气体B,把B与氮气以1:4体积混合充入一集气
加热某紫黑色固体A能生成B,将受热后的残余固体与另一种白色固体混合加热也生成气体B,把B与氮气以1:4体积混合充入一集气瓶中,将一定量暗红色粉末C点燃后伸入该集气瓶,即可见大量白烟D生成,并又得到较纯净氮气,试推断:A为______B为______C为______D为______.(用化学式表示)
 aa123456a1年前1
aa123456a1年前1 -
 kqinglong 共回答了18个问题
kqinglong 共回答了18个问题 |采纳率88.9%解题思路:此题考查了常见物质的物理及化学性质,题目中“紫黑色固体A能生成气体B”,“受热后的残余固体与另一种白色固体混合加热也生成气体B”,“将一定量暗红色粉末C点燃后伸入该集气瓶,即可见大量白烟D生成”,则推测各物质为:包括了高锰酸钾、二氧化锰、氯酸钾、氧气、红磷及五氧化二磷等常见物质的基本物理及化学性质.根据题目中的信息:“紫黑色固体A能生成气体B”,“受热后的残余固体与另一种白色固体混合加热也生成气体B”,“将一定量暗红色粉末C点燃后伸入该集气瓶,即可见大量白烟D生成”,则推测A为高锰酸钾、B为氧气、C为红磷、D为五氧化二磷.
故答案为:KMnO4;O2;P;P2O5点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义.
考点点评: 此题属于推断题,对常见物质的物理及化学性质要熟练掌握,对常见化学反应类型要准确掌握.1年前查看全部
- 将9.9g干燥的氯酸钾和二氧化锰的混合物放到大试管中加热,反应完全后冷却,称得试管中残余固体的质量为7.2g,求:
将9.9g干燥的氯酸钾和二氧化锰的混合物放到大试管中加热,反应完全后冷却,称得试管中残余固体的质量为7.2g,求:
(1)该反应制得氧气多少克?
(2)7.2g固体物质中含有哪些物质?各是多少克? xiaoqi_0011年前1
xiaoqi_0011年前1 -
 zhangpengshuaida 共回答了17个问题
zhangpengshuaida 共回答了17个问题 |采纳率94.1%(1)根据化学方程式可知,固体的减小值等于氧气的质量,因此氧气的质量=9.9克-7.2克=2.7克.
(2)设生成2.2克氧气需要氯酸钾的质量是X,生成氯化钾的质量是Y.
2KClO 3
Mn O 2
.
△ 2KCl+3O 2 ↑
245149 96
XY 2.7克
245
96 ═
X
2.7克
得:X=6.9克
149
96 ═
Y
2.7克
得:Y=4.2克
∵化学反应前后催化剂(二氧化锰)的质量保持不变.
∴二氧化锰的质量=9.9克-6.9克=3克.
答:该反应制得氧气为2.7克,7.2g固体物质中含有4.2克氯化钾和3克二氧化锰.1年前查看全部
- (2008•赤峰)如图,是一块三角形木板的残余部分,量得∠A=100°,∠B=40°,这块三角形木板另外一个角是____
 (2008•赤峰)如图,是一块三角形木板的残余部分,量得∠A=100°,∠B=40°,这块三角形木板另外一个角是______度.
(2008•赤峰)如图,是一块三角形木板的残余部分,量得∠A=100°,∠B=40°,这块三角形木板另外一个角是______度.  chenjh991年前1
chenjh991年前1 -
 miumiuxyzz 共回答了22个问题
miumiuxyzz 共回答了22个问题 |采纳率77.3%解题思路:根据木板的形状,将其“复原”为一个三角形,依据三角形的内角和定理解答.∠C=180-∠A-∠B=180°-100°-40°=40°.
点评:
本题考点: 三角形内角和定理.
考点点评: 解答此题要知道三角形的内角和定理:三角形三个内角的和等于180°.1年前查看全部
- 关于质量守恒定律的一道习题a克氯酸钾和b克二氧化锰的混合物,加热一会儿后,冷却,称得残余物质质量为c克,则生成氧气___
关于质量守恒定律的一道习题
a克氯酸钾和b克二氧化锰的混合物,加热一会儿后,冷却,称得残余物质质量为c克,则生成氧气_____克. yueminzhou1年前5
yueminzhou1年前5 -
 mousehj 共回答了27个问题
mousehj 共回答了27个问题 |采纳率96.3%a+b-c1年前查看全部
大家在问
- 1听下面一段对话,回答第1-2小题。 1. What do we learn about Bill? A. He just
- 2翻译Winning or losing is temporary,but friendship lasts谢谢
- 3一道数学简答题两个相等的钝角,它们有公共顶点和一条公共边,另两条边所成的角是直角,求这两个钝角的度数
- 4过些日子见英语怎么说
- 5一个正方形的对角线是10,边长是、
- 6初一英语作文my day ,写我的一天,记住.比如,get up at seven two.,再加点什么句子,让文章更好
- 7意思相反的四字词语
- 8解方程(1)x2-2x-3=0
- 9有一颗善良的心,总会得到回报的——读《窗下的树皮小屋》有感_ 作文
- 100乘无穷型求极限x从正方向趋近于0时,xlnx趋近于多少?
- 11we have some tennis rackets.改为否定句
- 122的4次方+2的5次方+···+2的100次方等于多少?我要简便计算,我知道等于多少,问题是为什么要×2?%D%A快点
- 13如图,在平行四边形ABCD中,AB=3,BC=4,BE平分∠ABC交AD于E,则AE和ED分别为( )
- 14____ is known to all,china is a developing country.
- 15是垂线是否垂直?
