淡黄色固体在空气中燃烧 发出淡蓝色火焰 用化学符号表示
 binyinfen5202022-10-04 11:39:541条回答
binyinfen5202022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 一个瘪三 共回答了21个问题
一个瘪三 共回答了21个问题 |采纳率85.7%- S+O2 =点燃=SO2
- 1年前
相关推荐
- 高一化学中的淡黄色固体有哪些
 xu070153881年前3
xu070153881年前3 -
 周子毅 共回答了19个问题
周子毅 共回答了19个问题 |采纳率94.7%S
AgI
AgBr
Na2O2
FeS21年前查看全部
- 化学中淡黄色气体都有什么?
 北极之恋0231年前6
北极之恋0231年前6 -
 seasonman 共回答了18个问题
seasonman 共回答了18个问题 |采纳率94.4%Cl2 S021年前查看全部
- 用Na2S溶液,溶液变浑浊(淡黄色沉淀) 的原因
 multek_you1年前1
multek_you1年前1 -
 liai1985 共回答了21个问题
liai1985 共回答了21个问题 |采纳率90.5%被空气中的氧气缓慢氧化产生了s单质1年前查看全部
- na2so3在600度分解后与盐酸反应生成的淡黄色固体的方程式
na2so3在600度分解后与盐酸反应生成的淡黄色固体的方程式
有淡黄色固体和大量气泡 pepolu11年前2
pepolu11年前2 -
 超大米 共回答了14个问题
超大米 共回答了14个问题 |采纳率85.7%4Na2SO4= 加热 =Na2S +3Na2SO4
2Na2S +2Na2SO3 + 8HCl = 3S ↓(淡黄) + SO2↑ +4H2O + 8NaCl1年前查看全部
- 化学问题电解食盐水产生什么 我用的是铁丝只有负极冒气泡不像氢溶液变色浑浊有蓝色絮状物过滤得淡黄色溶液
 人家才5岁1年前4
人家才5岁1年前4 -
 520小丽 共回答了15个问题
520小丽 共回答了15个问题 |采纳率100%电解饱和食盐水是化工坐产中重要的氯碱工业,阳极产生氯气,阴极(与电源负极相连)产生氢气,电解液变为氢氧化钠溶液,当电极为惰性电极(石墨,金或铂)时才会在阳极生成氯气.用铁做阳极,会生成二价的亚铁离子,它与氢氧根反应生成白色沉淀,又迅速氧化成红褐色沉淀.对于你的实验,把电解液换成饱和的,再把阴极换成铜,阳极换成铜或石墨,淡黄色溶液应该是氯气溶于水之后形成的.按我的设想,理论上会有你期望的现象.1年前查看全部
- 镁在什么气体中发生反应生成淡黄色固体
 dfjknhkhjkh1年前1
dfjknhkhjkh1年前1 -
 sedy 共回答了19个问题
sedy 共回答了19个问题 |采纳率94.7%氮气吧,我记得好像是,生成三镁化二氮1年前查看全部
- 化学中淡黄色气体单质是什么
 yf197719771年前1
yf197719771年前1 -
 545903826 共回答了22个问题
545903826 共回答了22个问题 |采纳率90.9%溴蒸汽1年前查看全部
- 次氯酸钠和什么发生化学反应生成淡黄色固体?
 nim21年前1
nim21年前1 -
 夏氏鼠鼠 共回答了20个问题
夏氏鼠鼠 共回答了20个问题 |采纳率90%我觉得应该说是硫化氢.你这里的淡黄色固定应该是S,而负价的S不多.1年前查看全部
- 铁的什么溶液为淡黄色
 再上有情天1年前2
再上有情天1年前2 -
 好人-好人 共回答了22个问题
好人-好人 共回答了22个问题 |采纳率81.8%三氯化铁水溶液显黄色1年前查看全部
- 黑火药是我国古代的四大发明之一.它是由白色的硝石,淡黄色的硫粉和黑色的木炭粉按一定的比例混合而成的.黑火药常用来制造鞭炮
黑火药是我国古代的四大发明之一.它是由白色的硝石,淡黄色的硫粉和黑色的木炭粉按一定的比例混合而成的.黑火药常用来制造鞭炮,点燃鞭炮火药引线,火药烧到鞭炮的内部,硝石受热会分解,同时引燃了硫粉和木炭粉,最终生成了硫化钾和氮气以及一氧化碳而发生爆炸,根据以上信息回答下列问题:
(1)硝石的物理性质是______,化学性质是______;
(2)硫粉的物理性质是______,化学性质是______;
(3)上述资料中描述的化学变化是______. 自搞1年前1
自搞1年前1 -
 ht197416 共回答了15个问题
ht197416 共回答了15个问题 |采纳率73.3%解题思路:物质的化学性质是需要通过化学变化才能表现出来的性质,物理性质是不需要发生化学变化就能表现出来的性质,包括物质的颜色、状态、气味、熔点、沸点、密度、溶解性等,化学性质一般包括可燃性、氧化性、稳定性、还原性等;化学变化中有新物质生成.(1)硝石是白色的,不需要通过化学变化就能表现出来,属于物理性质;硝石粉受热分解,需要通过化学反应才能表现出来,属于化学性质.
故填:白色;受热分解.
(2)硫粉是淡黄色的,不需要通过化学变化就能表现出来,属于物理性质;硫粉能燃烧,需要通过化学反应才能表现出来,属于化学性质.
故填:淡黄色;硫粉能燃烧.
(3)硝石分解,同时引燃了硫粉和木炭粉,最终生成了硫化钾和氮气以及一氧化碳而发生爆炸,属于化学变化,故填:硝石分解,同时引燃了硫粉和木炭粉,最终生成了硫化钾和氮气以及一氧化碳而发生爆炸.点评:
本题考点: 化学性质与物理性质的差别及应用;化学变化和物理变化的判别.
考点点评: 本题难度不大,区分物质的性质属于物理性质还是化学性质,关键是看这条性质是否需要通过化学变化表现出来.1年前查看全部
- (6分)已知X是淡黄色固体,A、B是盐,其焰色反应呈黄色,C是硫酸盐,D、E是无色气体。A、B、C、D、X之间的转化关系
(6分)已知X是淡黄色固体,A、B是盐,其焰色反应呈黄色,C是硫酸盐,D、E是无色气体。A、B、C、D、X之间的转化关系
 如下:
如下:
(1)A+H 2 SO 4 (稀)→C+D↑; (2)B+H 2 SO 4 →C+E↑+H 2 O;
(3)D+E→X+H 2 O; (4)B+O 2 →C; (5)X+NaOH→A+B+H 2 O
试推断化学式:A________,B_______,C________,
D________,E_______,X________。 tina61131年前1
tina61131年前1 -
 善心如水流 共回答了21个问题
善心如水流 共回答了21个问题 |采纳率95.2%Na 2 S、Na 2 SO 3 、Na 2 SO 4 、H 2 S、SO 2 、S
略1年前查看全部
- 镁带在空气中燃烧生成氧化镁和氯化镁(氯化镁是淡黄色固体) 你认为镁带更容易与空气中的 反应 理由是==
 首次制备1年前1
首次制备1年前1 -
 xumin9090 共回答了14个问题
xumin9090 共回答了14个问题 |采纳率92.9%当然是氧气啦,空气中的氯气含量是非常少的,但也会生成二氮化三镁,氮气含量是很多的.1年前查看全部
- 过氧化钠(Na2O2)是一种淡黄色粉末,在通常情况下能与CO2、H2O、HCl发生反应:
过氧化钠(Na2O2)是一种淡黄色粉末,在通常情况下能与CO2、H2O、HCl发生反应:
2Na2O2+2CO2═2Na2CO3+O2↑
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+4HCl═4NaCl+2H2O+O2↑
为了验证CO2跟Na2O2反应生成的气体是O2,某同学设计了图中所示装置,试回答下列问题: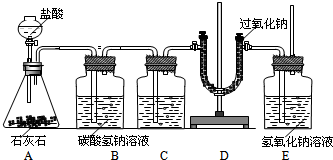
(1)设计B、C装置的目的是净化CO2气体,其中B的作用是______;发生的化学方程式为______;C装置瓶内的液体是______,利用了该物质的______性质(填“物理”或“化学”).
(2)为了验证CO2和Na2O2反应产生的气体是O2,最后还要在E处进行的操作是______;
(3)E装置中氢氧化钠溶液的作用是______.
(4)小明用50g稀盐酸与石灰石反应制取CO2气体,恰好完全反应后,得到溶质质量分数为20%的溶液55.5g,则该稀盐酸中溶质的质量分数是多少? olies1年前1
olies1年前1 -
 老毒妇 共回答了12个问题
老毒妇 共回答了12个问题 |采纳率91.7%解题思路:本题包含了二氧化碳的制取装置,同时也包含了气体的除杂方法、检验方法和干燥方法,本题研究了过氧化钠与二氧化碳反应的性质,检验生成物时用到了氧气的检验方法,氧气是用带火星的木条检验.二氧化碳是用澄清的石灰水检验,用氢氧化钠溶液吸收,用浓硫酸干燥.通过已知条件可知,B、C装置的目的是净化CO2气体,C装置的作用是干燥作用,E装置中氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,E装置中,最后还要进行的操作是:检验生成物中有氧气,根据溶质的质量分数、溶液的质量可求出氯化钙的质量,进一步求出氯化氢的质量,从而算出溶质的质量分数(1)设计B、C装置的目的是净化CO2气体,二氧化碳是用澄清的石灰水检验,用氢氧化钠溶液吸收,用浓硫酸干燥.故答案为:除去CO2气体中的氯化氢;反应的方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;浓硫酸(或浓H2SO4); 物理.
(2)用带火星的木条伸入集气瓶中,木条复燃,证明是氧气.故答案为:将带火星的木条靠近E装置中导气管的出口处;
(3)E装置中氢氧化钠的作用是吸收没有反应完的二氧化碳;
(4)设稀盐酸中氯化氢的质量为X.
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 111
X55.5g×20%
[73/111]=[X/11.1g]
解得:X=7.3g
稀盐酸溶液中溶质的质量分数为:[7.3g/50g]×100%=14.6%
故答案为::(1)除去CO2气体中的氯化氢;NaHCO3+HCl═NaCl+H2O+CO2↑;浓硫酸(或浓H2SO4); 物理.
(2)将带火星的木条靠近E装置中导气管的出口处;
(3)吸收没有反应的二氧化碳;
(4)14.6%点评:
本题考点: 二氧化碳的实验室制法;气体的净化(除杂);氧气的检验和验满;有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 本考点属于实验探究题,考查了过氧化钠的有关性质和变化的规律,还考查了反应装置、除杂装置和干燥装置等,综合性比较强.既有实验过程的探究,又有结论的探究.首先提出问题、作出假设,然后设计实验方案、进行实验,最后得出正确的结论,要注意实验现象的描述和化学方程式的配平.本考点主要出现在实验题中.1年前查看全部
- 物质单质是淡黄色粉末与氧气反应发出蓝色火焰
 行走寻找1年前2
行走寻找1年前2 -
 yy2003 共回答了19个问题
yy2003 共回答了19个问题 |采纳率94.7%淡黄色粉末是硫
S +O2 =SO21年前查看全部
- 过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.
过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O 2 ,设计出如下实验装置: 
(1)请写出过氧化钠与二氧化碳反应的化学方程式,并标明电子转移的方向和数目:______;
(2)A中制取CO 2 的装置,应从下列图①、②、③中选哪个图:______;
(3)B装置的作用是______;
(4)为了检验E中收集到的气体,在取出集气瓶后,用______的木条伸入集气瓶内,木条会出现______;
(5)若E中石灰水出现轻微白色浑浊,请说明原因:______;
(6)当D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?______;
(7)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值______(大或小),相差约______mL(取整数值,所用数据均在标准状况下测定),这是由于______. 神枪手0071年前1
神枪手0071年前1 -
 守夜tt 共回答了13个问题
守夜tt 共回答了13个问题 |采纳率84.6%(1)过氧化钠和二氧化碳反应生成碳酸钠和氧气,
故答案为:
(2)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,故选②.
(3)大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体,氯化氢和碳酸氢钠能反应生成二氧化碳,二氧化碳和碳酸氢钠不反应,所以B装置的作用是除二氧化碳中的氯化氢.
故答案为:除CO 2 中的HCl.
(4)过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃.
故答案为:故带火星;复燃.
(5)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致.
故答案为:未反应的二氧化碳与石灰水反应所致.
(6)当D中的1.95g过氧化钠样品接近反应完毕时,由于生成氧气的量减少,压强变小,所以E中可能会因二氧化碳与石灰水反应而倒吸.
故答案为:由于生成氧气的量减少,E中可能会因二氧化碳与石灰水反应而倒吸.
(7)1.95g过氧化钠完全反应生成氧气的体积为v.
2Na 2 O 2 ----O 2 ;
2mol22.4L
1.95g
78g/mol v
v=0.28L=280mL>250mL,所以实际收集到的氧气体积比理论计算值小.
280mL-250mL=30mL;
原因是Na 2 O 2 可能含有其它杂质;D装置可能有氧气未被排出.
故答案为:小;30;Na 2 O 2 可能含有其它杂质;D装置可能有氧气未被排出.1年前查看全部
- 下列花朵,蜜蜂不可能去采蜜的是A.花朵直径3毫米,淡绿色 B.花朵直径5厘米,黄色C.花朵直径6厘米,淡黄色 D.花朵直
下列花朵,蜜蜂不可能去采蜜的是
A.花朵直径3毫米,淡绿色 B.花朵直径5厘米,黄色
C.花朵直径6厘米,淡黄色 D.花朵直径8厘米,红色 暴徒1年前1
暴徒1年前1 -
 bjhunhun 共回答了12个问题
bjhunhun 共回答了12个问题 |采纳率83.3%A.花朵直径3毫米,淡绿色1年前查看全部
- 小明同学取出Na再切成两块,其中一块加执燃烧后得到淡黄色固体,另一块变成白色粉末.由此不能说明的是()
小明同学取出Na再切成两块,其中一块加执燃烧后得到淡黄色固体,另一块变成白色粉末.由此不能说明的是()
A常温下Na可与O2反应 B Na单质硬度小
C加热条件下Na可以在空气中燃烧 D Na与水反应产生H2 a1391991年前1
a1391991年前1 -
 海天相伴 共回答了15个问题
海天相伴 共回答了15个问题 |采纳率86.7%D 啊,没有任何现象表明产生了氢气1年前查看全部
- a.b.f为常见单质,其中b为气体,f与c均为淡黄色,g.h为两种所含元素种类相同的气体,d常温常压下为液态.推断a~f
a.b.f为常见单质,其中b为气体,f与c均为淡黄色,g.h为两种所含元素种类相同的气体,d常温常压下为液态.推断a~f各物质的化学式.

 likeat1年前1
likeat1年前1 -
 黑色魅影 共回答了25个问题
黑色魅影 共回答了25个问题 |采纳率96%转化关系看不清楚.1年前查看全部
- 溴化银和硫代硫酸跟离子反应生成二硫代硫酸银合银离子和溴离子,为什么现象是沉淀由淡黄色变黑色
 五行界外1年前1
五行界外1年前1 -
 piaoliuping4 共回答了25个问题
piaoliuping4 共回答了25个问题 |采纳率96%这与试剂的用量有关.
当硫代硫酸钠过量时,可以顺利地得到络合物,生成无色溶液.
当硫代硫酸钠不足时,生成硫代硫酸银白色沉淀,该沉淀迅速水解,生成硫化银,所以观察到你所说的现象.1年前查看全部
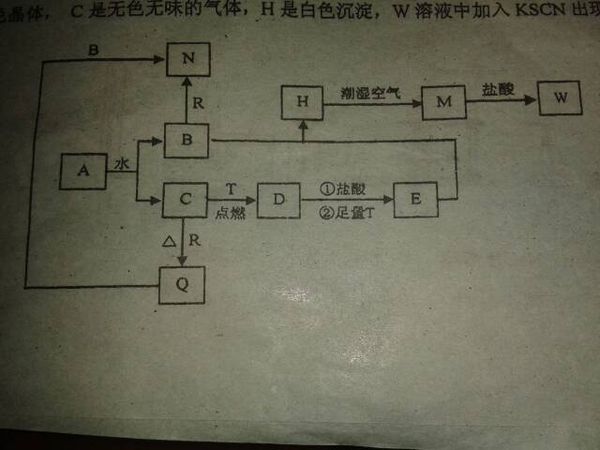
- 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色.
 faint_color1年前1
faint_color1年前1 -
 frsunny 共回答了21个问题
frsunny 共回答了21个问题 |采纳率95.2%A为淡黄色固体还可以和水反映生成气体,知道A为Na2O2 ,C为O2,则B Na(OH)
D有磁性,T为Fe D为Fe3O4 E FeCl2 H Fe(OH)2 M Fe(OH)3 W FeCl3
时间不够了,下面接着写1年前查看全部
- 有一淡黄色固体含23%的硼和77%的氯,它是从BCl3中制得的.0.0516g此样品在342K下蒸发,蒸气在2.95kP
有一淡黄色固体含23%的硼和77%的氯,它是从BCl3中制得的.0.0516g此样品在342K下蒸发,蒸气在2.95kPa压力下占有体积268dm^3.此化合物的分子式是什么?
 骆一琳1年前2
骆一琳1年前2 -
 手指烟草味道z 共回答了18个问题
手指烟草味道z 共回答了18个问题 |采纳率83.3%根据理想气体方程:PV=nRT求出n=0.27805mol
再求出分子量M=0.18558kg/mol=185.58g/mol(你的数据肯定有问题,应该是0.0516kg)
分子中硼原子数=185.58X0.23/10.811=3.9485=4
氯原子数=185.58X0.77/35.5=4.02=4
所以是B4Cl41年前查看全部
- 某气体D通过一种淡黄色的固体可得到一种气体E
某气体D通过一种淡黄色的固体可得到一种气体E
写出气体D转变为E的方程式.
PS.希望解释一下怎样推断出来的D和E. openland1年前2
openland1年前2 -
 whs002 共回答了18个问题
whs002 共回答了18个问题 |采纳率94.4%淡黄色固体是Na2O2
方程式是2CO2+2Na2O2=2Na2CO3+O2
中学阶段淡黄色固体一共就溴化银和过氧化钠等几种
记住就可以了1年前查看全部
- 硫是一种淡黄色晶体,它的蒸汽有橙色,无色,红棕色三种,它们都是硫的单质,但分子中硫原子的个数不同,可用s下标x表示
硫是一种淡黄色晶体,它的蒸汽有橙色,无色,红棕色三种,它们都是硫的单质,但分子中硫原子的个数不同,可用s下标x表示
红棕色蒸汽的质量是相同状况下同体积空气的6.63倍,则它的化学式是___
无色蒸气折算成标准状况下的密度是5.71g/L,则它的化学式是 liufang12152251年前3
liufang12152251年前3 -
 hexianzhe 共回答了16个问题
hexianzhe 共回答了16个问题 |采纳率100%红棕色蒸汽的质量是相同状况下同体积空气的6.63倍,说明该物质的M=29*6.63=192.27,再除以硫的摩尔质量32g/mol,所以该物质的化学式为S6
无色蒸气折算成标准状况下的密度是5.71g/L,说明该物质的M=5.71*22.4=127.904,再除以硫的摩尔质量32g/mol,所以该物质的化学式为S41年前查看全部
- 已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:
已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:
MnO 2 +4HCl(浓) MnCl 2 +Cl 2 ↑+2H 2 O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
MnCl 2 +Cl 2 ↑+2H 2 O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
(1)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S 2- 比Cl - 还原性强;④HCl比H 2 S稳定;⑤硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可作为氯元素比硫元素非金属性强的依据的是________。
A.②④B.②③④⑤C.②④⑤D.全部
(2)装有饱和食盐水的洗气瓶的作用是________________
(3)装置B中盛放的试剂是________(填选项),实验现象为_____________ 。
A.Na 2 S溶液B.Na 2 SO 3 溶液C.Na 2 SO 4 溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为________mol
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:____________________。 sniperp4d1年前1
sniperp4d1年前1 -
 钟戚 共回答了14个问题
钟戚 共回答了14个问题 |采纳率78.6%(1)B
(2)为了除去气体中的HCl
(3)A;生成淡黄色沉淀或溶液变浑浊
(4)0.02
(5)Cl 2 +2OH - =Cl - +ClO - +H 2 O1年前查看全部
- (2012•石景山区二模)氧化钙和过氧化钙(CaO2)是钙的两种氧化物.过氧化钙是一种淡黄色的固体,与水反应能放出氧气,
(2012•石景山区二模)氧化钙和过氧化钙(CaO2)是钙的两种氧化物.过氧化钙是一种淡黄色的固体,与水反应能放出氧气,过氧化钙在受热时生成氧化钙和氧气.下列结论中,正确的是( )
A.组成两种物质的元素不同
B.两种物质的化学性质相同
C.过氧化钙在受热时发生的反应属于分解反应
D.过氧化钙与水反应的化学方程式为CaO2+H2O=CaCO3↓+O2↑ jxqzb1年前1
jxqzb1年前1 -
 sunlan1999 共回答了17个问题
sunlan1999 共回答了17个问题 |采纳率100%解题思路:A、根据氧化钙和过氧化钙的化学式分析元素组成;
B、根据氧化钙的性质及信息提供的过氧化钙的性质分析;
C、根据分解反应的特征一边多的化学反应;
D、根据元素守恒的观点分析方程式.解;A、氧化钙和过氧化钙都是由钙元素和氧元素组成的,故选项错误;
B、氧化钙能与水反应生成氢氧化钙,而过氧化钙能与水反应放出氧气,故选项错误;
C、过氧化钙在受热时生成氧化钙和氧气符合分解反应的定义,故选项正确;
D、根据质量守恒定律,化学反应前后元素的质量不变,所以过氧化钙与水反应不能生成碳酸钙,故选项错误.
故选项为:C.点评:
本题考点: 物质的元素组成;分解反应及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了物质的元素组成、物质的性质、化学反应类型及质量守恒定律的应用,考查较为全面,所以基础性的考查,难度不大.1年前查看全部
- 化学问题:淡黄色沉淀是什么物质求大神帮助
 dean19801年前1
dean19801年前1 -
 侧古 共回答了22个问题
侧古 共回答了22个问题 |采纳率95.5%在高中有溴化银.硫单质1年前查看全部
- 淡黄色固态化合物是什么?
 dong0001年前1
dong0001年前1 -
 haitianyise31 共回答了19个问题
haitianyise31 共回答了19个问题 |采纳率94.7%Na2O2
AgBr
FeS2
推断题?再可、联系 其他 条件 想想常见的 就OK了1年前查看全部
- 淡黄色粘稠状液体 怎么翻译 英文
 快乐兔兔1年前3
快乐兔兔1年前3 -
 海棠春睡足 共回答了25个问题
海棠春睡足 共回答了25个问题 |采纳率84%light yellow sticky liquid1年前查看全部
- 某淡黄色粉末常用作潜水员的供氧剂,在供氧反应中,被氧化和被还原的物质的质量比为?答案好像1比1,为什
某淡黄色粉末常用作潜水员的供氧剂,在供氧反应中,被氧化和被还原的物质的质量比为?答案好像1比1,为什
可不可以讲解下 渡口等船1年前3
渡口等船1年前3 -
 浪漫左右 共回答了21个问题
浪漫左右 共回答了21个问题 |采纳率90.5%黄色粉末为过氧化钠,其中1个氧被氧化,另一个被还原,属典型歧化反应,答案1:1 .
过氧化钠中两个氧化合价均为-1,和潜水员呼出的二氧化碳反应后生成碳酸钠和氧气,即一个氧从-1变为0价,另一个变为-2价!1年前查看全部
- 过氧化钠(Na2O2)是潜水艇氧气再生装置中制氧剂,它是一种淡黄色粉末,能与二氧化碳反应生成氧气,反应的化学方程式是
过氧化钠(Na2O2)是潜水艇氧气再生装置中制氧剂,它是一种淡黄色粉末,能与二氧化碳反应生成氧气,反应的化学方程式是
2Na2O2+2CO2═O2+2X,则Na2O2中氧元素化合价为______,X的化学式为______. 毒71年前1
毒71年前1 -
 runrain 共回答了19个问题
runrain 共回答了19个问题 |采纳率89.5%解题思路:根据常见元素的化合价及化合物中正负化合价的代数和为0来计算过氧化钠中氧元素的花合计,再利用化学反应方程式和质量守恒定律来推断X的化学式.在Na2O2中Na元素的化合价为+1价,
设O元素的化合价为x,
根据化合物中正负化合价的代数和为0,则
(+1)×2+x×2=0,解得x=-1;
在2Na2O2+2CO2═O2+2X中,
根据质量守恒定律可知,反应前后元素种类、原子个数和种类相等,
反应前共4个Na原子、2个C原子、8个O原子,
反应后有氧气生成,
则X中应共含有4个Na原子、2个C原子、6个O原子,
又X的化学计量数为2,则X的化学式为Na2CO3,
故答案为:-1;Na2CO3.点评:
本题考点: 有关化学式的计算和推断;有关元素化合价的计算.
考点点评: 本题考查元素化合价的计算和利用化学反应方程式来推断物质的化学式,学生应熟悉常见元素的化合价及守恒法来分析解答.1年前查看全部
- (2007•泉州)化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na202)”的标签
(2007•泉州)化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na202)”的标签,这种外观与硫磺相似的物质到底有哪些性质?他们十分好奇,为了弄清它的有关性质,在老师的指导下,他们进行了以下探究活动:
【查阅资料】过氧化钠(Na202)在常温下能与水反应生成氢氧化钠和氧气;还能与二氧化碳反
应生成碳酸钠和氧气,在航空航天和潜水艇中常用作供氧剂.
[设计实验](1)过氧化钠与水反应;(2)过氧化钠与二氧化碳反应.
[进行实验]
(交流与讨论]实验步骤 实验现象 结 论 (1)①在试管中加入适量过氧化
钠,再加入足量水
②用______伸人试管中
③再向试管中加入
______①黄色粉末溶解,有气泡产生
②木条复燃
③______a.产物 填“有”或
“没有”)氧气
b.产物有氢氧化钠
写出过氧化钠与水反应的
化学方程式:
______(2)①向一定量的过氧化钠中通人
适量的二氧化碳,再用实验(1)②
的方法进行实验
②向上述充分反应后的固体产物
中加入稀盐酸
③将生成的气体通人
______①木条复燃
②有气泡产生
③溶液变浑浊
a.气体产物与实验(1)相同
b.实验①中
______(填“有”
或“没有”)碳酸钠生成
写出碳酸钠与稀盐酸反应
的化学方程式:
______
(1)通过实验,小池和小航同学知道了过氧化钠可用于航空航天和潜水艇中作为供氧剂的
主要原因是______.
(2)实验室可用双氧水和二氧化锰制取氧气,该反应化学方程式为2H202
2H20+02↑;MnO2 .2H202,其发生装置和收集装置的装配,应选用的仪器有:带导管的双孔塞、玻璃片以及下图所示中的______(填标号)等.氧气的收集方法有______种.
2H20+02↑;MnO2 .
(3)实验室制取气体的发生装置和收集装置类型的确定应根据______(填标号)
a.化学药品的状态
b.发生化学反应的条件
c.生成气体的密度和在水中的溶解性
(4)实验室选用上述仪器还可用来制取的气体有______(写一种). PIGGYFOREVER1年前1
PIGGYFOREVER1年前1 -
 frankie17 共回答了22个问题
frankie17 共回答了22个问题 |采纳率90.9%解题思路:本题研究了过氧化钠与水反应的性质,检验生成物时用到了氧气和二氧化碳的检验方法.氧气是用带火星的木条检验;二氧化碳是用澄清的石灰水检验.通过实验探究,知道了过氧化钠可用于航空航天和潜水艇中的供氧剂,因为二氧化碳和氧气已经形成了循环.本题还考查了氧气和氢气的制取装置,同时也包含了气体的收集方法、检验方法和仪器的连接,从而探究了发生装置和收集装置类型的确定应根据:药品的状态、反应的条件、气体的密度和溶解性等.[进行实验]由于过氧化钠(Na202)在常温下能与水反应生成氢氧化钠和氧气,通过产物推理思考可以得出化学方程式中的产物和氧气和氢氧化钠溶液的碱性的检验方法;同样在”还能与二氧化碳反应生成碳酸钠和氧气”的信息中完成碳酸钠的检验和反应方程式的书写,检验碳酸盐的存在一般要用到稀盐酸与澄清石灰水.
[交流与讨论](1)过氧化钠可用于航空航天和潜水艇中作为供氧剂,便于携带属于次要原因,而将人体呼出的二氧化碳并转化成人所需的氧气才是主要原因.
(2)选择仪器时要注意“带导管的双孔塞”这一隐藏条件,书写化学方程式时不要漏掉反应条件与气体生成符号.
(3)气体发生装置主要取决于反应物的状态与反应条件,而收集装置的选择组要取决于气体的密度与水溶性.
(4)这种“固液常温型”气体发生装置,还可以之躯氢气与二氧化碳.
故答案:
[进行实验]
实验步骤 实验现象 结论
(1)②带火星的木条
③无色酚酞试液(或紫色石蕊试液或硫酸铜溶液等) ③溶液变红(或变蓝或蓝色沉淀) a.有
2Na2O2+2H2O=4NaOH+O2↑
(2)③澄清的石灰水(或氢氧化钡溶液) b.有
Na2CO3+2HCl=2NaCl+H2O+CO2↑
[交流与讨论]
(1)不需外界反应条件,过氧化钠能吸收人呼出的二氧化碳并转化成人所需的氧气,可以保持航天器和潜水艇内空气成分的稳定
(2)2H202
MnO2
.
2H20+02↑;A、C、D(或A、C、D、E);2
(3)a、b、c
(4)氢气(H2)[或二氧化碳(C02)等]点评:
本题考点: 实验探究物质的性质或变化规律;常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;氧气的制取装置;氧气的收集方法;氧气的检验和验满;二氧化碳的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于实验探究题,考查了过氧化钠的有关性质和变化的规律,还考查了反应装置、收集装置等的选择,综合性比较强.既有实验过程的探究,又有结论的探究.首先提出问题、作出假设,然后设计实验方案、进行实验,最后得出正确的结论,并且进行交流评价,符合科学探究的基本环节.本考点主要出现在实验题中.1年前查看全部
- 为什么某淡黄色的颗粒状固体...
为什么某淡黄色的颗粒状固体...
某淡黄色的颗粒状固体,其化学性质比较活泼,在通常状况下能跟许多物质发生化学反应.例如:它与CO2反应时,只生成了Na2CO3和O2,它与稀盐酸反应时,只生成了NaCl、H2O和O2.上课时,老师做了如下实验:
a.取少量的淡黄色的颗粒状固体投入到盛有少量水的试管中,可观察到产生了一种无色无味的气体;
b.再向试管中滴加几滴酚酞试液,可观察到烧杯中溶液变红.
根据实验现象,回答下列问题:
(1)淡黄色的颗粒状固体中一定含有钠、氧钠、氧元素.你做出这个判断的理由是质量守恒定律质量守恒定律.
(2)实验a中产生的气体,可用 法收集.
(3)同学们对实验a中产生的气体的组成看法不一,提出了以下几种假设:
①该气体是CO;②该气体是H2.
请你推测该气体还可能是O2
O2
(写化学式).
(4)设计一个实验,证明你在(3)中的推测(写出简要操作步骤,反应现象和结论).
反应现象:
结论: atgc761年前1
atgc761年前1 -
 陌客墨客 共回答了17个问题
陌客墨客 共回答了17个问题 |采纳率94.1%这个高中要学到,该物质为过氧化钠,化学式:Na2O2,和二氧化碳反应生成氧气和碳酸钠,和水反应生成氧气和氢氧化钠,和稀盐酸反应是先和水反应生成氧气和氢氧化钠,然后氢氧化钠和稀盐酸反应生成氯化钠和水,以上这些应该可以帮你解决问题了.1年前查看全部
- A是金属单质,B 是淡黄色固体,C是白色固体,D、E都是物色溶液,发生下页图示的变化,指出各物质的名称.
 杰克斯派罗1年前2
杰克斯派罗1年前2 -
 佐哥 共回答了20个问题
佐哥 共回答了20个问题 |采纳率95%燃烧产生黄色火焰——这是钠的焰色,也是这个题的突破口.由此确定A就是钠,其它的不再讲原因了吧.
A:钠,B:过氧化钠,C:氧化钠,D:氢氧化钠,E:碳酸钠.1年前查看全部
- A+NaOH加热=C+D,C和硝酸酸化的硝酸银溶液反应生成淡黄色的沉淀(NaBr),D和浓硫酸共热生成只有两种同分异构体
A+NaOH加热=C+D,C和硝酸酸化的硝酸银溶液反应生成淡黄色的沉淀(NaBr),D和浓硫酸共热生成只有两种同分异构体的烃,请帮我看一下A是什么物质就行,请说明原因,
 gxfvm1年前2
gxfvm1年前2 -
 fang11wei 共回答了22个问题
fang11wei 共回答了22个问题 |采纳率81.8%A 是溴丁烷
CH2CH2CHBRCH3+NAOH=CH3CH2CH2OHCH3+NABR
NABR+AGNO3=NANO3+AGBR
2CH3CH2CHOHCH3+浓H2SO4催化=CH2=CHCH2CH3 +CH2CH=CHCH3+2H2O+H2SO41年前查看全部
- 谁能解释一下这个现象:在德国曾发生了一件有趣的事.一位染有淡黄色头发的学生在热天跳入游泳池.过了一会儿,人们吃惊地看到,
谁能解释一下这个现象:
在德国曾发生了一件有趣的事.一位染有淡黄色头发的学生在热天跳入游泳池.过了一会儿,人们吃惊地看到,从水中站起来一位满头绿发的青年.化学家对此作了解释:这是染发颜料与水中的氯发生了化学反应.
请解释一下“这是染发颜料与水中的氯发生了化学反应”
 中山二号1年前1
中山二号1年前1 -
 mjfr 共回答了27个问题
mjfr 共回答了27个问题 |采纳率92.6%首先游泳池里的水用的是自来水,自来水消毒时使用了次氯酸等物品,是水中含有氯离子.
而这个人染发用的黄色染发剂可能含有重金属铜离子,在跳入水中时,两种物质发生反应,反应生成物成绿色,附着在头发上,所以就出现了以上现象.1年前查看全部
- 46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末跟足量水反应放出气体的体积
46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末跟足量水反应放出气体的体积
A.44.8L B.11.2L C.22.4L D.5.6L
2Na + O2 == Na2O2 2Na2O2 + 2H2O == 4NaOH + O2↑
关系式:4Na ————O2
4×23 g 22.4L
46 g V(O2)
V(O2)=11.2L
为什么关系式可以写成4Na ————O2呢? cinkum1年前6
cinkum1年前6 -
 Royph 共回答了19个问题
Royph 共回答了19个问题 |采纳率84.2%(1)式乘以2,然后加上(2)式
4Na + 2O2 + 2Na2O2 + 2H2O = 2Na2O2 + 4NaOH + O2
化简 得到
4Na + O2 + 2H2O = 4NaOH
因此有这个关系式
也可以有另外的理解方法
1个Na原子可以失去一个电子成为Na+
1个O2一共可以失去4个电子成为O 2-
因此根据氧化还原反应电子转移要守恒,必须有4个Na对应1个O21年前查看全部
- 淡黄色粉未在气氧气表达示
 xujianfeng1年前1
xujianfeng1年前1 -
 北漂走族0001 共回答了21个问题
北漂走族0001 共回答了21个问题 |采纳率81%2NA2O2+2CO2=2NA2CO3+O21年前查看全部
- 高二化学选择题向某水溶液加过量稀盐酸后有白色沉淀生成,过滤后在滤液中通入足量H2S气体又有淡黄色沉淀生成,过滤后,向滤液
高二化学选择题
向某水溶液加过量稀盐酸后有白色沉淀生成,过滤后在滤液中通入足量H2S气体又有淡黄色沉淀生成,过滤后,向滤液中加入足量碳酸钠溶液又生成白色沉淀.则此溶液中含有( )
A.Ag +,Cu2+,Mg2+
B.Ag +,Fe3+,Ba2+
C.Ag +,Al3+,Mg2+
D.Ag +,Fe2+,Ca2+
写一下理由可以么?谢谢~~~好的会追加 静夜柔云1年前5
静夜柔云1年前5 -
 骑和尚的黑马 共回答了13个问题
骑和尚的黑马 共回答了13个问题 |采纳率92.3%加过量稀盐酸,仍有白色沉淀,高中阶段只有Ag+符合要求.
加H2S生成浅黄色沉淀,所以有硫单质生成,于是需要一种氧化性的金属离子,题中的Fe3+符合要求(Cu2+和H2S生成黑色硫化铜溶淀).
所以选择B1年前查看全部
- (2008•德阳模拟)图1表示物质A-K之间的转化关系.已知A、D、F、H均为单质,B为淡黄色固体,J为红褐色固体,反应
 (2008•德阳模拟)图1表示物质A-K之间的转化关系.已知A、D、F、H均为单质,B为淡黄色固体,J为红褐色固体,反应②通过图2装置实现.
(2008•德阳模拟)图1表示物质A-K之间的转化关系.已知A、D、F、H均为单质,B为淡黄色固体,J为红褐色固体,反应②通过图2装置实现.
请根据如图所示回答下列问题
(1)A为______,B为______,G的电子式为______.
(2)生成E 的电极反应式是______.
(3)反应①的化学方程式是3Fe+4H2O(g)
Fe3O4+4H2高温 .3Fe+4H2O(g).
Fe3O4+4H2高温 .
(4)反应⑥的离子方程式是______. moonriver05261年前1
moonriver05261年前1 -
 zxnina 共回答了17个问题
zxnina 共回答了17个问题 |采纳率94.1%解题思路:B为淡黄色固体为Na2O2,J为红褐色固体,说明J为Fe(OH)3;F为O2,G为NaOH,A为单质,结合转化关系①④可知,A为Fe,电解池中阳极是铁失电子生成亚铁离子,阴极放出H2,所以溶液中在阳极生成氢氧化亚铁;D为H2,E为Fe(OH)2,C为Fe3O4,H为Al,I为Al2O3,K为NaAlO2,综合推断和转化关系判断各物质分别为:A、Fe;B、Na2O2;C、Fe3O4;D、H2;E、Fe(OH)2;F、O2;G、NaOH;H、Al;J、Fe(OH)3;K、NaAlO2,结合对应单质、化合物的性质以及题目要求解答该题.B为淡黄色固体为Na2O2,J为红褐色固体,说明J为Fe(OH)3;F为O2,G为NaOH,A为单质,结合转化关系①④可知,A为Fe,电解池中阳极是铁失电子生成亚铁离子,阴极放出H2,所以溶液中在阳极生成氢氧化亚铁;D为H2,E为Fe(OH)2,C为Fe3O4,H为Al,I为Al2O3,K为NaAlO2,
(1)由以上分析可知,A为Fe,B为Na2O2,G为NaOH,电子式为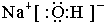 ,故答案为:Fe; Na2O2;
,故答案为:Fe; Na2O2;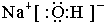 ;
;
(2)生成Fe(OH)2的电极反应式是Fe+2OH--2e-═Fe(OH)2,故答案为:Fe+2OH--2e-═Fe(OH)2;
(3)反应①为铁与水的反应,反应的方程式为3Fe+4H2O(g)
高温
.
Fe3O4+4H2,故答案为:3Fe+4H2O(g)
高温
.
Fe3O4+4H2;
(4)反应⑥为铝和氢氧化钠的反应,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.点评:
本题考点: 无机物的推断;电解原理.
考点点评: 本题考查了物质转化关系的应用,物质性质的综合应用,主要是考查铁及其化合物的性质判断和应用,铝及其化合物的性质应用,物质的性质和反应现象,铝热反应,电解原理是解题关键,题目较难,需要熟练掌握物质性质、反应的现象和转化关系.1年前查看全部
- 淡黄色固体焰色为黄色的物质是什么
 小木_木林森1年前3
小木_木林森1年前3 -
 qinbinghe 共回答了20个问题
qinbinghe 共回答了20个问题 |采纳率90%淡黄色固体 Na2O2
钠的焰色为黄色1年前查看全部
- 化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na2O2)”的标签,这种外观与硫磺相
化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na2O2)”的标签,这种外观与硫磺相似的物质到底有哪些性质?他们十分好奇,为了弄清它的有关性质,在老师的指导下,他们进行了以下探究活动:
查阅资料:过氧化钠(Na2O2)在常温下能与水反应生成氢氧化钠和氧气;还能与二氧化碳反应生成碳酸钠和氧气,在航空航天和潜水艇中常用作供氧剂.
设计实验:(1)过氧化钠与水反应;(2)过氧化钠与二氧化碳反应.
进行实验:
交流与讨论:通过实验,小池和小航同学知道了过氧化钠可用于航空航天和潜水艇中作为供氧剂的主要原因是:______.实验步骤 实验现象 结论 (1)①在试管中加入适量过氧化钠,再加入足量水;
②用______ 伸入试管中①黄色粉末溶解,有气泡产生
②木条复燃产物______(填“有”或“没有”)氧气;写出过氧化钠与水反应的化学方程式:
______(2)①向一定量的过氧化钠中通入适量的二氧化碳,再用实验(1)②的方法进行实验;
②向上述充分反应后的固体产物中加入稀盐酸;
③将生成的气体通入______①木条复燃
②有气泡产生
③溶液变浑浊a.气体产物与实验(1)相同;
b.实验①中______(填“有”或“没有”)碳酸钠生成.
写出碳酸钠与稀盐酸反应的化学方程式:
______ gracewater1年前1
gracewater1年前1 -
 wangoceanyang 共回答了21个问题
wangoceanyang 共回答了21个问题 |采纳率95.2%解题思路:(1)根据资料过氧化钠(Na2O2)在常温下能与水反应生成氢氧化钠和氧气可知,加水溶解有气泡产生,该气泡为氧气.为进一步确定,用带火星的木条检验,看是否复燃.根据以上信息完成化学方程式.
(2)根据资料过氧化钠(Na2O2)与二氧化碳反应生成碳酸钠和氧气和实验现象木条复燃可知,向一定量的过氧化钠中通入二氧化碳,也生成了氧气.要确定另一种物质为碳酸钠,只要验证有碳酸根离子即可,其验证方法为:加稀盐酸产生能使石灰水变浑浊的气体.
(3)解决交流与讨论的问题思路:根据物质的性质决定物质的用途的原理,过氧化钠不但可以产生氧气,还能吸收二氧化碳.认真分析过氧化钠的性质与反应后生成物的性质,结合所学知识完成表格.
实验步骤 实验现象 结论
(1)①在试管中加入适量过氧化钠,在加入足量水;
②用带火星的木条伸入试管 ①黄色粉末溶解,有气泡产生②木条复燃 有氧气2Na2O2+2H2O═4NaOH+O2↑
(2)①向一定量的过氧化钠通入二氧化碳,再用(1)②的方法进行
②向上述充分反应后的固体产物中加入稀盐酸
③把②中产生的气体通入澄清的石灰水
①木条复燃
②有气泡产生
③溶液变浑浊 有碳酸钠
Na2CO3+2HCl═2NaCl+H2O+CO2↑因航天器和潜水艇内都是有限的空间,航天员和潜水员呼吸时需要氧气同时产生的二氧化碳,若不及时排除或反应掉,空间内二氧化碳浓度增高,航天员和潜水员会感到憋闷,影响健康.过氧化钠不但能吸收二氧化碳产生氧气,而且不需外界反应条件,不用负载过多的物质,因此过氧化钠可用于航空航天和潜水艇中作为供氧剂.
所以原因为:不需外界反应条件,过氧化钠能吸收人呼出的二氧化碳并转化成人所需的氧气,可以保持航天器和潜水艇内空气成分的稳定.点评:
本题考点: 化学实验方案设计与评价;实验探究物质的性质或变化规律;证明碳酸盐;氧气的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 该题根据查阅资料提供的信息并结合实验步骤和现象解决问题.主要考查读题能力,能把题目所给信息与所学知识进行牵连.知道性质决定用途,用途体现性质.1年前查看全部
- 硫代硫酸钠溶液中通入氯气,有淡黄色沉淀产生的离子方程式
 爱尔兰-1年前2
爱尔兰-1年前2 -
 分手后再看海 共回答了18个问题
分手后再看海 共回答了18个问题 |采纳率88.9%4 Na2S2O3 + Cl2 = 5 S ↓ + 3 Na2SO4 + 2 NaCl
4 S2O32- + Cl2 = 5 S ↓+ 3 SO42- + 2 Cl-1年前查看全部
- 氯气通入氢硫酸溶液产生淡黄色浑浊
 athena2651cn1年前0
athena2651cn1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下
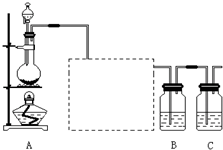
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中加入的试剂是______.
(2)画出虚线框内的实验装置图,并注明所加试剂,______说明装置的作用______.
(3)装置B中盛放的试剂是______(选填下列所给试剂的代码),实验现象为______,化学反应方程式是______,该反应属于四种基本反应类型中的______反应.
A.Na 2 S溶液B.Na 2 SO 3 溶液C.Na 2 SO 4 溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
______
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
______
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
______
______.
 jiangcheng7171年前1
jiangcheng7171年前1 -
 eent123 共回答了21个问题
eent123 共回答了21个问题 |采纳率90.5%(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO 2 .故答案为:浓盐酸;MnO 2 ;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为:
.故答案为:
;除去Cl 2 中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na 2 S溶液,发生的是置换反应,化学方程式为:Na 2 S+Cl 2 =2NaCl+S↓.
故答案为:A;有淡黄色沉淀生成;Na 2 S+Cl 2 =2NaCl+S↓;置换;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
(5)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.
故答案为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.(其他合理答案均可);
(6)判断元素金属性强弱的依据有:最高价氧化物对应水化物的碱性强弱、单质与水或酸反应置换出氢气的剧烈程度、金属之间的置换反应等,而判断元素具有金属的依据与之不同,如(5)所述.因此,Cl元素的化合价既有升高又有降低,不能说明氯元素既具有金属性又具有非金属性.本题答案为:金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.
故答案为:不能;金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)1年前查看全部
- 将一小块钠投入水中,发生反应的化学方程式为______,若将钠块放到石棉网上加热会生成淡黄色固体,该反应的化学方程式为2
将一小块钠投入水中,发生反应的化学方程式为______,若将钠块放到石棉网上加热会生成淡黄色固体,该反应的化学方程式为2Na+O2
Na2O2加热 .2Na+O2,该固体遇水会有无色无味的气体生成,该反应的化学方程式为______,
Na2O2加热 .
将氯气通入反应后的溶液中,发生反应的化学方程式为______,铁丝可以在氯气中燃烧其反应的化学方程式为3Cl2+2Fe
2FeCl3点燃 .3Cl2+2Fe.
2FeCl3点燃 . 牛一手1年前1
牛一手1年前1 -
 sooner001 共回答了20个问题
sooner001 共回答了20个问题 |采纳率75%解题思路:钠与水反应生成NaOH和氢气;钠在空气中加热会和氧气反应生成过氧化钠;过氧化钠和水反应,能生成氢氧化钠和氧气;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;氯气具有强的氧化性,铁丝在氯气中燃烧生成红棕色的固体三氯化铁.钠与水反应生成NaOH和氢气,该反应为2Na+2H2O=2NaOH+H2↑;金属钠在氧气中燃烧生成淡黄色固体,化学方程式为2Na+O2
加热
.
Na2O2;过氧化钠和水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为Cl2+2NaOH═NaCl+NaClO+H2O;氯气具有强的氧化性,铁丝在氯气中燃烧生成红棕色的固体三氯化铁,反应的化学方程式为3Cl2+2Fe
点燃
.
2FeCl3;
故答案为:2Na+2H2O=2NaOH+H2↑;2Na+O2
加热
.
Na2O2;2Na2O2+2H2O=4NaOH+O2↑;Cl2+2NaOH═NaCl+NaClO+H2O;3Cl2+2Fe
点燃
.
2FeCl3.点评:
本题考点: 钠的化学性质.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,可以根据教材知识来回答.1年前查看全部
- 已知:A、B、C为中学常见的单质,B为淡黄色固体;D、E、F为中学常见的氧化物,E是具有磁性的黑色晶体;H、K为中学常见
已知:A、B、C为中学常见的单质,B为淡黄色固体;D、E、F为中学常见的氧化物,E是具有磁性的黑色晶体;H、K为中学常见的盐;M为一种常见的无色液体.各物质间的转化关系如图所示(某些条件已略去).
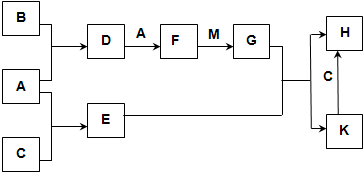
请回答:
(1)物质M的电子式为______,E与G反应的离子方程式为______.
(2)D可使酸性KMnO4溶液褪色,体现了D物质的______(填字母序号).
A.氧化性 B.还原性 C.漂白性
(3)C与M在一定条件下反应的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2高温 .3Fe+4H2O(g).
Fe3O4+4H2高温 .
(4)先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为______.
(5)H溶液在空气中长期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因:______. 罗尼1231年前1
罗尼1231年前1 -
 林子1985 共回答了24个问题
林子1985 共回答了24个问题 |采纳率95.8%解题思路:B为淡黄色固体单质,应为S,E是具有磁性的黑色晶体,应为Fe3O4,由B和A能连续反应可知A为O2,C为Fe,D为SO2,F为SO3,M为一种常见的无色液体,应为H2O,则G为H2SO4,由H和K的转化关系可知H为FeSO4,K为Fe3(SO4)2,结合对应物质的性质以及题目要求可解答该题.B为淡黄色固体单质,应为S,E是具有磁性的黑色晶体,应为Fe3O4,由B和A能连续反应可知A为O2,C为Fe,D为SO2,F为SO3,M为一种常见的无色液体,应为H2O,则G为H2SO4,由H和K的转化关系可知H为FeSO4,K为Fe3(SO4)2,
(1)M为H2O,为共价化合物,电子式为 ,E与G反应的离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O,
,E与G反应的离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O,
故答案为: ;Fe3O4+8H+═Fe2++2Fe3++4H2O;
;Fe3O4+8H+═Fe2++2Fe3++4H2O;
(2)D为SO2,具有还原性,可与酸性高锰酸钾发生氧化还原反应而是高锰酸钾溶液褪色,故答案为:B;
(3)铁和水蒸气在高温发生反应生成Fe3O4和H2,反应的方程式为3Fe+4H2O(g)
高温
.
Fe3O4+4H2,故答案为:3Fe+4H2O(g)
高温
.
Fe3O4+4H2;
(4)二氧化硫与氯化钡不反应,通入氨气,溶液呈碱性,存在大量的亚硫酸根离子,可生成亚硫酸钡沉淀,故答案为:先无明显现象,通入NH3后产生白色沉淀;
(5)H为FeSO4,具有还原性,可与空气中氧气发生反应生成红褐色氢氧化铁沉淀,反应的离子方程式为12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+,
故答案为:12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和推断能力的考查,注重于元素化合物知识的综合运用,化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合可根据物质的特殊颜色或特殊化学反应,推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键.1年前查看全部
- 用 Na2S4O6 滴定时为什么要先滴定用 Na2S4O6 滴定时为什么要先滴定至淡黄色再加淀粉液作指示剂?
用 Na2S4O6 滴定时为什么要先滴定用 Na2S4O6 滴定时为什么要先滴定至淡黄色再加淀粉液作指示剂?
好像是因为碘会进入淀粉内部. 曾经深爱过20051年前1
曾经深爱过20051年前1 -
 lovesword 共回答了18个问题
lovesword 共回答了18个问题 |采纳率83.3%是的,淀粉遇I2变蓝就是因为直链淀粉形成一个螺旋后,中间的隧道可以装入碘的分子形成蓝色络合物,会影响滴定准确度1年前查看全部
- 氢硫酸露置于空气中出现淡黄色混浊反应化学方程式
 注册个rr好难1年前1
注册个rr好难1年前1 -
 east1116 共回答了14个问题
east1116 共回答了14个问题 |采纳率100%2 H2S + O2 == 2 H2O + 2 S↓
希望能帮到你……1年前查看全部
- 化 学 无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气
化 学 无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气
化
学
无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气味气体f,这些字母名称是? rtttuytytytyty1年前2
rtttuytytytyty1年前2 -
 2007yexin 共回答了37个问题
2007yexin 共回答了37个问题 |采纳率91.9%a过氧化氢,b二氧化锰,c氧气,d水,e硫,f二氧化硫1年前查看全部
大家在问
- 1Only when __________ senior high school __________ to show a
- 2小刺猬 作文
- 31、不要忘记告诉他这个消息 2、做午饭花费我三十分钟时间 3、他妈妈不让他在大街上玩 4、恐怕他的
- 49分之5x乘4分之3等于6分之5解方程急
- 5醋酸和氢氧化钠反应,在不断消耗氢离子的情况下,醋酸可不可能完全电离?
- 6为提高白菜、菠菜的产量,应多施什么肥?
- 7简算 454+999X999+545
- 8已知函数f(X)=Xe^x(e为自然数的底)(1)求函数的单调增区间
- 9翻译一下这句The human is not strong enough,therefore,they will.
- 10设f(x)在[a,b]上连续,在(a,b)内二阶可导,且f(a)=f(b)=[1/b−a]∫baf(x)dx,试证:存在
- 11成语接龙 赏心悦目谁能帮我接下去 至少接5个
- 121.Our modern civilizition must not be thought of as ____in a
- 13如果1233…3n个3是27的倍数,那么n最小是几?
- 14有一根木料,用12分之1时截成5段,如果每截一次所用时间相同,那么要截7段,一共需要
- 15我经过艰难,学会了骑车作文,五百字,拜托了
