用 Na2S4O6 滴定时为什么要先滴定用 Na2S4O6 滴定时为什么要先滴定至淡黄色再加淀粉液作指示剂?
 曾经深爱过20052022-10-04 11:39:541条回答
曾经深爱过20052022-10-04 11:39:541条回答好像是因为碘会进入淀粉内部.

已提交,审核后显示!提交回复
共1条回复
 lovesword 共回答了18个问题
lovesword 共回答了18个问题 |采纳率83.3%- 是的,淀粉遇I2变蓝就是因为直链淀粉形成一个螺旋后,中间的隧道可以装入碘的分子形成蓝色络合物,会影响滴定准确度
- 1年前
相关推荐
- 现代化学传感器技术是研究溶液中离子反应的重要手段,某化学兴趣小组用1.0mol/LNaOH溶液滴定25mL未知浓度的盐酸
现代化学传感器技术是研究溶液中离子反应的重要手段,某化学兴趣小组用1.0mol/LNaOH溶液滴定25mL未知浓度的盐酸溶液,并用电导率传感器测定过程中的电导率,通过数据采集器自动记录测得的电导率并绘制电导率-V曲线,可显示滴定过程中的突跃现象(如图所示).对于突跃现象最合理的解释是______.

 locat1年前1
locat1年前1 -
 晨香物探 共回答了25个问题
晨香物探 共回答了25个问题 |采纳率96%解题思路:溶液导电率的大小取决于离子浓度的大小,结合酸碱中和滴定中pH突变的原因、酸碱中和的实质对电导率-V曲线分析.溶液导电率的大小取决于离子浓度的大小,离子浓度越大,导电能力越强.当接近终点时,溶液中离子浓度已非常之小,而加入的氢氧化钠溶液的离子浓度并没有变化,二者相比是非常大的,所以加入一滴离子浓度就会改变很大,出现突变的情况,C点为巧好完全中和的时刻,
故答案为:当接近终点时,一滴氢氧化钠溶液引起了离子浓度的突变.点评:
本题考点: 电解质溶液的导电性;中和滴定.
考点点评: 本题考查了溶液导电能力的判断、酸碱中和滴定实验,难度一般,可根据酸碱中和滴定中pH发生突变转移到本题导电率突变上来.1年前查看全部
- 氢氧化钠滴定盐酸的过程中的质子平衡式为什么是氢离子浓度加上氢氧化钠的浓度等于氢氧根的浓度与盐酸的浓
 lc76677831年前3
lc76677831年前3 -
 sdyfzp 共回答了19个问题
sdyfzp 共回答了19个问题 |采纳率89.5%电荷守恒:阳离子所带的正电荷等于阴离子所带的负电荷,及[H+]+[Na+]==[OH-]+[Cl-]1年前查看全部
- 用NaOH标准溶液滴定HCL和H3PO4混合溶液,一份滴定至甲基红变色时,消耗
用NaOH标准溶液滴定HCL和H3PO4混合溶液,一份滴定至甲基红变色时,消耗
NaOH溶液体积为V1毫升,另一份滴定至百里酚酞变色时,消耗NaOH体积为V2毫升,混合溶液中H3PO4消耗NaOH溶液体积为?
a.2V2 b.2V2-V1 c.2(V2-V1) d.V2-V1 guanpao1年前1
guanpao1年前1 -
 紫羽狼矢 共回答了19个问题
紫羽狼矢 共回答了19个问题 |采纳率73.7%题问的不清楚,若问第一份混合溶液中H3PO4消耗NaOH溶液体积选d,第二份混合溶液中H3PO4消耗NaOH溶液体积选c.
以甲基红作指示剂,发生如下反应:
NaOH + HCl = NaCl + H2O
NaOH + H3PO4 = NaH2PO4 + H2O
以百里酚酞作指示剂,发生如下反应:
NaOH + HCl = NaCl + H2O
2NaOH + H3PO4 = Na2HPO4 + 2H2O(可看做NaOH + H3PO4 = NaH2PO4 + H2O,
NaH2PO4 + NaOH = Na2HPO4 + H2O)
)
显然两份混合液中盐酸消耗的NaOH是相同的,第一份NaOH与H3PO41:1反应,第二份NaOH与H3PO42:1反应(可视为NaOH+H3PO4=NaH2PO4+H2O; NaH2PO4+NaOH=Na2HPO4+H2O)
,由此可知第一份磷酸消耗的氢氧化钠的体积为(v2-v1)1年前查看全部
- 基准草酸钠滴定高锰酸钾滴定液所加入的10ml硫酸的浓度是多少
 广顺1年前1
广顺1年前1 -
 wang__hong 共回答了11个问题
wang__hong 共回答了11个问题 |采纳率100%10ml浓度为6mol/L的1/2硫酸溶液
相当于10ml浓度为3mol/L的硫酸溶液1年前查看全部
- 用标准盐酸滴定未知浓度的NAOH溶液,为什么用酚酞作指示剂时,滴至溶液从红色变成无色即视为滴定终点,会引起实验误差?
 xiameng9341年前1
xiameng9341年前1 -
 ilovis 共回答了19个问题
ilovis 共回答了19个问题 |采纳率94.7%变色范围pH值8.2-10.0,溶液从红色变成无色时pH值8.2,氢氧化钠轻微过量,浓度为10^(-5.8),不足千万分之一,这样的实验误差是可以被接受的.1年前查看全部
- 硫代硫酸钠怎么水解?滴定的时候硫代硫酸钠是怎样反应的?用 碘酸钾 KIO3 滴定 硫代硫酸钠Na2S2O3它不是强碱弱酸
硫代硫酸钠怎么水解?
滴定的时候硫代硫酸钠是怎样反应的?用 碘酸钾 KIO3 滴定 硫代硫酸钠Na2S2O3
它不是强碱弱酸盐吗?为什么不水解?抛开那个滴定的话呢?会水解的吧.
这样的话,会水解请给方程式;不水解请给理由. ZHOUlangui1年前1
ZHOUlangui1年前1 -
 小肥宝宝 共回答了17个问题
小肥宝宝 共回答了17个问题 |采纳率94.1%硫代硫酸钠不水解.1年前查看全部
- (1)常温下,用0.1000mol/LNaOH浴液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL
(1)常温下,用0.1000mol/LNaOH浴液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如图所示.

①由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
②a=______mL;
③c(Na+)=c(CH3COO-)的点是______(填B、D或E);
④E点对应离子浓度由大到小的顺序为______.
(2)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Kap=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______. hardlystop1年前1
hardlystop1年前1 -
 我是谁哈 共回答了17个问题
我是谁哈 共回答了17个问题 |采纳率94.1%解题思路:(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等;
③根据电荷守恒判断;
④根据溶液的酸碱性及电荷守恒判断离子浓度大小;
(2)根据溶度积常数及铬离子浓度计算溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH.(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸,根据图象知,未加氢氧化钠溶液时,图1的PH小于图2,所以图1是盐酸,故答案为:图1;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等,盐酸和氢氧化钠的物质的量浓度相等,要使其物质的量相等,则体积必须相等,所以a=20mL,故答案为:20mL;
③溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(Na+)=c(CH3COO-),所以c(H+)=c(OH-),则溶液呈中性,为D点,故答案为:D;
④溶液呈碱性,c(H+)<c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以则c(Na+)>c(CH3COO-),溶液是盐溶液,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)根据溶度积常数得溶液中c(OH-)=
3
Ksp
c(Cr3+)
=
3
10−32
10−5
mol/L=10-9 mol/L,则溶液中氢离子浓度=
10−14
10−9mol/L=10-5 mol/L,则溶液的pH=5,
故答案为:5.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合溶液定性判断及溶度积常数的计算等知识点,明确弱电解质电离特点结合电荷守恒来分析解答即可,难度中等.1年前查看全部
- 常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说
常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是(
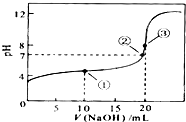 常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是( )
A.滴定过程中可能出现:c(Na+)>c(A-)>c(H+)>c(OH-)
B.点①所示溶液中:c(A-)+c(HA)=2c(Na+)
C.点②所示溶液中:c(Na+)=c(A-)
D.点③所示溶液中:c(OH-)=c(HA)+c(H+)
 omar_fermat1年前1
omar_fermat1年前1 -
 填鸭狂吐 共回答了20个问题
填鸭狂吐 共回答了20个问题 |采纳率95%A.若c(Na+)>c(A-)>c(H+)>c(OH-),阳离子电荷总数大于阴离子电荷总数,违反电荷守恒,故A错误;
B.点①所示溶液中,为等量的醋酸和醋酸钠溶液,物料守恒为2c(Na+)=c(CH3COO-)+c(CH3COOH),故B正确;
C.②为中性溶液,则c(H+)=c(OH-),电荷守恒得c(OH-)+c(CH3COO-)=c(Na+)+c(H+),所以c(Na+)=c(A-),故C正确;
D.点③所示溶液,恰好反应生成盐,但盐是强碱弱酸盐,根据质子守恒得c(OH-)=c(HA)+c(H+),故D正确;
故选A.1年前查看全部
- 滴定终点甲基橙怎么变色
 Y2KJACKCO1年前2
Y2KJACKCO1年前2 -
 yuyanqiu 共回答了16个问题
yuyanqiu 共回答了16个问题 |采纳率93.8%ph3.1以下,红色.3.1到4.4橙色.4.4以上,黄色.
滴定酸液,由公红变到黄色的时候停止.滴定碱液,由黄变橙的时候停止.
明白了吗?
望采纳1年前查看全部
- I2 + I- == I3- 用Na2S2O3去滴定它,硫代硫酸钠是跟哪个反应?能与I3-反应吗
 巨蟹座的我1年前1
巨蟹座的我1年前1 -
 yantao2004 共回答了10个问题
yantao2004 共回答了10个问题 |采纳率90%是和碘反应,和别的没关系.连四硫酸钠和碘化钠:2 Na2S2O3 + I2 = Na2S4O6 + 2 NaI1年前查看全部
- 重铬酸钾滴定硫酸亚铁铵用什么指示剂比较准确
 70年代出生的人1年前3
70年代出生的人1年前3 -
 nasdaq_66 共回答了19个问题
nasdaq_66 共回答了19个问题 |采纳率94.7%硫酸亚铁铵标准溶液配制标定,0.1mol/L
配制
称取39.2g硫酸亚铁铵溶解于适量的水中,加100mL硫酸溶液(1+1),用水稀释至1L.贮存溶液在棕色瓶中,加入两条洁净的铝片(C.P),以保持溶液浓度长期稳定.
标定
1,10-菲罗啉指示液:
用单标线吸管吸取25mL新标定的0.1mol/L重铬酸钾标准滴定溶液置于250mL锥形瓶中,加70~80mL水和10mL硫酸,冷却后加3滴1,10-菲罗啉指示液,用硫酸亚铁铵溶液滴定至溶液变为砖红色为终点.
计算
硫酸亚铁铵标准滴定溶液浓度按式(1)计算:
………………………………………(1)
式中:c〔(NH4)2Fe(SO4)2〕──
硫酸亚铁铵标准滴定溶液之物质的量浓度,mol/L;
c1──
重铬酸钾标准滴定溶液浓度,mol/L;
V1──
重铬酸钾标准滴定溶液体积,mL;
V2──
滴定用去硫酸亚铁铵溶液的实际体积,mL.
精密度
做五次平行测定,取平行测定的算术平均值为测定结果;五次平行测定的极差,应小于0.00040mol/L.
稳定性
硫酸亚铁铵标准滴定溶液使用时标定.
称取1.6g1,10-菲罗啉及1g硫酸亚铁铵(或0.7g硫酸亚铁),溶于100mL水中,贮存于棕色瓶中.1年前查看全部
- 实验室工作的来帮帮忙!我们做COD化学需氧量是用的烘箱法,有的水样加入了硫酸就变浑了,这是为什么啊,浑的直接滴定结果有什
实验室工作的来帮帮忙!
我们做COD化学需氧量是用的烘箱法,有的水样加入了硫酸就变浑了,这是为什么啊,浑的直接滴定结果有什么不一样 毒棍九号1年前1
毒棍九号1年前1 -
 东王西皇 共回答了16个问题
东王西皇 共回答了16个问题 |采纳率93.8%可能含有钡或银离子1年前查看全部
- 为什么测量亚铁离子浓度用高锰酸钾滴定亚铁离子更合适 而不是亚铁离子滴定高锰酸钾
 rr阿蒙1年前1
rr阿蒙1年前1 -
 markey 共回答了25个问题
markey 共回答了25个问题 |采纳率100%用高锰酸钾滴定亚铁离子终点是无色变红色,容易观察.
亚铁离子滴定高锰酸钾终点是红色变无色,不容易观察.1年前查看全部
- cod消解完成后,当下不滴定,第二天滴定对结果有影响没有,如果有,结果的误差多少?
 哈哭拉1年前4
哈哭拉1年前4 -
 老贼plum 共回答了16个问题
老贼plum 共回答了16个问题 |采纳率87.5%原则上会有一定影响,因为剩余的重铬酸钾长时间会继续和水中还原性物质进行反应.导致你测得的COD偏高.
但是差别很小,你尽量当天滴定掉,不要等到第二天.1年前查看全部
- 盐酸滴定碱液,判断碱液组成以hcl滴定一碱溶液,先用酚酞作指示剂,滴定至终点时体积为V1,加入甲基橙后继续滴定,至变橙色
盐酸滴定碱液,判断碱液组成
以hcl滴定一碱溶液,先用酚酞作指示剂,滴定至终点时体积为V1,加入甲基橙后继续滴定,至变橙色时体积为V2,结果是v1=v2不等于0,所以碱液组成为( )
A,NaOH+Na2CO3
B.纯Na2CO3
C.NaHCO3+Na2CO3
D.纯NaHCO3
试给出简要说明。 gto9911年前1
gto9911年前1 -
 uioo9158 共回答了21个问题
uioo9158 共回答了21个问题 |采纳率95.2%我认为选择A,首先LZ要知道酚酞的变色范围是pH=8左右的,甲基橙的变色范围是pH=3.9;其次碳酸氢钠溶液一般pH=8左右,碳酸钠pH=10.6,pH=8到3.9区间盐酸不与碳酸氢钠反应,pH=8到10的时候,盐酸不与碳酸钠反应.由题意,盐酸应先跟氢氧化钠反应,再和碳酸钠反应升成碳酸氢钠.1年前查看全部
- 用0.1摩每升氢氧化钠滴定0.1摩每升盐酸,如达到滴定终点时不慎多加一滴氢氧化钠溶液(1滴体积为0.05毫升),
用0.1摩每升氢氧化钠滴定0.1摩每升盐酸,如达到滴定终点时不慎多加一滴氢氧化钠溶液(1滴体积为0.05毫升),
继续加水至50毫升,则所得溶液的PH值是多少? tqxobeewl_71_481年前1
tqxobeewl_71_481年前1 -
 纹荭幛o 共回答了24个问题
纹荭幛o 共回答了24个问题 |采纳率83.3%多加的OH-的物质的量=5*10^-6mol
加水至50毫升:c(OH-)=5*10^-6mol/0.05L=10^-5mol/l
c(H+)=10^-10mol/l
PH=-lgc(H+)=101年前查看全部
- 酸碱指示剂问题为什么强碱滴定弱酸时常用酚酞作指示剂,强酸滴定强碱时常用甲基橙作指示剂?
 玉米粥1年前1
玉米粥1年前1 -
 哨兵的爱 共回答了17个问题
哨兵的爱 共回答了17个问题 |采纳率94.1%强碱滴定弱酸等当点时,溶液相当于强碱弱酸盐溶液,由于水解略显碱性,故应用酚酞(变色范围8-10).
强酸滴定弱碱等当点时,溶液相当于弱碱强酸盐溶液,由于水解略显酸性,故应用甲基橙(变色范围3.1-4.4).1年前查看全部
- 0.1mol/L盐酸滴定0.1mol/lNaOH溶液,如加到滴定终点时不慎多加了一滴盐酸(1滴溶液约为0.05ml)继续
0.1mol/L盐酸滴定0.1mol/lNaOH溶液,如加到滴定终点时不慎多加了一滴盐酸(1滴溶液约为0.05ml)继续加水至50ml,所得溶液PH?
要过程、、直接说答案的别回答、、可加悬赏分 dfefw091年前2
dfefw091年前2 -
 totowings 共回答了23个问题
totowings 共回答了23个问题 |采纳率91.3%滴定终点时溶液中是NaCl和水,ph为7
多加了一滴盐酸那么 n(H+)=(0.05×10^-3)×0.1 = 0.05×10^-4 mol
所以 c(H+)=(0.05×10^-4)÷(50×10^-3) = 1×10^-4 mol/L
所以最终 ph = 41年前查看全部
- 用EDTA滴定硫酸铜用PAN做指示剂 颜色的变化是什么呢?就是滴定重点
用EDTA滴定硫酸铜用PAN做指示剂 颜色的变化是什么呢?就是滴定重点
怎么我加了 缓冲溶液和掩蔽剂后就变成蓝色的了?
缓冲溶液用的氨-氯化铵 掩蔽剂用的氟化铵
有两种回答诶。到底是什么颜色呢?这是我的毕业设计~谢谢亲们了先 栗子31年前2
栗子31年前2 -
 夏日的蔷薇 共回答了16个问题
夏日的蔷薇 共回答了16个问题 |采纳率100%PAN:1-(2-吡啶偶氮)-2-萘酚.
一种分析化学常用指示剂,初始颜色黄色,滴定至终点时则颜色变为紫红色.
在一定pH下能与Cu2+配位呈现一种与游离指示剂完全不同的颜色而指示终点.适宜PH范围2~12.使用范围广,但容易发生指示剂僵化现象(反应颜色变化慢).1年前查看全部
- 在滴定分析中选择指示剂的一般原则是什么呢?(07.2.3)
 桂花苏1年前2
桂花苏1年前2 -
 康巴 共回答了16个问题
康巴 共回答了16个问题 |采纳率100%灵敏度度高,颜色变化明显,不与滴定物质发生反应,最好无毒1年前查看全部
- 滴定时为什么要加入氨水缓冲溶液
 非典型性云游1年前1
非典型性云游1年前1 -
 piglhy 共回答了20个问题
piglhy 共回答了20个问题 |采纳率95%酸度对配位滴定影响非常大,影响酸效应系数.
加氨水缓冲液是为了控制溶液的酸度,即PH值1年前查看全部
- 在直接配位滴定法中,滴定终点所呈现出的颜色是游离金属指示剂的颜色,为什么不对?
在直接配位滴定法中,滴定终点所呈现出的颜色是游离金属指示剂的颜色,为什么不对?
这个说法是错误的,错在哪里? 女博士1年前1
女博士1年前1 -
 sljlxq 共回答了14个问题
sljlxq 共回答了14个问题 |采纳率92.9%溶液颜色是金属离子M与MIn叠加色1年前查看全部
- 下列各表述与示意图一致的是 A.图①表示室温时,用0.1 mol.L -1 盐酸滴定0.1 mol·L -1 NaOH溶
下列各表述与示意图一致的是

A.图①表示室温时,用0.1 mol.L -1 盐酸滴定0.1 mol·L -1 NaOH溶液过程中的pH变化 B.T℃时,反应2NO 2 (g)  N 2 O 4 (g)达到平衡时NO 2 的体积分数
N 2 O 4 (g)达到平衡时NO 2 的体积分数 (NO 2 )随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅
(NO 2 )随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅C.图③表示向绝热恒容密闭容器中通入A 2 和B 2 ,一定条件下使反应2A 2 (g)+B 2 (g)  2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量
2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g)  M x (g),t 1 时刻,保持温度不变,再充入1 mol M,重新达到平衡时
M x (g),t 1 时刻,保持温度不变,再充入1 mol M,重新达到平衡时 将增大
将增大 醒醒了1年前1
醒醒了1年前1 -
 凌一蓝 共回答了17个问题
凌一蓝 共回答了17个问题 |采纳率88.2%D
1年前查看全部
- 简单的酸碱浓度滴定问题: 10mL HNO3 试剂, 用1mol/L NaOH 1.2mL滴定至无色,求HNO3的浓度.
简单的酸碱浓度滴定问题: 10mL HNO3 试剂, 用1mol/L NaOH 1.2mL滴定至无色,求HNO3的浓度.
求证算法,以验证.谢谢! 武陵山魈1年前4
武陵山魈1年前4 -
 轻轻我来了 共回答了11个问题
轻轻我来了 共回答了11个问题 |采纳率90.9%HNO3 + NaOH = NaNO3 + H2O
1 1
10A 1.2X1
1/1=10A/1.2
A=0.12mol/L
HNO3的浓度为:0.12mol/L1年前查看全部
- 急需一篇双相滴定法测量苯甲酸钠的含量论文
 dd_970631年前1
dd_970631年前1 -
 红苹果绿叶子 共回答了22个问题
红苹果绿叶子 共回答了22个问题 |采纳率95.5%楼主,我有这方面的资料,要怎么给你啊?建议你到 分析测试百科网 群组论坛去提问,我来回复你..也可以到分析测试百科网 下载中心搜索一下你想要的资料..1年前查看全部
- [分析化学]Na2C2O4能否作为滴定酸的基准物?为什么?
[分析化学]Na2C2O4能否作为滴定酸的基准物?为什么?
大学分析化学实验,酸碱滴定 藕叫狗狗1年前1
藕叫狗狗1年前1 -
 人情冷暖63 共回答了16个问题
人情冷暖63 共回答了16个问题 |采纳率93.8%Na2C2O4晶体可以作为滴定酸的基准物.
它比较稳定,是一种碱性物质.1年前查看全部
- 以纯铜标定Na2S2O3溶液时,滴定到达终点后又返回到蓝色!
 eqq的额头1年前1
eqq的额头1年前1 -
 虎啸aaa 共回答了22个问题
虎啸aaa 共回答了22个问题 |采纳率81.8%四水合铜离子为蓝色1年前查看全部
- 硫代硫酸钠滴定碘什么时候加淀粉我知道是在接近终点时加淀粉指示液,但怎么知道有没有接近终点啊?
 yangsaiyong1年前1
yangsaiyong1年前1 -
 ip170305448 共回答了21个问题
ip170305448 共回答了21个问题 |采纳率90.5%当溶液的棕黄色比较浅的时候,即残留的I2不多了,加入淀粉.1年前查看全部
- 醋酸钠也是强酸弱碱盐,是否能用盐酸标准溶液直接滴定
 8待字闺中1年前1
8待字闺中1年前1 -
 一条残龙 共回答了16个问题
一条残龙 共回答了16个问题 |采纳率87.5%醋酸钠是强碱弱酸盐,呈弱碱性,可以用盐酸直接滴定,终点在弱酸性区域,用甲基橙或甲基红做指示剂.1年前查看全部
- 甲基橙可以用来做滴定什么的指示剂?
 csj003311年前1
csj003311年前1 -
 ots14 共回答了19个问题
ots14 共回答了19个问题 |采纳率89.5%用作酸碱中和滴定的指示剂1年前查看全部
- 请问哪位有0.1mol/L硝酸汞的标准滴定溶液的配制方法?
请问哪位有0.1mol/L硝酸汞的标准滴定溶液的配制方法?
标定用基准氯化钠要在多高温度下烘多厂时间?烘的温度的高底有什么影响?我查到有的是110度烘有的是500到600度烘. 我有一颗虎牙1年前1
我有一颗虎牙1年前1 -
 45706 共回答了19个问题
45706 共回答了19个问题 |采纳率89.5%称取17.13g硝酸汞 Hg(NO3)2·H2O加7ml硝酸,用水溶解定溶至1000ml.
标定用基准氯化钠,精确称取5.844gNaCl,溶解定溶至1000ml,浓度为0.1mol/L,吸取25ml,加100ml水,加溴酚蓝指示剂,用1mol/L的硝酸将溶液颜色蓝色调成黄色,过量几滴,加1ml二苯偶氮炭酰肼,用硝酸汞溶液滴定到紫红色.同时做空白.
计算:
c= c1V1/(V-Vo)1年前查看全部
- 溴百里酚蓝滴定前是什么颜色的
 秋风梧桐燕儿飞1年前1
秋风梧桐燕儿飞1年前1 -
 dengshouyi 共回答了12个问题
dengshouyi 共回答了12个问题 |采纳率83.3%溴百里酚蓝
【中文名称】 溴百里酚蓝( 中文译名颇多 :溴瑞香草蓝,溴瑞香草酚蓝,溴化麝香草酚兰,溴麝香草酚兰,溴芮香草蓝,溴百里酚蓝指示剂,又名酒精蓝色指示剂) 【英文名称】 bromothymol blue 【性状】 几乎无色或极浅的玫瑰色结晶粉末.【溶解情况】 不溶于水,易溶于乙醇呈浅褐色,易溶于稀碱性溶液呈蓝色 BTB指示剂在酸性、中性和碱性溶液中的颜色
.【用途】 用作PH值指示剂,变色范围6.0-7.6,变化由黄色经绿色到蓝色.【制备或来源】 由百里酚与邻磺基苯甲酸酐缩合后经溴化而制得.【酸碱平衡方程式】 C27H28Br2O5S ⇌ H+ + C27H27Br2O5S− 溴百里酚蓝的pKa为7.10.1年前查看全部
- 酸碱滴定指示剂关于指示剂的,用碱滴定酸时候,用酚酞 当变为无色的时候试剂的PH应为8.2,这不就是说没完全反应吗?用酸滴
酸碱滴定指示剂
关于指示剂的,用碱滴定酸时候,用酚酞 当变为无色的时候试剂的PH应为8.2,这不就是说没完全反应吗?用酸滴定碱时用甲基红也是啊,为6.2不就小于7了吗? 或汉1年前1
或汉1年前1 -
 ganaawwa 共回答了17个问题
ganaawwa 共回答了17个问题 |采纳率94.1%当酸碱中和滴定时候,有一个滴定突跃,只加一滴碱或者酸,就能使PH改变几个单位,这叫做滴定突跃,只要在滴定突跃范围内显色,就算是合适的指示剂1年前查看全部
- 滴定分析的化学反应必须满足的要求是什么?
 沅泉1年前2
沅泉1年前2 -
 lqt010 共回答了16个问题
lqt010 共回答了16个问题 |采纳率87.5%1.反应能定量的完成.2.反应速度要快.3.能用比较简单的方法确定反应的等当点.1年前查看全部
- 急,滴定管读数问题滴定管读数是该用滴定后-滴定前还是滴定前-滴定后?我自己认为应该是滴定后-滴定前
 懵懂斋1年前1
懵懂斋1年前1 -
 果子没了 共回答了24个问题
果子没了 共回答了24个问题 |采纳率100%是的 滴定后-滴定前
总归大的减小的1年前查看全部
- 如何利用电导滴定确定强酸强碱滴定的终点?
 duoshoucainengd1年前1
duoshoucainengd1年前1 -
 Tpynv 共回答了17个问题
Tpynv 共回答了17个问题 |采纳率94.1%强酸强碱反应过程中,由于水,气体,沉淀的生成,导电能力基本不变,终点时,溶液中离子浓度开始上升,电流表示数开始上升,于是可以确定反应终点.1年前查看全部
- 硫磷混酸的电位滴定所用的酸度计是否进行校正
 wphan1年前1
wphan1年前1 -
 花落a红尘 共回答了14个问题
花落a红尘 共回答了14个问题 |采纳率92.9%记住任何水质分析仪器在使用前,均需要校正.一来是为了减少误差,二来是增加读数的准确性.大型的分析仪器,也有基线校准等1年前查看全部
- 电位滴定分析实验中,细测Ka时,为什么在1/2△Vex处增加测量密度
 asw291年前1
asw291年前1 -
 水生519 共回答了20个问题
水生519 共回答了20个问题 |采纳率90%越靠近终点时,相同体积的滴定剂产生的电势变化越大,若不增加测量密度,很可能会因为滴定剂的加入量过多而错过滴定终点,导致结果偏高1年前查看全部
- 用碳酸钠标定硫酸时,用甲基红-溴甲酚绿作指示剂,滴定至紫红是煮沸在滴至暗红色,有两个体积,计算时怎么
用碳酸钠标定硫酸时,用甲基红-溴甲酚绿作指示剂,滴定至紫红是煮沸在滴至暗红色,有两个体积,计算时怎么
怎么计算,煮沸的作用是什么, 4ok821年前1
4ok821年前1 -
 xhq007 共回答了16个问题
xhq007 共回答了16个问题 |采纳率93.8%计算的时候以后一个为准,第二个体积是终点
煮沸的用处是加热排除水中溶解的二氧化碳,二氧化碳常温在水中的溶解度约为体积比1:1,会对实验结果造成比较大的误差1年前查看全部
- 高锰酸钾浓度0.0186mol/L,滴定5mL草酸水用量10.4mL,求草酸根质量浓度?
 三十三不立1年前1
三十三不立1年前1 -
 怡然萱草 共回答了17个问题
怡然萱草 共回答了17个问题 |采纳率88.2%高锰酸钾和草酸反应方程式如下:2MnO4- + 5H2C2O4 +6H +=2Mn2+ + 10CO2↑ +8H2O
n(MnO4-)=0.0186*10.4*10^-3=1.9344*10^-4 mol
因为2/(1.9344*10^-4)=5/n(H2C2O4),所以草酸的物质的量为4.835*10^-4 mol,
所以草酸的浓度为4.835*10^-4 /(5*10^-3)=0.0967mol/L1年前查看全部
- 大二《分析化学》的一条题目.15.测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50
大二《分析化学》的一条题目.
15.测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50mL,以下结果表示正确的是( )
(A)10% (B)10.1% (C)10.08% (D)10.077%
我知道答案选C,我怎么总觉得题目不全呢.EDTA的浓度不是没有么 候鸟061年前1
候鸟061年前1 -
 好像没有不对 共回答了24个问题
好像没有不对 共回答了24个问题 |采纳率91.7%这道题考的是有效数字
题目中出现的两个数字有效数字都是4位,所以选C1年前查看全部
- 氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的氢氧化钠转变为碳酸钠,以此氢氧化钠溶液滴定未知浓度的盐酸,选
氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的氢氧化钠转变为碳酸钠,以此氢氧化钠溶液滴定未知浓度的盐酸,选用甲基橙作指示剂;盐酸浓度的测定结果会( )(为什么?)
A 偏低1%
B
C 无影响
D 偏高0.1% omejiajia1年前1
omejiajia1年前1 -
 www317 共回答了16个问题
www317 共回答了16个问题 |采纳率81.3%c
碳酸酸性没有盐酸强,甲基橙的变色点在酸性范围内,所以碳酸也会被盐酸变成二氧化碳1年前查看全部
- 盐酸滴定碳酸钠和碳酸氢钠的图像
 八世封印1年前0
八世封印1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 请问在酸碱滴定中,选择试剂可以不必考虑的因素是不是指示剂的分子结构?
 干了这杯我就走1年前1
干了这杯我就走1年前1 -
 yldhd 共回答了22个问题
yldhd 共回答了22个问题 |采纳率81.8%不是1年前查看全部
- 测定盐酸式样浓度时,用到的是碳酸钠,甲基红—溴甲酚蓝,为什么滴定到玫瑰红时要加热煮沸啊?
 第四条掌纹1年前3
第四条掌纹1年前3 -
 wsksqt 共回答了11个问题
wsksqt 共回答了11个问题 |采纳率90.9%因为你用的是碳酸钠做标样,你用盐酸滴定碳酸钠时会产生二氧化碳对吧,甲基红—溴甲酚蓝这种指示剂很灵敏,碳酸钠生成的二氧化碳显酸性,会使指示剂变红,但实际还没到达滴定终点,会影响滴定结果的,要加热赶去二氧化碳.1年前查看全部
- 关于实验水样总硬度测定的问题如果先取好水样三份,再分别加入掩蔽剂,缓冲溶液和指示剂,然后再一份一份地滴定,这样做可以吗?
关于实验水样总硬度测定的问题
如果先取好水样三份,再分别加入掩蔽剂,缓冲溶液和指示剂,然后再一份一份地滴定,这样做可以吗?为什么?
我知道这样做是不可以的,可是到底为什么呢? 垃圾斗士1年前1
垃圾斗士1年前1 -
 hy520karen 共回答了22个问题
hy520karen 共回答了22个问题 |采纳率81.8%铬黑T易被氧化,使终点不清晰,故加入指示剂后应尽快完成滴定
一起做影响测定时间,易使铬黑T被氧化.
另外,时间长了,氨的挥发使缓冲溶液的PH值降低也会影响总硬度的测定1年前查看全部
- 混合碱(NaOH,Na2co3,NaHCO3)用盐酸滴定时,当消耗盐酸体积V1=V2时,存在的形式是?
混合碱(NaOH,Na2co3,NaHCO3)用盐酸滴定时,当消耗盐酸体积V1=V2时,存在的形式是?
不应该是Na2co3吗?为什么答案是NaoH? sjy661年前2
sjy661年前2 -
 我是小黄 共回答了14个问题
我是小黄 共回答了14个问题 |采纳率92.9%你没有给出完整的题目,所以不好下结论.双指示剂法滴定混合碱时,一般V1是指酚酞褪色时的盐酸消耗体积,V2是指继续滴定时另外消耗的盐酸体积,按这种默认的体积分段计算方法,答案应该是Na2CO3,如果是NaOH,应该是V1>0,V2=0;
但有时出题时,如果表述为取两份等量的混合碱,一份以酚酞指示,盐酸滴定体积为V1,另一份以甲基橙指示,滴定体积为V2.V1=V2,显然,这种表述的结果应该是NaOH.(我出分析试题时有时也会设这样的陷阱)
如果题目不是第二种表述(或相似表述),则答案就是错的,你的判断正确!1年前查看全部
- Ag 2 CrO 4 的溶度积小于 AgCl 的溶度积,试说明 AgNO 3 滴定 Cl - 时为什么能用 K 2 Cr
Ag 2 CrO 4 的溶度积小于 AgCl 的溶度积,试说明 AgNO 3 滴定 Cl - 时为什么能用 K 2 CrO 4 作指示剂?(Ag 2 CrO 4 :; AgCl :)
 markboy1年前3
markboy1年前3 -
 派克因扎吉 共回答了18个问题
派克因扎吉 共回答了18个问题 |采纳率88.9%在含有Cl-的中性溶液中,以K2CrO4为指示剂,用AgNO3溶液滴定,由于AgCl的溶解度比Ag2CrO4小,根据分步沉淀的原理,溶液中首先析出AgCl沉淀,当AgCl定量沉淀后,过量的一滴AgNO3与CrO42-生成砖红色的Ag2CrO4沉淀 ,即为终点.
例:0.1000mol/LAgNO3标准溶液滴定0.1000mol/L的NaCl,指示剂K2CrO4浓度为5.0×10 -3 mol/l.
根据溶度积理论:Ksp(AgCl)=[Ag][Cl}=1.8×10 -10;在0.1000mol/l的Cl溶液中,析出AgCl沉淀时,溶液中[Ag]=Ksp/[Cl]=1.8×10 -10)/0.1=1.8×10 -11,此时,溶液中[Ag]2×[CrO4}=(1.8×10 -11)2×(5.0×10 -3)=1.62×10 -241年前查看全部
- 原料水杨酸甲酯,用气相做含量为99%,可是滴定方法,取2ml精密称定,精密加入50ml乙醇制氢氧化钾滴定液,
 东方红太阳红1年前1
东方红太阳红1年前1 -
 owenhu 共回答了19个问题
owenhu 共回答了19个问题 |采纳率94.7%楼主的帖子不完整.是两者结果的比较吗?
滴定方法结果中包含了其他其他酯类,应该比色谱法大
朋友可以到行业内专业的网站进行交流学习!
分析测试百科网这块做得不错,气相、液相、质谱、光谱、药物分析、化学分析、食品分析.这方面的专家比较多,基本上问题都能得到解答,有问题可去那提问,网址百度搜下就有.1年前查看全部
大家在问
- 1阿伏加德罗常数约为6.02×10 23 mol - 1 ,下列叙述正确的是 A.2.24 L CO 2 中含有的原子数为
- 2thereby的用法?thereby不是副词吗?副词和前句连接不是应该用分号或者句号吗?
- 3下列各物质中,不能发生水解反应的是( ) A.葡萄糖 B.纤维素 C.油脂 D.蛋白质
- 4一减十二分之一减五分之一减八分之一减二十分之一减四分之一减七分之一等于多少
- 5找出词语中的错别字,并在括号里改正过来.罪魁祸手( ) 苟廷残喘( )
- 6无论绘画和舞蹈都不好,你应该刻苦努力英语翻译 用neither nor
- 7光在真空中的传播速度为3x10的8次方米/秒,它所表示的物理意义是--------
- 8关于朋友生病了,得知消息后给她写一封英语慰问信,
- 9=...)1.已知sin(a-b)*cosa-cos(a-b)*sina=0.6 则sinb=( ) (我算出来的是0.
- 10英语翻译1.the ruminant periodically returns the cud to its mouth
- 11communicate sb 是不是等于talk with sb.
- 12高一物理(1)小车运动的加速度a=_m/s2(结果保留三位有效数字)(2)分别算出小车通过D点时的速度V=_ 请带详细过
- 13一辆汽车上午10:30从甲城出发,下午7:30到达乙城,共行驶414千米。(1)路上用了多长时间?(2)这辆汽车平均每小
- 14which is more important,working experience or education
- 15从个位起,第______位是千位,万位在第______位上,第八位是______位,______在第九位上.
