在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.55mol/L的naoh溶液混合,温度从2
 nv_bear2022-10-04 11:39:541条回答
nv_bear2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 很浅很浅 共回答了18个问题
很浅很浅 共回答了18个问题 |采纳率88.9%- 可参考:
- 1年前
相关推荐
- 大一无机化学题一道,about 将0.500g苯(C6H6),在盛有2050gH2O的弹式量热计的钢弹内完全燃烧,系统的
大一无机化学题一道,about
将0.500g苯(C6H6),在盛有2050gH2O的弹式量热计的钢弹内完全燃烧,系统的温度由21.30℃上升到23.43℃.反应:C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l)
己知钢弹在近此室温时的总热容为1230J×K-1.试计算1mol 在此室温时完全燃烧的qv值.
本人大一新生,好多东西都不懂的. cc科长1年前1
cc科长1年前1 -
 97759500 共回答了21个问题
97759500 共回答了21个问题 |采纳率90.5%0.5 g苯释放的热量
=钢弹吸收的热量+水吸收的热量
=(23.43-21.30)*(1230)+(23.43-21.30)*4.18*2050
=20871.87 J
1 mol苯是78 g,
所以1 mol苯释放的热量=78/0.5*20871.87=3256011.72 J
气体物质化学计量数改变量∑vi = 6-15/2 = - 1/5
恒容反应热Qv=Qp - ∑vi *R*T = 3256011.72- (-1/5)*8.314*(273+25) =3256507.2344 J/mol
(Qp恒压反应热,Qv恒容反应热,∑vi气体物质化学计量数改变量,R理想气体常数,T温度)
所以Qv ≈ -3256.5 kJ/mol (负号表示放热,不写也行.)1年前查看全部
- 小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也
小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量.爸爸将不同浓度的酸(A)和碱(B)溶液各100mL在量热计中混合,让小明记录了每次混合前后量热计重温度的升高值△t,得到下表. 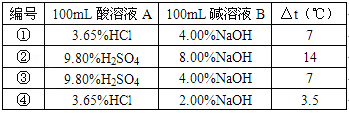
请就此实验回答下列问题:
(1)盐酸、硫酸与氢氧化钠反应是_________反应.(填“吸热”或“放热”)
(2)第1次和第3次实验中温度升高相同的可能原因是:_________
(3)分析上述数据可知下列因素中,与反应放出或吸收热量多少有关的是(_______)
A.使用盐酸还是硫酸B、量热计的保温效果C、参加反应的酸或碱的量.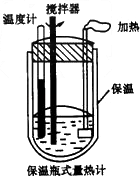
 阿拉斯加的雪狼1年前1
阿拉斯加的雪狼1年前1 -
 郑大张 共回答了20个问题
郑大张 共回答了20个问题 |采纳率90%(1)放热;
(2)两次反应消耗的氢氧化钠质量相等;
(3)C1年前查看全部
- 在量热计(如下图所示)中将l00cm 3 、0. 500mol·L -1 CH 3 COOH溶液与100cm 3 、0.
在量热计(如下图所示)中将l00cm 3 、0. 500mol·L -1 CH 3 COOH溶液与100cm 3 、0. 500mol·L -1 NaOH溶液混合,温度从298.16K升高到300. 71K。已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150. 5J·K -1 ,CH 3 COONa溶液比热容为4.03J·g -1 ·K -1 ,溶液的密度为0. 963g·cm -3 。 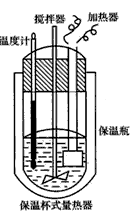
(1)试求CH 3 COOH的中和反应的反应热△H为____kJ·mol -1 。
(2)CH 3 COOH的中和热的文献值为56. 1kJ·mol -1 ,请你分析(1)中测得的实验值偏差的可能原因是____。
(3)已知HCl( aq) +NaOH (aq)=NaCl(aq) +H 2 O(l) △H=- 57. 3kJ.mol -1 ;现有①CH 3 COOH、②浓H 2 SO 4 、
③HNO 3 与NaOH溶液反应的反应热分别为 △H 1 、△H 2 、△H 3 ,则△H 1 、△H 2 、△H 3 三者的大小关系为___。 520025881年前1
520025881年前1 -
 pscat 共回答了22个问题
pscat 共回答了22个问题 |采纳率95.5%(1)47.3
(2)CH 3 COOH的电离为吸热反应,且反应后生成的CH 3 COONa水解也要吸收热量
(3)△H 1 >△H 3 >△H 21年前查看全部
- 在量热计中(如图)将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mo
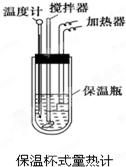 在量热计中(如图)将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
在量热计中(如图)将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
(1)试求CH3COOH的中和热△H表达数值式.
(2)上述数值结果与57.3kJ/mol有偏差,产生原因可能是______
a.实验装置保温、隔热效果差
b.配制0.55mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数. nick691年前1
nick691年前1 -
 ligangainannan 共回答了31个问题
ligangainannan 共回答了31个问题 |采纳率93.5%解题思路:(1)根据化学反应热的计算公式Q=-cm△T来计算;
(2)a.实验装置保温、隔热效果必须好;b.配制0.55mol/L NaOH溶液时视线要和凹液面相平;
c.允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中;d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度;e.量取NaOH溶液的体积时视线要和凹液面相平;(1)CH3COOH的中和热Q=△H=Q=-cm△T=
[150.5J/K+4.184J•(g•K)−1×200g]×(300.7−298)K
0.05mol=-5.33×104 J•mol-1=-53.3 kJ•mol-1,
答:CH3COOH的中和热△H=-53.3 kJ•mol-1;
(2)a.实验装置保温、隔热效果必须好,否则影响实验结果,故a正确;
b.配制0.55mol/L NaOH溶液时俯视刻度线读数,会导致所量的氢氧化钠浓度偏大,影响实验结果,故b正确;
c.允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c错误;
d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,直接测定影响实验结果,故d正确;
e.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,影响实验结果,故e正确;
故答案为:abde;点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生中和热的测定知识,注意稀的强酸和强碱溶液发生中和反应生成1mol水所放出的热量即为中和热.注意测定反应热的误差.1年前查看全部
- 小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也
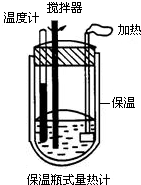 小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量.爸爸将不同浓度的酸(A)和碱(B)溶液各100mL在量热计中混合,让小明记录了每次混合前后量热计重温度的升高值△t,得到下表.
小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量.爸爸将不同浓度的酸(A)和碱(B)溶液各100mL在量热计中混合,让小明记录了每次混合前后量热计重温度的升高值△t,得到下表.
请就此实验回答下列问题:编号 100mL酸溶液A 100mL碱溶液B △t(℃) ① 3.65%HCl 4.00%NaOH 7 ② 9.80%H2SO4 8.00%NaOH 14 ③ 9.80%H2SO4 4.00%NaOH 7 ④ 3.65%HCl 2.00%NaOH 3.5
(1)盐酸、硫酸与氢氧化钠反应是______反应.(填“吸热”或“放热”)
(2)第1次和第3次实验中温度升高相同的可能原因是:______.
(3)分析上述数据可知下列因素中,与反应放出或吸收热量多少有关的是(______)
A.使用盐酸还是硫酸B、量热计的保温效果C、参加反应的酸或碱的量. qjtuutuu1年前1
qjtuutuu1年前1 -
 chenii16 共回答了22个问题
chenii16 共回答了22个问题 |采纳率90.9%(1)比较四次实验结果,可以发现温度都在升高,所以可得出反应放出热的结论;
故答案为:放热;
(2)比较第1次和第3次实验,可以发现所使用氢氧化钠溶液是一样的,而酸和酸的量不同,但最终温度变化却一样,因此,可推断是由于等质量的氢氧化钠完全反应的结果;
故答案为:两次反应消耗的氢氧化钠质量相等;
(3)对比第1次和第3次实验,可以得到放出热量的多少与使什么酸没有关系;对比第2次和第3次实验或第1次与第4次实验,可以发现,放出热量的多少与所使用溶液的量有密切关系;
故选C.1年前查看全部
- 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-
 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
(1)CH3COOH的中和热△H=______.
(2)在做中和反应的反应热的测定实验时,下列操作错误的是______
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应进行更完全,可以是酸(碱)适当过量
E.若用KOH代替NaOH,对测定结果有影响.
(3)你认为CH3COOH的中和热与HCl的中和热数值相比,______较大,其原因______. lovejun1年前1
lovejun1年前1 -
 gonghuan0625 共回答了21个问题
gonghuan0625 共回答了21个问题 |采纳率95.2%解题思路:(1)先根据溶液反应放出的热量Q=-cm△T+150.5J•0C-1×△T,再根据中和热△H=-
计算即可;Q n(H2O)
(2)A.反应前酸、碱溶液的温度要相同;
B.为观察溶液温度的变化,温度计要一直插在溶液中;
C.向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小;
D.为了使反应进行更完全,酸或碱要过量;
E.KOH代替NaOH都是强碱,符合中和热的概念;
(3)醋酸是弱酸,电离过程需要吸收能量.(1)温度差△t=300.7K-298.0K=2.7K,Q=cm△t=2.7K×4.184J•(g•K)-1×200g+150.5J•K-1×2.7K=2665.71J=2.67kJ,△H=[-Q
n(H2O)=-
2.67kJ/0.05mol]=-53.3 kJ/mol;
故答案为:-53.3 kJ/mol;
(2)A.为减少误差,反应前酸、碱溶液的温度要相同,故A不选;
B.为观察溶液温度的变化,测量溶液的温度计要一直插在溶液中,故B不选;
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小,故C选;
D.为了使反应进行更完全,可以是酸(碱)适当过量,故D不选;
E.用KOH代替NaOH,KOH也是强碱,符合中和热的概念,对测定结果无影响,故E选;
故答案为:CE;
(3)CH3COOH是弱酸,电离过程需要吸收能量,所以CH3COOH的中和热与HCl的中和热数值相比,HCl较大;
故答案为:HCl;CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热,中和时放热较少.点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.1年前查看全部
- 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1
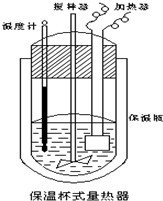 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
(1)试求CH3COOH的中和热△H=______.
(2)CH3COOH的中和热的文献值为56.1KJ•mol-1,则请你分析在(1)中测得的实验值偏差可能的原因______.
(3)实验中NaOH过量的目的是______. _若谷1年前1
_若谷1年前1 -
 御风飘舞 共回答了20个问题
御风飘舞 共回答了20个问题 |采纳率100%解题思路:(1)根据化学反应热的计算公式Q=-cm△T来计算;
(2)根据中和热的测定中能够导致放出的热量偏低的因素进行解答;
(3)为了确保CH3COOH溶液完全被中和,从而提高实验的准确度,所用NaOH稍过量.(1)温度从25.0℃升高到27.7℃,△T=(298+27.7)K-(298+25)K=(27.7-25)K,CH3COOH的中和热Q=△H=Q=-cm△T=
[150.5J/K+4.184J•(g•K)−1×200g]×(27.7−25)K
0.05mol=-5.33×104 J•mol-1=-53.3 kJ•mol-1,
故答案为:△H=-53.3 kJ•mol-1;
(2)CH3COOH的中和热的文献值为-56.1kJ/mol,实际上测定数值偏低,可能原因有:①量热计的保温瓶效果不好,②酸碱溶液混合不迅速,③温度计不够精确等,
故答案为:①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等;
(3)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度,
故答案为:使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度;点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,注意掌握测定中和热的原理、操作方法,以及热量计算公式的应用,题目难度不大.1年前查看全部
- 奥化热力学基础题11、通常中和热、溶解热等测定是在一种恒压绝热的量热计(又叫杜瓦瓶)中进行.已知:△f H = -286
奥化热力学基础题
11、通常中和热、溶解热等测定是在一种恒压绝热的量热计(又叫杜瓦瓶)中进行.已知:△f H = -286 kJ•mol-1,△f H = -230 kJ•mol-1.欲测弱酸与强碱反应的中和热,进行下列实验:
第一步,量照计热容量的测定.先在杜瓦瓶中装入350 mL 0.2 mol•L-1 HCl溶液,在另一带活塞的小储液管中装入35mL 0.2 mol•L-1 NaOH溶液,并将储液管放入杜瓦瓶酸液中,测定反应前温度为23.20℃,然后快速拔去活塞,使碱液与酸混合并搅拌,测得反应后最高温度为28.33℃.
第二步,以350 mL 0.2 mol•L-1 HAc标准溶液代替盐酸,重复上述操作,测得反应前后温度分别为23.33℃和27.64℃.
(1)求HAc与NaOH的中和热(kJ•mol-1);
(2)求HAc的电离热(kJ•mol-1).
(1)△H = -47.05 kJ•mol-1 (2)△H = 8.95 kJ•mol-1 apple罐头1年前2
apple罐头1年前2 -
 龙0翔 共回答了20个问题
龙0翔 共回答了20个问题 |采纳率90%ΔfH(H2O)=-286KJ·mol-1,ΔfH(OH-)=-230KJ·mol-1,根据这两个数可以算出中和热,即中和反应
H+ + OH- = H2O 的摩尔反应热为ΔrH=(-286)-(-230)=-56KJ·mol-1
第一步反应中,共有0.035×0.2=0.007mol 的H+和OH-发生中和,总反应热=(-56)×0.007=-0.392kJ,温度升高28.33-23.20=5.13℃,这样整个装置比热容=0.392÷5.13=0.0764kJ·K-1
第二步反应中,温度升高27.64-23.33=4.31℃,因此反应共放热=-(0.0764×4.31)=-0.329kJ
同样参与反应的OH-离子物质的量为0.007mol,则摩尔反应热=(-0.329)÷0.007=-47.05kJ·mol-1
这就是HAc与NaOH的中和热,即 HAc + OH- = Ac- + H2O 的摩尔反应热
HAc的电离反应为 HAc = H+ + Ac-
这个反应可看成两个反应相减的结果:
HAc + OH- = Ac- + H2O
H+ + OH- = H2O
第一个反应的反应热是HAc与NaOH的中和热,-47.05kJ·mol-1,第二个是强酸强碱中和热,-56kJ·mol-1
因此HAc的电离热是上面两个值相减=(-47.05)-(-56)=8.95kJ·mol-11年前查看全部
- 化学热力学基础的相关问题1.在一弹式量热计中完全燃烧0.3mol H2(g)生成H2O(l),量热计中水温升高5.212
化学热力学基础的相关问题
1.在一弹式量热计中完全燃烧0.3mol H2(g)生成H2O(l),量热计中水温升高5.212K.将2.345g正葵烷,C10H22(l)完全燃烧,使量热计中的水温升高6.862K.已知H2O(l)的标准摩尔生成热为-285.8kJ/mol,求正葵烷的燃烧热.(-6762.3kJ/mol)
nwnym你好高端。没错就是那本绿书,具体是怎么进行换算呢?我做出的总是跟答案差一点 弧周KJ1年前2
弧周KJ1年前2 -
 Emily-wong 共回答了14个问题
Emily-wong 共回答了14个问题 |采纳率85.7%吉大/武大等编的无机化学教材配的习题?题目本身缺了一个条件(当前环境温度),给的参考答案是不准确的.
楼上的回答是错的.
请注意,-285.8kJ/mol是H2O(l)的标准摩尔生成热,是恒压反应热,而在弹式量热计中测量的是恒容反应热,二者必须进行一个换算.同样,欲求的正葵烷的燃烧热同样是恒压反应热,最后也必须进行换算.
换算就是恒压恒容反应热的转换而已.这里要假定环境温度,一般设为298K.给的参考答案就是不准的,不用介意,我怀疑是它的相对分子质量没取准.这本书的参考答案还是有几个是有问题的.1年前查看全部
- 中和热的计算在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.5mol/L的naoh溶液混合
中和热的计算
在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.5mol/L的naoh溶液混合,温度从298.16k升高到300.17k.已知量热计的热容常数为150.5J/K,
0.25mol/ch3coona溶液比热容为4.03J/g·K,溶液的密度为0.963g/ml
求ch3cooh的中和热 飘逸骑士1年前1
飘逸骑士1年前1 -
 泡沫之秋 共回答了19个问题
泡沫之秋 共回答了19个问题 |采纳率84.2%在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.5mol/L的naoh溶液混合----得到0.25mol/L的CH3COONa溶液200mL
温度从298.16k升高到300.17k.已知量热计的热容常数为150.5J/K,
0.25mol/ch3coona溶液比热容为4.03J/g·K,溶液的密度为0.963g/ml
温度变化t=300.17-298.16=2.01K
反应放出的热量Q=cmt=150.5*2.01+200*0.963*4.03*2.01
以上是0.05mol的CH3COOH中和放出的热量
ch3cooh的中和热=Q/0.05=37.08kJ/mol1年前查看全部
- 关于氧弹量热计的几个问题装置里面装什么来吸收空气中的氮气?通电铁丝会发热,如何减去这部分热量?还有要实现绝热,最外面用的
关于氧弹量热计的几个问题
装置里面装什么来吸收空气中的氮气?通电铁丝会发热,如何减去这部分热量?还有要实现绝热,最外面用的材料是什么?我需要***,请别说“外面是隔温一类的材料”这一类没用的话. missQueen1年前1
missQueen1年前1 -
 luo41926565 共回答了20个问题
luo41926565 共回答了20个问题 |采纳率95%根本不用吸氮气,因为氧弹里边灌注的是纯氧,电热丝是有瓦数的,通了几秒电自然减去多少焦,隔热层是镀铝全反射真空胆,只有全反射真空环境才能近似完全隔热.1年前查看全部
- 在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.55mol/L的naoh溶液混合,温度从2
在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.55mol/L的naoh溶液混合,温度从298k升高到300.7k.已知量热计的几个部件每升高1K需要的热量为50.5J/K,溶液密度均为1g/mL,生成溶液比热容为c=4.184J/(g·K)求ch3cooh
的中和热 wangqing1111年前2
wangqing1111年前2 -
 abigfox 共回答了18个问题
abigfox 共回答了18个问题 |采纳率94.4%总共放出的热量:
50.5J/K*(300.7k-298K)+(300.7k-298K)*200g*4.184J/(g·K)=2395.71J
实际消耗了CH3COOH的物质的量为0.05mol,所以
CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H2O(l) ⊿H=-47.912KJ/mol
答:ch3cooh的中和热为 ⊿H=-47.912KJ/mol1年前查看全部
- 一道大学化学热力学题目求助1. 在一知弹式量热计中燃烧0.20molH2(g)生成H2O(l),使量热计温度升高0.88
一道大学化学热力学题目求助
1. 在一知弹式量热计中燃烧0.20molH2(g)生成H2O(l),使量热计温度升高0.88K,当0.010mol甲苯在此量热计中燃烧时,量热计温度升高0.615K,甲苯的燃烧反应为
C7H8(l) + 9 O2(g) → 7 CO2(g) + 4H2O(l)
求该反应的△rH。已知△H( H2O,l ) == —285.8 kJ·mol^(-1)
标准答案中有
△rV= △rH—△RT= —285.8+1.5×RT= —282.1kJ/mol
请问答案中的T是怎么求的还是已知的???谢谢
 暗夜迷城1年前1
暗夜迷城1年前1 -
 wolf666666 共回答了21个问题
wolf666666 共回答了21个问题 |采纳率57.1%Δ应该是加在T上的,所以ΔT=0.615K-0.88K1年前查看全部
- 大一化学计算题298K时6.5g液体苯在弹式量热计中完全燃烧,放热272.3kj,求该反应的标准摩尔自由能变和标准摩尔焓
大一化学计算题
298K时6.5g液体苯在弹式量热计中完全燃烧,放热272.3kj,求该反应的标准摩尔自由能变和标准摩尔焓变. plmmsw1231年前3
plmmsw1231年前3 -
 不wwDI蜗牛 共回答了15个问题
不wwDI蜗牛 共回答了15个问题 |采纳率100%焓变你就照272.3除苯的摩尔数计算
然后查表计算苯燃烧这个方程式的熵变
最后根据自由能方程式计算就可以得出自由能的变化1年前查看全部
- 某化学兴趣小组的同学利用如图所示的量热计完成中和热的测定实验。 实验用品:浓硫酸、0.55 mol·L -1 的NaOH
某化学兴趣小组的同学利用如图所示的量热计完成中和热的测定实验。 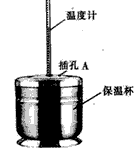
实验用品:浓硫酸、0.55 mol·L -1 的NaOH溶液、蒸馏水、自制量热计(如图)、烧杯、滴管、玻璃棒、量筒等。
实验步骤:
①配制0.25 mol·L -1 的硫酸溶液250 mL;
②分别量取0.25 mol·L -1 的硫酸、0.55 mol·L -1 的NaOH溶液各50 mL,并测量其起始温度;
③将二者于自制量热计中小心混合,测出反应过程中的温度变化,并做好记录;
④重复步骤②、③两次;
⑤处理数据得到如图所示曲线。
(1)量热计的插孔A中应插入的一种玻璃仪器是____。
(2)步骤①中除用到实验用品所列部分仪器外,还要用到的玻璃仪器是__________。
(3)计算中和热△H时,所使用的温度数据△t=__________。
(4)若实验中用60 mL 0.25 mol·L -1 硫酸溶液和50 mL 0.55 mol·L -1 NaOH溶液进行实验,与上述实验相比,则所测得的中和热____(填“相等”或“不相等”);若用50 mL 0.50 mol·L -1 醋酸溶液代替硫酸溶液进行上述实验,则测得反应前后溶液温度的变化值会_________ (填“偏大”、“偏小”或“无影响”)。 纳兰八十四若1年前1
纳兰八十四若1年前1 -
 meimeideng 共回答了22个问题
meimeideng 共回答了22个问题 |采纳率81.8%(1)环形玻璃搅拌棒
(2)250mL容量瓶
(3)3.4℃
(4)相等;偏小1年前查看全部
- 一、50ml 0.5mol/L盐酸与50ml 0.55mol/L NaOH溶液在量热计装置中进行中和反应.通过测定反应过
一、50ml 0.5mol/L盐酸与50ml 0.55mol/L NaOH溶液在量热计装置中进行中和反应.通过测定反应过程中所放出的热量可以计算中和热.问:用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______(填“偏大”、“偏小”、“无影响”)《氨水电离用的量不应该少么?中和热不该偏大么?》
二、C(金刚石,s)+O2(g)=CO2(g) H1=-395.41kJ/mol
C(石墨,s)+O2(g)=CO2(g) H2=-393.51kJ/mol
若取金刚石和石墨混合晶体共1mol在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为______(用含Q的代数式表示)《Q不应该是负值么?答案是Q-393.51/395.41-Q不就是个负数了么?》 麻雀殿下1年前3
麻雀殿下1年前3 -
 云之冰 共回答了14个问题
云之冰 共回答了14个问题 |采纳率100%1、偏小,因为氨水是弱碱,弱碱电离吸热,电离的氢氧根参与中和反应放出的热量虽然不变,但由于开始时吸收了热量,所以总的热量值测定出来会偏小.
2、答案正确,设金刚石xmol,石墨ymol,列方程组求教既得.
x+y=1
-395.41x+(-393.51y)=Q
解出x/y既得.
Q之所以是负值是因为化学上,放热反应的热量用负值来表示,你看你写的两个反应,都是放热反应,那不是后面跟的都是负值吗1年前查看全部
- 在量热计中(如图)将100 mL 0.50 mol·L -1 的CH 3 COOH溶液与100 mL 0.55 mol·
在量热计中(如图)将100 mL 0.50 mol·L -1 的CH 3 COOH溶液与100 mL 0.55 mol·L -1 的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K -1 ,溶液密度均为1 g·mL -1 ,生成溶液的比热容c=4.184 J·(g·K) -1 。 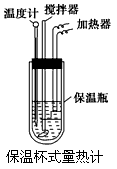
(1)试求CH 3 COOH的中和热ΔH。_____________________
(2)CH 3 COOH的中和热的文献值为56.1 kJ·mol -1 ,你认为(1)中测得的实验值有偏差可能的原因是____________________________________。
(3)实验中NaOH过量的目的是___________________________________________。
(4)你认为CH 3 COOH的中和热与HCl的中和热数值相比,________较大,其原因是_______________。 hippozheng1年前1
hippozheng1年前1 -
 samhbfjk 共回答了17个问题
samhbfjk 共回答了17个问题 |采纳率88.2%(1)ΔH=-53.3 kJ·mol -1
(2)①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等
(3)过量的碱能保证CH 3 COOH完全被中和,从而提高实验准确度
(4)HCl;CH 3 COOH是弱酸,只是少部分电离,CH 3 COOH发生电离时要吸热,中和时放热较少1年前查看全部
- 一道化学热力学题0.528g甲醇和过量的O2在成有1105g水的弹式量热计中完全燃烧,系统的温度由25.00℃升到27.
一道化学热力学题
0.528g甲醇和过量的O2在成有1105g水的弹式量热计中完全燃烧,系统的温度由25.00℃升到27.27℃.已知水的比热容Cw=4.18J/K,弹式量热计的热容C=638J/K.求1molCH3OH完全燃烧的Qv和Qp. 心灵的创伤20081年前1
心灵的创伤20081年前1 -
 傻子十 共回答了21个问题
傻子十 共回答了21个问题 |采纳率95.2%这个氧弹反应是恒容下进行的.
[Q-v] = (27.27-25)*638 + 1105*(27.27-25)*4.18 J
= 1448.26 + 10484.903
= 11933.163 J
甲醇0.528g / 32 gmol-1 = 0.0165 mol
Qv = 11933.163 / 0.0165 = 723222 J/mol = 723.222 kJ/mol
CH3OH (l) + 3/2 O2(g) = CO2 (g) + 2H2O (l)
1摩尔甲醇反应,气体变化量为 -0.5 mol.
298K时甲醇,水都为液态.
Qp= Qv - deta(n)* RT
= 723.222 + 0.5*8.31*298/1000 = 724.46 kJ/mol1年前查看全部
- 下列说法中正确的是( )A.凡是放热反应都是自发的,吸热反应都是非自发的B.量热计可用于测定酸碱中和反应的反应热;
下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.量热计可用于测定酸碱中和反应的反应热; pH计不能用于酸碱中和滴定终点的判断
C.化学腐蚀、电化学腐蚀本质上均因金属失去电子发生氧化反应而被腐蚀
D.使用催化剂可降低反应的△H和反应的活化能,从而提高化学反应速率 上辈子欠你的9951年前1
上辈子欠你的9951年前1 -
 冲盈剑法 共回答了16个问题
冲盈剑法 共回答了16个问题 |采纳率75%解题思路:A.反应是否自发进行,是根据焓变、熵变和温度判断依据进行分析,若△H-T△S<0,反应自发进行;若△H-T△S>0,则反应非自发进行;
B.测量溶液pH可以用pH试纸、pH计、酸碱指示剂;
C.金属腐蚀是金属失去电子被氧化;
D.催化剂加快反应速率,不影响平衡移动.A.判断自发反应是否能进行应综合考虑焓变与熵变,选项中只考虑了△H,故A错误;
B.pH计能用于酸碱中和滴定终点的判断,故B错误;
C.化学腐蚀、电化学腐蚀本质相同,金属腐蚀是金属失去电子被氧化,故C正确;
D.加入催化剂降低反应的活化能,改变酚酞途径,加快反应速率,但不影响平衡移动,△H不变,故D错误.
故选C.点评:
本题考点: 吸热反应和放热反应;催化剂的作用;金属腐蚀的化学原理;中和热的测定.
考点点评: 本题考查吸热反应和放热反应、pH计使用、金属腐蚀、催化剂等,难度不大,注意加入催化剂降低反应的活化能,改变反应途径,加快反应速率,但不影响平衡移动,△H不变.1年前查看全部
- 小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也
 小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量.爸爸将不同浓度的酸(A)和碱(B)溶液各100mL在量热计中混合,让小明记录了每次混合前后量热计重温度的升高值△t,得到下表.
小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量.爸爸将不同浓度的酸(A)和碱(B)溶液各100mL在量热计中混合,让小明记录了每次混合前后量热计重温度的升高值△t,得到下表.
请就此实验回答下列问题:编号 100mL酸溶液A 100mL碱溶液B △t(℃) ① 3.65%HCl 4.00%NaOH 7 ② 9.80%H2SO4 8.00%NaOH 14 ③ 9.80%H2SO4 4.00%NaOH 7 ④ 3.65%HCl 2.00%NaOH 3.5
(1)盐酸、硫酸与氢氧化钠反应是放热放热反应.(填“吸热”或“放热”)
(2)第1次和第3次实验中温度升高相同的可能原因是:两次反应消耗的氢氧化钠质量相等两次反应消耗的氢氧化钠质量相等.
(3)分析上述数据可知下列因素中,与反应放出或吸收热量多少有关的是(CC)
A.使用盐酸还是硫酸B、量热计的保温效果C、参加反应的酸或碱的量. PHOENIX-591年前1
PHOENIX-591年前1 -
 jibarude 共回答了21个问题
jibarude 共回答了21个问题 |采纳率71.4%解题思路:(1)根据实验数据,分析反应过程中热量的变化;
(2)比较两次实验中的相同之处与不同之处,分析造成温度变化相同的原因;
(3)对比温度变化与所使用溶液的关系,归纳出反应中影响温度变化的因素.(1)比较四次实验结果,可以发现温度都在升高,所以可得出反应放出热的结论;
故答案为:放热;
(2)比较第1次和第3次实验,可以发现所使用氢氧化钠溶液是一样的,而酸和酸的量不同,但最终温度变化却一样,因此,可推断是由于等质量的氢氧化钠完全反应的结果;
故答案为:两次反应消耗的氢氧化钠质量相等;
(3)对比第1次和第3次实验,可以得到放出热量的多少与使什么酸没有关系;对比第2次和第3次实验或第1次与第4次实验,可以发现,放出热量的多少与所使用溶液的量有密切关系;
故选C.点评:
本题考点: 中和反应及其应用;实验数据处理或者误差分析的探究;物质发生化学变化时的能量变化.
考点点评: 通过实验数据的对比分析,可得出酸和碱反应反出热量,并且所放出的热量多少与反应消耗物质的质量有关.1年前查看全部
- 关于有机物燃烧测定实验做有机物燃烧测定实验,测定萘和苯甲酸,书后有一道思考题是“为什么量热计中内筒的水温应调节得低于外筒
关于有机物燃烧测定实验
做有机物燃烧测定实验,测定萘和苯甲酸,书后有一道思考题是“为什么量热计中内筒的水温应调节得低于外筒的水温?”
一定要说清楚为什么,不要光告诉我低多少合适,尽快就是了,蛮急的,
我们用的是外推法求△T的 啥叫雷诺图解法呀 囧……孤陋寡闻了 轻袖1年前1
轻袖1年前1 -
 活着的意义 共回答了29个问题
活着的意义 共回答了29个问题 |采纳率89.7%基本原理一样啦,只是方法不同.主要就是为了能准确扣除氧弹外界带来的能量了.因为该体系并非严格的绝热体系,体系中会有搅拌等其他能量进入.因此就要用雷诺图解法进行扣除,当降低一点温度测定时,可以使扣除的温度较为符合实际情况.1年前查看全部
- HCl和Zn反映Zn+2HCl—H2+ZnCl2 0.103gZn和足量HCl混合50ml溶液在密封量热计中(q=-m(
HCl和Zn反映
Zn+2HCl—H2+ZnCl2
0.103gZn和足量HCl混合50ml溶液在密封量热计中(q=-m(H2O)*4.18J/g°C*△t),△t=1.2°C,假设溶液的密度是1g/ml,比热容是4.18J/g°C
问
1.反映产生的q是多少?
2.反映的焓变△H是什么 怒红1年前1
怒红1年前1 -
 垃圾游子 共回答了21个问题
垃圾游子 共回答了21个问题 |采纳率90.5%m(H2O)=密度*体积=1g/ml*50ml=50g
反应产生的热量Q=m(H2O)*4.18J/g°C*△t=50*4.18J/g°C*1.2°C=247.2J
书写热化学反应方程式Zn(s)+2HCl(l)=H2(g)+ZnCl2(aq),△H=?
焓变△H是每mol Zn反应放出的热量,因此0.103gZn是0.0016mol,放出247.2J热量,1molZn则放出154.5kJ
△H=-154.5kJ(注意符号,此为放热反应)1年前查看全部
- 下列有关实验说法正确的是 A.在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反
下列有关实验说法正确的是
A.在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、取2—3 次的实验平均值等措施,以达到良好的实验效果 B.纸上层析属于色谱分析法,其原理跟“毛细现象”相关,通常以滤纸作为惰性支持物,滤纸纤维吸附的水作为固定相 C.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热,用稀硫酸进行酸化后再加入硝酸银溶液 D.酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程  网络一兵1年前1
网络一兵1年前1 -
 hnjun2005 共回答了18个问题
hnjun2005 共回答了18个问题 |采纳率83.3%B
1年前查看全部
- 1.792L(标准状况下)的CO,CH4和O2的混合物,在量热计中燃烧时,放出13.683KJ热量,
1.792L(标准状况下)的CO,CH4和O2的混合物,在量热计中燃烧时,放出13.683KJ热量,
若向燃烧产物中再加一定量的H2使其燃烧完全,又放出9.672KJ热量,求原混合物中各气体的体积.已知:CO(g)+1/2O2(g)=CO2(g)△H=-283KJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3KJ/molH2(g)+1/2O2(g)=H2O(g)△H=-241.8KJ/mol 请有才之人写出具体的步骤,我要最具体的步骤, zhouzhou19861年前1
zhouzhou19861年前1 -
 liu980116 共回答了20个问题
liu980116 共回答了20个问题 |采纳率90%当再加入H2时,放出的热量增加,所以原混合物中含过量O2的物质的量为:n(O2)=9.672kJ/(2×241.8kJ·mol-1)=0.0200mol再求出气体的总物质的量为:1.792L/22.4L·mol-1=0.0800mol13.683kJ热量是燃烧(0.0800mol-0....1年前查看全部
- 普通化学一、单项选择题(每小题2分,共20分)1、反应或过程的哪个物理量可以通过弹式量热计直接测定而获得? ( )A、△
普通化学
一、单项选择题(每小题2分,共20分)
1、反应或过程的哪个物理量可以通过弹式量热计直接测定而获得? ( )
A、△H B、p△V C、 qp D、 qv
2、对于状态函数的描述,下列说法中正确的是 ( )
A、状态函数和途径函数一样,其变化值取决于具体的变化过程;
B、只要系统处于平衡态,某一状态函数的值就已经确定;
C、任意状态函数的值都可以通过实验测定得到;
D、△H和△U都是状态函数
3、在298.15K、100kPa下,反应N2(g)+2O2(g)=2NO2(g)的为66.36kJ(mol-1,则NO2(g)的标准摩尔生成焓为 ( )
A、-66.36kJ(mol-1 B、-33.18kJ(mol-1 C、33.18kJ(mol-1 D、66.36kJ(mol-1
4、在温度为T的标准状态下,若已知A→2B的标准摩尔生成焓,与反应2A→C
的标准摩尔生成焓,则反应C→4B的标准摩尔生成焓为 ( )
A、2+ B、-2
C、2- D、+
5、同一温度下,反应的标准平衡常数和反应的标准平衡常数 的关系是 ( )
A、= B、= C、= D、无法确定
6、下列几种溶液性质中不属于依数性的是 ( )
A、凝固点下降 B、沸点升高
C、渗透压 D、密度
7、室温下,0.20 mol/dm3 HCOOH溶液电离度为3.2%,HCOOH的电离常数为 ( )
A、2.0×10-4 B、1.3×10-3 C、6.4×10-3 D、6.4×10-4
8、对于电极反应O2 + 2H2O + 4e = 4OH- 来说,当O2的分压为标准压力时,酸度对电极电势影响的关系是为 ( )
A、φ = φө − 0.0592 pOH B、φ = φө + 0.0592 pOH
C、φ = φө + 0.0148 pOH D、φ = φө − 0.0148 pOH
9、对于下列两个反应式,说法完全正确的是 ( )
2Fe3++2Br-=2Fe2++Br2 Fe3++Br-=Fe2++1/2Br2
A、E( 、△G( 、K( 都相等 B、E( 、△G( 相等,K( 不等
C、E( 相等,△G( 、K( 不等 D、△G( 相等,E(、K( 不相等
10、在标准条件下,下列反应均能向正反应方向进行:
其中氧化性最强和还原性最强的分别是 ( )
A、和 B、和
C、和 D、和
二、判断题(每小题1分,共10分)
( )1、功和热都是状态函数,其变化值和具体途径无关,只和始末状态有关。
( )2、某一给定反应达到平衡后,若平衡条件不变,分离出生成物,待达到新的平衡时,各反应物和生成物的分压或浓度保持不变。
( )3、室温下,稳定状态的单质的标准摩尔生成焓为零。
( )4、两种分子酸HA溶液和HB溶液的pH值相等,则这两种酸的浓度也相同。
( )5、对HAc-NaAc缓冲溶液,加入少量的酸或碱时,其pH值能基本保持不变。
( )6、存在非极性键的分子一定是非极性分子。
( )7、电动势E的数值与电极反应的写法无关,而平衡常数的数值与反应式的书写有关。
( )8、298.15K时,H2(g)的标准摩尔燃烧焓与H2O(l)的标准摩尔生成焓数值上相等。
( )9、氢氧燃料电池属于化学电源中的二次电池。
( )10、浓度均为0.1mol/L的NaCl溶液和C12H12O6溶液具有相同的渗透压。
三、填空题(每空2分,共20分)
1、对于反应的标准平衡常数的表达式为
2、一只充满氢气的气球,飞到一定的高度就会爆炸,这主要由 和 两个因素共同决定的。
3、对于恒温恒压条件下的封闭系统,自发过程一定是ΔG 0的过程,设计成原电池发生自发氧化还原反应时E 0。(填>、<、=号)
4、电解Na2SO4溶液时,若两极都是惰性电极,则阳极上发生的反应是
阴极上反应是
5、理想气体的状态方程式是 cyalun1年前1
cyalun1年前1 -
 cyalun 共回答了822个问题
cyalun 共回答了822个问题 |采纳率16.1%你的回答完美的解决了我的问题,谢谢!1年前查看全部
- 大学基础化学2.5克葡萄糖式样在弹式量热计中燃烧,量热计温度从20.55升到23.25,如果
大学基础化学2.5克葡萄糖式样在弹式量热计中燃烧,量热计温度从20.55升到23.25,如果
葡萄糖燃烧热是15.57kj/mol
如果量热计中装有2.7千克水,该量热计的热容是多少? 无所谓n1年前1
无所谓n1年前1 -
 用情太专 共回答了13个问题
用情太专 共回答了13个问题 |采纳率84.6%2.5g葡萄糖 = 2.5/180 = 1/72 mol
葡萄糖的燃烧热是15.57kj/mol,那么1/72mol葡萄糖产生的热量 = 15.57*10^3*(1/72) = 216.25J
则热容C= Q/T = 216.25/(23.25-20.55) = 80.09J/K1年前查看全部
- 元素分析仪,红外光谱仪,原子吸收光谱仪,核磁共振仪,质谱仪,紫外可见光分光光度计,量热计,分光光度计,气相色谱仪ls不要
元素分析仪,
红外光谱仪,
原子吸收光谱仪,
核磁共振仪,
质谱仪,
紫外可见光分光光度计,
量热计,
分光光度计,
气相色谱仪
ls不要答非所问~ 我都要疯了1年前5
我都要疯了1年前5 -
 flycase 共回答了10个问题
flycase 共回答了10个问题 |采纳率100%1.分析元素
2.分析官能团
3.原子种类
4.原子种类一般指氢
5.质谱仪是分析同位素
6.元素种类
7、8、9都是元素种类1年前查看全部
- 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1
 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
(1)试求CH3COOH的中和热△H=-53.3kJ/mol-53.3kJ/mol.
(2)CH3COOH的中和热的文献值为56.1KJ•mol-1,则请你分析在(1)中测得的实验值偏差可能的原因①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等.
(3)实验中NaOH过量的目的是使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度. shoujiqq1年前1
shoujiqq1年前1 -
 vitaoss 共回答了19个问题
vitaoss 共回答了19个问题 |采纳率73.7%(1)温度从25.0℃升高到27.7℃,△T=(298+27.7)K-(298+25)K=(27.7-25)K,CH3COOH的中和热Q=△H=Q=-cm△T=
[150.5J/K+4.184J•(g•K)−1×200g]×(27.7−25)K
0.05mol=-5.33×104 J•mol-1=-53.3 kJ•mol-1,
故答案为:△H=-53.3 kJ•mol-1;
(2)CH3COOH的中和热的文献值为-56.1kJ/mol,实际上测定数值偏低,可能原因有:①量热计的保温瓶效果不好,②酸碱溶液混合不迅速,③温度计不够精确等,
故答案为:①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等;
(3)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度,
故答案为:使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度;1年前查看全部
- 在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.55mol/L的naoh溶液混合,温度从2
在量热计中将100ml 0.5mol/L的ch3cooh溶液和100ml 0.55mol/L的naoh溶液混合,温度从298k升高到300.7k.已知量热计的热容常数为150.5J/K,溶液密度均为1g/mL,生成溶液比热容为c=4.184J/(g·K)求ch3cooh
的中和热
答案是-53.3 kk非树境由心起1年前3
kk非树境由心起1年前3 -
 shen2010 共回答了19个问题
shen2010 共回答了19个问题 |采纳率89.5%((300.7k-298k)*(150.5J/K+200g*4.184J/(g·K)))/0.05=53.3
因为放热所以为负1年前查看全部
- 在量热计中将100ml的0.5mol/L的CH3COOH溶液与100毫升的0.5mol/L的氢氧化钠溶液混合,温度从29
在量热计中将100ml的0.5mol/L的CH3COOH溶液与100毫升的0.5mol/L的氢氧化钠溶液混合,温度从298.16K升高到300.17K已知量热计的热容常数为150.5J/K
求醋酸的中和热. ihdlee1年前3
ihdlee1年前3 -
 爱在刀烽之颠 共回答了19个问题
爱在刀烽之颠 共回答了19个问题 |采纳率84.2%是这样算吗?
△T=300.17K-298.16K=2.01K
J=150.5J/K*2.01K=302.505J
n(CH3COOH)=0.5mol/L*0.1L=0.05mol.
CH3COOH中和热=302.505J/0.05mol=6050.1J/mol1年前查看全部
- 化学反应的热效应50mL0.50 mol·L-1盐酸和50mL 0.55 mol·L-1烧碱溶液在如图所示的量热计简易装
化学反应的热效应
50mL0.50 mol·L-1盐酸和50mL 0.55 mol·L-1烧碱溶液在如图所示的量热计简易装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热(3)大烧杯若不盖硬纸板,求得的中和热数值将_____(填“偏大”、“偏小”或“无影响”). 玉米脆1年前2
玉米脆1年前2 -
 冰山雪莲8 共回答了23个问题
冰山雪莲8 共回答了23个问题 |采纳率78.3%偏小1年前查看全部
- 小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也
小明在爸爸的实验室里看见到如图所示的“保温瓶式量热计”.这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量.爸爸将不同浓度的酸(A)和碱(B)溶液各100mL在量热计中混合,让小明记录了每次混合前后量热计重温度的升高值△t,得到下表.
请就此实验回答下列问题:编号 100mL酸溶液A 100mL碱溶液B △t(℃) ① 3.65%HCl 4.00%NaOH 7 ② 9.80%H 2 SO 4 8.00%NaOH 14 ③ 9.80%H 2 SO 4 4.00%NaOH 7 ④ 3.65%HCl 2.00%NaOH 3.5
(1)盐酸、硫酸与氢氧化钠反应是______反应.(填“吸热”或“放热”)
(2)第1次和第3次实验中温度升高相同的可能原因是:______.
(3)分析上述数据可知下列因素中,与反应放出或吸收热量多少有关的是(______)
A.使用盐酸还是硫酸B、量热计的保温效果C、参加反应的酸或碱的量.
 海豚轻吻1年前1
海豚轻吻1年前1 -
 MDAJGAM 共回答了15个问题
MDAJGAM 共回答了15个问题 |采纳率86.7%(1)比较四次实验结果,可以发现温度都在升高,所以可得出反应放出热的结论;
故答案为:放热;
(2)比较第1次和第3次实验,可以发现所使用氢氧化钠溶液是一样的,而酸和酸的量不同,但最终温度变化却一样,因此,可推断是由于等质量的氢氧化钠完全反应的结果;
故答案为:两次反应消耗的氢氧化钠质量相等;
(3)对比第1次和第3次实验,可以得到放出热量的多少与使什么酸没有关系;对比第2次和第3次实验或第1次与第4次实验,可以发现,放出热量的多少与所使用溶液的量有密切关系;
故选C.1年前查看全部
- 为测定燃料完全燃烧时所放出的热量,可使用弹式量热计.将1g火箭燃料二甲基肼(CH3)2N2H2置于盛有5kg水的弹式热量
为测定燃料完全燃烧时所放出的热量,可使用弹式量热计.将1g火箭燃料二甲基肼(CH3)2N2H2置于盛有5kg水的弹式热量计的钢弹内完全燃尽,体系温度上升了1.39℃.已知钢弹的热容为1840j/k,试计算此燃烧反应实验中总放热是多少?答案是31.7KJ,
 虚抽1年前1
虚抽1年前1 -
 为卿折花 共回答了14个问题
为卿折花 共回答了14个问题 |采纳率92.9%水的比热容是已知的,温度上了1.39,水吸收的热量为4.2*1.39*5=29.19Kj
钢弹吸收的为1.39*1.84=2.5576
两个相加,得到正确结果1年前查看全部
- 在量热计中将100ml 0.55mol/L的CH3COOH溶液与100ml 0.50mol/L的NaOH溶液混合,温度从
在量热计中将100ml 0.55mol/L的CH3COOH溶液与100ml 0.50mol/L的NaOH溶液混合,温度从298.0K升高到300.7K.已知量热计的热熔常数是150.5J/K,溶液密度为1克/毫升,生成溶液的比热容C=4.184J/(gK)
求CH3COOH的中和热?
答案为-53.3kJ/mol.
Q = cmΔt + 150.5Δt = 2665.71 J
为什么要+150.5Δt . impulsion1年前2
impulsion1年前2 -
 断刀流水1132 共回答了17个问题
断刀流水1132 共回答了17个问题 |采纳率94.1%150.5Δt是表示量热计在这个反应过程中吸收的热量,也包含在整个中和反应释放的热量中,所以要加上这部分.1年前查看全部
- 在恒压条件下,葡萄糖的燃烧热为15.57kj/g,2.5g葡萄糖试样在弹式量热计中燃烧,量热计的
在恒压条件下,葡萄糖的燃烧热为15.57kj/g,2.5g葡萄糖试样在弹式量热计中燃烧,量热计的
度从20.55°C升高到23.25°C.
如果热量计中装有2.7g水,该热量计的热容为多少? osetxn1年前1
osetxn1年前1 -
 liujd0314 共回答了19个问题
liujd0314 共回答了19个问题 |采纳率89.5%感觉有点不太对
水的比热容一般取4.2kJ/(kg*℃)
2.5g葡萄糖完全燃烧放出近40kJ热量
如果只有2.7g水,而且温度只上升了2点多摄氏度
这仪器的热容都大的不正常了1年前查看全部
- 为什么要测定量热计的热熔
 sinna0071年前1
sinna0071年前1 -
 66kV 共回答了16个问题
66kV 共回答了16个问题 |采纳率93.8%因为待测体系升温时,除了体系本身吸热,量热计本身也吸热,这两部分热量都是体系产生的,必须同时考虑在内.1年前查看全部
- 热力学初步计算题反应N2+3H2===2NH3在弹式量热计内进行,放出热量为87.1KJ/mol,计算此反应ΔU和ΔH
热力学初步计算题
反应N2+3H2===2NH3在弹式量热计内进行,放出热量为87.1KJ/mol,计算此反应ΔU和ΔH 答案是87.2 和92.15 夜之玄1年前1
夜之玄1年前1 -
 chenzhihua 共回答了17个问题
chenzhihua 共回答了17个问题 |采纳率88.2%弹式量热计是一恒容反应器,即Q(v)=-87.1kJ/mol.
ΔU=Q(v)=-87.1kJ/mol
ΔH =ΔU+ΔnRT=-87.1+(2-1-3)*8.314*298.15(应该是这个温度吧,题中没有)=-92.06kJ/mol.1年前查看全部
- 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-
 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
(1)CH3COOH的中和热△H=______.
(2)实验中NaOH过量的目的是______.
(3)你认为CH3COOH的中和热与HCl的中和热数值相比,______较大,其原因是______.
(4)若用KOH代替NaOH,对测定结果______(填“有”或“无”)影响. sicily1年前1
sicily1年前1 -
 想飞1019 共回答了15个问题
想飞1019 共回答了15个问题 |采纳率86.7%解题思路:(1)先根据溶液反应放出的热量Q=-cm△T+150.5J•0C-1×△T,再根据中和热△H=-
计算即可;Q n(H2O)
(2)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差;
(3)CH3COOH是弱酸,电离过程需要吸收能量;
(4)KOH也是强碱,符合中和热的概念.(1)温度差△t=300.7K-298.0K=2.7K,Q=cm△t=2.7K×4.184J•(g•K)-1×200g+150.5J•K-1×2.7K=2665.71J=2.67kJ,△H=[−Q
n(H2O)=-
2.67kJ/0.05mol]=-53.3 kJ/mol,故答案为:-53.3 kJ/mol;
(2)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,
故答案为:过量的碱能保证CH3COOH完全被中和,从而提高实验准确度;
(3)CH3COOH是弱酸,电离过程需要吸收能量,所以CH3COOH的中和热与HCl的中和热数值相比,HCl较大;
故答案为:HCl;CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热,中和时放热较少;
(4)用KOH代替NaOH,KOH也是强碱,符合中和热的概念,对测定结果无影响,故答案为:无.点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.1年前查看全部
- 请问中和热的测定实验中需要用到的仪器除了简易量热计装置还有什么?
 10点零3分1年前1
10点零3分1年前1 -
 雪南山 共回答了25个问题
雪南山 共回答了25个问题 |采纳率88%大小烧杯各一个(小的装待测溶液,大的作为保温容器),碎纸屑或碎泡沫(隔热),泡沫板(隔热),环形玻璃棒(搅拌溶液使其充分反应)1年前查看全部
- 高2化学题(1) 1.792L(标准状况)的CO.CH4和O2组成的混合物,在量热计中燃烧时,放出13.683KJ热量.
高2化学题
(1) 1.792L(标准状况)的CO.CH4和O2组成的混合物,在量热计中燃烧时,放出13.683KJ热量.若向燃烧产物中再加一定量的H2使其燃烧完全,又放出9.672KJ热量.求愿混合物中各气体的体积.
CO(g)+1/2O2(g)===CO2(g)
△H=-283KJ/mol
CH4(g)+2O2(g)===CO2(g)+2H2O(g)
△H=-802.3KJ/mol
H2(g)+1/2O2(g)===H2O(g)
△H=-241.8KJ/mol
谢谢,要过程! 开羽宝贝1年前2
开羽宝贝1年前2 -
 whale-88 共回答了18个问题
whale-88 共回答了18个问题 |采纳率94.4%最后的一个条件一定是和氧气反应了所以:
H2:9.672/241.8=0.04mol---->O2:0.02mol
所以:
完全反应掉的混合气体有:
1.792/22.4=0.08mol-0.02mol=0.06mol
所以有方程组:
令CO摩尔数为x,CH4摩尔数为y
CO(g)+1/2O2(g)===CO2(g)
CH4(g)+2O2(g)===CO2(g)+2H2O(g)由这两个式子可以知道,氧气摩尔数为:0.5x+2y
有:x+y+0.5x+2y=0.06---------------①
另外 放出13.683KJ热量 凭这个有:
283x+802.3y=13.683-------------②
由①②得y=0.01mol x=0.02
那么CO体积:0.02*22.4=0.448L CH4体积:0.01*22.4=0.224L
O2体积:1.792-0.448-0.224=1.12L
上课不注意听讲作业不会来这边混,我老人家多少年不做化学了你知道么,不过给分就行了嘻嘻.1年前查看全部
- 为什么用保温式量热计测定稀盐酸和稀碳酸氢钠溶液反应的反应热,“测量反应后的温度时,要在温度计读书稳定后读数”是错的?
 地狱的火1年前1
地狱的火1年前1 -
 delta_26 共回答了12个问题
delta_26 共回答了12个问题 |采纳率100%因为那样会比正确值小,读出的数据不准确1年前查看全部
- 在量热计中将100ml 0.55mol/L的醋酸溶液与100ml 0.55mol/L的NaOH溶液混合,温度从298.0
在量热计中将100ml 0.55mol/L的醋酸溶液与100ml 0.55mol/L的NaOH溶液混合,温度从298.0K升高到300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J/K,溶液密度均为1g/mL,生成溶液的比热容C=4.184j/(g.K).
试求醋酸的中和热. qingbaook1年前2
qingbaook1年前2 -
 lixian1986 共回答了17个问题
lixian1986 共回答了17个问题 |采纳率88.2%这个先算热量溶液+器皿w=cm(t1-t2)
会吧?
算完,/0.055
就得了
中和热指的是酸碱中和生成1mol水
所有的中和热其实本质相等1年前查看全部
- 298K时,6.5克液体苯在弹式量热计中完全燃烧,放热272.3KJ.求该反应的△rUm标准 和△rHm标准
298K时,6.5克液体苯在弹式量热计中完全燃烧,放热272.3KJ.求该反应的△rUm标准 和△rHm标准
顺便问下△rUm标准 是什么? 飘飘何所似1年前1
飘飘何所似1年前1 -
 毓见倾心 共回答了18个问题
毓见倾心 共回答了18个问题 |采纳率88.9%“在弹式量热计中”是指该过程为恒容过程,放出的热量为恒容反应热Qv
热力学能变ΔU=Qv(U是热力学能或称内能)
△rUm标准是指反应进度为1mol时化学反应的标准摩尔反应热力学能变(单位是kJ/mol,而ΔU的单位是kJ).
C6H6(l) + 7.5O2(g) → 6CO2(g) + 3H2O(l) Qv
根据题目,放热272.3KJ,即Qv=-272.3KJ(Q的符号放热为负,吸热为正),即ΔU=-272.3KJ ;该反应中6.5克液体苯的物质的量=6.5/78=0.083mol.
△rUm标准=ΔU/n=-272.3KJ /0.083=-3267.6kJ/mol
因为H=U+PV,所以ΔH=ΔU+Δ(PV)=ΔU+ΔnRT,
则△rHm标准=△rUm标准+ΔnRT,Δn指反应前后气体物质的量之差(压强对液体和固体影响非常小,可忽略),在此Δn=6-7.5=-1.5mol,T=298K,R=8.314J/(mol*K)
所以△rHm标准=△rUm标准+ΔnRT=-3267.6-1.5*8.314*298/1000=-3271.3kJ/mol1年前查看全部
- 【判断题】化学反应热效应的测定进行化学反应热效应测定时,硫酸铜溶液与锌粉加入量热计中的先后次序,对测定结果没有影响.
 wangly1372861年前1
wangly1372861年前1 -
 organdy 共回答了24个问题
organdy 共回答了24个问题 |采纳率87.5%不对.应该先加入硫酸铜溶液,再加入锌粉,这样量热计的测量才更精确.反之反应不均匀会影响测量结果.1年前查看全部
大家在问
- 1蜡烛燃烧与酒精灯燃烧及其他物质燃烧共有的现象是______
- 2不属于蜡烛燃烧实验现象的是( )
- 3为什么蜡烛燃烧是化学反应
- 4光是物质吗?蜡烛燃烧是化学反应还是物理反应?
- 5左边是言字旁,右边是山,这个字是什么?
- 6左边山字旁,右边是含,这个字怎么打出来
- 7有30颗珍珠,有一颗是次品,比正品轻,怎样用天平秤4次把次品找出来?
- 8有什么成语是形容人指着那样东西就想要那样东西
- 9(1/2)一位工人在水平道路上推一辆运料车,车的质量为50kg,所用的水平推力为250N,产生的加速度为2m/s2,设.
- 10有一座时钟现在显示10时整,那么,经过______分钟,分针与时针第一次重合;再经过______分钟,分针与时针第二次重
- 11到底是谁骗谁用英语怎么说
- 12打字员打印一本书稿打印18小时候还剩下四分之一没打完每小时打印这本书的( )剩下的还要几小时完成
- 13有3个因数的最小自然数与有4个因数的最大的一位数的和是多少?
- 14有3个因数的最小自然数与有4个因数的最大一位数的和是多少
- 15有3个因数的最小自然数与有4个因数的最小自然数之和是多少?
