铁的析氢腐蚀总方程式是铁和氢离子反应还是铁和水反应呢?为啥?
 小海马19782022-10-04 11:39:541条回答
小海马19782022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 32fsadgoi 共回答了12个问题
32fsadgoi 共回答了12个问题 |采纳率91.7%- 析氢腐蚀是指在酸性环境下酸的氢离子变成氢气,铁变成铁离子,所以是铁与酸的氢离子反应.
至于水,是铁与氧气和水的吸氧腐蚀 - 1年前
相关推荐
- 为什么碳棒为正负电极,NaCl为电解液,正极发生的是析氢腐蚀而不是吸氧腐蚀
 sdfhh1年前4
sdfhh1年前4 -
 tong1688 共回答了19个问题
tong1688 共回答了19个问题 |采纳率89.5%纠正一下,金属的析氢腐蚀和吸氧腐蚀均属于原电池反应(自发反应).碳棒为正负电极,NaCl为电解液是电解反应(非自发反应),这个不是腐蚀.
反应方程式:
阳极(接电源正极):2Cl- - 2e- = Cl2(气体)
阴极(接电源负极):H2O + 2e- = 2OH- + H2(气体)1年前查看全部
- 将铜棒和碳棒用导线连接后插入食盐水中会发生什么反应?是吸氧腐蚀还是析氢腐蚀?
 呆呆小企鹅1年前1
呆呆小企鹅1年前1 -
 云中翩翩 共回答了14个问题
云中翩翩 共回答了14个问题 |采纳率71.4%将铜棒和碳棒用导线连接后插入食盐水中很明显形成了原电池
电池反应为:负极Cu-2e===Cu 2+正极O2+2H2O+4e===4OH-
4Cu2++6OH-+2Cl-===CuCl2·3Cu(OH)2·XH2O(碱式氯化铜)沉淀产生,但是铜离子和OH-比例不对此反应不可持续进行.
主要是吸氧腐蚀(吸氧腐蚀的正极的电势电位比析氢腐蚀的高许多,除非H+ 离子浓度很高就不是),因为析氢腐蚀要在PH值比较低的情况才是主要的,而食盐水是中性的呀.1年前查看全部
- 原电池的正极反应如何判断?原电池正极好像就两个 一个是析氢腐蚀 一个是吸氧腐蚀 假如构造一个原电池 ZN是负极 FE是正
原电池的正极反应如何判断?
原电池正极好像就两个 一个是析氢腐蚀 一个是吸氧腐蚀 假如构造一个原电池 ZN是负极 FE是正极 溶液是NACL 那么FE极的反应是吸氧腐蚀么?正极就没有像电解池一样 有一个离子反应的顺序? 鱼虾舞1年前2
鱼虾舞1年前2 -
 PUCCA_GARU 共回答了13个问题
PUCCA_GARU 共回答了13个问题 |采纳率84.6%正极不止两种反应吧,比如两烧杯中分别盛硫酸铜溶液和硫酸亚铁溶液,铜和铁棒作电极的那种原电池,正极反应是铜离子得电子生成铜单质啊
正极发生氧化反应,得电子
原电池没有电解池那么复杂,一般用不上离子反应顺序的.再说,离子反应顺序本质是离子氧化性(或还原性)顺序,是通用的
原电池是将氧化和还原反应分开的装置
总反应是Fe + Cu2+ =Cu +Fe2+
你看,是这样的.氧化还原反应的本质是电子的得失,若没有形成原电池,那么这个反应在溶液中就会完成铁失电子生成二价铁,铜离子的电子生成单质铜的过程.但若将铜离子和铁单质分开,让它们在分开的装置中,铁失的电子无法和铜离子结合(因为不在同一溶液中),只好通过导线跑到铜离子那里去,就形成电流了,盐桥是平衡电荷用的.
铁那一极(负极)发生Fe—2e=Fe2+
铜那一极(正极)发生Cu2+ +2e=Cu 这一极的单质铜纯粹是电极,导电用的,不参与反应
以上是我在另一处解释过的,是关于硫酸铜和硫酸亚铁的那种原电池,1年前查看全部
- 有关钢铁腐蚀与防护的说法正确的是 [ ] A.析氢腐蚀和吸氧腐蚀,负极均
有关钢铁腐蚀与防护的说法正确的是 [ ]A.析氢腐蚀和吸氧腐蚀,负极均是Fe发生还原反应 Fe -2e - =Fe 2+
B.镀层破损后,镀锡铁板的镀层仍能对铁制品起保护作用,比镀锌铁板更耐腐蚀
C.在海轮外壳连接锌块,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 葡丝1年前1
葡丝1年前1 -
 关健哥 共回答了23个问题
关健哥 共回答了23个问题 |采纳率82.6%C1年前查看全部
- 钢铁的吸氧腐蚀与析氢腐蚀哪个比较严重
 zhuxit1年前2
zhuxit1年前2 -
 kklonghb 共回答了22个问题
kklonghb 共回答了22个问题 |采纳率86.4%钢铁是 铁与C(碳)
及Si(硅)、Mn(锰)、P(磷)、S(硫)以及少量的其他元素所组成的合金.
对于吸氧腐蚀和析氢腐蚀,它们都是电化学腐蚀;
电化学腐蚀的影响因素很多,
对于钢铁来说,腐蚀介质的性质的影响非常大.
如下情况:
①当钢铁处于酸性溶液中时:
很显然,发生析氢腐蚀,
②当钢铁处在氧浓度很好的溶液中时:
发生吸氧腐蚀
这是两种非常明显的极限情况,类似的情况还有很多,
而判断究竟发生那种腐蚀主要依据是化学电位的高低:
吸氧腐蚀和析氢腐蚀都发生在腐蚀电池的阴极,
(氧气的电子变成氢氧根,氢离子的电子变成氢气,都是在阴极得电子)
因此,谁的阴极电位越高谁就优先反应.
看看上面的那个公式,是能斯特方程,抱歉打不出来,
从式中可以看出,氧气得浓度和氢离子的浓度是影响它们电极电位的因素.
此外温度也是一个影响因素. 1年前查看全部
1年前查看全部
- 下列有关说法正确的是( )A.钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀可能同时发生B.反应NH3(g)+HCl(g)═NH
下列有关说法正确的是( )
A.钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀可能同时发生
B.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0
C.由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀
D.0.1mol•L-1 CH3COOH溶液加水稀释后,c(OH-)、CH3COOH电离度均增大 丘比特之吻1年前1
丘比特之吻1年前1 -
 tiedandan117117 共回答了18个问题
tiedandan117117 共回答了18个问题 |采纳率100%解题思路:A、从电解质是酸性的角度来分析;
B、根据吉布斯自由能来判断;
C、只要使钡离子和碳酸根离子浓度积大于Ksp(BaCO3),即可转化;
D、CH3COOH溶液加水稀释,根据电离平衡的移动来分析.A、钢铁腐蚀时若介质为酸性,则可能同时发生析氢腐蚀与吸氧腐蚀,故A正确;
B、该反应熵变小于零,若自发进行焓变一定小于零,故B错误;
C、可以用高浓度的碳酸盐溶液使溶液中钡离子和碳酸根离子浓度积大于Ksp(BaCO3),即可使BaSO4沉淀转化为BaCO3沉淀,故C错误;
D、加水稀释,平衡正向移动,醋酸电离度增大,但平衡中离子浓度减低,水电离出的c(OH-)增大,故D正确;
故选AD.点评:
本题考点: 金属的电化学腐蚀与防护;反应热和焓变;弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题综合考察了钢铁的腐蚀、反应能否自发的判断、沉淀溶解平衡和电离平衡的应用,综合性较强,难度适中.1年前查看全部
- 析氢腐蚀为什么不是氧气得电子不是说氧气的氧化性强,比氢容易得电子么,为什么不是氧气得电子而是氢离子得电子?
 MYULIU1年前3
MYULIU1年前3 -
 困兽不斗 共回答了18个问题
困兽不斗 共回答了18个问题 |采纳率94.4%酸性溶液中发生析氢腐蚀,碱性溶液中发生吸氧腐蚀.看溶液PH1年前查看全部
- 吸氧腐蚀和析氢腐蚀 都是原电池的嘛还是都是电解池的
 lintwhite1年前3
lintwhite1年前3 -
 tmeltion 共回答了21个问题
tmeltion 共回答了21个问题 |采纳率95.2%都是原电池.吸氧腐蚀的环境是碱性、中性、微酸性,正极吸收氧气得电子,与水一起生成氢氧根.析氢腐蚀是强酸性(非强氧化性酸)条件下进行的1年前查看全部
- 原电池正负极是不是只要电极是惰性电极就发生析氢腐蚀和吸氧腐蚀呢?如果是原因是什么?
原电池正负极是不是只要电极是惰性电极就发生析氢腐蚀和吸氧腐蚀呢?如果是原因是什么?
两烧杯中分别盛硫酸铜溶液和硫酸亚铁溶液,铜放在硫酸铜溶液和铁棒放在硫酸亚铁溶液作电极的原电池,有以下几个疑问
1铁失的电子和铜离子结合,通过导线跑到铜离子那里去,就形成电流 .形成这个反应的动力是什么?铁棒放在硫酸铜溶液是直接反应的,铁棒放在硫酸亚铁溶液也不反应,最后怎么能形成和前者一样的反应
2如果把硫酸铜溶液换成是硫酸亚铁,或是两者都换成别的盐溶液最后的总反应还能是Fe + Cu2+ =Cu +Fe2+吗
3原电池和电解池的电解液有什么不同 ,是原电池的电解液只起到导电作用,而电解池的电解液中的离子有的还参加反应吗? 西雅图zz1年前2
西雅图zz1年前2 -
 HWENFENG12 共回答了12个问题
HWENFENG12 共回答了12个问题 |采纳率100%1.原电池反应需要考虑的是氧化还原电对的电极电势高低.在1中的情境下,两对电对分别是E(Fe2+/Fe)=-0.44V 与E(Cu2+/Cu)=0.337V所以这个反应本质上是Cu2+氧化Fe生成Cu与Fe2+的反应,总电动势为0.337V-(-0.44V)=0.777V.在原电池反应中,不需要有各个反应物的接触,只要有电对的接触就行.产生电流的动力就是电对的电极电势差.
2.必须要有Cu2+的溶液,剩下的一种可以是随机的电解质溶液.只要满足电对的存在就行,没有Cu2+就相当于没有反应物,自然无法进行.
3.原电池和电解池的区别比较大,原电池的电解液一方面是导电,一方面也能参与反应,但是他能主动产生电流.电解液时通过外加电源,相当于外加一个强氧化还原剂来进行辅助分解.1年前查看全部
- 下列说法正确的是( )①用甲装置电解精炼镁 ②用乙装置验证试管中铁丝发生析氢腐蚀 ③用丙装置构成铜锌原电池 ④用丁装置
下列说法正确的是( )
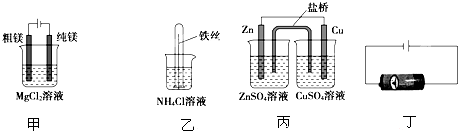
①用甲装置电解精炼镁
②用乙装置验证试管中铁丝发生析氢腐蚀
③用丙装置构成铜锌原电池
④用丁装置对二次电池进行充电.
A.①②
B.①③
C.①④
D.②③ 淡淡过1年前1
淡淡过1年前1 -
 uu6644 共回答了22个问题
uu6644 共回答了22个问题 |采纳率95.5%解题思路:①该装置中阴极上氢离子放电;
②酸性条件下,铁发生析氢腐蚀;
③该装置符合原电池构成条件;
④二次电池充电时,其阳极与原电池正极相连.①该装置中阴极上氢离子放电,所以阴极上得不到金属Mg单质,故错误;
②酸性条件下,铁发生析氢腐蚀,氯化铵为强酸弱碱盐,其溶液呈酸性,所以该溶液中铁发生析氢腐蚀,故正确;
③该装置符合原电池构成条件,所以能构成原电池,锌易失电子作负极、铜作正极,故正确;
④二次电池充电时,阳极上失电子发生氧化反应,所以其阳极与原电池正极相连,故错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,涉及原电池的构成条件、金属的腐蚀与防护、电解精炼等知识点,知道各个电极上发生的电极反应,易错选项是④,注意:二次电池充电时电极如何连接原电池电极,为易错点.1年前查看全部
- 在金属腐蚀中,析氢腐蚀和吸氧腐蚀有什么异同?
 tt浪淘尽1年前1
tt浪淘尽1年前1 -
 nandi3721 共回答了19个问题
nandi3721 共回答了19个问题 |采纳率100%吸氧腐蚀是指金属做负极,惰性非金属作正极的一类原电池反应,例如铁生锈的反应就是吸氧腐蚀,铁做负极,铁中的杂质等物质作正极,正极发生反应O2 + 4e- +2H20 = 4OH-,吸收氧气
负极发生反应Fe - 2e- = Fe2+
析氢腐蚀是指以酸为电解液的一类原电池反应,例如铁-锌,稀硫酸为电解液的原电池,正极发生反应2H+ + 2e- = H2,析出了氢气
负极发生反应Zn - 2e- = Zn2+1年前查看全部
- 铁的析氢腐蚀中,为什么会生成氢氧化铁?水解不可能这么剧烈吧 请详细解释一下,谢谢
 柯大1年前1
柯大1年前1 -
 衡水幸运星 共回答了26个问题
衡水幸运星 共回答了26个问题 |采纳率88.5%析氢腐蚀不会形成氢氧化铁.
负极 Fe - 2 e- = Fe2+
正极 2 H+ + 2 e- = H2
吸氧腐蚀会产生Fe(OH)3
负极 2 Fe - 4 e = 2 Fe2+
正极 2 H2O + O2 + 4 e = 4 OH-
总反应方程式 2 Fe + O2 + 2 H2O = 2 Fe(OH)2
后续反应 4 Fe(OH)2 + O2 + 2 H2O = 4 Fe(OH)31年前查看全部
- 以Fe生锈为例,写出电化学腐蚀,析氢腐蚀,吸氧腐蚀的正负极反应 打好了追悬赏,
 Maggie12101年前1
Maggie12101年前1 -
 名门出xxcc 共回答了19个问题
名门出xxcc 共回答了19个问题 |采纳率94.7%析氢腐蚀
负极:Fe-2e-=Fe2+
正极:2H+ +2e-=H2↑
吸氧腐蚀
负极:2Fe-4e-=2Fe2+
正极:2H2O+O2+4e- =4OH-1年前查看全部
- 电化学腐蚀中只有吸氧腐蚀和析氢腐蚀两种吗?
 阏觜1年前2
阏觜1年前2 -
 wzxyh 共回答了14个问题
wzxyh 共回答了14个问题 |采纳率100%是的,从本质上来看,只有得电子与失电子两种情况,分别对应吸氧腐蚀与析氢腐蚀,必然不会再有除了得失电子之外的第三种情况.1年前查看全部
- 酸性条件下金属腐蚀都是析氢腐蚀吗
酸性条件下金属腐蚀都是析氢腐蚀吗
电化学腐蚀分为析氢腐蚀和吸氧腐蚀,析氢腐蚀的条件是电解质溶液显酸性,那么酸性条件下的腐蚀都是析氢腐蚀吗? LZX161年前1
LZX161年前1 -
 黄颜色的布丁 共回答了21个问题
黄颜色的布丁 共回答了21个问题 |采纳率81%一般情况下是,但是如果酸性过强,或是没有杂质的纯金属,则会在酸性中溶解1年前查看全部
- 等物质的量的Fe发生析氢腐蚀和吸氧腐蚀过程中消耗氧气比为1:3
 享之水天1年前2
享之水天1年前2 -
 五香草 共回答了15个问题
五香草 共回答了15个问题 |采纳率100%析氢:Fe+2H+=Fe2+ +H2
4Fe2+ +O2+4H+=4Fe3+ +2H2O
吸氧:2Fe+O2+2H2O=2Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
1:31年前查看全部
- 生铁块在氯化铵溶液中发生析氢腐蚀?
生铁块在氯化铵溶液中发生析氢腐蚀?
我觉得氯化铵溶液水解应该是弱碱性卅、、为何书上说会发生析氢腐蚀.为什么、、电极反应式是什么? 风中松涛1年前1
风中松涛1年前1 -
 细语漫说 共回答了18个问题
细语漫说 共回答了18个问题 |采纳率83.3%首先,氯化铵溶液是弱酸性的,生铁中含有C元素,形成原电池
总反应式:Fe+2H^=Fe2^+H2 氢离子是铵根水解产生1年前查看全部
- 为什么钢铁在酸性条件下发生析氢腐蚀,在弱酸或中性或碱性条件下发生吸氧腐蚀
 tt卿1年前1
tt卿1年前1 -
 檀香扇 共回答了14个问题
檀香扇 共回答了14个问题 |采纳率100%这个与氢离子浓度有关
比如铁 氢离子浓度 足够 就生产 铁离子和氢气单质
浓度太低 就会和空气中的氧气 二氧化碳 生成该金属氧化物.比如铁锈1年前查看全部
- 将铜棒和碳棒用导线连接后插入食盐水中会发生什么反应 ?是析氢腐蚀还是吸氧腐蚀?
 sunjory1年前2
sunjory1年前2 -
 我是钱啊 共回答了19个问题
我是钱啊 共回答了19个问题 |采纳率68.4%吸氧腐蚀
如果酸性不是特别强都是吸氧腐蚀1年前查看全部
- 写出钢铁吸氧腐蚀和析氢腐蚀的电极反应式
 bclz1121年前2
bclz1121年前2 -
 didadidadida 共回答了16个问题
didadidadida 共回答了16个问题 |采纳率81.3%负极都是Fe-2e-=Fe2+
正极:
吸氧腐蚀:2H2O+O2+4e-=4OH-
析氢腐蚀:2H+ +2e-=H2↑1年前查看全部
- 金属的腐蚀全部是氧化还原反应吗?金属腐蚀原理是什么?化学腐蚀与电化学腐蚀怎样区分?在什么条件下发生析氢腐蚀与吸氧腐蚀?无
金属的腐蚀全部是氧化还原反应吗?金属腐蚀原理是什么?化学腐蚀与电化学腐蚀怎样区分?在什么条件下发生析氢腐蚀与吸氧腐蚀?无论析氢腐蚀或吸氧腐蚀都是金属被氧化吗?
 classicist1年前2
classicist1年前2 -
 R0Ya 共回答了19个问题
R0Ya 共回答了19个问题 |采纳率89.5%是的,全都是氧化还原反应.化学腐蚀分为吸氧腐蚀和析氢腐蚀,相信LZ这点还是知道吧~化学腐蚀和电化学腐蚀最大的区别在于有没有形成原电池.有,则是电化学腐蚀.这种原电池是微小的原电池.在酸性(不管弱酸还是强酸)条件下发生析氢腐蚀,在中性或碱性条件下发生吸氧腐蚀.
是的,两种腐蚀都是金属被氧化,因为金属(高中阶段主要指主族的)无负价,也就是说它不能被还原.1年前查看全部
- 在析氢腐蚀中金属作阳极被腐蚀;而在吸氧腐蚀中,则是作阴极的金属被腐蚀
在析氢腐蚀中金属作阳极被腐蚀;而在吸氧腐蚀中,则是作阴极的金属被腐蚀
A.错误
B.正确 南京hwmol1年前3
南京hwmol1年前3 -
 lanlianhua_123 共回答了26个问题
lanlianhua_123 共回答了26个问题 |采纳率84.6%正确1年前查看全部
- 吸氧腐蚀和析氢腐蚀是吸热反应还是放热反应?
 上泡1年前2
上泡1年前2 -
 last347 共回答了14个问题
last347 共回答了14个问题 |采纳率85.7%都是放热反应的1年前查看全部
- 吸氧腐蚀和析氢腐蚀是怎么会是啊?
 最zz米1年前2
最zz米1年前2 -
 317603567 共回答了24个问题
317603567 共回答了24个问题 |采纳率87.5%吸氧腐蚀:
析氢腐蚀:1年前查看全部
- 析氢腐蚀和吸氧腐蚀哪个常见?如题
 郑佳金苗1年前2
郑佳金苗1年前2 -
 xiaohei_yeah 共回答了15个问题
xiaohei_yeah 共回答了15个问题 |采纳率80%吸氧腐蚀,只有在重工业区雨水酸性较强时才有析氢腐蚀1年前查看全部
- 常态下钢铁的腐蚀到底属于吸氧腐蚀还是析氢腐蚀?为什么资料上说是吸氧腐蚀,但反应过程中还生成氢气?
 zxc90g1年前1
zxc90g1年前1 -
 6qq7699 共回答了12个问题
6qq7699 共回答了12个问题 |采纳率66.7%吸氧腐蚀 铁和氧气反应生成氧化铁写红色 有氧气是电化学中的1年前查看全部
- 生铁块在氯化铵溶液中发生析氢腐蚀?
生铁块在氯化铵溶液中发生析氢腐蚀?
请给出电极反应式、、 bybyfine1年前1
bybyfine1年前1 -
 整志为 共回答了12个问题
整志为 共回答了12个问题 |采纳率83.3%关于电极反应方程式不懂,但是我知道工业上用氢气还原的生产,比如硝基苯生产苯胺的时候,是在反应液体里加入氯化铵和铁粉的.氯化铵起了催化剂的作用!1年前查看全部
- 生铁块在氯化铵溶液中发生析氢腐蚀?
 乖乖落地咚1年前2
乖乖落地咚1年前2 -
 feiloveqin522 共回答了19个问题
feiloveqin522 共回答了19个问题 |采纳率89.5%生铁块里面含铁和碳.铁作负极,碳作正极.1年前查看全部
- 吸氧和析氢腐蚀各在什么条件下发生?
 无人知道1年前1
无人知道1年前1 -
 young_gun 共回答了16个问题
young_gun 共回答了16个问题 |采纳率100%电解质溶液酸性较强时发生析氢腐蚀,酸性较弱,或中性,或碱性,且金属和电解质溶液不能直接反应时发生吸氧腐蚀.1年前查看全部
- 析氢腐蚀与吸氧腐蚀能同时反应的原因
 基巴扎比利1年前1
基巴扎比利1年前1 -
 唬笑半步痴 共回答了18个问题
唬笑半步痴 共回答了18个问题 |采纳率88.9%当氧气少,腐蚀环境ph小时,主要发生析氢腐蚀.当氧气多,腐蚀环境ph大时,主要发生吸氧腐蚀.在ph小向ph大的过渡的过程中,析氢腐蚀和吸氧腐蚀同时发生.1年前查看全部
- 铜碳稀硫酸原电池怎么反应?是析氢腐蚀吗?
 nutter881年前2
nutter881年前2 -
 ╰ㄝ界末ㄖ 共回答了21个问题
╰ㄝ界末ㄖ 共回答了21个问题 |采纳率90.5%哇…我最喜欢的化学题唉!是析氢腐蚀,还原析氢腐蚀,铜活泼性大于碳,铜就和酸反应还原氢!1年前查看全部
- 常见化学原电池方程式吸氧腐蚀和析氢腐蚀的方程式 各列举出几例
 冬虫语冰1年前1
冬虫语冰1年前1 -
 関亠 共回答了10个问题
関亠 共回答了10个问题 |采纳率70%吸氧腐蚀
定义 金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀,叫吸氧腐蚀.
电极反应 负极(铁):2Fe-4e-=2Fe2+ 正极(碳或碳化铁):2H2O+O2+4e-=4OH-
析氢腐蚀
定义 金属在酸性较强的溶液里放出氢气的电化学的腐蚀叫做析氢腐蚀.
成因 在钢铁制品中一般都含有石墨(C)或碳化铁(Fe3C).在潮湿空气中,钢铁表面会吸附水汽而形成一层薄薄的水膜.水膜中溶有二氧化碳或二氧化硫后就变成一种电解质溶液,使水里的H+增多:
CO2+H2O←→H2CO3←→H++HCO3- SO2+H2O←→H2SO3←→H++HSO3-
于是就产生了无数个以铁为负极、碳或碳化铁为正极、酸性水膜为电解质溶液的微小原电池.1年前查看全部
- 为什么铁锌等金属要在酸性介质才发生析氢腐蚀
 --人在ss--1年前1
--人在ss--1年前1 -
 SMU2006 共回答了18个问题
SMU2006 共回答了18个问题 |采纳率88.9%因为在中性和碱性溶剂中氢离子的含量过少,导致其氧化性比溶解在水中的氧气分子还小,所以此时会发生吸氧腐蚀,而非析氢腐蚀.
你上高中还是大学,大学的话可以看一下电级电势,可以知道离子浓度同样影响电级电势(即氧化性).高中看前面的解释就行了1年前查看全部
- 什么样的原电池会发生吸氧或析氢腐蚀?
 hiloyee1年前3
hiloyee1年前3 -
 锋魔小子 共回答了16个问题
锋魔小子 共回答了16个问题 |采纳率87.5%由铁和氯化钠溶液组成的原电池会发生吸氧,正极:2H2O +O2 +4e====4OH-
负极:Fe --- 2e ===Fe2+
由铜和硫酸溶液组成的原电池会发生析氢,正极:2H+ + 2e ==== H2
负极:Cu --- 2e === Cu2+
一般来说在酸性溶液组成的原电池中容易发生析氢腐蚀,在活泼金属组成的原电池中,也就是容易失去电子的金属组成的原电池中容易发生吸氧腐蚀.1年前查看全部
- 为什么会发生吸氧腐蚀析氢腐蚀?吸氧腐蚀和析氢腐蚀只会发生在原电池中吗?
 wghlym1年前1
wghlym1年前1 -
 小柠儿 共回答了15个问题
小柠儿 共回答了15个问题 |采纳率86.7%吸氧腐蚀可以发生在常温下1年前查看全部
- 发生吸氧腐蚀和析氢腐蚀的条件各是什么
 涩涩的向月葵1年前1
涩涩的向月葵1年前1 -
 左弦的耳 共回答了22个问题
左弦的耳 共回答了22个问题 |采纳率77.3%不纯的铁(含碳)在强酸性环境下和H+发生氧化还原反应,发生析氢腐蚀;在弱酸性或中性条件下和氧气反应,发生吸氧腐蚀.1年前查看全部
- 化学腐蚀和电化学腐蚀那个更普遍,吸氧腐蚀与析氢腐蚀那个更普遍
 巴哈鱼521年前4
巴哈鱼521年前4 -
 powow 共回答了13个问题
powow 共回答了13个问题 |采纳率84.6%电化学腐蚀那个更普遍,吸氧腐蚀更普遍1年前查看全部
- 析氢腐蚀是化学腐蚀还是电化学腐蚀?
 yj06601年前4
yj06601年前4 -
 watchred 共回答了12个问题
watchred 共回答了12个问题 |采纳率100%电化学腐蚀.由金属表面的呈弱酸性的水膜中的氢离子得电子生成氢气,所以叫做析氢腐蚀.像Fe与氯气直接接触才能算是化学腐蚀1年前查看全部
- 析氢腐蚀和析氧腐蚀如果酸性条件下有氧气,可不可以析氧腐蚀?
 cmzheng1年前1
cmzheng1年前1 -
 天使No 共回答了27个问题
天使No 共回答了27个问题 |采纳率92.6%吸氧腐蚀 金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀,叫吸氧腐蚀.
例如钢铁在接近中性的潮湿的空气中腐蚀属于吸氧腐蚀,其电极反应如下:
负极(Fe):Fe - 2e = Fe2+
正极(C):2H2O + O2 + 4e = 4OH-
钢铁等金属的电化腐蚀主要是吸氧腐蚀.
在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀.在钢铁制品中一般都含有碳.在潮湿空气中,钢铁表面会吸附水汽而形成一层薄薄的水膜.水膜中溶有二氧化碳后就变成一种电解质溶液,使水里的H+增多.是就构成无数个以铁为负极、碳为正极、酸性水膜为电解质溶液的微小原电池.这些原电池里发生的氧化还原反应是
负极(铁):铁被氧化Fe-2e=Fe2+;正极(碳):溶液中的H+被还原2H++2e=H2↑
这样就形成无数的微小原电池.最后氢气在碳的表面放出,铁被腐蚀,所以叫析氢腐蚀.1年前查看全部
- cu zn nacl原电池为什么发生析氢腐蚀
 albarain1年前1
albarain1年前1 -
 shixianheng 共回答了14个问题
shixianheng 共回答了14个问题 |采纳率85.7%这里没有氢,哪来的氢气,要是HCI就可以1年前查看全部
- 请把铁吸氧腐蚀和析氢腐蚀的总反应式
请把铁吸氧腐蚀和析氢腐蚀的总反应式
写给我 不需要电极反应式 Checking_in1年前1
Checking_in1年前1 -
 swj102 共回答了23个问题
swj102 共回答了23个问题 |采纳率91.3%吸氧腐蚀:4Fe+6H2O+3O2=4Fe(OH)3
析氢腐蚀:Fe+2H+=Fe2+ + H2↑
其实通过电极反应式的加和就可以弄出来1年前查看全部
- 镀锌铁发生析氢腐蚀,有0.2mol电子发生转移,问有多少金属被腐蚀
 3641199341年前1
3641199341年前1 -
 dikcy 共回答了14个问题
dikcy 共回答了14个问题 |采纳率85.7%无论铁或是锌反应都是变成正二价,所以是0·1摩尔.1年前查看全部
- 关于吸氧腐蚀与析氢腐蚀.介质是强酸性的时候 是吸氧中性和碱性是 析氢那电解质不是 要么碱性 要么酸性 要么中性么.那意思
关于吸氧腐蚀与析氢腐蚀.
介质是强酸性的时候 是吸氧
中性和碱性是 析氢
那电解质不是 要么碱性 要么酸性 要么中性么.
那意思不就是说 反应不是析氢 就是吸氧咯?
可是有些反应却不是这样呀.
为什么了.
怎么判断呢?
例如zn pt Na2SO4 是吸氧.
而Zn pt CuSO4 又是CU离子 得电子 xixi1101年前2
xixi1101年前2 -
 andrewgirl 共回答了20个问题
andrewgirl 共回答了20个问题 |采纳率85%你说反了.
介质是强酸性的时候 析氢
中性和碱性是 是吸氧
你想想强酸性的时候与H离子反应,就析氢,对吧..
某些东西不同时因为他们的金属活动性不同
··而Zn pt CuSO4 又是CU离子 得电子
对于这个是一个原电池.你明白吧?Cu离子的氧化性比H20大,所以Cu离子先得电子.你学到原电池,接触到离子放电顺序就知道了!
不懂再问,乐意为你解答1年前查看全部
- 氢氧化钠中铝的腐蚀,到底是析氢腐蚀还是吸氧腐蚀,如果是析氢腐蚀,为什么会产氢气
 daoba0081年前3
daoba0081年前3 -
 海棠春睡123 共回答了19个问题
海棠春睡123 共回答了19个问题 |采纳率84.2%别听楼上的= =.
是吸氧腐蚀.因为氢氧化钠是碱性环境.所以发生吸氧腐蚀.如果是析氢腐蚀的话要求是强酸环境下.吸氧腐蚀一般发生在中性和碱性环境中.
而且铝和氢氧化钠会反应.
2Al+2NAOH+2H2O==2NAAlO2+3H2↑1年前查看全部
- 吸氧腐蚀和析氢腐蚀的原理是什么我要知道详细的原理
 cls12331年前2
cls12331年前2 -
 zouzhhua 共回答了24个问题
zouzhhua 共回答了24个问题 |采纳率87.5%当氢离子浓度很低时,发生吸氧腐蚀,否侧发生析氢腐蚀.化学书的选修4反应原理的后面的电池那里有相关方程式1年前查看全部
- 吸氧腐蚀和析氢腐蚀是不是都是铁被腐蚀
 夜听细雨1年前1
夜听细雨1年前1 -
 yangxk 共回答了23个问题
yangxk 共回答了23个问题 |采纳率82.6%不一定是Fe,但铁最常见
(1)析氢腐蚀(钢铁表面吸附水膜酸性较强时)电化学腐蚀 负极(Fe):Fe=Fe2++2e- Fe2++2H2O=Fe(OH)2+2H+ 正极(杂质):2H++2e-=H2 电池反应:Fe+2H2O=Fe(OH)2+H2↑ 由于有氢气放出,所以称之为析氢腐蚀.(2)吸氧腐蚀(钢铁表面吸附水膜酸性较弱时) 负极(Fe):Fe=Fe2++2e- 正极:O2+2H2O+4e-=4OH- 总反应:2Fe+O2+2H2O=2Fe(OH)2 由于吸收氧气,所以也叫吸氧腐蚀.析氢腐蚀与吸氧腐蚀生成的Fe(OH)2被氧所氧化,生成Fe(OH)3脱水生成Fe2O3 铁锈.4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 钢铁制品在大气中的腐蚀主要是吸氧腐蚀.Fe+2H2O=Fe(OH)2+H2↑ O2+2H2O+4e-→4OH- 2Fe+O2+2H2O=2Fe(OH)2 2H++2e-→H2 析氢腐蚀主要发生在强酸性环境中,而吸氧腐蚀发生在弱酸性或中性环境中.1年前查看全部
- 关于原电池正极得电子物质若电解质溶液为碱或中性,则发生吸氧腐蚀,为酸性,则发生析氢腐蚀,这种观点是不是有正极棒不活泼这一
关于原电池正极得电子物质
若电解质溶液为碱或中性,则发生吸氧腐蚀,为酸性,则发生析氢腐蚀,这种观点是不是有正极棒不活泼这一前提?为什么铜锌原电池是电解质溶液中的铜离子得电子呢? 酷酷小狗1年前2
酷酷小狗1年前2 -
 Richtting 共回答了18个问题
Richtting 共回答了18个问题 |采纳率88.9%金属离子的氧化性是金属活动顺序表倒置,但是Fe3+与此规律不相符,这个的氧化性排在Cu2+的前面,Fe2+的顺序与规律相符.所以由于Cu2+的氧化性大于Zn2+,所以Cu2+先得电子.由于Zn2+的氧化性在H+之后,所以理论上要把水反应完才能让Zn2+得电子.
吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀.这个是电化学腐蚀,如果是原电池的话不能这么叫的.而且要原电池要能自主反应,两个电极必须是不同材质.所以负极一定比正极活泼,也就是说两个材质连在一起,活泼的自然就成了负极.
你问这种观点是不是有正极棒不活泼这一前提是不存在这个问题的.组成原电池的两极,一定是负极活泼.1年前查看全部
- 铜在酸性环境中易发生析氢腐蚀 这句话为什么不对
 Karen_lOVE1年前1
Karen_lOVE1年前1 -
 chris_22 共回答了20个问题
chris_22 共回答了20个问题 |采纳率90%铜的活动性弱,应该是吸氧腐蚀.1年前查看全部
- 钢铁的析氢腐蚀与吸氧腐蚀有哪些区别?3Q
 yaoyaoda1年前1
yaoyaoda1年前1 -
 黑马雷达 共回答了21个问题
黑马雷达 共回答了21个问题 |采纳率95.2%析氢腐蚀:要求水膜呈较强酸性,负极:Fe-2e-=Fe2+, 正极:2H++2e-=H2
吸氧腐蚀: 水膜呈极弱酸性、中性或碱性均可,负极:Fe-2e-=Fe2+, 正极:O2+2H2O+4e-=4OH-1年前查看全部
大家在问
- 1为了迎接新学期开学,某服装厂赶制一批校服,要求必须在规定时间内完成.在生产过程中,如果每天生产50套,这将还差100套不
- 2英语中 讨厌这个单词怎么说?
- 3这雨中的绿色,在画家的调色板上是很难调出来的.只要见过这水淋淋的绿,便很难忘却.仿写
- 4为什么山雨中作者说 这山中的绿色,在画家的调色板上是很难调出来的
- 5这雨中的绿色,在画家的调色板上是很难调出来的.只要见过这水淋淋的绿,便很难忘却.
- 6要是见过这雨中的水淋淋的绿,怎么能忘却呢?(改成陈述句)
- 7我永远不会放弃你 英文怎么说
- 8上课的英语怎么读请告诉我
- 9读书读抱的英文怎么写?
- 10求证等腰三角形的底角不可能是直角 用反证法证明
- 11人教版数学书初一上册应用题希腊数学家丢番图(公元3-4世纪)的墓碑上记载着:他的生命的六分之一是幸福的童年;再活了他生命
- 12滁州西涧描绘了怎样一幅画面
- 13初一下册数学书103应用题答案帮下忙呗!
- 14请问2014年7月7日,英语怎么翻译
- 15哪些无色溶液与氯化铜反应生成蓝色沉淀
