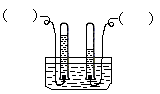
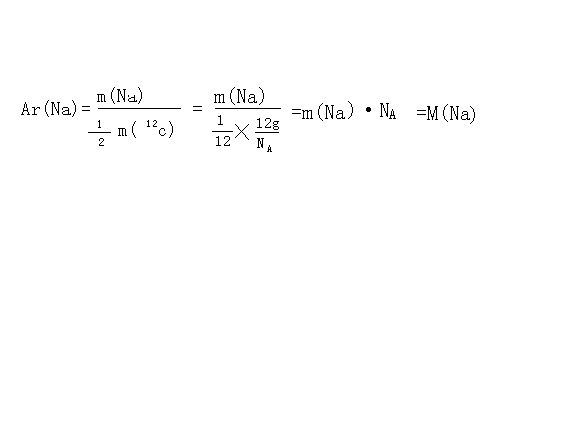阿伏加德罗曾经总结出一条定律,在同温同压下,同体积的任何气体都含有相同的分子数。下图是简易的电解水的装置图: (1)
 shiyun2302022-10-04 11:39:541条回答
shiyun2302022-10-04 11:39:541条回答| 阿伏加德罗曾经总结出一条定律,在同温同压下,同体积的任何气体都含有相同的分子数。下图是简易的电解水的装置图: |
| |
| (1)在图中的括号内标出电源正、负极; (2)与正极相连的试管里产生的气体能使_________________,是__________气,与负极相连的试管里产生的气体能________________,是__________气,它们的分子个数比是:______________________。 |

已提交,审核后显示!提交回复
共1条回复
 晓风和ss 共回答了25个问题
晓风和ss 共回答了25个问题 |采纳率88%- (1)左端为正极
(2)能使带火星木条复燃 ;氧气 ;燃烧 ;氢 ;1:2 - 1年前
相关推荐
- 阿伏加德罗曾经总结出一条定律:在同温、同压下,同体积的任何气体都含有相同的分子数.如图是简易电解水的装置图,试根据观察到
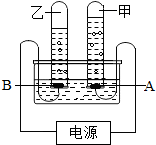 阿伏加德罗曾经总结出一条定律:在同温、同压下,同体积的任何气体都含有相同的分子数.如图是简易电解水的装置图,试根据观察到的实验现象回答下列问题:
阿伏加德罗曾经总结出一条定律:在同温、同压下,同体积的任何气体都含有相同的分子数.如图是简易电解水的装置图,试根据观察到的实验现象回答下列问题:
(1)乙管中生成的气体是______,A电极为电源的______极,甲管中的气体可用______检验.
(2)如果甲管中气体的密度是乙管中气体密度的16倍,则甲管中气体与乙管中气体的质量比是______,分子个数比是______. 西门约翰1年前1
西门约翰1年前1 -
 风中歌铃 共回答了15个问题
风中歌铃 共回答了15个问题 |采纳率86.7%解题思路:本题主要考查电解水实验的现象和结论,解题时要依据所学知识和实验经验来解答,还要通过读题学会提取有用的信息进行推导.在电解水实验中,可观察到的现象有:正极的气体体积少,能使带火星的木条复燃,负极的气体体积多,能燃烧,而且体积多的是少的二倍.根据以上现象可推出正极产生的气体是氧气,负极产生的气体是氢气,还能进一步推出水由氢元素和氧元素组成.(1)通过观察图可以发现:乙管气体多,所收集的气体是氢气,因此B接的是负极,甲管气体少,所收集的气体是氧气,因此A接的是正极,氢气具有可燃性,点燃能燃烧,氧气具有助燃性,能使带火星的木条复燃;
(2)如果设氧气体积是v,密度是d,则氢气的体积就是2v,密度是[1/16]d,那么氧气和氢气的质量比是(v×d):(2v×[1/16]d)=8:1;
由题意知在同温、同压下,同体积的任何气体都含有相同的分子数,即可理解为同温同压下,气体体积越大,所含的分子数越多,因此,氧气和氢气的分子个数比=v:2v=1:2.
故答案是:(1)氢气、正、带火星的木条;
(2)8:1、1:2.点评:
本题考点: 电解水实验.
考点点评: 本题就考查的内容不难,但是根据题中信息进行合理的推导得出结论,相对要难一些,这是一种能力题,同学们要学会读题提取有用的信息.1年前查看全部
- 设 N A 表示阿伏加德罗常数值,下列说法中正确的是( ) A.1mol某气体的体积为22.4L,该气体的状
设 N A 表示阿伏加德罗常数值,下列说法中正确的是( )
A.1mol某气体的体积为22.4L,该气体的状况一定是标准状况 B.工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜小于0.5 N A C.1molCl 2 参加化学反应获得的电子数都是2 N A D.将1molNO 2 气体在降温后颜色变浅,但其所含的分子数仍然为 N A  coffeetime121年前0
coffeetime121年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 设NA表示阿伏加德罗常数值,下列叙述正确的是( )
设NA表示阿伏加德罗常数值,下列叙述正确的是( )
A.常温常压下,56gFe与足量的盐酸完全反应转移的电子数为3NA
B.18gH2O中含有电子数为NA
C.0.1mol•L-1的硫酸铝溶液所含的SO42-数就是0.3NA
D.在常温、常压下,24gO2和O3的混合气体中含有的氧原子数为1.5NA ys62427921年前1
ys62427921年前1 -
 一根小葱 共回答了21个问题
一根小葱 共回答了21个问题 |采纳率90.5%解题思路:A、根据铁与盐酸反应生成的是亚铁离子分析;
B、根据水的质量计算出水的物质的量,再计算出含有的电子数;
C、硫酸铝溶液的体积没有告诉,无法计算硫酸根离子的数目;
D、根据氧气和臭氧中含有的氧原子的质量计算出氧原子的物质的量及数目.A、56g铁的物质的量为1mol,与足量的盐酸反应生成1mol亚铁离子,失去2mol电子,转移的电子数为2NA,故A错误;
B、18g水的物质的量为1mol,1mol水中含有10mol电子,含有电子数为10NA,故B错误;
C、0.1mol•L-1的硫酸铝溶液的体积不知道,无法计算硫酸根离子的物质的量及数目,故C错误;
D、24g氧气和臭氧中含有24g氧原子,含有氧原子的物质的量为1.5mol,含有的氧原子数为1.5NA,故D正确;
故选D.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意铁与盐酸反应生成的是亚铁离子,阿伏加德罗常数是高考的“热点”,既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
- 科学家道尔顿和阿伏加德罗经过研究,得出一个重要的结论:物质是由______和______构成的,______和_____
科学家道尔顿和阿伏加德罗经过研究,得出一个重要的结论:物质是由______和______构成的,______和______是化学变化的基础,在化学变化中______会破裂,而______不会破裂,但可以重新组成______.
 youzili1年前1
youzili1年前1 -
 深秋的日子 共回答了21个问题
深秋的日子 共回答了21个问题 |采纳率90.5%物质是由___分子___和___原子___构成的,___分子的拆分___和__原子的重新组合____是化学变化的基础,在化学变化中___分子___会破裂,而___原子___不会破裂,但可以重新组成___分子___.1年前查看全部
- (2009·江苏模拟)阿伏加德罗曾经总结出一条定律:在同温同压下,同体积的任何气体都含有相同的分子数。右图是实验室电解水
(2009·江苏模拟)阿伏加德罗曾经总结出一条定律:在同温同压下,同体积的任何气体都含有相同的分子数。右图是实验室电解水的简易装置示意图。
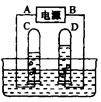
①接通直流电源后,B电极为电源的______极,C管中的气体是_____气
②C、D两试管内气体的体积比为____________。
③电解水反应的化学方程式: 。
④水电解过程中,发生变化的微粒是 ,不发生变化的微粒是 和 。(均填名称) yy得rr1年前1
yy得rr1年前1 -
 gty56ewhege 共回答了20个问题
gty56ewhege 共回答了20个问题 |采纳率100%1年前查看全部
- 能表示阿伏加德罗常数数值的是( )
能表示阿伏加德罗常数数值的是( )
A. 1 mol 金属钠含有的电子数
B. 标准状况下,22.4 L 苯所含的分子数
C. 0.012 kg 12C所含的原子数
D. 1 L 1 mol•L-1硫酸溶液所含的H+数 sss41年前4
sss41年前4 -
 Prosnan 共回答了22个问题
Prosnan 共回答了22个问题 |采纳率90.9%解题思路:A.钠原子含有11个电子,1mol钠原子中含有11mol电子;
B.标准状况下,苯的状态为液体,不能使用标况下的气体摩尔体积计算其物质的量;
C.0.012kg12C的物质的量为1mol,含有阿伏伽德罗常数个碳原子;
D.先计算出硫酸的物质的量,1mol硫酸在溶液中电离出2mol氢原子.A.1mol钠原子中含有11mol电子,不能表示阿伏加德罗常数数值,故A错误;
B.标况下苯不是气体,22.4L苯的物质的量不是1mol,不能表示阿伏加德罗常数数值,故B错误;
C.0.012 kg 12C所含的原子数为阿伏伽德罗常数个碳原子,能表示阿伏加德罗常数数值,故C正确;
D.1 L 1 mol•L-1硫酸溶液中含有1mol硫酸,1mol硫酸在溶液中电离出2mol氢离子,不能表示阿伏加德罗常数数值,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数,题目难度不大,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确阿伏伽德罗常数的概念及表示的意义.1年前查看全部
- 设Na为阿伏加德罗常数值,下列叙述中正确的是 :A .1L0.5mol.L-1Na2CO3溶液中含有的CO32-数目为0
设Na为阿伏加德罗常数值,下列叙述中正确的是 :A .1L0.5mol.L-1Na2CO3溶液中含有的CO32-数目为0.5NA
B.常温下14g由乙烯和丙烯组成的混合物中总原子数为3NA
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3NA
D.4.5gSiO2晶体中含有氧原子数目为0.3NA 张ai1981年前1
张ai1981年前1 -
 U精灵 共回答了18个问题
U精灵 共回答了18个问题 |采纳率100%A错 考虑到碳酸根的水解
B对 因为C H比相同
C错 没有说明是浓硝酸还是稀硝酸
D错、、这个算算就知道了1年前查看全部
- N A 为阿伏加德罗常数下列说法正确的是( ) A.1mol/L的氯化钠溶液中钠离子的个数为N A B.依据阿伏加德罗
N A 为阿伏加德罗常数下列说法正确的是( ) A.1mol/L的氯化钠溶液中钠离子的个数为N A B.依据阿伏加德罗定律,同温同体积F两种气体的物质的量之比等于压强之比 C.在标准状况下,1L辛烷完全燃烧,所生成气态产物的分子数为
N A8 22.4 D.常温常压下,1mol氦气含有核外电子数为4N A  杀了我去喂猪1年前1
杀了我去喂猪1年前1 -
 光着脚丫儿 共回答了20个问题
光着脚丫儿 共回答了20个问题 |采纳率85%A、没有告诉1mol/L的氯化钠溶液的体积,无法计算溶液中钠离子的个数,故A错误;
B、由PV=nRT可知,相同温度下,同体积的两种气体的物质的量之比等于气体的压强之比,故B正确;
C、标况下,辛烷不是气体,题中条件无法计算1L辛烷的物质的量,故C错误;
D、1mol氦气中含有1mol氦原子,含有2mol核外电子,含有核外电子数为2N A ,故D错误;
故选B.1年前查看全部
- 阿伏加德罗曾经总结出一条重要定律:同温同压下,同体积的任何气体含有相同数目的分子,如图是电解水的简易装置.
阿伏加德罗曾经总结出一条重要定律:同温同压下,同体积的任何气体含有相同数目的分子,如图是电解水的简易装置.
(1)电极A为______极,电解水时通常在水中加入适量的氢氧化钠(或硫酸),其目的是______.
(2)C试管中收集到的气体是______用______检验.
(3)C、D中两种气体的分子个数比为______质量比是______.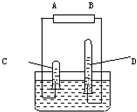
 vink_ly1年前1
vink_ly1年前1 -
 酶苷驹WA 共回答了17个问题
酶苷驹WA 共回答了17个问题 |采纳率88.2%(1)通过观察图可以发现:C管气体少,所收集的气体是氧气,因此电极A是正极;电解水时通常在水中加入适量的氢氧化钠(或硫酸),其目的是增强导电性;
(2)C管气体少,所收集的气体是氧气,氧气具有助燃性,能使带火星的木条复燃;
(3)由题意知在同温、同压下,同体积的任何气体都含有相同的分子数,因此氧气和氢气的分子个数比等于其体积之比,等于1:2;质量比是(1×32):(2×2)=8:1.
故答案为:(1)正;增强导电性;(2)氧气;带火星的木条;(3)1:2;8:1.1年前查看全部
- 设N A 表示阿伏加德罗常数值,下列叙述正确的是( ) A.5.6g铁与足量氯气完全反应时失去的电子数目为0.2N A
设N A 表示阿伏加德罗常数值,下列叙述正确的是( ) A.5.6g铁与足量氯气完全反应时失去的电子数目为0.2N A B.11.2L H 2 中含有的电子数为1N A C.标准状况下,2.24L水中含有水分子0.1N A D.16g氧气和16g臭氧含有的氧原子数均为1N A  ybulongd1年前1
ybulongd1年前1 -
 fanyunzhi 共回答了13个问题
fanyunzhi 共回答了13个问题 |采纳率92.3%A、铁与氯气反应生成氯化铁,5.6g铁与足量氯气完全反应时失去的电子数目为0.3N A ,故A错误.
B、气体摩尔体积V m =22.4L/mol的使用条件为标准状况,未指明条件,故B错误.
C、标准状况下,水是液体,不能使用气体气体摩尔体积V m =22.4L/mol,2.24L水的物质的量不是0.1mol,故C错误.
D、氧气和臭氧都是由氧原子构成,质量相等,氧原子数目相等,故D正确.
故选D.1年前查看全部
- 阿伏加德罗的推论.将下列公式,推理的“过程”写出来
阿伏加德罗的推论.将下列公式,推理的“过程”写出来
推论“同温同压下,气体的体积之比等于其物质的量之比”.V1/V2=n1/n2
推论“同温同体积下,气体的压强之比等于其物质的量之比”.p1/p2=n1/n2
推论“同温同压下,相同体积的任何气体的质量之比等于其摩尔质量之比”m1/m2=M1/M2
推论“同温同压下,任何气体的密度之比等于其摩尔质量之比”p1/p2=M1/M2
推论“同温同物质的量的气体,压强之比等于体积的反比” p1/p2=V2/V1 眼波过处自有柔情1年前2
眼波过处自有柔情1年前2 -
 小强特攻队 共回答了21个问题
小强特攻队 共回答了21个问题 |采纳率100%基本公式 PV=nRT 下标分别为1,2
同温同压下 T1=T2,P1=P2,则 V与n成正比 所以V1/V2=n1/n2
同温同体下 T1=T2,V1=V2,则P和n成正比 p1/p2=n1/n2
同温同压下 变形上公式 PV=(m/M)RT 其他同理
以下两一样的啊 应该会了吧 加油啊!1年前查看全部
- 含有阿伏加德罗常数个氧原子的水的物质的量是1摩尔.这句话对吗?
 九尾发条橙1年前6
九尾发条橙1年前6 -
 tiankong_li 共回答了16个问题
tiankong_li 共回答了16个问题 |采纳率75%对1年前查看全部
- 阿伏加德罗的定律推论.那些体积,物质的量,摩尔体积,压强等的一些量,他们之间的正比,反比关系有什么特殊记法,或者口诀?
 onisho1年前1
onisho1年前1 -
 abc1898108 共回答了14个问题
abc1898108 共回答了14个问题 |采纳率78.6%就是几个公式的运用,不需要什么口诀吧!而且这些公式你也没必要一次记完,比如说,你在平时做题的时候,公式忘了,问一下同学,或者翻一下书,只需一次,就记住了.
阿伏伽德罗定律 PV=nRT n=m/M n=cv n=N/NA 推论你就用这几个公式去用就行了.比如,你要找压强与物质的量的关系,那么肯定是恒温恒容,用第一个公式去比就行了.(R为常数)1年前查看全部
- 设N A 表示阿伏加德罗常数值,下列叙述正确的是( ) A.N A 个氧气分子和N A 个氢气分子的质量比为16:1
设N A 表示阿伏加德罗常数值,下列叙述正确的是( ) A.N A 个氧气分子和N A 个氢气分子的质量比为16:1 B.标准状况下,22.4LH 2 O含有的分子数为N A C.11.2L 氯气中含有的原子数为N A 个 D.2L 1mol/L Na 2 SO 4 溶液中Na + 离子数为2N A 个  曾经还是现在1年前1
曾经还是现在1年前1 -
 和南里工 共回答了17个问题
和南里工 共回答了17个问题 |采纳率88.2%A.分子数相同的氧气和氢气的物质的量相等,氧气的摩尔质量是32g/mol,氢气的摩尔质量是2g/mol,结合m=nM知,二者质量质量比为16:1,故A正确;
B.标况下,水是液体,气体摩尔体积对其不适用,所以22.4LH 2 O含有的分子数不是N A ,故B错误;
C.温度和压强未知,所以气体摩尔体积未知,导致无法计算氯气的物质的量,故C错误;
D.2L1mol/L Na 2 SO 4 溶液中Na + 离子数为4N A 个,故D错误;
故选A.1年前查看全部
- 十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出了分子概念,认为
十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出了分子概念,认为
1、一切物质都是由分子组成的;2、分子由原子构成;3、分子之间是有间隔的;4、分子是保持物质化学性质的最小微粒;5、分子的质量等于构成分子的各原子的质量之和;6、分子在不停的运动.从你所学的知识看,上述观点中存在明显不足的是()
A、1、4 B、3、5 C、1、2、5 D、4、5、6
(最好有解析) 你坟旁是我1年前1
你坟旁是我1年前1 -
 liaheys 共回答了21个问题
liaheys 共回答了21个问题 |采纳率95.2%A,物质不仅由分子构成,还有原子,离子.所以1错.分子是其中一种微粒,所以由原子构成的,由离子构成的乌骓,原子离子也能保持物质化学性质1年前查看全部
- 设NA表示阿伏加德罗常数值,下列叙述正确的是( )
设NA表示阿伏加德罗常数值,下列叙述正确的是( )
A. NA个氧分子和NA个氢分子的质量比等于8:1
B. 11.2L H2中含有的原子数为NA个
C. 54g H2O中含有分子数为3NA个
D. 1mol/L Na2SO4溶液中离子数为3NA个 简单451年前2
简单451年前2 -
 kentuky 共回答了10个问题
kentuky 共回答了10个问题 |采纳率90%解题思路:A、NA个氧分子和NA个氢分子的物质的量都为0.5mol,根据m=nM计算出二者质量比;
B、没有告诉是标况下,不能使用标况下的气体摩尔体积计算氢气的物质的量;
C、54g水的物质的量为:[54g/18g/mol]=3mol;
D、没有告诉硫酸钠溶液的体积,无法计算溶液中离子数目.A、氧气和氢气都为双原子分子,NA个氧分子和NA个氢分子的物质的量都为0.5mol,根据m=nM可知,二者质量比就等于其摩尔质量之比,即质量比为:32g/mol:2g/mol=16:1,故A错误;
B、不是标准状况下,题中条件无法计算11.2L氢气的物质的量及原子数,故B错误;
C、54g水的物质的量为3mol,3mol水中含有分子数为3NA个,故C正确;
D、没有告诉1mol/L Na2SO4溶液的体积,无法计算溶液中离子的物质的量及数目,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握阿伏伽德罗常数与物质的量之间的转化;选项D为易错点,注意题中数据情况.1年前查看全部
- (4v11•甘肃)阿伏加德罗曾经总结出一条定律:在同温同压个,同体积的任何气体都含有相同的分子数.如图是实验室电解水的简
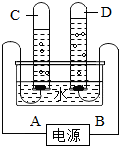 (4v11•甘肃)阿伏加德罗曾经总结出一条定律:在同温同压个,同体积的任何气体都含有相同的分子数.如图是实验室电解水的简易装置示意图.
(4v11•甘肃)阿伏加德罗曾经总结出一条定律:在同温同压个,同体积的任何气体都含有相同的分子数.如图是实验室电解水的简易装置示意图.
①接通直流电源后,B电极为电源的______极,C管中的气体是______气.
②C、D两试管内气体的分子个数比为______.
③电解水反应的化学方程式:4H4O
4H4↑+O4↑通电 .4H4O.
4H4↑+O4↑通电 .
④水电解的过程中,发生变化的微粒是______(填名称,个同),不发生变化的微粒是______和______. 闪电种子101年前1
闪电种子101年前1 -
 心静如烟 共回答了14个问题
心静如烟 共回答了14个问题 |采纳率92.9%解题思路:由电解水生成气体是“负氢正氧”,且氧气与氢气的体积比是1:2,结合图示所示的气体体积进行分析有关的问题.再根据分子、原子在化学变化中变化,分析在水电解过程中微粒的变化.①由电解水的简易装置示意图可知,九试管右收集的气体较少是氧气,应是电源的正极产生的气体,所以,B电极为电源的正极.则C管右的气体是氢气.
②由电解水的简易装置示意图可知,C、九两试管内气体的分别是氢气和氧气,体积比为个:1.
③电解水生成了氢气和氧气,反应的化学方程式:个H个O
通电
.
个H个↑+O个↑;
④由于分子在化学变化右能再分,原子不能再分,所以,水电解过程右,发生变化的微粒是水分子,不发生变化的微粒是氢原子和氧原子.
故答案为::①正,氢;
②个:1;
③个H个O
通电
.
个H个↑+O个↑;
④水分子;氢原子;氧原子.点评:
本题考点: 电解水实验;书写化学方程式、文字表达式、电离方程式.
考点点评: 要熟记正氧负氢,氢二氧一,电解水实验得到的结论有:水是由氢元素和氧元素组成等,以上这些常是解决此类题的关键.1年前查看全部
- 设NA为阿伏加德罗常数值,下列说法中正确的是( )
设NA为阿伏加德罗常数值,下列说法中正确的是( )
A.氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子
B.25℃,1.01×105Pa,64gS02中含有的原子数为3NA
C.NA个一氧化碳分子和0.5mol甲烷(CH4)的质量比为7:4
D.标准状况下,11.2L氦气所含的原子数为NA 月芽儿20041年前1
月芽儿20041年前1 -
 tt代言谁谁谁 共回答了16个问题
tt代言谁谁谁 共回答了16个问题 |采纳率93.8%解题思路:A、氯气参加的反应,分为只做氧化剂和既是氧化剂也是还原剂两种情况;
B、根据二氧化硫的质量计算出物质的量及含有的原子数;
C、计算出一氧化碳的物质的量和质量、甲烷的质量,再判断二者质量之比;
D、稀有气体为单原子分子,1mol氦气含有1mol原子.A、7.1g氯气的物质的量为1mol.氯气与金属单质的反应,1mol氯气转移2mol电子;氯气与氢氧化钠溶液的反应,1mol氯气转移了1mol电子,所以氯气参加的氧化还原反应中,若消耗7.1g Cl2,转移的电子数不一定为0.2NA,故A错误;
B、64g二氧化硫的物质的量为1mol,含有3mol原子,含有的原子数为3NA,故B正确;
C、NA个一氧化碳分子的物质的量为1mol,质量为28g;0.5mol甲烷(CH4)的质量为8g,二者质量之比为28:8=7:2,故C错误;
D、标准状况下,11.2L氦气的物质的量为0.5mol,含有0.5mol氦原子,所含的原子数为0.5NA,故D错误;
故选B.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意稀有气体为单原子分子,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
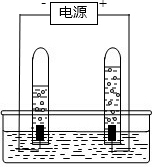
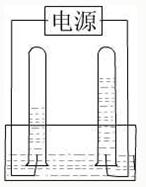
- 阿伏加德罗曾经总结出一条定律:同温、同压下,同体积的任何气体都含有相同的分子数.右图是电解水的简易装置图.
 阿伏加德罗曾经总结出一条定律:同温、同压下,同体积的任何气体都含有相同的分子数.右图是电解水的简易装置图.
阿伏加德罗曾经总结出一条定律:同温、同压下,同体积的任何气体都含有相同的分子数.右图是电解水的简易装置图.
(1)在图的括号中标出电源的正极和负极(用“+”、“-”表示)
(2)与正极相连的试管里产生的是氧气氧气气;与负极相连的试管中产生的是氢气氢气气;这两种气体的分子个数比是1:21:2.
(3)怎样用实验的方法证明这两种气体.
(4)通过以上实验可说明水由氢元素和氧元素氢元素和氧元素组成. metalmood1年前1
metalmood1年前1 -
 我不是栋梁 共回答了23个问题
我不是栋梁 共回答了23个问题 |采纳率91.3%(1)由正氧负氢,氢二氧一,可知左边为负极,右边为正极;
(2)正极产生的气体体积少为氧气,负极产生的气体体积多为氢气,氧气和氢气分子的个数比为1:2;
(3)证明氧气用带火星的木条,能够复燃即可,证明氢气用燃着的木条,能够燃烧,产生淡蓝色火焰即可;
(4)电解水生成了氢气和氧气,所以说明水是由氢元素和氧元素组成的.
故答案为:(1)左边为负极,右边为正极;
(2)氧气,氢气,1:2;
(3)用带火星的木条,能够复燃是氧气,用燃着的木条,能够燃烧,产生淡蓝色火焰是氢气;
(4)氢元素和氧元素.1年前查看全部
- 某气体的摩尔质量为M,分子个数为X,在标况下所占的体积是V,质量是m;某元素原子的摩尔质量是A,原子个数为y;阿伏加德罗
某气体的摩尔质量为M,分子个数为X,在标况下所占的体积是V,质量是m;某元素原子的摩尔质量是A,原子个数为y;阿伏加德罗常数为NA,说明下列各式表示的意义:
1.M除以NA
2.X除以NA
3.A除以NA
4.y除以NA
5.m除以V
6.m除以M sibyllyy1年前1
sibyllyy1年前1 -
 qiaoqiaozhouzhou 共回答了12个问题
qiaoqiaozhouzhou 共回答了12个问题 |采纳率83.3%1.M除以NA :一个分子的质量
2.X除以NA :该气体的物质的量
3.A除以NA :该元素一个原子的质量
4.y除以NA :该原子的物质的量
5.m除以V :标况下气体的密度
6.m除以M:该气体的物质的量1年前查看全部
- 下列科学家中,主要贡献不是在化学领域的科学家是( ) A.牛顿 B.道尔顿 C.阿伏加德罗 D.门捷列夫
 aihe25081年前1
aihe25081年前1 -
 lidtin 共回答了28个问题
lidtin 共回答了28个问题 |采纳率89.3%A、牛顿是著名的物理学家,主要贡献是在力学方面,不是在化学领域.
B、道尔顿在化学上的主要贡献是提出了原子学说,主要贡献是在化学领域,故选项错误.
C、阿伏加德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说,主要贡献是在化学领域.
D、门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,主要贡献是在化学领域.
故选A.1年前查看全部
- 阿伏加德罗曾经总结出一条定律:在同温同压下,相同体积的任何气体都含有相同的分子数.下图是简易电解水的装置图. (1
阿伏加德罗曾经总结出一条定律:在同温同压下,相同体积的任何气体都含有相同的分子数.下图是简易电解水的装置图. 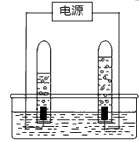
(1)在图上标出电源的正极和负极(用“+”和“-”表示)
(2)与正极相连的试管里产生的气体是____气,与负极相连的试管里产生的气体是____气;分子个数比是____.
(3)由电解水实验可知:水是由____组成的.
(4)实验过程中发现,产生氢气和氧气的体积比比理论值大,你认为可能的原因是____(填一点即可). 髝薾1年前1
髝薾1年前1 -
 jerryraul 共回答了21个问题
jerryraul 共回答了21个问题 |采纳率85.7%(1)右“-” 左“+”
(2)氧气 ;氢气 ;1:2
(3)氢元素和氧元素
(4)氧气比氢气溶于水的能力强或生成的氧气与金属电极发生了氧化反应而被消耗1年前查看全部
- 有关阿伏加德罗的假说的题实验证明:在同温同压下,相同体积的任何气体中含有的分子数相同,则在同温同压下,相同体积的CO2和
有关阿伏加德罗的假说的题
实验证明:在同温同压下,相同体积的任何气体中含有的分子数相同,则在同温同压下,相同体积的CO2和CH4的质量比是_____,所含碳元素的质量比是_____. chen19x1年前1
chen19x1年前1 -
 zytx007 共回答了16个问题
zytx007 共回答了16个问题 |采纳率100%答案:11:4 1:1
同温同压下,相同体积的CO2和CH4所含有的分子数目相同,也就是说它们的“物质的量”(设为n)相同,进一步得质量比就等于物质的量乘以它们的相对分子质量之比,即M1:M2=(n*44)/(n*16)=11:4;
所含碳元素的质量比=所含碳原子的个数比=两气体分子的个数比=体积比=1:11年前查看全部
- 设N A 为阿伏加德罗常的数值,下列说法正确的是( ) A.常温常压下,16gO 3 气体含有氧原子数为N A B.标
设N A 为阿伏加德罗常的数值,下列说法正确的是( ) A.常温常压下,16gO 3 气体含有氧原子数为N A B.标准状况下,44.8L四氯化碳含有的分子数为2N A C.0.1mol•L -1 氯化铝溶液中含有Al 3+ 数为0.1N A D.2.4g金属镁变为镁离子时失去的电子数为0.1N A  kue781年前1
kue781年前1 -
 唯一清凉爽 共回答了13个问题
唯一清凉爽 共回答了13个问题 |采纳率84.6%A、常温常压下,16gO 3 气体物质的量=
16g
48g/mol ,含有氧原子数=
16
48 ×3×N A =N A ,故A正确;
B、标准状况四氯化碳不是气体,44.8L四氯化碳物质的量不是2mol,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、2.4g金属镁物质的量=
2.4g
24g/mol =0.1mol,变为镁离子时失去的电子数为0.2N A ,故D错误;
故选A.1年前查看全部
- 天天就是物质的量、量浓度,什么摩尔质量,阿伏加德罗定理及其推论,上课都糊里糊涂的,怎么办?有谁能告诉我阿伏加德罗定理的推
天天就是物质的量、量浓度,什么摩尔质量,阿伏加德罗定理及其推论,上课都糊里糊涂的,怎么办?有谁能告诉我阿伏加德罗定理的推论和常数,还有就是守恒有什么守恒?
 liurongfang181年前4
liurongfang181年前4 -
 cobrahunter 共回答了21个问题
cobrahunter 共回答了21个问题 |采纳率90.5%1.内容:在同温同压下,同体积的气体含有相等的分子数.即“三同”定“一等”.
2.推论
(1)同温同压下,V1/V2=n1/n2
(2)同温同体积时,p1/p2=n1/n2=N1/N2
(3)同温同压等质量时,V1/V2=M2/M1
(4)同温同压同体积时,M1/M2=ρ1/ρ2
注意:
(1)阿伏加德罗定律也适用于混合气体.
(2)考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3、乙醇等.
(3)物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2双原子分子.胶体粒子及晶体结构:P4、金刚石、石墨、二氧化硅等结构.
(4)要用到22.4L·mol-1时,必须注意气体是否处于标准状况下,否则不能用此概念;
(5)某些原子或原子团在水溶液中能发生水解反应,使其数目减少;
(6)注意常见的的可逆反应:如NO2中存在着NO2与N2O4的平衡;
(7)不要把原子序数当成相对原子质量,也不能把相对原子质量当相对分子质量.
(8)较复杂的化学反应中,电子转移数的求算一定要细心.如Na2O2+H2O;Cl2+NaOH;电解AgNO3溶液等.
例题:下列说法正确的是(NA表示阿伏加德罗常数)()
⑴常温常压下,1mol氮气含有NA个氮分子
⑵标准状况下,以任意比例混合的甲烷和丙烷混合气体22.4L,所含的气体的分子数约为NA个
⑶标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个
⑷将NO2和N2O4分子共NA个降温至标准状况下,其体积为22.4L
⑸常温下,18g重水所含中子数为10NA个
⑹常温常压下,1mol氦气含有的核外电子数为4NA
⑺常温常压下,任何金属和酸反应,若生成2g 氢气,则有2NA电子发生转移
⑻标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为
⑼31g白磷分子中,含有的共价单键数目是NA个
⑽1L1 mol?L-1的氯化铁溶液中铁离子的数目为NA
【点拨】⑴正确,1mol氮气的分子数与是否标准状况无关.
⑵正确,任意比例混合的甲烷和丙烷混合气体 22.4L,气体的总物质的量为1mol,因此含有NA个分子.
⑶不正确,因为NO和氧气一接触就会立即反应生成二氧化氮.
⑷不正确,因为存在以下平衡:2NO2 N2O4(放热),降温,平衡正向移动,分子数
少于1mol,标准状况下,其体积小于22.4L
⑸不正确,重水分子(D2O)中含有10个中子,相对分子质量为 20,18g重水所含中子数为:10×18g/20g· mol-1=9mol. w.w.w.k.s.5.u.c.o.m
⑹正确,1个氦原子核外有4个电子,氦气是单原子分子,所以1mol氦气含有4mol
电子,这与外界温度和压强无关.
⑺正确,不论在任何条件下,2g氢气都是1mol,无论什么金属生成氢气的反应均可表示为:2H++2e=H2↑,因此,生成1mol氢气一定转移 2mol电子.
⑻不正确,标准状况下,辛烷是液体,不能使用标准状况下气体的摩尔体积22.4L/mol这一量,所以1L辛烷的物质的量不是1/22.4mol.
⑼不正确,白磷分子的分子式为P4,其摩尔质量为124g/mol,31g白磷相当于0.25mol,
白磷的分子结构为正四面体,一个白磷分子中含有6个P-P共价键,所以,0.25mol白磷中含有1.5NA个P-P共价键.
⑽不正确,Fe3+在溶液中水解.
本题答案为⑴⑵⑹⑺1年前查看全部
- 设N A 表示阿伏加德罗常数值,下列叙述正确的是( ) A.N A 个氧气分子和N A 个氢气分
设N A 表示阿伏加德罗常数值,下列叙述正确的是( )
A.N A 个氧气分子和N A 个氢气分子的质量比为16∶1 B.54g H 2 O中含有的水分子数为3N A 个 C.11.2L 氯气中含有的原子数为N A 个 D.2L 1mol/L Na 2 SO 4 溶液中Na + 离子数为2N A 个  zxw51961年前1
zxw51961年前1 -
 _鲛人泪_ 共回答了19个问题
_鲛人泪_ 共回答了19个问题 |采纳率89.5%AB
在相同条件下,气体的分子数之比是物质的量之比,所以A正确。54g水是3mol,B正确。C中没有指明温度和压强,不正确,D中应该是4N A 个,答案选AB。1年前查看全部
- 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs + 离子核间距为a cm,氯化铯的摩尔质量为M,N A 为 阿伏加德罗
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs + 离子核间距为a cm,氯化铯的摩尔质量为M,N A 为 阿伏加德罗常数,则氯化铯晶体的密度为( )

A. 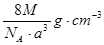
B. 
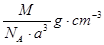
C. 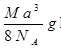
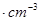
D. 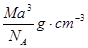
 木每三青1年前1
木每三青1年前1 -
 我不是张韶涵 共回答了11个问题
我不是张韶涵 共回答了11个问题 |采纳率81.8%B
1年前查看全部
- 设钠原子的质量为m(Na),12C原子的质量为m(12C),阿伏加德罗NA.证明钠的相对原子质量等于钠的摩尔质量
设钠原子的质量为m(Na),12C原子的质量为m(12C),阿伏加德罗NA.证明钠的相对原子质量等于钠的摩尔质量
用数学和概念证明钠的相对原子质量等于钠的摩尔质量 还是要谢谢侬1年前4
还是要谢谢侬1年前4 -
 wwcom1975 共回答了19个问题
wwcom1975 共回答了19个问题 |采纳率89.5%1年前查看全部
- 已知水的摩尔质量是18g/mol,若1g水中含m个水分子,则阿伏加德罗常数值可表示为
 猛ll熏蚊子1年前1
猛ll熏蚊子1年前1 -
 flyorcru 共回答了21个问题
flyorcru 共回答了21个问题 |采纳率81%1g水中含m个水分子
18g水中含18m个水分子
则阿伏加德罗常数值可表示为18m1年前查看全部
- 阿伏加德罗曾经总结出下列一条定律:“在同温同压下,同体积的任何气体都含有相同数量的分子.”请看图简易电解水的装置,回答下
 阿伏加德罗曾经总结出下列一条定律:“在同温同压下,同体积的任何气体都含有相同数量的分子.”请看图简易电解水的装置,回答下列问题:
阿伏加德罗曾经总结出下列一条定律:“在同温同压下,同体积的任何气体都含有相同数量的分子.”请看图简易电解水的装置,回答下列问题:
(1)指出电源的“正”、“负”极.
A为______,B为______.
(2)C管中产生的是______,D管产生的是______.C、D两管中气体的体积比为______,分子个数之比是______.
(3)写出水电解的化学方程式(或文字表达式、符号表达式):2H2O
2H2↑+O2↑通电 .2H2O,由上面的实验事实得出结论:说明水是由______组成的.
2H2↑+O2↑通电 . gaoliguan1年前1
gaoliguan1年前1 -
 sunshine770513 共回答了23个问题
sunshine770513 共回答了23个问题 |采纳率87%解题思路:在电解水实验中,可观察到的现象有:正极的气体体积少,能使带火星的木条复燃,负极的气体体积多,能燃烧,而且体积多的是少的二倍.根据以上现象可推出正极产生的气体是氧气,负极产生的气体是氢气,还能进一步推出水由氢元素和氧元素组成.(1)由电解水的实验装置可知,C试管收集的气体较多是氢气,是电源的负极产生的气体,故A为负极;D试管收集的气体较少是氧气,是电源的正极产生的气体,故B为正极.
(2)由上述分析可知,C管中产生的是氢气,D管产生的是氧气.C、D两管中气体的体积比为2:1,由于在同温同压下,同体积的任何气体都含有相同数量的分子所以,所以,分子个数之比是2:1.
(3)电解水生成了氢气和氧气,反应的化学方程式是:2H2O
通电
.
2H2↑+O2↑,由上面的实验事实得出结论:说明水是由氢元素、氧元素组成的.
故答为:(1)负,正;(2)氢气,氧气.2:1,2:1; (3)2H2O
通电
.
2H2↑+O2↑,氢元素、氧元素.点评:
本题考点: 电解水实验;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题就考查的内容不难,但是根据题中信息进行合理的推导得出结论,相对要难一些,这是一种能力题,同学们要学会读题提取有用的信息.1年前查看全部
- 阿伏加德罗曾经总结出一条定律:同温、同压下,同体积的任何气体都含有相同的分子数.右图是电解水的简易装置图.
阿伏加德罗曾经总结出一条定律:同温、同压下,同体积的任何气体都含有相同的分子数.右图是电解水的简易装置图.
(1)在图的括号中标出电源的正极和负极(用“+”、“-”表示)
(2)与正极相连的试管里产生的是______气;与负极相连的试管中产生的是______气;这两种气体的分子个数比是______.
(3)怎样用实验的方法证明这两种气体.
(4)通过以上实验可说明水由______组成. xueyuzhui1年前1
xueyuzhui1年前1 -
 yuyinghai 共回答了13个问题
yuyinghai 共回答了13个问题 |采纳率69.2%解题思路:熟记电解水的实验现象和结论,气体的验证方法.(1)由正氧负氢,氢二氧一,可知左边为负极,右边为正极;
(2)正极产生的气体体积少为氧气,负极产生的气体体积多为氢气,氧气和氢气分子的个数比为1:2;
(3)证明氧气用带火星的木条,能够复燃即可,证明氢气用燃着的木条,能够燃烧,产生淡蓝色火焰即可;
(4)电解水生成了氢气和氧气,所以说明水是由氢元素和氧元素组成的.
故答案为:(1)左边为负极,右边为正极;
(2)氧气,氢气,1:2;
(3)用带火星的木条,能够复燃是氧气,用燃着的木条,能够燃烧,产生淡蓝色火焰是氢气;
(4)氢元素和氧元素.点评:
本题考点: 电解水实验;水的组成.
考点点评: 熟记正氧负氢,氢二氧一,电解水能够获得的结论.1年前查看全部
- 下列说法正确的是( ) A.32gO 2 占有的体积约为22.4L B.28gN 2 和CO的混合气体共含阿伏加德罗常
下列说法正确的是( ) A.32gO 2 占有的体积约为22.4L B.28gN 2 和CO的混合气体共含阿伏加德罗常数个分子 C.在标准状况下,22.4L水的质量约为18g D.22g二氧化碳与标准状况下11.2LHCl含有相同的原子数  风约湘君1年前1
风约湘君1年前1 -
 bluxwell 共回答了18个问题
bluxwell 共回答了18个问题 |采纳率94.4%A.没有明确气体存在的状态是否标准状况下,则32gO 2 占有的体积不一定为22.4L,故A错误;
B.N 2 和CO的相对分子质量都为28,则28gN 2 和CO的混合气体共1mol,含阿伏加德罗常数个分子,故B正确;
C.标准状况下,水为液态,22.4L水的质量约为22.4kg,故C错误;
D.22g二氧化碳的物质的量为0.5mol,含有1.5mol原子,11.2LHCl的物质的量为0.5mol,含有1mol原子,二者原子数不等,故D错误.
故选B.1年前查看全部
- N A 代表阿伏加德罗常数值,下列说法正确的是 A.78gNa 2 O 2 所含有的离子数为3 N A B.1mol甲基
N A 代表阿伏加德罗常数值,下列说法正确的是
A.78gNa 2 O 2 所含有的离子数为3 N A B.1mol甲基中含有电子数为10 N A C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2 N A D.1molC 10 H 22 分子中共价键总数为22 N A  huolianghao1年前0
huolianghao1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 阿伏加德罗曾经总结出一条重要定律:同温同压下,同体积的任何气体含有相同数目的分子,如图是电解水的简易装置.
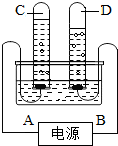 阿伏加德罗曾经总结出一条重要定律:同温同压下,同体积的任何气体含有相同数目的分子,如图是电解水的简易装置.
阿伏加德罗曾经总结出一条重要定律:同温同压下,同体积的任何气体含有相同数目的分子,如图是电解水的简易装置.
(1)电极A为______极,电解水时通常在水中加入适量的氢氧化钠(或硫酸),其目的是______.
(2)C试管中收集到的气体是______用______检验.
(3)C、D中两种气体的分子个数比为______质量比是______. 谁执彩旗当空舞1年前1
谁执彩旗当空舞1年前1 -
 zzlba 共回答了18个问题
zzlba 共回答了18个问题 |采纳率88.9%解题思路:由电解水生成气体是“负氢正氧”,且氧气与氢气的体积比是1:2,质量比是8:1,氧气用带火星的木条检验,结合图示所示的气体体积进行解题即可.(1)通过观察图可以发现:C管气体少,所收集的气体是氧气,因此电极A是正极;电解水时通常在水中加入适量的氢氧化钠(或硫酸),其目的是增强导电性;
(2)C管气体少,所收集的气体是氧气,氧气具有助燃性,能使带火星的木条复燃;
(3)由题意知在同温、同压下,同体积的任何气体都含有相同的分子数,因此氧气和氢气的分子个数比等于其体积之比,等于1:2;质量比是(1×32):(2×2)=8:1.
故答案为:(1)正;增强导电性;(2)氧气;带火星的木条;(3)1:2;8:1.点评:
本题考点: 电解水实验.
考点点评: 要熟记“正氧负氢,氢二氧一”,电解水实验得到的结论有:水是由氢元素和氧元素组成等,以上这些常是解决此类题的关键.1年前查看全部
- 哪位科学家和阿伏加德罗提出原子论和分子学说
 97453efe140235ba1年前1
97453efe140235ba1年前1 -
 sherdan 共回答了9个问题
sherdan 共回答了9个问题 |采纳率88.9%道尔顿和阿伏加德罗1年前查看全部
- 阿伏加德罗与分子学说他提出的分子学说的大致内容是什么?原子-分子学说又是什么?
 风雨同舟20461年前1
风雨同舟20461年前1 -
 hadau 共回答了20个问题
hadau 共回答了20个问题 |采纳率90%1811年,阿伏加德罗详细研究道尔顿原子论和盖·吕萨克的气体反应定律后提出分子学说.他首先肯定原子论和气体反应定律都是正确的,关键是原子论忽略了一个重要事实,那就是分子的存在.于是他提出分子假说如下:
(1)元素的最小单元是原子,但气体的最小单元并非原子,而是由几个原子组成的分子.也就是说,气体由分子组成,而分子由原子构成.例如,氧气、氢气都是由双原子分子组成的.气态化合物则是由分子组成,而化学物的分子是由不同原子构成的.例如,氨气由氨分子组成,而氨分子由3个氢原子和1个氮原子构成.
(2)在同温同压下,同体积的任何气体含有相同数目的分子.有了这两条分子假说,道尔顿原子论和盖·吕萨克的气体反应体积定律就得到圆满解释.
直到1858年,阿伏加德罗死后3年,他的学生意大利年轻化学家康尼查罗(Cannizzaro,1826-1910)在德国卡尔斯鲁厄召开的国际化学家代表会议上散发《化学哲学教程概要》的论文,把阿伏加德罗的分子学说用通俗语言阐明,才得到许多化学家赞同.不久康尼查罗又用分子学说原理测定许多物质分子量用实验事实证明分子的存在,至此才使原子学说和分子学说统一成原子--分子学说.
(1)一切物质都是由分子构成的,分子是保持物质化学性质的最小微粒.
(2)分子不能用物理方法分割,但是用化学方法能使它分解.分子由原子构成,原子是用化学方法不能分割的微粒.
(3)原子和分子都在不断运动.原子和分子的种类不同,它们的大小、质量和性质也各不相同.
化学家们在通力合作下,几乎经历半个世纪的努力,化学界才确认原子--分子学说,它为近代化学的发展提供扎实的理论基础,也是化学发展史上的又一里程碑.1年前查看全部
- 含阿伏加德罗常数个水蒸气分子,18克水和1mol冰中,他们各含原子总数谁最多?同温同压下,同体积的不同...
含阿伏加德罗常数个水蒸气分子,18克水和1mol冰中,他们各含原子总数谁最多?同温同压下,同体积的不同...
含阿伏加德罗常数个水蒸气分子,18克水和1mol冰中,他们各含原子总数谁最多?同温同压下,同体积的不同气体,什么一定相同? 桃花仙女1年前3
桃花仙女1年前3 -
 tll13 共回答了19个问题
tll13 共回答了19个问题 |采纳率94.7%用公式PV=nRT可知V=nR.其中R为常数,所以物质的量相同,又它们是同一种物质,所以原子个数相同1年前查看全部
- 10克氖气所含有的原子数约为多少?0.5NA还是1NA,NA是阿伏加德罗常数哦!
 淘然1年前1
淘然1年前1 -
 想当老师的人 共回答了16个问题
想当老师的人 共回答了16个问题 |采纳率100%10克氖气的物质的量为10/20=0.5mol,由于氖气是单原子分子,1mol氖气所含有的原子数为1NA,所以10克氖气所含有的原子数约为0.5NA.1年前查看全部
- 阿伏加德罗将组成物质的并能保持其化学性质不变的最小微粒命名为?
阿伏加德罗将组成物质的并能保持其化学性质不变的最小微粒命名为?
填分子还是原子啊? 赵鹏20081年前3
赵鹏20081年前3 -
 l66340899 共回答了18个问题
l66340899 共回答了18个问题 |采纳率100%分子啊,原子是没有化学性质的.你想想O2,O3(臭氧)有什么不一样?是分子结构不一样啊.1年前查看全部
- 这个阿伏加德罗数怎么算在常温下,2.7克的铝与足量的盐酸反应,失去的电子数是多少?说明白点在常温下这个条件能成立吗,为何
这个阿伏加德罗数怎么算
在常温下,2.7克的铝与足量的盐酸反应,失去的电子数是多少?说明白点
在常温下这个条件能成立吗,为何不说常温常压下呢,因为我认为他不是常温常压下所以我就不选他,但答案却说他对》 polybear1年前2
polybear1年前2 -
 gxnfg 共回答了14个问题
gxnfg 共回答了14个问题 |采纳率71.4%先写出化学方程式:
2Al+6HCl=3H2+2AlCl3
(铝从0价升为+3价 所以1摩尔铝失去3个电子)
每2摩尔铝失去6摩尔电子,那2.7克会失去多少呢?(铝的分子质量为27)
列方程为:2.7/(27×2)=X/6
所以 X=(2.7×6)/(27×2)=0.3mol1年前查看全部
- 这个阿伏加德罗数为何不对?在常温常压下,11.2L的甲烷中含有氢原子数等于2NA.为和不对呢?等于2NA那里错啊.我算了
这个阿伏加德罗数为何不对?
在常温常压下,11.2L的甲烷中含有氢原子数等于2NA.
为和不对呢?等于2NA那里错啊.我算了在11.2L中那甲烷应该为11.2/22.4=0.5 那么CH4中氢有4个那就4X0.5就等于2NA了,为何不对呢? 乱世孤雁1年前1
乱世孤雁1年前1 -
 liuxu525 共回答了18个问题
liuxu525 共回答了18个问题 |采纳率88.9%注意是常温常压,不是标准状况1年前查看全部
- 关于阿伏加德罗数已知某种物质的摩尔质量和密度,则可以求出:A.一个分子的质量B.一个分子的体积C.一个分子平均占有的空间
关于阿伏加德罗数
已知某种物质的摩尔质量和密度,则可以求出:
A.一个分子的质量
B.一个分子的体积
C.一个分子平均占有的空间
D.分子的直径
说明理由.或者说列出公式 盲流小虫1年前4
盲流小虫1年前4 -
 新大熊 共回答了21个问题
新大熊 共回答了21个问题 |采纳率90.5%A
C
摩尔质量除以摩尔数就是一个份子的质量
摩尔质量除以密度就是摩尔体积
摩尔体积除以摩尔数就是平均一个分子占有的空间1年前查看全部
- 请估算1立方厘米水的分子个数以及分子的质量.用阿伏加德罗来算
请估算1立方厘米水的分子个数以及分子的质量.用阿伏加德罗来算
第二个问题我用第一小问题算出的个数乘上每个水分子的质量和直接用1立方厘米/18立方厘米*18g为什么答案不一样呢. 讨厌的名字1131年前1
讨厌的名字1131年前1 -
 我是阿楠 共回答了22个问题
我是阿楠 共回答了22个问题 |采纳率90.9%质量=1g
n=1/18 mol
个数=1/18*NA
分子质量为:水的总质量除以分子个数
=1/(1/18*NA)1年前查看全部
- 10克氖气所含有的原子数约为多少?0.5NA还是1NA,NA是阿伏加德罗常数哦!
 pfrmh1年前1
pfrmh1年前1 -
 长的就一狼样 共回答了14个问题
长的就一狼样 共回答了14个问题 |采纳率64.3%10克氖气的物质的量为10/20=0.5mol,由于氖气是单原子分子,1mol氖气所含有的原子数为1NA,所以10克氖气所含有的原子数约为0.5NA.1年前查看全部
- 物理学中一个基本的观念是“世界是由物质组成的”.1811年,意大利物理学家阿伏加德罗将组成物质的仍能保持其化学性质不变的
物理学中一个基本的观念是“世界是由物质组成的”.1811年,意大利物理学家阿伏加德罗将组成物质的仍能保持其化学性质不变的最小微粒命名为______.1909年,著名科学家卢瑟福在进行了α粒子散射实验后,提出了______核式结构模型.
 gb2121211年前1
gb2121211年前1 -
 bluesprit9802 共回答了19个问题
bluesprit9802 共回答了19个问题 |采纳率78.9%解题思路:我们把保持物体化学性质不变的最小微粒叫分子;卢瑟福发现了电子,提出了原子核核式模型.1811年,意大利物理学家阿伏加德罗将组成物质的仍能保持其化学性质不变的最小微粒命名为分子;
1909年,著名科学家卢瑟福在进行了α粒子散射实验后,提出了原子核式模型.
故答案为:分子;原子.点评:
本题考点: 原子的核式模型.
考点点评: 此题考查的是我们对于微观世界的了解,是一道基础题.1年前查看全部
- 设Na为阿伏加德罗数的值,下列叙述正确的是 A.常温常压下16g臭氧所含的原
设Na为阿伏加德罗数的值,下列叙述正确的是 A.常温常压下16g臭氧所含的原
设Na为阿伏加德罗数的值,下列叙述正确的是
A.常温常压下16g臭氧所含的原子数目为Na
B.25℃,PH=13的NaOH溶液中含有OH-的数目为0.1Na
C.标准状况下,2.24L乙烷含有的分子的数目为0.1Na
D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4Na 爱在香柏树下1年前5
爱在香柏树下1年前5 -
 wxqwxl 共回答了14个问题
wxqwxl 共回答了14个问题 |采纳率92.9%A.常温常压下16g臭氧所含的原子数目为Na
物质的量为1 /3mol 所以原子数为1 /3*3=1mol即Na正确
B.25℃,PH=13的NaOH溶液中含有OH-的数目为0.1Na
PH=13 浓度为0.1mol/L 不知体积所以不知OH-的数目 不对
C.标准状况下,2.24L乙烷含有的分子的数目为0.1Na
2.24L即0.1mol 所以含有的分子的数目为0.1Na 正确
D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4Na
不对1年前查看全部
- 16克氧气所含的分子个数等于阿伏加德罗常数值吗
 eliang21881年前3
eliang21881年前3 -
 春天的虫儿 共回答了20个问题
春天的虫儿 共回答了20个问题 |采纳率80%不是
按氧16来算:
n=m/M=16g/ 32g/mol=0.5mol
是0.5NA,其它同位素所得到的数据比0,5还要小.
望采纳,多谢!1年前查看全部
- 阿伏加德罗曾经总结出这样一条规律:在同温同压下,同体积的气体都含有相同的分子数.右图是电解水的装置.
阿伏加德罗曾经总结出这样一条规律:在同温同压下,同体积的气体都含有相同的分子数.右图是电解水的装置. 
(1)在图中标出电源的正极和负极(用“+”、“-”表示)
(2)与正极相连的试管里产生的是______气,与负极相连的试管里产生的是______气,两气体的体积比______;分子个数之比是______. daisy_b1年前1
daisy_b1年前1 -
 麦甜tian 共回答了18个问题
麦甜tian 共回答了18个问题 |采纳率94.4%1年前查看全部
- NA表示阿伏加德罗常数值,下列说法正确的是( )
NA表示阿伏加德罗常数值,下列说法正确的是( )
A. 18g水所含电子数为NA
B. 14g CO和N2的混合气体所含分子数为NA
C. 16g O2和O3的混合气体所含原子数为NA
D. 58.5g NaCl所含的离子数为NA bluedream2221年前2
bluedream2221年前2 -
 cdzhaodonghai 共回答了14个问题
cdzhaodonghai 共回答了14个问题 |采纳率78.6%解题思路:A.水分子中含有10个电子,18g水的物质的量为1mol,含有10mol电子;
B.一氧化碳和氮气的摩尔质量都是28g/mol,14g混合物的物质的量为0.5mol;
C.氧气和臭氧分子中都只含有氧原子,16g混合物中含有16g氧原子,含有氧原子的物质的量为1mol;
D.氯化钠中含有 钠离子和氯离子,58.5g氯化钠的物质的量为1mol,含有2mol离子.A.18g水的物质的量为1mol,1mol水分子中含有10mol电子,所含电子数为10NA,故A错误;
B.14gCO和N2混合物的物质的量为0.5mol,所含分子数为0.5NA,故B错误;
C.16g O2和O3的混合气体含有16g氧原子,含有1mol氧原子,所含原子数为NA,故C正确;
D.58.5g氯化钠的物质的量为1mol,1mol氯化钠中含有2mol离子,所含的离子数为2NA,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,明确清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
大家在问
- 1造纸术电话印刷术电灯各是谁发明的
- 2(2014•嘉峪关)细胞分裂完成后,新细胞和原细胞所含的何种物质一致( )
- 3the old 是单数还是复数这种the+一个形容词表示一类人是单数还是复数?那还有the family,a pair
- 4证明1/ n+1 +1/ n+2 +……+1/ 3n>5/6(n>=2,n∈正整数)
- 5even so能不能和but连用
- 6已知f(x+1)=5x+6.求函数f(x)的解析式
- 7甲乙两车分别同时从相距20千米的A、B两地背向而行,甲每小时行80千米,是乙车速度的2倍,两车开出后5小时相距多少千米?
- 8sin@2-cos@2等于
- 9一个长和宽都是10厘米,高为31.4厘米的长方体铁块锻造成底面半径10厘米的圆锥后,圆锥高是多少厘米?
- 10下列有关细胞结构和功能的叙述,正确的是( )
- 11念旧 作文
- 12英语翻译:讨论未取得一致意见
- 13已知某月中,星期二的天数比星期一的天数多,而星期三的天数比星期四的天数多,那么这个月的最后是星期几
- 14有理数的减法可以转换为加法,所以加减混合运算可以统一为四则运算,用式子可表示为A加B减C等于多少
- 15当m为何值时,关于x的方程[2x−3/x−2=m+4x−2]会产生增根?