边微热边铵明矾溶液中逐滴加入氢氧化钡溶液至中性,离子方程式是什么?继续滴加氢氧化钡的离子方程式是什
 thismyname2022-10-04 11:39:541条回答
thismyname2022-10-04 11:39:541条回答RT
铵明矾[NH4Al(SO4)2·12H2O

已提交,审核后显示!提交回复
共1条回复
 dennieyuly 共回答了17个问题
dennieyuly 共回答了17个问题 |采纳率88.2%- 铵明矾的化学名称是十二水合硫酸铝铵(我按照明矾的名称瞎编的哈哈),它是由铝离子,铵根离子,硫酸根离子以及结晶水共同组成的白色晶体.明矾溶于水后,其水溶液中存在着铝离子,钾离子,硫酸根离子.所以滴加氢氧化钡的离子方程式是
Ba2+ + SO42- == BaSO4 向下箭头
Al3+ + OH- == Al(OH)3 向下箭头
NH4+ + OH- == H2O + NH3 向上箭头
当过量时,鉴于氢氧化铝的特殊性,会进一步反应
Al(OH)3 + OH- == AlO2- + 2H2O 那个是偏铝酸根相信你知道 - 1年前
相关推荐
- 能使氧化铜还原的溶液是什么?取氧化铜跟一溶液与烧杯中,垫上石棉网,用酒精灯加热(微热).氧化铜被还原?这溶液是什么?
 54dianjing1年前3
54dianjing1年前3 -
 tom18281 共回答了24个问题
tom18281 共回答了24个问题 |采纳率87.5%醛类物质啊
被氧化成了羧酸,高中有机化学有的.同时,还有砖红色沉淀生成.1年前查看全部
- 实验室制取氢气 mno2 hcl 是加热还是微热
 小新笨笨1年前3
小新笨笨1年前3 -
 falcononly 共回答了19个问题
falcononly 共回答了19个问题 |采纳率84.2%实验室制取氯气,用的药品是浓盐酸和二氧化锰.反应需要加热.反应的化学方程式为:
MnO2+4HCl=△=MnCl2+2H2O+Cl2↑1年前查看全部
- 氧化铜能和什么溶液反应生成铜?黑色的铜丝网加入B溶液(微热)生成铜网b .可能是我表达错误...原来的题目是这样的. C
氧化铜能和什么溶液反应生成铜?
黑色的铜丝网加入B溶液(微热)生成铜网b .可能是我表达错误...原来的题目是这样的. CO还原已经知道了... xtwcp1年前1
xtwcp1年前1 -
 爱也知秋 共回答了17个问题
爱也知秋 共回答了17个问题 |采纳率70.6%醇类溶液都可以.人教版教材高二教科书上有机物,醇与氧化铜反应生成铜和醛和水.其实这个和银镜反应有点类似,银镜反应是银氨溶液氧化醇,这个是氧化铜...
1楼和2楼的有够强哦,这种题不正是高考中的基础吗?1年前查看全部
- 要将明原因哦将10gCuO粉末加入90g一定质量分数的稀硫酸中,微热至氧化铜全部溶解再向蓝色溶液中加入mg铁粉,充分反应
要将明原因哦
将10gCuO粉末加入90g一定质量分数的稀硫酸中,微热至氧化铜全部溶解再向蓝色溶液中加入mg铁粉,充分反应后,过滤,将滤渣烘干得到干燥固体物质mg.
(1)当m取何值是,才能满足加入的铁粉和得到的固体质量相等
(一定要讲明原因啊!) pupusun1年前1
pupusun1年前1 -
 Oo鱼儿游游oO 共回答了18个问题
Oo鱼儿游游oO 共回答了18个问题 |采纳率94.4%我回答过类似问题,copy下
已知 Fe + Cu2+==Cu + Fe2+ 质量差
56 64 8 通过方程我们知道 如果只发生置换反应,那么是不可能得到干燥固体物质mg,必然是增重部分跟剩余稀硫酸反应了.因此我们求得稀硫酸质量分2部分
Fe+CuO +H2SO4=FeSO4 + Cu +H2O
56 80 98 64
Y 10 X Z X=12.25g Y=7g Z=8g 可知置换反应增重了8-7=1g,这增重的1g要过量Fe溶解于过量稀硫酸才可以保证最后得到m克滤渣,所以
Fe+ H2SO4==FeSO4 + H2
56 98
1 X X=1.75g 所以硫酸的质量分数为12.25+1.75/100=14%
至于m的取值范围那就简单了,只要满足m>8g 即可1年前查看全部
- 化学中微热和加热的区别化学实验中的微热和加热油什么区别呢?
 冬日艳阳0011年前2
冬日艳阳0011年前2 -
 无余涅盘 共回答了23个问题
无余涅盘 共回答了23个问题 |采纳率95.7%微热指温度不是很高.因为有些反应(特别是有机反应)需要控制温度,否则会发生很多副反应.有些反应的生成物不稳定,如果温度太高会分解.
加热就是指一般的用酒精灯加热1年前查看全部
- 在100ml某溶液里,硝酸浓度0.4mol/L,硫酸浓度0.1mol/L,向混合液里加1.92g铜,微热,充分反映后溶液
在100ml某溶液里,硝酸浓度0.4mol/L,硫酸浓度0.1mol/L,向混合液里加1.92g铜,微热,充分反映后溶液里
铜离子的物质的量的浓度约为?谢过】 致癌深蓝1年前1
致癌深蓝1年前1 -
 飞扬妮子 共回答了20个问题
飞扬妮子 共回答了20个问题 |采纳率90%n(H+)=0.06mol n(NO3-)=0.04mol n(Cu)=0.03mol
3Cu+8H+ +2NO3-===3Cu2+ +2NO↑+4H2O
所以H+不足按氢算
n(Cu2+)=0.06*3/8=0.0225mol
c(Cu2+)=0.225mol/L
(主要起作用的为H+,硝酸和硫酸总共可提供H+0.06mol,)1年前查看全部
- 把19.2g 的Cu放入足量的稀硝酸中,微热至Cu完全反应.已知:3Cu+8HNO3(稀)=3Cu(NO3)2
把19.2g 的Cu放入足量的稀硝酸中,微热至Cu完全反应.已知:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O求:
(1)参加反应的硝酸的物质的量;
(2)被还原的硝酸的质量;
(3)生成的NO在标准状况下的体积. whfswf1年前3
whfswf1年前3 -
 aifus 共回答了16个问题
aifus 共回答了16个问题 |采纳率93.8%解题思路:首先计算出参加反应的Cu的物质的量,根据化学方程式计算.19.2g 的Cu的物质的量为[19.2g/64g/mol]=0.3mol,
(1)设参加反应的硝酸的物质的量为x
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol8mol
0.3molx
x=0.8mol,
答:参加反应的硝酸的物质的量为0.8mol.
(2)由方程式可以看出,硝酸没有全部被还原,当有8mol硝酸反应时,有2mol被还原,
则0.8mol硝酸参加反应,被还原的硝酸的物质的量为0.2mol,
质量为:0.2mol×63g/mol=12.6g.
(3)设产生的NO在标准状况下的体积为V,则
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 44.8L
0.3molV
V=4.48L,
答:产生的NO在标准状况下的体积为4.48L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学反应的计算,题目难度不大,正确书写化学方程式为解答该题的关键.1年前查看全部
- 将加热后的铜丝放入稀硫酸并微热铜丝表面变为什么色
 cxljl1年前1
cxljl1年前1 -
 smile_945 共回答了18个问题
smile_945 共回答了18个问题 |采纳率88.9%加热的铜丝的表面会和空气中的氧气反应生成一层黑色的CuO,之后放入溶液中,铜表面的一层氧化铜会和硫酸反应生成硫酸铜溶液(蓝色),而铜丝表面的氧化铜被逐渐腐蚀掉后就会露出新的铜(红色)!
回答完毕!1年前查看全部
- 将10gCuO粉末加入到100g一定质量分数的硫酸中,微热至CuO全部溶解.再向蓝色溶液中加入m g铁粉,充分反应后,过
将10gCuO粉末加入到100g一定质量分数的硫酸中,微热至CuO全部溶解.再向蓝色溶液中加入m g铁粉,充分反应后,过滤,将滤渣烘干得到干燥固体m g,求:1.硫酸中溶质的质量分数.2.当m取何值时,才能满足加入铁粉与得到固体的质量相等.
 mateylater1年前1
mateylater1年前1 -
 榴莲味道 共回答了19个问题
榴莲味道 共回答了19个问题 |采纳率73.7%因为CuO全部溶解,所以:CuO—————CuSO4
80 160
10g x
x=20g1年前查看全部
- 向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,分反应后过滤.以下判断错误的是( )
向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,分反应后过滤.以下判断错误的是( )
A. 滤纸上可能含有铜
B. 滤液中可能含有硫酸亚铁
C. 滤液中可能含有硫酸铜
D. 滤纸上可能含有氧化铜 短横线不能用1年前2
短横线不能用1年前2 -
 yiwang1982 共回答了20个问题
yiwang1982 共回答了20个问题 |采纳率95%解题思路:在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能把位于其后的金属从其盐溶液中置换出来.氧化铜可与硫酸反应生成硫酸铜和水.铁可以与硫酸反应生成硫酸亚铁和氢气,氧化铜能与硫酸反应生成硫酸铜,生成的硫酸铜能与铁发生置换反应,生成铜和硫酸亚铁,所以滤液中一定含有硫酸亚铁,硫酸的量不固定,不一定把铁和氧化铜全部反应掉,所以滤纸上可能含有氧化铜,铁的量不固定,所以无法确定与硫酸铜的反应程度,故滤纸上可能有铜,滤液中可能有硫酸铜,分析选项,故选B.
点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 9.将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应
9.将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应
后过滤,弃去滤渣,滤液中金属阳离子情况不可能是
A.只含Cu2+、Fe2+、Zn2+ B.只含Zn2+
C.只含Fe2+、Zn2+ D.只含Cu2+、Fe3+、Zn2+
10.如下三个热化学方程式:
H2 (g)+ 1/2O2(g)═H2 O(g) △H=a kJ•mol-1
H2 (g)+ 1/2O2(g)═H2 O(l) △H=b kJ•mol-1
2H2(g)+ O2 (g)═2H2O(l) △H=c kJ•mol-1
关于以上三个热化学方程式的表述中正确的是( )
①它们都是放热反应 ②a、b、c均为正值 ③a=b ④b>a ⑤2b=c
A.①④⑤ B.①②④ C.①②③ D.①⑤ 岭南漠沙1年前1
岭南漠沙1年前1 -
 bsym888 共回答了12个问题
bsym888 共回答了12个问题 |采纳率100%D.只含Cu2+、Fe3+、Zn2+
C.①②③1年前查看全部
- NH4CUSO3与足量10摩每升硫酸液混合微热,产生现象 有红色金属生成 产生刺激性气味的气体 溶液呈蓝色 方程
 Milanello52571年前1
Milanello52571年前1 -
 y282292742 共回答了19个问题
y282292742 共回答了19个问题 |采纳率89.5%2NH4CUSO3+2H2SO4=(NH4)2SO4+CUSO4+2SO2+CU+2H2O
不好意思,沉淀与气体符号打不出来.1年前查看全部
- 金属锌中加入稀硫酸 现象,往黑色的氧化铜粉末中加入稀硫酸,微热 现象往生锈的铁钉中加入足量的稀盐酸和往生锈的铁钉中加入足
金属锌中加入稀硫酸 现象,
往黑色的氧化铜粉末中加入稀硫酸,微热 现象
往生锈的铁钉中加入足量的稀盐酸和往生锈的铁钉中加入足量的稀硫酸有什么区别么 WENTVRTY1年前3
WENTVRTY1年前3 -
 brianhy 共回答了22个问题
brianhy 共回答了22个问题 |采纳率90.9%Zn+H2SO4=ZnSO4+H2(加气体符号)
现象:有气泡产生
CuO+H2SO4=CuSO4+H2O
现象:氧化铜粉末溶解,溶液变成浅蓝色1年前查看全部
- 紫色石蕊试液滴加到浓硝酸中,微热后为何褪色?
 gmsill271年前1
gmsill271年前1 -
 wudilali 共回答了24个问题
wudilali 共回答了24个问题 |采纳率95.8%因为浓硝酸有强氧化性,将石蕊分子氧化了,变成了无色的物质,所以就褪色了1年前查看全部
- 将一定量的氧化铜加入到100ml 0.5mol/l的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10g充分反应
将一定量的氧化铜加入到100ml 0.5mol/l的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10g充分反应后过滤,烘干,得干燥的固体物质为10g.
(1)参加反应的铁为多少?
(2)原加入的氧化铜为多少?
(3)最后得到的溶液为100ml,其物质的量浓度为多少? 灰蓝海1年前1
灰蓝海1年前1 -
 lfl19829 共回答了20个问题
lfl19829 共回答了20个问题 |采纳率90%我来吧
首先分析一下反应过程
(先不论反应是否过量问题,以免落入题目陷阱)
首先CuO与H2SO4反应,然后Fe又从CuSO4中置换出Cu (计算可知,H2SO4相对于CuO过量,最后的固体是Fe、Cu混合物)
换言之,最后溶液中没有Cu,
那我们可以这么理解,简化过程,理解成过程中只有 Fe与H2SO4反应,最后剩下FeSO4溶液,
那么第一问
H2SO4~~~~~~反应的Fe
1 56
100*10-3* 0.5 X
解得 过程中反应的Fe有2.8(g)
接着是第二问
剩余的Fe=加入的10 gFe — 反应掉的Fe =10-2.8=7.2(g)
最后10 g固体物质中的Cu=固体物质 — 剩余的Fe =10-7.2=2.8(g)
Cu~~~~~~~~~~~~~~~CuO
64 80
2.8 Y
解得 原加入的CuO有4(g)
最后一问,其实都不用算,由SO42-守衡知道,FeSO4也有0.05mol,既然体积不变那么物质的量浓度也不变
很晚了,脑子有点瞌睡了,表述不清之处,还请见谅,不明白再来问我吧,说道你懂为止1年前查看全部
- 将一定量的氧化铜加入到100ml 0.5mol/l的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10g充分
将一定量的氧化铜加入到100ml 0.5mol/l的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10g充分
将一定量的氧化铜加入到100ml 0.5mol/l的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10g充分反应后过滤,烘干,得干燥的固体物质为10g.
(1)参加反应的铁为多少?
(2)原加入的氧化铜为多少?
(3)最后得到的溶液为100ml,其物质的量浓度为多少? 五儿_pixy1年前3
五儿_pixy1年前3 -
 z8gg8888 共回答了12个问题
z8gg8888 共回答了12个问题 |采纳率91.7%从氧化铜全部溶解知氧化铜小于0.05mol.设氧化铜为x mol,由 CuSO4+Fe=FeSO4+Cu 知道 最后,得铜x mol;同时反应了x+(0.5*0.1-x) mol=0.05mol的铁.
则 63.55* x+ 未反应的铁=10 (1)
未反应的铁=10-反应了的铁=10-55.85*0.5*0.1
解上方程(1)得x=0.044mol,这样
(1)2.79g(0.05mol)
(2)3.50g(0.044mol)
(3)0.5mol/l 的FeSO4溶液 或可以换算成其他浓度单位1年前查看全部
- 制备氯化氢为什么微热生成硫酸清钠,抢热就生成硫酸钠 ?
 hssky1年前2
hssky1年前2 -
 lindeinwien 共回答了17个问题
lindeinwien 共回答了17个问题 |采纳率100%你说的是浓硫酸和氯化钠共热吧,因为硫酸氢钠不稳定加热温度高时就会分解成硫酸钠.1年前查看全部
- 铜粉和氧化铜的差异怎样把铜粉中混有少量的氧化铜除去a.在空气中燃烧b.加入适量稀硫酸、微热、过滤c.加入适量稀硫酸、微热
铜粉和氧化铜的差异
怎样把铜粉中混有少量的氧化铜除去
a.在空气中燃烧
b.加入适量稀硫酸、微热、过滤
c.加入适量稀硫酸、微热、蒸发 涅磐蝴蝶1年前2
涅磐蝴蝶1年前2 -
 无业游民0328 共回答了18个问题
无业游民0328 共回答了18个问题 |采纳率83.3%通氢气或一氧化碳,并加热.1年前查看全部
- 某溶液中有Mg2+、Fe2+、Fe3+和Al3+四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,过滤,在滤渣中再
某溶液中有Mg2+、Fe2+、Fe3+和Al3+四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,过滤,在滤渣中再加入过量的盐酸,所得溶液中含有的阳离子是( )
A.Mg2+ B.Fe2+ C. Fe3+ D.Al3+
此题双选 69207291年前4
69207291年前4 -
 elena_anne 共回答了22个问题
elena_anne 共回答了22个问题 |采纳率86.4%加入NaOH,Mg2+、Fe2+、Fe3+被沉淀为Mg(OH)2、Fe(OH)2、Fe(OH)3
Al3+转化为AlO2-
过滤后为NaAlO2溶液,加入酸后形成AlCl3溶液
选择D1年前查看全部
- 50mL 18.4mol/L浓硫酸与足量铜微热反应,转移电子数目为0.92NA.请问这个说法为什么错?
 channelchou1年前1
channelchou1年前1 -
 柠檬冰水1234 共回答了17个问题
柠檬冰水1234 共回答了17个问题 |采纳率88.2%浓硫酸会变稀,就不反应了1年前查看全部
- 下列离子检测正确的是A 在淀粉溶液中加入少量食盐配制的溶液 可以鉴别真假碘盐B向某溶液中加入NAOH并微热,产生能够使湿
下列离子检测正确的是
A 在淀粉溶液中加入少量食盐配制的溶液 可以鉴别真假碘盐
B向某溶液中加入NAOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体
可以说明该溶液中一定含有铵根离子 伤情的小鱼1年前2
伤情的小鱼1年前2 -
 拂天闻笑语 共回答了21个问题
拂天闻笑语 共回答了21个问题 |采纳率90.5%B是正确的,A中首先碘是以化合物的形式存在,量极其微少.淀粉要与I2才能反应.
B中产生氨水,加热挥发!1年前查看全部
- 某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶
某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A. NH4+
B. Mg2+
C. Fe2+
D. Al3+ 寒冰重现1年前1
寒冰重现1年前1 -
 弄彩木芙蓉 共回答了23个问题
弄彩木芙蓉 共回答了23个问题 |采纳率95.7%解题思路:NH4+与碱在微热时反应生成氨气逸出,则铵根离子减少,Fe2+和氢氧化钠溶液反应生成的Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,则Fe2+减少,以此来解答.混合溶液中加入过量的NaOH并加热时,反应生成的氨气逸出,并同时生成Mg(OH)2、Fe(OH)2沉淀和NaAlO2,
Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,
再向混合物中加入过量盐酸,则Mg(OH)2、Fe(OH)3和NaAlO2与过量酸作用分别生成MgCl2、AlCl3、FeCl3,
则减少的离子主要有:NH4+和Fe2+,
故选AC.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子之间的反应,明确阳离子与碱反应后的生成物的性质及生成物与酸的反应是解答本题的关键,注意亚铁离子易被氧化是学生解答中容易忽略的地方.1年前查看全部
- 将氧化铜和铁粉的混合物加入到一定量的稀硫酸中,微热 ,反应完全后滤出不容物,像滤液中加入一根铁钉未发现变化.
将氧化铜和铁粉的混合物加入到一定量的稀硫酸中,微热 ,反应完全后滤出不容物,像滤液中加入一根铁钉未发现变化.
A.滤出的不溶物一定是铜
B.滤出的不溶物中一定有铜,也可能有铁
C.滤出的不溶物中一定是铁
D.滤液中一定含有硫酸亚铁,可能含有硫酸铜和硫酸
为什么选B nmklop111年前3
nmklop111年前3 -
 ghb827 共回答了13个问题
ghb827 共回答了13个问题 |采纳率100%题设情景的开头、结尾非常明显地暗示了反应,因而是入手解题的好切入点.
开头:CuO、Fe放入稀硫酸中微热,三种物质均不知道具体含量、浓度;但是稀硫酸规定了弱氧化性的H+环境.因此必然同时发生着CuO被酸溶解成Cu2+、Fe被H+氧化成为Fe2+的反应;因为溶液中引入了Cu2+,而Fe粉毕竟会存在一段时间,所以会有二级反应:Fe置换出Cu单质的反应.
最终由于所有氧化剂中没有比Cu2+更强的了,所以断定:溶液中必定有Fe2+,可能有H+或Cu2+;固体中必然有析出的铜单质,可能有剩余铁粉.如何决定?分析一下反应完全后的情形.
结尾:反映完全后有不容物,滤液与铁钉不反应.可见溶液中既没有Cu2+、也没有H+.那么CuO一定已经全部被置换成为Cu单质了,不容物中一定有Cu,且铁对铜必然是恰好足量或过量;H+也被耗尽,即Fe粉对稀硫酸也必然是足量或过量.
总之,滤出不容物一定有铜,也可能有铁;滤液是FeSO4的溶液.1年前查看全部
- 2NaNO3(s)+H2SO4(浓)==(微热)==HNO3(g)+NaHSO4
2NaNO3(s)+H2SO4(浓)==(微热)==HNO3(g)+NaHSO4
这是实验室制硝酸的化学方程式,请问,NaNO3括号的(s)是什么? 金一艳1年前3
金一艳1年前3 -
 gzgg2 共回答了23个问题
gzgg2 共回答了23个问题 |采纳率100%solid的简写,固体的意思.就是说反应条件是将硝酸钠固体投入浓硫酸中并加热.
s-固体,l-液体,g-气体,aq-稀溶液.1年前查看全部
- 把固体碘密封在一根长约.把固体碘密封在一根长约10cm的玻璃管里,用酒精微热玻璃管盛碘的一端,受热后有什么变化?在玻璃管
把固体碘密封在一根长约.
把固体碘密封在一根长约10cm的玻璃管里,用酒精微热玻璃管盛碘的一端,受热后有什么变化?在玻璃管的另一端看到的现象是什么?这一变化过程属于什么变化?此实验说明了什么 就要圆满1年前2
就要圆满1年前2 -
 股海淘金8888 共回答了23个问题
股海淘金8888 共回答了23个问题 |采纳率73.9%受热后看到试管中产生紫色烟雾,在玻璃管的另一端看到的现象是有紫黑色颗粒生成,前者是碘升华,后者是碘的凝华.说明了碘受热易升华1年前查看全部
- 常见的铵盐有()(),与浓NaOH溶液混合(微热)产生能使()的有()气味的气体,此气体的名称是(),化学式为()
 wenjianlan1年前1
wenjianlan1年前1 -
 99xyxy 共回答了17个问题
99xyxy 共回答了17个问题 |采纳率94.1%有NH4Cl、(NH4)2SO4,
使湿润的红色石蕊试纸变蓝色的有刺激性气味的气体,叫氨气,化学式NH31年前查看全部
- 化学方程式计算,将一些氧化铜粉末加入到100克质量分数为l4%的硫酸溶液中,微热至氧化铜全部溶解,再向该蓝色溶液中加入2
化学方程式计算,
将一些氧化铜粉末加入到100克质量分数为l4%的硫酸溶液中,微热至氧化铜全部溶解,再向该蓝色溶液中加入20克铁粉.充分反应后,过滤、烘干,得到干燥的固体物质仍是20克.
(1)原加入的氧化铜的质量是多少?
(2)最后得到的溶液中溶质的质量分数是多少?
答案(1)l O克;(2)20.6 5%
我要计算过程,答得好加分. wyytiger1年前1
wyytiger1年前1 -
 JUJU星 共回答了15个问题
JUJU星 共回答了15个问题 |采纳率86.7%首先要分析整个过程,理解题目的意思
这个题目里干燥后仍然是20克说明,置换出来的铜的质量=反应掉的铁的质量.这里就有一个点要理解,如果是铁全部用来置换铜根据反应式
Fe+CuSO4==FeSO4+Cu可知质量会大于20克,所以会有另外一条反应式
Fe+H2SO4==FeSO4+H2.由此可知原来和铜反应的时候,酸过量,后来和铁反应的时候铁过量,根据关系式
Cu——CuO——H2SO4——Fe H2SO4————Fe——H2
64 80 98 56 98 56 2
a X Y m 100*14%-Y n b
X=10/8a Y=49/32a m=7/8a n=56/98(14-Y)=8-7/8a b=1/28n
a=m+n=56/64a+8-7/8a=7/8a+8-7/8a a=8
氧化铜的质量X=80/64*8=10g
第一步解出来了,第二步答案有点对不上.
最后生成的溶解就是FeSO4
根据 H2SO4——FeSO4
98 152
14 Z Z=21.7
溶液质量为100+10-8+7+1-1/28=109.96
硫酸溶液+氧化铜-铜+与铜反应的铁+与酸反应的铁-氢气
A%=21.7/109.96=19.7%1年前查看全部
- 某溶液中有NH+、Mg2+、Fe2+ 和 Al3+ 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸
某溶液中有NH+、Mg2+、Fe2+ 和 Al3+ 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.NH+ 和 Fe2+
B.Mg2+ 和 Al3+
C.Fe2+ 和 Al3+
D.Al3+ 和 NH+
..为什么?我选D...泪 基隆1年前6
基隆1年前6 -
 jc_zhou 共回答了14个问题
jc_zhou 共回答了14个问题 |采纳率100%铵根减少,这是肯定的.
至于铝离子,在加入氢氧化钠之后,形成偏铝酸钠,再加入盐酸之后,又形成铝离子,所以不会大量减少.
而亚铁离子与氢氧化钠反应生成氢氧化亚铁之后被氧化成为氢氧化铁,加入盐酸之后,变成三价铁离子,就没有亚铁离子了.1年前查看全部
- 向蛋清溶液中滴几滴浓硝酸,微热,出现黄色
向蛋清溶液中滴几滴浓硝酸,微热,出现黄色
化学方程式什么 于节约能1年前1
于节约能1年前1 -
 forever4 共回答了19个问题
forever4 共回答了19个问题 |采纳率89.5%蛋白质变性了凝固.部分不饱和键被氧化.1年前查看全部
- 解释下列有关实验现象,并写出有关化学方程式:(1)取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试
解释下列有关实验现象,并写出有关化学方程式:(1)取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有“白霜”.(2)向氨水中滴几滴酚酞试液,溶液变红色.(3)一瓶无色气体打开瓶盖后,瓶口呈现出红棕色.
 冰_芯1年前1
冰_芯1年前1 -
 yangyang1 共回答了21个问题
yangyang1 共回答了21个问题 |采纳率90.5%(1)取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有“白霜”.
氯化铵受热分解为氨气和氯化氢气体,两种气体在试管内相遇产生白烟,附于试管内壁形成白霜
NH4Cl=△=NH3+HCl ;NH3+HCl =NH4Cl
(2)向氨水中滴几滴酚酞试液,溶液变红色.
氨气溶于水和水反应生成碱一水合氨,溶液显碱性使酚酞变红,NH3+H2O=NH3·H2O
(3)一瓶无色气体打开瓶盖后,瓶口呈现出红棕色.
气体是一氧化氮,遇到空气生成红棕色二氧化氮,2NO+O2=2NO21年前查看全部
- 把混有少量氧化铜的铁粉加入一定量的稀硫酸中微热,反应停止后过滤,滤纸上有可能有?
 天之涯06181年前1
天之涯06181年前1 -
 梦回沙河 共回答了31个问题
梦回沙河 共回答了31个问题 |采纳率93.5%aluxiao2明显没学好还出来误人子弟,Cu怎么可能跟稀硫酸反应.
滤纸上肯定可能有铜,因为只要金属过量,硫酸铜中的铜就绝对会被铁置换出来(铁的活动性大于铜).氧化铜是不会有的,因为已经与硫酸反应完了,所以滤纸上只可能有铜和水.1年前查看全部
- 下表中有4组物质需要鉴别,试选择合理答案的序号填下表空格中。 ★检验用试剂或操作:①浓硫酸(微热) ②无色酚酞试液 ③紫
下表中有4组物质需要鉴别,试选择合理答案的序号填下表空格中。 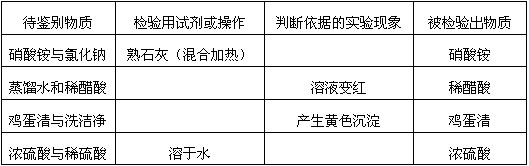
★检验用试剂或操作:①浓硫酸(微热) ②无色酚酞试液 ③紫色石蕊试液 ④饱和硫酸铵溶液
★判断依据的实验现象:A.产生能使湿润的红色石蕊试纸变蓝的刺激性气味的气体 B.溶液温度降低 C.产生能使湿润的蓝色石蕊试纸变红的刺激性气味的气体 D.溶液温度升高 流浪八月1年前1
流浪八月1年前1 -
 阿莫西林AMOR 共回答了16个问题
阿莫西林AMOR 共回答了16个问题 |采纳率93.8%1年前查看全部
- 铜离子和铁哪个活泼比如有下题:在CuO与Fe的混合固体中加入过量稀硫酸并微热,请问是CuO先和稀硫酸反应还是铁先和稀硫酸
铜离子和铁哪个活泼
比如有下题:在CuO与Fe的混合固体中加入过量稀硫酸并微热,请问是CuO先和稀硫酸反应还是铁先和稀硫酸反应?
请问各位是否会有氢气生成? 狼哥1111年前1
狼哥1111年前1 -
 19667249 共回答了16个问题
19667249 共回答了16个问题 |采纳率81.3%只有铁会有氢气产生,Cu没有.我认为是一起反应,只是哪边比较快的问题.我认为,和氧化铜反应比较快,因为氧化铜是偏碱性的氧化物,和酸是较容易反应的.铁虽然也会反应,但是很慢.1年前查看全部
- 某溶液中有Na+,Mg+,Fe+,Al+四种离子,若向其中加入过量的氢氧化钠溶液,微热搅拌,在加过量盐酸
某溶液中有Na+,Mg+,Fe+,Al+四种离子,若向其中加入过量的氢氧化钠溶液,微热搅拌,在加过量盐酸
溶液中大量减少的阳离子是谁? cy_yl1年前5
cy_yl1年前5 -
 月中的水 共回答了13个问题
月中的水 共回答了13个问题 |采纳率92.3%Fe+这是什么东东?貌似是这个东东,Na+,不反应;Mg+先是Mg(OH)2,加盐酸后又变成Mg+;Al3+,先变AlO2-,加盐酸又变成Al3+1年前查看全部
- 将一些氧化铜粉末加入到100克14%的硫酸溶液中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉16.8克,充分反应后过
将一些氧化铜粉末加入到100克14%的硫酸溶液中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉16.8克,充分反应后过滤,仍得到干燥后的固体物质16.8克,求:(1)原加入氧化铜的质量是多少?(2)最后得到的溶液的质量分数是多少?
 金樽饮月1年前1
金樽饮月1年前1 -
 chychy7111 共回答了17个问题
chychy7111 共回答了17个问题 |采纳率88.2%每1molFe变成Cu质量增加8g,现在质量没变.什么有一部分Fe 变成了亚铁离子.每1molFe溶解质量减少56g,所以,置换出Cu的Fe与溶解的Fe为7:1.所以有14.7g的Fe(0.2625mol)与Cu反应了~所以,Cu也是0.2625mol,所以CuO0.2625mol,所以氧化铜21g.
最后是氯化亚铁溶液,16.8g的Fe,121g的溶液,所以,13.8%1年前查看全部
- 碳酸钠滴加酚酞会变红,微热后溶液的颜色会怎么样?原因是什么?
碳酸钠滴加酚酞会变红,微热后溶液的颜色会怎么样?原因是什么?
滴加酚酞变红的原因我知道 yyhuohu754301年前1
yyhuohu754301年前1 -
 三十rr 共回答了23个问题
三十rr 共回答了23个问题 |采纳率91.3%加热后红色加深,因为碳酸根的水解程度加大、1年前查看全部
- 有元素R的氧化物RO,将其与化合物X混合后,再加少量的水,微热后,便能生成一种气体使潮湿石蕊试纸变红
有元素R的氧化物RO,将其与化合物X混合后,再加少量的水,微热后,便能生成一种气体使潮湿石蕊试纸变红
错了 是变蓝 则X和元素R可能是 A.X是纯碱 R是碳元素 B.X是氯化钠 R是硫元素 X是硫酸铵 R是钙元素 D.X是碳酸氢铵 R是钠元素 找个用户名真难阿1年前2
找个用户名真难阿1年前2 -
 bee123 共回答了11个问题
bee123 共回答了11个问题 |采纳率90.9%形成RO,是第二主族元素,可以生成氨气,那么RO肯定是强碱,常见的就是CaO或者氧化钡.
另外一个肯定是铵盐.
所以答案只有C1年前查看全部
- 某溶液中有NH4+,Mg2+,Fe3+,向其中加入过量NAOH,微热并搅拌,再加入过量HCL,
某溶液中有NH4+,Mg2+,Fe3+,向其中加入过量NAOH,微热并搅拌,再加入过量HCL,
为什么FE2+会大量减少?而不是AL3+大量减少 lynnemay1年前1
lynnemay1年前1 -
 奈奈儿 共回答了18个问题
奈奈儿 共回答了18个问题 |采纳率100%Fe2+因为生成沉淀Fe(OH)2,会被O2氧化为Fe(OH)3,最终得到的是Fe3+,Fe2+几乎没有.
Al3+不会发生变化,发生的反应如下:
Al3+ +4OH-=AlO2- +2H2O
AlO2- +4H+=Al3+ +2H2O
Mg2+也不会发生变化.
NH4+会减少,因为NH4+ +OH-=△=NH3↑+H2O1年前查看全部
- 取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有白霜,白霜的成分是
取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有白霜,白霜的成分是
A.氯化铵固体 B.盐酸小液滴 C.氨水小夜滴 D.碳酸氨固体 猪小头1年前4
猪小头1年前4 -
 冰释忐忑 共回答了14个问题
冰释忐忑 共回答了14个问题 |采纳率100%霜是水汽(也就是气态的水)在温度很低时,一种凝华现象,跟雪很类似.严寒的冬天清晨,户外植物上通常会结霜,这是因为夜间植物散热的慢、地表的温度又特别低、水汽散发不快,还聚集在植物表面时就结冻了,因此形成霜.科学上,霜是由冰晶组成,和露的出现过程是雷同的,都是空气中的相对湿度到达100%时,水分从空气中析出的现象,它们的差别只在于露点(水汽液化成露的温度)高于冰点,而霜点(水汽凝华成霜的温度)低于冰点,因此只有近地表的温度低于摄氏零度时,才会结霜.
霜是固体,答案应该是A 氯化铵分解成氨气和氯化氢,在试管口处又会重新反应生成氯化铵,氯化铵高温下不稳定,但是常温下氨气和氯化氢极易反应生成氯化铵1年前查看全部
- 还原CuO,用加入稀硫酸,微热,的方法还原和通入Co,加热,的方法还原,那个得到的铜的质量多?
 现在二十二点了1年前1
现在二十二点了1年前1 -
 hollylll 共回答了21个问题
hollylll 共回答了21个问题 |采纳率85.7%只要CuO的质量一样,那个方法得到的铜的质量都是一样多.【铜元素质量守恒.】1年前查看全部
- 纯净物M微热分解生成NH3和H2O和CO2还不能得出的结论是 A.M不稳定 B.M是化合物C.M中含有水DM有四种元素组
纯净物M微热分解生成NH3和H2O和CO2还不能得出的结论是 A.M不稳定 B.M是化合物C.M中含有水DM有四种元素组成
 鸟人也dd1年前1
鸟人也dd1年前1 -
 lafewants 共回答了28个问题
lafewants 共回答了28个问题 |采纳率92.9%A、纯净物M微热分解,说明了M不稳定是正确的;
B、由于M微热分解生成NH3和H2O和CO2,从产物分析可知M是由四种元素组成的化合物,所以M是化合物是正确的;
D、正确.理由同上.
所以答案选C.1年前查看全部
- NH4CuSO3与足量1mol/L的硫酸溶液混合微热,离子方程式是?
 qq77550081年前2
qq77550081年前2 -
 SSDD58 共回答了20个问题
SSDD58 共回答了20个问题 |采纳率95%2NH4CUSO3+2H2SO4=CUSO4+NH4(SO4)2+2H2O+2SO2
2NH4+ 2cu+ +2SO32-+4H+=CU2+ +2NH4+ +2H2O+2SO21年前查看全部
- A盐和碱石灰反应,微热时放出一种气体B,再经强热又放 出一种气体C.在同温同压下,气体B与C的密度相近,余 下的残渣中加
A盐和碱石灰反应,微热时放出一种气体B,再经强热又放 出一种气体C.在同温同压下,气体B与C的密度相近,余 下的残渣中加入硝酸又有一种气体D放出,气体D通入一 种淡黄色的固体中可得到气体E.请确定各物质的分子式.和有关化学反应方程式.
 ykbe1年前1
ykbe1年前1 -
 jayy141548 共回答了21个问题
jayy141548 共回答了21个问题 |采纳率90.5%A盐:碳酸铵((NH4)2CO3)B气体:NH3,C气体:H2O
(NH4)2CO3+2NaOH=微热=2NH3↑+2H2O+Na2CO3
强热的过程是水蒸发的过程
D气体为CO2
Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
E气体为氧气:
2CO2+2K2O2=2K2CO3+O2↑1年前查看全部
- 往1Lph=1的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成标准状况下的NO气体44ml.
往1Lph=1的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成标准状况下的NO气体44ml.
反应前混合溶液中硝酸的物质的量 瑞丫丫1年前2
瑞丫丫1年前2 -
 云528 共回答了19个问题
云528 共回答了19个问题 |采纳率94.7%3Cu+8H++2NO3-=3Cu2++2NO+4H2O
3 8 2 2
0.06 0.1 X 0.002(NO的体积是不是输错了)
X=0.002 反应前HNO3的物质的量就是0.002mol1年前查看全部
- 某溶液中有铵根离子、镁离子、铜离子、铝离子,若向其加入过量氢氧化钠微热并搅拌,再加过量的盐酸,溶液
某溶液中有铵根离子、镁离子、铜离子、铝离子,若向其加入过量氢氧化钠微热并搅拌,再加过量的盐酸,溶液
大量减少的阳离子是哪一种 态急冷法1年前1
态急冷法1年前1 -
 小可爱的id 共回答了21个问题
小可爱的id 共回答了21个问题 |采纳率95.2%/铜离子
因为铝离子与过量氢氧化钠反应生成偏铝酸根
镁离子与氢氧化钠反应生成的氢氧化铝沉淀遇酸溶解
铵根离子不易生成不容物
铜离子加入过量氢氧化钠微热生成氢氧化铜沉淀,遇酸不溶解
所以铜离子大量减少
另外楼下说得有道理1年前查看全部
- (2z66•桂林)某纯净物M微热就能分解生成NHn、H2O和CO2,由此还不能得出的结论是( )
(2z66•桂林)某纯净物M微热就能分解生成NHn、H2O和CO2,由此还不能得出的结论是( )
A.M不稳定
B.M是化合物
C.M中含有水
D.M由四种元素组成 motomm1年前1
motomm1年前1 -
 蓝色电光 共回答了12个问题
蓝色电光 共回答了12个问题 |采纳率91.7%解题思路:根据题意“微热就能分解”,说明不稳定;“纯净物M微热就能分解生成NH3、H2O和CO2”说明是化合物;“纯净物M”是不可能含有水的;根据质量守恒定律,由生成物可以推测反应物中的元素组成.i、根据题意“微热就能分解”,说明不稳定;故i正确;
B、“纯净物M微热就能分解生成N口3、口着O和CO着”,根据质量守恒定律:反应前后元素种类不变,则可知纯净物M含有多种元素,是化合物,故B正确;
C、“纯净物M”是不可能含有水3,故C错误;
D、根据质量守恒定律,由生成物可以推测反应物3元素组成,则M由氮、氢、碳、氧元素四种元素组成,故D正确.
故选:C.点评:
本题考点: 质量守恒定律及其应用;单质和化合物的判别;物质的元素组成;化学性质与物理性质的差别及应用.
考点点评: 根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;掌握物质的元素组成;掌握单质和化合物的判别.1年前查看全部
- 把一定量的稀硫酸倒入盛有氧化铜和过量的铁粉的是试管微热,静置片刻后过滤,滤纸上留下的物质一定有———
把一定量的稀硫酸倒入盛有氧化铜和过量的铁粉的是试管微热,静置片刻后过滤,滤纸上留下的物质一定有———
滤纸上可能有的物质是———,滤液中留有溶质的是—————— 长一下1年前2
长一下1年前2 -
 homepeng 共回答了17个问题
homepeng 共回答了17个问题 |采纳率94.1%滤纸上可能有的物质是Cu 和Fe
滤液中留有溶质的是FeSO41年前查看全部
- 向铁粉和氧化铜的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入铁片,有气泡产生,则滤渣中一定含有____
向铁粉和氧化铜的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入铁片,有气泡产生,则滤渣中一定含有______;氧化铜与稀硫酸反应的化学反应方程式为______.实验室用浓硫酸配制一定量的稀硫酸,正确操作是将______,并不断搅拌.  rosemarying1年前1
rosemarying1年前1 -
 baoyuhai 共回答了19个问题
baoyuhai 共回答了19个问题 |采纳率84.2%根据氧化铜与硫酸反应生成硫酸铜和水;铁与硫酸反应生成硫酸亚铁和氢气;由题目给出的信息可知:向滤液中插入薄铁片,有气泡产生,说明滤液中一定含有硫酸,没有硫酸铜;也说明铁把硫酸铜中的铜置换出来,因此固体中一定有铜,其中氧化铜和硫酸反应的方程式为CuO+H 2 SO 4 =CuSO 4 +H 2 O;浓硫酸溶于水会释放大量的热,可能会溅出伤人,所以用浓硫酸配制一定量的稀硫酸时,要把浓硫酸沿容器壁慢慢注入水中,并不断搅拌.
故答案为:铜;CuO+H 2 SO 4 =CuSO 4 +H 2 O;要把浓硫酸沿容器壁慢慢注入水中;1年前查看全部
- 初三化学问题黑色的铜丝网(CuO) 加入溶液 微热 (图中画的是燃着的酒精灯) 则溶液是什么?还有顺便解释下 微热 这个
初三化学问题
黑色的铜丝网(CuO) 加入溶液 微热 (图中画的是燃着的酒精灯) 则溶液是什么?
还有顺便解释下 微热 这个词 为什么要微热呢 ?
除去 CuO 找个人来靠1年前4
找个人来靠1年前4 -
 guying821213 共回答了25个问题
guying821213 共回答了25个问题 |采纳率80%CuO能和酸反应,加入稀硫酸或者稀盐酸溶液都可以去除CuO,然后再过滤、干燥,就能得到Cu单质,至于微热,可能是加快反应速率吧?
我也不是很清楚,偶还是只是初三学生而已1年前查看全部
大家在问
- 113年立夏是几号
- 2某公司有一堆煤,原计划每天烧12吨,可以烧45天,实际每天比原计划节约25%,实际烧了多少天?列算式 ,
- 3100ML 0.2mol/L氯化钡溶液若从500ML溶液中取出100ML,氯化钡物质的量浓度是多少?氯离子物质的量是多少
- 4在粤北粤东粤西建立产业转移园区有利于A节约土地,形成集聚效应 B促进工业向乡村地区扩散 ,为什么B不对?
- 5已知有理数abc满足|a-1|+|b-3|+|3c-1|=0,求(a乘b乘c)178次方+(a的36次方乘b的七次方乘c
- 6假如我是一朵云 作文
- 7Mr. Smith is a good teacher. He is &
- 8各位来赐教啊---牛津和朗文的英语辞典,哪个比较好呢?
- 91/64开本,印张43 2226千字是什么意思
- 10AutoCAD如何更改比例尺原来有一张图是1:25的,现在就用这图当模板改另一个比较小的图,比例尺为1:12.5,就是原
- 11机车质量为5×10^4kg在平直轨道运动受的阻力为车重的0.01倍若机车由静止开始做匀加速直线运动在位移s=1km时速度
- 12如图所示,不计质量的光滑小滑轮用细绳悬挂于墙上O点,跨过滑轮的细绳连接物块A、B,A、B都处于静止状态,现将物块B移至C
- 13要使cosx=2a-3/(4-a)有意义,则a的取值范围是
- 14将1-16个数字填入横竖都为4格的空格内,使每行和竖相加都相等,
- 15朱自清在写《春?时,多出用了比喻,如写桃花、杏花、梨花,说他们红的像火,粉的像霞,白的橡血:写春雨,将他比作牛毛、花针、